Porphyrie
| Porphyrie ⓘ | |
|---|---|
 | |
| Die linke Abbildung zeigt den Urin am ersten Tag, während die rechte Abbildung den Urin nach dreitägiger Sonnenexposition zeigt und die klassische Farbveränderung zu Purpur zeigt. | |
| Aussprache |
|
| Fachgebiet | Hämatologie, Dermatologie, Neurologie |
| Symptome | Je nach Subtyp: Bauchschmerzen, Brustschmerzen, Erbrechen, Verwirrung, Verstopfung, Fieber, Krampfanfälle, Blasenbildung bei Sonnenlicht |
| Gewöhnlicher Ausbruch | Wiederkehrende Anfälle, die Tage bis Wochen andauern |
| Ursachen | In der Regel genetisch bedingt |
| Diagnostische Methode | Blut-, Urin- und Stuhltests, Gentests |
| Differentialdiagnose | Bleivergiftung, alkoholische Lebererkrankung |
| Behandlung | Abhängig von der Art und den Symptomen |
| Häufigkeit | 1 bis 100 von 50.000 Menschen |
Porphyrie ist eine Gruppe von Lebererkrankungen, bei denen sich Substanzen, die Porphyrine genannt werden, im Körper ansammeln und die Haut oder das Nervensystem negativ beeinflussen. Die Formen, die das Nervensystem betreffen, werden auch als akute Porphyrie bezeichnet, da die Symptome schnell auftreten und von kurzer Dauer sind. Zu den Symptomen eines Anfalls gehören Bauchschmerzen, Brustschmerzen, Erbrechen, Verwirrung, Verstopfung, Fieber, hoher Blutdruck und hohe Herzfrequenz. Die Anfälle dauern in der Regel Tage bis Wochen an. Zu den Komplikationen können Lähmungen, ein niedriger Natriumspiegel im Blut und Krampfanfälle gehören. Die Anfälle können durch Alkohol, Rauchen, hormonelle Veränderungen, Fasten, Stress oder bestimmte Medikamente ausgelöst werden. Wenn die Haut betroffen ist, kann es bei Sonneneinstrahlung zu Blasenbildung oder Juckreiz kommen. ⓘ
Die meisten Arten von Porphyrie werden von einem oder beiden Elternteilen vererbt und sind auf eine Mutation in einem der Gene zurückzuführen, die Häm produzieren. Sie können autosomal dominant, autosomal rezessiv oder X-chromosomal dominant vererbt werden. Eine Form, die Porphyria cutanea tarda, kann auch durch Hämochromatose (erhöhtes Eisen in der Leber), Hepatitis C, Alkohol oder HIV/AIDS verursacht werden. Der zugrundeliegende Mechanismus führt zu einer Abnahme der produzierten Häm-Menge und zu einer Anhäufung von Substanzen, die an der Häm-Produktion beteiligt sind. Porphyrien können auch danach klassifiziert werden, ob die Leber oder das Knochenmark betroffen ist. Die Diagnose wird in der Regel durch Blut-, Urin- und Stuhltests gestellt. Um die spezifische Mutation zu bestimmen, können Gentests durchgeführt werden. ⓘ
Die Behandlung hängt von der Art der Porphyrie und den Symptomen der Person ab. Die Behandlung der Porphyrie der Haut umfasst im Allgemeinen die Vermeidung von Sonnenlicht, während die Behandlung der akuten Porphyrie die intravenöse Gabe von Häm oder einer Glukoselösung beinhalten kann. In seltenen Fällen kann auch eine Lebertransplantation durchgeführt werden. ⓘ
Die genaue Prävalenz der Porphyrie ist unklar, man schätzt jedoch, dass zwischen 1 und 100 von 50.000 Menschen betroffen sind. Die Raten sind weltweit unterschiedlich. Die Porphyria cutanea tarda gilt als die häufigste Form. Die Krankheit wurde bereits 370 v. Chr. von Hippokrates beschrieben. Der zugrunde liegende Mechanismus wurde erstmals 1871 von dem deutschen Physiologen und Chemiker Felix Hoppe-Seyler beschrieben. Der Name Porphyrie leitet sich vom griechischen πορφύρα, porphyra, ab, was "violett" bedeutet und sich auf die Farbe des Urins bezieht, die während eines Anfalls auftreten kann. ⓘ
| Klassifikation nach ICD-10 | |
|---|---|
| E80 | Störungen des Porphyrin- und Bilirubinstoffwechsels |
| ICD-10 online (WHO-Version 2019) | |
Unter den Porphyrien (altgriechisch πορφυρία porphyría, abgeleitet von altgriechisch πορφυρά porphyrá ‚Purpur‘) versteht man eine Gruppe von (meist angeborenen) Stoffwechselerkrankungen, die mit einer Störung des Aufbaus des roten Blutfarbstoffs Häm einhergehen. Betroffen sind die Enzyme der Hämbiosynthese – je nachdem, welches der acht Enzyme einen Defekt aufweist, reichern sich spezifische Zwischenprodukte der Hämsynthese in den verschiedenen Organen an und verursachen die für die jeweilige Porphyrie typischen Symptome. ⓘ
Anzeichen und Symptome
Akute Porphyrien
Akute intermittierende Porphyrie (AIP), variegate Porphyrie (VP), Aminolävulinsäure-Dehydratase-Mangelporphyrie (ALAD) und hereditäre Koproporphyrie (HCP). Diese Krankheiten betreffen in erster Linie das Nervensystem und führen zu episodischen Krisen, die als akute Attacken bezeichnet werden. Das Hauptsymptom einer akuten Attacke sind Bauchschmerzen, die oft von Erbrechen, Hypertonie (erhöhtem Blutdruck) und Tachykardie (abnorm schneller Herzschlag) begleitet werden. ⓘ
Die schwersten Episoden können neurologische Komplikationen mit sich bringen: typischerweise eine motorische Neuropathie (schwere Funktionsstörung der peripheren Nerven, die die Muskeln innervieren), die zu Muskelschwäche und möglicherweise zu Tetraplegie (Lähmung aller vier Gliedmaßen) und Symptomen des zentralen Nervensystems wie Krampfanfällen und Koma führt. Gelegentlich können auch kurzzeitige psychiatrische Symptome wie Angstzustände, Verwirrtheit, Halluzinationen und, sehr selten, eine offene Psychose auftreten. Alle diese Symptome klingen ab, sobald der akute Anfall vorüber ist. ⓘ
Angesichts der vielfältigen Erscheinungsformen und der relativ geringen Häufigkeit der Porphyrie kann bei den Patienten zunächst der Verdacht auf andere, nicht damit zusammenhängende Erkrankungen bestehen. So kann die Polyneuropathie der akuten Porphyrie fälschlicherweise für das Guillain-Barré-Syndrom gehalten werden, und ein Porphyrie-Test wird in solchen Fällen häufig empfohlen. Eine Erhöhung der Aminolävulinsäure aufgrund einer bleiinduzierten Störung der Häm-Synthese führt zu einer Bleivergiftung mit ähnlichen Symptomen wie eine akute Porphyrie. ⓘ
Chronische Porphyrien
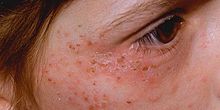
Die nicht akuten Porphyrien sind die X-chromosomal dominante Protoporphyrie (XLDPP), die kongenitale erythropoetische Porphyrie (CEP), die Porphyria cutanea tarda (PCT) und die erythropoetische Protoporphyrie (EPP). Bei keiner dieser Porphyrien kommt es zu akuten Schüben; sie manifestieren sich in erster Linie durch Hauterkrankungen. Aus diesem Grund werden diese vier Porphyrien - zusammen mit zwei akuten Porphyrien, VP und HCP, die ebenfalls Hauterscheinungen hervorrufen können - manchmal als kutane Porphyrien bezeichnet. ⓘ
Eine Hauterkrankung liegt vor, wenn sich überschüssige Porphyrine in der Haut ansammeln. Porphyrine sind photoaktive Moleküle, die bei Lichteinwirkung Elektronen auf ein höheres Energieniveau befördern. Wenn diese in den Ruhe- oder Grundzustand zurückkehren, wird Energie freigesetzt. Dies ist der Grund für die für Porphyrine typische Fluoreszenzeigenschaft. Dies führt zu lokalen Hautschäden. ⓘ
Bei der Porphyrie sind zwei verschiedene Muster von Hauterkrankungen zu beobachten:
- Unmittelbare Lichtempfindlichkeit. Dies ist typisch für XLDPP und EPP. Nach einer variablen Dauer der Sonnenexposition - in der Regel etwa 30 Minuten - klagen die Patienten über starke Schmerzen, Brennen und Unbehagen in den exponierten Bereichen. In der Regel sind die Auswirkungen nicht sichtbar, gelegentlich kann es jedoch zu Rötungen und Schwellungen der Haut kommen.
- Vesikulo-erosive Hauterkrankung. Hierbei handelt es sich um die charakteristische Blasenbildung (Vesikel) und offene Wunden (Erosionen), die bei den Patienten festgestellt werden, und die bei CEP, PCT, VP und HCP auftreten. Die Veränderungen treten nur an sonnenexponierten Stellen wie dem Gesicht und den Handrücken auf. Mildere Hauterkrankungen, wie sie bei VP und HCP zu beobachten sind, bestehen aus einer erhöhten Brüchigkeit der Haut an exponierten Stellen mit einer Tendenz zur Bildung von Blasen und Erosionen, insbesondere nach kleinen Stößen oder Schürfwunden. Diese heilen nur langsam ab und hinterlassen oft kleine Narben, die heller oder dunkler als normale Haut sein können. Bei der PCT kommt es manchmal zu schwereren Hauterkrankungen mit auffälligen Läsionen, Verdunkelung der freiliegenden Haut, z. B. im Gesicht, und Hypertrichose: abnormer Haarwuchs im Gesicht, insbesondere auf den Wangen. Die schwerste Erkrankung tritt bei der CEP und einer seltenen Variante der PCT auf, der hepatoerythropoetischen Porphyrie (HEP); zu den Symptomen gehören eine starke Verkürzung der Gliedmaßen, der Verlust von Hautanhangsgebilden wie Haaren und Nägeln sowie eine schwere Vernarbung der Haut mit fortschreitendem Verschwinden von Ohren, Lippen und Nase. Die Patienten können auch deformierte, verfärbte Zähne oder Anomalien an Zahnfleisch und Augen aufweisen. ⓘ
Charakteristisch ist bei den kutanen (hautbezogenen) Porphyrien die starke, extrem schmerzhafte Lichtempfindlichkeit der Haut gegenüber vor allem sichtbarem Licht um die 406 nm (Soret-Bande), die zu teilweise massiven und entstellenden Haut- und Gewebeschäden führt. Porphyrieformen mit Sonnen- und Lichtunverträglichkeit sind CEP, HEP, PCT, HCP, PV EPP und XLP. ⓘ
Erbliche Porphyrien sind seltene Erkrankungen, die meist einen komplizierten Erbgang aufweisen (Überspringen mehrerer Generationen usw.) und daher häufig nicht erkannt werden; dies stellt einen nicht unerheblichen Risikofaktor für die Betroffenen dar, da die Erkrankungen extrem schmerzhaft und potenziell lebensbedrohlich sind. ⓘ
„Drakula-Symptome“: Erythrodontie („Blutzähne“), Photophobie (Tagschläfer), Anämie (Blässe aufgrund mangelnden roten Blutfarbstoffs). ⓘ
„Werwolf-Symptome“: Hypertrichose (vermehrte Gesichtsbehaarung nach Abheilen der Photodermatose), Erythrodontie („Blutzähne“), Nasen- und/oder Fingerlosigkeit (Verstümmelung infolge Knorpel-Knochen-Gewebezerstörung). ⓘ
Ursache
Vergiftungen z. B. mit Blei, Quecksilber oder bestimmten Pflanzenschutzmitteln schädigen Enzyme der Häm-Biosynthese und verursachen die gleichen Symptome wie die jeweilige genetisch bedingte Porphyrie. ⓘ
Genetik
Die Untertypen der Porphyrie hängen davon ab, welches Enzym defekt ist. ⓘ
| Porphyrie-Typ | Defektes Enzym | Art der Porphyrie | Vererbung | Symptome | Prävalenz ⓘ |
|---|---|---|---|---|---|
| Aminolävulinat-Dehydratase-Mangelporphyrie (ALADP) | 5-Aminolävulinat-Dehydratase (ALAD) | Hepatisch | Autosomal rezessiv | Abdominalschmerzen, Neuropathie | Äußerst selten; weniger als 10 Fälle wurden je gemeldet. |
| Akute intermittierende Porphyrie (AIP) | Hydroxymethylbilan-Synthase (HMBS) früher Porphobilinogen-Deaminase (PBGD) | Hepatisch | Autosomal dominant | Periodische Unterleibsschmerzen, periphere Neuropathie, psychiatrische Störungen, Tachykardie | 1 von 10.000-20.000 |
| Kongenitale erythropoetische Porphyrie (CEP) | Uroporphyrinogen-Synthase (UROS) | Erythropoetische Porphyrie | Autosomal rezessiv | Schwere Photosensibilität mit Erythem, Schwellung und Blasenbildung. Hämolytische Anämie, Splenomegalie | 1 von 1.000.000 oder weniger. |
| Porphyria cutanea tarda (PCT) | Uroporphyrinogen-Decarboxylase (UROD) | Hepatisch | Ungefähr 80% sporadisch, 20% autosomal dominant | Lichtempfindlichkeit mit Bläschen und Bullae | 1 von 10.000 |
| Hereditäre Koproporphyrie (HCP) | Koproporphyrinogen-Oxidase (CPOX) | Hepatisch | Autosomal dominant | Lichtempfindlichkeit, neurologische Symptome, Koliken | 1 von 500.000 |
| Harderoporphyrie | Koproporphyrinogen-Oxidase (CPOX) | Erythropoetische Porphyrie | Autosomal rezessiv | Gelbsucht, Anämie, vergrößerte Leber und Milz, häufig bei Neugeborenen. Später Lichtempfindlichkeit. | Äußerst selten; weniger als 10 Fälle wurden je gemeldet. |
| Variegate Porphyrie (VP) | Protoporphyrinogen-Oxidase (PPOX) | Hepatisch | Autosomal dominant | Lichtempfindlichkeit, neurologische Symptome, Entwicklungsverzögerung | 1 von 300 in Südafrika 1 von 75.000 in Finnland |
| Erythropoetische Protoporphyrie (EPP) | Ferrochelatase (FECH) | Erythropoetische Porphyrie | Autosomal rezessiv | Photosensibilität mit Hautläsionen. Gallensteine, leichte Leberfunktionsstörung | 1 von 75.000-200.000 |
Die X-chromosomal-dominante Protoporphyrie ist eine seltene Form der erythropoetischen Protoporphyrie, die durch eine Gain-of-function-Mutation in ALAS2 verursacht wird und durch schwere Lichtempfindlichkeit gekennzeichnet ist. ⓘ
Bei den autosomal rezessiven Typen kann eine Person, die nur ein einziges Gen erbt, Träger werden. In der Regel haben sie keine Symptome, können das Gen aber an ihre Nachkommen weitergeben. ⓘ
Auslöser
Eine akute Porphyrie kann durch eine Reihe von Arzneimitteln ausgelöst werden, von denen man annimmt, dass sie mit Enzymen in der Leber interagieren, die mit Häm hergestellt werden. Zu diesen Medikamenten gehören:
- Sulfonamide, einschließlich Sulfadiazin, Sulfasalazin und Trimethoprim/Sulfamethoxazol.
- Sulfonylharnstoffe wie Glibenclamid, Gliclazid und Glimepirid, obwohl Glipizid als sicher gilt.
- Barbiturate einschließlich Thiopental, Phenobarbital, Primidon usw.
- Systemische Behandlung mit Antimykotika wie Fluconazol, Griseofulvin, Ketoconazol und Voriconazol. (Die topische Anwendung dieser Mittel gilt aufgrund der minimalen systemischen Absorption als sicher).
- Bestimmte Antibiotika wie Rifapentin, Rifampicin, Rifabutin, Isoniazid, Nitrofurantoin und möglicherweise Metronidazol.
- Mutterkornderivate wie Dihydroergotamin, Ergometrin, Ergotamin, Methysergid usw.
- Bestimmte antiretrovirale Medikamente (z. B. Indinavir, Nevirapin, Ritonavir, Saquinavir usw.)
- Gestagene
- Einige Antikonvulsiva wie Carbamazepin, Ethosuximid, Phenytoin, Topiramat, Valproat.
- Bestimmte Schmerzmittel wie Dextropropoxyphen, Ketorolac, Metamizol, Pentazocin
- Einige Krebsbehandlungen wie Bexaroten, Busulfan, Chlorambucil, Estramustin, Etoposid, Flutamid, Idarubicin, Ifosfamid, Irinotecan, Ixabepilon, Letrozol, Lomustin, Megestrol, Mitomycin, Mitoxantron, Paclitaxel, Procarbazin, Tamoxifen, Topotecan
- Einige Antidepressiva wie Imipramin, Phenelzin, Trazodon
- Einige Antipsychotika wie Risperidon, Ziprasidon
- Einige Retinoide zur Behandlung von Hauterkrankungen wie Acitretin und Isotretinoin
- Verschiedene andere, darunter: Kokain, Methyldopa, Fenfluramin, Disulfiram, Orphenadrin, Pentoxifyllin und Natrium-Aurothiomalat. ⓘ
Pathogenese

Beim Menschen sind Porphyrine die wichtigsten Vorstufen von Häm, einem wesentlichen Bestandteil von Hämoglobin, Myoglobin, Katalase, Peroxidase und P450-Lebercytochromen. ⓘ
Der Körper benötigt Porphyrine zur Herstellung von Häm, das u. a. für den Sauerstofftransport im Blut benötigt wird. Bei Porphyrien liegt jedoch ein (ererbter oder erworbener) Mangel an den Enzymen vor, die die verschiedenen Porphyrine in andere umwandeln, was zu abnorm hohen Konzentrationen eines oder mehrerer dieser Stoffe führt. Porphyrien werden auf zwei Arten klassifiziert: nach den Symptomen und nach der Pathophysiologie. Physiologisch gesehen werden Porphyrien nach dem Ort der Anhäufung von Häm-Vorläufersubstanzen entweder in der Leber oder im Knochenmark und in den roten Blutkörperchen als leber- oder erythropoetisch eingestuft. ⓘ
Ein Mangel an den Enzymen des Porphyrinweges führt zu einer unzureichenden Produktion von Häm. Die Häm-Funktion spielt eine zentrale Rolle im zellulären Stoffwechsel. Dies ist nicht das Hauptproblem bei den Porphyrien; die meisten Enzyme der Häm-Synthese - auch die gestörten - haben genügend Restaktivität, um die Häm-Biosynthese zu unterstützen. Das Hauptproblem bei diesen Defiziten ist die Anhäufung von Porphyrinen, den Häm-Vorläufern, die in hohen Konzentrationen gewebetoxisch sind. Die chemischen Eigenschaften dieser Zwischenprodukte bestimmen den Ort der Anhäufung, ob sie eine Lichtempfindlichkeit hervorrufen und ob das Zwischenprodukt ausgeschieden wird (mit dem Urin oder den Fäkalien). ⓘ
Es gibt acht Enzyme des Häm-Biosynthesewegs, von denen sich vier - das erste und die letzten drei - in den Mitochondrien befinden, während die anderen vier im Zytosol angesiedelt sind. Defekte in einem dieser Bereiche können zu einer Form von Porphyrie führen. Die hepatischen Porphyrien sind durch akute neurologische Schübe (Krampfanfälle, Psychosen, extreme Rücken- und Bauchschmerzen und eine akute Polyneuropathie) gekennzeichnet, während die erythropoetischen Formen mit Hautproblemen, in der Regel einem lichtempfindlichen, blasigen Ausschlag und verstärktem Haarwuchs, einhergehen. Die variegate Porphyrie (auch Porphyria variegata oder gemischte Porphyrie), die aus einem partiellen Mangel an PROTO-Oxidase resultiert, äußert sich durch Hautläsionen, die denen der Porphyria cutanea tarda ähneln, kombiniert mit akuten neurologischen Attacken. Die hereditäre Koproporphyrie, die durch einen Mangel an Koproporphyrinogen-Oxidase gekennzeichnet ist, die durch das CPOX-Gen kodiert wird, kann ebenfalls sowohl mit akuten neurologischen Attacken als auch mit Hautläsionen einhergehen. Bei allen anderen Porphyrien überwiegen entweder die Haut- oder die Nervenläsionen. ⓘ
Porphyrine sind eine Stoffklasse von farbigen Molekülen (nach altgriechisch πορφυρά porphyrá, dem Purpurfarbstoff). Das in roten Blutkörperchen vorkommende, sauerstofftransportierende Protein Hämoglobin (der rote Blutfarbstoff) enthält als prosthetische Gruppe das Häm, ein Eisen(II)-Porphyrin, das aus Tetrapyrrol als Grundkörper aufgebaut ist. In seinem Zentrum ist ein Eisenion, das für die Sauerstoffbindung unabdingbar ist, komplexiert. Bei Störungen der Hämsynthese entstehen stattdessen regelwidrig andere Porphyrine, die Namensgeber der Porphyrie. Bei diesen Porphyrinen ist kein Eisenion im Stickstoffring verankert. Da Häm auch Bestandteil von vielen weiteren Proteinen wie Cytochromen oder Myoglobin ist, bedingt dieser zentrale Ort der Störung der Biosynthese eine Fülle unterschiedlichster Symptome bei Porphyrie in den verschiedenen Systemen: Nerven- und Verdauungssystem, innere Atmung, Haut und Psyche. ⓘ
Diagnose
Porphyrin-Untersuchungen
Porphyrie wird durch biochemische Analysen von Blut, Urin und Stuhl diagnostiziert. Im Allgemeinen ist die Bestimmung des Porphobilinogens (PBG) im Urin der erste Schritt bei Verdacht auf akute Porphyrie. Infolge einer Rückkopplung führt die verminderte Produktion von Häm zu einer erhöhten Produktion von Vorläufersubstanzen, wobei PBG eine der ersten Substanzen im Porphyrin-Syntheseweg ist. In fast allen Fällen von akuten Porphyrie-Syndromen ist PBG im Urin deutlich erhöht, außer bei dem sehr seltenen ALA-Dehydratase-Mangel oder bei Patienten mit Symptomen aufgrund einer hereditären Tyrosinämie Typ I. Bei Quecksilber- oder Arsenvergiftung induzierten Porphyrie treten andere Veränderungen im Porphyrinprofil auf, insbesondere Erhöhungen der Uroporphyrine I und III, der Koproporphyrine I und III sowie des Präkoproporphyrins. ⓘ
Wiederholte Tests während eines Anfalls und nachfolgender Anfälle können notwendig sein, um eine Porphyrie zu erkennen, da die Werte zwischen den Anfällen normal oder nahezu normal sein können. Es ist bekannt, dass der Urin-Screening-Test im Anfangsstadium eines schweren, lebensbedrohlichen Anfalls einer akuten intermittierenden Porphyrie versagt. ⓘ
Bei bis zu 90 % der genetischen Träger der häufigeren, dominant vererbten akuten hepatischen Porphyrien (akute intermittierende Porphyrie, hereditäre Koproporphyrie, variegate Porphyrie) wurde in DNA-Tests festgestellt, dass sie latent an klassischen Symptomen leiden und möglicherweise einen DNA- oder Enzymtest benötigen. Eine Ausnahme bilden latente genetische Träger der hereditären Koproporphyrie nach der Pubertät. ⓘ
Da es sich bei den meisten Porphyrien um seltene Erkrankungen handelt, verfügen allgemeine Krankenhauslabors in der Regel nicht über das Fachwissen, die Technologie oder die Personalzeit, um Porphyrie-Tests durchzuführen. Im Allgemeinen werden für die Tests Blut-, Stuhl- und Urinproben an ein Referenzlabor geschickt. Alle Proben zum Nachweis von Porphyrinen müssen richtig behandelt werden. Die Proben sollten während eines akuten Anfalls entnommen werden, da sonst ein falsch negatives Ergebnis auftreten kann. Die Proben müssen vor Licht geschützt und entweder gekühlt oder konserviert werden. ⓘ
Wenn alle Porphyrin-Untersuchungen negativ sind, muss eine Pseudoporphyrie in Betracht gezogen werden. Durch eine sorgfältige Überprüfung der Medikation lässt sich die Ursache der Pseudoporphyrie oft feststellen. ⓘ
Zusätzliche Tests
Unter Umständen sind weitere diagnostische Untersuchungen der betroffenen Organe erforderlich, z. B. Nervenleitfähigkeitsuntersuchungen bei Neuropathie oder eine Ultraschalluntersuchung der Leber. Grundlegende biochemische Tests können helfen, eine Lebererkrankung, ein hepatozelluläres Karzinom und andere Organprobleme zu erkennen. ⓘ
Behandlung
Akute Porphyrie
Verabreichung von Kohlenhydraten
Oft ist eine empirische Behandlung erforderlich, wenn der diagnostische Verdacht auf eine Porphyrie hoch ist, da akute Anfälle tödlich sein können. In der Regel wird eine kohlenhydratreiche Diät empfohlen; bei schweren Attacken wird eine 10%ige Dextrose-Infusion eingeleitet, die die Genesung unterstützen kann, indem sie die Häm-Synthese unterdrückt, was wiederum die Porphyrin-Akkumulation verringert. Dies kann jedoch einen niedrigen Natriumspiegel im Blut (Hyponatriämie) verschlimmern und sollte nur mit äußerster Vorsicht durchgeführt werden, da dies tödlich enden kann. ⓘ
Häm-Analoga
Hämatin (Handelsname Panhematin) und Häm-Arginat (Handelsname NormoSang) sind in den Vereinigten Staaten bzw. im Vereinigten Königreich die Medikamente der Wahl bei akuter Porphyrie. Diese Medikamente müssen in einem sehr frühen Stadium eines Anfalls verabreicht werden, um wirksam zu sein; die Wirksamkeit ist von Person zu Person unterschiedlich. Sie sind nicht heilend, können aber die Anfälle verkürzen und die Intensität der Anfälle verringern. Nebenwirkungen sind selten, können aber schwerwiegend sein. Diese hämatopoetischen Substanzen hemmen theoretisch die ALA-Synthase und damit die Anhäufung von toxischen Vorläufersubstanzen. Im Vereinigten Königreich werden die Vorräte an NormoSang in zwei nationalen Zentren aufbewahrt; eine Notversorgung ist im St. Thomas's Hospital in London möglich. In den Vereinigten Staaten stellt Lundbeck Panhematin zur Infusion her und liefert es. ⓘ
Häm-Arginat (NormoSang) wird während Krisen, aber auch zur vorbeugenden Behandlung eingesetzt, um Krisen zu vermeiden; eine Behandlung alle 10 Tage. ⓘ
Jedes Anzeichen von Natriummangel im Blut (Hyponatriämie) oder Schwäche sollte mit Hämatin, Häm-Arginat oder sogar Zinnmesoporphyrin behandelt werden, da dies Anzeichen für ein drohendes Syndrom des unangemessenen antidiuretischen Hormons (SIADH) oder eine Beteiligung des peripheren Nervensystems sind, die lokalisiert oder schwerwiegend sein und zu Bulbärparese und Atemlähmung führen kann. ⓘ
Cimetidin
Cimetidin hat sich auch bei der akuten porphyrischen Krise als wirksam erwiesen und ist möglicherweise auch zur Langzeitprophylaxe geeignet. ⓘ
Symptomkontrolle
Die Schmerzen sind stark, stehen häufig in keinem Verhältnis zu den körperlichen Symptomen und erfordern häufig den Einsatz von Opiaten, um sie auf ein erträgliches Maß zu reduzieren. Die Schmerzen sollten so früh wie medizinisch möglich behandelt werden. Übelkeit kann schwerwiegend sein; sie kann auf Phenothiazin-Medikamente ansprechen, ist aber manchmal nicht behandelbar. Heiße Bäder und Duschen können die Übelkeit vorübergehend lindern, doch ist Vorsicht geboten, um Verbrennungen oder Stürze zu vermeiden. ⓘ
Frühzeitige Erkennung
Es wird empfohlen, dass Patienten mit einer akuten Porphyrie in der Vorgeschichte und sogar Genträger stets ein Armband oder eine andere Kennzeichnung tragen. Dies gilt für den Fall, dass sie schwerwiegende Symptome entwickeln oder bei Unfällen, bei denen die Gefahr einer Arzneimittelexposition besteht, nicht in der Lage sind, dem medizinischen Personal ihren Zustand zu erklären. Einige Arzneimittel sind für Patienten mit jeglicher Form von Porphyrie absolut kontraindiziert. ⓘ
Neurologische und psychiatrische Störungen
Bei Patienten, die häufige Anfälle erleiden, können sich chronische neuropathische Schmerzen in den Extremitäten sowie chronische Schmerzen im Unterleib entwickeln. Pseudoobstruktion des Darms, Ileus, Intussuszeption, Hypoganglionose und Enkopresis bei Kindern wurden mit Porphyrie in Verbindung gebracht. Man nimmt an, dass dies auf eine axonale Nervenschädigung in den betroffenen Bereichen des Nervensystems und eine Funktionsstörung des Vagusnervs zurückzuführen ist. Eine Schmerzbehandlung mit langwirksamen Opioiden wie Morphin ist häufig angezeigt, und in Fällen, in denen Krampfanfälle oder Neuropathie vorliegen, kann Gabapentin das Ergebnis verbessern. ⓘ
Krampfanfälle sind häufig eine Begleiterscheinung dieser Krankheit. Die meisten Medikamente gegen Krampfanfälle verschlimmern diesen Zustand. Die Behandlung kann problematisch sein: Insbesondere Barbiturate müssen vermieden werden. Einige Benzodiazepine sind sicher und bieten in Verbindung mit neueren Medikamenten gegen Krampfanfälle, wie Gabapentin, eine mögliche Behandlung zur Anfallskontrolle. Gabapentin hat die zusätzliche Eigenschaft, bei der Behandlung einiger Arten von neuropathischen Schmerzen zu helfen. Magnesiumsulfat und -bromide sind ebenfalls bei Porphyrie-Anfällen eingesetzt worden; die Entwicklung eines Status epilepticus bei Porphyrie spricht jedoch möglicherweise nicht auf Magnesium allein an. Der Zusatz von Hämatin oder Häm-Arginat wurde während des Status epilepticus eingesetzt. ⓘ
Depressionen gehen häufig mit der Krankheit einher und lassen sich am besten durch die Behandlung der auslösenden Symptome und, falls erforderlich, durch den umsichtigen Einsatz von Antidepressiva behandeln. Einige Psychopharmaka sind porphyrinogen, was den therapeutischen Spielraum einschränkt. Andere psychiatrische Symptome wie Angst, Unruhe, Schlaflosigkeit, Depression, Manie, Halluzinationen, Wahnvorstellungen, Verwirrung, Katatonie und Psychose können auftreten. ⓘ
Zugrundeliegende Lebererkrankung
Einige Lebererkrankungen können Porphyrie verursachen, auch wenn keine genetische Veranlagung vorliegt. Dazu gehören Hämochromatose und Hepatitis C. Eine Behandlung der Eisenüberladung kann erforderlich sein. ⓘ
Patienten mit akuten Porphyrien (AIP, HCP, VP) haben im Laufe ihres Lebens ein erhöhtes Risiko für ein hepatozelluläres Karzinom (primärer Leberkrebs) und müssen möglicherweise überwacht werden. Andere typische Risikofaktoren für Leberkrebs müssen nicht vorhanden sein. ⓘ
Hormonbehandlung
Hormonelle Schwankungen, die zu zyklischen Attacken bei Frauen beitragen, wurden mit oralen Kontrazeptiva und luteinisierenden Hormonen behandelt, um die Menstruationszyklen zu unterbrechen. Orale Kontrazeptiva haben jedoch auch eine Lichtempfindlichkeit ausgelöst, und das Absetzen oraler Kontrazeptiva hat Attacken ausgelöst. Androgene und Fruchtbarkeitshormone haben ebenfalls Anfälle ausgelöst. Im Jahr 2019 wurde Givosiran in den Vereinigten Staaten zur Behandlung der akuten hepatischen Porphyrie zugelassen. ⓘ
Erythropoetische Porphyrie
Diese gehen mit einer Anhäufung von Porphyrinen in den Erythrozyten einher und sind selten. ⓘ
Die Schmerzen, das Brennen, die Schwellung und der Juckreiz, die bei erythropoetischen Porphyrien auftreten, erfordern im Allgemeinen die Vermeidung von hellem Sonnenlicht. Die meisten Sonnenschutzmittel sind nicht wirksam, aber langärmelige Hemden mit hohem Lichtschutzfaktor, Hüte, Kopftücher und Handschuhe können helfen. Chloroquin kann bei einigen EPs die Porphyrinausscheidung erhöhen. Bluttransfusionen werden gelegentlich zur Unterdrückung der angeborenen Häm-Produktion eingesetzt. ⓘ
Die seltenste Form ist die kongenitale erythropoetische Porphyrie (CEP), auch bekannt als Morbus Gunther. Die Anzeichen können von Geburt an auftreten und umfassen schwere Lichtempfindlichkeit, braune Zähne, die aufgrund der Ablagerung von Typ-1-Porphyrinen im ultravioletten Licht fluoreszieren, und später Hypertrichose. In der Regel entwickelt sich eine hämolytische Anämie. Zur Behandlung kann Beta-Carotin in pharmazeutischer Qualität verwendet werden. In einigen wenigen Fällen konnte die CEP auch durch eine Knochenmarktransplantation geheilt werden, obwohl noch keine Langzeitergebnisse vorliegen. ⓘ
Im Dezember 2014 erhielt Afamelanotid von der Europäischen Kommission die Zulassung als Behandlung zur Vorbeugung von Phototoxizität bei erwachsenen Patienten mit EPP. ⓘ
Epidemiologie
Die Häufigkeit aller Arten von Porphyrie zusammengenommen wird in den Vereinigten Staaten auf etwa eine von 25.000 Personen geschätzt. Die weltweite Prävalenz wird auf eine von 500 bis eine von 50.000 Personen geschätzt. ⓘ
Porphyrien wurden bei allen Rassen und in verschiedenen ethnischen Gruppen auf allen Kontinenten festgestellt. Es gibt Berichte über eine hohe Inzidenz von AIP in Gebieten in Indien und Skandinavien. Es sind mehr als 200 genetische Varianten der AIP bekannt, von denen einige familienspezifisch sind, obwohl sich einige Stämme als wiederholte Mutationen erwiesen haben. ⓘ
Geschichte
Der zugrunde liegende Mechanismus wurde erstmals 1871 von Felix Hoppe-Seyler beschrieben, und die akuten Porphyrien wurden 1889 von dem niederländischen Arzt Barend Stokvis beschrieben. ⓘ
Der Zusammenhang zwischen Porphyrien und Geisteskrankheiten ist seit Jahrzehnten bekannt. In den frühen 1950er Jahren wurden Patienten mit Porphyrie (gelegentlich auch als "porphyrische Hämophilie" bezeichnet) und schweren Symptomen von Depression oder Katatonie mit Elektroschocktherapie behandelt. ⓘ
Vampire und Werwölfe
Die Porphyrie wurde als Erklärung für den Ursprung der Vampir- und Werwolflegenden vorgeschlagen, da gewisse Ähnlichkeiten zwischen der Krankheit und der Folklore festgestellt wurden. ⓘ
Im Januar 1964 wurde die Arbeit von L. Illis aus dem Jahr 1963, "On Porphyria and the Aetiology of Werewolves", in den Proceedings of the Royal Society of Medicine veröffentlicht. Später argumentierte Nancy Garden in ihrem 1973 erschienenen Buch Vampire" für einen Zusammenhang zwischen Porphyrie und dem Vampirglauben. 1985 veröffentlichte der Biochemiker David Dolphin für die American Association for the Advancement of Science den Aufsatz "Porphyria, Vampires, and Werewolves: The Aetiology of European Metamorphosis Legends" (Die Ätiologie der europäischen Metamorphose-Legenden) wurde in den Medien weit verbreitet und machte die Idee populär. ⓘ
Die Theorie wurde von einigen Volkskundlern und Forschern abgelehnt, da sie die Merkmale der ursprünglichen Werwolf- und Vampirlegenden oder der Krankheit nicht genau beschreibe und Menschen mit Porphyrie möglicherweise stigmatisiere. ⓘ
Ein Artikel aus dem Postgraduate Medical Journal von 1995 (via NIH) erklärt dies:
Da man glaubte, dass der volkstümliche Vampir sich bei Tageslicht frei bewegen konnte, im Gegensatz zur Variante des 20. Jahrhunderts, kann die angeborene erythropoetische Porphyrie den volkstümlichen Vampir nicht ohne weiteres erklären, aber sie könnte eine Erklärung für den Vampir sein, wie wir ihn im 20. Außerdem wurde der volkstümliche Vampir, wenn er ausgegraben wurde, immer als ziemlich gesund beschrieben ("wie er im Leben war"), während die Betroffenen aufgrund der entstellenden Aspekte der Krankheit den Exhumierungstest nicht bestanden hätten. Menschen mit kongenitaler erythropoetischer Porphyrie haben kein Verlangen nach Blut. Das Enzym (Hämatin), das zur Linderung der Symptome erforderlich ist, wird bei oraler Einnahme nicht intakt aufgenommen, und das Trinken von Blut hätte keine positive Wirkung auf die Betroffenen. Schließlich, und das ist das Wichtigste, macht die Tatsache, dass im 18. Jahrhundert Berichte über Vampire im wahrsten Sinne des Wortes grassierten und dass die kongenitale erythropoetische Porphyrie eine extrem seltene Manifestation einer seltenen Krankheit ist, diese Erklärung für den folkloristischen Vampir unwahrscheinlich. ⓘ
Bemerkenswerte Fälle
- König Georg III. Die Geisteskrankheit, die Georg III. in der Regentschaftskrise von 1788 zeigte, hat mehrere Versuche einer retrospektiven Diagnose ausgelöst. Der erste, 1855, fünfunddreißig Jahre nach seinem Tod, kam zu dem Schluss, dass er an akuter Manie litt. M. Guttmacher schlug 1941 eine manisch-depressive Psychose als wahrscheinlichere Diagnose vor. Die erste Vermutung, dass eine körperliche Krankheit die Ursache für die geistige Umnachtung König Georges war, wurde 1966 in einem Aufsatz mit dem Titel "The Insanity of King George III: A Classic Case of Porphyria" (Der Wahnsinn König Georges III.: Ein klassischer Fall von Porphyrie) geäußert, dem 1968 ein weiterer Aufsatz mit dem Titel "Porphyria in the Royal Houses of Stuart, Hanover and Prussia" folgte. Die von einem Mutter-Sohn-Psychiaterteam verfassten Abhandlungen wurden so verfasst, als sei der Fall der Porphyrie bewiesen, doch die Reaktionen zeigten, dass viele Experten, auch diejenigen, die mit den Erscheinungsformen der Porphyrie besser vertraut waren, nicht überzeugt waren. Viele Psychiater waren mit der Diagnose nicht einverstanden und hielten eine bipolare Störung für weitaus wahrscheinlicher. Die Theorie wird in Purple Secret behandelt, das die letztlich erfolglose Suche nach genetischen Beweisen für Porphyrie in den sterblichen Überresten königlicher Persönlichkeiten dokumentiert, die im Verdacht standen, an Porphyrie erkrankt zu sein. Im Jahr 2005 wurde die Vermutung geäußert, dass Arsen (das bekanntermaßen porphyrogen wirkt), das Georg III. zusammen mit Antimon verabreicht wurde, seine Porphyrie verursacht haben könnte. In dieser Studie wurden hohe Arsenkonzentrationen im Haar von König Georg festgestellt. Im Jahr 2010 wurde in einer Analyse historischer Aufzeichnungen argumentiert, dass die Porphyrie-Behauptung auf einer falschen und selektiven Interpretation zeitgenössischer medizinischer und historischer Quellen beruhte. Die Geisteskrankheit von Georg III. ist die Grundlage der Handlung in The Madness of King George, einem britischen Film von 1994, der auf dem Theaterstück The Madness of George III. von Alan Bennett aus dem Jahr 1991 basiert. Im Abspann des Films wird darauf hingewiesen, dass die Symptome des Königs auf Porphyrie hindeuten und dass diese Krankheit "periodisch, unvorhersehbar und erblich" ist.
Das traditionelle Argument, dass Georg III. NICHT an Porphyrie, sondern vielmehr an einer bipolaren Störung litt, wird von Andrew Roberts in seiner neuen Biografie "The Last King of America" ausführlich verteidigt.
- Nachkommen von Georg III. Zu den anderen Nachkommen Georgs III., von denen die Autoren von Purple Secret annehmen, dass sie an Porphyrie litten (basierend auf der Analyse ihrer umfangreichen und detaillierten medizinischen Korrespondenz), gehörten seine Ururenkelin Prinzessin Charlotte von Preußen (die älteste Schwester von Kaiser Wilhelm II.) und ihre Tochter Prinzessin Feodora von Sachsen-Meiningen. Sie erbrachten bessere Beweise dafür, dass bei dem Ururenkel von Georg III., Prinz William von Gloucester, zuverlässig eine variegate Porphyrie diagnostiziert wurde.
- Maria, Königin der Schotten. Es wird angenommen, dass Maria, Königin der Schotten, die Vorfahrin von König Georg III, ebenfalls an akuter intermittierender Porphyrie erkrankt war, obwohl dies umstritten ist. Es wird angenommen, dass sie die Krankheit, wenn sie sie denn hatte, von ihrem Vater, Jakob V. von Schottland, geerbt hat. Sowohl Vater als auch Tochter litten unter gut dokumentierten Anfällen, die unter die Symptomenkonstellation der Porphyrie fallen könnten.
- Maria I. von Portugal. Maria I. - bekannt als "Maria die Fromme" oder "Maria die Verrückte" wegen ihres religiösen Eifers und ihrer akuten Geisteskrankheit, die sie nach 1792 unfähig machte, die Staatsgeschäfte zu führen - soll ebenfalls Porphyrie gehabt haben. Francis Willis, derselbe Arzt, der Georg III. behandelte, wurde sogar vom portugiesischen Hof vorgeladen, kehrte aber nach England zurück, nachdem der Hof die Behandlungen, die er beaufsichtigen durfte, eingeschränkt hatte. Zeitgenössische Quellen wie der Staatssekretär für auswärtige Angelegenheiten, Luís Pinto de Sousa Coutinho, berichten, dass die Königin unter immer schlimmer werdenden Magenschmerzen und Unterleibskrämpfen litt, die auf Porphyrie hindeuten.
- Vlad III. Vlad III. soll ebenfalls an akuter Porphyrie gelitten haben, was möglicherweise die Vorstellung begründete, dass Vampire allergisch auf Sonnenlicht reagierten.
- Vincent van Gogh. Andere Kommentatoren haben vorgeschlagen, dass Vincent van Gogh an akuter intermittierender Porphyrie gelitten haben könnte.
- König Nebukadnezar von Babylon. Die Beschreibung dieses Königs in Daniel 4 legt für einige nahe, dass er an Porphyrie litt.
- Der Arzt Archie Cochrane. Er wurde mit Porphyrie geboren, die sein Leben lang gesundheitliche Probleme verursachte.
- Paula Frías Allende. Die Tochter der chilenischen Schriftstellerin Isabel Allende. Sie fiel 1991 in ein durch Porphyrie verursachtes Koma, was Isabel dazu inspirierte, die ihr gewidmeten Memoiren Paula zu schreiben. ⓘ
Maria I. von Portugal in einem Porträt aus der Zeit um 1790, das Giuseppe Troni oder Thomas Hickey zugeschrieben wird. ⓘ
Verwendungen in der Literatur
In der Literatur, insbesondere in der Gothic-Literatur, wird Porphyrie teilweise explizit oder implizit erwähnt. Dazu gehören die folgenden:
- Die Krankheit ist der Name der Titelfigur in dem Gothic-Gedicht "Porphyria's Lover" von Robert Browning.
- In der gotischen Kurzgeschichte "Lusus Naturae" von Margaret Atwood wird die Krankheit als Ursache für die Symptome des Erzählers angedeutet. Einige der Symptome der Erzählerin ähneln denen der Porphyrie, und an einer Stelle der Geschichte heißt es, dass der Name der Krankheit der Erzählerin "einige Ps und Rs in sich hatte". ⓘ
Therapie
Die Behandlung einer Porphyrie bleibt spezialisierten Kliniken/Zentren vorbehalten. In Deutschland ist das Sächsische Porphyriezentrum (Klinikum Chemnitz) – Leitung: Ulrich Stölzel – das führende überregionale Kompetenzzentrum für alle Arten von Porphyrien. Ein zweites, ebenfalls von der Europäischen Porphyrie-Initiative (EPI) zertifiziertes Zentrum ist die Hämatologisch/Onkologisch Schwerpunktpraxis von Petro E. Petrides, München. Müssen neue Medikamente eingenommen werden, sollte zuvor der Rat eines Porphyrie-Spezialisten eingeholt werden. Zu beachten ist, dass Angaben in gängigen Kompendien häufig veraltet sind. Listen mit Medikamenten, die nach dem aktuellen Stand des Wissens sicher bei akuten Porphyrien eingesetzt werden können, finden sich auf den Internetseiten der Porphyrie-Kompetenzzentren. ⓘ
Akute Porphyrien
Givosiran (Handelsname: Givlaari, Alnylam Pharmaceuticals) wurde im November 2019 in den USA und im März 2020 in der EU zur Behandlung der akuten hepatischen Porphyrie (AHP) zugelassen. ⓘ
Das Risiko eines Schubes kann vermindert werden, indem auslösende Substanzen wie die meisten Medikamente, Alkohol und Rauchen gemieden und auf eine regelmäßige Kohlenhydratzufuhr (regelmäßig Essen) geachtet wird. Akute Porphyrieschübe können durch die Gabe hoher Kohlenhydratmengen (Glukose) oder Hämin bzw. Hämin-Arginat symptomatisch therapiert werden (Hämin, Markenname Normosang, sollte nicht mit Hämatin verwechselt werden). ⓘ
Wirkweise: Die Häm-Gruppe kommt hauptsächlich im Hämoglobin (roter Blutfarbstoff) vor, aber auch in Enzymen wie dem Cytochrom P450, das u. a. beim Abbau bzw. der Entgiftung von Xenobiotika (z. B. Medikamenten) in der Leber eine Rolle spielt. Müssen vermehrt z. B. Medikamente abgebaut werden, kommt es zu einem erhöhten Bedarf an Cytochrom P450 und einer positiven Rückkopplung auf den Häm-Syntheseweg. Bei einer Störung des Synthesewegs aber kann der Bedarf an Häm nicht gedeckt werden, die positive Rückkopplung führt stattdessen zu einer Anreicherung des Stoffwechselproduktes, das nicht mit der normalen Rate umgesetzt (weiterverarbeitet) werden kann. Da Porphyrinvorläufer für den Körper toxisch (giftig) sind, kommt es zu den Symptomen eines Schubes. Hämin-Arginat besetzt die positive Rückkopplungsstelle im Syntheseweg des Häms (es suggeriert dem Körper, dass eine ausreichende Menge Häm vorhanden ist) und unterbricht dadurch die schubauslösende Rückkopplung. ⓘ
Die Porphyria cutanea tarda (PCT) spricht auf Aderlass-Therapien an, wobei jedoch die Blutarmut verstärkt wird. ⓘ
Zur Therapie der Porphyrien war auch Riboflavin im Gespräch. ⓘ
Hydroxychloroquintherapie und Eisendepletion via Aderlass sind wirksame „First-line“-Maßnahmen bei Porphyria cutanea tarda. Bei PCT und homozygoter Mutation C282Y muss mit Aderläsen wie bei Hämochromatose behandelt werden. Bei PCT und ausschließlich heterozygoten Mutationen im HFEGen ist die Behandlung mit Hydroxychloroquin ausreichend, da sich keine schwere Eisenüberladung entwickelt. Alkoholkarenz bewirkt bereits eine klinische Besserung mit metabolischem Rückgang der Porphyrinakkumulation. Frauen müssen hormonale Kontrazeptiva bzw. eine evtl. Hormonersatztherapie absetzen. Die hoch effektive antivirale Therapie der Hepatitis C führte ebenso zur klinischen und zur biochemischen Remission der PCT. ⓘ
Kutane Porphyrien
Hydroxychloroquintherapie und Eisendepletion via Aderlass sind wirksame „First-line“-Maßnahmen bei Porphyria cutanea tarda. Bei PCT und homozygoter Mutation C282Y muss mit Aderläsen wie bei Hämochromatose behandelt werden. Bei PCT und ausschließlich heterozygoten Mutationen im HFEGen ist die Behandlung mit Hydroxychloroquin ausreichend, da sich keine schwere Eisenüberladung entwickelt. Alkoholkarenz bewirkt bereits eine klinische Besserung mit metabolischem Rückgang der Porphyrinakkumulation. Frauen müssen hormonale Kontrazeptiva bzw. eine evtl. Hormonersatztherapie absetzen. Die hoch effektive antivirale Therapie der Hepatitis C führte ebenso zur klinischen und zur biochemischen Remission der PCT. ⓘ
Die Vermeidung von (Sonnen)-Licht und leberschädigenden Substanzen (Alkohol usw.) stellt momentan die einzige Möglichkeit zum Schutz vor einem Ausbruch der Symptome dar. Da die Symptome auslösenden Wellenlängen im sichtbaren Bereich des Lichts liegen, ist Sonnencreme nutzlos, da nur eine Schutzwirkung im UV-Bereich besteht. Ähnliches gilt für andere Materialien (Schutzfolien, Textilien usw.) mit UV-Schutzfaktor. Ein Derivat des Hormons Alpha-MSH führt über hormonelle Anregung zur Bräunung der Haut auch ohne Sonneneinwirkung und erzielt dadurch einen hohen Schutzeffekt. ⓘ
Protoporphyrie
In der Arbeitsgruppe von Ulrich Stölzel (s. o.; Porphyriezentrum Chemnitz) wurde erstmals nachgewiesen, dass die sehr seltene X-chromosomal vererbte Protoporphyrie (XLP) durch Eisensubstitution gebessert werden kann. ⓘ


