Magnesiumsulfat
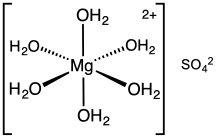 Magnesiumsulfat-Hexahydrat
| |
 Wasserfreies Magnesiumsulfat
| |
 Epsomit (Magnesiumsulfat-Heptahydrat)
| |
| Bezeichnungen | |
|---|---|
| IUPAC-Bezeichnung
Magnesiumsulfat
| |
| Andere Bezeichnungen
Bittersalz (Magnesiumsulfat-Heptahydrat)
Englisches Salz Bittere Salze Badesalz | |
| Bezeichner | |
| |
3D-Modell (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Arzneimittelbank | |
PubChem CID
|
|
| RTECS-Nummer |
|
| UNII |
|
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
MgSO4 |
| Molekulare Masse | 120,366 g/mol (wasserfrei) 138,38 g/mol (Monohydrat) 174,41 g/mol (Trihydrat) 210,44 g/mol (Pentahydrat) 228,46 g/mol (Hexahydrat) 246,47 g/mol (Heptahydrat) |
| Erscheinungsbild | weißer kristalliner Feststoff |
| Geruch | geruchlos |
| Dichte | 2,66 g/cm3 (wasserfrei) 2,445 g/cm3 (Monohydrat) 1,68 g/cm3 (Heptahydrat) 1,512 g/cm3 (11-Hydrat) |
| Schmelzpunkt | wasserfrei zersetzt sich bei 1.124 °C Monohydrat zersetzt sich bei 200 °C Heptahydrat zersetzt sich bei 150 °C Undecahydrat zersetzt sich bei 2 °C |
Löslichkeit in Wasser
|
wasserfrei 26,9 g/100 mL (0 °C) 35,1 g/100 mL (20 °C) 50,2 g/100 mL (100 °C) Heptahydrat 113 g/100 mL (20 °C) |
Löslichkeitsprodukt (Ksp)
|
738 (502 g/L) |
| Löslichkeit | 1,16 g/100 mL (18 °C, Ether) schwer löslich in Alkohol, Glycerin unlöslich in Aceton |
Magnetische Suszeptibilität (χ)
|
-50-10-6 cm3/mol |
Brechungsindex (nD)
|
1,523 (Monohydrat) 1,433 (Heptahydrat) |
| Struktur | |
Kristallstruktur
|
monoklin (Hydrat) |
| Pharmakologie | |
ATC-Code
|
A06AD04 (WER) A12CC02 (WER) B05XA05 (WER) D11AX05 (WER) V04CC02 (WER) |
| Gefährdungen | |
| NFPA 704 (Feuerdiamant) | |
| Sicherheitsdatenblatt (SDS) | Externes MSDS |
| Verwandte Verbindungen | |
Andere Kationen
|
Beryllium-Sulfat Kalziumsulfat Strontiumsulfat Bariumsulfat Eisen(II)-sulfat Kupfer(II)-sulfat |
Wenn nicht anders angegeben, beziehen sich die Daten auf den Standardzustand der Stoffe (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
Magnesiumsulfat oder Magnesiumsulfat (in englischsprachigen Ländern mit Ausnahme der USA) ist eine chemische Verbindung, ein Salz mit der Formel MgSO4, bestehend aus Magnesiumkationen Mg2+ (20,19 Massenprozent) und Sulfatanionen SO2-4. Es ist ein weißer kristalliner Feststoff, der in Wasser, aber nicht in Ethanol löslich ist. ⓘ
Magnesiumsulfat kommt in der Regel in Form eines Hydrats MgSO4-nH2O mit verschiedenen n-Werten zwischen 1 und 11 vor. Am gebräuchlichsten ist das Heptahydrat MgSO4-7H2O, bekannt als Bittersalz, eine Haushaltschemikalie mit vielen traditionellen Verwendungen, einschließlich Badesalz. ⓘ
Hauptsächlich wird Magnesiumsulfat in der Landwirtschaft verwendet, um Böden mit Magnesiummangel auszugleichen (ein wichtiger Pflanzennährstoff, da Magnesium eine wichtige Rolle für das Chlorophyll und die Photosynthese spielt). Zu diesem Zweck wird vor allem das Monohydrat verwendet, dessen Produktion Mitte der 1970er Jahre bei 2,3 Millionen Tonnen pro Jahr lag. Die wasserfreie Form und mehrere Hydrate kommen in der Natur als Mineralien vor, und das Salz ist ein wichtiger Bestandteil des Wassers einiger Quellen. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
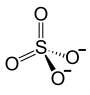
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Magnesiumsulfat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel |
| ||||||||||||||||||
| Kurzbeschreibung |
farbloser, hygroskopischer Feststoff | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | |||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
| ||||||||||||||||||
| Schmelzpunkt |
1124 °C (Zersetzung) | ||||||||||||||||||
| Löslichkeit |
gut in Wasser löslich: 300 g·l−1 (20 °C) (MgSO4) | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||

Magnesiumsulfat MgSO4 ist neben Magnesiumhydrogensulfat Mg(HSO4)2 eines der beiden Magnesiumsalze der Schwefelsäure. Das auch als Mineral Epsomit auftretende Magnesiumsulfat-Heptahydrat MgSO4·7 H2O erhielt des bitteren Geschmacks wegen den Trivialnamen Bittersalz. ⓘ
Epsomit ⓘ
Hydrate
Magnesiumsulfat kann als verschiedene Hydrate kristallisieren, darunter:
- Wasserfrei, MgSO4; in der Natur instabil, kristallisiert als Hydrat und bildet Bittersalz.
- Monohydrat, MgSO4-H2O; Kieserit, monoklin.
- MgSO4-1,25H2O oder 8MgSO4-10H2O.
- Dihydrat, MgSO4-2H2O; orthorhombisch.
- MgSO4-2.5H2O oder 2MgSO4-5H2O.
- Trihydrat, MgSO4-3H2O.
- Tetrahydrat, MgSO4-4H2O; Starkeyit, monoklin.
- Pentahydrat, MgSO4-5H2O; Pentahydrit, triklin.
- Hexahydrat, MgSO4-6H2O; Hexahydrit, monoklin.
- Heptahydrat, MgSO4-7H2O ("Bittersalz"); Epsomit, orthorhombisch.
- Enneahydrat, MgSO4-9H2O, monoklin.
- Dekahydrat, MgSO4-10H2O.
- Undecahydrat, MgSO4-11H2O; Meridianiit, triklin. ⓘ
Die Existenz des Dekahydrats ist offenbar noch nicht bestätigt (Stand 2017). ⓘ
Alle Hydrate verlieren beim Erhitzen Wasser. Über 320 °C ist nur die wasserfreie Form stabil. Sie zersetzt sich ohne zu schmelzen bei 1124 °C in Magnesiumoxid (MgO) und Schwefeltrioxid (SO3). ⓘ
Heptahydrat
Das Heptahydrat hat seinen gebräuchlichen Namen "Epsom-Salz" von einer bitteren Salzquelle in Epsom in Surrey, England, wo das Salz aus den Quellen gewonnen wurde, die dort entstehen, wo die poröse Kreide der North Downs auf den undurchlässigen Londoner Ton trifft. ⓘ
Das Heptahydrat verliert leicht ein Äquivalent an Wasser, um das Hexahydrat zu bilden. ⓘ
Es ist eine natürliche Quelle von Magnesium und Schwefel. Bittersalz wird häufig in Badesalzen, Peelings, Muskelrelaxantien und Schmerzmitteln verwendet. Diese unterscheiden sich jedoch von Bittersalz, das für die Gartenarbeit verwendet wird, da es Aromen und Duftstoffe enthält, die für Pflanzen nicht geeignet sind. ⓘ
Monohydrat
Magnesiumsulfat-Monohydrat, auch Kieserit genannt, kann durch Erhitzen des Heptahydrats auf 120 °C hergestellt werden. Durch weiteres Erhitzen auf 250 °C erhält man wasserfreies Magnesiumsulfat. ⓘ
Undecahydrat
Das Undecahydrat MgSO4-11H2O, Meridianiit, ist bei Atmosphärendruck nur unter 2 °C stabil. Oberhalb dieser Temperatur verflüssigt es sich zu einer Mischung aus festem Heptahydrat und einer gesättigten Lösung. Es hat einen eutektischen Punkt mit Wasser bei -3,9 °C und 17,3 % (Masse) MgSO4. Aus Lösungen mit der richtigen Konzentration, die einige Tage bei 0 °C aufbewahrt werden, können große Kristalle gewonnen werden. ⓘ
Bei einem Druck von etwa 0,9 GPa und 240 K zersetzt sich Meridianiit in ein Gemisch aus Eis VI und dem Enneahydrat MgSO4-9H2O. ⓘ
Enneahydrat
Das Enneahydrat MgSO4-9H2O wurde erst vor kurzem identifiziert und charakterisiert, obwohl es offenbar leicht herzustellen ist (durch Abkühlen einer Lösung aus MgSO4 und Natriumsulfat Na2SO4 in geeigneten Anteilen). ⓘ
Die Struktur ist monoklin, mit folgenden Einheitszellenparametern bei 250 K: a = 0,675 nm, b = 1,195 nm, c = 1,465 nm, β = 95,1°, V = 1,177 nm3 mit Z = 4. Die wahrscheinlichste Raumgruppe ist P21/c. Magnesiumselenat bildet auch ein Enneahydrat MgSeO4-9H2O, jedoch mit einer anderen Kristallstruktur. ⓘ
Natürliches Vorkommen
Da Mg2+- und SO2-4-Ionen nach Na+ und Cl- das zweite Kation bzw. das zweite Anion im Meerwasser sind, sind Magnesiumsulfate häufige Mineralien in geologischen Umgebungen. Ihr Vorkommen ist meist mit supergenen Prozessen verbunden. Einige von ihnen sind auch wichtige Bestandteile von evaporitischen Kalium-Magnesium (K-Mg)-Salzlagerstätten. ⓘ
Helle Flecken, die von der Raumsonde Dawn im Occator-Krater auf dem Zwergplaneten Ceres beobachtet wurden, lassen sich am ehesten auf reflektiertes Licht von Magnesiumsulfat-Hexahydrat zurückführen. ⓘ
Fast alle bekannten mineralogischen Formen von MgSO4 sind Hydrate. Epsomit ist das natürliche Analogon von Bittersalz. Meridianiit, MgSO4-11H2O, wurde auf der Oberfläche von gefrorenen Seen beobachtet und kommt vermutlich auch auf dem Mars vor. Hexahydrit ist das nächst niedrigere Hydrat. Die drei nächst niedrigeren Hydrate - Pentahydrit, Starkeyit und vor allem Sanderit - sind selten. Kieserit ist ein Monohydrat und kommt häufig in evaporitischen Ablagerungen vor. Wasserfreies Magnesiumsulfat wurde aus einigen brennenden Kohlehalden gemeldet. ⓘ
Herstellung
Magnesiumsulfat wird in der Regel direkt aus trockenen Seebetten und anderen natürlichen Quellen gewonnen. Es kann auch durch Reaktion von Magnesit (Magnesiumcarbonat, MgCO
3) oder Magnesia (Oxid, MgO) mit Schwefelsäure (H2SO4) hergestellt werden. ⓘ
Eine andere Möglichkeit besteht darin, Meerwasser oder magnesiumhaltige Industrieabfälle so zu behandeln, dass Magnesiumhydroxid ausgefällt wird, und den Niederschlag mit Schwefelsäure umzusetzen. ⓘ
Auch Magnesiumsulfat-Heptahydrat (Epsomit, MgSO4-7H2O) wird durch Auflösen von Magnesiumsulfat-Monohydrat (Kieserit, MgSO4-H2O) in Wasser und anschließende Kristallisation des Heptahydrats hergestellt. ⓘ
Magnesiumsulfat lässt sich aus Magnesium und Schwefelsäure nach folgender Reaktionsgleichung herstellen:
Weiterhin entsteht es bei der Umsetzung von Magnesiumoxid oder Magnesiumhydroxid mit Schwefelsäure und anschließender Abdampfung des Wassers bzw. Trocknung:
Physikalische Eigenschaften
Die Entspannung von Magnesiumsulfat ist der wichtigste Mechanismus, der die Absorption von Schall im Meerwasser bei Frequenzen über 10 kHz bewirkt (akustische Energie wird in Wärmeenergie umgewandelt). Niedrigere Frequenzen werden vom Salz weniger stark absorbiert, so dass sich niederfrequenter Schall im Meer weiter ausbreitet. Borsäure und Magnesiumcarbonat tragen ebenfalls zur Absorption bei. ⓘ
Verwendungen
Medizinisch
Magnesiumsulfat wird sowohl äußerlich (als Bittersalz) als auch innerlich verwendet. ⓘ
Die wichtigste äußere Anwendung ist die Formulierung als Badesalz, insbesondere für Fußbäder zur Linderung von wunden Füßen. Es wird behauptet, dass solche Bäder auch die Heilung von Muskelschmerzen, Muskelkater oder Verletzungen erleichtern und beschleunigen. Mögliche gesundheitliche Wirkungen von Magnesiumsulfat spiegeln sich in medizinischen Studien über die Auswirkungen von Magnesium auf resistente Depressionen und als Analgetikum bei Migräne und chronischen Schmerzen wider. Magnesiumsulfat wurde bei der Behandlung von Asthma, Präeklampsie und Eklampsie untersucht. ⓘ
Magnesiumsulfat ist der übliche Bestandteil der konzentrierten Salzlösung, die in Isolationstanks verwendet wird, um deren spezifisches Gewicht auf etwa 1,25-1,26 zu erhöhen. Diese hohe Dichte ermöglicht es einer Person, mühelos auf der Wasseroberfläche des geschlossenen Tanks zu schwimmen und so viele äußere Sinne wie möglich auszuschalten. ⓘ
Im Vereinigten Königreich ist ein Medikament, das Magnesiumsulfat und Phenol enthält und "Drawing Paste" genannt wird, nützlich für kleine Furunkel oder lokale Infektionen und zum Entfernen von Splittern. ⓘ
Innerlich kann Magnesiumsulfat auf oralem, respiratorischem oder intravenösem Weg verabreicht werden. Zu den innerlichen Anwendungen gehören die Ersatztherapie bei Magnesiummangel, die Behandlung akuter und schwerer Herzrhythmusstörungen, als Bronchodilatator bei der Behandlung von Asthma, zur Verhinderung von Eklampsie, als Tokolytikum und als Antikonvulsivum. ⓘ
Es kann auch als Abführmittel verwendet werden. ⓘ
- In der Medizin findet es schon lange Zeit als Abführmittel Verwendung. Der Pflanzenanatom Nehemiah Grew extrahierte das Bittersalz, welches er 1697 als Magnesiumsulfat identifizierte, erstmals aus Mineralwasser.
- In der Geburtshilfe wird MgSO4 als Mittel der Wahl für die Therapie und Prophylaxe von Eklampsie-assoziierten Krampfanfällen verwendet.
- Magnesiumsulfat findet Anwendung in sogenannten Instant-Hot-Packs zur Erzeugung von (therapeutischer) Wärme bis zu 40 °C.
- Magnesiumsulfat wird in der Medizin auch für Gallenfluss-Tests verwendet (siehe Choleretikum).
- Zur Therapie einer Torsades-de-pointes-Tachykardie wird Magnesiumsulfat intravenös verabreicht (Off-Label-Use).
- Magnesiumsulfat findet Anwendung in der Behandlung eines akuten Asthmaanfalls und auch beim akuten Herzinfarkt. ⓘ
Landwirtschaft
In der Landwirtschaft wird Magnesiumsulfat verwendet, um den Magnesium- oder Schwefelgehalt im Boden zu erhöhen. Am häufigsten wird es bei Topfpflanzen oder bei magnesiumhungrigen Pflanzen wie Kartoffeln, Tomaten, Karotten, Paprika, Zitronen und Rosen eingesetzt. Der Vorteil von Magnesiumsulfat gegenüber anderen magnesiumhaltigen Bodenhilfsstoffen (wie z. B. Dolomitkalk) ist seine hohe Löslichkeit, die auch eine Blattdüngung ermöglicht. Lösungen von Magnesiumsulfat sind außerdem nahezu pH-neutral, verglichen mit den leicht alkalischen Magnesiumsalzen, die in Kalkstein vorkommen; daher verändert die Verwendung von Magnesiumsulfat als Magnesiumquelle für den Boden den pH-Wert des Bodens nicht wesentlich. Entgegen der landläufigen Meinung, Magnesiumsulfat könne Schädlinge und Schnecken bekämpfen, die Keimung von Saatgut fördern, mehr Blüten hervorbringen, die Nährstoffaufnahme verbessern und umweltfreundlich sein, erfüllt es keine der behaupteten Eigenschaften, außer dass es Magnesiummangel im Boden behebt. Magnesiumsulfat kann bei übermäßiger Anwendung sogar das Wasser verschmutzen. ⓘ
Magnesiumsulfat wurde vor der Entwicklung der Chelattherapie zur Behandlung von Bleivergiftungen eingesetzt, da man hoffte, dass das aufgenommene Blei durch das Magnesiumsulfat ausgefällt und anschließend aus dem Verdauungstrakt ausgeschwemmt würde. Diese Anwendung war Anfang bis Mitte des 20. Jahrhunderts unter Tierärzten besonders weit verbreitet; Bittersalz war bereits in vielen landwirtschaftlichen Betrieben verfügbar und wurde häufig für die Behandlung von Nutztieren verschrieben, die versehentlich Blei aufgenommen hatten. ⓘ
Zubereitung von Lebensmitteln
Magnesiumsulfat wird verwendet als
Chemie
Wasserfreies Magnesiumsulfat wird aufgrund seiner Affinität zu Wasser und seiner Kompatibilität mit den meisten organischen Verbindungen häufig als Trocknungsmittel in der organischen Synthese verwendet. Bei der Aufarbeitung wird eine organische Phase mit wasserfreiem Magnesiumsulfat behandelt. Der hydratisierte Feststoff wird dann durch Filtration, Dekantierung oder Destillation (wenn der Siedepunkt niedrig genug ist) entfernt. Andere anorganische Sulfatsalze wie Natrium- und Calciumsulfat können auf die gleiche Weise verwendet werden. ⓘ
Bauwesen
Magnesiumsulfat wird verwendet, um durch die Reaktion zwischen Magnesiumoxid und Magnesiumsulfatlösung spezielle Zemente herzustellen, die ein gutes Bindevermögen und eine höhere Beständigkeit als Portlandzement aufweisen. Dieser Zement wird hauptsächlich für die Herstellung von leichten Isolierplatten verwendet. Die schwache Wasserbeständigkeit schränkt seine Verwendung ein. ⓘ
Magnesiumsulfat (oder Natriumsulfat) wird auch für die Prüfung der Festigkeit von Gesteinskörnungen gemäß der Norm ASTM C88 verwendet, wenn keine Aufzeichnungen über den Einsatz des Materials unter tatsächlichen Witterungsbedingungen vorliegen. Die Prüfung wird durch wiederholtes Eintauchen in gesättigte Lösungen und anschließendes Trocknen im Ofen durchgeführt, um das in den durchlässigen Porenräumen ausgefällte Salz zu dehydrieren. Die innere Ausdehnungskraft, die sich aus der Rehydrierung des Salzes beim erneuten Eintauchen ergibt, simuliert die Ausdehnung von Wasser beim Gefrieren. ⓘ
Magnesiumsulfat wird auch verwendet, um den Widerstand von Beton gegen externen Sulfatangriff (ESA) zu testen. ⓘ
Aquarien
Magnesiumsulfat-Heptahydrat wird auch verwendet, um die Magnesiumkonzentration in Meerwasseraquarien aufrechtzuerhalten, in denen sich große Mengen an Steinkorallen befinden, da das Magnesium bei ihrem Verkalkungsprozess langsam verbraucht wird. In einem Meerwasseraquarium mit Magnesiummangel sind die Kalzium- und Alkalinitätskonzentrationen sehr schwer zu kontrollieren, da nicht genügend Magnesium vorhanden ist, um diese Ionen im Meerwasser zu stabilisieren und ihre spontane Ausfällung in Kalziumkarbonat zu verhindern. ⓘ
Doppelsalze
Es gibt Doppelsalze, die Magnesiumsulfat enthalten. Es gibt mehrere, die als Natriummagnesiumsulfate und Kaliummagnesiumsulfate bekannt sind. Ein gemischtes Kupfer-Magnesiumsulfat-Heptahydrat (Mg,Cu)SO4-7H2O wurde kürzlich in Abraumhalden gefunden und erhielt den Mineralnamen Alpersit. ⓘ
Eigenschaften
Magnesiumsulfat ist ein farbloser, geruchloser, stark hygroskopischer Feststoff mit bitterem Geschmack. Es existieren mehrere Hydrate, von denen das wichtigste das Magnesiumsulfat-Heptahydrat MgSO4 · 7 H2O (Synonym: Bittersalz; Mineral Epsomit) ist. ⓘ


Epsomit bildet farblose Kristalle, die ein rhombisch pseudotetragonales Kristallgitter ausbilden. Die Kristalle blühen oft in faserigen Aggregaten aus und bilden Stalaktiten. Epsomit ist gut wasserlöslich und hat eine Dichte von 1,68 g/cm³. ⓘ
Aufgrund seiner calciumantagonistischen Eigenschaft bewirkt Magnesiumsulfat eine periphere Muskelerschlaffung. Charles H. Peck und Samuel J. Meltzner hatten es 1916 auch zur Erzielung einer zentralen Narkose intravenös eingesetzt. ⓘ
Verwendung
Düngemittel
- Magnesiumsulfat wird als Magnesiumquelle für Pflanzen in Düngemitteln verwendet. Reines Bittersalz wird unter anderem im Obstbau eingesetzt, speziell aber auch, um ein Braunwerden der Nadeln von Nadelgehölzen zu verhindern. Magnesiumsulfat trägt zu einem sauren Bodenmilieu bei, welches von Koniferen im Allgemeinen bevorzugt wird. Üblich ist ein Eintrag von 50 g/m² im Frühjahr oder Spätherbst. Bei großen Bäumen werden bis zu 200 g/m² aufgebracht. ⓘ
Trocknungsmittel
- Wegen seines hygroskopischen Charakters wird es in der organischen Chemie zur Trocknung von Stoffen benutzt. Dazu gibt man zu der zu trocknenden Flüssigkeit so viel wasserfreies Magnesiumsulfat, bis neu zugesetztes Magnesiumsulfat in der Flüssigkeit feinkörnig bleibt und nicht mehr verklumpt. Das Magnesiumsulfat kann anschließend abfiltriert werden. ⓘ
Weitere Verwendung
- MgSO4 wird in Floating-Anlagen verwendet, um eine hochgesättigte Sole herzustellen, auf der ein Körper liegen kann, ohne unterzutauchen.
- Magnesiumsulfat-Lösung wird als Elektrolyt-Ersatz- bzw. -Regenerations-Lösung für Bleiakkumulatoren verwendet.
- Als Bestandteil künstlicher Speisesalze, z. B. Pansalz, zur Einsparung von Natriumchlorid. ⓘ






