Riboflavin
 | |
 Chemische Struktur | |
| Klinische Daten | |
|---|---|
| Handelsnamen | Viele |
| Andere Bezeichnungen | Laktochrom, Laktoflavin, Vitamin G |
| AHFS/Drugs.com | Monographie |
| Lizenz-Daten |
|
| Wege der Verabreichung | Durch den Mund, intramuskulär, intravenös |
| ATC-Code |
|
| Rechtlicher Status | |
| Rechtlicher Status |
|
| Pharmakokinetische Daten | |
| Eliminationshalbwertszeit | 66 bis 84 Minuten |
| Ausscheidung | Urin |
| Bezeichner | |
IUPAC-Bezeichnung
| |
| CAS-Nummer | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL |
|
| Chemische und physikalische Daten | |
| Formel | C17H20N4O6 |
| Molare Masse | 376,369 g-mol-1 |
| 3D-Modell (JSmol) | |
SMILES
| |
InChI
| |
Riboflavin, auch bekannt als Vitamin B2, ist ein Vitamin, das in Lebensmitteln enthalten ist und als Nahrungsergänzungsmittel verkauft wird. Es ist unentbehrlich für die Bildung von zwei wichtigen Coenzymen, Flavinmononukleotid und Flavin-Adenin-Dinukleotid. Diese Coenzyme sind am Energiestoffwechsel, der Zellatmung und der Antikörperproduktion sowie an normalem Wachstum und Entwicklung beteiligt. Die Coenzyme sind auch für den Stoffwechsel von Niacin, Vitamin B6 und Folat erforderlich. Riboflavin wird zur Behandlung von Hornhautverdünnung verschrieben und kann, oral eingenommen, das Auftreten von Migränekopfschmerzen bei Erwachsenen verringern. ⓘ
Riboflavinmangel ist selten und geht meist mit einem Mangel an anderen Vitaminen und Nährstoffen einher. Er kann durch orale Ergänzungen oder Injektionen verhindert oder behandelt werden. Da es sich um ein wasserlösliches Vitamin handelt, wird Riboflavin, das über den Nährstoffbedarf hinaus aufgenommen wird, nicht gespeichert; es wird entweder nicht absorbiert oder absorbiert und schnell mit dem Urin ausgeschieden, was zu einer hellgelben Färbung des Urins führt. Natürliche Quellen für Riboflavin sind Fleisch, Fisch und Geflügel, Eier, Milchprodukte, grünes Gemüse, Pilze und Mandeln. In einigen Ländern ist der Zusatz von Riboflavin zu Getreide vorgeschrieben. ⓘ
Riboflavin wurde 1920 entdeckt, 1933 isoliert und 1935 erstmals synthetisiert. In seiner gereinigten, festen Form ist es ein wasserlösliches, gelb-oranges, kristallines Pulver. Neben seiner Funktion als Vitamin wird es auch als Lebensmittelfarbstoff verwendet. Die Biosynthese findet in Bakterien, Pilzen und Pflanzen statt, nicht aber in Tieren. Die industrielle Synthese von Riboflavin wurde ursprünglich durch ein chemisches Verfahren erreicht, aber die derzeitige kommerzielle Herstellung beruht auf Fermentationsmethoden unter Verwendung von Pilzstämmen und genetisch veränderten Bakterien. ⓘ
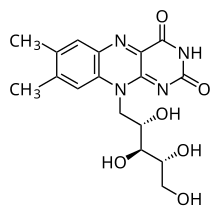
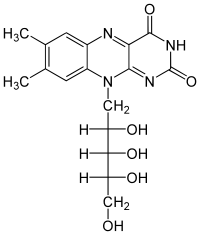
| Strukturformel ⓘ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Allgemeines | |||||||||
| Trivialname | Vitamin B2 | ||||||||
| Andere Namen |
| ||||||||
| Summenformel | C17H20N4O6 | ||||||||
| CAS-Nummer | 83-88-5 | ||||||||
| PubChem | 1072 | ||||||||
| ATC-Code |
A11HA04 | ||||||||
| DrugBank | DB00140 | ||||||||
| Kurzbeschreibung | bitter schmeckender, gelb bis orangefarbener Feststoff | ||||||||
| Vorkommen | Leber, Hefe, Weizenkeime | ||||||||
| Physiologie | |||||||||
| Funktion | Vorstufe für Flavin-Coenzyme (FAD, FMN) | ||||||||
| Täglicher Bedarf | 1,5–1,7 mg | ||||||||
| Folgen bei Mangel | Entzündungen der Haut (Exantheme, Hautrisse), Störungen des Wachstums, der Blutbildung und neurologischer Art | ||||||||
| Überdosis | nicht bekannt | ||||||||
| Eigenschaften | |||||||||
| Molare Masse | 376,37 g·mol−1 | ||||||||
| Aggregatzustand | fest | ||||||||
| Schmelzpunkt |
278–282 °C (Zersetzung) | ||||||||
| Löslichkeit |
| ||||||||
| Sicherheitshinweise | |||||||||
| |||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||
Riboflavin, auch Lactoflavin oder Vitamin B2, frühere Bezeichnung Vitamin G, ist ein Vitamin aus dem B-Komplex. Es wird umgangssprachlich auch Wachstumsvitamin genannt. ⓘ
Definition
Riboflavin, auch bekannt als Vitamin B2, ist ein wasserlösliches Vitamin und gehört zu den B-Vitaminen. Im Gegensatz zu Folat und Vitamin B6, die in mehreren chemisch verwandten Formen, den so genannten Vitameren, vorkommen, ist Riboflavin nur eine einzige chemische Verbindung. Es ist eine Ausgangsverbindung für die Synthese der Coenzyme Flavinmononukleotid (FMN, auch Riboflavin-5'-phosphat genannt) und Flavin-Adenin-Dinukleotid (FAD). FAD ist die häufigere Form von Flavin, die Berichten zufolge an 75 % der flavinabhängigen, proteinkodierten Gene im Genom aller Arten (dem Flavoproteom) bindet und als Co-Enzym für 84 % der vom Menschen kodierten Flavoproteine dient. ⓘ
In gereinigter, fester Form ist Riboflavin ein gelb-oranges, kristallines Pulver mit leichtem Geruch und bitterem Geschmack. Es ist in polaren Lösungsmitteln, wie Wasser und wässrigen Natriumchloridlösungen, löslich und in Alkoholen leicht löslich. In unpolaren oder schwach polaren organischen Lösungsmitteln wie Chloroform, Benzol oder Aceton ist es nicht löslich. In Lösung oder bei trockener Lagerung als Pulver ist Riboflavin hitzestabil, wenn es nicht dem Licht ausgesetzt wird. Bei der Zersetzung durch Erhitzen werden giftige, stickoxidhaltige Dämpfe freigesetzt. ⓘ
Funktionen
Riboflavin ist für die Bildung von zwei wichtigen Coenzymen, FMN und FAD, unerlässlich. Diese Coenzyme sind am Energiestoffwechsel, der Zellatmung, der Antikörperproduktion, dem Wachstum und der Entwicklung beteiligt. Riboflavin ist für den Stoffwechsel von Kohlenhydraten, Proteinen und Fetten unerlässlich. FAD trägt zur Umwandlung von Tryptophan in Niacin (Vitamin B3) bei, und die Umwandlung von Vitamin B6 in das Coenzym Pyridoxal-5'-phosphat erfordert FMN. Riboflavin ist an der Aufrechterhaltung eines normalen Homocysteinspiegels im Blutkreislauf beteiligt; bei Riboflavinmangel steigt der Homocysteinspiegel an, was das Risiko von Herz-Kreislauf-Erkrankungen erhöht. ⓘ
Redox-Reaktionen
Redoxreaktionen sind Prozesse, die den Transfer von Elektronen beinhalten. Die Flavin-Coenzyme unterstützen die Funktion von etwa 70-80 Flavoenzymen beim Menschen (und Hunderten von weiteren in allen Organismen, einschließlich derer, die von Archaeen-, Bakterien- und Pilzgenomen kodiert werden), die für Ein- oder Zwei-Elektronen-Redoxreaktionen verantwortlich sind, die sich die Fähigkeit der Flavine zunutze machen, zwischen oxidierten, halb-reduzierten und vollständig reduzierten Formen umgewandelt zu werden. FAD wird auch für die Aktivität der Glutathion-Reduktase benötigt, einem wichtigen Enzym für die Bildung des körpereigenen Antioxidans Glutathion. ⓘ
Mikronährstoff-Stoffwechsel
Riboflavin, FMN und FAD sind am Stoffwechsel von Niacin, Vitamin B6 und Folat beteiligt. An der Synthese der niacinhaltigen Coenzyme NAD und NADP aus Tryptophan ist das FAD-abhängige Enzym Kynurenin-3-Monooxygenase beteiligt. Ein ernährungsbedingter Mangel an Riboflavin kann die Produktion von NAD und NADP verringern und dadurch einen Niacinmangel begünstigen. An der Umwandlung von Vitamin B6 in sein Coenzym, die Pyridoxal-5'-phosphat-Synthase, ist das Enzym Pyridoxin-5'-phosphat-Oxidase beteiligt, das FMN benötigt. Ein am Folatstoffwechsel beteiligtes Enzym, die 5,10-Methylentetrahydrofolatreduktase, benötigt FAD, um aus Homocystein die Aminosäure Methionin zu bilden. ⓘ
Riboflavinmangel scheint den Stoffwechsel des Nahrungsminerals Eisen zu beeinträchtigen, das für die Bildung von Hämoglobin und roten Blutkörperchen unerlässlich ist. Die Behebung eines Riboflavinmangels bei Personen, die sowohl einen Riboflavin- als auch einen Eisenmangel aufweisen, verbessert die Wirksamkeit einer Eisenergänzung zur Behandlung einer Eisenmangelanämie. ⓘ
Synthese
Biosynthese
Die Biosynthese findet in Bakterien, Pilzen und Pflanzen statt, jedoch nicht in Tieren. Die biosynthetischen Vorstufen von Riboflavin sind Ribulose-5-Phosphat und Guanosintriphosphat. Ersteres wird in L-3,4-Dihydroxy-2-butanon-4-phosphat umgewandelt, während letzteres in einer Reihe von Reaktionen umgewandelt wird, die zu 5-Amino-6-(D-ribitylamino)uracil führen. Diese beiden Verbindungen sind dann die Substrate für den vorletzten Schritt des Weges, der durch das Enzym Lumazin-Synthase in der Reaktion EC 2.5.1.78 katalysiert wird.
Im letzten Schritt der Biosynthese werden zwei Moleküle 6,7-Dimethyl-8-ribityllumazin durch das Enzym Riboflavin-Synthase in einer Dismutationsreaktion verbunden. Dabei entsteht ein Molekül Riboflavin und ein Molekül 5-Amino-6-(D-Ribitylamino)-Uracil. Letzteres wird zur vorherigen Reaktion in der Sequenz zurückgeführt.
Die Umwandlung von Riboflavin in die Cofaktoren FMN und FAD erfolgt durch die Enzyme Riboflavin-Kinase und FAD-Synthetase, die nacheinander wirken.
 Riboflavin ist die biosynthetische Vorstufe von FMN und FAD ⓘ
Riboflavin ist die biosynthetische Vorstufe von FMN und FAD ⓘ
Industrielle Synthese

Für die großtechnische Herstellung von Riboflavin werden verschiedene Mikroorganismen verwendet, darunter Fadenpilze wie Ashbya gossypii, Candida famata und Candida flaveri sowie die Bakterien Corynebacterium ammoniagenes und Bacillus subtilis. B. subtilis, das gentechnisch verändert wurde, um sowohl die Riboflavinproduktion zu steigern als auch einen Antibiotikaresistenzmarker (Ampicillin) einzubringen, wird in kommerziellem Maßstab zur Herstellung von Riboflavin für die Anreicherung von Futter- und Lebensmitteln eingesetzt. Im Jahr 2012 wurden über 4 000 Tonnen pro Jahr durch solche Fermentationsverfahren hergestellt. ⓘ
In Gegenwart hoher Konzentrationen von Kohlenwasserstoffen oder aromatischen Verbindungen überproduzieren einige Bakterien Riboflavin, möglicherweise als Schutzmechanismus. Ein solcher Organismus ist Micrococcus luteus (American Type Culture Collection Stammnummer ATCC 49442), der durch die Produktion von Riboflavin eine gelbe Farbe entwickelt, wenn er auf Pyridin wächst, aber nicht, wenn er auf anderen Substraten wie Bernsteinsäure wächst. ⓘ
Synthese im Labor
Die erste vollständige Synthese von Riboflavin wurde von der Gruppe von Richard Kuhn durchgeführt. Ein substituiertes Anilin, das durch reduktive Aminierung mit D-Ribose hergestellt wurde, wurde im letzten Schritt mit Alloxan kondensiert:
Verwendet
Behandlung der Hornhautverdünnung
Keratokonus ist die häufigste Form der Hornhautektasie, einer fortschreitenden Verdünnung der Hornhaut. Dieser Zustand wird durch eine Kollagenvernetzung der Hornhaut behandelt, die die Steifigkeit der Hornhaut erhöht. Die Vernetzung wird durch Auftragen einer topischen Riboflavinlösung auf die Hornhaut erreicht, die dann mit ultraviolettem A-Licht bestrahlt wird. ⓘ
Vorbeugung von Migräne
In ihren Leitlinien aus dem Jahr 2012 erklärte die American Academy of Neurology, dass hochdosiertes Riboflavin (400 mg) "wahrscheinlich wirksam ist und für die Migräneprävention in Betracht gezogen werden sollte", eine Empfehlung, die auch das National Migraine Centre im Vereinigten Königreich ausspricht. In einer Überprüfung aus dem Jahr 2017 wurde berichtet, dass die tägliche Einnahme von 400 mg Riboflavin über einen Zeitraum von mindestens drei Monaten die Häufigkeit von Migränekopfschmerzen bei Erwachsenen verringern kann. Die Forschungsergebnisse zu hochdosiertem Riboflavin zur Vorbeugung oder Behandlung von Migräne bei Kindern und Jugendlichen sind nicht schlüssig, weshalb Nahrungsergänzungsmittel nicht empfohlen werden. ⓘ
Lebensmittelfarbe
Riboflavin wird als Lebensmittelfarbstoff (gelb-orangefarbenes kristallines Pulver) verwendet und ist in Europa als Lebensmittelzusatzstoff mit der E-Nummer E101 gekennzeichnet. ⓘ
Empfehlungen für die Ernährung
Die National Academy of Medicine hat 1998 den geschätzten durchschnittlichen Bedarf (Estimated Average Requirements - EARs) und die empfohlenen Tagesdosen (Recommended Dietary Allowances - RDAs) für Riboflavin aktualisiert. Die EAR-Werte für Riboflavin für Frauen und Männer ab 14 Jahren betragen 0,9 mg/Tag bzw. 1,1 mg/Tag; die RDA-Werte liegen bei 1,1 bzw. 1,3 mg/Tag. Die RDAs sind höher als die EARs, um eine angemessene Zufuhr für Personen mit überdurchschnittlichem Bedarf zu gewährleisten. Die RDA während der Schwangerschaft beträgt 1,4 mg/Tag und die RDA für stillende Mütter 1,6 mg/Tag. Für Säuglinge bis zum Alter von 12 Monaten beträgt die angemessene Zufuhr (AI) 0,3-0,4 mg/Tag und für Kinder im Alter von 1-13 Jahren steigt die RDA mit dem Alter von 0,5 auf 0,9 mg/Tag. Was die Sicherheit anbelangt, so legt die IOM für Vitamine und Mineralstoffe tolerierbare Höchstmengen fest, wenn die Beweise ausreichen. Für Riboflavin gibt es keinen UL, da es keine Humandaten über schädliche Wirkungen hoher Dosen gibt. Die EARs, RDAs, AIs und ULs werden zusammen als Dietary Reference Intakes (DRIs) bezeichnet. ⓘ
Die Europäische Behörde für Lebensmittelsicherheit (EFSA) bezeichnet die Gesamtheit der Informationen als Referenzwerte für die Ernährung, wobei die Bevölkerungsreferenzzufuhr (PRI) anstelle der RDA und der durchschnittliche Bedarf anstelle der EAR steht. AI und UL sind genauso definiert wie in den Vereinigten Staaten. Für Frauen und Männer ab 15 Jahren ist die PRI auf 1,6 mg/Tag festgelegt. Die PRI während der Schwangerschaft beträgt 1,9 mg/Tag und die PRI für stillende Frauen beträgt 2,0 mg/Tag. Für Kinder im Alter von 1-14 Jahren steigen die PRI mit dem Alter von 0,6 auf 1,4 mg/Tag an. Diese PRI sind höher als die RDA-Werte in den USA. Die EFSA befasste sich auch mit der maximalen sicheren Aufnahmemenge und entschied wie die U.S. National Academy of Medicine, dass keine ausreichenden Informationen für die Festlegung eines UL vorliegen. ⓘ
| Empfohlene Zufuhrmengen Vereinigte Staaten ⓘ | |
| Altersgruppe (Jahre) | RDA für Riboflavin (mg/d) |
|---|---|
| 0-6 Monate | 0.3* |
| 6-12 Monate | 0.4* |
| 1–3 | 0.5 |
| 4–8 | 0.6 |
| 9–13 | 0.9 |
| Frauen 14-18 | 1.0 |
| Männer 14-18 | 1.3 |
| Frauen 19+ | 1.1 |
| Männer 19+ | 1.3 |
| Schwangere Frauen | 1.4 |
| Laktierende Frauen | 1.6 |
| * Angemessene Zufuhr für Säuglinge, noch keine RDA/RDI festgelegt | |
| Referenzzufuhr für die Bevölkerung Europäische Union | |
| Altersgruppe (Jahre) | PRI für Riboflavin (mg/d) |
| 7-11 Monate | 0.4 |
| 1–3 | 0.6 |
| 4–6 | 0.7 |
| 7–10 | 1.0 |
| 11–14 | 1.4 |
| 15-Erwachsener | 1.6 |
| Schwangere Frauen | 1.9 |
| Laktierende Frauen | 2.0 |
Sicherheit
Beim Menschen gibt es keine Hinweise auf eine Riboflavin-Toxizität bei übermäßiger Zufuhr, und die Absorption wird mit steigender Dosis weniger effizient. Überschüssiges Riboflavin wird über die Nieren in den Urin ausgeschieden, was zu einer hellgelben Farbe führt, die als Flavinurie bekannt ist. Im Rahmen einer klinischen Studie über die Wirksamkeit von Riboflavin bei der Behandlung der Häufigkeit und Schwere von Migräne wurden den Probanden über einen Zeitraum von 3-12 Monaten täglich bis zu 400 mg Riboflavin oral verabreicht. Zu den berichteten Nebenwirkungen gehörten Bauchschmerzen und Durchfall. ⓘ
Kennzeichnung
Bei der Kennzeichnung von Lebensmitteln und Nahrungsergänzungsmitteln in den USA wird die Menge einer Portion als Prozentsatz des Tageswertes (%DV) angegeben. Bei der Kennzeichnung von Riboflavin betrug 100 % des Tageswerts 1,7 mg, aber am 27. Mai 2016 wurde dieser Wert auf 1,3 mg geändert, um ihn mit der RDA in Einklang zu bringen. Eine Tabelle mit den alten und neuen Tageswerten für Erwachsene finden Sie unter Reference Daily Intake. ⓘ
Quellen
Das Landwirtschaftsministerium der Vereinigten Staaten (United States Department of Agriculture, Agricultural Research Service) unterhält eine Datenbank zur Lebensmittelzusammensetzung, in der der Riboflavingehalt in Hunderten von Lebensmitteln recherchiert werden kann. ⓘ
|
|
|
Beim Mahlen von Weizen gehen 85 % des Riboflavins verloren, weshalb Weißmehl in einigen Ländern angereichert wird. Riboflavin wird auch Babynahrung, Frühstückszerealien, Nudeln und mit Vitaminen angereicherten Mahlzeitenersatzprodukten zugesetzt. Es ist schwierig, Riboflavin in flüssige Produkte einzubringen, da es in Wasser schlecht löslich ist. Daher wird Riboflavin-5'-phosphat (FMN, auch E101 genannt, wenn es als Farbstoff verwendet wird), eine besser lösliche Form von Riboflavin, benötigt. Die Anreicherung von Brot und verzehrfertigen Frühstückscerealien trägt wesentlich zur Versorgung mit dem Vitamin bei. Freies Riboflavin ist in Lebensmitteln tierischen Ursprungs zusammen mit proteingebundenem FMN und FAD natürlich vorhanden. Kuhmilch enthält hauptsächlich freies Riboflavin, aber sowohl FMN als auch FAD sind in geringen Konzentrationen vorhanden. ⓘ
Anreicherung
In einigen Ländern ist die Anreicherung von Getreidelebensmitteln vorgeschrieben oder empfohlen. Ab 2021 schreiben 56 Länder, vor allem in Nord- und Südamerika und Südostafrika, die Anreicherung von Weizen- oder Maismehl mit Riboflavin oder Riboflavin-5'-phosphat-Natrium vor. Die vorgeschriebenen Mengen reichen von 1,3 bis 5,75 mg/kg. Weitere 16 Länder haben ein freiwilliges Anreicherungsprogramm. Die indische Regierung empfiehlt beispielsweise 4,0 mg/kg für "Maida" (Weißmehl) und "Atta" (Vollkornmehl). ⓘ
Absorption, Stoffwechsel, Ausscheidung
Mehr als 90 % des mit der Nahrung aufgenommenen Riboflavins liegt in Form von proteingebundenem FMN und FAD vor. Durch den Kontakt mit Magensäure im Magen werden die Coenzyme freigesetzt, die anschließend im proximalen Dünndarm enzymatisch hydrolysiert werden, um freies Riboflavin freizusetzen. ⓘ
Die Absorption erfolgt über ein schnelles aktives Transportsystem, wobei bei hohen Konzentrationen eine zusätzliche passive Diffusion stattfindet. Gallensalze erleichtern die Aufnahme, so dass die Absorption verbessert wird, wenn das Vitamin mit einer Mahlzeit eingenommen wird. In einer kleinen klinischen Studie an Erwachsenen wurde berichtet, dass die maximale Menge an Riboflavin, die aus einer einzigen Dosis absorbiert werden kann, 27 mg beträgt. Der Großteil des neu aufgenommenen Riboflavins wird beim ersten Durchgang von der Leber aufgenommen, was darauf hindeutet, dass das postprandiale Auftreten von Riboflavin im Blutplasma die Absorption möglicherweise unterschätzt. Es wurden drei Riboflavintransporterproteine identifiziert: RFVT1 kommt im Dünndarm und auch in der Plazenta vor; RFVT2 wird im Gehirn und in den Speicheldrüsen stark exprimiert; und RFVT3 wird am stärksten im Dünndarm, in den Hoden und in der Prostata exprimiert. Säuglinge mit Mutationen in den Genen, die diese Transportproteine kodieren, können mit oral verabreichtem Riboflavin behandelt werden. ⓘ
Riboflavin wird reversibel in FMN und dann in FAD umgewandelt. Für die Umwandlung von Riboflavin in FMN ist eine zinkhaltige Riboflavin-Kinase zuständig, für den umgekehrten Vorgang eine Phosphatase. Die Umwandlung von FMN in FAD erfolgt durch die Magnesium benötigende FAD-Synthase; der umgekehrte Vorgang wird durch eine Pyrophosphatase vollzogen. FAD scheint ein hemmendes Endprodukt zu sein, das seine eigene Bildung herunterreguliert. ⓘ
Wenn überschüssiges Riboflavin vom Dünndarm absorbiert wird, wird es schnell aus dem Blut entfernt und mit dem Urin ausgeschieden. Die Farbe des Urins wird als Biomarker für den Hydratationsstatus verwendet und korreliert unter normalen Bedingungen mit dem spezifischen Gewicht des Urins und der Osmolalität des Urins. Eine Riboflavinsupplementierung, die weit über den Bedarf hinausgeht, lässt den Urin jedoch gelber als normal erscheinen. Bei normaler Nahrungsaufnahme bestehen etwa zwei Drittel der Urinausscheidung aus Riboflavin, während der Rest durch Oxidation in den Zellen und in Form anderer Metaboliten teilweise zu Hydroxymethylriboflavin metabolisiert wird. Wenn der Verbrauch die Absorptionsfähigkeit übersteigt, gelangt Riboflavin in den Dickdarm, wo es von Bakterien zu verschiedenen Metaboliten abgebaut wird, die in den Fäkalien nachgewiesen werden können. Es gibt Spekulationen, dass nicht absorbiertes Riboflavin das Mikrobiom des Dickdarms beeinflussen könnte. ⓘ
Mangel
Prävalenz
Riboflavinmangel ist in den Vereinigten Staaten und in anderen Ländern mit Programmen zur Anreicherung von Weizenmehl oder Maismehl ungewöhnlich. Aus Daten, die im Rahmen halbjährlicher Erhebungen in der US-Bevölkerung gesammelt wurden, geht hervor, dass in der Altersgruppe ab 20 Jahren 22 % der Frauen und 19 % der Männer angaben, ein Riboflavin-haltiges Nahrungsergänzungsmittel einzunehmen, in der Regel ein Vitamin-Mineralstoff-Multipräparat. Bei den Personen, die keine Nahrungsergänzungsmittel zu sich nahmen, lag die durchschnittliche Zufuhr bei erwachsenen Frauen bei 1,74 mg/Tag und bei Männern bei 2,44 mg/Tag. Diese Mengen liegen über den RDA-Werten für Riboflavin von 1,1 bzw. 1,3 mg/Tag. Bei allen Altersgruppen lag die durchschnittliche Aufnahme über die Nahrung über den RDA-Werten. Eine US-Erhebung aus den Jahren 2001-02 ergab, dass weniger als 3 % der Bevölkerung weniger als den geschätzten durchschnittlichen Bedarf an Riboflavin zu sich nahmen. ⓘ
Anzeichen und Symptome
Riboflavinmangel (auch Ariboflavinose genannt) führt zu Stomatitis, zu deren Symptomen rissige und zerklüftete Lippen, Entzündungen der Mundwinkel (Stomatitis angularis), Halsschmerzen, schmerzhafte rote Zunge und Haarausfall gehören. Die Augen können juckend, tränend, blutunterlaufen und lichtempfindlich werden. Riboflavinmangel ist mit Anämie verbunden. Längerer Riboflavinmangel kann zur Degeneration der Leber und des Nervensystems führen. Riboflavinmangel kann das Risiko einer Präeklampsie bei schwangeren Frauen erhöhen. Ein Mangel an Riboflavin während der Schwangerschaft kann zu Geburtsfehlern beim Fötus führen, einschließlich Herz- und Gliedmaßendefekten. ⓘ
Risikofaktoren
Zu den Risikopersonen für einen niedrigen Riboflavinspiegel gehören Alkoholiker, vegetarisch lebende Sportler und Veganer. Schwangere oder stillende Frauen und ihre Kinder können ebenfalls gefährdet sein, wenn die Mutter auf Fleisch und Milchprodukte verzichtet. Anorexie und Laktoseintoleranz erhöhen das Risiko eines Riboflavinmangels. Menschen mit körperlich anstrengendem Leben, wie Sportler und Arbeiter, benötigen möglicherweise eine höhere Riboflavinzufuhr. Die Umwandlung von Riboflavin in FAD und FMN ist bei Menschen mit Hypothyreose, Nebenniereninsuffizienz und Riboflavin-Transporter-Mangel beeinträchtigt. ⓘ
Ursachen
Ein Riboflavinmangel tritt in der Regel zusammen mit anderen Nährstoffmängeln auf, insbesondere einem Mangel an anderen wasserlöslichen Vitaminen. Ein Riboflavinmangel kann primär (d. h. durch unzureichende Vitaminquellen in der normalen Ernährung) oder sekundär sein, d. h. durch Bedingungen verursacht werden, die die Absorption im Darm beeinträchtigen. Ein sekundärer Mangel wird in der Regel dadurch verursacht, dass der Körper das Vitamin nicht verwerten kann, oder durch eine erhöhte Ausscheidungsrate des Vitamins. Zu den Ernährungsmustern, die das Risiko eines Mangels erhöhen, gehören Veganismus und milcharmer Vegetarismus. Krankheiten wie Krebs, Herzkrankheiten und Diabetes können einen Riboflavinmangel verursachen oder verschlimmern. ⓘ
Es gibt seltene genetische Defekte, die die Aufnahme, den Transport, den Stoffwechsel oder die Verwendung von Riboflavin durch Flavoproteine beeinträchtigen. Einer dieser Defekte ist der Riboflavin-Transporter-Mangel, der früher als Brown-Vialetto-Van Laere-Syndrom bekannt war. Varianten der Gene SLC52A2 und SLC52A3, die für die Transporterproteine RDVT2 bzw. RDVT3 kodieren, sind defekt. Bei Säuglingen und Kleinkindern treten Muskelschwäche, Hirnnervendefizite einschließlich Hörverlust, sensorische Symptome einschließlich sensorischer Ataxie, Fütterungsschwierigkeiten und Atemnot auf, die durch eine sensomotorische axonale Neuropathie und Hirnnervenpathologie verursacht werden. Unbehandelt haben Säuglinge mit Riboflavintransporter-Mangel eine erschwerte Atmung und laufen Gefahr, im ersten Lebensjahrzehnt zu sterben. Die Behandlung mit einer oralen Supplementierung hoher Mengen an Riboflavin ist lebensrettend. ⓘ
Zu den anderen angeborenen Stoffwechselstörungen gehören der Riboflavin-responsive multiple Acyl-CoA-Dehydrogenase-Mangel, der auch als Untergruppe der Glutarsäureanämie Typ 2 bekannt ist, und die C677T-Variante des Enzyms Methylentetrahydrofolat-Reduktase, die bei Erwachsenen mit dem Risiko für Bluthochdruck in Verbindung gebracht wird. ⓘ

Bei normaler Ernährung treten keine Mangelerscheinungen auf. Allerdings kann es bei Schwangeren und Alkoholkranken zu Mangelerscheinungen kommen, die sich in Exanthemen, Hautrissen (insbesondere an den Lippen bzw. im Mundwinkel, Cheilosis) und Lichtüberempfindlichkeit äußern. Diese Hypovitaminose heißt Ariboflavinose oder B2-Avitaminose. Zur Früherkennung eines Riboflavin-Mangels kann der EGRAC bestimmt werden. ⓘ
In der Migräne-Forschung wird vermutet, dass Migräne-Patienten an einer Unterversorgung des Hirnstoffwechsels mit Riboflavin leiden können, der durch die Zuführung von entsprechend mehr Vitamin behoben oder gelindert werden kann. ⓘ
Diagnose und Bewertung
Die Beurteilung des Riboflavinstatus ist bei Verdacht auf einen Mangel zur Bestätigung von Fällen mit unspezifischen Symptomen unerlässlich. Die Gesamtausscheidung von Riboflavin beträgt bei gesunden Erwachsenen mit normaler Riboflavinzufuhr etwa 120 Mikrogramm pro Tag, während eine Ausscheidung von weniger als 40 Mikrogramm pro Tag auf einen Mangel hinweist. Die Riboflavin-Ausscheidungsrate nimmt mit zunehmendem Alter ab, steigt jedoch bei chronischem Stress und der Einnahme einiger verschreibungspflichtiger Medikamente an. ⓘ
Die beim Menschen verwendeten Indikatoren sind die erythrozytäre Glutathionreduktase (EGR), die erythrozytäre Flavinkonzentration und die Urinausscheidung. Der Aktivitätskoeffizient der erythrozytären Glutathion-Reduktase (EGRAC) ist ein Maß für die Gewebesättigung und den langfristigen Riboflavinstatus. Die Ergebnisse werden als Verhältnis des Aktivitätskoeffizienten ausgedrückt, der durch die Enzymaktivität mit und ohne Zugabe von FAD zum Kulturmedium bestimmt wird. Ein EGRAC von 1,0 bis 1,2 zeigt an, dass ausreichende Mengen an Riboflavin vorhanden sind; 1,2 bis 1,4 gilt als niedrig, ein Wert über 1,4 als mangelhaft. Bei der weniger empfindlichen "Erythrozyten-Flavin-Methode" gelten Werte über 400 nmol/L als ausreichend und Werte unter 270 nmol/L als mangelhaft. Die Urinausscheidung wird als nmol Riboflavin pro Gramm Kreatinin angegeben. Niedrig ist definiert als im Bereich von 50 bis 72 nmol/g. Mangelhaft ist ein Wert unter 50 nmol/g. Zur Bestimmung des Ernährungsbedarfs wurden Urinausscheidungstests durchgeführt. Bei erwachsenen Männern kam es bei einer Erhöhung der oralen Dosis von 0,5 mg auf 1,1 mg zu einem bescheidenen linearen Anstieg der Riboflavinausscheidung im Urin, die bei einer anschließenden 24-stündigen Urinsammlung 100 Mikrogramm erreichte. Über eine Belastungsdosis von 1,1 mg hinaus nahm die Urinausscheidung rasch zu, so dass bei einer Dosis von 2,5 mg die Urinausscheidung 800 Mikrogramm bei einer 24-stündigen Urinsammlung betrug. ⓘ
Geschichte
Der Name "Riboflavin" leitet sich von "Ribose" (dem Zucker, dessen reduzierte Form, das Ribitol, Teil seiner Struktur ist) und "Flavin" ab, der Ringkomponente, die dem oxidierten Molekül die gelbe Farbe verleiht (von lateinisch flavus, "gelb"). Die reduzierte Form, die im Stoffwechsel zusammen mit der oxidierten Form auftritt, erscheint als orange-gelbe Nadeln oder Kristalle. Die früheste Identifizierung, die noch vor dem Konzept der Vitamine als essenzielle Nährstoffe erfolgte, wurde von Alexander Wynter Blyth vorgenommen. Im Jahr 1897 isolierte Blyth einen wasserlöslichen Bestandteil der Kuhmilchmolke, den er "Laktochrom" nannte und der bei Lichteinwirkung gelb-grün fluoreszierte. ⓘ
In den frühen 1900er Jahren untersuchten mehrere Forschungslabors Nahrungsbestandteile, die für das Wachstum von Ratten wichtig waren. Diese Bestandteile wurden zunächst in das fettlösliche "Vitamin" A und das wasserlösliche "Vitamin" B unterteilt. (Das "e" wurde 1920 gestrichen.) Man ging davon aus, dass Vitamin B aus zwei Komponenten besteht, einer hitzelabilen Substanz namens B1 und einer hitzestabilen Substanz namens B2. Vitamin B2 wurde versuchsweise als der Faktor identifiziert, der für die Verhinderung von Pellagra notwendig ist, doch wurde später bestätigt, dass dies auf einen Mangel an Niacin (Vitamin B3) zurückzuführen ist. Die Verwirrung war darauf zurückzuführen, dass ein Mangel an Riboflavin (B2) Stomatitis-Symptome hervorruft, die denen der Pellagra ähneln, jedoch ohne die weit verbreiteten peripheren Hautläsionen. Aus diesem Grund wurde der Riboflavinmangel beim Menschen schon früh als "Pellagra sine Pellagra" (Pellagra ohne Pellagra) bezeichnet. ⓘ
1935 berichtete Paul Gyorgy in Zusammenarbeit mit dem Chemiker Richard Kuhn und dem Arzt T. Wagner-Jauregg, dass Ratten, die eine B2-freie Diät erhielten, nicht an Gewicht zunahmen. Bei der Isolierung von B2 aus Hefe wurde ein leuchtend gelb-grün fluoreszierendes Produkt gefunden, das das normale Wachstum wiederherstellte, wenn es an Ratten verfüttert wurde. Das wiederhergestellte Wachstum war direkt proportional zur Intensität der Fluoreszenz. Diese Beobachtung ermöglichte es den Forschern 1933, einen schnellen chemischen Bioassay zu entwickeln und den Faktor aus Eiklar zu isolieren und ihn Ovoflavin zu nennen. Die gleiche Gruppe isolierte dann ein ähnliches Präparat aus Molke und nannte es Lactoflavin. 1934 identifizierte Kuhns Gruppe die chemische Struktur dieser Flavine als identisch, entschied sich für "Riboflavin" als Namen und konnte das Vitamin auch synthetisieren. ⓘ
Um 1937 wurde Riboflavin auch als "Vitamin G" bezeichnet. 1938 erhielt Richard Kuhn den Nobelpreis für Chemie für seine Arbeiten über Vitamine, zu denen auch B2 und B6 gehörten. Im Jahr 1939 wurde durch eine klinische Studie von William H. Sebrell und Roy E. Butler bestätigt, dass Riboflavin für die menschliche Gesundheit unerlässlich ist. Frauen, die mit einer riboflavinarmen Diät gefüttert wurden, entwickelten Stomatitis und andere Mangelerscheinungen, die durch die Behandlung mit synthetischem Riboflavin rückgängig gemacht wurden. Die Symptome kehrten zurück, wenn die Nahrungsergänzungsmittel abgesetzt wurden. ⓘ
Vitamin B2 wurde 1920 erstmals aus Milch (lacto) isoliert, enthält ein gelbes Chromophor (flavin) und einen Ribityl-Rest (ribo). ⓘ
Vorkommen
Vitamin B2 kann in der Nahrung als ungebundenes Riboflavin vorliegen oder an Eiweiße gebunden. Es kommt unter anderem in Milch und Milchprodukten, aber auch in Gemüse wie Broccoli, Spargel oder Spinat vor, außerdem in Fisch, Muskelfleisch, Eiern und Vollkornprodukten. ⓘ
Es wird seit 1990 biotechnologisch mit Hilfe des filamentösen Pilzes Ashbya gossypii hergestellt. Der Wildtyp produziert bis zu 100 mg Riboflavin pro g Biomasse, die Produktionsstämme liefern mehr als 20 g/L. Alternativ wird Riboflavin auch durch gentechnisch veränderte Stämme von Bacillus subtilis produziert. ⓘ
Eigenschaften
Riboflavin ist ein Derivat des Heterozyklus Pteridin, genauer des Isoalloxazins und des Zuckeralkohols Ribitol. Riboflavin zählt – obwohl wenig in Wasser löslich – zu den wasserlöslichen Vitaminen; es ist lichtempfindlich, aber so stabil gegen Hitze und Sauerstoff, dass es beim Kochen nicht zerstört wird. ⓘ
Organische Synthese
Die organische Synthese wird ausgehend von D-Ribose gestartet. Alternativ kann auch D-Glucose verwendet werden. Dabei wird die D-Glucose über Oxidation, Epimerisierung der Hydroxygruppen und anschließender Reduzierungen zu D-Ribose umgewandelt. ⓘ
Die D-Ribose wird mit 3,4-Xylidin bei 50–80 °C in Methanol gelöst. Dabei wird Wasserstoff unter einem Druck von 3 bar an einen Palladium-Kohle-Katalysator zugeströmt, wodurch der doppelt gebundene Sauerstoff zwei Wasserstoffatome aufnehmen kann und sich somit Wasser aus der Verbindung abspalten kann. Diese Abspaltung ist die Triebkraft für die Bildung des Zwischenprodukts N-D-Ribityl-3,4-xylidin. ⓘ
Dieses Zwischenprodukt wird im Folgenden mit einem Anilinderivat, zum Beispiel Phenyldiazoniumchlorid, in Essigsäure gegeben, wobei sich 1-D-Ribitylamino-3,4-dimethyl-6-phenylazobenzol bildet. Diese elektrophile aromatische Substitutionsreaktion, bei der das Diazoniumsalz mit dem aktivierten Aromaten reagiert, wird Azokupplung genannt. Dabei wird das positiv geladene Stickstoffatom des Diazoniumsalzes von der ortho-Position des N-D-Ribityl-3,4-xylidins angegriffen, wobei unter Abspaltung von Chlorwasserstoffsäure 1-D-Ribitylamino-3,4-dimethyl-6-phenylazobenzol entsteht. ⓘ
Zuletzt wird das 1-D-Ribitylamino-3,4-dimethyl-6-phenylazobenzol in Eisessigsäure und Dioxan gelöst und Barbitursäure zugegeben. Ein doppelt gebundener Sauerstoff der Barbitursäure wird dabei Protonen aufnehmen und unter der Abspaltung von Wasser (Kondensationsreaktion) das Ringsystem öffnen. Das Intermediat bindet dann an das 1-D-Ribitylamino-3,4-dimethyl-6-phenylazobenzol, wobei es unter Abspaltung von Anilin einen intramolekularen Ringschluss vollzieht. ⓘ
Das entstandene Produkt wird Riboflavin genannt und kann anschließend aufgereinigt werden. ⓘ
Funktion
Riboflavin dient als Vorstufe für Flavin-Koenzyme (FAD, FMN), die insbesondere in Oxidoreduktasen, z. B. NADH-Dehydrogenase, eine große Rolle spielen. Dadurch nimmt es im Stoffwechsel eine zentrale Rolle ein. ⓘ
Der angeblichen Empfehlung von Neurologen zu einer Tablette zu 100 mg bzw. 400 mg Riboflavin am Tag zur Prophylaxe gegen Migräne steht die Einschätzung einer S3-Leitlinie gegenüber, dass von einem Hinweis, aber nicht von einem Nachweis der Wirksamkeit von Riboflavin (Vitamin B2) zur Migräneprophylaxe gesprochen werden kann. ⓘ
Überdosierung
Überdosierungen sind beim Menschen nicht bekannt. Die Toxizität von B2 ist sehr gering. Für gewöhnlich wird, wie bei anderen wasserlöslichen Vitaminen auch, vom Körper nicht benötigtes bzw. resorbierbares Riboflavin mit dem Urin bzw. Stuhl wieder ausgeschieden. ⓘ
Sonstige Nutzung
Das wasserlösliche, hitzestabile und lichtempfindliche Riboflavin wurde 1962 als einer der ersten Lebensmittelzusatzstoffe durch die Richtlinie des Rats zur Angleichung der Rechtsvorschriften der Mitgliedstaaten für färbende Stoffe, die in Lebensmitteln verwendet werden dürfen in der EWG zugelassen und erhielt die E-Nummer E 101. Auch in der aktuellen Verordnung (EG) Nr. 1333/2008 wird es aufgeführt und ist dadurch in der EU und den anderen Ländern des EWR als Lebensmittelfarbstoff zugelassen. In der Verordnung wird auch geregelt, dass eine Verwendung nur in bestimmten Lebensmitteln zulässig ist. Riboflavin darf dabei ohne Mengebegrenzung (quantum satis) verwendet werden. In der Schweiz ist die Verwendung sinngemäß durch die Zusatzstoffverordnung geregelt. ⓘ
Es wird auch gerne zur Kontrolle von Reinigungsprozessen (Flächen, Hände etc.) in der Pharmaindustrie eingesetzt, da es auch in geringer Konzentration bei UV-Licht leuchtet und damit gut sichtbar ist. ⓘ
In der Medizin kann Riboflavin auch als Photosensibilisator eingesetzt werden. So wird es beispielsweise zur Quervernetzung von Kollagen in der menschlichen Hornhaut verwendet, was als Behandlung von Keratokonus dienen kann. ⓘ


