Erythrozyt
| Rote Blutkörperchen ⓘ | |
|---|---|
 Rasterelektronenmikroskopische Aufnahme von menschlichen roten Blutkörperchen (ca. 6-8 μm Durchmesser) | |
| Einzelheiten | |
| Funktion | Sauerstofftransport |
| Bezeichner | |
| Akronym(e) | ERYTHROZYTEN |
| Anatomische Begriffe der Mikroanatomie [Bearbeiten auf Wikidata] | |
Rote Blutkörperchen (RBCs), auch rote Zellen, rote Blutkörperchen (beim Menschen oder anderen Tieren ohne Zellkern in roten Blutkörperchen), Hämatide, erythroide Zellen oder Erythrozyten (von griechisch erythros für "rot" und kytos für "Hohlgefäß", wobei -cyte im modernen Sprachgebrauch mit "Zelle" übersetzt wird), sind die häufigste Art von Blutzellen und das wichtigste Mittel der Wirbeltiere, um Sauerstoff (O2) zu den Körpergeweben zu bringen - über den Blutfluss durch das Kreislaufsystem. Die Erythrozyten nehmen den Sauerstoff in der Lunge bzw. bei Fischen in den Kiemen auf und geben ihn an das Gewebe ab, während sie sich durch die Kapillaren des Körpers quetschen. ⓘ
Das Zytoplasma der roten Blutkörperchen ist reich an Hämoglobin, einem eisenhaltigen Biomolekül, das Sauerstoff binden kann und für die rote Farbe der Zellen und des Blutes verantwortlich ist. Jedes menschliche rote Blutkörperchen enthält etwa 270 Millionen Hämoglobinmoleküle. Die Zellmembran besteht aus Proteinen und Lipiden, und diese Struktur sorgt für Eigenschaften, die für die physiologische Funktion der Zelle wesentlich sind, wie z. B. die Verformbarkeit und Stabilität der Blutzelle beim Durchqueren des Kreislaufsystems und insbesondere des Kapillarnetzes. ⓘ
Beim Menschen sind reife rote Blutkörperchen flexible, bikonkave Scheiben. Sie haben keinen Zellkern und keine Organellen, um möglichst viel Platz für das Hämoglobin zu bieten; man kann sie als Hämoglobinsäcke mit einer Plasmamembran als Sack betrachten. Bei einem erwachsenen Menschen werden pro Sekunde etwa 2,4 Millionen neue Erythrozyten gebildet. Die Zellen entwickeln sich im Knochenmark und zirkulieren etwa 100-120 Tage im Körper, bevor ihre Bestandteile von Makrophagen recycelt werden. Jeder Kreislauf dauert etwa 60 Sekunden (eine Minute). Ungefähr 84 % der Zellen im menschlichen Körper sind 20-30 Billionen rote Blutkörperchen. Nahezu die Hälfte des Blutvolumens (40 bis 45 %) besteht aus roten Blutkörperchen. ⓘ
Verpackte rote Blutkörperchen (pRBC) sind rote Blutkörperchen, die gespendet, verarbeitet und in einer Blutbank für Bluttransfusionen gelagert wurden. ⓘ
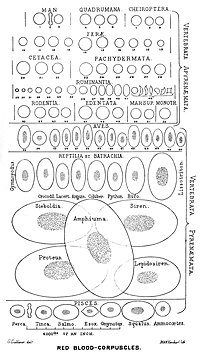
Reife Erythrozyten von Säugetieren erscheinen unter dem Mikroskop als ungefähr gleich große, blasse, runde Scheiben, die in der Mitte von beiden Seiten leicht eingedellt (bikonkav) sind und keinen Zellkern haben. Auch andere Organellen wie Mitochondrien und Ribosomen fehlen. Die Erythrozyten anderer Wirbeltiergruppen haben in der Regel Zellkerne, sie fehlen sonst nur bei einigen Fisch- und Amphibienarten. Die Größe kann zwischen verschiedenen Arten um das Zweihundertfache variieren. ⓘ
Aufbau
Wirbeltiere
Die große Mehrheit der Wirbeltiere, einschließlich der Säugetiere und des Menschen, hat rote Blutkörperchen. Rote Blutkörperchen sind Zellen, die im Blut vorhanden sind, um Sauerstoff zu transportieren. Die einzigen bekannten Wirbeltiere ohne rote Blutkörperchen sind die Krokodileisfische (Familie Channichthyidae); sie leben in sehr sauerstoffreichem kaltem Wasser und transportieren den Sauerstoff frei gelöst in ihrem Blut. Obwohl sie kein Hämoglobin mehr verwenden, finden sich in ihrem Genom Reste von Hämoglobin-Genen. ⓘ
Die roten Blutkörperchen der Wirbeltiere bestehen hauptsächlich aus Hämoglobin, einem komplexen Metalloprotein mit Häm-Gruppen, dessen Eisenatome sich in der Lunge oder den Kiemen vorübergehend an Sauerstoffmoleküle (O2) binden und diese im ganzen Körper abgeben. Der Sauerstoff kann leicht durch die Zellmembran der roten Blutkörperchen diffundieren. Das Hämoglobin in den roten Blutkörperchen transportiert auch einen Teil des Abfallprodukts Kohlendioxid aus den Geweben zurück; der größte Teil des Abfallprodukts Kohlendioxid wird jedoch als im Blutplasma gelöstes Bikarbonat (HCO3-) zu den Lungenkapillaren der Lunge zurücktransportiert. Myoglobin, eine mit dem Hämoglobin verwandte Verbindung, dient der Speicherung von Sauerstoff in den Muskelzellen. ⓘ
Die Farbe der roten Blutkörperchen ist auf die Häm-Gruppe des Hämoglobins zurückzuführen. Das Blutplasma allein ist strohfarben, aber die roten Blutkörperchen ändern ihre Farbe je nach Zustand des Hämoglobins: Wenn es mit Sauerstoff verbunden ist, ist das entstehende Oxyhämoglobin scharlachrot, und wenn der Sauerstoff freigesetzt wurde, ist das entstehende Desoxyhämoglobin von dunkelroter, burgunderroter Farbe. Durch die Gefäßwand und die Haut hindurch betrachtet, kann das Blut jedoch bläulich erscheinen. Die Pulsoxymetrie nutzt die Farbänderung des Hämoglobins, um die Sauerstoffsättigung des arteriellen Blutes mit kolorimetrischen Verfahren direkt zu messen. Hämoglobin hat auch eine sehr hohe Affinität für Kohlenmonoxid und bildet Carboxyhämoglobin, das eine sehr leuchtend rote Farbe hat. Errötete, verwirrte Patienten mit einem Sättigungswert von 100 % bei der Pulsoxymetrie leiden manchmal an einer Kohlenmonoxidvergiftung. ⓘ
Das Vorhandensein von sauerstofftransportierenden Proteinen in spezialisierten Zellen (im Gegensatz zu den in der Körperflüssigkeit gelösten Sauerstoffträgern) war ein wichtiger Schritt in der Evolution der Wirbeltiere, da dies eine geringere Viskosität des Blutes, höhere Sauerstoffkonzentrationen und eine bessere Diffusion von Sauerstoff aus dem Blut in das Gewebe ermöglicht. Die Größe der roten Blutkörperchen variiert stark zwischen den Wirbeltierarten; die Breite der roten Blutkörperchen ist im Durchschnitt etwa 25 % größer als der Kapillardurchmesser, und es wird vermutet, dass dies den Sauerstofftransfer von den roten Blutkörperchen zum Gewebe verbessert. ⓘ
Säugetiere
Die roten Blutkörperchen von Säugetieren sind in der Regel als bikonkave Scheiben geformt: abgeflacht und vertieft in der Mitte, mit einem hantelförmigen Querschnitt und einem torusförmigen Rand am Rand der Scheibe. Diese Form ermöglicht ein hohes Verhältnis von Oberfläche zu Volumen (SA/V), um die Diffusion von Gasen zu erleichtern. Es gibt jedoch einige Ausnahmen hinsichtlich der Form in der Ordnung der Paarhufer (Huftiere mit glatten Zehen, einschließlich Rinder, Hirsche und ihre Verwandten), die eine große Vielfalt an bizarren Morphologien der roten Blutkörperchen aufweisen: kleine und stark ovale Zellen bei Lamas und Kamelen (Familie Camelidae), winzige kugelförmige Zellen bei Mäusehirschen (Familie Tragulidae) und Zellen, die bei Rothirschen und Wapiti (Familie Cervidae) fusiforme, lanzettliche, halbmondförmige, unregelmäßig polygonale und andere eckige Formen annehmen. Die Mitglieder dieser Ordnung haben eindeutig einen Entwicklungsmodus der roten Blutkörperchen entwickelt, der sich wesentlich von der Norm bei Säugetieren unterscheidet. Insgesamt sind die roten Blutkörperchen von Säugetieren bemerkenswert flexibel und verformbar, so dass sie sich durch winzige Kapillaren zwängen und ihre Oberfläche maximieren können, indem sie die Form einer Zigarre annehmen, an der sie ihre Sauerstoffladung effizient abgeben. ⓘ
Die roten Blutkörperchen der Säugetiere sind einzigartig unter den Wirbeltieren, da sie im reifen Zustand keine Zellkerne haben. In den frühen Phasen der Erythropoese haben sie Kerne, die sie aber während der Entwicklung während der Reifung abstoßen, um mehr Platz für das Hämoglobin zu schaffen. Die roten Blutkörperchen ohne Zellkern, die so genannten Retikulozyten, verlieren später alle anderen Zellorganellen wie ihre Mitochondrien, den Golgi-Apparat und das endoplasmatische Reticulum. ⓘ
Die Milz dient als Reservoir für rote Blutkörperchen, doch ist dieser Effekt beim Menschen eher begrenzt. Bei einigen anderen Säugetieren wie Hunden und Pferden speichert die Milz eine große Anzahl roter Blutkörperchen, die bei Anstrengung ins Blut abgegeben werden, was zu einer höheren Sauerstofftransportkapazität führt. ⓘ

Mensch


Ein typisches menschliches rotes Blutkörperchen hat einen Scheibendurchmesser von ca. 6,2-8,2 µm und eine Dicke an der dicksten Stelle von 2-2,5 µm und eine minimale Dicke in der Mitte von 0,8-1 µm und ist damit viel kleiner als die meisten anderen menschlichen Zellen. Diese Zellen haben ein durchschnittliches Volumen von etwa 90 fL mit einer Oberfläche von etwa 136 μm2 und können zu einer Kugelform anschwellen, die 150 fL enthält, ohne dass sich die Membran ausdehnt. ⓘ
Ein erwachsener Mensch hat zu jedem Zeitpunkt etwa 20-30 Billionen rote Blutkörperchen, die zahlenmäßig etwa 70 % aller Zellen ausmachen. Frauen haben etwa 4-5 Millionen rote Blutkörperchen pro Mikroliter (Kubikmillimeter) Blut und Männer etwa 5-6 Millionen; Menschen, die in großen Höhen mit niedriger Sauerstoffspannung leben, haben mehr. Die roten Blutkörperchen sind also viel häufiger als die anderen Blutteilchen: Es gibt etwa 4.000-11.000 weiße Blutkörperchen und etwa 150.000-400.000 Blutplättchen pro Mikroliter. ⓘ
Menschliche rote Blutkörperchen benötigen durchschnittlich 60 Sekunden, um einen Kreislauf zu durchlaufen. ⓘ
Die rote Farbe des Blutes ist auf die spektralen Eigenschaften der Häm-Eisen-Ionen im Hämoglobin zurückzuführen. Jedes Hämoglobinmolekül trägt vier Häm-Gruppen; Hämoglobin macht etwa ein Drittel des gesamten Zellvolumens aus. Hämoglobin ist für den Transport von mehr als 98 % des Sauerstoffs im Körper verantwortlich (der restliche Sauerstoff wird im Blutplasma gelöst transportiert). Die roten Blutkörperchen eines durchschnittlichen erwachsenen Mannes speichern insgesamt etwa 2,5 Gramm Eisen, was etwa 65 % des gesamten im Körper enthaltenen Eisens entspricht. ⓘ
Mikrostruktur
Zellkern
Die roten Blutkörperchen von Säugetieren sind in der Reifephase kernlos, d. h. sie haben keinen Zellkern. Im Vergleich dazu haben die roten Blutkörperchen anderer Wirbeltiere einen Zellkern; die einzigen bekannten Ausnahmen sind Salamander der Gattung Batrachoseps und Fische der Gattung Maurolicus. ⓘ
Der Wegfall des Zellkerns in den roten Blutkörperchen der Wirbeltiere wurde als Erklärung für die anschließende Anhäufung von nicht codierender DNA im Genom angeführt. Die Argumentation lautet wie folgt: Ein effizienter Gastransport erfordert, dass die roten Blutkörperchen durch sehr enge Kapillaren fließen, was ihre Größe einschränkt. Ohne Kerneliminierung wird die Anhäufung von Wiederholungssequenzen durch das vom Kern eingenommene Volumen begrenzt, das mit der Größe des Genoms zunimmt. ⓘ
Bei Säugetieren gibt es zwei Formen kernhaltiger roter Blutkörperchen: Normoblasten, die normale erythropoetische Vorstufen reifer roter Blutkörperchen sind, und Megaloblasten, die abnorm große Vorstufen sind, die bei megaloblastischen Anämien auftreten. ⓘ
Zusammensetzung der Membranen
Rote Blutkörperchen sind verformbar, flexibel, können an anderen Zellen haften und mit Immunzellen in Kontakt treten. Ihre Membran spielt dabei zahlreiche Rollen. Diese Funktionen sind in hohem Maße von der Zusammensetzung der Membran abhängig. Die Membran der roten Blutkörperchen besteht aus drei Schichten: der Glykokalyx auf der Außenseite, die reich an Kohlenhydraten ist, der Lipiddoppelschicht, die neben ihren lipidischen Hauptbestandteilen viele Transmembranproteine enthält, und dem Membranskelett, einem strukturellen Netzwerk von Proteinen, das sich auf der Innenseite der Lipiddoppelschicht befindet. Die Hälfte der Membranmasse in den roten Blutkörperchen des Menschen und der meisten Säugetiere besteht aus Proteinen. Die andere Hälfte sind Lipide, nämlich Phospholipide und Cholesterin. ⓘ
Membranlipide

Die Erythrozytenmembran besteht aus einer typischen Lipiddoppelschicht, wie sie auch in praktisch allen menschlichen Zellen zu finden ist. Einfach ausgedrückt, besteht diese Lipiddoppelschicht aus Cholesterin und Phospholipiden in gleichen Gewichtsanteilen. Die Lipidzusammensetzung ist wichtig, da sie viele physikalische Eigenschaften wie die Membrandurchlässigkeit und Fluidität bestimmt. Außerdem wird die Aktivität vieler Membranproteine durch Wechselwirkungen mit den Lipiden in der Doppelschicht reguliert. ⓘ
Im Gegensatz zu Cholesterin, das gleichmäßig zwischen den inneren und äußeren Membranblättern verteilt ist, sind die 5 wichtigsten Phospholipide asymmetrisch angeordnet, wie unten dargestellt: Äußere Monolage
- Phosphatidylcholin (PC);
- Sphingomyelin (SM). ⓘ
Innere Monolage
- Phosphatidylethanolamin (PE);
- Phosphoinositol (PI) (geringe Mengen).
- Phosphatidylserin (PS); ⓘ
Diese asymmetrische Verteilung der Phospholipide in der Doppelschicht ist das Ergebnis der Funktion mehrerer energieabhängiger und energieunabhängiger Phospholipid-Transportproteine. Als "Flippasen" bezeichnete Proteine transportieren Phospholipide von der äußeren zur inneren Monolage, während andere, als "Floppasen" bezeichnete Proteine den umgekehrten Vorgang gegen einen Konzentrationsgradienten auf energieabhängige Weise ausführen. Darüber hinaus gibt es auch "Scramblase"-Proteine, die Phospholipide gleichzeitig in beide Richtungen bewegen, und zwar auf energieunabhängige Weise entlang ihres Konzentrationsgradienten. Über die Identität dieser Membranerhaltungsproteine in der Erythrozytenmembran wird noch viel diskutiert. ⓘ
Die Aufrechterhaltung einer asymmetrischen Phospholipidverteilung in der Doppelschicht (z. B. eine ausschließliche Lokalisierung von PS und PI in der inneren Monoschicht) ist aus mehreren Gründen entscheidend für die Integrität und Funktion der Zelle:
- Makrophagen erkennen und phagozytieren Erythrozyten, die PS an ihrer äußeren Oberfläche freilegen. Der Einschluss der PS in der inneren Monoschicht ist daher unerlässlich, wenn die Zelle die häufigen Begegnungen mit Makrophagen des retikuloendothelialen Systems, insbesondere in der Milz, überleben soll.
- Die vorzeitige Zerstörung von Erythrozyten mit Thallassämie und Sichelzellanämie wurde mit Störungen der Lipidasymmetrie in Verbindung gebracht, die zur Freilegung von PS auf der äußeren Monoschicht führen.
- Eine Exposition von PS kann die Adhäsion von Erythrozyten an vaskulären Endothelzellen verstärken und so den normalen Transit durch das Mikrogefäßsystem verhindern. Daher ist es wichtig, dass PS nur im inneren Fiederblatt der Doppelschicht erhalten bleibt, um einen normalen Blutfluss in der Mikrozirkulation zu gewährleisten.
- Sowohl PS als auch Phosphatidylinositol-4,5-bisphosphat (PIP2) können aufgrund ihrer Wechselwirkungen mit Skelettproteinen wie Spectrin und Protein 4.1R die mechanische Funktion der Membran regulieren. Jüngste Studien haben gezeigt, dass die Bindung von Spectrin an PS die mechanische Stabilität der Membran fördert. PIP2 verstärkt die Bindung von Proteinbande 4.1R an Glycophorin C, verringert aber dessen Wechselwirkung mit Proteinbande 3 und kann dadurch die Bindung der Doppelschicht an das Membranskelett modulieren. ⓘ
In neueren Studien wurde das Vorhandensein spezialisierter Strukturen in der Erythrozytenmembran beschrieben, die als "Lipid Rafts" bezeichnet werden. Dabei handelt es sich um Strukturen, die mit Cholesterin und Sphingolipiden angereichert sind und mit spezifischen Membranproteinen assoziiert sind, nämlich Flotillinen, STOMatinen (Band 7), G-Proteinen und β-adrenergen Rezeptoren. Es hat sich gezeigt, dass Lipid Rafts, die in nicht-erythroiden Zellen in Zellsignalisierungsereignisse verwickelt sind, in erythroiden Zellen die β2-adrenerge Rezeptorsignalisierung vermitteln und den cAMP-Spiegel erhöhen und damit den Eintritt von Malariaparasiten in normale Erythrozyten regulieren. ⓘ
Membranproteine

Die Proteine des Membranskeletts sind für die Verformbarkeit, Flexibilität und Haltbarkeit der Erythrozyten verantwortlich. Sie ermöglichen es ihnen, sich durch Kapillaren mit einem Durchmesser von weniger als der Hälfte des Erythrozytendurchmessers (7-8 μm) zu quetschen und ihre scheibenförmige Gestalt wiederzuerlangen, sobald diese Zellen keine Druckkräfte mehr erfahren, ähnlich wie ein Gegenstand aus Gummi. ⓘ
Derzeit sind mehr als 50 Membranproteine bekannt, die in einigen hundert bis zu einer Million Kopien pro rotem Blutkörperchen vorhanden sein können. Etwa 25 dieser Membranproteine tragen die verschiedenen Blutgruppen-Antigene, wie die A-, B- und Rh-Antigene, neben vielen anderen. Diese Membranproteine können eine Vielzahl von Funktionen erfüllen, wie z. B. den Transport von Ionen und Molekülen durch die Erythrozytenmembran, die Adhäsion und Interaktion mit anderen Zellen, wie z. B. Endothelzellen, als Signalrezeptoren sowie weitere derzeit unbekannte Funktionen. Die Blutgruppen des Menschen sind auf Unterschiede in den Oberflächenglykoproteinen der roten Blutkörperchen zurückzuführen. Störungen der Proteine in diesen Membranen werden mit vielen Erkrankungen in Verbindung gebracht, wie z. B. der hereditären Sphärozytose, der hereditären Elliptozytose, der hereditären Stomatozytose und der paroxysmalen nächtlichen Hämoglobinurie. ⓘ
Die Membranproteine der roten Blutkörperchen, geordnet nach ihrer Funktion:

Transport
- Band 3 - Anionentransporter, ebenfalls ein wichtiger struktureller Bestandteil der Erythrozytenmembran, macht bis zu 25 % der Zellmembranoberfläche aus, jedes rote Blutkörperchen enthält etwa eine Million Kopien. Bestimmt die Diego-Blutgruppe;
- Aquaporin 1 - Wassertransporter, definiert die Colton-Blutgruppe;
- Glut1 - Glukose- und L-Dehydroascorbinsäure-Transporter;
- Kidd-Antigen-Protein - Harnstofftransporter;
- RHAG - Gastransporter, wahrscheinlich für Kohlendioxid, definiert die Rh-Blutgruppe und den damit verbundenen ungewöhnlichen Blutgruppenphänotyp Rhnull;
- Na+/K+ - ATPase;
- Ca2+ - ATPase;
- Na+ K+ 2Cl- - Cotransporter;
- Na+-Cl- - Cotransporter;
- Na-H-Austauscher;
- K-Cl-Kotransporter;
- Gardos-Kanal. ⓘ
Zelladhäsion
- ICAM-4 - interagiert mit Integrinen;
- BCAM - ein Glykoprotein, das die lutherische Blutgruppe definiert und auch als Lu oder Laminin-bindendes Protein bekannt ist. ⓘ
Strukturelle Rolle - Die folgenden Membranproteine stellen Verbindungen mit Skelettproteinen her und spielen möglicherweise eine wichtige Rolle bei der Regulierung des Zusammenhalts zwischen der Lipiddoppelschicht und dem Membranskelett, wodurch die Erythrozyten wahrscheinlich ihre günstige Membranoberfläche beibehalten können, indem sie verhindern, dass die Membran kollabiert (vesikuliert).
- Makromolekularer Komplex auf Ankyrin-Basis - Proteine, die die Doppelschicht mit dem Membranskelett durch die Interaktion ihrer zytoplasmatischen Domänen mit Ankyrin verbinden.
- Band 3 - fasst auch verschiedene glykolytische Enzyme, den mutmaßlichen CO2-Transporter und die Kohlensäureanhydrase zu einem makromolekularen Komplex zusammen, der als "Metabolon" bezeichnet wird und eine Schlüsselrolle bei der Regulierung des Erythrozytenstoffwechsels und der Funktion des Ionen- und Gastransports spielen könnte.
- RHAG - ebenfalls am Transport beteiligt, definiert den damit verbundenen ungewöhnlichen Blutgruppenphänotyp Rhmod.
- Auf Protein 4.1R basierender makromolekularer Komplex - Proteine, die mit Protein 4.1R interagieren.
- Protein 4.1R - schwache Expression der Gerbich-Antigene;
- Glykophorin C und D - Glykoprotein, definiert die Gerbich-Blutgruppe;
- XK - definiert die Kell-Blutgruppe und den ungewöhnlichen Mcleod-Phänotyp (Fehlen des Kx-Antigens und stark reduzierte Expression der Kell-Antigene);
- RhD/RhCE - definiert die Rh-Blutgruppe und den damit verbundenen ungewöhnlichen Blutgruppenphänotyp Rhnull;
- Duffy-Protein - wird mit der Chemokin-Clearance in Verbindung gebracht;
- Adducin - Wechselwirkung mit Band 3;
- Dematin - Wechselwirkung mit dem Glukosetransporter Glut1. ⓘ
Auf der Zelloberfläche befinden sich verschiedene Glykoproteine (z. B. die Blutgruppen-Antigene), die u. a. die serologisch nachweisbaren genetischen Merkmale der Erythrozyten definieren. ⓘ
Die Scheibenform verdanken Erythrozyten ihrem Membranskelett. Dieses besteht aus einem flächigen Netz aus Spektrin-Filamenten, die durch kurze Aktin-Filamente zusammen gehalten werden. Durch Vermittlung von Adapterproteinen, wie Ankyrin, ist das Netz an integralen Proteinen der Plasmamembran verankert. Zu den integralen Proteinen der Plasmamembran zählen der Anionen-Austauscher 1 und das Glykophorin. ⓘ
Die bikonkave Form ermöglicht es den Erythrozyten, Sauerstoff schneller aufzunehmen, da die Diffusionsstrecke von der Zellmembran in das Innere der Zelle verkürzt ist und das Verhältnis von Oberfläche zu Volumen möglichst groß ist (siehe Abbildung a und b). Sehr wichtig für die Funktion der Erythrozyten ist ihre starke Verformbarkeit, die es ihnen erlaubt, auch kleinste Kapillaren zu durchqueren. Durch den engen Kontakt zwischen Erythrozyten und dem Endothel der Gefäße ist der Gasaustausch in den Kapillaren besonders effektiv. ⓘ
Elektrostatisches Oberflächenpotenzial
Das Zetapotenzial ist eine elektrochemische Eigenschaft von Zelloberflächen, die durch die elektrische Nettoladung von Molekülen bestimmt wird, die an der Oberfläche von Zellmembranen der Zelle exponiert sind. Das normale Zetapotenzial der roten Blutkörperchen beträgt -15,7 Millivolt (mV). Ein Großteil dieses Potenzials scheint auf die freiliegenden Sialinsäurereste in der Membran zurückzuführen zu sein: Ihre Entfernung führt zu einem Zetapotenzial von -6,06 mV. ⓘ
Funktion
Rolle beim CO2-Transport
Es sei daran erinnert, dass bei der Atmung, wie hier schematisch mit einer Kohlenhydrateinheit dargestellt, etwa so viele Moleküle Kohlendioxid (CO2) entstehen, wie Sauerstoff (O2) verbraucht wird. ⓘ
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{HCOH + O2 -> CO2 + H2O <span title="Aus: Englische Wikipedia, Abschnitt "Role in CO2 transport"" class="plainlinks">[https://en.wikipedia.org/wiki/Red_blood_cell#Role_in_CO2_transport <span style="color:#dddddd">ⓘ</span>]</span>}}
Die Funktion des Kreislaufsystems besteht also ebenso sehr im Transport von Kohlendioxid wie im Transport von Sauerstoff. Wie an anderer Stelle in diesem Artikel erwähnt, liegt der größte Teil des Kohlendioxids im Blut in Form von Bikarbonat-Ionen vor. Das Bicarbonat ist ein wichtiger pH-Puffer. Im Gegensatz zum Hämoglobin für den O2-Transport gibt es also einen physiologischen Vorteil, wenn es kein spezifisches CO2-Transportmolekül gibt. ⓘ
Dennoch spielen die roten Blutkörperchen aus zwei Gründen eine Schlüsselrolle im CO2-Transportprozess. Erstens, weil sie neben Hämoglobin eine große Anzahl von Kopien des Enzyms Kohlensäureanhydrase auf der Innenseite ihrer Zellmembran enthalten. Die Karbonatanhydrase wirkt, wie ihr Name schon sagt, als Katalysator für den Austausch zwischen Kohlensäure und Kohlendioxid (dem Anhydrid der Kohlensäure). Da sie ein Katalysator ist, kann sie viele CO2-Moleküle beeinflussen, so dass sie ihre wichtige Aufgabe erfüllen kann, ohne so viele Kopien zu benötigen, wie für den O2-Transport durch Hämoglobin erforderlich sind. In Gegenwart dieses Katalysators erreichen Kohlendioxid und Kohlensäure sehr schnell ein Gleichgewicht, während sich die Erythrozyten noch durch die Kapillare bewegen. So sorgen die Erythrozyten dafür, dass der größte Teil des CO2 als Bikarbonat transportiert wird. Bei einem physiologischen pH-Wert begünstigt das Gleichgewicht stark die Kohlensäure, die größtenteils in Bicarbonat-Ionen dissoziiert wird. ⓘ
- Fehler beim Parsen (Syntaxfehler): {\displaystyle \ce{CO2 + H2O <=>> H2CO3 <=>> HCO3- + H+ <span title="Aus: Englische Wikipedia, Abschnitt "Role in CO2 transport"" class="plainlinks">[https://en.wikipedia.org/wiki/Red_blood_cell#Role_in_CO2_transport <span style="color:#dddddd">ⓘ</span>]</span> }}
Die H+-Ionen, die durch diese schnelle Reaktion in den Erythrozyten freigesetzt werden, während sie sich noch in der Kapillare befinden, verringern die Sauerstoffbindungsaffinität des Hämoglobins (Bohr-Effekt). ⓘ
Der zweite wichtige Beitrag der Erythrozyten zum Kohlendioxidtransport besteht darin, dass Kohlendioxid direkt mit den Globinproteinkomponenten des Hämoglobins reagiert und dabei Carbamino-Hämoglobinverbindungen bildet. Wenn Sauerstoff in den Geweben freigesetzt wird, bindet sich mehr CO2 an Hämoglobin, und wenn sich der Sauerstoff in der Lunge bindet, verdrängt er das an Hämoglobin gebundene CO2, dies wird als Haldane-Effekt bezeichnet. Obwohl nur ein kleiner Teil des CO2 im Blut an Hämoglobin im venösen Blut gebunden ist, ist ein größerer Teil der Veränderung des CO2-Gehalts zwischen venösem und arteriellem Blut auf die Veränderung dieses gebundenen CO2 zurückzuführen. Das heißt, dass sowohl im venösen als auch im arteriellen Blut immer reichlich Bikarbonat vorhanden ist, da es die bereits erwähnte Funktion als pH-Puffer erfüllt. ⓘ
Zusammenfassend lässt sich sagen, dass das durch die Zellatmung erzeugte Kohlendioxid sehr schnell in Bereiche mit niedrigerer Konzentration diffundiert, insbesondere in nahe gelegene Kapillaren. Wenn es in die Erythrozyten diffundiert, wird das CO2 durch die Kohlensäureanhydrase, die sich auf der Innenseite der Erythrozytenmembran befindet, rasch in Bikarbonationen umgewandelt. Die Bicarbonat-Ionen wiederum verlassen die Erythrozyten im Austausch gegen Chlorid-Ionen aus dem Plasma, was durch das in der Erythrozytenmembran befindliche Anionen-Transportprotein Band 3 erleichtert wird. Das Bicarbonat-Ion diffundiert nicht aus der Kapillare zurück, sondern wird in die Lunge transportiert. In der Lunge bewirkt der niedrigere Partialdruck des Kohlendioxids in den Alveolen, dass das Kohlendioxid schnell aus der Kapillare in die Alveolen diffundiert. Die Kohlensäureanhydrase in den Erythrozyten hält das Bicarbonat-Ion im Gleichgewicht mit dem Kohlendioxid. Wenn also das Kohlendioxid die Kapillare verlässt und das CO2 durch O2 auf dem Hämoglobin verdrängt wird, wandelt sich genügend Bikarbonat-Ion schnell in Kohlendioxid um, um das Gleichgewicht aufrechtzuerhalten. ⓘ
Sekundäre Funktionen
Wenn die roten Blutkörperchen in verengten Gefäßen einer Scherbelastung ausgesetzt sind, setzen sie ATP frei, wodurch sich die Gefäßwände entspannen und ausdehnen, um einen normalen Blutfluss zu fördern. ⓘ
Wenn ihre Hämoglobinmoleküle desoxygeniert werden, setzen die roten Blutkörperchen S-Nitrosothiole frei, die ebenfalls zur Erweiterung der Blutgefäße beitragen und so mehr Blut in die sauerstoffarmen Körperbereiche leiten. ⓘ
Auch rote Blutkörperchen können Stickoxid enzymatisch synthetisieren, wobei sie L-Arginin als Substrat verwenden, ebenso wie Endothelzellen. Wenn rote Blutkörperchen physiologischen Scherbelastungen ausgesetzt werden, wird die Stickoxid-Synthase aktiviert und Stickoxid exportiert, was zur Regulierung des Gefäßtonus beitragen kann. ⓘ
Rote Blutkörperchen können auch Schwefelwasserstoff produzieren, ein Signalgas, das zur Entspannung der Gefäßwände beiträgt. Man nimmt an, dass die kardioprotektive Wirkung des Knoblauchs darauf zurückzuführen ist, dass die roten Blutkörperchen seine Schwefelverbindungen in Schwefelwasserstoff umwandeln. ⓘ
Die roten Blutkörperchen spielen auch eine Rolle bei der Immunantwort des Körpers: Wenn sie von Krankheitserregern wie Bakterien lysiert werden, setzt ihr Hämoglobin freie Radikale frei, die die Zellwand und die Membran des Erregers zerstören und ihn so abtöten. ⓘ
Zelluläre Prozesse
Da die roten Blutkörperchen keine Mitochondrien enthalten, verbrauchen sie keinen der von ihnen transportierten Sauerstoffmengen; stattdessen produzieren sie den Energieträger ATP durch die Glykolyse von Glukose und die Milchsäuregärung des dabei entstehenden Pyruvats. Außerdem spielt der Pentosephosphatweg in den roten Blutkörperchen eine wichtige Rolle; weitere Informationen finden Sie unter Glucose-6-Phosphat-Dehydrogenase-Mangel. ⓘ
Da rote Blutkörperchen keinen Zellkern enthalten, geht man derzeit davon aus, dass in diesen Zellen keine Proteinbiosynthese stattfindet. ⓘ
Aufgrund des Fehlens von Zellkernen und Organellen enthalten reife rote Blutkörperchen keine DNA und können keine RNA synthetisieren, sie können sich folglich nicht teilen und haben nur begrenzte Reparaturmöglichkeiten. Die Unfähigkeit zur Proteinsynthese bedeutet, dass sich kein Virus entwickeln kann, das auf rote Blutkörperchen von Säugetieren abzielt. Eine Infektion mit Parvoviren (wie z. B. dem humanen Parvovirus B19) kann jedoch erythroide Vorstufen befallen, solange diese noch über DNA verfügen, was an der Anwesenheit von riesigen Pronormoblasten mit Viruspartikeln und Einschlusskörpern zu erkennen ist, wodurch das Blut vorübergehend an Retikulozyten verarmt und Anämie verursacht wird. ⓘ
Die Erythrozyten von Säugetieren stoßen im Verlauf ihrer Reifung vom Erythroblasten ihren Zellkern und ihre Organellen aus, im Gegensatz zu anderen Wirbeltier-Klassen. Da diese Erythrozyten keinen Zellkern besitzen, fehlt auch die DNA. Jedoch findet sich in der Zelle mRNA in kleinen Mengen. Durch den Abbau der Organellen wird zusätzlicher Platz für Hämoglobin geschaffen. Diese Erythrozyten besitzen auch keine Mitochondrien, Energie wird über die Glykolyse mit anschließender Milchsäuregärung bereitgestellt. Die Glucoseaufnahme der Erythrozyten wird dabei nicht über Insulin reguliert, da der entsprechende Rezeptor fehlt. Stattdessen erfolgt die Aufnahme von Glucose über andere Glucosetransporter (hier: GLUT-1). ⓘ

Lebenszyklus
Menschliche rote Blutkörperchen werden durch einen als Erythropoese bezeichneten Prozess gebildet, bei dem sie sich innerhalb von etwa 7 Tagen von festen Stammzellen zu reifen roten Blutkörperchen entwickeln. Wenn sie ausgereift sind, leben diese Zellen bei einem gesunden Menschen etwa 100 bis 120 Tage lang im Blutkreislauf (und 80 bis 90 Tage bei einem voll ausgebildeten Säugling). Am Ende ihrer Lebenszeit werden sie aus dem Kreislauf entfernt. Bei vielen chronischen Krankheiten ist die Lebensdauer der roten Blutkörperchen verkürzt. ⓘ
Entstehung
Die Erythropoese ist der Prozess, durch den neue rote Blutkörperchen gebildet werden; er dauert etwa 7 Tage. Durch diesen Prozess werden im roten Knochenmark der großen Knochen kontinuierlich rote Blutkörperchen gebildet. (Beim Embryo ist die Leber der Hauptort der Produktion roter Blutkörperchen.) Die Produktion kann durch das Hormon Erythropoietin (EPO) angeregt werden, das von der Niere synthetisiert wird. Kurz vor und nach dem Verlassen des Knochenmarks werden die sich entwickelnden Zellen als Retikulozyten bezeichnet; sie machen etwa 1 % der zirkulierenden roten Blutkörperchen aus. ⓘ
Funktionelle Lebensdauer
Die funktionelle Lebensdauer eines roten Blutkörperchens beträgt etwa 100-120 Tage. Während dieser Zeit werden die roten Blutkörperchen ständig durch den Blutfluss bewegt, sei es durch Druck (in den Arterien) oder durch Zug (in den Venen) oder durch eine Kombination von beidem, wenn sie sich durch Mikrogefäße wie Kapillaren quetschen. Sie werden auch im Knochenmark recycelt. ⓘ
Seneszenz
Die alternden roten Blutkörperchen machen Veränderungen an ihrer Plasmamembran durch, die sie anfällig für die selektive Erkennung durch Makrophagen und die anschließende Phagozytose im mononukleären Phagozytensystem (Milz, Leber und Lymphknoten) machen. Dieser Prozess wird als Eryptose, als programmierter Tod der roten Blutkörperchen, bezeichnet. Dieser Prozess läuft normalerweise mit der gleichen Produktionsrate wie die Erythropoese ab, wodurch sich die Gesamtzahl der zirkulierenden roten Blutkörperchen ausgleicht. Die Eryptose ist bei einer Vielzahl von Krankheiten erhöht, darunter Sepsis, hämolytisch-urämisches Syndrom, Malaria, Sichelzellenanämie, Beta-Thalassämie, Glukose-6-Phosphat-Dehydrogenase-Mangel, Phosphatverarmung, Eisenmangel und Morbus Wilson. Eryptose kann durch osmotischen Schock, oxidativen Stress und Energiemangel sowie durch eine Vielzahl von endogenen Mediatoren und Xenobiotika ausgelöst werden. Übermäßige Eryptose wird in roten Blutkörperchen beobachtet, denen die cGMP-abhängige Proteinkinase Typ I oder die AMP-aktivierte Proteinkinase AMPK fehlt. Zu den Inhibitoren der Eryptose gehören Erythropoietin, Stickstoffmonoxid, Katecholamine und hohe Konzentrationen von Harnstoff. ⓘ
Ein Großteil der dabei entstehenden Abbauprodukte wird im Körper rezirkuliert. Die Häm-Bestandteile des Hämoglobins werden zu Eisen (Fe3+) und Biliverdin abgebaut. Das Biliverdin wird zu Bilirubin reduziert, das in das Plasma freigesetzt und an Albumin gebunden in die Leber zurückgeführt wird. Das Eisen wird durch ein Trägerprotein namens Transferrin in das Plasma freigesetzt und in den Kreislauf zurückgeführt. Fast alle roten Blutkörperchen werden auf diese Weise aus dem Kreislauf entfernt, bevor sie alt genug sind, um zu hämolysieren. Das hämolysierte Hämoglobin wird im Plasma an ein Protein namens Haptoglobin gebunden, das nicht über die Niere ausgeschieden wird. ⓘ
Klinische Bedeutung
Krankheit

Zu den Blutkrankheiten, die die roten Blutkörperchen betreffen, gehören:
- Anämien (oder Blutarmut) sind Krankheiten, die durch eine geringe Sauerstofftransportkapazität des Blutes gekennzeichnet sind, weil die Zahl der roten Blutkörperchen zu niedrig ist oder eine Anomalie der roten Blutkörperchen oder des Hämoglobins vorliegt. ⓘ
- Eisenmangelanämie ist die häufigste Anämie; sie tritt auf, wenn die Nahrungsaufnahme oder die Aufnahme von Eisen unzureichend ist und das eisenhaltige Hämoglobin nicht gebildet werden kann. ⓘ
- Die perniziöse Anämie ist eine Autoimmunerkrankung, bei der dem Körper der intrinsische Faktor fehlt, der für die Aufnahme von Vitamin B12 aus der Nahrung erforderlich ist. Vitamin B12 wird für die Produktion und Reifung der roten Blutkörperchen benötigt. ⓘ
- Die Sichelzellenanämie ist eine genetische Erkrankung, die zu abnormen Hämoglobinmolekülen führt. Wenn diese ihre Sauerstoffladung im Gewebe abgeben, werden sie unlöslich, was zu fehlgeformten roten Blutkörperchen führt. Diese sichelförmigen roten Blutkörperchen sind weniger verformbar und viskoelastisch, d. h. sie sind starr geworden und können Blutgefäßverschlüsse, Schmerzen, Schlaganfälle und andere Gewebeschäden verursachen. ⓘ
- Thalassämie ist eine genetisch bedingte Krankheit, bei der ein abnormales Verhältnis von Hämoglobin-Untereinheiten gebildet wird. ⓘ
- Hereditäre Sphärozytose-Syndrome sind eine Gruppe von Erbkrankheiten, die durch Defekte in der Zellmembran der roten Blutkörperchen gekennzeichnet sind und dazu führen, dass die Zellen klein, kugelförmig und zerbrechlich sind, anstatt donutförmig und flexibel. Diese abnormen roten Blutkörperchen werden von der Milz zerstört. Es sind mehrere andere erbliche Störungen der Membran der roten Blutkörperchen bekannt. ⓘ
- Die aplastische Anämie wird durch die Unfähigkeit des Knochenmarks verursacht, Blutzellen zu produzieren. ⓘ
- Die reine Erythrozytenaplasie wird durch die Unfähigkeit des Knochenmarks verursacht, ausschließlich rote Blutkörperchen zu produzieren. ⓘ


- Hämolyse ist der allgemeine Begriff für den übermäßigen Abbau von roten Blutkörperchen. Sie kann verschiedene Ursachen haben und zu einer hämolytischen Anämie führen. ⓘ
- Der Malariaparasit verbringt einen Teil seines Lebenszyklus in den roten Blutkörperchen, ernährt sich von deren Hämoglobin und bricht sie dann auf, was Fieber verursacht. Sowohl die Sichelzellkrankheit als auch die Thalassämie sind in Malariagebieten häufiger anzutreffen, da diese Mutationen einen gewissen Schutz gegen den Parasiten bieten.
- Polyzythämien (oder Erythrozytosen) sind Krankheiten, die durch einen Überschuss an roten Blutkörperchen gekennzeichnet sind. Die erhöhte Viskosität des Blutes kann eine Reihe von Symptomen verursachen. ⓘ
- Bei der Polyzythämie vera ist die erhöhte Anzahl der roten Blutkörperchen auf eine Anomalie im Knochenmark zurückzuführen.
- Mehrere mikroangiopathische Erkrankungen, darunter die disseminierte intravasale Koagulation und thrombotische Mikroangiopathien, weisen pathognomonische (diagnostische) Fragmente roter Blutkörperchen auf, die Schistozyten genannt werden. Bei diesen Pathologien entstehen Fibrinstränge, die die roten Blutkörperchen abtrennen, wenn sie versuchen, an einem Thrombus vorbeizukommen. ⓘ
- Bei einer Anämie oder Blutarmut ist in der Regel die Anzahl der Erythrozyten vermindert. Es gibt viele Ursachen für eine Anämie, wobei Eisenmangel der häufigste Grund in der westlichen Welt sein dürfte. Durch Eisenmangel wird die Häm-Synthese gehemmt. Als Folge sind die Erythrozyten hypochrom (vor allem im Zentrum schwächer rot gefärbt) und mikrozytär (kleiner als normal). Bei einer Gruppe von Stoffwechselkrankheiten, den Porphyrien, fallen Enzyme der Hämgruppen-Synthese teilweise aus und drosseln dadurch die Hämoglobinmenge in den Erythrozyten. Vorhandenes Eisen kann nicht vollständig in die Häm-Vorläufersubstanzen (Porphyrine) eingebaut werden, die im Gewebe akkumulieren und verschiedene Symptome verursachen (Lichtempfindlichkeit der Haut, starke Bauchschmerzen u. a.).
- Bei der Polyglobulie – z. B. der Polycythaemia vera, der Polycythaemia rubra hypertonica und der Polyglobulie des Neugeborenen – treten Erythrozyten vermehrt auf. Durch die erhöhte Anzahl der Thrombozyten bzw. Erythrozyten, wie im Falle der Polycythämie wird das Blut dickflüssiger. Es besteht die Gefahr einer Thrombose und in der Folge einer Embolie.
- Bei einer Hämolyse (verstärkter Abbau von Erythrozyten) tritt eine Gelbsucht auf, verursacht durch das Hämoglobin-Abbauprodukt Bilirubin. Außerdem können sich durch die Überladung mit Bilirubin Gallensteine in Form von Pigmentsteinen (Bilirubinsteinen) bilden.
- Mutationen in den Globinketten sind mit verschiedenen Hämoglobinopathien verbunden, wie der Sichelzellkrankheit und der Thalassämie. Bei der Sichelzellkrankheit handelt es sich um eine hauptsächlich in von Malaria betroffenen Gebieten vorkommende Krankheit. Bei ihr verformen sich die Erythrozyten im Deoxy-, das heißt sauerstoffarmen Zustand sichelförmig. In dieser Form können sie die kleinen Kapillaren nur mit Schwierigkeiten passieren und es kommt vermehrt zur Zerstörung der Erythrozyten, der sogenannten Hämolyse. Homozygote Träger dieser Erbanlagen haben eine deutlich verkürzte Lebenserwartung, die heterozygoten Träger sind jedoch in begrenztem Maße vor einer Malaria-Erkrankung geschützt, da der Erreger (Plasmodium falciparum) sich in derart deformierten Erythrozyten nicht vermehren kann.
- Die Kugelzellenanämie ist ein genetischer Defekt, bei dem kugelförmige Erythrozyten, sogenannte Sphärozyten, durch ein gestörtes Zytoskelett auftreten.
- Beim Favismus führt der genetisch bedingte Mangel an einem Enzym (Glucose-6-phosphat-Dehydrogenase) nach Einnahme bestimmter Medikamente (Acetylsalicylsäure) oder Nahrungsmittel (Saubohnen) zum Platzen der Erythrozyten. ⓘ
Transfusion
Rote Blutkörperchen können im Rahmen einer Bluttransfusion verabreicht werden. Das Blut kann von einer anderen Person gespendet oder vom Empfänger zu einem früheren Zeitpunkt gelagert werden. Blutspenden erfordern in der Regel ein Screening, um sicherzustellen, dass die Spender keine Risikofaktoren für durch Blut übertragbare Krankheiten aufweisen oder sich durch die Blutspende nicht selbst schädigen. Das Blut wird in der Regel entnommen und auf häufige oder schwere durch Blut übertragbare Krankheiten wie Hepatitis B, Hepatitis C und HIV getestet. Die Blutgruppe (A, B, AB oder O) oder das Blutprodukt wird identifiziert und mit dem Blut des Empfängers abgeglichen, um die Wahrscheinlichkeit einer akuten hämolytischen Transfusionsreaktion, einer Art Transfusionsreaktion, zu minimieren. Dies hängt mit dem Vorhandensein von Antigenen auf der Oberfläche der Zellen zusammen. Nach diesem Vorgang wird das Blut gelagert und innerhalb kurzer Zeit verwendet. Blut kann als ganzes Produkt verabreicht werden oder die roten Blutkörperchen werden als gepackte rote Blutkörperchen separiert. ⓘ
Blut wird häufig transfundiert, wenn eine Anämie oder eine aktive Blutung bekannt ist oder wenn ein schwerer Blutverlust zu erwarten ist, z. B. vor einer Operation. Vor der Blutspende wird eine kleine Blutprobe des Empfängers mit der Transfusion in einem so genannten Cross-Matching-Verfahren getestet. ⓘ
Im Jahr 2008 wurde berichtet, dass es gelungen war, menschliche embryonale Stammzellen im Labor zu roten Blutkörperchen zu formen. Der schwierige Schritt bestand darin, die Zellen dazu zu bringen, ihren Zellkern auszustoßen; dies wurde erreicht, indem die Zellen auf Stromazellen aus dem Knochenmark gezüchtet wurden. Es besteht die Hoffnung, dass diese künstlichen roten Blutkörperchen schließlich für Bluttransfusionen verwendet werden können. ⓘ
Tests

Mehrere Bluttests befassen sich mit roten Blutkörperchen. Dazu gehören die Erythrozytenzahl (die Anzahl der roten Blutkörperchen pro Blutvolumen), die Berechnung des Hämatokrits (prozentualer Anteil der roten Blutkörperchen am Blutvolumen) und die Erythrozytensenkungsgeschwindigkeit. Die Blutgruppe muss bestimmt werden, um eine Bluttransfusion oder eine Organtransplantation vorzubereiten. ⓘ
Viele Krankheiten, an denen rote Blutkörperchen beteiligt sind, werden mit einem Blutfilm (oder peripheren Blutausstrich) diagnostiziert, bei dem eine dünne Schicht Blut auf einen Objektträger gestrichen wird. Dabei können Poikilozytosen, d. h. Abweichungen in der Form der roten Blutkörperchen, festgestellt werden. Wenn rote Blutkörperchen manchmal als Stapel auftreten, liegt eine flache Seite neben einer flachen Seite. Dies wird als Rouleaux-Bildung bezeichnet und tritt häufiger auf, wenn der Spiegel bestimmter Serumproteine erhöht ist, wie z. B. bei Entzündungen. ⓘ
Auftrennung und Blutdoping
Erythrozyten können aus Vollblut durch Zentrifugation gewonnen werden. Dabei werden die Zellen vom Blutplasma getrennt, was als Blutfraktionierung bezeichnet wird. Abgepackte rote Blutkörperchen, die auf diese Weise aus Vollblut hergestellt werden, von dem das Plasma entfernt wurde, werden in der Transfusionsmedizin verwendet. Bei der Plasmaspende werden die roten Blutkörperchen sofort wieder in den Körper zurückgepumpt, und nur das Plasma wird gesammelt. ⓘ
Einige Sportler haben versucht, ihre Leistung durch Blutdoping zu verbessern: Zunächst wird ihnen etwa 1 Liter Blut abgenommen, dann werden die roten Blutkörperchen isoliert, eingefroren und gelagert, um sie kurz vor dem Wettkampf wieder zu injizieren. (Rote Blutkörperchen können 5 Wochen lang bei -79 °C oder -110 °F oder über 10 Jahre lang mit Kryoprotektoren konserviert werden). Diese Praxis ist schwer nachzuweisen, kann aber das menschliche Herz-Kreislauf-System gefährden, das für Blut mit der daraus resultierenden höheren Viskosität nicht ausgelegt ist. Eine weitere Methode des Blutdopings ist die Injektion von Erythropoietin, um die Produktion roter Blutkörperchen anzuregen. Beide Praktiken sind von der Welt-Anti-Doping-Agentur verboten worden. ⓘ
Geschichte
Der erste, der rote Blutkörperchen beschrieb, war der junge niederländische Biologe Jan Swammerdam, der 1658 ein frühes Mikroskop benutzte, um das Blut eines Frosches zu untersuchen. In Unkenntnis dieser Arbeit lieferte Anton van Leeuwenhoek 1674 eine weitere mikroskopische Beschreibung, diesmal mit einer präziseren Beschreibung der roten Blutkörperchen, die sogar ihre Größe annähernd angab: "25.000 Mal kleiner als ein feines Sandkorn". ⓘ
In den 1740er Jahren konnte Vincenzo Menghini in Bologna das Vorhandensein von Eisen nachweisen, indem er Magnete über das Pulver oder die Asche erhitzter roter Blutkörperchen führte. ⓘ
Im Jahr 1901 veröffentlichte Karl Landsteiner seine Entdeckung der drei Hauptblutgruppen A, B und C (die er später in O umbenannte). Landsteiner beschrieb die regelmäßigen Muster, nach denen Reaktionen auftraten, wenn Serum mit roten Blutkörperchen gemischt wurde, und identifizierte so kompatible und widersprüchliche Kombinationen zwischen diesen Blutgruppen. Ein Jahr später identifizierten Alfred von Decastello und Adriano Sturli, zwei Kollegen von Landsteiner, eine vierte Blutgruppe - AB. ⓘ
1959 gelang es Dr. Max Perutz, mit Hilfe der Röntgenkristallographie die Struktur des Hämoglobins zu entschlüsseln, des Proteins der roten Blutkörperchen, das für den Sauerstofftransport zuständig ist. ⓘ
Die ältesten jemals entdeckten intakten roten Blutkörperchen wurden bei Ötzi dem Mann aus dem Eis gefunden, einer natürlichen Mumie eines Mannes, der um 3255 v. Chr. starb. Diese Zellen wurden im Mai 2012 entdeckt. ⓘ
Aufbau und Merkmale

Sonderformen

Die Sichelzellenanämie ist gekennzeichnet durch sichelförmige Erythrozyten. Die Form geht zurück auf ein erblich abnormes Hämoglobin (Sichelzell-Hämoglobin, HbS), das bei Sauerstoffmangel zur Auskristallisation neigt und daher weniger Platz einnimmt, wodurch das Volumen der ganzen Zelle schrumpft. Heterozygot Betroffene sind jedoch vor den schweren Verlaufsformen der Malaria geschützt, da diese Zellen weniger durch Plasmodien angreifbar sind. ⓘ
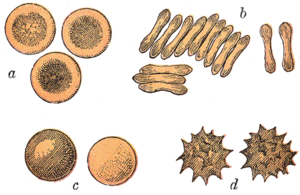
Unter speziellen Bedingungen können Erythrozyten Kugel-, Stechapfel- oder Becherform annehmen, meistens jedoch haben sie eine plattenähnliche Form. Sphärozyten sind kugelig-deformierte Erythrozyten, Echinozyten oder Stechapfelzellen (in der Zeichnung mit d markiert) weisen zudem zahlreiche (10–30) stumpfe Fortsätze auf und becherförmige Erythrozyten (c) werden als Stomatozyten bezeichnet. Diese Formen können durch Austrocknung oder andere Einflüsse entstehen. Sind Echinozyten jedoch trotz mehrfacher sorgfältiger Verarbeitung nachweisbar, kann dies in einer Pyruvatkinaseinsuffizienz, einer Niereninsuffizienz, einem Vitamin-E-Mangel (Hypovitaminose) oder einer Vergiftung begründet sein. ⓘ
Ein Fragmentozyt oder Schistozyt ist ein geschädigter oder im Abbau befindlicher Erythrozyt bzw. ein Fragment eines Erythrozyten. ⓘ
Bei sehr niedriger Fließgeschwindigkeit des Blutes können einzelne Erythrozyten aneinander haften und Ketten bilden, man spricht dann von einer Geldrollenbildung (in der Zeichnung mit b markiert) oder Agglomeration. Letztere kann zu Thrombosen führen. Treten solche in Herzkranzgefäßen auf, kann infolge des daraus resultierenden Sauerstoffmangels ein Herzinfarkt entstehen; im Gehirn ein Schlaganfall. Mittel dagegen sind Acetylsalicylsäure (ASS), Clopidogrel und Phenprocoumon (Marcumar). ⓘ
Inhaltsstoffe
Erythrozyten bestehen zu 90 % der Trockenmasse aus dem Sauerstoff bindenden Protein Hämoglobin. Dies entspricht ca. 35 % der Masse eines Erythrozyten bzw. 120–160 g/l des Vollblutes bei Frauen und 140–180 g/l bei Männern. Der Häm-Anteil dieses Proteins verleiht den Erythrozyten und somit auch dem Blut die rote Farbe. ⓘ
Visualisierung

Aufgrund deren Größe benötigt man für die Betrachtung von Erythrozyten ein Mikroskop. Wegen der einfachen Anwendbarkeit wird standardmäßig optische Mikroskopie verwendet, geeignet ist dabei insbesondere die Dunkelfeldmikroskopie (Streulicht-Mikroskopie mit dunklem Hintergrund), bei der es nicht auf die (wenig kontrastreiche) (Auflicht-)Farbe, sondern auf die unterschiedliche Lichtstreuung der Blutkörperchen-Umrisse ankommt, mit der sich die Formen gut erkennen lassen.
Auch mittels photoakustischer Mikroskopie erhält man Bilder mit hohem Kontrast.
Eine bessere örtliche Auflösung als mittels optischer Verfahren erhält man mit dem Rasterelektronenmikroskop. Allerdings benötigt man dafür eine spezielle Probenvorbereitung, beispielsweise das Beschichten der Erythrozyten mit einer leitfähigen Substanz. ⓘ
Siehe auch
- Leukozyt (Weißes Blutkörperchen)
- Glykohämoglobin
- Fragmentozyt
- Erythrozytenverteilungsbreite ⓘ
Ältere Literatur
- Ludwig Heilmeyer, Herbert Begemann: Blut und Blutkrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 376–449, hier: S. 379–382 (Die Erythrocyten). ⓘ