Silbernitrat
 Strukturformel
| |

| |
 Kristallstruktur
| |
| Bezeichnungen | |
|---|---|
| IUPAC-Bezeichnung
Silbernitrat
| |
| Systematische IUPAC-Bezeichnung
Silber(I)-nitrat | |
| Andere Bezeichnungen
Salpetersäure-Silber(1+)-Salz
Lapis infernalis Argentinisches Nitrat | |
| Bezeichner | |
3D-Modell (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| EC-Nummer |
|
PubChem CID
|
|
| RTECS-Nummer |
|
| UNII | |
| UN-Nummer | 1493 |
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
AgNO3 |
| Molekulare Masse | 169,872 g-mol-1 |
| Erscheinungsbild | farbloser Feststoff |
| Geruch | Geruchlos |
| Dichte | 4,35 g/cm3 (24 °C) 3,97 g/cm3 (210 °C) |
| Schmelzpunkt | 209,7 °C (409,5 °F; 482,8 K) |
| Siedepunkt | 440 °C (824 °F; 713 K) zersetzt sich |
Löslichkeit in Wasser
|
122 g/100 mL (0 °C) 170 g/100 mL (10 °C) 256 g/100 mL (25 °C) 373 g/100 mL (40 °C) 912 g/100 mL (100 °C) |
| Löslichkeit | Löslich in Aceton, Ammoniak, Ether, Glycerin |
| Löslichkeit in Essigsäure | 0,776 g/kg (30 °C) 1,244 g/kg (40 °C) 5,503 g/kg (93 °C) |
| Löslichkeit in Aceton | 0,35 g/100 g (14 °C) 0,44 g/100 g (18 °C) |
| Löslichkeit in Benzol | 0,22 g/kg (35 °C) 0,44 g/kg (40,5 °C) |
| Löslichkeit in Ethanol | 3,1 g/100 g (19 °C) |
| Löslichkeit in Ethylacetat | 2,7 g/100 g (20 °C) |
| log P | 0.19 |
Magnetische Suszeptibilität (χ)
|
-45,7-10-6 cm3/mol |
Brechungsindex (nD)
|
1.744 |
| Viskosität | 3,77 cP (244 °C) 3,04 cP (275 °C) |
| Struktur | |
Kristallstruktur
|
Orthorhombisch, oP56 |
Raumgruppe
|
P212121, Nr. 19 |
Punktgruppe
|
222 |
Gitterkonstante
|
a = 6,992(2) Å, b = 7,335(2) Å, c = 10,125(2) Å α = 90°, β = 90°, γ = 90°
|
| Thermochemie | |
Wärmekapazität (C)
|
93,1 J/mol-K |
Std. molare
Entropie (S |
140.9 J/mol-K |
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-124,4 kJ/mol |
Gibbssche freie Energie (ΔfG˚)
|
-33,4 kJ/mol |
| Pharmakologie | |
ATC-Code
|
D08AL01 (WHO) |
| Gefahren | |
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |
Hauptgefahren
|
Reagiert explosionsartig mit Ethanol. Giftig. Ätzend. |
| GHS-Kennzeichnung: | |
Piktogramme
|
   
|
Signalwort
|
Gefahr |
Gefahrenhinweise
|
H272, H314, H410 |
Sicherheitshinweise
|
P220, P273, P280, P305+P351+P338, P310, P501 |
| NFPA 704 (Feuerdiamant) | |
| Tödliche Dosis oder Konzentration (LD, LC): | |
LDLo (niedrigste veröffentlichte)
|
800 mg/kg (Kaninchen, oral) 20 mg/kg (Hund, oral) |
Wenn nicht anders angegeben, gelten die Daten für Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |

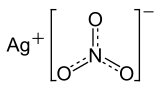
Silbernitrat ist eine anorganische Verbindung mit der chemischen Formel AgNO
3. Dieses Salz ist ein vielseitiger Ausgangsstoff für viele andere Silberverbindungen, die beispielsweise in der Fotografie verwendet werden. Es ist weit weniger lichtempfindlich als die Halogenide. Es wurde früher als Mondlauge bezeichnet, weil Silber von den alten Alchemisten, die Silber mit dem Mond in Verbindung brachten, Luna genannt wurde. In festem Silbernitrat sind die Silberionen dreifach koordiniert in einer trigonal-planaren Anordnung. ⓘ
Silbernitrat (trivial: Höllenstein, lateinisch Lapis infernalis ‚höllischer Stein‘) ist ein Salz der Salpetersäure. Es ist zusammengesetzt aus dem Kation Ag+ und dem Nitratanion NO3−. ⓘ
Synthese und Struktur
Albertus Magnus dokumentierte im 13. Jahrhundert die Fähigkeit der Salpetersäure, Gold und Silber zu trennen, indem sie das Silber auflöst. In der Tat kann Silbernitrat durch Auflösen von Silber in Salpetersäure und anschließendes Verdampfen der Lösung hergestellt werden. Die Stöchiometrie der Reaktion hängt von der Konzentration der verwendeten Salpetersäure ab.
- 3 Ag + 4 HNO3 (kalt und verdünnt) → 3 AgNO3 + 2 H2O + NO
- Ag + 2 HNO3 (heiß und konzentriert) → AgNO3 + H2O + NO2 ⓘ
Die Struktur von Silbernitrat wurde mehrfach durch Röntgenkristallographie untersucht. In der üblichen orthorhombischen Form, die bei normaler Temperatur und normalem Druck stabil ist, bilden die Silberatome Paare mit Ag---Ag-Kontakten von 3,227 Å. Jedes Ag+-Zentrum ist an sechs Sauerstoffzentren von ein- und zweizähnigen Nitratliganden gebunden. Die Ag-O-Abstände reichen von 2,384 bis 2,702 Å. ⓘ
oder durch die Reaktion von Salpetersäure mit Silberoxid ohne Bildung nitroser Gase:
Reaktionen
Eine typische Reaktion mit Silbernitrat besteht darin, ein Kupferstäbchen in einer Silbernitratlösung zu suspendieren und einige Stunden lang stehen zu lassen. Das Silbernitrat reagiert mit dem Kupfer und bildet haarähnliche Kristalle aus Silbermetall und eine blaue Lösung aus Kupfernitrat:
- 2 AgNO3 + Cu → Cu(NO3)2 + 2 Ag ⓘ
Silbernitrat zersetzt sich beim Erhitzen:
- 2 AgNO3(l) → 2 Ag(s) + O2(g) + 2 NO2(g) ⓘ
Die Zersetzung ist unterhalb des Schmelzpunkts vernachlässigbar, wird aber bei etwa 250 °C spürbar und ist bei 440 °C vollständig zersetzt. ⓘ
Die meisten Metallnitrate zersetzen sich thermisch in die entsprechenden Oxide, aber Silberoxid zersetzt sich bei einer niedrigeren Temperatur als Silbernitrat, so dass bei der Zersetzung von Silbernitrat stattdessen elementares Silber entsteht. ⓘ
Verwendungen
Ausgangsstoff für andere Silberverbindungen
Silbernitrat ist das preiswerteste Silbersalz und bietet darüber hinaus noch einige andere Vorteile. Es ist nicht hygroskopisch, im Gegensatz zu Silberfluoroborat und Silberperchlorat. Es ist relativ stabil gegenüber Licht. Außerdem löst es sich in zahlreichen Lösungsmitteln, einschließlich Wasser. Das Nitrat kann leicht durch andere Liganden ersetzt werden, was AgNO3 vielseitig einsetzbar macht. Bei der Behandlung mit Lösungen von Halogenidionen fällt AgX (X = Cl, Br, I) als Niederschlag aus. Bei der Herstellung von Fotofilmen wird Silbernitrat mit Natrium- oder Kaliumhalogenidsalzen behandelt, um in fotografischer Gelatine in situ unlösliches Silberhalogenid zu bilden, das dann auf Triacetat- oder Polyesterstreifen aufgebracht wird. In ähnlicher Weise wird Silbernitrat zur Herstellung einiger Sprengstoffe auf Silberbasis, wie Fulminat, Azid oder Acetylid, durch eine Fällungsreaktion verwendet. ⓘ
Die Behandlung von Silbernitrat mit einer Base ergibt dunkelgraues Silberoxid:
- 2 AgNO3 + 2 NaOH → Ag2O + 2 NaNO3 + H2O ⓘ
Abstraktion von Halogeniden
Das Silberkation, Ag+
reagiert schnell mit Halogenidquellen unter Bildung des unlöslichen Silberhalogenids, das als cremefarbener Niederschlag vorliegt, wenn Br-
verwendet wird, ein weißer Niederschlag, wenn Cl-
verwendet wird und ein gelber Niederschlag, wenn I-
verwendet wird. Diese Reaktion wird in der anorganischen Chemie häufig zur Abstraktion von Halogeniden verwendet:
- Ag+
(aq) + X-
(aq) → AgX(s) ⓘ
wobei X-
= Cl-
, Br-
, oder I-
. ⓘ
Andere Silbersalze mit nichtkoordinierenden Anionen, nämlich Silbertetrafluorborat und Silberhexafluorphosphat, werden für anspruchsvollere Anwendungen verwendet. ⓘ
In ähnlicher Weise wird diese Reaktion in der analytischen Chemie eingesetzt, um das Vorhandensein von Chlorid-, Bromid- oder Iodid-Ionen zu bestätigen. Die Proben werden in der Regel mit verdünnter Salpetersäure angesäuert, um störende Ionen, z. B. Karbonat- und Sulfid-Ionen, zu entfernen. Dieser Schritt vermeidet die Verwechslung von Silbersulfid- oder Silbercarbonatniederschlägen mit Silberhalogeniden. Die Farbe des Niederschlags ist je nach Halogenid unterschiedlich: weiß (Silberchlorid), blassgelb/cremefarben (Silberbromid), gelb (Silberiodid). AgBr und vor allem AgI zerfallen durch Licht in das Metall, was sich in einer gräulichen Farbe auf belichteten Proben zeigt. ⓘ
Die gleiche Reaktion wurde auf Dampfschiffen eingesetzt, um festzustellen, ob das Kesselspeisewasser mit Meerwasser verunreinigt war. Sie wird auch heute noch verwendet, um festzustellen, ob Feuchtigkeit auf ehemals trockener Ladung durch Kondensation von feuchter Luft oder durch Seewasser, das durch den Schiffsrumpf sickert, entstanden ist. ⓘ
Organische Synthese
Silbernitrat wird in der organischen Synthese vielfältig eingesetzt, z. B. für Entschützungen und Oxidationen. Ag+
bindet Alkene reversibel, und Silbernitrat wurde zur Trennung von Alkengemischen durch selektive Absorption verwendet. Das entstandene Addukt kann mit Ammoniak zersetzt werden, um das freie Alken freizusetzen. Silbernitrat ist gut wasserlöslich, aber schwer löslich in den meisten organischen Lösungsmitteln, mit Ausnahme von Acetonitril (111,8 g/100 g, 25 °C). ⓘ
Biologie
In der Histologie wird Silbernitrat zur Silberfärbung, zum Nachweis von retikulären Fasern, Proteinen und Nukleinsäuren verwendet. Aus diesem Grund wird es auch zum Nachweis von Proteinen in PAGE-Gelen verwendet. Es kann als Färbemittel in der Rasterelektronenmikroskopie verwendet werden. ⓘ
Unauslöschliche Tinte
Silbernitrat erzeugt eine lang anhaltende Färbung, wenn es auf die Haut aufgetragen wird. Eine Wahlfärbung macht sich dies zunutze, um den Finger von Personen zu markieren, die an einer Wahl teilgenommen haben, und ermöglicht so eine einfache Identifizierung, um Doppelabstimmungen zu verhindern. ⓘ
Medizin

Silbersalze haben antiseptische Eigenschaften. 1881 führte Credé die Verwendung verdünnter Lösungen von AgNO3 in den Augen von Neugeborenen bei der Geburt ein, um eine Ansteckung mit Gonorrhöe von der Mutter zu verhindern, die zur Erblindung führen könnte. (Heute werden stattdessen moderne Antibiotika verwendet). ⓘ
Geschmolzenes Silbernitrat, zu Stäbchen geformt, wurde traditionell als "Mondlauge" bezeichnet. Es wird als Kauterisierungsmittel verwendet, um beispielsweise Granulationsgewebe um ein Stoma zu entfernen. General Sir James Abbott vermerkte in seinen Aufzeichnungen, dass es 1827 in Indien von einem britischen Chirurgen in Wunden an seinem Arm, die durch den Biss eines tollwütigen Hundes entstanden waren, infundiert wurde, um die Wunden zu kauterisieren und den Ausbruch der Tollwut zu verhindern. ⓘ
Silbernitrat wird zur Verödung oberflächlicher Blutgefäße in der Nase verwendet, um Nasenbluten zu verhindern. ⓘ
Zahnärzte verwenden manchmal mit Silbernitrat getränkte Tupfer, um Mundgeschwüre zu heilen. Einige Fußpfleger verwenden Silbernitrat, um Zellen im Nagelbett abzutöten. ⓘ
Der kanadische Arzt C. A. Douglas Ringrose erforschte die Verwendung von Silbernitrat für Sterilisationsverfahren, da er glaubte, dass Silbernitrat die Eileiter blockieren und verätzen könnte. Die Technik war jedoch unwirksam. ⓘ
Desinfektion
Die Fähigkeit des Silberions zur Inaktivierung von Escherichia coli, einem Mikroorganismus, der häufig als Indikator für fäkale Verunreinigungen und als Ersatz für Krankheitserreger bei der Trinkwasseraufbereitung verwendet wird, wurde eingehend untersucht. Die in Inaktivierungsexperimenten untersuchten Konzentrationen von Silbernitrat reichen von 10-200 Mikrogramm pro Liter als Ag+. Die antimikrobielle Wirkung von Silber wurde vor der Entdeckung der modernen Antibiotika vielfach genutzt und geriet dann fast in Vergessenheit. Die Assoziation mit Schimmelpilzen machte die Verbraucher misstrauisch und führte dazu, dass sie sich von Silber abwandten, wenn sie eine Alternative hatten. ⓘ
Gegen Warzen

Die wiederholte tägliche Anwendung von Silbernitrat kann zu einer ausreichenden Zerstörung von Hautwarzen führen, gelegentlich können jedoch pigmentierte Narben entstehen. In einer placebokontrollierten Studie mit 70 Patienten führte die neuntägige Verabreichung von Silbernitrat einen Monat nach der Behandlung bei 43 % zu einer Beseitigung aller Warzen und bei 26 % zu einer Verbesserung der Warzen im Vergleich zu 11 % bzw. 14 % in der Placebogruppe. ⓘ
Sicherheit
Da Silbernitrat ein Oxidationsmittel ist, sollte es in angemessener Entfernung von organischen Verbindungen gelagert werden. Trotz seiner häufigen Verwendung in extrem niedrigen Konzentrationen zur Vorbeugung von Gonorrhö und zur Kontrolle von Nasenbluten ist Silbernitrat sehr giftig und ätzend. Bei kurzzeitiger Exposition treten außer den violetten, braunen oder schwarzen Flecken auf der Haut keine unmittelbaren Nebenwirkungen auf, doch bei ständiger Exposition gegenüber hohen Konzentrationen machen sich Nebenwirkungen bemerkbar, zu denen auch Verbrennungen gehören. Langfristige Exposition kann zu Augenschäden führen. Silbernitrat ist als haut- und augenreizend bekannt. Silbernitrat wurde nicht gründlich auf eine mögliche krebserregende Wirkung untersucht. ⓘ
Silbernitrat ist in Wasserquellen derzeit nicht durch die US-Umweltschutzbehörde reguliert. Wenn sich jedoch mehr als 1 Gramm Silber im Körper ansammelt, kann sich ein Zustand namens Argyria entwickeln. Argyria ist ein dauerhafter kosmetischer Zustand, bei dem die Haut und die inneren Organe eine blaugraue Farbe annehmen. Die US-Umweltschutzbehörde (United States Environmental Protection Agency) hatte bis 1990 einen Höchstwert für Silber im Wasser festgelegt, als festgestellt wurde, dass Argyria trotz der Verfärbung keine Auswirkungen auf die Funktion der betroffenen Organe hat. Argyria wird häufiger mit dem Verzehr von kolloidalen Silberlösungen in Verbindung gebracht als mit Silbernitrat, da dieses nur in extrem niedrigen Konzentrationen zur Desinfektion des Wassers verwendet wird. Dennoch ist es wichtig, vor der Einnahme von Silberionenlösungen jeglicher Art Vorsicht walten zu lassen. ⓘ
Sicherheitshinweise
Silbernitrat wirkt auf Haut und Schleimhäute stark reizend und ist in der Lage, lebendes Gewebe zu zerstören (Verätzung). Als Umweltgift bedarf es besonderer Entsorgung. ⓘ



