Acetaldehyd
|
| |||
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugter IUPAC-Name
Acetaldehyd | |||
| Systematische IUPAC-Bezeichnung
Ethanal | |||
| Andere Bezeichnungen
Essigsäurealdehyd
Ethylaldehyd Acetylaldehyd | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
IUPHAR/BPS
|
|||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C2H4O | ||
| Molare Masse | 44,053 g-mol-1 | ||
| Erscheinungsbild | Farbloses Gas oder Flüssigkeit | ||
| Geruch | Ätherisch | ||
| Dichte | 0,784 g-cm-3 (20 °C)
0,7904-0,7928 g-cm-3 (10 °C) | ||
| Schmelzpunkt | -123,37 °C (-190,07 °F; 149,78 K) | ||
| Siedepunkt | 20,2 °C (68,4 °F; 293,3 K) | ||
Löslichkeit in Wasser
|
mischbar | ||
| Löslichkeit | mischbar mit Ethanol, Ether, Benzol, Toluol, Xylol, Terpentin, Aceton schwer löslich in Chloroform | ||
| log P | -0.34 | ||
| Dampfdruck | 740 mmHg (20 °C) | ||
| Acidität (pKa) | 13,57 (25 °C, H2O) | ||
Magnetische Suszeptibilität (χ)
|
-.5153-6 cm3/g | ||
Brechungsindex (nD)
|
1.3316 | ||
| Viskosität | 0,21 mPa-s bei 20 °C (0,253 mPa-s bei 9,5 °C) | ||
| Struktur | |||
Molekulare Form
|
trigonal planar (sp2) bei C1 tetraedrisch (sp3) bei C2 | ||
Dipolmoment
|
2.7 D | ||
| Thermochemie | |||
Wärmekapazität (C)
|
89 J-mol-1-K-1 | ||
Std. molare
Entropie (S |
160,2 J-mol-1-K-1 | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-192,2 kJ-mol-1 | ||
Gibbssche freie Energie (ΔfG˚)
|
-127,6 kJ-mol-1 | ||
| Gefahren | |||
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |||
Hauptgefahren
|
potenziell krebserregend am Arbeitsplatz | ||
| GHS-Kennzeichnung: | |||
Piktogramme
|
  
| ||
Gefahrensätze
|
H224, H319, H335, H351 | ||
Sicherheitshinweise
|
P210, P261, P281, P305+P351+P338 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | -39,00 °C; -38,20 °F; 234,15 K | ||
Selbstentzündung
temperatur |
175,00 °C; 347,00 °F; 448,15 K | ||
| Explosionsgrenzen | 4.0–60% | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LD50 (Mittlere Dosis)
|
1930 mg/kg (Ratte, oral) | ||
LC50 (mittlere Konzentration)
|
13.000 ppm (Ratte), 17.000 ppm (Hamster), 20.000 ppm (Ratte) | ||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
200 ppm (360 mg/m3) | ||
IDLH (Unmittelbare Gefahr)
|
2000 ppm | ||
| Sicherheitsdatenblatt (SDS) | HMDB | ||
| Verwandte Verbindungen | |||
Verwandte Aldehyde
|
Formaldehyd Propionaldehyd | ||
Verwandte Verbindungen
|
Ethylenoxid | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Acetaldehyd (IUPAC systematischer Name Ethanal) ist eine organische chemische Verbindung mit der Formel CH3CHO, von Chemikern manchmal als MeCHO (Me = Methyl) abgekürzt. Es ist eine farblose Flüssigkeit oder ein Gas, das in der Nähe der Raumtemperatur siedet. Es ist einer der wichtigsten Aldehyde, der in der Natur häufig vorkommt und in großem Umfang industriell hergestellt wird. Acetaldehyd kommt in der Natur in Kaffee, Brot und reifem Obst vor und wird von Pflanzen produziert. Es entsteht auch bei der teilweisen Oxidation von Ethanol durch das Leberenzym Alkoholdehydrogenase und ist mitverantwortlich für den Kater nach Alkoholkonsum. Die Exposition erfolgt über die Luft, das Wasser, den Boden oder das Grundwasser, aber auch über Getränke und Rauch. Die Einnahme von Disulfiram hemmt die Acetaldehyd-Dehydrogenase, das Enzym, das für den Stoffwechsel von Acetaldehyd verantwortlich ist, und führt so zu dessen Anreicherung im Körper. ⓘ
Die Internationale Agentur für Krebsforschung (IARC) hat Acetaldehyd als Karzinogen der Gruppe 1 eingestuft. Acetaldehyd ist "einer der am häufigsten vorkommenden Luftschadstoffe mit einem Krebsrisiko von mehr als eins zu einer Million". ⓘ
Acetaldehyd [aˈt͡seːt|aldehyːt], auch Ethanal genannt, ist ein Aldehyd und besitzt die Halbstrukturformel CH3-CHO. ⓘ
Biochemisch gesehen ist Acetaldehyd ebenfalls ein häufiges Zwischenprodukt. So wandeln Hefezellen das in der Glykolyse entstandene Pyruvat in zwei Schritten zu Ethanol um, indem das Pyruvat zuerst mit Hilfe der Pyruvat-Decarboxylase, einem Enzym der Klasse der Lyasen, in Acetaldehyd umgewandelt und anschließend mit Hilfe der Alkoholdehydrogenase, einem Enzym der Klasse der Oxidoreduktasen, in Ethanol umgewandelt wird. ⓘ
Geschichte
Acetaldehyd wurde wahrscheinlich erstmals im Jahre 1781 von Carl Wilhelm Scheele beim Versuch der Oxidation von Ethanol mit Braunstein in Gegenwart von Schwefelsäure synthetisiert. Die Charakterisierung gelang jedoch erst Justus Liebig in Zusammenarbeit mit Johann Wolfgang Döbereiner im Jahre 1835. Er benannte die Verbindung Aldehyd (von lat. alcoholus dehydrogenatus). Acetaldehyd kann somit als der historisch erste Vertreter der Stoffklasse der Aldehyde angesehen werden, während Formaldehyd (Methanal) der einfachste Vertreter der Klasse ist. ⓘ
Produktion
Historisch wurde Acetaldehyd durch Oxidation von Ethanol mit einer Reihe von Oxidationsmitteln, beispielsweise Braunstein/Schwefelsäure (Scheele) oder Chromsäure (Liebig), nach folgender Gleichung erhalten:
Zur großtechnischen Synthese wird im Rahmen des Wacker-Hoechst-Verfahrens Acetaldehyd durch katalytische Wasseraddition an Ethen bei gleichzeitiger Luftoxidation über Festbettkatalysatoren hergestellt. Formal ergibt sich folgende Gleichung:
Eine Laborsynthese geht von Tetrahydrofuran als synthetisches Äquivalent aus. Dieses muss mit n-Butyllithium gespalten werden, wobei neben Ethen zunächst das Lithiumethenolat gebildet wird. Letzteres tautomerisiert durch Hydrolyse zum Acetaldehyd, welches somit bei Bedarf sogar in situ erzeugt werden kann. Der Mechanismus der Zersetzung des Tetrahydrofurans mit n-Butyllithium wurde 2002 ramanspektroskopisch und mittels Dichtefunktionaltheorie untersucht. In den 1970er Jahren stieg die weltweite Produktionskapazität für Acetaldehyd auf über 2 Millionen Tonnen pro Jahr an. Auf Grund der Entwicklung neuer Synthesewege, welche nicht Acetaldehyd als Edukt benötigen, sinkt derzeit jedoch der Bedarf. ⓘ
Im Jahr 2003 betrug die weltweite Produktion etwa 1 Million Tonnen. Vor 1962 waren Ethanol und Acetylen die Hauptquellen für Acetaldehyd. Seitdem ist Ethylen der vorherrschende Ausgangsstoff. ⓘ
Kleinere Mengen können durch die partielle Oxidation von Ethanol in einer exothermen Reaktion hergestellt werden. Dieser Prozess wird in der Regel über einem Silberkatalysator bei etwa 500-650 °C durchgeführt.
- CH3CH2OH + 1⁄2 O2 → CH3CHO + H2O
Diese Methode ist einer der ältesten Wege zur industriellen Herstellung von Acetaldehyd. ⓘ
Andere Methoden
Hydratisierung von Acetylen
Vor dem Wacker-Verfahren und der Verfügbarkeit von billigem Ethylen wurde Acetaldehyd durch die Hydratisierung von Acetylen hergestellt. Diese Reaktion wird durch Quecksilber(II)-Salze katalysiert:
- C2H2 + Hg2+ + H2O → CH3CHO + Hg
Der Mechanismus beruht auf der Zwischenstufe des Vinylalkohols, der zu Acetaldehyd tautomerisiert. Die Reaktion wird bei 90-95 °C durchgeführt, und der gebildete Acetaldehyd wird von Wasser und Quecksilber getrennt und auf 25-30 °C abgekühlt. Bei der Nassoxidation wird Eisen(III)-sulfat verwendet, um das Quecksilber wieder zum Quecksilber(II)-Salz zu reoxidieren. Das entstandene Eisen(II)-sulfat wird in einem separaten Reaktor mit Salpetersäure oxidiert. ⓘ
Dehydrierung von Ethanol
Traditionell wurde Acetaldehyd durch die partielle Dehydrierung von Ethanol hergestellt:
- CH3CH2OH → CH3CHO + H2
Bei diesem endothermen Verfahren wird Ethanoldampf bei 260-290 °C über einen Katalysator auf Kupferbasis geleitet. Das Verfahren war früher wegen des Wertes des Wasserstoff-Coprodukts attraktiv, ist aber heute nicht mehr wirtschaftlich. ⓘ
Hydroformylierung von Methanol
Bei der Hydroformylierung von Methanol mit Katalysatoren wie Kobalt-, Nickel- oder Eisensalzen entsteht ebenfalls Acetaldehyd, allerdings ist dieses Verfahren nicht von industrieller Bedeutung. Acetaldehyd entsteht mit bescheidener Selektivität aus Synthesegas und ist ebenfalls nicht konkurrenzfähig. ⓘ
Reaktionen
Tautomerisierung von Acetaldehyd zu Vinylalkohol

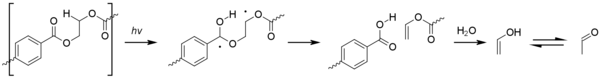
Wie viele andere Carbonylverbindungen tautomerisiert Acetaldehyd zu einem Enol (Vinylalkohol; IUPAC-Name: Ethenol):
- CH3CH=O ⇌ CH2=CHOH ∆H298,g = +42,7 kJ/mol ⓘ
Die Gleichgewichtskonstante beträgt bei Raumtemperatur 6×10-7, was bedeutet, dass die relative Menge der Enolform in einer Acetaldehydprobe sehr gering ist. Bei Raumtemperatur ist Acetaldehyd (CH3CH=O) um 42,7 kJ/mol stabiler als Vinylalkohol (CH2=CHOH): Insgesamt verläuft die Keto-Enol-Tautomerisierung langsam, wird aber durch Säuren katalysiert. ⓘ
Die photoinduzierte Keto-Enol-Tautomerisierung ist unter atmosphärischen oder stratosphärischen Bedingungen durchführbar. Diese Phototautomerisierung ist für die Erdatmosphäre von Bedeutung, da man davon ausgeht, dass Vinylalkohol ein Vorläufer von Carbonsäuren in der Atmosphäre ist. ⓘ
Kondensationsreaktionen
Acetaldehyd ist ein häufiges Elektrophil in der organischen Synthese. In Kondensationsreaktionen ist Acetaldehyd prochiral. Es wird hauptsächlich als Quelle für das "CH3C+H(OH)"-Synthon in Aldol- und verwandten Kondensationsreaktionen verwendet. Grignard-Reagenzien und lithiumorganische Verbindungen reagieren mit MeCHO zu Hydroxyethylderivaten. In einer der spektakulärsten Kondensationsreaktionen werden drei Äquivalente Formaldehyd mit MeCHO zu Pentaerythrit, C(CH2OH)4, umgesetzt. ⓘ
In einer Strecker-Reaktion kondensiert Acetaldehyd mit Cyanid und Ammoniak und ergibt nach Hydrolyse die Aminosäure Alanin. Acetaldehyd kann mit Aminen zu Iminen kondensieren, z. B. mit Cyclohexylamin zu N-Ethylidenecyclohexylamin. Diese Imine können zur Steuerung von Folgereaktionen wie einer Aldolkondensation verwendet werden. ⓘ
Es ist auch ein Baustein in der Synthese von heterocyclischen Verbindungen. In einem Beispiel verwandelt es sich bei der Behandlung mit Ammoniak in 5-Ethyl-2-methylpyridin ("Aldehyd-Collidin"). ⓘ
Eigenschaften
Acetaldehyd ist eine farblose, sehr leicht flüchtige und leicht entzündliche Flüssigkeit, die mit Wasser in jedem Verhältnis mischbar ist; dabei bildet sich in einer Gleichgewichtsreaktion das Aldehydhydrat. Anders als bei Formaldehyd liegt das Gleichgewicht jedoch nur zu etwas über 50 % auf der Seite des Hydrats. ⓘ
Acetaldehyd muss kühl gelagert werden, da es schon bei 20 °C siedet und explosive Dampf-Luft-Gemische bildet. Diese Dämpfe können sich aufgrund des extrem niedrigen Zündpunkts von 140 °C an heißen Heizflächen entzünden. Der Flammpunkt von Acetaldehyd liegt bei −39 °C und seine UN-Nummer ist 1089. ⓘ
Acetaldehyd oligomerisiert leicht säurekatalysiert zu Aldoladditionsprodukten.
- Das „Dimer“ (CH3CHO)2 ist das sogenannte Aldol, welches unter Wasserabspaltung zum Crotonaldehyd weiterreagieren kann.
- Das Trimer (CH3CHO)3 hat eine cyclische Acetalstruktur (2,4,6-Trimethyl-1,3,5-trioxan). Es handelt sich um eine Flüssigkeit (Sdp. 124 °C) mit dem Trivialnamen Paraldehyd.
- Das Tetramer (CH3CHO)4 hat ebenfalls cyclische Acetalstruktur (2,4,6,8-Tetramethyl-1,3,5,7-tetroxocan). Es handelt sich um einen Feststoff (sublimiert bei 112 °C), auch Metaldehyd genannt. Es wird als Trockenbrennstoff und wegen seiner Giftigkeit auch als Schneckengift (Schneckenkorn) verwendet.
- Zumeist enthält Trockenbrennstoff auch höhere Oligomere des Acetaldehyds, wie z. B. Pentamere (CH3CHO)5 und Hexamere (CH3CHO)6. ⓘ
Die Oligomere mit Acetalstruktur können leicht wieder durch Säuren gespalten werden. ⓘ
Drei Acetaldehydmoleküle kondensieren zu "Paraldehyd", einem cyclischen Trimer mit C-O-Einfachbindungen. In ähnlicher Weise führt die Kondensation von vier Acetaldehydmolekülen zu dem zyklischen Molekül Metaldehyd. Paraldehyd kann mit Hilfe eines Schwefelsäurekatalysators in guter Ausbeute hergestellt werden. Metaldehyd wird nur in wenigen Prozent Ausbeute und unter Kühlung gewonnen, wobei häufig HBr statt H2SO4 als Katalysator verwendet wird. Bei -40 °C wird in Gegenwart von sauren Katalysatoren Polyacetaldehyd hergestellt. Es gibt zwei Stereomere des Paraldehyds und vier des Metaldehyds. ⓘ
Der deutsche Chemiker Valentin Hermann Weidenbusch (1821-1893) synthetisierte Paraldehyd 1848 durch Behandlung von Acetaldehyd mit Säure (entweder Schwefel- oder Salpetersäure) und Abkühlung auf 0 °C. Er stellte fest, dass beim Erhitzen von Paraldehyd mit einer Spur derselben Säure die Reaktion in die andere Richtung verlief und Acetaldehyd entstand. ⓘ
Acetalderivate
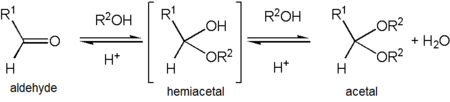
Acetaldehyd bildet bei der Reaktion mit Ethanol unter Bedingungen, die eine Dehydratisierung begünstigen, ein stabiles Acetal. Das Produkt, CH3CH(OCH2CH3)2, trägt die offizielle Bezeichnung 1,1-Diethoxyethan, wird aber im Allgemeinen als "Acetal" bezeichnet. Dies kann zu Verwechslungen führen, da "Acetal" eher zur Beschreibung von Verbindungen mit den funktionellen Gruppen RCH(OR')2 oder RR'C(OR)2 verwendet wird, als dass es sich auf diese spezifische Verbindung bezieht - tatsächlich wird 1,1-Diethoxyethan auch als Diethylacetal von Acetaldehyd bezeichnet. ⓘ
Vorläufer der Vinylphosphonsäure
Acetaldehyd ist eine Vorstufe der Vinylphosphonsäure, die zur Herstellung von Klebstoffen und ionenleitenden Membranen verwendet wird. Die Synthesefolge beginnt mit einer Reaktion mit Phosphortrichlorid:
- PCl3 + CH3CHO → CH3CH(O-)PCl3+
- CH3CH(O-)PCl3+ + 2 CH3CO2H → CH3CH(Cl)PO(OH)2 + 2 CH3COCl
- CH3CH(Cl)PO(OH)2 → CH2=CHPO(OH)2 + HCl ⓘ
Biochemie
In der Leber oxidiert das Enzym Alkoholdehydrogenase Ethanol zu Acetaldehyd, das dann von der Acetaldehyddehydrogenase zu harmloser Essigsäure weiter oxidiert wird. Diese beiden Oxidationsreaktionen sind mit der Reduktion von NAD+ zu NADH gekoppelt. Im Gehirn ist in erster Linie das Enzym Katalase für die Oxidation von Ethanol zu Acetaldehyd verantwortlich, während die Alkoholdehydrogenase eine untergeordnete Rolle spielt. Die letzten Schritte der alkoholischen Gärung in Bakterien, Pflanzen und Hefe beinhalten die Umwandlung von Pyruvat in Acetaldehyd und Kohlendioxid durch das Enzym Pyruvat-Decarboxylase, gefolgt von der Umwandlung von Acetaldehyd in Ethanol. Die letztgenannte Reaktion wird wiederum durch eine Alkoholdehydrogenase katalysiert, die nun in umgekehrter Richtung arbeitet. ⓘ
Verwendungen
Traditionell wurde Acetaldehyd hauptsächlich als Vorprodukt für Essigsäure verwendet. Diese Verwendung ist zurückgegangen, da Essigsäure nach dem Monsanto- und dem Cativa-Verfahren effizienter aus Methanol hergestellt werden kann. Acetaldehyd ist ein wichtiges Vorprodukt für Pyridinderivate, Pentaerythrit und Crotonaldehyd. Harnstoff und Acetaldehyd verbinden sich zu einem nützlichen Harz. Essigsäureanhydrid reagiert mit Acetaldehyd zu Ethylidendiacetat, einem Vorprodukt von Vinylacetat, das zur Herstellung von Polyvinylacetat verwendet wird. ⓘ
Der Weltmarkt für Acetaldehyd ist rückläufig. Die Nachfrage wurde durch Veränderungen in der Produktion von Weichmacheralkoholen beeinflusst, die sich verschoben hat, da n-Butyraldehyd seltener aus Acetaldehyd, sondern durch Hydroformylierung von Propylen hergestellt wird. Ebenso wird Essigsäure, die früher aus Acetaldehyd hergestellt wurde, heute überwiegend durch das kostengünstigere Methanol-Carbonylierungsverfahren hergestellt. Die Auswirkungen auf die Nachfrage haben zu einem Anstieg der Preise und damit zu einer Verlangsamung des Marktes geführt. ⓘ

Verbrauch von Acetaldehyd (103 t) im Jahr 2003
(* Enthalten in Sonstige - Glyoxal/Glyoxalsäure, Crotonaldehyd, Milchsäure, n-Butanol, 2-Ethylhexanol) ⓘ
| Produkt | USA | Mexiko | W. Europa | Japan | Insgesamt ⓘ |
|---|---|---|---|---|---|
| Essigsäure/Essigsäureanhydrid | - | 11 | 89 | 47 | 147 |
| Acetat-Ester | 35 | 8 | 54 | 224 | 321 |
| Pentaerythritol | 26 | – | 43 | 11 | 80 |
| Pyridin und Pyridinbasen | 73 | – | 10 | * | 83 |
| Peressigsäure | 23 | – | – | * | 23 |
| 1,3-Butylenglykol | 14 | – | – | * | 14 |
| Andere | 5 | 3 | 10 | 80 | 98 |
| Insgesamt | 176 | 22 | 206 | 362 | 766 |
China ist der weltweit größte Verbraucher von Acetaldehyd und verbrauchte 2012 fast die Hälfte des weltweiten Verbrauchs. Die Hauptverwendung ist die Herstellung von Essigsäure. Andere Verwendungszwecke wie Pyridine und Pentaerythritol werden voraussichtlich schneller wachsen als Essigsäure, aber die Mengen sind nicht groß genug, um den Rückgang bei Essigsäure auszugleichen. Infolgedessen könnte der Gesamtverbrauch von Acetaldehyd in China bis 2018 leicht um 1,6 % pro Jahr ansteigen. Westeuropa ist mit einem Anteil von 20 % am Weltverbrauch im Jahr 2012 der zweitgrößte Verbraucher von Acetaldehyd weltweit. Wie in China wird auch für den westeuropäischen Acetaldehydmarkt im Zeitraum 2012-2018 ein nur sehr geringes Wachstum von 1 % pro Jahr erwartet. Japan könnte sich jedoch in den nächsten fünf Jahren als potenzieller Verbraucher von Acetaldehyd erweisen, da dort die kommerzielle Produktion von Butadien neu entdeckt wurde. Das Angebot an Butadien war in Japan und im übrigen Asien unbeständig. Dies dürfte dem flachen Markt ab 2013 den dringend benötigten Auftrieb geben. ⓘ
Sicherheit
Expositionsgrenzwerte
Der Grenzwert liegt bei 25 ppm (STEL/Deckelwert) und der MAK-Wert (Maximale Arbeitsplatzkonzentration) bei 50 ppm. Bei 50 ppm Acetaldehyd werden keine Reizungen oder lokale Gewebeschäden an der Nasenschleimhaut beobachtet. Bei Aufnahme in den Organismus wird Acetaldehyd in der Leber rasch zu Essigsäure verstoffwechselt. Nur ein kleiner Teil wird unverändert ausgeatmet. Nach intravenöser Injektion beträgt die Halbwertszeit im Blut etwa 90 Sekunden. ⓘ
Gefahren
Toxizität
Es sind viele schwere Fälle von akuter Vergiftung bekannt. Acetaldehyd wird im menschlichen Körper natürlich abgebaut. ⓘ
Irritation
Acetaldehyd ist ein Reizstoff für Haut, Augen, Schleimhäute, Rachen und Atemwege. Dies tritt bereits bei Konzentrationen von 1000 ppm auf. Zu den Symptomen einer Exposition gegenüber dieser Verbindung gehören Übelkeit, Erbrechen und Kopfschmerzen. Diese Symptome treten möglicherweise nicht sofort auf. Die Wahrnehmungsschwelle für Acetaldehyd in der Luft liegt im Bereich zwischen 0,07 und 0,25 ppm. Bei solchen Konzentrationen ist der fruchtige Geruch von Acetaldehyd wahrnehmbar. Nach einer 15-minütigen Exposition gegenüber Konzentrationen von 25 und 50 ppm wurden Bindehautreizungen beobachtet, aber auch nach einer 15-minütigen Exposition gegenüber 200 ppm Acetaldehyd wurden vorübergehende Bindehautentzündungen und Reizungen der Atemwege berichtet. ⓘ
Karzinogenität
Acetaldehyd ist für den Menschen krebserregend. Im Jahr 1988 stellte die Internationale Agentur für Krebsforschung fest: "Es gibt ausreichende Beweise für die Karzinogenität von Acetaldehyd (dem Hauptmetaboliten von Ethanol) bei Versuchstieren." Im Oktober 2009 aktualisierte die Internationale Agentur für Krebsforschung die Einstufung von Acetaldehyd und stellte fest, dass Acetaldehyd, das in alkoholischen Getränken enthalten ist und endogen aus ihnen gewonnen wird, ein Humankarzinogen der Gruppe I ist. Darüber hinaus schädigt Acetaldehyd die DNA und verursacht eine abnorme Muskelentwicklung, da es sich an Proteine bindet. ⓘ
DNA-Querverbindungen
Acetaldehyd führt zu DNA-Vernetzungen zwischen den Strängen, einer Form von DNA-Schäden. Diese können durch einen von zwei Replikations-gekoppelten DNA-Reparaturwegen repariert werden. Der erste wird als FA-Weg bezeichnet, weil er Genprodukte verwendet, die bei Patienten mit Fanconi-Anämie defekt sind. Dieser Reparaturweg führt zu einer erhöhten Mutationshäufigkeit und einem veränderten Mutationsspektrum. Der zweite Reparaturweg erfordert die Konvergenz der Replikationsgabeln, das Aufbrechen der Acetaldehyd-Vernetzung, die Translesionssynthese durch eine DNA-Polymerase der Y-Familie und homologe Rekombination. ⓘ
Verschlimmernde Faktoren
Alzheimer-Krankheit
Menschen mit einem genetischen Mangel an dem Enzym, das für die Umwandlung von Acetaldehyd in Essigsäure verantwortlich ist, haben möglicherweise ein höheres Risiko, an Alzheimer zu erkranken. "Diese Ergebnisse deuten darauf hin, dass der ALDH2-Mangel ein Risikofaktor für LOAD [spät einsetzende Alzheimer-Krankheit] ist ..." ⓘ
Genetische Bedingungen
Eine Studie mit 818 starken Trinkern ergab, dass diejenigen, die durch eine genetische Variante des Gens, das für die Alkoholdehydrogenase kodiert, mehr Acetaldehyd als normal ausgesetzt sind, ein höheres Risiko haben, Krebserkrankungen des oberen Magen-Darm-Trakts und der Leber zu entwickeln. ⓘ
Disulfiram
Das Medikament Disulfiram (Antabuse) hemmt die Acetaldehyd-Dehydrogenase, ein Enzym, das die Verbindung zu Essigsäure oxidiert. Bei der Verstoffwechselung von Ethanol wird Acetaldehyd gebildet, bevor Acetaldehyd-Dehydrogenase Essigsäure bildet, aber wenn das Enzym gehemmt wird, sammelt sich Acetaldehyd an. Wenn man Ethanol konsumiert, während man Disulfiram einnimmt, wird die Katerwirkung von Ethanol schneller und intensiver empfunden. Aus diesem Grund wird Disulfiram manchmal als Abschreckung für Alkoholiker eingesetzt, die nüchtern bleiben wollen. ⓘ
Quellen der Exposition
Innenraumluft
Acetaldehyd ist ein potenzieller Schadstoff am Arbeitsplatz, in Innenräumen und in der Umgebungsluft. Außerdem verbringt die Mehrheit der Menschen mehr als 90 % ihrer Zeit in Innenräumen, was die Exposition und das Risiko für die menschliche Gesundheit erhöht. ⓘ
In einer Studie in Frankreich war die durchschnittliche Innenraumkonzentration von Acetaldehyden, die in 16 Wohnungen gemessen wurde, etwa siebenmal höher als die Acetaldehydkonzentration im Freien. Im Wohnzimmer lag der Mittelwert bei 18,1±17,5 μg m-3 und im Schlafzimmer bei 18,2±16,9 μg m-3, während die Außenluft eine mittlere Konzentration von 2,3±2,6 μg m-3 aufwies. ⓘ
Es wurde festgestellt, dass flüchtige organische Verbindungen (VOC) wie Benzol, Formaldehyd, Acetaldehyd, Toluol und Xylole im Hinblick auf ihre gesundheitlichen Auswirkungen als prioritäre Schadstoffe anzusehen sind. Es wurde darauf hingewiesen, dass die VOC-Konzentrationen in renovierten oder völlig neuen Gebäuden oft um mehrere Größenordnungen höher sind. Zu den Hauptquellen von Acetaldehyden in Wohnungen gehören Baumaterialien, Laminat, PVC-Böden, lackierte Holzböden und lackierte Kork-/Kiefernböden (im Lack, nicht im Holz). Acetaldehyd ist auch in Kunststoffen, Farben auf Öl- und Wasserbasis, Verbundholzdecken, Spanplatten, Sperrholz, behandeltem Kiefernholz und Möbeln aus laminierten Spanplatten enthalten. ⓘ
Außenluft
Acetaldehyd ist in verschiedenen Industriezweigen weit verbreitet und kann bei der Produktion, der Verwendung, dem Transport und der Lagerung ins Abwasser oder in die Luft gelangen. Zu den Quellen von Acetaldehyd gehören Emissionen aus der Verbrennung von Brennstoffen in stationären Verbrennungsmotoren und Kraftwerken, die fossile Brennstoffe, Holz oder Müll verbrennen, aus der Öl- und Gasförderung, aus Raffinerien, Zementöfen, Holz- und Papierfabriken. Acetaldehyd ist auch in Auto- und Dieselabgasen enthalten. Daher ist Acetaldehyd "einer der am häufigsten vorkommenden Luftschadstoffe mit einem Krebsrisiko von mehr als eins zu einer Million". ⓘ
Tabakrauch
Natürliche Tabakpolysaccharide, einschließlich Zellulose, sind nachweislich die Hauptvorläufer, die Acetaldehyd zu einem wichtigen Bestandteil des Tabakrauchs machen. In Suchtstudien mit Nagetieren wurde nachgewiesen, dass Acetaldehyd eine synergistische Wirkung mit Nikotin hat. Acetaldehyd ist auch das am häufigsten vorkommende Karzinogen im Tabakrauch; es wird beim Rauchen in den Speichel gelöst. ⓘ
Cannabisrauch
Acetaldehyd wurde im Cannabisrauch nachgewiesen. Dieser Befund ergab sich durch den Einsatz neuer chemischer Verfahren, die zeigten, dass das vorhandene Acetaldehyd in Laborversuchen DNA-Schäden verursacht. ⓘ
Alkoholkonsum
Viele Mikroben produzieren Acetaldehyd aus Ethanol, haben aber eine geringere Kapazität, das Acetaldehyd zu eliminieren, was zu einer Anhäufung von Acetaldehyd im Speichel, in der Magensäure und im Darminhalt führen kann. Fermentierte Lebensmittel und viele alkoholische Getränke können ebenfalls erhebliche Mengen an Acetaldehyd enthalten. Acetaldehyd, das aus der mukosalen oder mikrobiellen Oxidation von Ethanol, Tabakrauch und Nahrung stammt, scheint im oberen Verdauungstrakt des Menschen als kumulatives Karzinogen zu wirken. Laut der "Opinion on Acetaldehyde" (2012) des Wissenschaftlichen Ausschusses für Verbrauchersicherheit (SCCS) der Europäischen Kommission liegt der spezielle Risikogrenzwert für kosmetische Produkte bei 5 mg/l und Acetaldehyd sollte nicht in Mundspülmitteln verwendet werden. ⓘ
Kunststoffe
Acetaldehyd kann durch die Photooxidation von Polyethylenterephthalat (PETE) über eine Norrish-Reaktion vom Typ II erzeugt werden. ⓘ
Obwohl die bei diesem Prozess entstehenden Mengen sehr gering sind, hat Acetaldehyd eine äußerst niedrige Geschmacks-/Geruchsschwelle von etwa 20-40 ppb und kann in abgefülltem Wasser einen Fehlgeschmack verursachen. Der Wert, bei dem ein durchschnittlicher Verbraucher Acetaldehyd feststellen könnte, ist immer noch deutlich niedriger als jede Toxizität. ⓘ
Candida-Überwucherung
Es ist erwiesen, dass Candida albicans bei Patienten mit potenziell karzinogenen Mundkrankheiten Acetaldehyd in ausreichenden Mengen produziert, um Probleme zu verursachen. ⓘ
Nomenklatur
Der systematische IUPAC-Name Ethanal ist abgeleitet von Ethan durch Anhängen des Suffixes -al für Aldehyde. Die gemeinhin bevorzugte Bezeichnung Acetaldehyd geht auf „acetum“ zurück, das lateinische Wort für Essig, denn bei der Oxidation von Acetaldehyd („Essigsäurealdehyd“) entsteht Essigsäure. ⓘ
Wirkungen im menschlichen Körper
Acetaldehyd geht leicht Bindungen mit der menschlichen DNA ein und wirkt deshalb mutagen (erbgutschädigend) und ferner auch kanzerogen (krebserregend). Zunächst kann Acetaldehyd eine reversible Reaktion mit Nukleosiden der DNA eingehen. Die hierbei entstehenden instabilen Addukte können durch Reduktion mit Natriumborhydrid in stabile Addukte umgewandelt werden. Ein Guanosin-Acetaldehyd-Addukt wird nach einer solchen Reduktion in ein Produkt überführt, dem die Struktur von N2-Ethylguanosin zugeschrieben wird. ⓘ
Acetaldehyd hat vielfältig schädliche Wirkungen auf Leber und Herz. Es bildet Proteinaddukte, die die sogenannten Kupffer-Zellen (Makrophagen der Leber) aktivieren. Diese sezernieren verstärkt Stoffe, die andere Zellen der Leber, die Itozellen, so verändern, dass diese daraufhin verstärkt Kollagen bilden. Das begünstigt die Ausbildung einer Leberzirrhose. Außerdem führt Acetaldehyd über die Aktivierung der NADPH-Oxidase (NOX2) zur vermehrten Bildung von Sauerstoffradikalen, welche die Membranen der Zellen schädigen, sodass diese zugrunde gehen. Davon betroffen sind auch die Mitochondrien der Kardiomyozyten, was zunächst die Fähigkeit der Herzmuskelzellen zur Kontraktion beeinträchtigt und diese im weiteren Verlauf zerstört, sodass es zu einer irreparablen Schädigung des Muskels und schließlich zur chronischen Herzinsuffizienz kommt. ⓘ
Verwendung
Acetaldehyd ist ein wichtiger Ausgangsstoff in der chemischen Industrie. Acetaldehyd dient beispielsweise zur Herstellung von Essigsäure, Essigsäureanhydrid, Butadien, Acrolein und Pentaerythrit. ⓘ