Estrogene
| Östrogen ⓘ | |
|---|---|
| Wirkstoffklasse | |
 Estradiol, das wichtigste Östrogen-Sexualhormon des Menschen und ein weit verbreitetes Medikament.
| |
| Identifikatoren der Klasse | |
| Verwendung | Empfängnisverhütung, Menopause, Hypogonadismus, Transgender-Frauen, Prostatakrebs, Brustkrebs, andere |
| ATC-Code | G03C |
| Biologisches Ziel | Östrogenrezeptoren (ERα, ERβ, mERs (z. B. GPER, andere)) |
| Externe Links | |
| MeSH | D004967 |
Östrogen oder Östrogen ist eine Kategorie von Sexualhormonen, die für die Entwicklung und Regulierung des weiblichen Fortpflanzungssystems und der sekundären Geschlechtsmerkmale verantwortlich sind. Es gibt drei wichtige endogene Östrogene mit östrogener Hormonaktivität: Estron (E1), Estradiol (E2) und Estriol (E3). Estradiol, ein Estron, ist das stärkste und am weitesten verbreitete Östrogen. Ein weiteres Östrogen, Estriol (E4), wird nur während der Schwangerschaft gebildet. ⓘ
Östrogene werden in allen Wirbeltieren und einigen Insekten synthetisiert. Ihr Vorhandensein sowohl bei Wirbeltieren als auch bei Insekten deutet darauf hin, dass östrogene Sexualhormone eine uralte evolutionäre Geschichte haben. Quantitativ gesehen zirkulieren Östrogene sowohl bei Männern als auch bei Frauen in niedrigeren Konzentrationen als Androgene. Obwohl die Östrogenspiegel bei Männern deutlich niedriger sind als bei Frauen, spielen Östrogene bei Männern dennoch eine wichtige physiologische Rolle. ⓘ
Wie alle Steroidhormone können Östrogene leicht durch die Zellmembran diffundieren. Sobald sie in der Zelle sind, binden sie an Östrogenrezeptoren (ERs) und aktivieren diese, was wiederum die Expression vieler Gene moduliert. Darüber hinaus binden Östrogene an membranständige Östrogenrezeptoren (mER), wie z. B. GPER (GPR30), und aktivieren diese. ⓘ
Neben ihrer Rolle als natürliche Hormone werden Östrogene auch als Medikamente eingesetzt, z. B. in der Hormontherapie der Wechseljahre, der hormonellen Geburtenkontrolle und der feminisierenden Hormontherapie für Transgender-Frauen und nichtbinäre Menschen. ⓘ
Estrogene oder Östrogene (als „oestrus“-erzeugende Substanzen von altgriechisch οἶστρος oístrŏs, latinisiert oestrus „Stachel“, „Leidenschaft“ und lateinisch gignere „erzeugen“), auch Follikelhormone genannt, sind die wichtigsten weiblichen Sexualhormone aus der Klasse der Steroidhormone. Es sind Verbindungen, die im Tierexperiment beispielsweise bei kastrierten Nagetieren Brunsterscheinungen hervorrufen. ⓘ
Sie werden hauptsächlich in den Eierstöcken (Ovarien) in Follikeln und im Gelbkörper, zu einem geringeren Teil auch in der Nebennierenrinde, produziert. Während der Schwangerschaft werden die Estrogene auch in der Plazenta und vom Fetus gebildet. Auch Männer produzieren im Hoden kleine Mengen an Estrogenen; zudem wird ein gewisser Teil des Testosterons im Fettgewebe durch ein Enzym, die sog. Aromatase, in Estrogene umgewandelt. Die Regulierung der Menge der in den Gonaden produzierten Östrogene erfolgt durch von der Hypophyse gebildete in die Blutbahn ausgeschüttete Steuerungshormone. ⓘ
Estrogene sind Steroide, die als Grundgerüst Estran (13β-Methyl-gonan) besitzen. Die erstmalige Isolierung von Estrogenen und die Bestimmung der Struktur von Estrogenen erfolgte 1929 durch den deutschen Chemiker Adolf Butenandt. ⓘ
Arten und Beispiele
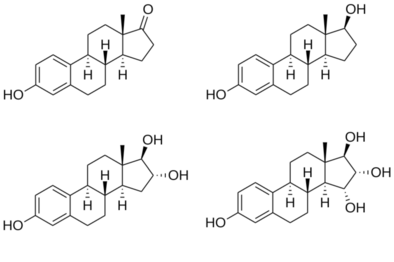
Strukturen der wichtigsten endogenen Östrogene
|
Die vier wichtigsten natürlich vorkommenden Östrogene bei Frauen sind Estron (E1), Estradiol (E2), Estriol (E3) und Estetrol (E4). Estradiol (E2) ist das vorherrschende Östrogen während der reproduktiven Jahre, sowohl was die absoluten Serumspiegel als auch die östrogene Aktivität betrifft. In der Menopause ist Estron das vorherrschende zirkulierende Östrogen, und während der Schwangerschaft ist Östriol das vorherrschende zirkulierende Östrogen, was die Serumspiegel betrifft. Bei subkutaner Injektion in Mäuse ist Estradiol etwa 10-mal stärker als Estron und etwa 100-mal stärker als Estriol. Somit ist Östradiol das wichtigste Östrogen bei nicht schwangeren Frauen, die sich zwischen der Menarche und der Menopause befinden. Während der Schwangerschaft verlagert sich diese Rolle jedoch auf Estriol, und bei Frauen nach der Menopause wird Estron zur wichtigsten Östrogenform im Körper. Ein anderer Östrogentyp, das Östetrol (E4), wird nur während der Schwangerschaft gebildet. Alle verschiedenen Östrogenformen werden durch das Enzym Aromatase aus Androgenen, insbesondere Testosteron und Androstendion, synthetisiert. ⓘ
Zu den kleineren endogenen Östrogenen, an deren Biosynthese Aromatase nicht beteiligt ist, gehören 27-Hydroxycholesterin, Dehydroepiandrosteron (DHEA), 7-Oxo-DHEA, 7α-Hydroxy-DHEA, 16α-Hydroxy-DHEA, 7β-Hydroxyepiandrosteron, Androstendion (A4), Androstendiol (A5), 3α-Androstandiol und 3β-Androstandiol. Einige Östrogen-Metaboliten, wie die Katechol-Östrogene 2-Hydroxyestradiol, 2-Hydroxyestron, 4-Hydroxyestradiol und 4-Hydroxyestron sowie 16α-Hydroxyestron, sind ebenfalls Östrogene mit unterschiedlichem Wirkungsgrad. Die biologische Bedeutung dieser kleineren Östrogene ist nicht ganz klar. ⓘ
Biologische Funktion

Die Wirkung von Östrogen wird durch den Östrogenrezeptor (ER) vermittelt, ein dimeres Kernprotein, das an die DNA bindet und die Genexpression kontrolliert. Wie andere Steroidhormone gelangt Östrogen passiv in die Zelle, wo es sich an den Östrogenrezeptor bindet und diesen aktiviert. Der Östrogen:ER-Komplex bindet an spezifische DNA-Sequenzen, die als Hormonreaktionselement bezeichnet werden, um die Transkription von Zielgenen zu aktivieren (in einer Studie, die eine östrogenabhängige Brustkrebszelllinie als Modell verwendete, wurden 89 solcher Gene identifiziert). Da Östrogen in alle Zellen eindringt, hängt seine Wirkung davon ab, ob der ER in der Zelle vorhanden ist. Der ER wird in bestimmten Geweben wie dem Eierstock, der Gebärmutter und der Brust exprimiert. Die metabolischen Auswirkungen von Östrogen bei postmenopausalen Frauen wurden mit dem genetischen Polymorphismus des ER in Verbindung gebracht. ⓘ
Obwohl Östrogene sowohl bei Männern als auch bei Frauen vorkommen, sind sie bei Frauen im fortpflanzungsfähigen Alter in der Regel in deutlich höheren Mengen vorhanden. Sie fördern die Entwicklung der weiblichen sekundären Geschlechtsmerkmale, wie z. B. der Brüste, und sind auch an der Verdickung der Gebärmutterschleimhaut und anderen Aspekten der Regulierung des Menstruationszyklus beteiligt. Bei Männern reguliert Östrogen bestimmte Funktionen des Fortpflanzungssystems, die für die Reifung der Spermien wichtig sind, und kann für eine gesunde Libido notwendig sein. ⓘ
| Ligand | Andere Bezeichnungen | Relative Bindungsaffinitäten (RBA, %)a | Absolute Bindungsaffinitäten (Ki, nM)a | Wirkung ⓘ | ||
|---|---|---|---|---|---|---|
| ERα | ERβ | ERα | ERβ | |||
| Estradiol | E2; 17β-Estradiol | 100 | 100 | 0.115 (0.04–0.24) | 0.15 (0.10–2.08) | Östrogen |
| Estron | E1; 17-Ketoestradiol | 16.39 (0.7–60) | 6.5 (1.36–52) | 0.445 (0.3–1.01) | 1.75 (0.35–9.24) | Östrogen |
| Estriol | E3; 16α-OH-17β-E2 | 12.65 (4.03–56) | 26 (14.0–44.6) | 0.45 (0.35–1.4) | 0.7 (0.63–0.7) | Östrogen |
| Estetrol | E4; 15α,16α-Di-OH-17β-E2 | 4.0 | 3.0 | 4.9 | 19 | Östrogen |
| Alfatradiol | 17α-Estradiol | 20.5 (7–80.1) | 8.195 (2–42) | 0.2–0.52 | 0.43–1.2 | Stoffwechselprodukt |
| 16-Epiestriol | 16β-Hydroxy-17β-estradiol | 7.795 (4.94–63) | 50 | ? | ? | Stoffwechselprodukt |
| 17-Epiestriol | 16α-Hydroxy-17α-Östradiol | 55.45 (29–103) | 79–80 | ? | ? | Stoffwechselprodukt |
| 16,17-Epiestriol | 16β-Hydroxy-17α-Östradiol | 1.0 | 13 | ? | ? | Stoffwechselprodukt |
| 2-Hydroxy-Estradiol | 2-OH-E2 | 22 (7–81) | 11–35 | 2.5 | 1.3 | Stoffwechselprodukt |
| 2-Methoxyestradiol | 2-MeO-E2 | 0.0027–2.0 | 1.0 | ? | ? | Stoffwechselprodukt |
| 4-Hydroxyestradiol | 4-OH-E2 | 13 (8–70) | 7–56 | 1.0 | 1.9 | Stoffwechselprodukt |
| 4-Methoxyestradiol | 4-MeO-E2 | 2.0 | 1.0 | ? | ? | Stoffwechselprodukt |
| 2-Hydroxyestradiol | 2-OH-E1 | 2.0–4.0 | 0.2–0.4 | ? | ? | Stoffwechselprodukt |
| 2-Methoxyestron | 2-MeO-E1 | <0.001–<1 | <1 | ? | ? | Stoffwechselprodukt |
| 4-Hydroxyestron | 4-OH-E1 | 1.0–2.0 | 1.0 | ? | ? | Stoffwechselprodukt |
| 4-Methoxyestron | 4-MeO-E1 | <1 | <1 | ? | ? | Stoffwechselprodukt |
| 16α-Hydroxyestron | 16α-OH-E1; 17-Ketoestriol | 2.0–6.5 | 35 | ? | ? | Stoffwechselprodukt |
| 2-Hydroxyestriol | 2-OH-E3 | 2.0 | 1.0 | ? | ? | Stoffwechselprodukt |
| 4-Methoxyestriol | 4-MeO-E3 | 1.0 | 1.0 | ? | ? | Stoffwechselprodukt |
| Estradiol-Sulfat | E2S; Estradiol-3-sulfat | <1 | <1 | ? | ? | Stoffwechselprodukt |
| Estradiol-Disulfat | Estradiol-3,17β-Disulfat | 0.0004 | ? | ? | ? | Stoffwechselprodukt |
| Estradiol-3-Glucuronid | E2-3G | 0.0079 | ? | ? | ? | Stoffwechselprodukt |
| Estradiol-17β-Glucuronid | E2-17G | 0.0015 | ? | ? | ? | Stoffwechselprodukt |
| Estradiol-3-gluc. 17β-Sulfat | E2-3G-17S | 0.0001 | ? | ? | ? | Stoffwechselprodukt |
| Estron-Sulfat | E1S; Estron 3-Sulfat | <1 | <1 | >10 | >10 | Stoffwechselprodukt |
| Estradiol-Benzoat | EB; Estradiol-3-benzoat | 10 | ? | ? | ? | Östrogen |
| Estradiol 17β-Benzoat | E2-17B | 11.3 | 32.6 | ? | ? | Östrogen |
| Estron-Methylether | Estron-3-Methylether | 0.145 | ? | ? | ? | Östrogen |
| ent-Estradiol | 1-Estradiol | 1.31–12.34 | 9.44–80.07 | ? | ? | Östrogen |
| Äquilin | 7-Dehydroestron | 13 (4.0–28.9) | 13.0–49 | 0.79 | 0.36 | Östrogen |
| Äquilenin | 6,8-Didehydroestron | 2.0–15 | 7.0–20 | 0.64 | 0.62 | Östrogen |
| 17β-Dihydroequilin | 7-Dehydro-17β-Östradiol | 7.9–113 | 7.9–108 | 0.09 | 0.17 | Östrogen |
| 17α-Dihydroequilin | 7-Dehydro-17α-Östradiol | 18.6 (18–41) | 14–32 | 0.24 | 0.57 | Östrogen |
| 17β-Dihydroequilenin | 6,8-Didehydro-17β-Östradiol | 35–68 | 90–100 | 0.15 | 0.20 | Östrogen |
| 17α-Dihydroequilenin | 6,8-Didehydro-17α-Östradiol | 20 | 49 | 0.50 | 0.37 | Östrogen |
| Δ8-Estradiol | 8,9-Dehydro-17β-Estradiol | 68 | 72 | 0.15 | 0.25 | Östrogen |
| Δ8-Estron | 8,9-Dehydro-Estron | 19 | 32 | 0.52 | 0.57 | Östrogen |
| Ethinylestradiol | EE; 17α-Ethynyl-17β-E2 | 120.9 (68.8–480) | 44.4 (2.0–144) | 0.02–0.05 | 0.29–0.81 | Östrogen |
| Mestranol | EE 3-Methylether | ? | 2.5 | ? | ? | Östrogen |
| Moxestrol | RU-2858; 11β-Methoxy-EE | 35–43 | 5–20 | 0.5 | 2.6 | Östrogen |
| Methylestradiol | 17α-Methyl-17β-estradiol | 70 | 44 | ? | ? | Östrogen |
| Diethylstilbestrol | DES; Stilbestrol | 129.5 (89.1–468) | 219.63 (61.2–295) | 0.04 | 0.05 | Östrogen |
| Hexestrol | Dihydrodiethylstilbestrol | 153.6 (31–302) | 60–234 | 0.06 | 0.06 | Östrogen |
| Dienestrol | Dehydrostilbestrol | 37 (20.4–223) | 56–404 | 0.05 | 0.03 | Östrogen |
| Benzestrol (B2) | – | 114 | ? | ? | ? | Östrogen |
| Chlortrianisene | TACE | 1.74 | ? | 15.30 | ? | Östrogen |
| Triphenylethylen | TPE | 0.074 | ? | ? | ? | Östrogen |
| Triphenylbromethylen | TPBE | 2.69 | ? | ? | ? | Östrogen |
| Tamoxifen | ICI-46,474 | 3 (0.1–47) | 3.33 (0.28–6) | 3.4–9.69 | 2.5 | SERM |
| Afimoxifen | 4-Hydroxytamoxifen; 4-OHT | 100.1 (1.7–257) | 10 (0.98–339) | 2.3 (0.1–3.61) | 0.04–4.8 | SERM |
| Toremifen | 4-Chlorotamoxifen; 4-CT | ? | ? | 7.14–20.3 | 15.4 | SERM |
| Clomifen | MRL-41 | 25 (19.2–37.2) | 12 | 0.9 | 1.2 | SERM |
| Cyclofenil | F-6066; Sexovid | 151–152 | 243 | ? | ? | SERM |
| Nafoxidin | U-11.000A | 30.9–44 | 16 | 0.3 | 0.8 | SERM |
| Raloxifen | – | 41.2 (7.8–69) | 5.34 (0.54–16) | 0.188–0.52 | 20.2 | SERM |
| Arzoxifen | LY-353,381 | ? | ? | 0.179 | ? | SERM |
| Lasofoxifen | CP-336,156 | 10.2–166 | 19.0 | 0.229 | ? | SERM |
| Ormeloxifen | Centchroman | ? | ? | 0.313 | ? | SERM |
| Levormeloxifen | 6720-CDRI; NNC-460,020 | 1.55 | 1.88 | ? | ? | SERM |
| Ospemifen | Deaminohydroxytoremifen | 0.82–2.63 | 0.59–1.22 | ? | ? | SERM |
| Bazedoxifen | – | ? | ? | 0.053 | ? | SERM |
| Etacstil | GW-5638 | 4.30 | 11.5 | ? | ? | SERM |
| ICI-164,384 | – | 63.5 (3.70–97.7) | 166 | 0.2 | 0.08 | Antiöstrogene |
| Fulvestrant | ICI-182,780 | 43.5 (9.4–325) | 21.65 (2.05–40.5) | 0.42 | 1.3 | Antiöstrogene |
| Propylpyrazoletriol | PPT | 49 (10.0–89.1) | 0.12 | 0.40 | 92.8 | ERα-Agonist |
| 16α-LE2 | 16α-Lacton-17β-Östradiol | 14.6–57 | 0.089 | 0.27 | 131 | ERα-Agonist |
| 16α-Jod-E2 | 16α-Iodo-17β-estradiol | 30.2 | 2.30 | ? | ? | ERα-Agonist |
| Methylpiperidinopyrazol | MPP | 11 | 0.05 | ? | ? | ERα-Antagonist |
| Diarylpropionitril | DPN | 0.12–0.25 | 6.6–18 | 32.4 | 1.7 | ERβ-Agonist |
| 8β-VE2 | 8β-Vinyl-17β-Östradiol | 0.35 | 22.0–83 | 12.9 | 0.50 | ERβ-Agonist |
| Prinaberel | ERB-041; WAY-202,041 | 0.27 | 67–72 | ? | ? | ERβ-Agonist |
| ERB-196 | WEG-202,196 | ? | 180 | ? | ? | ERβ-Agonist |
| Erteberel | SERBA-1; LY-500,307 | ? | ? | 2.68 | 0.19 | ERβ-Agonist |
| SERBA-2 | – | ? | ? | 14.5 | 1.54 | ERβ-Agonist |
| Coumestrol | – | 9.225 (0.0117–94) | 64.125 (0.41–185) | 0.14–80.0 | 0.07–27.0 | Xenoöstrogen |
| Genistein | – | 0.445 (0.0012–16) | 33.42 (0.86–87) | 2.6–126 | 0.3–12.8 | Xenoöstrogen |
| Equol | – | 0.2–0.287 | 0.85 (0.10–2.85) | ? | ? | Xenoöstrogen |
| Daidzein | – | 0.07 (0.0018–9.3) | 0.7865 (0.04–17.1) | 2.0 | 85.3 | Xenoöstrogen |
| Biochanin A | – | 0.04 (0.022–0.15) | 0.6225 (0.010–1.2) | 174 | 8.9 | Xenoöstrogen |
| Kaempferol | – | 0.07 (0.029–0.10) | 2.2 (0.002–3.00) | ? | ? | Xenoöstrogen |
| Naringenin | – | 0.0054 (<0.001–0.01) | 0.15 (0.11–0.33) | ? | ? | Xenoöstrogen |
| 8-Prenylnaringenin | 8-PN | 4.4 | ? | ? | ? | Xenoöstrogen |
| Quercetin | – | <0.001–0.01 | 0.002–0.040 | ? | ? | Xenoöstrogen |
| Ipriflavon | – | <0.01 | <0.01 | ? | ? | Xenoöstrogen |
| Miroestrol | – | 0.39 | ? | ? | ? | Xenoöstrogen |
| Deoxymiroestrol | – | 2.0 | ? | ? | ? | Xenoöstrogen |
| β-Sitosterin | – | <0.001–0.0875 | <0.001–0.016 | ? | ? | Xenoöstrogen |
| Resveratrol | – | <0.001–0.0032 | ? | ? | ? | Xenoöstrogen |
| α-Zearalenol | – | 48 (13–52.5) | ? | ? | ? | Xenoöstrogen |
| β-Zearalenol | – | 0.6 (0.032–13) | ? | ? | ? | Xenoöstrogen |
| Zeranol | α-Zearalanol | 48–111 | ? | ? | ? | Xenoöstrogen |
| Taleranol | β-Zearalanol | 16 (13–17.8) | 14 | 0.8 | 0.9 | Xenoöstrogen |
| Zearalenon | ZEN | 7.68 (2.04–28) | 9.45 (2.43–31.5) | ? | ? | Xenoöstrogen |
| Zearalanon | ZAN | 0.51 | ? | ? | ? | Xenoöstrogen |
| Bisphenol A | BPA | 0.0315 (0.008–1.0) | 0.135 (0.002–4.23) | 195 | 35 | Xenoöstrogen |
| Endosulfan | EDS | <0.001–<0.01 | <0.01 | ? | ? | Xenoöstrogen |
| Kepon | Chlordecon | 0.0069–0.2 | ? | ? | ? | Xenoöstrogen |
| o,p-DDT | ||||||
| 0.0073-0.4 | ? | ? | ? | Xenoestrogen | ||
| p,p-DDT | ||||||
| 0.03 | ? | ? | ? | Xenoestrogen | ||
| Methoxychlor | p,p-Dimethoxy-DDT | 0.01 (<0.001–0.02) | 0.01–0.13 | ? | ? | Xenoöstrogen |
| HPTE | Hydroxychlor; p,p-OH-DDT | 1.2–1.7 | ? | ? | ? | Xenoöstrogen |
| Testosteron | T; 4-Androstenolon | <0.0001–<0.01 | <0.002–0.040 | >5000 | >5000 | Androgen |
| Dihydrotestosteron | DHT; 5α-Androstanolon | 0.01 (<0.001–0.05) | 0.0059–0.17 | 221–>5000 | 73–1688 | Androgen |
| Nandrolon | 19-Nortestosteron; 19-NT | 0.01 | 0.23 | 765 | 53 | Androgen |
| Dehydroepiandrosteron | DHEA; Prasteron | 0.038 (<0.001–0.04) | 0.019–0.07 | 245–1053 | 163–515 | Androgen |
| 5-Androstenediol | A5; Androstendiol | 6 | 17 | 3.6 | 0.9 | Androgen |
| 4-Androstendiol | – | 0.5 | 0.6 | 23 | 19 | Androgen |
| 4-Androstendion | A4; Androstendion | <0.01 | <0.01 | >10000 | >10000 | Androgen |
| 3α-Androstandiol | 3α-Adiol | 0.07 | 0.3 | 260 | 48 | Androgen |
| 3β-Androstandiol | 3β-Adiol | 3 | 7 | 6 | 2 | Androgen |
| Androstanedion | 5α-Androstandion | <0.01 | <0.01 | >10000 | >10000 | Androgen |
| Etiocholandion | 5β-Androstanedion | <0.01 | <0.01 | >10000 | >10000 | Androgen |
| Methyltestosteron | 17α-Methyltestosteron | <0.0001 | ? | ? | ? | Androgen |
| Ethinyl-3α-androstanediol | 17α-Ethynyl-3α-Adiol | 4.0 | <0.07 | ? | ? | Östrogen |
| Ethinyl-3β-androstandiol | 17α-Ethynyl-3β-Adiol | 50 | 5.6 | ? | ? | Östrogen |
| Progesteron | P4; 4-Pregnenedion | <0.001–0.6 | <0.001–0.010 | ? | ? | Progestogen |
| Norethisteron | NET; 17α-Ethynyl-19-NT | 0.085 (0.0015–<0.1) | 0.1 (0.01–0.3) | 152 | 1084 | Progestogen |
| Norethynodrel | 5(10)-Norethisteron | 0.5 (0.3–0.7) | <0.1–0.22 | 14 | 53 | Progestogen |
| Tibolon | 7α-Methylnorethynodrel | 0.5 (0.45–2.0) | 0.2–0.076 | ? | ? | Progestogen |
| Δ4-Tibolon | 7α-Methylnorethisteron | 0.069–<0.1 | 0.027–<0.1 | ? | ? | Progestogen |
| 3α-Hydroxytibolon | – | 2.5 (1.06–5.0) | 0.6–0.8 | ? | ? | Progestogen |
| 3β-Hydroxytibolon | – | 1.6 (0.75–1.9) | 0.070–0.1 | ? | ? | Progestogen |
| Fußnoten: a = (1) Die Werte für die Bindungsaffinität haben das Format "Median (Bereich)" (# (#-#)), "Bereich" (#-#) oder "Wert" (#), abhängig von den verfügbaren Werten. Die vollständigen Wertesätze innerhalb der Bereiche sind im Wiki-Code zu finden. (2) Die Bindungsaffinitäten wurden durch Verdrängungsstudien in einer Vielzahl von In-vitro-Systemen mit markiertem Estradiol und menschlichen ERα- und ERβ-Proteinen bestimmt (mit Ausnahme der ERβ-Werte aus Kuiper et al. (1997), bei denen es sich um Ratten-ERβ handelt). Quellen: Siehe Vorlagenseite. | ||||||
| Östrogen | Relative Bindungsaffinitäten (%) ⓘ | ||||||
|---|---|---|---|---|---|---|---|
| ER | AR | PR | GR | MR | SHBG | CBG | |
| Estradiol | 100 | 7.9 | 2.6 | 0.6 | 0.13 | 8.7–12 | <0.1 |
| Estradiol-Benzoat | ? | ? | ? | ? | ? | <0.1–0.16 | <0.1 |
| Estradiolvalerat | 2 | ? | ? | ? | ? | ? | ? |
| Estron | 11–35 | <1 | <1 | <1 | <1 | 2.7 | <0.1 |
| Estron-Sulfat | 2 | 2 | ? | ? | ? | ? | ? |
| Estriol | 10–15 | <1 | <1 | <1 | <1 | <0.1 | <0.1 |
| Äquilin | 40 | ? | ? | ? | ? | ? | 0 |
| Alfatradiol | 15 | <1 | <1 | <1 | <1 | ? | ? |
| Epiestriol | 20 | <1 | <1 | <1 | <1 | ? | ? |
| Ethinylestradiol | 100–112 | 1–3 | 15–25 | 1–3 | <1 | 0.18 | <0.1 |
| Mestranol | 1 | ? | ? | ? | ? | <0.1 | <0.1 |
| Methylestradiol | 67 | 1–3 | 3–25 | 1–3 | <1 | ? | ? |
| Moxestrol | 12 | <0.1 | 0.8 | 3.2 | <0.1 | <0.2 | <0.1 |
| Diethylstilbestrol | ? | ? | ? | ? | ? | <0.1 | <0.1 |
| Anmerkungen: Referenzliganden (100%) waren Progesteron für die PR, Testosteron für die AR, Estradiol für die ER, Dexamethason für die GR, Aldosteron für die MR, Dihydrotestosteron für SHBG und Cortisol für CBG. Quellen: Siehe Vorlage. | |||||||
| Östrogen | Andere Bezeichnungen | RBA (%)a | REP (%)b ⓘ | |||
|---|---|---|---|---|---|---|
| ER | ERα | ERβ | ||||
| Estradiol | E2 | 100 | 100 | 100 | ||
| Estradiol-3-sulfat | E2S; E2-3S | ? | 0.02 | 0.04 | ||
| Estradiol-3-Glucuronid | E2-3G | ? | 0.02 | 0.09 | ||
| Estradiol-17β-Glucuronid | E2-17G | ? | 0.002 | 0.0002 | ||
| Estradiol-Benzoat | EB; Estradiol-3-benzoat | 10 | 1.1 | 0.52 | ||
| Östradiol-17β-Acetat | E2-17A | 31–45 | 24 | ? | ||
| Estradiol-Diacetat | EDA; Estradiol 3,17β-Diacetat | ? | 0.79 | ? | ||
| Estradiol-Propionat | EP; Estradiol-17β-propionat | 19–26 | 2.6 | ? | ||
| Estradiolvalerat | EV; Estradiol 17β-Valerat | 2–11 | 0.04–21 | ? | ||
| Estradiol-Cypionat | EC; Estradiol 17β-cypionat | ?c | 4.0 | ? | ||
| Estradiol-Palmitat | Estradiol 17β-Palmitat | 0 | ? | ? | ||
| Estradiol-Stearat | Estradiol 17β-Stearat | 0 | ? | ? | ||
| Estron | E1; 17-Ketoestradiol | 11 | 5.3–38 | 14 | ||
| Estron-Sulfat | E1S; Estron 3-Sulfat | 2 | 0.004 | 0.002 | ||
| Estron-Glucuronid | E1G; Estron-3-Glucuronid | ? | <0.001 | 0.0006 | ||
| Ethinylestradiol | EE; 17α-Ethynylestradiol | 100 | 17–150 | 129 | ||
| Mestranol | EE 3-Methylether | 1 | 1.3–8.2 | 0.16 | ||
| Quinestrol | EE 3-Cyclopentylether | ? | 0.37 | ? | ||
| Fußnoten: a = Die relativen Bindungsaffinitäten (RBAs) wurden durch In-vitro-Verdrängung von markiertem Östradiol von Östrogenrezeptoren (ERs) im Uteruszytosol von Nagetieren bestimmt. Östrogenester werden in diesen Systemen in unterschiedlicher Weise zu Östrogenen hydrolysiert (kürzere Esterkettenlänge -> höhere Hydrolyserate), und die ER-RBAs der Ester nehmen stark ab, wenn die Hydrolyse verhindert wird. b = Relative östrogene Potenzen (REPs) wurden aus halbmaximalen wirksamen Konzentrationen (EC50) berechnet, die über in-vitro-β-Galactosidase (β-gal) und grün fluoreszierendes Protein (GFP) Produktionsassays in Hefe, die menschlichen ERα und menschlichen ERβ exprimiert, bestimmt wurden. Sowohl Säugetierzellen als auch Hefe sind in der Lage, Östrogenester zu hydrolysieren. c = Die Affinitäten von Östradiolcypionat zu den ERs sind ähnlich wie die von Östradiolvalerat und Östradiolbenzoat (Abbildung). Quellen: Siehe Vorlagenseite. | ||||||
| Östrogen | ER RBA (%) | Gewicht der Gebärmutter (%) | Uterotrophie | LH-Spiegel (%) | SHBG RBA (%) ⓘ |
|---|---|---|---|---|---|
| Kontrolle | – | 100 | – | 100 | – |
| Estradiol (E2) | 100 | 506 ± 20 | +++ | 12–19 | 100 |
| Estron (E1) | 11 ± 8 | 490 ± 22 | +++ | ? | 20 |
| Estriol (E3) | 10 ± 4 | 468 ± 30 | +++ | 8–18 | 3 |
| Östetrol (E4) | 0.5 ± 0.2 | ? | Inaktiv | ? | 1 |
| 17α-Estradiol | 4.2 ± 0.8 | ? | ? | ? | ? |
| 2-Hydroxy-Estradiol | 24 ± 7 | 285 ± 8 | +b | 31–61 | 28 |
| 2-Methoxyestradiol | 0.05 ± 0.04 | 101 | Inaktiv | ? | 130 |
| 4-Hydroxyestradiol | 45 ± 12 | ? | ? | ? | ? |
| 4-Methoxyestradiol | 1.3 ± 0.2 | 260 | ++ | ? | 9 |
| 4-Fluorestradiola | 180 ± 43 | ? | +++ | ? | ? |
| 2-Hydroxyestradiol | 1.9 ± 0.8 | 130 ± 9 | Inaktiv | 110–142 | 8 |
| 2-Methoxyestron | 0.01 ± 0.00 | 103 ± 7 | Inaktiv | 95–100 | 120 |
| 4-Hydroxyestron | 11 ± 4 | 351 | ++ | 21–50 | 35 |
| 4-Methoxyestron | 0.13 ± 0.04 | 338 | ++ | 65–92 | 12 |
| 16α-Hydroxyestron | 2.8 ± 1.0 | 552 ± 42 | +++ | 7–24 | <0.5 |
| 2-Hydroxyestriol | 0.9 ± 0.3 | 302 | +b | ? | ? |
| 2-Methoxyestriol | 0.01 ± 0.00 | ? | Inaktiv | ? | 4 |
| Anmerkungen: Die Werte sind Mittelwert ± SD oder Bereich. ER RBA = Relative Bindungsaffinität zu Östrogenrezeptoren des Uteruszytosols von Ratten. Uterusgewicht = Prozentuale Veränderung des uterinen Feuchtgewichts ovarektomierter Ratten nach 72 Stunden mit kontinuierlicher Verabreichung von 1 μg/Stunde über subkutan implantierte Osmosepumpen. LH-Spiegel = Spiegel des luteinisierenden Hormons im Vergleich zum Ausgangswert bei ovarektomierten Ratten nach 24 bis 72 Stunden kontinuierlicher Verabreichung über ein subkutanes Implantat. Fußnoten: a = Synthetisch (d. h. nicht endogen). b = Atypische uterotrophe Wirkung, die innerhalb von 48 Stunden abklingt (die uterotrophe Wirkung von Estradiol hält linear bis zu 72 Stunden an). Quellen: Siehe Vorlage. | |||||
Überblick über die Wirkungen
- Strukturell
- Anabolika: Erhöht die Muskelmasse und -kraft, die Geschwindigkeit der Muskelregeneration und die Knochendichte, erhöht die Empfindlichkeit gegenüber körperlicher Anstrengung, schützt vor Muskelschäden, verstärkt die Kollagensynthese, erhöht den Kollagengehalt des Bindegewebes, der Sehnen und Bänder, verringert aber auch die Steifheit der Sehnen und Bänder (insbesondere während der Menstruation). Durch die geringere Steifigkeit der Sehnen sind Frauen weniger anfällig für Muskelzerrungen, aber weiche Bänder sind viel verletzungsanfälliger (Kreuzbandrisse sind bei Frauen 2-8 Mal häufiger als bei Männern).
- Entzündungshemmende Eigenschaften
- Vermittelt die Ausbildung weiblicher sekundärer Geschlechtsmerkmale
- Beschleunigung des Stoffwechsels
- Vermehrte Fettspeicherung in einigen Körperteilen wie Brüsten, Gesäß und Beinen, aber weniger Bauch- und Viszeralfett (androgene Adipositas) Estradiol reguliert auch den Energieverbrauch und die Homöostase des Körpergewichts und scheint eine viel stärkere Wirkung gegen Fettleibigkeit zu haben als Testosteron im Allgemeinen.
- Frauen haben in der Regel eine geringere Grundkraft, nehmen aber im Durchschnitt die gleiche Menge an Muskelmasse zu wie Männer und steigern ihre relative Kraft viel schneller.
- Stimulierung des endometrialen Wachstums
- Steigerung des Gebärmutterwachstums
- Erhöhung der vaginalen Lubrikation
- Verdickung der Vaginalwand
- Erhaltung von Gefäßen und Haut
- Verringerung der Knochenresorption, Erhöhung der Knochenbildung
- Synthese von Proteinen
- Erhöhung der hepatischen Produktion von Bindungsproteinen
- Gerinnung
- Erhöhung des zirkulierenden Spiegels der Faktoren 2, 7, 9, 10, Plasminogen
- Verminderung von Antithrombin III
- Erhöhung der Adhäsionskraft der Blutplättchen
- Erhöhung des vWF (Östrogen -> Angiotensin II -> Vasopressin)
- Erhöhung von PAI-1 und PAI-2 auch durch Angiotensin II
- Lipide
- Erhöhung von HDL, Triglycerid
- Verringerung von LDL, Fettablagerung
- Flüssigkeitshaushalt
- Salz (Natrium) und Wasserretention
- Erhöhung von Cortisol, SHBG
- Gastrointestinaltrakt
- Verringerung der Darmmotilität
- Erhöhung des Cholesterins in der Galle
- Melanin
- Erhöhung von Phäomelanin, Verringerung von Eumelanin
- Krebs
- Unterstützt hormonempfindliche Brustkrebsarten (siehe Abschnitt unten)
- Funktion der Lunge
- Fördert die Lungenfunktion durch Unterstützung der Alveolen (bei Nagetieren, aber wahrscheinlich auch beim Menschen).
- Gebärmutterschleimhaut
- Östrogen fördert und erhält zusammen mit Progesteron die Gebärmutterschleimhaut als Vorbereitung auf die Einnistung der befruchteten Eizelle und die Aufrechterhaltung der Gebärmutterfunktion während der Trächtigkeit; außerdem wird der Oxytocin-Rezeptor im Myometrium hochreguliert
- Eisprung
- Ein Anstieg des Östrogenspiegels führt zur Ausschüttung des luteinisierenden Hormons, das den Eisprung auslöst, indem es die Eizelle aus dem Graafschen Follikel im Eierstock freisetzt.
- Sexuelles Verhalten
- Östrogen ist erforderlich, damit weibliche Säugetiere während des Östrus (wenn die Tiere "brünstig" sind) ein Lordoseverhalten zeigen. Dieses Verhalten ist für die sexuelle Empfänglichkeit dieser Säugetiere erforderlich und wird durch den ventromedialen Kern des Hypothalamus gesteuert.
- Der Sexualtrieb ist nur in Anwesenheit von Östrogen vom Androgenspiegel abhängig, aber ohne Östrogen verringert der freie Testosteronspiegel tatsächlich das sexuelle Verlangen (anstatt den Sexualtrieb zu steigern), wie bei Frauen mit hypoaktivem sexuellem Verlangen nachgewiesen wurde, und das sexuelle Verlangen kann bei diesen Frauen durch die Verabreichung von Östrogen (mit einem oralen Verhütungsmittel) wiederhergestellt werden. ⓘ
Weibliche Pubertätsentwicklung
Östrogene sind für die Entwicklung der weiblichen sekundären Geschlechtsmerkmale während der Pubertät verantwortlich, einschließlich der Brustentwicklung, der Verbreiterung der Hüften und der weiblichen Fettverteilung. Umgekehrt sind Androgene für das Wachstum der Scham- und Körperbehaarung sowie für Akne und Achselhöhlengeruch verantwortlich. ⓘ
Entwicklung der Brüste
Östrogen ist in Verbindung mit dem Wachstumshormon (GH) und seinem Sekretionsprodukt, dem insulinähnlichen Wachstumsfaktor 1 (IGF-1), von entscheidender Bedeutung für die Brustentwicklung während der Pubertät sowie für die Brustreifung während der Schwangerschaft in Vorbereitung auf das Stillen. Östrogen ist in erster Linie und direkt für die Auslösung der duktalen Komponente der Brustentwicklung sowie für die Fettablagerung und das Bindegewebswachstum verantwortlich. Indirekt ist es auch an der lobuloalveolären Komponente beteiligt, indem es die Expression von Progesteronrezeptoren in der Brust erhöht und die Sekretion von Prolaktin auslöst. Progesteron und Prolaktin wirken zusammen, um die lobuloalveoläre Entwicklung während der Schwangerschaft zu vervollständigen, was durch Östrogen ermöglicht wird. ⓘ
Androgene wie Testosteron wirken der Wirkung von Östrogen in den Brüsten entgegen, indem sie die Expression von Östrogenrezeptoren in den Brüsten verringern. ⓘ
Weibliches Fortpflanzungssystem
Östrogene sind für die Reifung und den Erhalt der Vagina und der Gebärmutter verantwortlich und sind auch an der Funktion der Eierstöcke beteiligt, z. B. an der Reifung der Eierstockfollikel. Darüber hinaus spielen Östrogene eine wichtige Rolle bei der Regulierung der Gonadotropinsekretion. Aus diesen Gründen sind Östrogene für die weibliche Fruchtbarkeit erforderlich. ⓘ
Neuroprotektion und DNA-Reparatur
Östrogen regulierte DNA-Reparaturmechanismen im Gehirn haben neuroprotektive Wirkungen. Östrogen reguliert die Transkription von DNA-Basenexzisionsreparaturgenen sowie die Verlagerung der Basenexzisionsreparaturenzyme zwischen verschiedenen subzellulären Kompartimenten. ⓘ
Gehirn und Verhalten
Sexualtrieb
Östrogene sind sowohl bei Frauen als auch bei Männern an der Libido (Sexualtrieb) beteiligt. ⓘ
Kognition
Verbale Gedächtniswerte werden häufig als ein Maß für die Kognition auf höherer Ebene verwendet. Diese Werte schwanken in direktem Verhältnis zum Östrogenspiegel während des Menstruationszyklus, der Schwangerschaft und der Menopause. Außerdem verhindern Östrogene, wenn sie kurz nach der natürlichen oder chirurgischen Menopause verabreicht werden, eine Verschlechterung des verbalen Gedächtnisses. Im Gegensatz dazu haben Östrogene kaum Auswirkungen auf das verbale Gedächtnis, wenn sie erst Jahre nach der Menopause verabreicht werden. Östrogene haben auch einen positiven Einfluss auf andere Messgrößen der kognitiven Funktion. Die Wirkung von Östrogenen auf die Kognition ist jedoch nicht einheitlich günstig und hängt vom Zeitpunkt der Verabreichung und von der Art der gemessenen kognitiven Fähigkeit ab. ⓘ
Die schützenden Wirkungen von Östrogenen auf die Kognition werden möglicherweise durch die entzündungshemmenden Wirkungen von Östrogenen im Gehirn vermittelt. Studien haben auch gezeigt, dass das Met-Allel-Gen und der Östrogenspiegel die Effizienz von Aufgaben des Arbeitsgedächtnisses in Abhängigkeit vom präfrontalen Kortex beeinflussen. Die Forscher fordern weitere Forschungsarbeiten, um die Rolle von Östrogen und sein Potenzial zur Verbesserung der kognitiven Funktionen zu beleuchten. ⓘ
Psychische Gesundheit
Man geht davon aus, dass Östrogen eine wichtige Rolle für die psychische Gesundheit von Frauen spielt. Plötzlicher Östrogenentzug, schwankender Östrogenspiegel und Perioden mit anhaltend niedrigem Östrogenspiegel korrelieren mit einer deutlichen Verschlechterung der Stimmung. Die klinische Genesung von Depressionen nach der Geburt, in der Perimenopause und nach der Menopause hat sich als wirksam erwiesen, nachdem der Östrogenspiegel stabilisiert und/oder wiederhergestellt worden war. Eine Verschlimmerung der Menstruation (einschließlich einer Menstruationspsychose) wird in der Regel durch einen niedrigen Östrogenspiegel ausgelöst und wird häufig mit einer prämenstruellen Dysphorie verwechselt. ⓘ
Zwänge bei männlichen Labormäusen, wie sie bei Zwangsstörungen auftreten, können durch einen niedrigen Östrogenspiegel verursacht werden. Als der Östrogenspiegel bei männlichen Labormäusen durch eine erhöhte Aktivität des Enzyms Aromatase erhöht wurde, gingen die Zwangsrituale drastisch zurück. Die hypothalamischen Proteine des Gens COMT werden durch die Erhöhung des Östrogenspiegels verstärkt, was vermutlich dazu führt, dass die Mäuse, die Zwangsstörungsrituale zeigten, wieder normal aktiv werden. Schließlich wird ein Aromatasemangel vermutet, der an der Östrogensynthese beim Menschen beteiligt ist und therapeutische Auswirkungen bei Menschen mit Zwangsstörungen hat. ⓘ
Es hat sich gezeigt, dass die lokale Anwendung von Östrogen im Hippocampus der Ratte die Wiederaufnahme von Serotonin hemmt. Im Gegensatz dazu hat sich gezeigt, dass die lokale Anwendung von Östrogen die Fähigkeit von Fluvoxamin, die Serotonin-Clearance zu verlangsamen, blockiert, was darauf hindeutet, dass dieselben Signalwege, die an der Wirksamkeit von SSRI beteiligt sind, auch von Komponenten der lokalen Östrogen-Signalwege beeinflusst werden können. ⓘ
Elternschaft
Studien haben auch ergeben, dass Väter niedrigere Cortisol- und Testosteronspiegel, aber höhere Östrogenspiegel (Östradiol) aufweisen als Nicht-Väter. ⓘ
Essanfälle
Östrogen kann eine Rolle bei der Unterdrückung von Essanfällen spielen. Eine Hormonersatztherapie mit Östrogen könnte eine mögliche Behandlung für das Binge-Eating-Verhalten bei Frauen sein. Es hat sich gezeigt, dass Östrogenersatz bei weiblichen Mäusen das Essanfallverhalten unterdrückt. Der Mechanismus, durch den Östrogenersatz das Binge-Eating-Verhalten hemmt, beinhaltet den Ersatz von Serotonin-Neuronen (5-HT). Bei Frauen, die Essanfälle haben, wird eine erhöhte Aufnahme von 5-HT-Neuronen im Gehirn festgestellt, so dass der Neurotransmitter Serotonin in der Zerebrospinalflüssigkeit weniger vorhanden ist. Östrogen aktiviert die 5-HT-Neuronen, was zu einer Unterdrückung von Essanfällen führt. ⓘ
Es wird auch vermutet, dass es eine Wechselwirkung zwischen dem Hormonspiegel und dem Essen zu verschiedenen Zeitpunkten des weiblichen Menstruationszyklus gibt. Die Forschung hat ein verstärktes emotionales Essen während des Hormonflusses vorausgesagt, der durch hohe Progesteron- und Östradiolspiegel in der Mitte der Lutealphase gekennzeichnet ist. Die Hypothese ist, dass diese Veränderungen auf Veränderungen im Gehirn während des Menstruationszyklus zurückzuführen sind, die wahrscheinlich eine genomische Wirkung der Hormone sind. Diese Auswirkungen führen zu Veränderungen im Menstruationszyklus, die eine Hormonausschüttung zur Folge haben, die zu Verhaltensänderungen führt, insbesondere zu Essanfällen und emotionalem Essen. Diese treten besonders häufig bei Frauen auf, die genetisch für Binge-Eating-Phänotypen anfällig sind. ⓘ
Binge Eating wird mit einem Rückgang von Östradiol und einem Anstieg von Progesteron in Verbindung gebracht. Klump et al. Progesteron kann die Auswirkungen eines niedrigen Östradiolspiegels (z. B. während eines dysregulierten Essverhaltens) abmildern, was jedoch nur für Frauen gilt, bei denen klinisch diagnostizierte Essanfälle (Binge Episodes, BEs) aufgetreten sind. Dysreguliertes Essverhalten ist bei Frauen mit BEs stärker mit solchen Ovarialhormonen verbunden als bei Frauen ohne BEs. ⓘ
Die Implantation von 17β-Östradiol-Pellets bei ovarektomierten Mäusen reduzierte das Binge-Eating-Verhalten signifikant, und die Injektion von GLP-1 bei ovarektomierten Mäusen verringerte das Binge-Eating-Verhalten. ⓘ
Die Assoziationen zwischen Essanfällen, Menstruationszyklusphase und Eierstockhormonen korrelierten. ⓘ
Vermännlichung bei Nagetieren
Bei Nagetieren spielen Östrogene (die im Gehirn lokal aus Androgenen aromatisiert werden) eine wichtige Rolle bei der psychosexuellen Differenzierung, z. B. durch Maskulinisierung des Territorialverhaltens; beim Menschen ist dies nicht der Fall. Beim Menschen scheinen die maskulinisierenden Wirkungen pränataler Androgene auf das Verhalten (und andere Gewebe, mit der möglichen Ausnahme der Auswirkungen auf die Knochen) ausschließlich über den Androgenrezeptor zu wirken. Daher wird der Nutzen von Nagetiermodellen für die Untersuchung der psychosexuellen Differenzierung beim Menschen in Frage gestellt. ⓘ
Skelettsystem
Östrogene sind sowohl für den pubertären Wachstumsschub, der eine Beschleunigung des Längenwachstums bewirkt, als auch für den Epiphysenschluss verantwortlich, der die Körpergröße und die Länge der Gliedmaßen sowohl bei weiblichen als auch bei männlichen Tieren begrenzt. Darüber hinaus sind Östrogene für die Knochenreifung und die Erhaltung der Knochenmineraldichte während des gesamten Lebens verantwortlich. Aufgrund des Hypoöstrogenismus steigt das Osteoporoserisiko in den Wechseljahren. ⓘ
Herz-Kreislauf-System
Frauen sind aufgrund der gefäßschützenden Wirkung von Östrogen, das zur Vorbeugung von Atherosklerose beiträgt, weniger von Herzerkrankungen betroffen. Es trägt auch dazu bei, das empfindliche Gleichgewicht zwischen der Bekämpfung von Infektionen und dem Schutz der Arterien vor Schäden aufrechtzuerhalten, wodurch das Risiko von Herz-Kreislauf-Erkrankungen gesenkt wird. Während der Schwangerschaft erhöhen hohe Östrogenspiegel die Blutgerinnung und das Risiko für venöse Thromboembolien. ⓘ
| Absolute Inzidenz der ersten VTE pro 10.000 Personenjahre während der Schwangerschaft und im Wochenbett ⓘ | ||||||||
|---|---|---|---|---|---|---|---|---|
| Schwedische Daten A | Schwedische Daten B | Englische Daten | Dänische Daten | |||||
| Zeitabschnitt | N | Rate (95% CI) | N | Rate (95% CI) | N | Rate (95% CI) | N | Rate (95% CI) |
| Außerhalb der Schwangerschaft | 1105 | 4.2 (4.0–4.4) | 1015 | 3.8 (?) | 1480 | 3.2 (3.0–3.3) | 2895 | 3.6 (3.4–3.7) |
| Vor der Geburt | 995 | 20.5 (19.2–21.8) | 690 | 14.2 (13.2–15.3) | 156 | 9.9 (8.5–11.6) | 491 | 10.7 (9.7–11.6) |
| Trimester 1 | 207 | 13.6 (11.8–15.5) | 172 | 11.3 (9.7–13.1) | 23 | 4.6 (3.1–7.0) | 61 | 4.1 (3.2–5.2) |
| Trimester 2 | 275 | 17.4 (15.4–19.6) | 178 | 11.2 (9.7–13.0) | 30 | 5.8 (4.1–8.3) | 75 | 5.7 (4.6–7.2) |
| Trimester 3 | 513 | 29.2 (26.8–31.9) | 340 | 19.4 (17.4–21.6) | 103 | 18.2 (15.0–22.1) | 355 | 19.7 (17.7–21.9) |
| Rund um die Geburt | 115 | 154.6 (128.8–185.6) | 79 | 106.1 (85.1–132.3) | 34 | 142.8 (102.0–199.8) | –
| |
| Postpartal | 649 | 42.3 (39.2–45.7) | 509 | 33.1 (30.4–36.1) | 135 | 27.4 (23.1–32.4) | 218 | 17.5 (15.3–20.0) |
| Frühes Postpartum | 584 | 75.4 (69.6–81.8) | 460 | 59.3 (54.1–65.0) | 177 | 46.8 (39.1–56.1) | 199 | 30.4 (26.4–35.0) |
| Spät postpartal | 65 | 8.5 (7.0–10.9) | 49 | 6.4 (4.9–8.5) | 18 | 7.3 (4.6–11.6) | 319 | 3.2 (1.9–5.0) |
| Inzidenzraten (IRRs) der ersten VTE während der Schwangerschaft und im Wochenbett | ||||||||
| Schwedische Daten A | Schwedische Daten B | Englische Daten | Dänische Daten | |||||
| Zeitabschnitt | IRR* (95% CI) | IRR* (95% CI) | IRR (95% CI)† | IRR (95% CI)† | ||||
| Außerhalb der Schwangerschaft | Referenz (d. h. 1,00)
| |||||||
| Vor der Geburt | 5.08 (4.66–5.54) | 3.80 (3.44–4.19) | 3.10 (2.63–3.66) | 2.95 (2.68–3.25) | ||||
| Trimester 1 | 3.42 (2.95–3.98) | 3.04 (2.58–3.56) | 1.46 (0.96–2.20) | 1.12 (0.86–1.45) | ||||
| Trimester 2 | 4.31 (3.78–4.93) | 3.01 (2.56–3.53) | 1.82 (1.27–2.62) | 1.58 (1.24–1.99) | ||||
| Trimester 3 | 7.14 (6.43–7.94) | 5.12 (4.53–5.80) | 5.69 (4.66–6.95) | 5.48 (4.89–6.12) | ||||
| Rund um die Geburt | 37.5 (30.9–44.45) | 27.97 (22.24–35.17) | 44.5 (31.68–62.54) | –
| ||||
| Postpartal | 10.21 (9.27–11.25) | 8.72 (7.83–9.70) | 8.54 (7.16–10.19) | 4.85 (4.21–5.57) | ||||
| Frühes Postpartum | 19.27 (16.53–20.21) | 15.62 (14.00–17.45) | 14.61 (12.10–17.67) | 8.44 (7.27–9.75) | ||||
| Spät postpartal | 2.06 (1.60–2.64) | 1.69 (1.26–2.25) | 2.29 (1.44–3.65) | 0.89 (0.53–1.39) | ||||
| Anmerkungen: Schwedische Daten A = Verwendung eines beliebigen Codes für VTE, unabhängig von der Bestätigung. Schwedische Daten B = Verwendung von nur durch den Algorithmus bestätigten VTE. Frühes Postpartum = Die ersten 6 Wochen nach der Entbindung. Spätes postpartales Stadium = Mehr als 6 Wochen nach der Entbindung. * = Bereinigt um Alter und Kalenderjahr. † = Unbereinigtes Verhältnis, das auf der Grundlage der bereitgestellten Daten berechnet wurde. Quelle: | ||||||||
Immunsystem
Östrogen hat entzündungshemmende Eigenschaften und hilft bei der Mobilisierung von polymorphkernigen weißen Blutkörperchen oder Neutrophilen. ⓘ
Assoziierte Erkrankungen
Forscher haben Östrogene mit verschiedenen östrogenabhängigen Erkrankungen in Verbindung gebracht, z. B. mit ER-positivem Brustkrebs sowie mit einer Reihe von genetischen Erkrankungen, die mit der Östrogensignalübertragung oder dem Östrogenstoffwechsel zusammenhängen, wie z. B. das Östrogeninsensitivitätssyndrom, der Aromatasemangel und das Aromataseexzesssyndrom. ⓘ
Ein hoher Östrogenspiegel kann die Stresshormonreaktionen in Stresssituationen verstärken. ⓘ
Biochemie
Biosynthese

Östrogene werden bei Frauen hauptsächlich von den Eierstöcken und während der Schwangerschaft von der Plazenta produziert. Das follikelstimulierende Hormon (FSH) regt die Eierstockproduktion von Östrogenen durch die Granulosazellen der Eierstockfollikel und der Gelbkörper an. Einige Östrogene werden in geringeren Mengen auch von anderen Geweben wie der Leber, der Bauchspeicheldrüse, den Knochen, den Nebennieren, der Haut, dem Gehirn, dem Fettgewebe und den Brüsten produziert. Diese sekundären Östrogenquellen sind besonders wichtig für Frauen nach der Menopause. Der Weg der Östrogenbiosynthese in extragonadalen Geweben ist anders. Diese Gewebe sind nicht in der Lage, C19-Steroide zu synthetisieren, und sind daher auf die C19-Zufuhr aus anderen Geweben und den Gehalt an Aromatase angewiesen. ⓘ
Bei der Frau beginnt die Östrogensynthese in den Theca interna-Zellen des Eierstocks mit der Synthese von Androstendion aus Cholesterin. Androstendion ist eine Substanz mit schwacher androgener Aktivität, die in erster Linie als Vorstufe für stärkere Androgene wie Testosteron und Östrogen dient. Diese Verbindung gelangt über die Basalmembran in die umgebenden Granulosazellen, wo sie entweder sofort in Estron oder in einem weiteren Schritt in Testosteron und dann in Estradiol umgewandelt wird. Die Umwandlung von Androstendion in Testosteron wird durch die 17β-Hydroxysteroid-Dehydrogenase (17β-HSD) katalysiert, während die Umwandlung von Androstendion und Testosteron in Estron bzw. Estradiol durch die Aromatase katalysiert wird, Enzyme, die beide in Granulosazellen exprimiert werden. Im Gegensatz dazu fehlt den Granulosazellen die 17α-Hydroxylase und die 17,20-Lyase, während die Thekazellen diese Enzyme und die 17β-HSD exprimieren, aber keine Aromatase. Daher sind sowohl die Granulosa- als auch die Thekazellen für die Produktion von Östrogen in den Eierstöcken unerlässlich. ⓘ
Der Östrogenspiegel schwankt im Verlauf des Menstruationszyklus, wobei er gegen Ende der Follikelphase kurz vor dem Eisprung am höchsten ist. ⓘ
Beachten Sie, dass bei Männern Östrogen auch von den Sertoli-Zellen produziert wird, wenn FSH an ihre FSH-Rezeptoren bindet. ⓘ
| Geschlecht | Sexualhormon | Fortpflanzung Phase |
Blut Produktionsrate |
Keimdrüsen Sekretionsrate |
Stoffwechsel Clearance-Rate |
Referenzbereich (Serumspiegel) ⓘ | |
|---|---|---|---|---|---|---|---|
| SI-Einheiten | Nicht-SI-Einheiten | ||||||
| Männer | Androstendion | –
|
2,8 mg/Tag | 1,6 mg/Tag | 2200 L/Tag | 2,8-7,3 nmol/L | 80-210 ng/dL |
| Testosteron | –
|
6,5 mg/Tag | 6,2 mg/Tag | 950 L/Tag | 6,9-34,7 nmol/L | 200-1000 ng/dL | |
| Estron | –
|
150 μg/Tag | 110 μg/Tag | 2050 L/Tag | 37-250 pmol/L | 10-70 pg/ml | |
| Estradiol | –
|
60 μg/Tag | 50 μg/Tag | 1600 L/Tag | <37-210 pmol/L | 10-57 pg/ml | |
| Estron-Sulfat | –
|
80 μg/Tag | Unbedeutend | 167 L/Tag | 600-2500 pmol/L | 200-900 pg/ml | |
| Frauen | Androstendion | –
|
3,2 mg/Tag | 2,8 mg/Tag | 2000 L/Tag | 3,1-12,2 nmol/L | 89-350 ng/dL |
| Testosteron | –
|
190 μg/Tag | 60 μg/Tag | 500 L/Tag | 0,7-2,8 nmol/L | 20-81 ng/dL | |
| Estron | Follikuläre Phase | 110 μg/Tag | 80 μg/Tag | 2200 L/Tag | 110-400 pmol/L | 30-110 pg/ml | |
| Lutealphase | 260 μg/Tag | 150 μg/Tag | 2200 L/Tag | 310-660 pmol/L | 80-180 pg/ml | ||
| Postmenopause | 40 μg/Tag | Unbedeutend | 1610 L/Tag | 22-230 pmol/L | 6-60 pg/ml | ||
| Estradiol | Follikuläre Phase | 90 μg/Tag | 80 μg/Tag | 1200 L/Tag | <37-360 pmol/L | 10-98 pg/ml | |
| Lutealphase | 250 μg/Tag | 240 μg/Tag | 1200 L/Tag | 699-1250 pmol/L | 190-341 pg/ml | ||
| Postmenopause | 6 μg/Tag | Unbedeutend | 910 L/Tag | <37-140 pmol/L | 10-38 pg/ml | ||
| Estron-Sulfat | Follikuläre Phase | 100 μg/Tag | Unbedeutend | 146 L/Tag | 700-3600 pmol/L | 250-1300 pg/ml | |
| Lutealphase | 180 μg/Tag | Unbedeutend | 146 L/Tag | 1100-7300 pmol/L | 400-2600 pg/ml | ||
| Progesteron | Follikuläre Phase | 2 mg/Tag | 1,7 mg/Tag | 2100 L/Tag | 0,3-3 nmol/L | 0,1-0,9 ng/ml | |
| Lutealphase | 25 mg/Tag | 24 mg/Tag | 2100 L/Tag | 19-45 nmol/L | 6-14 ng/ml | ||
Anmerkungen und Quellen
Anmerkungen: "Die Konzentration eines Steroids im Blutkreislauf wird durch die Geschwindigkeit bestimmt, mit der es aus den Drüsen ausgeschieden wird, durch die Geschwindigkeit, mit der Vorläufer- oder Prähormone in das Steroid umgewandelt werden, und durch die Geschwindigkeit, mit der es von den Geweben extrahiert und metabolisiert wird. Die Sekretionsrate eines Steroids bezieht sich auf die Gesamtausscheidung der Verbindung aus einer Drüse pro Zeiteinheit. Die Sekretionsraten wurden durch die Entnahme von Proben aus dem venösen Ausfluss einer Drüse über einen bestimmten Zeitraum und durch Subtraktion der arteriellen und peripheren venösen Hormonkonzentration ermittelt. Die metabolische Clearance-Rate eines Steroids ist definiert als das Blutvolumen, das pro Zeiteinheit vollständig von dem Hormon abgebaut wurde. Die Produktionsrate eines Steroidhormons bezieht sich auf den Eintritt der Verbindung in das Blut aus allen möglichen Quellen, einschließlich der Sekretion aus Drüsen und der Umwandlung von Prohormonen in das Steroid von Interesse. Im Fließgleichgewicht ist die Menge des Hormons, die aus allen Quellen ins Blut gelangt, gleich der Rate, mit der es abgebaut wird (metabolische Clearance-Rate), multipliziert mit der Blutkonzentration (Produktionsrate = metabolische Clearance-Rate × Konzentration). Wenn der Prohormonstoffwechsel nur wenig zum zirkulierenden Steroidpool beiträgt, entspricht die Produktionsrate ungefähr der Sekretionsrate." Quellen: Siehe Vorlage. | |||||||
Verteilung
Östrogene sind im Kreislauf als Plasmaprotein an Albumin und/oder Sexualhormon-bindendes Globulin gebunden. ⓘ
Stoffwechsel
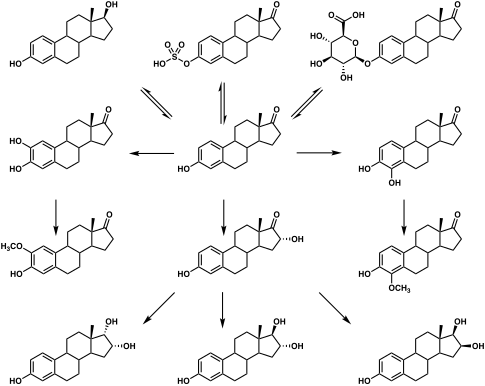
Östrogene werden durch Hydroxylierung durch Cytochrom-P450-Enzyme wie CYP1A1 und CYP3A4 und durch Konjugation durch Östrogensulfotransferasen (Sulfatierung) und UDP-Glucuronyltransferasen (Glucuronidierung) metabolisiert. Darüber hinaus wird Östradiol durch 17β-Hydroxysteroid-Dehydrogenase in das viel weniger potente Östrogen Östron dehydriert. Diese Reaktionen finden hauptsächlich in der Leber, aber auch in anderen Geweben statt. ⓘ
Östrogen-Metabolismus beim Menschen
|
Ausscheidung
Östrogene werden hauptsächlich über die Nieren als Konjugate über den Urin ausgeschieden. ⓘ
Medizinische Verwendung
Östrogene werden als Medikamente verwendet, hauptsächlich zur hormonellen Empfängnisverhütung, zur Hormonersatztherapie und zur Behandlung von Geschlechtsdysphorie bei Transgender-Frauen und anderen transfemininen Personen im Rahmen einer feminisierenden Hormontherapie. ⓘ
Chemie
Die Östrogen-Steroidhormone sind Östrogen-Steroide. ⓘ
Geschichte
Im Jahr 1929 isolierten und reinigten Adolf Butenandt und Edward Adelbert Doisy unabhängig voneinander Estron, das erste entdeckte Östrogen. Estriol und Estradiol wurden 1930 bzw. 1933 entdeckt. Kurz nach ihrer Entdeckung wurden sowohl natürliche als auch synthetische Östrogene für die medizinische Verwendung eingeführt. Beispiele sind Östriolglucuronid (Emmenin, Progynon), Östradiolbenzoat, konjugierte Östrogene (Premarin), Diethylstilbestrol und Ethinylestradiol. ⓘ
Das Wort Östrogen stammt aus dem Altgriechischen. Es ist abgeleitet von "oestros" (ein periodischer Zustand sexueller Aktivität bei weiblichen Säugetieren) und genos (erzeugen). Es wurde erstmals in den frühen 1920er Jahren veröffentlicht und als "Östrin" bezeichnet. Im Laufe der Jahre hat das amerikanische Englisch die Schreibweise von Östrogen an die phonetische Aussprache angepasst. Heutzutage werden jedoch sowohl Östrogen als auch Östrogen verwendet, wobei einige die ursprüngliche Schreibweise beibehalten möchten, da sie den Ursprung des Wortes widerspiegelt. ⓘ
Gesellschaft und Kultur
Etymologie
Der Name Östrogen leitet sich vom griechischen οἶστρος (oistros) ab, was wörtlich "Schwung oder Inspiration" bedeutet, aber im übertragenen Sinne sexuelle Leidenschaft oder Begierde meint, und der Endung -gen, was "Erzeuger von" bedeutet. ⓘ
Umwelt
In der Umwelt wurde eine Reihe von synthetischen und natürlichen Stoffen mit östrogener Wirkung festgestellt, die als Xenoöstrogene bezeichnet werden. ⓘ
- Synthetische Stoffe wie Bisphenol A sowie Metalloestrogene (z. B. Cadmium).
- Pflanzenprodukte mit östrogener Aktivität werden als Phytoöstrogene bezeichnet (z. B. Coumestrol, Daidzein, Genistein, Miroestrol).
- Die von Pilzen produzierten Östrogene werden als Mykoöstrogene bezeichnet (z. B. Zearalenon). ⓘ
Östrogene gehören zu den zahlreichen endokrin wirksamen Verbindungen (EDCs), da sie eine hohe östrogene Potenz aufweisen. Wenn ein EDC in die Umwelt gelangt, kann es bei wild lebenden Tieren zu Störungen der männlichen Fortpflanzung führen. Das von Nutztieren ausgeschiedene Östrogen gelangt in die Süßwassersysteme. Während der Keimphase der Fortpflanzung sind die Fische niedrigen Östrogenspiegeln ausgesetzt, die bei männlichen Fischen zu Fortpflanzungsstörungen führen können. ⓘ
Kosmetika
Einige auf dem Markt befindliche Haarshampoos enthalten Östrogene und Plazentaextrakte; andere enthalten Phytoöstrogene. 1998 gab es Fallberichte über vier vorpubertäre afroamerikanische Mädchen, die nach dem Gebrauch dieser Shampoos Brüste entwickelten. 1993 stellte die FDA fest, dass nicht alle rezeptfrei erhältlichen, topisch angewendeten hormonhaltigen Arzneimittel für den menschlichen Gebrauch allgemein als sicher und wirksam anerkannt sind und daher als falsch gekennzeichnet werden. Ein begleitender Regelungsvorschlag befaßt sich mit Kosmetika und kommt zu dem Schluß, daß jede Verwendung natürlicher Östrogene in einem kosmetischen Produkt dieses zu einem nicht zugelassenen neuen Arzneimittel macht und daß jedes kosmetische Mittel, das den Begriff "Hormon" im Text seiner Kennzeichnung oder in der Angabe der Inhaltsstoffe verwendet, eine implizite Arzneimittelaussage darstellt, so daß ein solches Produkt behördlichen Maßnahmen unterliegt. ⓘ
Produkte, die behaupten, Plazentaextrakt zu enthalten, können nicht nur als falsch gekennzeichnete Arzneimittel betrachtet werden, sondern auch als falsch gekennzeichnete Kosmetika, wenn der Extrakt aus Plazenta hergestellt wurde, aus der die Hormone und andere biologisch aktive Substanzen entfernt wurden, und die extrahierte Substanz hauptsächlich aus Protein besteht. Die FDA empfiehlt, diese Substanz mit einem anderen Namen als "Plazentaextrakt" zu bezeichnen und ihre Zusammensetzung genauer zu beschreiben, da die Verbraucher den Namen "Plazentaextrakt" mit einer therapeutischen Verwendung einer biologischen Aktivität in Verbindung bringen. ⓘ
Biosynthese
Estrogene entstehen durch die Umwandlung von männlichen Geschlechtshormonen. Hauptsächlich entsteht Estradiol durch Umwandlung von Testosteron. Die Umwandlung wird durch das Enzym Aromatase katalysiert. Dabei wird der Ring A mit den C-Atomen 1 bis 5 und 10 des Sterangerüstes in eine aromatische Struktur (siehe Aromat) umgewandelt. ⓘ
Wirkung
Estrogene fördern die Reifung einer befruchtungsfähigen Eizelle. Durch Estrogene wird die Gebärmutterschleimhaut gut durchblutet, der Muttermund öffnet sich, und das Gebärmutterhalssekret wird durchlässig für Spermien. Estrogene signalisieren der Hypophyse die Eizellreife und lösen damit indirekt den Eisprung aus. Die Konzentration der Estrogene ändert sich erheblich im Verlauf des weiblichen Zyklus. Gesteuert wird die Produktion von der Hypophyse über die Gonadotropine (FSH und LH). Nach der Menopause fällt die Estrogensynthese im weiblichen Körper stark ab. ⓘ
Im Blut werden Estrogene meist an Eiweiß gebunden transportiert. An bestimmten Organen (z. B. der weiblichen Brust und der Gebärmutter) befinden sich spezifische Estrogenrezeptoren, an die sich die Estrogene binden. Die Estrogene werden direkt zum Zellkern transportiert und beeinflussen so die Aktivität der Zellen. Der synthetische Estrogenabkömmling Ethinylestradiol war in der ersten in Europa erhältlichen Antibabypille (Anovlar) enthalten und wurde zu einer tragenden Säule des Pharmaunternehmens Schering AG. Es ist noch heute die estrogene Komponente in vielen hormonellen Empfängnisverhütungsmitteln. ⓘ
Estrogene fördern das Wachstum von Vagina (Scheide), Gebärmutter, Eierstock und Eileiter sowie die Ausbildung sekundärer weiblicher Geschlechtsmerkmale wie der Brüste. ⓘ
Estrogene wirken physiologisch auf die Knochen in Form eines Epiphysenschlusses und Hemmung der osteoklastären Knochenresorption; eine Verminderung des Estrogenspiegels im Blut kann zu Osteoporose (Knochenschwund) führen. Estrogene haben auch eine stimulierende Wirkung auf das Immunsystem, weswegen Estrogentherapien gelegentlich als Nebenwirkung die Aktivierung latenter Autoimmunerkrankungen haben. Zudem erhöhen Estrogene im Hirn die Sensibilität für das Hören; ein verminderter Estrogenspiegel, etwa nach der Menopause, verschlechtert dagegen das Hörvermögen. Das Hormon ist essentiell für das Speichern von Gedächtnisinhalten von Geräuschen und Sprache. ⓘ
Bei einigen Tieren wie Fischen und Fröschen wurden unter Einfluss von Estrogenen und Halogenkohlenwasserstoffen künstliche Geschlechtsumwandlungen beobachtet. ⓘ
Arten von Estrogenen
Von den natürlichen Estrogenen zeigen lediglich Estriol und – in hoher Dosierung – Estradiol bei oraler Anwendung eine Wirkung. Wegen schneller Metabolisierung besitzen Estradiol und andere natürliche Estrogene bei parenteraler Applikation eine flüchtige und bei oraler Applikation nur geringe Wirkung. Aus diesem Grunde werden vorwiegend künstliche Estrogene medikamentös eingesetzt, die meist als Ester der natürlichen Verbindungen oder als substituierte Derivate wesentlich langsamer metabolisiert werden und damit länger wirksam sind. Eine natürliche oder künstlich hergestellte Estrogenform, die zur Symptombehandlung bei der Menopause (Hitzewallungen, Scheidenveränderungen, Knochenschwund) oder zur Behandlung einer ausbleibenden Ovulation einsetzbar ist und zur Beschwerdelinderung in fortgeschrittenen Stadien von Prostata- und Brustkrebs verwendet wurde, wird als (mit Schwefel- oder Glukuronsäure) gekoppeltes Estrogen bezeichnet. ⓘ
Synthetische Estrogene mit 17α-Ethinylgruppe
| • 57-63-6 : | Ethinylestradiol ⓘ |
| • 72-33-3 : | Mestranol |
| • 13655-95-3 : | 11β-Methyl-ethinylestradiol |
| • 28913-23-7 : | Turisteron |
| • 34816-55-2 : | Moxestrol (11β-Methoxy-ethinylestradiol) |
Sonstige Estrogene
| • 2208-12-0 : | 6-Dehydroestron ⓘ |
| • 53-63-4 : | 17-Desoxyestradiol |
| • 362-05-0 : | 2-Hydroxyestradiol |
| • 517-04-4 : | Isoestradiol (8α-Estradiol) |
| • 1818-12-8 : | 2-Methylestradiol |
| • 6171-48-8 : | 4-Methylestradiol |
| • 28014-46-2 : | Polyestradiol-phosphat |
| • 39219-28-8 : | Promestrien |
| • 88847-87-4 : | 2-Chloroestradiol |
| • 126559-87-3 : | 1,11β-Ethanoestradiol |
Nicht-steroidale Estrogene
| • 56-53-1 : | C18H20O2 : Diethylstilbestrol ⓘ |
| • 13029-44-2 : | C18H18O2 : Dienestrol |
| • 130-79-0 : | C20H24O2 : Dimestrol |
| • 569-57-3 : | C23H21ClO3 : Chlorotrianisen |
| • 6202-26-2 : | C25H26O2 : Stilbestrol-monobenzyl-ether |
| • 13425-53-1 : | C18H22O8P2 : Fosfestrol |
| • 22059-16-1 : | C19H26O2 : Homoestradiol (Grundgerüst ist Perhydrochrysen anstatt Steran) |
| Fusarientoxine mit estrogener Wirkung: | |
| • 17924-92-4 | C18H22O5 : Zearalenon |
| • 26538-44-3 | C18H26O5 : Zeranol |
Hyperandrogenismus
Etwa fünf bis zehn Prozent aller Frauen leiden unter den Folgen einer Ungleichverteilung männlicher und weiblicher Hormone, die mit eine Ursache des sogenannten polyzystischen Ovarsyndrom PCOS ist. ⓘ