Estradiol

| |

| |
| Namen | |
|---|---|
| Aussprache | /ˌɛstrəˈdaɪoʊl/ ES-trə-DY-ohl |
| Bevorzugter IUPAC-Name
(1S,3aS,3bR,9bS,11aS)-11a-Methyl-2,3,3a,3b,4,5,9b,10,11,11a-decahydro-1H-cyclopenta[a]phenanthrene-1,7-diol | |
| Andere Bezeichnungen
Östradiol; E2; 17β-Estradiol; Estra-1,3,5(10)-trien-3,17β-diol; 17β-Östradiol
| |
| Bezeichner | |
3D-Modell (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Arzneimittelbank | |
| EC-Nummer |
|
| KEGG | |
PubChem CID
|
|
| UNII | |
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
C18H24O2 |
| Molekulare Masse | 272,38 g/mol |
Magnetische Suszeptibilität (χ)
|
-186,6-10-6 cm3/mol |
| Pharmakologie | |
ATC-Code
|
G03CA03 (WHO) |
| Zulassungsdaten |
|
Wege der
Verabreichung |
Oral, sublingual, intranasal, topisch/transdermal, vaginal, intramuskulär oder subkutan (als Ester), subdermales Implantat |
| Pharmakokinetik: | |
Bioverfügbarkeit
|
Oral: <5% |
Proteinbindung
|
~98%: - Albumin: 60% - SHBG: 38% - Frei: 2% |
| Leber (über Hydroxylierung, Sulfatierung, Glucuronidierung) | |
Biologische Halbwertszeit
|
Oral: 13-20 Stunden Sublingual: 8-18 Stunden Topisch (Gel): 36,5 Stunden |
Ausscheidung
|
Urin: 54 %. Fäkalien: 6% |
Wenn nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
Estradiol (E2), auch Östradiol genannt, ist ein östrogenes Steroidhormon und das wichtigste weibliche Sexualhormon. Es ist an der Regulierung des weiblichen Fortpflanzungszyklus (Östrus und Menstruation) beteiligt. Östradiol ist verantwortlich für die Entwicklung der weiblichen sekundären Geschlechtsmerkmale wie Brüste, breitere Hüften und eine weiblich geprägte Fettverteilung. Es ist auch wichtig für die Entwicklung und Erhaltung der weiblichen Fortpflanzungsgewebe wie Brustdrüsen, Gebärmutter und Vagina während der Pubertät, des Erwachsenenalters und der Schwangerschaft. Es hat auch wichtige Auswirkungen auf viele andere Gewebe wie Knochen, Fett, Haut, Leber und das Gehirn. ⓘ
Obwohl der Östradiolspiegel bei Männern viel niedriger ist als bei Frauen, spielt Östradiol auch bei Männern eine wichtige Rolle. Abgesehen von Menschen und anderen Säugetieren kommt Estradiol auch in den meisten Wirbeltieren und Krebstieren, Insekten, Fischen und anderen Tierarten vor. ⓘ
Estradiol wird vor allem in den Follikeln der Eierstöcke, aber auch in anderen Geweben wie den Hoden, den Nebennieren, dem Fett, der Leber, den Brüsten und dem Gehirn produziert. Estradiol wird im Körper über eine Reihe von Reaktionen und Zwischenstufen aus Cholesterin hergestellt. Der wichtigste Weg ist die Bildung von Androstendion, das dann durch Aromatase in Estron und anschließend in Estradiol umgewandelt wird. Alternativ kann Androstendion auch in Testosteron umgewandelt werden, das wiederum in Estradiol umgewandelt werden kann. In den Wechseljahren der Frau wird die Östrogenproduktion in den Eierstöcken eingestellt, und der Östradiolspiegel sinkt auf einen sehr niedrigen Wert. ⓘ
Neben seiner Rolle als natürliches Hormon wird Östradiol auch als Medikament verwendet, z. B. in der Hormontherapie der Wechseljahre und der feminisierenden Hormontherapie für Transgender-Frauen; Informationen über Östradiol als Medikament finden Sie im Artikel Östradiol (Medikament). ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Freiname | Estradiol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C18H24O2 | ||||||||||||||||||
| Kurzbeschreibung |
farblose Prismen | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
G03CA03 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 272,39 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
177 °C | ||||||||||||||||||
| Löslichkeit |
gut löslich in vielen organischen Lösungsmitteln, kaum löslich in Wasser | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
> 300 mg·kg−1 (LD50, Ratte, s.c.) | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Estradiol oder Östradiol, gelegentlich abgekürzt mit E2, ist ein Sexualhormon und im Vergleich mit Estron und Estriol das wirksamste natürliche Estrogen (Östrogen). Es wird vor allem in den Follikeln der Eierstöcke gebildet. ⓘ
Biologische Funktion
Sexuelle Entwicklung
Die Entwicklung der sekundären Geschlechtsmerkmale bei Frauen wird durch Östrogene, genauer gesagt durch Östradiol, gesteuert. Diese Veränderungen werden in der Pubertät eingeleitet, sind in den meisten Fällen während der reproduktiven Jahre verstärkt und werden mit abnehmender Östradiolzufuhr nach der Menopause weniger ausgeprägt. So bewirkt Östradiol die Brustentwicklung und ist für Veränderungen der Körperform verantwortlich, die sich auf Knochen, Gelenke und Fettablagerungen auswirken. Bei Frauen bewirkt Östradiol die Brustentwicklung, die Verbreiterung der Hüften, eine weibliche Fettverteilung (wobei sich das Fett vor allem in den Brüsten, den Hüften, den Oberschenkeln und dem Gesäß ablagert) und die Reifung von Vagina und Vulva, während es bei beiden Geschlechtern den pubertären Wachstumsschub (indirekt über eine erhöhte Wachstumshormonausschüttung) und den Epiphysenschluss (und damit die Begrenzung der endgültigen Körpergröße) vermittelt. ⓘ
Fortpflanzung
Weibliches Fortpflanzungssystem
Bei der Frau wirkt Östradiol als Wachstumshormon für das Gewebe der Fortpflanzungsorgane, indem es die Auskleidung der Vagina, die Gebärmutterhalsdrüsen, die Gebärmutterschleimhaut und die Auskleidung der Eileiter unterstützt. Es fördert das Wachstum des Myometriums. Estradiol scheint notwendig zu sein, um die Eizellen im Eierstock zu erhalten. Während des Menstruationszyklus löst Estradiol, das von den wachsenden Follikeln produziert wird, über ein positives Rückkopplungssystem die hypothalamisch-hypophysären Ereignisse aus, die zum Anstieg des luteinisierenden Hormons führen und den Eisprung auslösen. In der Lutealphase bereitet Estradiol in Verbindung mit Progesteron die Gebärmutterschleimhaut auf die Einnistung vor. Während der Schwangerschaft steigt der Östradiolspiegel aufgrund der Plazenta-Produktion an. Die Wirkung von Östradiol, zusammen mit Estron und Estriol, in der Schwangerschaft ist weniger klar. Sie können die Durchblutung der Gebärmutter und das Wachstum des Myometriums fördern, das Brustwachstum stimulieren und während der Schwangerschaft die Erweichung des Gebärmutterhalses und die Expression von Oxytocinrezeptoren im Myometrium fördern. Bei Pavianen führt die Blockierung der Östrogenproduktion zum Verlust der Schwangerschaft, was darauf schließen lässt, dass Östradiol eine Rolle bei der Aufrechterhaltung der Schwangerschaft spielt. In der Forschung wird die Rolle der Östrogene bei der Einleitung der Wehen untersucht. Die Wirkung von Östradiol ist erforderlich, bevor das Progesteron in der Lutealphase wirkt. ⓘ
Männliches Fortpflanzungssystem
Die Wirkung von Östradiol (und Östrogenen im Allgemeinen) auf die männliche Fortpflanzung ist komplex. Östradiol wird durch Aromatase hauptsächlich in den Leydig-Zellen der Hoden von Säugetieren, aber auch in einigen Keimzellen und den Sertoli-Zellen unreifer Säugetiere gebildet. Es verhindert (in vitro) die Apoptose der männlichen Samenzellen. Während einige Studien in den frühen 1990er Jahren einen Zusammenhang zwischen der weltweit sinkenden Spermienzahl und der Östrogenexposition in der Umwelt behaupteten, fanden spätere Studien weder einen solchen Zusammenhang noch Hinweise auf einen allgemeinen Rückgang der Spermienzahl. Die Unterdrückung der Östradiolproduktion bei einer Teilpopulation subfertiler Männer kann die Spermienanalyse verbessern. ⓘ
Männer mit bestimmten genetisch bedingten Geschlechtschromosomen, wie dem Klinefelter-Syndrom, weisen einen höheren Östradiolspiegel auf. ⓘ
Skelettsystem
Estradiol hat eine tiefgreifende Wirkung auf die Knochen. Menschen ohne Estradiol (oder andere Östrogene) werden groß und eunuchoid, da sich der Epiphysenschluss verzögert oder gar nicht stattfindet. Auch die Knochendichte wird beeinträchtigt, was zu einer frühen Osteopenie und Osteoporose führt. Niedrige Östradiolspiegel können auch Knochenbrüche vorhersagen, wobei Frauen nach der Menopause am häufigsten von Knochenbrüchen betroffen sind. Bei Frauen nach der Menopause kommt es aufgrund eines relativen Östrogenmangels zu einem beschleunigten Verlust an Knochenmasse. ⓘ
Gesundheit der Haut
Sowohl der Östrogenrezeptor als auch der Progesteronrezeptor wurden in der Haut nachgewiesen, unter anderem in Keratinozyten und Fibroblasten. In den Wechseljahren und danach führt der Rückgang der weiblichen Geschlechtshormone zu Atrophie, Ausdünnung und verstärkter Faltenbildung der Haut sowie zu einer Verringerung der Elastizität, Festigkeit und Stärke der Haut. Diese Hautveränderungen stellen eine Beschleunigung der Hautalterung dar und sind das Ergebnis eines verringerten Kollagengehalts, von Unregelmäßigkeiten in der Morphologie der epidermalen Hautzellen, einer verringerten Grundsubstanz zwischen den Hautfasern sowie einer verminderten Kapillarität und Durchblutung. In den Wechseljahren wird die Haut außerdem trockener, was auf eine verringerte Hautfeuchtigkeit und Oberflächenlipide (Talgproduktion) zurückzuführen ist. Neben der chronologischen Alterung und der Lichtalterung ist der Östrogenmangel in den Wechseljahren einer der drei Hauptfaktoren, die die Hautalterung am stärksten beeinflussen. ⓘ
Eine Hormonersatztherapie, die aus einer systemischen Behandlung mit Östrogenen allein oder in Kombination mit einem Gestagen besteht, hat nachweislich beträchtliche positive Auswirkungen auf die Haut postmenopausaler Frauen. Zu diesen Vorteilen gehören ein höherer Kollagengehalt der Haut, eine größere Hautdicke und -elastizität sowie eine höhere Hautfeuchtigkeit und mehr Oberflächenlipide. Topisches Östrogen hat nachweislich ähnliche positive Auswirkungen auf die Haut. Darüber hinaus wurde in einer Studie festgestellt, dass topische 2%ige Progesteroncreme bei Frauen in der Peri- und Postmenopause die Elastizität und Festigkeit der Haut signifikant erhöht und die Faltenbildung deutlich verringert. Der Feuchtigkeitsgehalt der Haut und die Oberflächenlipide hingegen veränderten sich durch topisches Progesteron nicht signifikant. Diese Ergebnisse deuten darauf hin, dass Progesteron wie Östrogen auch positive Auswirkungen auf die Haut hat und möglicherweise unabhängig davon vor Hautalterung schützt. ⓘ
Nervensystem
Östrogene können im Gehirn aus Steroidvorläufern gebildet werden. Als Antioxidantien haben sie nachweislich eine neuroprotektive Funktion. ⓘ
An den positiven und negativen Rückkopplungsschleifen des Menstruationszyklus ist Östradiol aus den Eierstöcken als Bindeglied zum hypothalamisch-hypophysären System zur Regulierung der Gonadotropine beteiligt. (Siehe Hypothalamus-Hypophysen-Gonaden-Achse.) ⓘ
Es wird davon ausgegangen, dass Östrogen eine wichtige Rolle für die psychische Gesundheit von Frauen spielt, wobei ein Zusammenhang zwischen dem Hormonspiegel, der Stimmung und dem Wohlbefinden vermutet wird. Ein plötzliches Absinken oder Schwanken des Östrogenspiegels oder lange Zeiträume mit anhaltend niedrigem Östrogenspiegel können mit einer deutlichen Senkung der Stimmung verbunden sein. Es hat sich gezeigt, dass die klinische Erholung von Depressionen nach der Geburt, in der Perimenopause und in der Postmenopause wirksam ist, nachdem der Östrogenspiegel stabilisiert und/oder wiederhergestellt wurde. ⓘ
Die Volumina geschlechtsdimorpher Hirnstrukturen bei Transgender-Frauen veränderten sich und näherten sich den typischen weiblichen Hirnstrukturen an, wenn sie über einen Zeitraum von mehreren Monaten gleichzeitig Östrogen und Androgenentzug ausgesetzt waren, was darauf hindeutet, dass Östrogen und/oder Androgene bei der Geschlechtsdifferenzierung des Gehirns sowohl vor der Geburt als auch später im Leben eine wichtige Rolle spielen. ⓘ
Es gibt auch Hinweise darauf, dass die Programmierung des erwachsenen männlichen Sexualverhaltens bei vielen Wirbeltieren weitgehend von Östradiol abhängt, das während des pränatalen Lebens und im frühen Säuglingsalter produziert wird. Es ist noch nicht bekannt, ob dieser Prozess beim menschlichen Sexualverhalten eine bedeutende Rolle spielt, obwohl Hinweise von anderen Säugetieren auf einen Zusammenhang hindeuten. ⓘ
Man hat festgestellt, dass Östrogen die Sekretion von Oxytocin und die Expression seines Rezeptors, des Oxytocin-Rezeptors, im Gehirn erhöht. Bei Frauen hat sich gezeigt, dass eine einzige Östradiol-Dosis ausreicht, um die zirkulierenden Oxytocin-Konzentrationen zu erhöhen. ⓘ
Gynäkologische Krebserkrankungen
Estradiol wird mit der Entstehung und dem Fortschreiten von Krebsarten wie Brust-, Eierstock- und Gebärmutterschleimhautkrebs in Verbindung gebracht. Estradiol wirkt auf das Zielgewebe hauptsächlich durch Interaktion mit zwei Kernrezeptoren, dem Östrogenrezeptor α (ERα) und dem Östrogenrezeptor β (ERβ). Eine der Funktionen dieser Östrogenrezeptoren ist die Modulation der Genexpression. Sobald Östradiol an die ERs bindet, binden die Rezeptorkomplexe an bestimmte DNA-Sequenzen, was möglicherweise zu einer Schädigung der DNA und einer Zunahme der Zellteilung und DNA-Replikation führt. Eukaryontische Zellen reagieren auf geschädigte DNA, indem sie die G1-, S- oder G2-Phasen des Zellzyklus stimulieren oder beeinträchtigen, um die DNA-Reparatur einzuleiten. Infolgedessen kommt es zur Zelltransformation und zur Vermehrung von Krebszellen. ⓘ
Herz-Kreislauf-System
Östrogen wirkt sich auf bestimmte Blutgefäße aus. In den Herzkranzgefäßen wurde eine Verbesserung des arteriellen Blutflusses nachgewiesen. ⓘ
Während der Schwangerschaft erhöhen hohe Östrogenspiegel, insbesondere Östradiol, die Blutgerinnung und das Risiko von venösen Thromboembolien. ⓘ
| Absolute Inzidenz der ersten VTE pro 10.000 Personenjahre während der Schwangerschaft und im Wochenbett ⓘ | ||||||||
|---|---|---|---|---|---|---|---|---|
| Schwedische Daten A | Schwedische Daten B | Englische Daten | Dänische Daten | |||||
| Zeitabschnitt | N | Rate (95% CI) | N | Rate (95% CI) | N | Rate (95% CI) | N | Rate (95% CI) |
| Außerhalb der Schwangerschaft | 1105 | 4.2 (4.0–4.4) | 1015 | 3.8 (?) | 1480 | 3.2 (3.0–3.3) | 2895 | 3.6 (3.4–3.7) |
| Vor der Geburt | 995 | 20.5 (19.2–21.8) | 690 | 14.2 (13.2–15.3) | 156 | 9.9 (8.5–11.6) | 491 | 10.7 (9.7–11.6) |
| Trimester 1 | 207 | 13.6 (11.8–15.5) | 172 | 11.3 (9.7–13.1) | 23 | 4.6 (3.1–7.0) | 61 | 4.1 (3.2–5.2) |
| Trimester 2 | 275 | 17.4 (15.4–19.6) | 178 | 11.2 (9.7–13.0) | 30 | 5.8 (4.1–8.3) | 75 | 5.7 (4.6–7.2) |
| Trimester 3 | 513 | 29.2 (26.8–31.9) | 340 | 19.4 (17.4–21.6) | 103 | 18.2 (15.0–22.1) | 355 | 19.7 (17.7–21.9) |
| Rund um die Geburt | 115 | 154.6 (128.8–185.6) | 79 | 106.1 (85.1–132.3) | 34 | 142.8 (102.0–199.8) | –
| |
| Postpartal | 649 | 42.3 (39.2–45.7) | 509 | 33.1 (30.4–36.1) | 135 | 27.4 (23.1–32.4) | 218 | 17.5 (15.3–20.0) |
| Frühes Postpartum | 584 | 75.4 (69.6–81.8) | 460 | 59.3 (54.1–65.0) | 177 | 46.8 (39.1–56.1) | 199 | 30.4 (26.4–35.0) |
| Spät postpartal | 65 | 8.5 (7.0–10.9) | 49 | 6.4 (4.9–8.5) | 18 | 7.3 (4.6–11.6) | 319 | 3.2 (1.9–5.0) |
| Inzidenzraten (IRRs) der ersten VTE während der Schwangerschaft und im Wochenbett | ||||||||
| Schwedische Daten A | Schwedische Daten B | Englische Daten | Dänische Daten | |||||
| Zeitabschnitt | IRR* (95% CI) | IRR* (95% CI) | IRR (95% CI)† | IRR (95% CI)† | ||||
| Außerhalb der Schwangerschaft | Referenz (d. h. 1,00)
| |||||||
| Vor der Geburt | 5.08 (4.66–5.54) | 3.80 (3.44–4.19) | 3.10 (2.63–3.66) | 2.95 (2.68–3.25) | ||||
| Trimester 1 | 3.42 (2.95–3.98) | 3.04 (2.58–3.56) | 1.46 (0.96–2.20) | 1.12 (0.86–1.45) | ||||
| Trimester 2 | 4.31 (3.78–4.93) | 3.01 (2.56–3.53) | 1.82 (1.27–2.62) | 1.58 (1.24–1.99) | ||||
| Trimester 3 | 7.14 (6.43–7.94) | 5.12 (4.53–5.80) | 5.69 (4.66–6.95) | 5.48 (4.89–6.12) | ||||
| Rund um die Geburt | 37.5 (30.9–44.45) | 27.97 (22.24–35.17) | 44.5 (31.68–62.54) | –
| ||||
| Postpartal | 10.21 (9.27–11.25) | 8.72 (7.83–9.70) | 8.54 (7.16–10.19) | 4.85 (4.21–5.57) | ||||
| Frühes Postpartum | 19.27 (16.53–20.21) | 15.62 (14.00–17.45) | 14.61 (12.10–17.67) | 8.44 (7.27–9.75) | ||||
| Spät postpartal | 2.06 (1.60–2.64) | 1.69 (1.26–2.25) | 2.29 (1.44–3.65) | 0.89 (0.53–1.39) | ||||
| Anmerkungen: Schwedische Daten A = Verwendung eines beliebigen Codes für VTE, unabhängig von der Bestätigung. Schwedische Daten B = Verwendung von nur durch den Algorithmus bestätigten VTE. Frühes Postpartum = Die ersten 6 Wochen nach der Entbindung. Spätes postpartales Stadium = Mehr als 6 Wochen nach der Entbindung. * = Bereinigt um Alter und Kalenderjahr. † = Unbereinigtes Verhältnis, das auf der Grundlage der bereitgestellten Daten berechnet wurde. Quelle: | ||||||||
Andere Funktionen
Estradiol hat komplexe Auswirkungen auf die Leber. Es beeinflusst die Produktion mehrerer Proteine, darunter Lipoproteine, Bindungsproteine und Proteine, die für die Blutgerinnung verantwortlich sind. In hohen Mengen kann Estradiol zu Cholestase führen, z. B. Cholestase in der Schwangerschaft. ⓘ
Bestimmte gynäkologische Erkrankungen sind von Östrogen abhängig, z. B. Endometriose, Leiomyomata uteri und Gebärmutterblutungen. ⓘ
Biologische Aktivität
Estradiol wirkt in erster Linie als Agonist des Östrogenrezeptors (ER), eines nukleären Steroidhormonrezeptors. Es gibt zwei Subtypen des ER, ERα und ERβ, und Estradiol bindet stark an beide Rezeptoren und aktiviert sie. Das Ergebnis der ER-Aktivierung ist eine Modulation der Gentranskription und -expression in ER-exprimierenden Zellen, was der wichtigste Mechanismus ist, durch den Estradiol seine biologischen Wirkungen im Körper vermittelt. Estradiol wirkt auch als Agonist von membranständigen Östrogenrezeptoren (mER) wie GPER (GPR30), einem kürzlich entdeckten nicht-nuklearen Rezeptor für Estradiol, über den es eine Vielzahl von schnellen, nicht-genomischen Wirkungen vermitteln kann. Im Gegensatz zum ER scheint GPER selektiv für Östradiol zu sein und zeigt eine sehr geringe Affinität für andere endogene Östrogene wie Östron und Östriol. Zu den weiteren mERs neben GPER gehören ER-X, ERx und Gq-mER. ⓘ
ERα/ERβ sind im inaktiven Zustand in multimolekularen Chaperonkomplexen eingeschlossen, die um das Hitzeschockprotein 90 (HSP90) herum organisiert sind, p23-Protein und Immunophilin enthalten und sich überwiegend im Zytoplasma und teilweise im Zellkern befinden. Beim klassischen E2-Weg oder klassischen Östrogen-Weg gelangt Östradiol in das Zytoplasma, wo es mit den ERs interagiert. Nach der Bindung von E2 dissoziieren die ER von den molekularen Chaperonkomplexen und werden befähigt, sich zu dimerisieren, in den Zellkern zu wandern und an spezifische DNA-Sequenzen (Estrogen-Response-Element, ERE) zu binden, was die Gentranskription ermöglicht, die sich über Stunden und Tage hinziehen kann. ⓘ
Durch subkutane Injektion in Mäuse verabreicht, ist Estradiol etwa 10-mal stärker als Estron und etwa 100-mal stärker als Estriol. Als solches ist Estradiol das wichtigste Östrogen im Körper, obwohl die Rolle von Estron und Estriol als Östrogene nicht zu vernachlässigen ist. ⓘ
| Östrogen | ER RBA (%) | Gewicht der Gebärmutter (%) | Uterotrophie | LH-Spiegel (%) | SHBG RBA (%) |
|---|---|---|---|---|---|
| Kontrolle | – | 100 | – | 100 | – |
| Estradiol (E2) | 100 | 506 ± 20 | +++ | 12–19 | 100 |
| Estron (E1) | 11 ± 8 | 490 ± 22 | +++ | ? | 20 |
| Estriol (E3) | 10 ± 4 | 468 ± 30 | +++ | 8–18 | 3 |
| Östetrol (E4) | 0.5 ± 0.2 | ? | Inaktiv | ? | 1 |
| 17α-Estradiol | 4.2 ± 0.8 | ? | ? | ? | ? |
| 2-Hydroxyöstradiol | 24 ± 7 | 285 ± 8 | +b | 31–61 | 28 |
| 2-Methoxyestradiol | 0.05 ± 0.04 | 101 | Inaktiv | ? | 130 |
| 4-Hydroxyestradiol | 45 ± 12 | ? | ? | ? | ? |
| 4-Methoxyestradiol | 1.3 ± 0.2 | 260 | ++ | ? | 9 |
| 4-Fluorestradiola | 180 ± 43 | ? | +++ | ? | ? |
| 2-Hydroxyestradiol | 1.9 ± 0.8 | 130 ± 9 | Inaktiv | 110–142 | 8 |
| 2-Methoxyestradiol | 0.01 ± 0.00 | 103 ± 7 | Inaktiv | 95–100 | 120 |
| 4-Hydroxyestron | 11 ± 4 | 351 | ++ | 21–50 | 35 |
| 4-Methoxyestron | 0.13 ± 0.04 | 338 | ++ | 65–92 | 12 |
| 16α-Hydroxyestron | 2.8 ± 1.0 | 552 ± 42 | +++ | 7–24 | <0.5 |
| 2-Hydroxyestriol | 0.9 ± 0.3 | 302 | +b | ? | ? |
| 2-Methoxyestriol | 0.01 ± 0.00 | ? | Inaktiv | ? | 4 |
| Anmerkungen: Die Werte sind Mittelwerte ± SD oder Spannen. ER RBA = Relative Bindungsaffinität zu Östrogenrezeptoren des Uteruszytosols der Ratte. Uterusgewicht = Prozentuale Veränderung des uterinen Feuchtgewichts ovarektomierter Ratten nach 72 Stunden mit kontinuierlicher Verabreichung von 1 μg/Stunde über subkutan implantierte Osmosepumpen. LH-Spiegel = Spiegel des luteinisierenden Hormons im Vergleich zum Ausgangswert bei ovarektomierten Ratten nach 24 bis 72 Stunden kontinuierlicher Verabreichung über ein subkutanes Implantat. Fußnoten: a = Synthetisch (d. h. nicht endogen). b = Atypische uterotrophe Wirkung, die innerhalb von 48 Stunden abklingt (die uterotrophe Wirkung von Estradiol hält linear bis zu 72 Stunden an). Quellen: Siehe Vorlage. | |||||
Biochemie
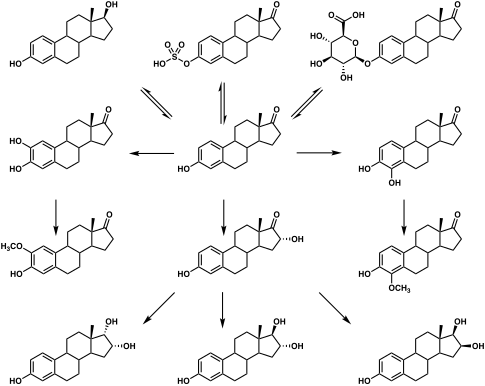
Im Organismus ist Cholesterol der Ausgangsstoff für die Estradiol-Synthese. Über Pregnenolon, Progesteron, 17α-Hydroxyprogesteron, Androst-4-en-3,17-dion, Testosteron und 19-Hydroxytestosteron entsteht durch eine Aromatase schlussendlich das Estradiol. Durch Oxidation der OH-Gruppe in 17 Position kann es in Estron überführt werden. Abgebaut wird Estradiol durch 4-Hydroxylierung mittels CYP1B1. ⓘ
Steroidhormone können als Lipide frei im Körper durch Zellmembranen diffundieren und aktivieren die Genexpression durch Bindung an den Rezeptor, welcher meist gleichzeitig ein Transkriptionsfaktor ist. Im Gegensatz zu vielen anderen Hormonen (zum Beispiel Adrenalin) müssen Steroidhormone in die Zielzelle eindringen. Im Cytosol der Zelle bindet das Hormon an seinen Hormonrezeptor (in diesem Falle an einen Estrogenrezeptor). Der Komplex aus Hormon und Rezeptor wird in den Zellkern transportiert. Dort wird die Transkription von mRNA bestimmter Gene veranlasst. Dies ist der erste Schritt zur Synthese von Proteinen. Seine volle Wirkung erreicht dieses Hormon erst nach Stunden, nicht innerhalb von Minuten, weil sein biologischer Effekt von der Synthese dieser neuen Proteine abhängt. ⓘ
Das Estradiol im Serum ist größtenteils an das sexualhormon-bindende Globulin und Albumin komplexiert. Etwa 2,21 % des Estradiols sind biologisch aktiv. Über den enterohepatischen Kreislauf wird ein Teil resorbiert. Estradiol wird durch Glucuronidierung und Sulfatierung in der Leber verstoffwechselt und im Urin ausgeschieden. ⓘ

Biosynthese
Estradiol wird, wie andere Steroidhormone, aus Cholesterin gewonnen. Nach Abspaltung der Seitenkette und über den Δ5- oder den Δ4-Weg ist Androstendion das wichtigste Zwischenprodukt. Ein Teil des Androstendions wird in Testosteron umgewandelt, das wiederum durch Aromatase in Estradiol umgewandelt wird. Auf einem alternativen Weg wird Androstendion zu Estron aromatisiert, das anschließend über 17β-Hydroxysteroid-Dehydrogenase (17β-HSD) in Östradiol umgewandelt wird. ⓘ
Während der Fortpflanzungszeit wird das meiste Östradiol bei Frauen von den Granulosazellen der Eierstöcke durch Aromatisierung von Androstendion (das in den Theca-Folliculi-Zellen gebildet wird) zu Östron produziert, gefolgt von der Umwandlung von Östron in Östradiol durch 17β-HSD. Kleinere Mengen von Estradiol werden auch von der Nebennierenrinde und bei Männern von den Hoden produziert. ⓘ
Estradiol wird nicht nur in den Keimdrüsen produziert; insbesondere die Fettzellen produzieren aktive Vorstufen von Estradiol, und zwar auch noch nach der Menopause. Estradiol wird auch im Gehirn und in den Arterienwänden gebildet. ⓘ
Bei Männern werden etwa 15 bis 25 % des zirkulierenden Östradiols in den Hoden produziert. Der Rest wird durch periphere Aromatisierung von Testosteron zu Estradiol und von Androstendion zu Estron synthetisiert (das dann über peripheres 17β-HSD in Estradiol umgewandelt wird). Diese periphere Aromatisierung findet vorwiegend im Fettgewebe statt, aber auch in anderen Geweben wie Knochen, Leber und Gehirn. Bei Männern werden pro Tag etwa 40 bis 50 µg Estradiol produziert. ⓘ
Verteilung
Im Plasma ist Estradiol weitgehend an SHBG und auch an Albumin gebunden. Nur ein Anteil von 2,21 % (± 0,04 %) ist frei und biologisch aktiv, wobei der Prozentsatz während des Menstruationszyklus konstant bleibt. ⓘ
Stoffwechsel
Stoffwechselwege von Estradiol beim Menschen
|
Die Inaktivierung von Östradiol umfasst die Umwandlung in weniger aktive Östrogene wie Estron und Estriol. Estriol ist der wichtigste Metabolit im Urin. Östradiol wird in der Leber zu Östrogenkonjugaten wie Östradiolsulfat und Östradiolglucuronid konjugiert und als solches über die Nieren ausgeschieden. Einige der wasserlöslichen Konjugate werden über die Gallenwege ausgeschieden und teilweise nach Hydrolyse aus dem Darmtrakt resorbiert. Dieser enterohepatische Kreislauf trägt zur Aufrechterhaltung des Estradiolspiegels bei. ⓘ
Estradiol wird auch durch Hydroxylierung zu Katecholöstrogenen metabolisiert. In der Leber wird es unspezifisch durch CYP1A2, CYP3A4 und CYP2C9 über 2-Hydroxylierung zu 2-Hydroxyestradiol und durch CYP2C9, CYP2C19 und CYP2C8 über 17β-Hydroxy-Dehydrierung zu Estron verstoffwechselt, wobei auch verschiedene andere Cytochrom P450 (CYP)-Enzyme und metabolische Umwandlungen beteiligt sind. ⓘ
Estradiol wird außerdem in gewissem Umfang mit einem Ester zu lipoiden Estradiolformen wie Estradiolpalmitat und Estradiolstearat konjugiert; diese Ester werden im Fettgewebe gespeichert und können als sehr lang anhaltendes Estradiolreservoir dienen. ⓘ
Ausscheidung
Estradiol wird in Form von Glucuronid- und Sulfat-Östrogenkonjugaten mit dem Urin ausgeschieden. Nach einer intravenösen Injektion von markiertem Estradiol bei Frauen werden fast 90 % innerhalb von 4 bis 5 Tagen mit dem Urin und den Fäkalien ausgeschieden. Die enterohepatische Rezirkulation verzögert die Ausscheidung von Östradiol. ⓘ
Spiegel

Die Östradiolspiegel prämenopausaler Frauen sind während des gesamten Menstruationszyklus sehr variabel, und die Referenzbereiche variieren stark von Quelle zu Quelle. Die Estradiolspiegel sind minimal und liegen nach Angaben der meisten Labors in der frühen bis mittleren Follikelphase (oder in der ersten Woche des Menstruationszyklus, auch als Menstruation bezeichnet) zwischen 20 und 80 pg/ml. Der Östradiolspiegel steigt während dieser Zeit und in der mittleren bis späten Follikelphase (oder der zweiten Woche des Menstruationszyklus) bis zur präovulatorischen Phase allmählich an. Während der Präovulationsphase (ein Zeitraum von etwa 24 bis 48 Stunden) steigt der Östradiolspiegel kurzzeitig an und erreicht die höchsten Konzentrationen während des gesamten Menstruationszyklus. Die zirkulierenden Werte liegen zu diesem Zeitpunkt in der Regel zwischen 130 und 200 pg/ml, können aber bei manchen Frauen auch 300 bis 400 pg/ml erreichen, und die obere Grenze des Referenzbereichs einiger Labors liegt sogar noch höher (z. B. 750 pg/ml). Nach dem Eisprung (oder in der Mitte des Zyklus) und während der zweiten Hälfte des Menstruationszyklus oder der Lutealphase erreicht der Östradiolspiegel ein Plateau und schwankt während der frühen und mittleren Lutealphase zwischen etwa 100 und 150 pg/ml und erreicht in der späten Lutealphase oder einige Tage vor der Menstruation einen Tiefstand von etwa 40 pg/ml. Die mittleren integrierten Östradiolspiegel während eines vollständigen Menstruationszyklus werden von verschiedenen Quellen mit 80, 120 und 150 pg/ml angegeben. Obwohl es widersprüchliche Berichte gibt, wurden in einer Studie mittlere integrierte Estradiolspiegel von 150 pg/ml bei jüngeren Frauen festgestellt, während die mittleren integrierten Spiegel bei älteren Frauen zwischen 50 und 120 pg/ml lagen. ⓘ
Während der reproduktiven Jahre der Frau sind die Estradiolspiegel etwas höher als die von Estron, außer in der frühen Follikelphase des Menstruationszyklus; daher kann Estradiol als das vorherrschende Estrogen während der reproduktiven Jahre der Frau angesehen werden, was die absoluten Serumspiegel und die estrogene Aktivität betrifft. Während der Schwangerschaft wird Estriol zum vorherrschenden zirkulierenden Östrogen, und dies ist die einzige Zeit, in der Estron im Körper vorkommt, während in den Wechseljahren Estron vorherrscht (beide auf der Grundlage der Serumspiegel). Das von männlichen Menschen aus Testosteron produzierte Östradiol liegt in Serumkonzentrationen vor, die in etwa mit denen postmenopausaler Frauen vergleichbar sind (14-55 bzw. <35 pg/ml). Es wurde auch berichtet, dass die Östradiolkonzentrationen eines 70-jährigen Mannes im Vergleich zu denen einer 70-jährigen Frau beim Mann etwa 2- bis 4-mal höher sind. ⓘ
| Gruppe | E2 (prod) | E2 (Spiegel) | E1 (Spiegel) | Verhältnis |
|---|---|---|---|---|
| Pubertierende Mädchena Tanner-Stadium I (Kindheit) Tanner-Stadium II (8-12 Jahre) Tanner-Stadium III (Alter 10-13) Tanner-Stadium IV (Alter 11-14) Tanner-Stadium V (12-15 Jahre) Follikelphase (Tage 1-14) Luteal (Tage 15-28) |
? ? ? ? ? ? |
9 (<9-20) pg/ml 15 (<9-30) pg/ml 27 (<9-60) pg/mL 55 (16-85) pg/ml 50 (30-100) pg/ml 130 (70-300) pg/mL |
13 (<9-23) pg/mL 18 (10-37) pg/mL 26 (17-58) pg/mL 36 (23-69) pg/mL 44 (30-89) pg/mL 75 (39-160) pg/mL |
? ? ? ? ? ? |
| Vorpubertäre Jungen | ? | 2-8 pg/mL | ? | ? |
| Prämenopausale Frauen Frühe Follikelphase (Tage 1-4) Mittlere Follikelphase (Tage 5-9) Späte Follikelphase (Tage 10-14) Lutealphase (Tage 15-28) Orale Verhütungsmittel (anovulatorisch) |
30-100 µg/Tag 100-160 µg/Tag 320-640 µg/Tag 300 µg/Tag ? |
40-60 pg/ml 60-100 pg/ml 200-400 pg/ml 190 pg/ml 12-50 pg/ml |
40-60 pg/ml ? 170-200 pg/ml 100-150 pg/ml ? |
0.5–1 ? 1–2 1.5 ? |
| Postmenopausale Frauen | 18 µg/Tag | 5-20 pg/ml | 30-70 pg/ml | 0.3–0.8 |
| Schwangere Frauen Erstes Trimester (Wochen 1-12) Zweites Trimester (13-26 Wochen) Drittes Trimester (Wochen 27-40) |
? ? ? |
1.000-5.000 pg/ml 5.000-15.000 pg/ml 10.000-40.000 pg/ml |
? ? ? |
? ? ? |
| Mena | 20-60 µg/Tag | 27 (20-55) pg/mL | 20-90 pg/ml | 0.4–0.6 |
| Fußnoten: a = Format ist "Mittelwert (Bereich)" oder nur "Bereich". Quellen: Siehe Vorlage. | ||||
Messung
Bei Frauen wird das Serumöstradiol in einem klinischen Labor gemessen und spiegelt in erster Linie die Aktivität der Eierstöcke wider. Der Estradiol-Bluttest misst die Menge an Estradiol im Blut. Er wird verwendet, um die Funktion der Eierstöcke, der Plazenta und der Nebennieren zu überprüfen. Auf diese Weise kann der Östrogen-Grundwert bei Frauen mit Amenorrhoe oder Menstruationsstörungen ermittelt und der Zustand der Hypoöstrogenität und der Menopause festgestellt werden. Darüber hinaus dient die Östrogenüberwachung während der Fertilitätstherapie der Beurteilung des Follikelwachstums und ist für die Überwachung der Behandlung nützlich. Östrogenproduzierende Tumoren weisen anhaltend hohe Konzentrationen von Östradiol und anderen Östrogenen auf. Bei frühzeitiger Pubertät sind die Östradiolspiegel unangemessen erhöht. ⓘ
Wertebereiche
Einzelne Laborergebnisse sollten immer anhand der Bereiche interpretiert werden, die von dem Labor, das den Test durchgeführt hat, angegeben wurden. ⓘ
| Patiententyp | Untere Grenze | Oberer Grenzwert | Einheit |
|---|---|---|---|
| Erwachsener Mann | 50 | 200 | pmol/L |
| 14 | 55 | pg/ml | |
| Erwachsene Frau (Follikel Phase, Tag 5) |
70 95% PI (Standard) |
500 95% PI |
pmol/L |
| 110 90% PI (verwendet im Diagramm) |
220 90% PI | ||
| 19 (95% PI) | 140 (95% PI) | pg/ml | |
| 30 (90% PI) | 60 (90% PI) | ||
| Erwachsene Frau (präovulatorischer Höhepunkt) |
400 | 1500 | pmol/L |
| 110 | 410 | pg/ml | |
| Erwachsene Frau (Lutealphase) |
70 | 600 | pmol/L |
| 19 | 160 | pg/ml | |
| Erwachsene Frau - frei (nicht proteingebunden) |
0.5 | 9 | pg/ml |
| 1.7 | 33 | pmol/L | |
| Postmenopausale Frau | K.A. | < 130 | pmol/L |
| K.A. | < 35 | pg/ml |
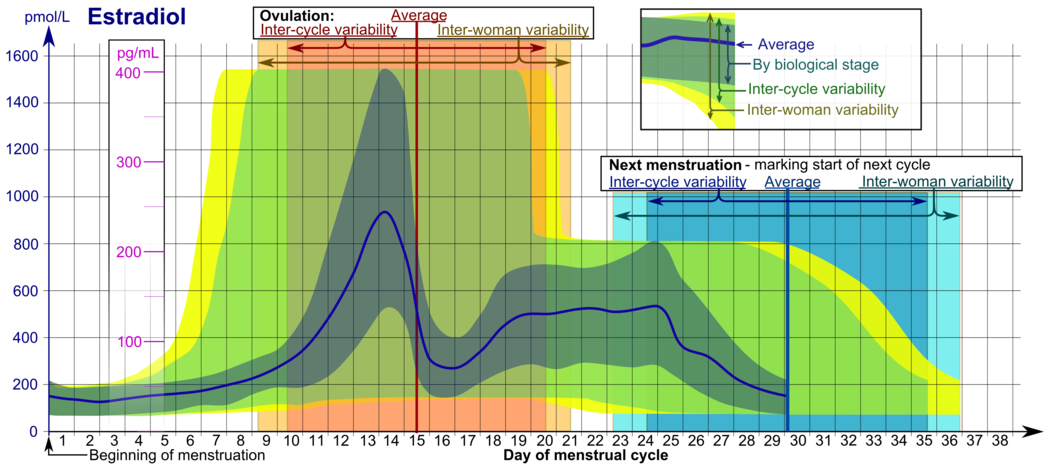
- Die mit Nach biologischem Stadium bezeichneten Bereiche können bei engmaschig überwachten Menstruationszyklen im Hinblick auf andere Marker des biologischen Verlaufs verwendet werden, wobei die Zeitskala komprimiert oder gedehnt wird, um zu zeigen, wie viel schneller bzw. langsamer der Zyklus im Vergleich zu einem durchschnittlichen Zyklus verläuft.
- Die mit "Inter-Zyklus-Variabilität" bezeichneten Bereiche eignen sich besser für nicht überwachte Zyklen, bei denen nur der Beginn der Menstruation bekannt ist, die Frau aber ihre durchschnittlichen Zykluslängen und den Zeitpunkt des Eisprungs genau kennt und weiß, dass diese einigermaßen durchschnittlich regelmäßig sind, wobei die Zeitskala dahingehend gestaucht oder gedehnt wird, um wie viel die durchschnittliche Zykluslänge der Frau kürzer bzw. länger ist als der Durchschnitt der Bevölkerung.
- Die mit Inter-Frau-Variabilität bezeichneten Bereiche sind besser geeignet, wenn die durchschnittlichen Zykluslängen und der Zeitpunkt des Eisprungs nicht bekannt sind, sondern nur der Beginn der Menstruation angegeben wird. ⓘ
Im normalen Menstruationszyklus liegt der Östradiolspiegel bei der Menstruation typischerweise bei <50 pg/ml, steigt mit der Follikelentwicklung an (Höchstwert: 200 pg/ml), fällt beim Eisprung kurzzeitig ab und steigt während der Lutealphase für einen zweiten Höchstwert wieder an. Am Ende der Lutealphase sinkt der Östradiolspiegel auf das Niveau der Menstruation, es sei denn, es besteht eine Schwangerschaft. ⓘ
Während der Schwangerschaft steigen die Östrogenspiegel, einschließlich Östradiol, bis zum Ende der Schwangerschaft stetig an. Die Quelle dieser Östrogene ist die Plazenta, die die in der fetalen Nebenniere produzierten Prohormone aromatisiert. ⓘ
| Geschlecht | Sexualhormon | Fortpflanzung Phase |
Blut Produktionsrate |
Keimdrüsen Sekretionsrate |
Stoffwechsel Clearance-Rate |
Referenzbereich (Serumspiegel) | |
|---|---|---|---|---|---|---|---|
| SI-Einheiten | Nicht-SI-Einheiten | ||||||
| Männer | Androstendion | –
|
2,8 mg/Tag | 1,6 mg/Tag | 2200 L/Tag | 2,8-7,3 nmol/L | 80-210 ng/dL |
| Testosteron | –
|
6,5 mg/Tag | 6,2 mg/Tag | 950 L/Tag | 6,9-34,7 nmol/L | 200-1000 ng/dL | |
| Estron | –
|
150 μg/Tag | 110 μg/Tag | 2050 L/Tag | 37-250 pmol/L | 10-70 pg/ml | |
| Estradiol | –
|
60 μg/Tag | 50 μg/Tag | 1600 L/Tag | <37-210 pmol/L | 10-57 pg/ml | |
| Estron-Sulfat | –
|
80 μg/Tag | Unbedeutend | 167 L/Tag | 600-2500 pmol/L | 200-900 pg/ml | |
| Frauen | Androstendion | –
|
3,2 mg/Tag | 2,8 mg/Tag | 2000 L/Tag | 3,1-12,2 nmol/L | 89-350 ng/dL |
| Testosteron | –
|
190 μg/Tag | 60 μg/Tag | 500 L/Tag | 0,7-2,8 nmol/L | 20-81 ng/dL | |
| Estron | Follikuläre Phase | 110 μg/Tag | 80 μg/Tag | 2200 L/Tag | 110-400 pmol/L | 30-110 pg/ml | |
| Lutealphase | 260 μg/Tag | 150 μg/Tag | 2200 L/Tag | 310-660 pmol/L | 80-180 pg/ml | ||
| Postmenopause | 40 μg/Tag | Unbedeutend | 1610 L/Tag | 22-230 pmol/L | 6-60 pg/ml | ||
| Estradiol | Follikuläre Phase | 90 μg/Tag | 80 μg/Tag | 1200 L/Tag | <37-360 pmol/L | 10-98 pg/ml | |
| Lutealphase | 250 μg/Tag | 240 μg/Tag | 1200 L/Tag | 699-1250 pmol/L | 190-341 pg/ml | ||
| Postmenopause | 6 μg/Tag | Unbedeutend | 910 L/Tag | <37-140 pmol/L | 10-38 pg/ml | ||
| Estron-Sulfat | Follikuläre Phase | 100 μg/Tag | Unbedeutend | 146 L/Tag | 700-3600 pmol/L | 250-1300 pg/ml | |
| Lutealphase | 180 μg/Tag | Unbedeutend | 146 L/Tag | 1100-7300 pmol/L | 400-2600 pg/ml | ||
| Progesteron | Follikuläre Phase | 2 mg/Tag | 1,7 mg/Tag | 2100 L/Tag | 0,3-3 nmol/L | 0,1-0,9 ng/ml | |
| Lutealphase | 25 mg/Tag | 24 mg/Tag | 2100 L/Tag | 19-45 nmol/L | 6-14 ng/ml | ||
Anmerkungen und Quellen
Anmerkungen: "Die Konzentration eines Steroids im Blutkreislauf wird durch die Geschwindigkeit bestimmt, mit der es aus den Drüsen ausgeschieden wird, durch die Geschwindigkeit, mit der Vorläufer- oder Prähormone in das Steroid umgewandelt werden, und durch die Geschwindigkeit, mit der es von den Geweben extrahiert und metabolisiert wird. Die Sekretionsrate eines Steroids bezieht sich auf die Gesamtausscheidung der Verbindung aus einer Drüse pro Zeiteinheit. Die Sekretionsraten wurden durch die Entnahme von Proben aus dem venösen Ausfluss einer Drüse über einen bestimmten Zeitraum und durch Subtraktion der arteriellen und peripheren venösen Hormonkonzentration ermittelt. Die metabolische Clearance-Rate eines Steroids ist definiert als das Blutvolumen, das pro Zeiteinheit vollständig von dem Hormon abgebaut wurde. Die Produktionsrate eines Steroidhormons bezieht sich auf den Eintritt der Verbindung in das Blut aus allen möglichen Quellen, einschließlich der Sekretion aus Drüsen und der Umwandlung von Prohormonen in das Steroid von Interesse. Im Fließgleichgewicht ist die Menge des Hormons, die aus allen Quellen ins Blut gelangt, gleich der Rate, mit der es abgebaut wird (metabolische Clearance-Rate), multipliziert mit der Blutkonzentration (Produktionsrate = metabolische Clearance-Rate × Konzentration). Wenn der Prohormonstoffwechsel nur wenig zum zirkulierenden Steroidpool beiträgt, entspricht die Produktionsrate ungefähr der Sekretionsrate." Quellen: Siehe Vorlage. | |||||||
Medizinische Verwendung
Estradiol wird als Medikament verwendet, vor allem in der Hormontherapie bei Wechseljahrsbeschwerden sowie in der Hormonersatztherapie für Transgender. ⓘ
Chemie
Strukturen der wichtigsten endogenen Östrogene
|
Estradiol ist ein Estron-Steroid. Es ist auch als 17β-Estradiol (zur Unterscheidung von 17α-Estradiol) oder als Estra-1,3,5(10)-Trien-3,17β-diol bekannt. Es hat zwei Hydroxylgruppen, eine an der C3-Position und die andere an der 17β-Position, sowie drei Doppelbindungen im A-Ring. Aufgrund seiner zwei Hydroxylgruppen wird Estradiol häufig als E2 abgekürzt. Die strukturell verwandten Östrogene Estron (E1), Estriol (E3) und Estetrol (E4) haben eine, drei bzw. vier Hydroxylgruppen. ⓘ
Neuropsychopharmakologie
In einer randomisierten, doppelblinden, placebokontrollierten Studie wurde gezeigt, dass Estradiol geschlechtsspezifische Auswirkungen auf die Fairness-Sensibilität hat. Wenn die Aufteilung eines bestimmten Geldbetrages in einer modifizierten Version des Ultimatumspiels als fair oder unfair dargestellt wurde, erhöhte Estradiol die Akzeptanzrate der fair dargestellten Vorschläge bei Männern und verringerte sie bei Frauen. In der Placebo-Gruppe hingegen "erhöhte allein der Glaube an eine Estradiol-Behandlung bei beiden Geschlechtern signifikant die Akzeptanz von Angeboten mit ungerechtem Rahmen", was darauf hindeutet, dass so genannte "Umweltfaktoren" eine Rolle bei der Organisation der Reaktionen auf diese Darstellungen des Ultimatumspiels spielen. ⓘ
Geschichte
Die Entdeckung des Östrogens wird gewöhnlich den amerikanischen Wissenschaftlern Edgar Allen und Edward A. Doisy zugeschrieben. Im Jahr 1923 beobachteten sie, dass die Injektion von Flüssigkeit aus Schweine-Eierstockfollikeln bei geschlechtsreifen, ovarektomierten Mäusen und Ratten pubertäre und östrogenähnliche Veränderungen (einschließlich Veränderungen der Scheide, der Gebärmutter und der Brustdrüsen sowie der sexuellen Empfänglichkeit) hervorrief. Diese Ergebnisse belegten die Existenz eines Hormons, das von den Eierstöcken produziert wird und an der sexuellen Reifung und Fortpflanzung beteiligt ist. Zum Zeitpunkt seiner Entdeckung gaben Allen und Doisy dem Hormon keinen Namen und bezeichneten es einfach als "Ovarialhormon" oder "Follikelhormon"; andere bezeichneten es als Feminin, Folliculin, Menformon, Thelykinin und Emmenin. 1926 prägten Parkes und Bellerby den Begriff Estrin für das Hormon, weil es bei Tieren den Östrus auslöst. Estron wurde 1929 unabhängig voneinander von Allen und Doisy und dem deutschen Wissenschaftler Adolf Butenandt isoliert und gereinigt, und Estriol wurde 1930 von Marrian isoliert und gereinigt; sie waren die ersten Östrogene, die identifiziert wurden. ⓘ
Estradiol, das stärkste der drei wichtigsten Östrogene, wurde als letztes der drei identifiziert. Es wurde 1933 von Schwenk und Hildebrant entdeckt, die es durch Reduktion von Estron synthetisierten. Estradiol wurde dann 1935 von Doisy aus den Eierstöcken von Sauen isoliert und gereinigt, wobei gleichzeitig seine chemische Struktur bestimmt wurde, und wurde unter den Bezeichnungen Dihydrotheelin, Dihydrofolliculin, Dihydrofollikelhormon und Dihydroxyestrin bekannt. 1935 wurden der Name Estradiol und der Begriff Östrogen vom Ausschuss für Sexualhormone der Gesundheitsorganisation des Völkerbundes formell festgelegt, nachdem 1932 auf der ersten Sitzung der Internationalen Konferenz zur Standardisierung von Sexualhormonen in London die Namen Estron (ursprünglich Theelin, Progynon, Folliculin und Ketohydroxyestrin) und Estriol (ursprünglich Theelol und Trihydroxyestrin) festgelegt worden waren. Nach seiner Entdeckung wurde 1940 von Inhoffen und Hohlweg eine Teilsynthese von Estradiol aus Cholesterin und 1948 von Anner und Miescher eine Totalsynthese entwickelt. ⓘ
Gesellschaft und Kultur
Etymologie
Der Name Estradiol leitet sich von estra-, Gk. οἶστρος (oistros, wörtlich "Schwung oder Eingebung"), das sich auf das Steroidringsystem des Östradiols bezieht, und -diol, einem chemischen Begriff und Suffix, das anzeigt, dass es sich bei der Verbindung um eine Art Alkohol mit zwei Hydroxylgruppen handelt. ⓘ
Derivate des Estradiols
- Ethinylestradiol, häufig die estrogene Komponente in Kombinationspräparaten der Antibabypille
- Mestranol, ein Prodrug (eine inaktive Vorstufe) von Ethinylestradiol ⓘ
Handelsnamen
Monopräparate ⓘ
Climara (CH), Dermestril (D), Divigel (CH), Estraderm (D), Estradot (D, A, CH), Estramon (D, A, CH), Estreva (D), Estrifam (D), Estring (D, CH), Estrofem (CH), Estronorm (D), Fem7 (D), Femoston mono (D, CH), Gynokadin (D), GynPolar (D), Klimapur (A), Oestrogel (CH), Sandrena (CH), Systen (CH), Vagifem (CH), Generika (D), Linoladiol N Creme (D) ⓘ
Kombinationspräparate ⓘ
Activelle (D, A, CH), Angeliq (D, A, CH), Climen (CH), Clionara (D), Cutanum (D), Estalis (D, A, CH), Estragest (D, CH), Fem7 Combi (D), Femoston (D, A, CH), Gynamon (D), Gynodian (CH), Indivina (CH), Kliogest (D, A, CH), Merigest (CH), Novofem (D, CH), Osmil (D), Sequidot (D), Triaval (CH), Trisequenz (A, CH) ⓘ