Fettgewebe
| Fettgewebe ⓘ | |
|---|---|
 Das Fettgewebe ist eine der wichtigsten Arten von Bindegewebe. | |
 Morphologie der drei verschiedenen Klassen von Adipozyten. | |
| Aussprache | /ˈædɪˌpoʊs/ ( |
| Anatomische Terminologie (Bearbeiten auf Wikidata) | |
Fettgewebe, Körperfett oder einfach nur Fett ist ein lockeres Bindegewebe, das hauptsächlich aus Adipozyten besteht. Zusätzlich zu den Fettzellen enthält das Fettgewebe die stromale vaskuläre Fraktion (SVF) von Zellen wie Präadipozyten, Fibroblasten, vaskuläre Endothelzellen und eine Vielzahl von Immunzellen wie Fettgewebsmakrophagen. Das Fettgewebe entsteht aus Präadipozyten. Seine Hauptaufgabe besteht darin, Energie in Form von Lipiden zu speichern, obwohl es den Körper auch polstert und isoliert. Das Fettgewebe ist keineswegs hormonell träge, sondern hat sich in den letzten Jahren als wichtiges endokrines Organ erwiesen, da es Hormone wie Leptin, Östrogen, Resistin und Zytokine (insbesondere TNFα) produziert. Bei Adipositas ist das Fettgewebe auch an der chronischen Freisetzung von entzündungsfördernden Markern, den so genannten Adipokinen, beteiligt, die für die Entwicklung des metabolischen Syndroms verantwortlich sind, einer Konstellation von Krankheiten, zu denen unter anderem Typ-2-Diabetes, Herz-Kreislauf-Erkrankungen und Atherosklerose gehören. Es gibt zwei Arten von Fettgewebe: das weiße Fettgewebe (WAT), das Energie speichert, und das braune Fettgewebe (BAT), das Körperwärme erzeugt. Die Bildung von Fettgewebe wird offenbar zum Teil durch das Adipose-Gen gesteuert. Das Fettgewebe - genauer gesagt das braune Fettgewebe - wurde erstmals 1551 von dem Schweizer Naturforscher Conrad Gessner entdeckt. ⓘ
Anatomische Merkmale
Einzelne oder Gruppen von Fettzellen können fast überall im Körper, eingelagert in das lockere Bindegewebe, vorkommen. Im eigentlichen Fettgewebe in bestimmten Körperregionen dagegen sind zahlreiche Fettzellen durch Bindegewebe in Läppchen zusammengefasst. Das Fettgewebe ist immer gut mit Blutgefäßen versorgt. ⓘ
Das weiße Fettgewebe erfüllt verschiedene Funktionen:
- Speicher- oder Depotfett: Lipide sind energiereiche Verbindungen. Durch den hohen Fettanteil des Körpers hat der Mensch Reserven, um mehrere Wochen ohne Nahrungszufuhr auszukommen. Je nach Geschlecht und Ernährungszustand macht das Depotfett 10 % (Sportler, extrem schlanke Menschen), 15–25 % (Normalgewicht), oder bis weit über 50 % (fettleibige Menschen) des Körpergewichtes aus. Die Funktion als Depotfett erfüllt vor allem das Fettgewebe in der Unterhaut (Subkutis), hier hauptsächlich die Speckschicht am Bauch und den Gesäßbacken (ausgeprägte Fettdepots), und am Bauchfell.
- Isolierfett: Da Fett ein schlechterer Wärmeleiter als andere Gewebe ist, eignet es sich als Wärmedämmung des Körpers. Es schützt vor allem auch das Fett (Speckschicht) in der Unterhaut (subkutanes Fett) vor zu schnellem Wärmeverlust. In der Unterhaut liegen etwa 65 % des Gesamtfettes vor, der Rest liegt im Bauchraum.
- Baufett: Fettgewebe dient an bestimmten Stellen auch als mechanischer Schutz in Form eines druckelastischen Polsters (Fettpolster): unter der Fußsohle, an Gelenken (im Kniegelenk als Hoffa-Fettkörper), an der Wange (Corpus adiposum buccae, auch Bichat-Fettpfropf), am Gesäß sowie als Organlager im Nierenlager (Capsula adiposa), bei den Herzkranzgefäßen und unter dem Augapfel (Corpus adiposum orbitae). Das Baufett wird bei Nahrungsmangel erst als letzte Reserve mobilisiert – hierher rühren die tiefen, eingefallenen Augen von Menschen nach Hungerkatastrophen.
- Stoffwechselorgan: Das Fettgewebe spielt eine wichtige Rolle im Energiestoffwechsel durch Sekretion hormonartiger Substanzen. ⓘ
An einigen Körperstellen ist das Unterhautfettgewebe im Regelfall nur sehr schwach ausgeprägt (Hand- und Fußrücken, Nase, Augenlid, Lippe, Penis und Hodensack, kl. Schamlippe sowie an der Ohrmuschel (aber nicht Ohrläppchen)). Besonders ausgeprägte Fettdepots befinden sich als mehrere Zentimeter dicke Schicht am Bauch und an den Gesäßbacken. Die Dicke des Bauches sowie Form, Größe und Gewicht der Gesäßbacken werden dabei durch den Trainingszustand der Muskulatur und die Menge des eingelagerten Fettes (Mastfett) bestimmt, hängen also auch vom Ernährungszustand ab. Die Menge des Depotfettes beträgt bei Normalgewichtigen etwa 15 kg bei Männern und etwa 15–20 kg bei Frauen. ⓘ
Fettzellen (Adipozyten) werden vom Körper zwar abgebaut, doch auch ständig wieder durch neue ersetzt, wobei auch das intrazelluläre Fett einem ständigen Austausch unterliegt. Durch Diäten kann daher zwar das im Fettgewebe gespeicherte Fett, nicht jedoch das Fettgewebe selbst abgebaut werden. ⓘ

Beim Menschen befindet sich das Fettgewebe unter der Haut (subkutanes Fett), um die inneren Organe (viszerales Fett), im Knochenmark (gelbes Knochenmark), zwischen den Muskeln (Muskulatur) und in der Brust (Brustgewebe). Das Fettgewebe befindet sich an bestimmten Stellen, die als Fettdepots bezeichnet werden. Neben den Adipozyten, die den größten Prozentsatz der Zellen im Fettgewebe ausmachen, gibt es noch andere Zelltypen, die unter dem Begriff stromale vaskuläre Fraktion (SVF) zusammengefasst werden. Zur SVF gehören Präadipozyten, Fibroblasten, Makrophagen des Fettgewebes und Endothelzellen. ⓘ
Das Fettgewebe enthält viele kleine Blutgefäße. Im integumentären System, zu dem auch die Haut gehört, sammelt es sich in der tiefsten Schicht, der subkutanen Schicht, an und dient der Isolierung gegen Hitze und Kälte. Um die Organe herum bildet es eine schützende Unterlage. Seine Hauptfunktion besteht jedoch darin, als Lipidreserve zu fungieren, die oxidiert werden kann, um den Energiebedarf des Körpers zu decken und ihn vor überschüssiger Glukose zu schützen, indem es Triglyceride speichert, die von der Leber aus Zucker hergestellt werden, obwohl es Hinweise darauf gibt, dass der größte Teil der Lipidsynthese aus Kohlenhydraten im Fettgewebe selbst stattfindet. Die Fettdepots in den verschiedenen Teilen des Körpers haben unterschiedliche biochemische Profile. Unter normalen Bedingungen liefert es dem Gehirn Rückmeldungen über Hunger und Ernährung. ⓘ
Mäuse

Mäuse haben acht Hauptfettdepots, von denen sich vier in der Bauchhöhle befinden. Die paarigen Gonadendepots sind bei weiblichen Tieren mit der Gebärmutter und den Eierstöcken und bei männlichen Tieren mit den Nebenhoden und den Hoden verbunden; die paarigen Retroperitonealdepots befinden sich entlang der dorsalen Bauchwand, umgeben die Niere und reichen, wenn sie massiv sind, bis in das Becken. Das Mesenterialdepot bildet ein leimartiges Geflecht, das den Darm und das Omentaldepot (das in der Nähe des Magens und der Milz entspringt) stützt und sich - wenn es massiv ist - bis in den Bauchraum hinein erstreckt. Sowohl das Mesenterial- als auch das Omentaldepot enthalten viel lymphatisches Gewebe in Form von Lymphknoten bzw. milchigen Flecken. ⓘ
Die beiden oberflächlichen Depots sind die paarigen Inguinaldepots, die sich vor dem oberen Segment der Hintergliedmaßen (unter der Haut) befinden, und die Subscapulardepots, paarige mediale Mischungen aus braunem Fettgewebe neben Regionen mit weißem Fettgewebe, die sich unter der Haut zwischen den dorsalen Kämmen der Schulterblätter befinden. Die Schicht des braunen Fettgewebes in diesem Depot ist oft von einem "Zuckerguss" aus weißem Fettgewebe bedeckt; manchmal sind diese beiden Arten von Fett (braun und weiß) schwer zu unterscheiden. Die Leistendepots umschließen die Leistenlymphknotengruppe. Zu den kleineren Depots gehören das Perikarddepot, das das Herz umgibt, und die paarigen Poplitealdepots zwischen den großen Muskeln hinter den Knien, die jeweils einen großen Lymphknoten enthalten. Von allen Depots der Maus sind die Keimdrüsendepots die größten und am leichtesten zu sezierenden; sie machen etwa 30 % des sezierbaren Fetts aus. ⓘ
Fettleibigkeit
Bei einer fettleibigen Person hängt überschüssiges Fettgewebe vom Bauch herab und wird als Panniculus bezeichnet. Ein Pannikulus erschwert die Operation eines krankhaft fettleibigen Menschen. Er kann als buchstäbliche "Hautschürze" zurückbleiben, wenn eine stark fettleibige Person große Mengen an Fett verliert (eine häufige Folge von Magenbypassoperationen). Fettleibigkeit wird durch Bewegung, Diät und Verhaltenstherapie behandelt. Die rekonstruktive Chirurgie ist ein Aspekt der Behandlung. ⓘ
Viszerales Fett
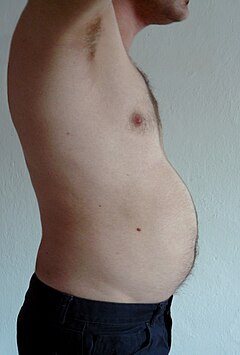
Viszerales Fett oder Bauchfett (auch als Organfett oder intraabdominales Fett bezeichnet) befindet sich in der Bauchhöhle, gepackt zwischen den Organen (Magen, Leber, Darm, Nieren usw.). Das viszerale Fett unterscheidet sich vom subkutanen Fett unter der Haut und vom intramuskulären Fett, das in den Skelettmuskeln eingelagert ist. Das Fett im Unterkörper, wie in den Oberschenkeln und im Gesäß, ist subkutan und besteht nicht aus gleichmäßig verteiltem Gewebe, während das Fett im Bauchraum meist viszeral und halbflüssig ist. Viszerales Fett setzt sich aus mehreren Fettdepots zusammen, darunter mesenteriales, epididymales weißes Fettgewebe (EWAT) und perirenale Depots. Viszerales Fett wird häufig als Fläche in cm2 ausgedrückt (VFA, visceral fat area). ⓘ
Ein Übermaß an viszeralem Fett ist als abdominale Adipositas oder "Bauchfett" bekannt, bei der der Bauch übermäßig vorsteht. Neuere Entwicklungen wie der Body-Volume-Index (BVI) sind speziell auf die Messung des Bauchvolumens und des Bauchfetts ausgerichtet. Überschüssiges viszerales Fett wird auch mit Typ-2-Diabetes, Insulinresistenz, entzündlichen Erkrankungen und anderen mit Fettleibigkeit verbundenen Krankheiten in Verbindung gebracht. Ebenso hat sich gezeigt, dass die Ansammlung von Halsfett (oder zervikalem Fettgewebe) mit der Sterblichkeit in Verbindung steht. Mehrere Studien haben gezeigt, dass viszerales Fett anhand einfacher anthropometrischer Maße vorhergesagt werden kann und die Sterblichkeit genauer vorhersagt als der Body-Mass-Index oder der Taillenumfang. ⓘ
Bei Männern ist die Wahrscheinlichkeit höher, dass sie Fett im Bauchraum speichern, was auf die Unterschiede zwischen den Geschlechtshormonen zurückzuführen ist. Östrogen (weibliches Geschlechtshormon) bewirkt bei Frauen, dass Fett im Gesäß, in den Oberschenkeln und in den Hüften gespeichert wird. Wenn Frauen in die Wechseljahre kommen und das von den Eierstöcken produzierte Östrogen nachlässt, wandert das Fett vom Gesäß, den Hüften und den Oberschenkeln zur Taille; später wird das Fett im Bauchraum gespeichert. ⓘ
Viszerales Fett kann durch einen zu hohen Cortisolspiegel verursacht werden. Mindestens 10 MET-Stunden pro Woche aerobes Training führt zu einer Verringerung des viszeralen Fettes bei Personen ohne Stoffwechselstörungen. Widerstandstraining und Kalorienrestriktion führen ebenfalls zu einer Verringerung des viszeralen Fettgewebes, auch wenn ihre Wirkung möglicherweise nicht kumulativ ist. Sowohl körperliche Betätigung als auch eine hypokalorische Diät führen zu einer Abnahme des viszeralen Fettes, doch hat körperliche Betätigung eine größere Wirkung auf das viszerale Fett als auf das Gesamtfett. Hochintensives Training ist eine Möglichkeit, das Gesamtbauchfett wirksam zu reduzieren. Eine energiereduzierte Ernährung in Kombination mit körperlicher Betätigung reduziert das Gesamtkörperfett und das Verhältnis von viszeralem zu subkutanem Fettgewebe, was auf eine bevorzugte Mobilisierung von viszeralem Fett gegenüber subkutanem Fett hindeutet. ⓘ
Epikardiales Fett
Epikardiales Fettgewebe (EAT) ist eine besondere Form des viszeralen Fetts, das sich um das Herz herum ablagert und sich als stoffwechselaktives Organ erwiesen hat, das verschiedene bioaktive Moleküle erzeugt, die die Herzfunktion erheblich beeinflussen könnten. Beim Vergleich von EAT mit subkutanem Fett wurden deutliche Unterschiede zwischen den Komponenten festgestellt, was auf einen ortsspezifischen Einfluss der gespeicherten Fettsäuren auf die Funktion und den Stoffwechsel der Adipozyten schließen lässt. ⓘ
Subkutanes Fett
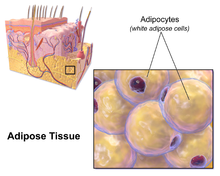
Der größte Teil des verbleibenden nicht viszeralen Fetts befindet sich direkt unter der Haut in einer Region, die als Unterhaut bezeichnet wird. Dieses subkutane Fett steht in keinem Zusammenhang mit vielen der klassischen fettleibigkeitsbedingten Krankheiten wie Herzkrankheiten, Krebs und Schlaganfall, und es gibt sogar Hinweise darauf, dass es schützend wirken könnte. Das typisch weibliche (oder gynäkologische) Muster der Körperfettverteilung um die Hüften, die Oberschenkel und das Gesäß ist subkutanes Fett und stellt daher im Vergleich zu viszeralem Fett ein geringeres Gesundheitsrisiko dar. ⓘ
Wie alle anderen Fettorgane ist auch das subkutane Fett ein aktiver Teil des endokrinen Systems und sezerniert die Hormone Leptin und Resistin. ⓘ
Die Beziehung zwischen der subkutanen Fettschicht und dem Gesamtkörperfett einer Person wird häufig mit Hilfe von Regressionsgleichungen modelliert. Die bekannteste dieser Gleichungen wurde von Durnin und Wormersley aufgestellt, die zahlreiche Hautfaltendiagramme getestet und daraufhin zwei Formeln zur Berechnung der Körperdichte von Männern und Frauen aufgestellt haben. Diese Gleichungen zeigen eine umgekehrte Korrelation zwischen Hautfalten und Körperdichte - je höher die Summe der Hautfalten, desto geringer die Körperdichte. ⓘ
Faktoren wie Geschlecht, Alter, Bevölkerungsgröße oder andere Variablen können dazu führen, dass die Gleichungen ungültig und unbrauchbar werden, und seit 2012 sind die Gleichungen von Durnin und Wormersley nur noch Schätzungen für den tatsächlichen Fettanteil einer Person. Es werden immer noch neue Formeln entwickelt. ⓘ
Knochenmarkfett
Knochenmarkfett, auch Markfettgewebe (MAT) genannt, ist ein wenig erforschtes Fettdepot, das sich im Knochen befindet und mit hämatopoetischen Zellen sowie Knochenelementen durchsetzt ist. Die Fettzellen in diesem Depot stammen von mesenchymalen Stammzellen (MSC) ab, aus denen Fettzellen, Knochenzellen und andere Zelltypen entstehen können. Die Tatsache, dass MAT bei Kalorienrestriktion/Anorexie zunimmt, ist ein Merkmal, das dieses Depot von anderen Fettdepots unterscheidet. Bewegung reguliert MAT, indem sie die MAT-Menge verringert und die Größe der Knochenmark-Adipozyten reduziert. Die Regulierung des Knochenmarkfetts durch Bewegung lässt vermuten, dass es eine gewisse physiologische Ähnlichkeit mit anderen weißen Fettdepots aufweist. Darüber hinaus deutet die Zunahme von MAT bei Adipositas auf eine weitere Ähnlichkeit mit weißen Fettdepots hin. ⓘ
Ektopisches Fett
Ektopisches Fett ist die Speicherung von Triglyceriden in anderen Geweben als dem Fettgewebe, die eigentlich nur geringe Mengen an Fett enthalten sollten, wie Leber, Skelettmuskel, Herz und Bauchspeicheldrüse. Dies kann die Zellfunktionen und damit die Funktion der Organe beeinträchtigen und wird mit der Insulinresistenz bei Typ-2-Diabetes in Verbindung gebracht. Es wird in relativ großen Mengen um die Organe der Bauchhöhle herum gespeichert, ist aber nicht mit dem viszeralen Fett zu verwechseln. ⓘ
Die spezifische Ursache für die Ansammlung von ektopischem Fett ist unbekannt. Wahrscheinlich handelt es sich um eine Kombination aus genetischen, umweltbedingten und verhaltensbedingten Faktoren, die mit einer übermäßigen Energiezufuhr und geringer körperlicher Aktivität einhergehen. Eine erhebliche Gewichtsabnahme kann die ektopischen Fettspeicher in allen Organen reduzieren, was mit einer Verbesserung der Funktion dieser Organe einhergeht. ⓘ
Im letzteren Fall können nicht-invasive Maßnahmen zur Gewichtsabnahme wie Diät oder körperliche Betätigung das ektopische Fett (insbesondere in Herz und Leber) bei übergewichtigen oder fettleibigen Kindern und Erwachsenen verringern. ⓘ
Physiologie
Freie Fettsäuren (FFA) werden durch Lipoproteinlipase (LPL) aus Lipoproteinen freigesetzt und gelangen in den Adipozyten, wo sie durch Veresterung mit Glycerin wieder zu Triglyceriden zusammengesetzt werden. Das menschliche Fettgewebe besteht zu etwa 87 % aus Lipiden. ⓘ
Es findet ein ständiger Fluss von FFAs in das und aus dem Fettgewebe statt. Die Nettorichtung dieses Flusses wird durch Insulin und Leptin gesteuert - wenn Insulin erhöht ist, kommt es zu einem Nettozufluss von FFA, und nur wenn Insulin niedrig ist, können FFA das Fettgewebe verlassen. Die Insulinsekretion wird durch einen hohen Blutzuckerspiegel angeregt, der durch den Verzehr von Kohlenhydraten entsteht. ⓘ
Beim Menschen wird die Lipolyse (Hydrolyse von Triglyceriden in freie Fettsäuren) durch eine ausgewogene Kontrolle der lipolytischen B-adrenergen Rezeptoren und der durch den a2A-adrenergen Rezeptor vermittelten Antilipolyse gesteuert. ⓘ
Fettzellen spielen eine wichtige physiologische Rolle bei der Aufrechterhaltung des Triglyceridspiegels und der freien Fettsäuren sowie bei der Bestimmung der Insulinresistenz. Bauchfett hat ein anderes metabolisches Profil - es neigt eher dazu, eine Insulinresistenz hervorzurufen. Dies erklärt weitgehend, warum die zentrale Fettleibigkeit ein Marker für eine gestörte Glukosetoleranz und ein unabhängiger Risikofaktor für Herz-Kreislauf-Erkrankungen ist (selbst wenn kein Diabetes mellitus oder Bluthochdruck vorliegt). Studien an weiblichen Affen an der Wake Forest University (2009) ergaben, dass Personen mit höherem Stress einen höheren Anteil an viszeralem Fett in ihrem Körper haben. Dies deutet auf einen möglichen Zusammenhang zwischen Ursache und Wirkung hin: Stress fördert die Ansammlung von viszeralem Fett, was wiederum hormonelle und metabolische Veränderungen verursacht, die zu Herzerkrankungen und anderen Gesundheitsproblemen beitragen. ⓘ
Jüngste Fortschritte in der Biotechnologie haben es ermöglicht, adulte Stammzellen aus dem Fettgewebe zu gewinnen, wodurch das Nachwachsen von Gewebe mit patienteneigenen Zellen stimuliert werden kann. Darüber hinaus können aus Fettgewebe gewonnene Stammzellen von Mensch und Tier Berichten zufolge effizient in induzierte pluripotente Stammzellen umprogrammiert werden, ohne dass Feederzellen erforderlich sind. Die Verwendung patienteneigener Zellen verringert das Risiko einer Gewebeabstoßung und vermeidet ethische Probleme, die mit der Verwendung humaner embryonaler Stammzellen verbunden sind. Es gibt immer mehr Hinweise darauf, dass verschiedene Fettdepots (z. B. Bauch, Omental, Perikard) Stammzellen aus Fettgewebe mit unterschiedlichen Eigenschaften liefern. Zu diesen depotabhängigen Merkmalen gehören die Proliferationsrate, der Immunphänotyp, das Differenzierungspotenzial, die Genexpression sowie die Empfindlichkeit gegenüber hypoxischen Kulturbedingungen. Der Sauerstoffgehalt scheint eine wichtige Rolle für den Stoffwechsel und allgemein die Funktion von Stammzellen aus Fettgewebe zu spielen. ⓘ
Fettgewebe ist sowohl bei Männern als auch bei Frauen eine wichtige periphere Quelle für Aromatase, die zur Produktion von Estradiol beiträgt. ⓘ
Zu den aus Fettgewebe gewonnenen Hormonen gehören:
Fettgewebe sezerniert auch eine Art von Zytokinen (Zell-zu-Zell-Signalproteine), die als Adipokine bezeichnet werden und eine Rolle bei den mit Fettleibigkeit verbundenen Komplikationen spielen. Perivaskuläres Fettgewebe setzt Adipokine wie Adiponektin frei, die die kontraktile Funktion der Gefäße, die sie umgeben, beeinflussen. ⓘ
Braunes Fett

Braunes Fett oder braunes Fettgewebe (BAT) ist eine spezialisierte Form des Fettgewebes, die für die adaptive Thermogenese beim Menschen und anderen Säugetieren wichtig ist. BAT kann Wärme erzeugen, indem es die Atmungskette der oxidativen Phosphorylierung in den Mitochondrien durch die gewebespezifische Expression des Entkopplungsproteins 1 (UCP1) "entkoppelt". BAT befindet sich vor allem im Bereich des Halses und der großen Blutgefäße des Brustkorbs, wo es effektiv am Wärmeaustausch beteiligt ist. BAT wird bei Kälteexposition durch die Freisetzung von Katecholaminen aus den Sympathikusnerven, die zu einer Aktivierung von UCP1 führt, stark aktiviert. Eine Aktivierung der BAT kann auch als Reaktion auf eine Überernährung erfolgen. Die UCP1-Aktivität wird durch langkettige Fettsäuren stimuliert, die nach der Aktivierung des β-adrenergen Rezeptors gebildet werden. Es wird angenommen, dass UCP1 als Fettsäure-Protonen-Symporter fungiert, obwohl der genaue Mechanismus noch nicht geklärt ist. Im Gegensatz dazu wird UCP1 durch ATP, ADP und GTP gehemmt. ⓘ
Versuche, diesen Prozess pharmakologisch zu simulieren, waren bisher erfolglos. Techniken zur Manipulation der Differenzierung von "braunem Fett" könnten in Zukunft ein Mechanismus für die Therapie der Gewichtsabnahme sein, indem sie das Wachstum von Gewebe mit diesem spezialisierten Stoffwechsel fördern, ohne es in anderen Organen zu induzieren. Samuelson und Vidal-Puig veröffentlichten 2020 eine Übersicht über die mögliche therapeutische Nutzung von braunem Fett zur Behandlung von Fettleibigkeit beim Menschen. ⓘ
Bis vor kurzem dachte man, dass braunes Fettgewebe beim Menschen hauptsächlich auf Säuglinge beschränkt sei, aber neue Erkenntnisse haben diese Annahme widerlegt. Stoffwechselaktives Gewebe mit ähnlichen Temperaturreaktionen wie braunes Fettgewebe wurde erstmals 2007 im Nacken und am Rumpf einiger menschlicher Erwachsener nachgewiesen, und das Vorhandensein von braunem Fettgewebe bei menschlichen Erwachsenen wurde später in denselben anatomischen Regionen histologisch bestätigt. ⓘ
Braunes Fett und WAT-Bräunung
Die Bräunung des WAT, auch als "Beiging" bezeichnet, tritt auf, wenn die Adipozyten in den WAT-Depots Merkmale der BAT entwickeln. Beige Fettzellen nehmen ein multilokuläres Aussehen an (sie enthalten mehrere Lipidtröpfchen) und erhöhen die Expression von Uncoupling Protein 1 (UCP1). Auf diese Weise werden diese normalerweise energiespeichernden Adipozyten zu energiefreisetzenden Adipozyten. ⓘ
Die Fähigkeit von braunem und beigem Fett, Kalorien zu verbrennen, wurde ausgiebig untersucht, da sich die Forschungsbemühungen auf Therapien zur Behandlung von Fettleibigkeit und Diabetes konzentrieren. Das Medikament 2,4-Dinitrophenol, das ähnlich wie UCP1 als chemischer Entkoppler wirkt, wurde in den 1930er Jahren zur Gewichtsabnahme eingesetzt. Es wurde jedoch schnell wieder abgesetzt, als eine übermäßige Dosierung zu unerwünschten Nebenwirkungen wie Hyperthermie und Tod führte. β3-Agonisten, wie CL316,243, wurden ebenfalls entwickelt und am Menschen getestet. Der Einsatz solcher Medikamente hat sich jedoch aufgrund verschiedener Probleme, wie der unterschiedlichen Spezies-Rezeptorspezifität und der schlechten oralen Bioverfügbarkeit, als weitgehend erfolglos erwiesen. ⓘ
Kälte ist ein primärer Regulator der BAT-Prozesse und führt zu einer Bräunung der WAT. Die Bräunung als Reaktion auf chronische Kälteexposition ist gut dokumentiert und ist ein reversibler Prozess. Eine Studie an Mäusen zeigte, dass die kältebedingte Bräunung innerhalb von 21 Tagen vollständig rückgängig gemacht werden kann, wobei innerhalb von 24 Stunden ein messbarer Rückgang von UCP1 zu beobachten war. Eine Studie von Rosenwald et al. ergab, dass dieselben Adipozyten einen beigen Phänotyp annehmen, wenn die Tiere erneut einer kalten Umgebung ausgesetzt werden, was darauf hindeutet, dass die beigen Adipozyten erhalten bleiben. ⓘ
Transkriptionsregulatoren sowie eine wachsende Zahl anderer Faktoren regulieren die Entstehung von beigem Fett. Vier Transkriptionsregulatoren sind für die WAT-Bräunung von zentraler Bedeutung und dienen als Ziele für viele der Moleküle, von denen bekannt ist, dass sie diesen Prozess beeinflussen. Dazu gehören der Peroxisom-Proliferator-aktivierte Rezeptor gamma (PPARγ), PRDM16, der Peroxisom-Proliferator-aktivierte Rezeptor gamma Coaktivator 1 alpha (PGC-1α) und der Early B-Cell Factor-2 (EBF2). ⓘ
Die Liste der Moleküle, die die Bräunung beeinflussen, ist im direkten Verhältnis zur Popularität dieses Themas gewachsen und wird ständig erweitert, da immer mehr Erkenntnisse gewonnen werden. Zu diesen Molekülen gehören Irisin und der Fibroblasten-Wachstumsfaktor 21 (FGF21), die gut untersucht sind und als wichtige Regulatoren der Bräunung gelten. Irisin wird als Reaktion auf körperliche Betätigung aus den Muskeln abgesondert und erhöht nachweislich die Bräunung, indem es auf beigefarbene Präadipozyten wirkt. FGF21, ein Hormon, das hauptsächlich von der Leber ausgeschüttet wird, hat großes Interesse geweckt, nachdem es als starker Stimulator der Glukoseaufnahme und als Regulator der Bräunung durch seine Wirkung auf PGC-1α identifiziert wurde. Es wird in der BAT bei Kälteexposition vermehrt ausgeschüttet und trägt vermutlich zur Resistenz gegen ernährungsbedingte Fettleibigkeit bei. FGF21 wird möglicherweise auch als Reaktion auf körperliche Betätigung und eine eiweißarme Ernährung ausgeschüttet, obwohl letzteres noch nicht gründlich untersucht wurde. Die Daten aus diesen Studien deuten darauf hin, dass Umweltfaktoren wie Ernährung und Bewegung wichtige Vermittler der Bräunung sein könnten. Bei Mäusen wurde festgestellt, dass die Bräunung durch die Produktion von Methionin-Enkephalin-Peptiden durch angeborene Lymphoidzellen vom Typ 2 als Reaktion auf Interleukin 33 ausgelöst werden kann. ⓘ
Genomik- und Bioinformatik-Tools zur Untersuchung der Bräunung
Aufgrund der Komplexität des Fettgewebes und der wachsenden Zahl von Molekülen, die die Bräunung regulieren, besteht ein großes Potenzial für den Einsatz von Bioinformatik-Tools zur Verbesserung der Studien auf diesem Gebiet. Studien zur WAT-Bräunung haben von den Fortschritten in diesen Techniken stark profitiert, da beiges Fett als therapeutisches Ziel für die Behandlung von Fettleibigkeit und Diabetes schnell an Popularität gewinnt. ⓘ
DNA-Mikroarrays sind ein bioinformatisches Instrument zur gleichzeitigen Quantifizierung der Expressionsniveaus verschiedener Gene und wurden bei der Untersuchung des Fettgewebes ausgiebig eingesetzt. In einer solchen Studie wurde die Microarray-Analyse in Verbindung mit der Ingenuity IPA-Software verwendet, um die Veränderungen in der Genexpression von WAT und BAT zu untersuchen, wenn Mäuse Temperaturen von 28 und 6 °C ausgesetzt waren. Die am stärksten herauf- und herunterregulierten Gene wurden dann identifiziert und für die Analyse der unterschiedlich exprimierten Signalwege verwendet. Es wurde festgestellt, dass viele der Wege, die in der WAT nach Kälteexposition hochreguliert wurden, auch in der BAT stark exprimiert werden, z. B. die oxidative Phosphorylierung, der Fettsäurestoffwechsel und der Pyruvatstoffwechsel. Dies deutet darauf hin, dass ein Teil der Adipozyten bei 6 °C zu einem beigen Phänotyp überging. Mössenböck et al. wiesen mit Hilfe von Microarray-Analysen nach, dass Insulinmangel die Differenzierung beiger Adipozyten hemmt, aber ihre Fähigkeit zur Bräunung nicht beeinträchtigt. Diese beiden Studien zeigen das Potenzial des Einsatzes von Microarrays bei der Untersuchung der Bräunung von WAT. ⓘ
Die RNA-Sequenzierung (RNA-Seq) ist ein leistungsfähiges computergestütztes Instrument, das die Quantifizierung der RNA-Expression für alle Gene in einer Probe ermöglicht. Die Einbeziehung von RNA-Seq in Studien zur Bräunung ist von großem Wert, da sie eine bessere Spezifität und Empfindlichkeit sowie einen umfassenderen Überblick über die Genexpression bietet als andere Methoden. RNA-Seq wurde sowohl in Studien an Menschen als auch an Mäusen eingesetzt, um beigefarbene Fettzellen anhand ihrer Genexpressionsprofile zu charakterisieren und potenzielle therapeutische Moleküle zu identifizieren, die den beigefarbenen Phänotyp hervorrufen können. In einer solchen Studie wurden mit Hilfe von RNA-Seq die Genexpressionsprofile von WAT von Wildtyp-Mäusen (WT) und solchen, die den Early B-Cell Factor-2 (EBF2) überexprimieren, verglichen. Die WAT der transgenen Tiere wiesen ein Genprogramm für braunes Fett auf und hatten im Vergleich zu den WT-Mäusen eine geringere WAT-spezifische Genexpression. Somit wurde EBF2 als potenzielles therapeutisches Molekül zur Auslösung von Beiging identifiziert. ⓘ
Die Chromatin-Immunpräzipitation mit Sequenzierung (ChIP-seq) ist eine Methode zur Identifizierung von Proteinbindungsstellen auf der DNA und zur Bewertung von Histonmodifikationen. Dieses Instrument hat die Untersuchung der epigenetischen Regulierung der Bräunung ermöglicht und trägt zur Aufklärung der Mechanismen bei, durch die Protein-DNA-Interaktionen die Differenzierung beiger Adipozyten stimulieren. Studien zur Beobachtung der Chromatinlandschaften beiger Adipozyten haben ergeben, dass die Adipogenese dieser Zellen aus der Bildung zellspezifischer Chromatinlandschaften resultiert, die das Transkriptionsprogramm regulieren und letztlich die Differenzierung steuern. Durch den Einsatz von ChIP-seq in Verbindung mit anderen Instrumenten haben jüngste Studien über 30 transkriptionelle und epigenetische Faktoren identifiziert, die die Entwicklung beiger Adipozyten beeinflussen. ⓘ
Genetik
Die Hypothese des sparsamen Gens (auch Hungerhypothese genannt) besagt, dass der Körper in manchen Populationen in Zeiten des Überflusses effizienter Fett einlagert und dadurch in Zeiten der Nahrungsmittelknappheit widerstandsfähiger gegen Hunger ist. Diese Hypothese, die ursprünglich im Zusammenhang mit dem Glukosestoffwechsel und der Insulinresistenz aufgestellt wurde, ist von Anthropologen, Physiologen und dem ursprünglichen Befürworter der Idee selbst in diesem Zusammenhang in Misskredit gebracht worden, obwohl sie nach Aussage ihres Entwicklers in anderen Zusammenhängen nach wie vor "so tragfähig ist wie zu der Zeit, als sie erstmals aufgestellt wurde". ⓘ
1995 entdeckte Jeffrey Friedman während seiner Assistenzzeit an der Rockefeller University zusammen mit Rudolph Leibel, Douglas Coleman et al. das Protein Leptin, das der genetisch fettleibigen Maus fehlte. Leptin wird im weißen Fettgewebe produziert und sendet Signale an den Hypothalamus. Wenn der Leptinspiegel sinkt, interpretiert der Körper dies als Energieverlust und das Hungergefühl nimmt zu. Mäuse, denen dieses Protein fehlt, fressen so lange, bis sie das Vierfache ihrer normalen Größe erreicht haben. ⓘ
Leptin spielt jedoch eine andere Rolle bei diätbedingter Fettleibigkeit bei Nagetieren und Menschen. Da Adipozyten Leptin produzieren, ist der Leptinspiegel bei fettleibigen Menschen erhöht. Der Hunger bleibt jedoch bestehen, und wenn der Leptinspiegel aufgrund einer Gewichtsabnahme sinkt, nimmt der Hunger zu. Der Leptinabfall ist besser als Hungersignal zu verstehen als der Leptinanstieg als Sättigungssignal. Ein erhöhter Leptinspiegel bei Fettleibigkeit wird jedoch als Leptinresistenz bezeichnet. Die Veränderungen im Hypothalamus, die zu einer Leptinresistenz bei Adipositas führen, stehen derzeit im Mittelpunkt der Adipositasforschung. ⓘ
Gendefekte im Leptin-Gen (ob) sind bei der menschlichen Adipositas selten. Bis Juli 2010 wurden weltweit nur 14 Personen aus fünf Familien identifiziert, die ein mutiertes ob-Gen tragen (eine davon war die erste jemals identifizierte Ursache für genetische Adipositas beim Menschen) - zwei Familien pakistanischer Herkunft, die im Vereinigten Königreich leben, eine Familie in der Türkei, eine in Ägypten und eine in Österreich - sowie zwei weitere Familien, die einen mutierten ob-Rezeptor tragen. Bei anderen wurde ein teilweiser genetischer Leptinmangel festgestellt, und bei diesen Personen können Leptinwerte am unteren Ende des Normalbereichs Fettleibigkeit vorhersagen. ⓘ
Mehrere Mutationen von Genen, die Melanocortine (die bei der mit dem Appetit verbundenen Signalübertragung im Gehirn verwendet werden) und ihre Rezeptoren betreffen, wurden ebenfalls als Ursache für Fettleibigkeit bei einem größeren Teil der Bevölkerung identifiziert als Leptinmutationen. ⓘ
Physikalische Eigenschaften
Fettgewebe hat eine Dichte von ~0,9 g/ml. Daher schwimmt eine Person mit mehr Fettgewebe leichter als eine Person gleichen Gewichts mit mehr Muskelgewebe, da Muskelgewebe eine Dichte von 1,06 g/ml hat. ⓘ
Körperfettmessgerät
Ein Körperfettmessgerät ist ein Gerät zur Messung des Verhältnisses von Körperfett zu Gewicht im menschlichen Körper. Verschiedene Messgeräte verwenden unterschiedliche Methoden zur Bestimmung des Verhältnisses. Sie neigen dazu, den Körperfettanteil zu niedrig zu messen. ⓘ
Im Gegensatz zu den klinischen Geräten nutzt eine relativ preiswerte Art von Körperfettmessgerät das Prinzip der bioelektrischen Impedanzanalyse (BIA), um den Körperfettanteil einer Person zu bestimmen. Dazu lässt das Messgerät einen kleinen, harmlosen elektrischen Strom durch den Körper fließen, misst den Widerstand und errechnet dann anhand von Angaben zu Gewicht, Größe, Alter und Geschlecht einen ungefähren Wert für den Körperfettanteil der Person. Bei der Berechnung wird das gesamte Wasservolumen im Körper gemessen (mageres Gewebe und Muskeln enthalten einen höheren Anteil an Wasser als Fett) und der Fettanteil auf der Grundlage dieser Informationen geschätzt. Das Ergebnis kann um mehrere Prozentpunkte schwanken, je nachdem, was man vor der Analyse gegessen und wie viel Wasser man getrunken hat. ⓘ
Vor der Entwicklung von Geräten zur bioelektrischen Impedanzanalyse gab es viele verschiedene Methoden zur Analyse der Körperzusammensetzung, z. B. die Hautfaltenmessung mit einem Messschieber, das Unterwasserwiegen, die Ganzkörper-Luftverdrängungsplethysmographie (ADP) und die DXA. ⓘ
Tierstudien
Im Fettgewebe von CCR2-defizienten Mäusen findet sich eine erhöhte Anzahl von Eosinophilen, eine stärkere Aktivierung alternativer Makrophagen und eine Neigung zur Expression von Zytokinen des Typs 2. Darüber hinaus wurde dieser Effekt noch verstärkt, wenn die Mäuse durch eine fettreiche Ernährung fettleibig wurden. ⓘ
Galerie
- Image:Yellow adipose tissue in paraffin section - lipids washed out.jpg
Weißes Fettgewebe im Paraffinschnitt
- Image:Body Fat meter.jpg
Elektronisches Instrument zur Messung des Körperfetts ⓘ
Weißes Fettgewebe
Chemische Zusammensetzung
Das Fett im menschlichen Fettgewebe setzt sich aus folgenden Fettsäureanteilen zusammen: Ölsäure 42–51 %, Palmitinsäure 21–30 %, Palmitoleinsäure und Stearinsäure (beide 5–8,5 %), Myristinsäure (2–6 %). Das Verhältnis von ungesättigten zu gesättigten Fettsäuren beträgt etwa 60:40. ⓘ
Histologische Merkmale
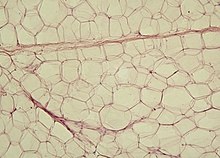
Die Adipozyten des weißen Fettes sind recht große Zellen (bis zu 100 µm), deren Zellleib fast vollständig von einem großen Lipidtropfen ausgefüllt ist: Deshalb spricht man von univakuolären Fettzellen. Der Kern ist durch die riesige Vakuole an den Rand gedrückt und abgeflacht, andere Zellorganellen oder viel Zytoplasma sind meist nicht zu erkennen (man spricht von Ähnlichkeit mit einem Siegelring). Die Fettvakuole ist nicht, wie etwa Sekretvesikel, von einer Biomembran umgeben, sondern liegt „frei“ im Zytosol vor. Sie ist allerdings von Intermediärfilamenten umsponnen, um sie zusammen- und in Form zu halten. Jeder einzelne Adipozyt ist von einer Basallamina und von retikulären Fasern umgeben, die die Zelle auch unter gewisser Krafteinwirkung (siehe Baufett) in Form halten. Das weiße Fettgewebe ist reichlich durch Blutkapillaren versorgt. ⓘ
Das weiße Fettgewebe erhält seinen Namen daher, dass in histologischen Standardpräparaten fast immer das Fett ausgelöst ist und die Zellen daher völlig leer, das heißt unter dem Mikroskop weiß, erscheinen. ⓘ
Menschliches Fett ist von der Konsistenz her eher ölig (hoher Gehalt an Ölsäure) und bei Körpertemperatur halbflüssig und intensiv gelb. ⓘ
Fettspeicherung
Adipozyten nehmen Fettsäuren aus dem Blut auf und synthetisieren mit α-Glycerophosphat (aktiviertes Glycerin) aus ihrem Stoffwechsel (Nebenweg der Glykolyse) die Lipide, die in der Zelle gespeichert werden (Fettsäuresynthese). Bei Bedarf können die Lipide wieder in ihre Bausteine gespalten (Lipolyse) und an das Blut abgegeben werden, so dass andere Zellen sie zur Energiegewinnung nutzen können. Beide Vorgänge, Lipogenese und Lipolyse, werden unter anderem durch die Hormone Insulin und Adrenalin beeinflusst. ⓘ
Eine Veränderung der gespeicherten Fettmenge geschieht hauptsächlich durch die Vergrößerung der gespeicherten Menge in der einzelnen Zelle. Es können sich aber auch neue Fettzellen aus Stammzellen bilden. ⓘ
Stammzellengewinnung aus dem Fettgewebe
Jahrzehntelang wurden Stammzellen vorrangig aus Knochenmark für medizinische Zwecke extrahiert. Die Grundlagenforschung für diese neue Stammzellengewinnung ist noch ausbaufähig, dennoch können aus dem Fettgewebe mesenchymale Stammzellen isoliert und weiterverwendet werden. Die Fettstammzellen (adipose-derived stem cells ASC) beinhalten viele multipotente Stammzellen und die Gewinnungsmethode ist schonender verglichen mit der Knochenmarkspende. In mehreren europäischen Ländern (bspw. Tschechien) wird diese Methode schon angewendet. Weil dieses Verfahren in Deutschland unter das Gewebegesetz fällt und die Extraktion- und Weiterverwendungsmethode als Arzneimittel gilt, ist die behördliche Genehmigung noch nicht abgeschlossen (Stand 2018). ⓘ
