Lyme-Borreliose
| Lyme-Borreliose ⓘ | |
|---|---|
| Andere Namen | Lyme-Borreliose |
 | |
| Eine erwachsene Hirschzecke (die meisten Fälle von Lyme werden durch Nymphen und nicht durch erwachsene Zecken verursacht) | |
| Fachgebiet | Infektiöse Krankheit |
| Symptome | Ausgedehnte Rötung an der Zeckenbissstelle, Fieber, Kopfschmerzen, Müdigkeit |
| Komplikationen | Gesichtsnervenlähmung, Arthritis, Hirnhautentzündung, Herzrhythmusstörungen, kognitive Störungen, wie Gedächtnisstörungen. |
| Gewöhnlicher Ausbruch | Eine Woche nach einem Biss |
| Erreger | Durch Zecken übertragene Borrelien |
| Diagnostische Methode | Anhand von Symptomen, Zeckenexposition, Bluttests |
| Vorbeugung | Vorbeugung von Zeckenstichen (Kleidung an den Gliedmaßen, DEET), Doxycyclin |
| Medikation | Doxycyclin, Amoxicillin, Ceftriaxon, Cefuroxim |
| Häufigkeit | ~476.000 pro Jahr in den USA (2010 - 2018) |
Die Lyme-Krankheit, auch bekannt als Lyme-Borreliose, ist eine durch Vektoren übertragene Krankheit, die durch das Bakterium Borrelia verursacht wird, das von Zecken der Gattung Ixodes übertragen wird. Das häufigste Anzeichen einer Infektion ist ein sich ausbreitender roter Ausschlag, das so genannte Erythema migrans, das etwa eine Woche nach dem Zeckenstich an der Einstichstelle auftritt. Der Ausschlag ist in der Regel weder juckend noch schmerzhaft. Etwa 70-80 % der infizierten Personen entwickeln einen Ausschlag. Die Frühdiagnose kann schwierig sein. Andere frühe Symptome können Fieber, Kopfschmerzen und Müdigkeit sein. Unbehandelt können Symptome wie der Verlust der Fähigkeit, eine oder beide Seiten des Gesichts zu bewegen, Gelenkschmerzen, starke Kopfschmerzen mit Nackensteifigkeit oder Herzklopfen auftreten. Monate bis Jahre später können wiederholte Episoden von Gelenkschmerzen und Schwellungen auftreten. Gelegentlich kann es auch zu stechenden Schmerzen oder Kribbeln in Armen und Beinen kommen. Trotz angemessener Behandlung entwickeln etwa 10 bis 20 % der Betroffenen mindestens sechs Monate lang Gelenkschmerzen, Gedächtnisprobleme und Müdigkeit. ⓘ
Die Lyme-Borreliose wird durch den Biss infizierter Zecken der Gattung Ixodes auf den Menschen übertragen. In den Vereinigten Staaten sind in der Regel Zecken des Typs Ixodes scapularis betroffen, die mindestens 36 Stunden lang festsitzen müssen, bevor die Bakterien übertragen werden können. In Europa können Ixodes ricinus-Zecken die Bakterien schneller verbreiten. In Nordamerika verursachen die Bakterien Borrelia burgdorferi, B. bissettiae und B. mayonii die Lyme-Krankheit. In Europa und Asien verursachen Borrelia afzelii, Borrelia garinii, B. spielmanii und vier weitere Arten die Krankheit. Die Krankheit scheint weder von Mensch zu Mensch, noch durch andere Tiere oder durch Lebensmittel übertragbar zu sein. Die Diagnose stützt sich auf eine Kombination aus Symptomen, einer Vorgeschichte des Zeckenbefalls und möglicherweise einem Test auf spezifische Antikörper im Blut. Bluttests sind in den frühen Stadien der Krankheit oft negativ. Die Untersuchung einzelner Zecken ist in der Regel nicht sinnvoll. ⓘ
Zur Vorbeugung gehört das Tragen von Kleidung, die Arme und Beine bedeckt, und die Verwendung von Insektenschutzmitteln auf DEET- oder Picaridin-Basis, um Zeckenbisse zu vermeiden. Der Einsatz von Pestiziden zur Reduzierung der Zeckenanzahl kann ebenfalls wirksam sein. Zecken können mit einer Pinzette entfernt werden. Wenn die entfernte Zecke voller Blut ist, kann eine Einzeldosis Doxycyclin eingesetzt werden, um die Entwicklung einer Infektion zu verhindern, wird aber nicht generell empfohlen, da die Entwicklung einer Infektion selten ist. Wenn sich eine Infektion entwickelt, sind verschiedene Antibiotika wirksam, darunter Doxycyclin, Amoxicillin und Cefuroxim. Die Standardbehandlung dauert in der Regel zwei bis drei Wochen. Manche Menschen entwickeln unter der Behandlung Fieber sowie Muskel- und Gelenkschmerzen, die ein oder zwei Tage anhalten können. Bei denjenigen, die anhaltende Symptome entwickeln, hat sich eine langfristige Antibiotikatherapie nicht als sinnvoll erwiesen. ⓘ
Die Borreliose ist die häufigste durch Zecken übertragene Krankheit in der nördlichen Hemisphäre und in Europa. In den Vereinigten Staaten werden jährlich schätzungsweise 476 000 Menschen mit der Krankheit diagnostiziert und behandelt, in Westeuropa sind es über 200 000 Menschen pro Jahr. Die meisten Infektionen treten im Frühjahr und Frühsommer auf. Die Borreliose wurde 1975 in Lyme, Connecticut, erstmals als eigenständige Krankheit diagnostiziert. Ursprünglich wurde sie mit juveniler rheumatoider Arthritis verwechselt. Das beteiligte Bakterium wurde erstmals 1981 von Willy Burgdorfer beschrieben. Die chronischen Symptome nach der Behandlung sind gut beschrieben und werden als "Post-Treatment Lyme Disease Syndrome" (PTLDS) bezeichnet. Das PTLDS unterscheidet sich von der chronischen Lyme-Borreliose, einem Begriff, der von Wissenschaftlern nicht mehr unterstützt und von verschiedenen Gruppen unterschiedlich verwendet wird. Einige Gesundheitsdienstleister behaupten, dass das PTLDS durch eine persistierende Infektion verursacht wird, was jedoch nicht der Wahrheit entspricht, da nach einer Standardbehandlung keine Anzeichen für eine persistierende Infektion gefunden werden können. ⓘ
Gegenwärtig gibt es keine Impfstoffe gegen Borreliose, obwohl die Forschung weitergeht. Zur Vorbeugung der Lyme-Borreliose bei Hunden stehen mehrere Impfstoffe zur Verfügung. ⓘ
| Klassifikation nach ICD-10 | |
|---|---|
| A69.2 | Lyme-Krankheit Erythema chronicum migrans durch Borrelia burgdorferi |
| ICD-10 online (WHO-Version 2019) | |
Die Lyme-Borreliose oder Lymekrankheit (Aussprache [ˈlaɪ̯m…]) ist eine Infektionskrankheit, die durch das Bakterium Borrelia burgdorferi oder verwandte Borrelien aus der Gruppe der Spirochäten ausgelöst wird. Die in drei Stadien verlaufende Erkrankung kann verschiedene Organe in jeweils verschiedenen Stadien und Ausprägungen betreffen, speziell die Haut, das Nervensystem und die Gelenke. Bei dem dritten Stadium der Erkrankung könnte es sich dabei um eine Autoimmunerkrankung handeln. Die Infektion mit Borrelia burgdorferi kommt beim Menschen, verschiedenen Säugetieren und Vögeln vor, und sie geschieht in der Regel über einen Zeckenstich. Der Infektionsweg verläuft von einem Reservoirwirt über Zecken wie den Gemeinen Holzbock (Ixodes ricinus) als Überträger (Vektor), sehr selten auch durch fliegende Insekten (Pferdebremsen, Stechmücken). ⓘ
Anzeichen und Symptome

Die Lyme-Borreliose kann mehrere Körpersysteme befallen und ein breites Spektrum an Symptomen hervorrufen. Nicht jeder Borreliosekranke hat alle Symptome, und viele der Symptome sind nicht spezifisch für die Borreliose, sondern können auch bei anderen Krankheiten auftreten. ⓘ
Die Inkubationszeit von der Infektion bis zum Auftreten der Symptome beträgt in der Regel ein bis zwei Wochen, kann aber auch viel kürzer (Tage) oder viel länger (Monate bis Jahre) sein. Lyme-Symptome treten in der nördlichen Hemisphäre am häufigsten von Mai bis September auf, da das Nymphenstadium der Zecke für die meisten Fälle verantwortlich ist. Eine asymptomatische Infektion ist möglich, tritt aber bei weniger als 7 % der infizierten Personen in den Vereinigten Staaten auf. Eine asymptomatische Infektion kann bei Infizierten in Europa viel häufiger vorkommen. ⓘ
Frühe lokalisierte Infektion
Eine frühe lokalisierte Infektion kann auftreten, wenn sich die Infektion noch nicht im ganzen Körper ausgebreitet hat. Nur die Stelle, an der die Infektion zum ersten Mal mit der Haut in Berührung gekommen ist, ist betroffen. Das erste Anzeichen von etwa 80 % der Borreliose-Infektionen ist ein Erythema migrans (EM) an der Stelle des Zeckenbisses, oft in der Nähe von Hautfalten wie Achselhöhle, Leiste oder Kniekehle, am Rumpf, unter Kleidungsbändern oder in den Haaren, Ohren oder im Nacken von Kindern. Die meisten Infizierten können sich nicht daran erinnern, eine Zecke oder einen Biss gesehen zu haben. Der Ausschlag tritt typischerweise eine oder zwei Wochen (Bereich 3-32 Tage) nach dem Biss auf und dehnt sich täglich um 2-3 cm aus, bis er einen Durchmesser von 5-70 cm (Median 16 cm) erreicht. Der Ausschlag ist in der Regel kreisförmig oder oval, rot oder bläulich und kann einen erhabenen oder dunkleren Mittelpunkt haben. In etwa 79 % der Fälle in Europa, aber nur in 19 % der Fälle in den endemischen Gebieten der USA bildet sich der Ausschlag allmählich von der Mitte zu den Rändern hin zurück und bildet möglicherweise ein "Bullaugen"-Muster. Der Ausschlag kann sich warm anfühlen, juckt aber normalerweise nicht, ist selten empfindlich oder schmerzhaft und braucht bis zu vier Wochen, um abzuklingen, wenn er nicht behandelt wird. ⓘ
Der EM-Ausschlag wird häufig von Symptomen einer virusähnlichen Erkrankung begleitet, darunter Müdigkeit, Kopf- und Gliederschmerzen, Fieber und Schüttelfrost, aber in der Regel keine Übelkeit oder Probleme mit den oberen Atemwegen. Diese Symptome können auch ohne Ausschlag auftreten oder nach dem Verschwinden des Ausschlags weiterbestehen. Die Lyme-Borreliose kann auch ohne diese Symptome oder einen Ausschlag in ein späteres Stadium übergehen. ⓘ
Personen, die mehr als zwei Tage lang hohes Fieber haben oder deren andere Symptome einer virusähnlichen Erkrankung sich trotz einer Antibiotikabehandlung gegen die Lyme-Borreliose nicht bessern, oder die ungewöhnlich niedrige Werte an weißen oder roten Blutkörperchen oder Blutplättchen im Blut haben, sollten auf eine mögliche Koinfektion mit anderen durch Zecken übertragenen Krankheiten wie Ehrlichiose und Babesiose untersucht werden. ⓘ

Ab Übertragung des Erregers kann es nach einer Inkubationszeit von meist 5–29 Tagen zu einer Lokalinfektion der Haut kommen, die mit einem charakteristischen Hautausschlag, dem Erythema (chronicum) migrans (Wanderröte), einhergeht. Ein Fleck, typischerweise im Zentrum blasser als am Rand, weitet sich von der Einstichstelle der Zecke ausgehend in der Haut aus, der äußere helle rote Ring oder auch Doppelring wird größer und wandert so – daher der Name. Die Wanderröte kann jucken oder brennen, aber auch ohne Beschwerden auftreten. Prädilektionsstellen beim Erwachsenen sind die Achselhöhle, die Leiste und die Kniekehlen, beim Kind sind es der Kopf und der Nacken. Ferner kann es zu einem Borrelien-Lymphozytom kommen. ⓘ
Zusätzlich können Allgemeinsymptome wie Fieber, Kopfschmerzen und allgemeines Krankheitsgefühl mit Gliederschmerzen und Abgeschlagenheit auftreten. Das Erythema migrans ist ein eindeutiges Zeichen für eine Reaktion des Immunsystems auf Borrelien, allerdings tritt nicht in allen Fällen von Borreliose-Infektionen eine Wanderröte auf. Aus dem fehlenden Erscheinungsbild nach einem Zeckenstich darf deswegen nicht geschlossen werden, dass keine Borreliose-Infektion erfolgt sein könnte. Das Erythem verschwindet manchmal ohne Therapie, kann aber auch über Monate bestehen. Ein Rückgang des Erythema migrans ist kein Beleg für eine Heilung, da der Erreger gestreut haben kann. ⓘ
Im ersten Stadium kann die Borreliose noch gut mit Antibiotika (Doxycyclin oder Amoxicillin) behandelt werden. Notwendig ist jedoch eine ausreichend lange und hoch genug dosierte Therapie. ⓘ
Frühe disseminierte Infektion
Innerhalb von Tagen bis Wochen nach Beginn der lokalen Infektion können sich die Borrelien über das Lymphsystem oder den Blutkreislauf ausbreiten. In 10-20 % der unbehandelten Fälle entwickeln sich EM-Ausschläge an Stellen am ganzen Körper, die in keinem Zusammenhang mit dem ursprünglichen Zeckenstich stehen. Vorübergehende Muskel- und Gelenkschmerzen sind ebenfalls häufig. ⓘ
Bei etwa 10-15 % der unbehandelten Menschen verursacht Lyme neurologische Probleme, die als Neuroborreliose bekannt sind. Die frühe Neuroborreliose tritt typischerweise 4-6 Wochen (Bereich 1-12 Wochen) nach dem Zeckenstich auf und umfasst eine Kombination aus lymphozytärer Meningitis, kranialer Neuritis, Radikulopathie und/oder Mononeuritis multiplex. Die lymphozytäre Meningitis führt zu charakteristischen Veränderungen im Liquor und kann mehrere Wochen lang von variablen Kopfschmerzen und, seltener, von meist leichten Meningitis-Symptomen wie der Unfähigkeit, den Nacken vollständig zu beugen, und der Unverträglichkeit von hellem Licht begleitet sein, wobei typischerweise kein oder nur sehr geringes Fieber auftritt. Nach mehreren Monaten kann die Neuroborreliose auch otolaryngologische Symptome hervorrufen. Bis zu 76,5 % dieser HNO-Symptome äußern sich als Tinnitus, dem häufigsten Symptom. Schwindel und Benommenheit (53,7 %) und Hörverlust (16,7 %) sind die nächsthäufigsten Symptome. Bei Kindern kann auch ein teilweiser Verlust des Sehvermögens auftreten. Die kraniale Neuritis ist eine Entzündung der Hirnnerven. Wenn sie auf Lyme zurückzuführen ist, verursacht sie in der Regel Gesichtslähmungen, die das Blinzeln, Lächeln und Kauen auf einer oder beiden Seiten des Gesichts beeinträchtigen. Sie kann auch zu zeitweiligem Doppeltsehen führen. Bei der Lyme-Radikulopathie handelt es sich um eine Entzündung von Spinalnervenwurzeln, die häufig Schmerzen und seltener Schwäche, Taubheit oder veränderte Empfindungen in den Körperbereichen verursacht, die von den mit den betroffenen Wurzeln verbundenen Nerven versorgt werden, z. B. Gliedmaßen oder Teile des Rumpfes. Der Schmerz wird häufig als anders als alle anderen zuvor empfundenen Schmerzen beschrieben, als quälend, wandernd, nachts schlimmer, selten symmetrisch und oft von extremen Schlafstörungen begleitet. Bei der Mononeuritis multiplex handelt es sich um eine Entzündung, die ähnliche Symptome in einem oder mehreren nicht miteinander verbundenen peripheren Nerven verursacht. In seltenen Fällen kann eine frühe Neuroborreliose eine Entzündung des Gehirns oder des Rückenmarks mit sich bringen, die mit Symptomen wie Verwirrtheit, abnormalem Gang, Augenbewegungen oder Sprache, Bewegungsstörungen, Störungen der motorischen Planung oder Zittern einhergeht. ⓘ
In Nordamerika ist die Gesichtslähmung die typische frühe Form der Neuroborreliose, die bei 5-10 % der unbehandelten Patienten auftritt und in etwa 75 % der Fälle von einer lymphozytären Meningitis begleitet wird. Über eine Lyme-Radikulopathie wird halb so häufig berichtet, aber viele Fälle können unerkannt bleiben. Bei europäischen Erwachsenen tritt am häufigsten eine Kombination aus lymphozytärer Meningitis und Radikulopathie auf, die als Bannwarth-Syndrom bekannt ist und in 36-89 % der Fälle von einer Gesichtslähmung begleitet wird. Bei diesem Syndrom beginnen die radikulären Schmerzen in der Regel in derselben Körperregion wie der anfängliche Erythema-migrans-Ausschlag, sofern ein solcher vorhanden war, und gehen einer möglichen Gesichtslähmung und anderen Bewegungseinschränkungen voraus. In extremen Fällen kann es zu einer dauerhaften Beeinträchtigung der motorischen oder sensorischen Funktion der unteren Gliedmaßen kommen. Bei europäischen Kindern sind die häufigsten Erscheinungsformen Gesichtslähmung (in 55 %), andere kraniale Neuritis und lymphozytäre Meningitis (in 27 %). ⓘ
In etwa 4-10 % der unbehandelten Fälle in den USA und 0,3-4 % der unbehandelten Fälle in Europa kann die Infektion etwa einen Monat (zwischen 4 Tagen und 7 Monaten) nach dem Zeckenstich zu Herzkomplikationen führen, die als Lyme-Karditis bekannt sind. Zu den Symptomen gehören Herzklopfen (bei 69 % der Betroffenen), Schwindel, Ohnmacht, Kurzatmigkeit und Brustschmerzen. Es können auch andere Symptome der Lyme-Borreliose auftreten, wie EM-Ausschlag, Gelenkschmerzen, Gesichtslähmung, Kopfschmerzen oder radikuläre Schmerzen. Bei manchen Menschen kann die Karditis jedoch die erste Manifestation der Lyme-Borreliose sein. Bei 19-87 % der Menschen wirkt sich die Lyme-Karditis negativ auf das elektrische Leitungssystem des Herzens aus und verursacht einen atrioventrikulären Block, der sich häufig in Form von Herzrhythmen äußert, die innerhalb von Minuten zwischen abnorm langsam und abnorm schnell wechseln. Bei 10-15 % der Menschen verursacht Lyme myokardiale Komplikationen wie Kardiomegalie, linksventrikuläre Dysfunktion oder kongestives Herzversagen. ⓘ
Eine weitere Hauterkrankung, die in Europa, aber nicht in Nordamerika vorkommt, ist das borreliale Lymphozytom, ein violetter Knoten, der sich am Ohrläppchen, an der Brustwarze oder am Hodensack bildet. ⓘ
Späte disseminierte Infektion
Nach einigen Monaten können unbehandelte oder unzureichend behandelte Personen chronische Symptome entwickeln, die viele Teile des Körpers betreffen, darunter die Gelenke, die Nerven, das Gehirn, die Augen und das Herz. ⓘ
Lyme-Arthritis tritt bei bis zu 60 % der unbehandelten Personen auf und beginnt in der Regel etwa sechs Monate nach der Infektion. In der Regel sind nur ein oder wenige Gelenke betroffen, häufig ein Knie oder möglicherweise die Hüfte, andere große Gelenke oder das Kiefergelenk. In der Regel kommt es zu großen Gelenkergüssen und Schwellungen, aber nur zu leichten oder mäßigen Schmerzen. Ohne Behandlung klingen Schwellung und Schmerzen in der Regel mit der Zeit ab, kehren aber in regelmäßigen Abständen zurück. Es können sich Baker-Zysten bilden und reißen. In einigen Fällen kommt es zu einer Erosion der Gelenke. ⓘ
Chronische neurologische Symptome treten bei bis zu 5 % der unbehandelten Personen auf. Es kann sich eine periphere Neuropathie oder Polyneuropathie entwickeln, die abnorme Empfindungen wie Taubheit, Kribbeln oder Brennen verursacht, die an den Füßen oder Händen beginnen und mit der Zeit möglicherweise die Gliedmaßen hinaufwandern. Ein Test kann ein vermindertes Vibrationsempfinden in den Füßen zeigen. Betroffene können das Gefühl haben, einen Strumpf oder Handschuh zu tragen, ohne dies tatsächlich zu tun. ⓘ
Ein neurologisches Syndrom, das als Lyme-Enzephalopathie bezeichnet wird, geht mit subtilen Gedächtnis- und kognitiven Schwierigkeiten, Schlaflosigkeit, einem allgemeinen Gefühl des Unwohlseins und Veränderungen der Persönlichkeit einher. Probleme wie Depressionen und Fibromyalgie treten jedoch bei Menschen mit Borreliose ebenso häufig auf wie in der Allgemeinbevölkerung. ⓘ
Borreliose kann eine chronische Enzephalomyelitis verursachen, die der Multiplen Sklerose ähnelt. Sie kann fortschreitend sein und kognitive Beeinträchtigungen, Hirnnebel, Migräne, Gleichgewichtsstörungen, Schwäche in den Beinen, Gangunsicherheit, Gesichtslähmung, Blasenprobleme, Schwindel und Rückenschmerzen mit sich bringen. In seltenen Fällen kann eine unbehandelte Borreliose eine offene Psychose verursachen, die fälschlicherweise als Schizophrenie oder bipolare Störung diagnostiziert wurde. Es kann zu Panikattacken und Angstzuständen kommen; außerdem kann wahnhaftes Verhalten auftreten, einschließlich somatoformer Wahnvorstellungen, manchmal begleitet von einem Depersonalisations- oder Derealisationssyndrom, bei dem die Betroffenen beginnen, sich von sich selbst oder von der Realität losgelöst zu fühlen. ⓘ
Acrodermatitis chronica atrophicans (ACA) ist eine chronische Hauterkrankung, die vor allem in Europa bei älteren Menschen beobachtet wird. Die ACA beginnt als rötlich-blau verfärbter Hautfleck, oft an den Hand- oder Fußrücken. Die Läsion verkümmert langsam über mehrere Wochen oder Monate, wobei die Haut zunächst dünn und faltig wird und dann, wenn sie unbehandelt bleibt, völlig trocken und haarlos wird. ⓘ
Ursache




Die Lyme-Krankheit wird durch Spirochäten, spiralförmige Bakterien der Gattung Borrelia, verursacht. Spirochäten sind von Peptidoglykan und Geißeln umgeben und besitzen eine äußere Membran, die der von gramnegativen Bakterien ähnelt. Aufgrund ihrer Doppelmembranhülle werden Borrelien oft fälschlicherweise als gramnegative Bakterien bezeichnet, obwohl sich ihre Hüllkomponenten erheblich von denen gramnegativer Bakterien unterscheiden. Die mit den Borrelien verwandten Borrelienarten werden unter dem Namen Borrelia burgdorferi sensu lato zusammengefasst und weisen eine große genetische Vielfalt auf. ⓘ
B. burgdorferi sensu lato ist ein Artenkomplex, der aus 20 anerkannten und drei vorgeschlagenen Genospezies besteht. Von acht Arten ist bekannt, dass sie die Lyme-Krankheit verursachen: B. mayonii (in Nordamerika), B. burgdorferi sensu stricto, B. bissettiae (beide in Nordamerika und Europa), B. afzelii, B. garinii, B. spielmanii, und B. lusitaniae (alle in Eurasien). In einigen Studien wurde auch vorgeschlagen, dass B. valaisiana manchmal den Menschen infizieren kann, aber diese Art scheint keine wichtigen Krankheitsursachen zu sein. ⓘ
Lebenszyklus der Zecke
Im Lebenszyklus einer Zecke gibt es drei Stadien. Larve, Nymphe und Erwachsener. Im Nymphenstadium übertragen Zecken am häufigsten die Lyme-Borreliose und sind in der Regel im späten Frühjahr und frühen Sommer in Regionen mit mildem Klima am aktivsten. Im adulten Stadium ist die Übertragung der Lyme-Borreliose weniger häufig, da erwachsene Zecken den Menschen seltener stechen können und weil sie in der Regel größer sind und daher leicht gesehen und entfernt werden können. ⓘ
Übertragung
Die Lyme-Borreliose wird als Zoonose eingestuft, da sie aus einem natürlichen Reservoir von Kleinsäugern und Vögeln durch Zecken, die sich von beiden Wirtsarten ernähren, auf den Menschen übertragen wird. Harte Zecken der Gattung Ixodes sind die Überträger der Lyme-Borreliose (sie sind auch die Überträger der Babesien). Die meisten Infektionen werden von Zecken im Nymphenstadium verursacht, da sie sehr klein sind und sich daher lange Zeit unbemerkt ernähren können. Nymphale Zecken sind im Allgemeinen so groß wie ein Mohnsamen und haben manchmal einen dunklen Kopf und einen durchscheinenden Körper. Die Nymphenzecken können auch dunkler sein. (Die jüngeren Larvenzecken sind sehr selten infiziert.) Obwohl Hirsche die bevorzugten Wirte der erwachsenen Hirschzecken sind und die Zeckenpopulationen in Abwesenheit von Hirschen viel geringer sind, nehmen Zecken Borrelien im Allgemeinen nicht von Hirschen auf, sondern von infizierten kleinen Säugetieren wie der weißfüßigen Maus und gelegentlich auch von Vögeln. Die Gebiete, in denen Borreliose häufig vorkommt, breiten sich aus. ⓘ
Im Mitteldarm der Zecke bindet sich das äußere Oberflächenprotein A (OspA) der Borrelien an den Zeckenrezeptor für OspA, der als TROSPA bezeichnet wird. Wenn die Zecke frisst, wird OspA von den Borrelien herunterreguliert und OspC, ein weiteres Oberflächenprotein, hochreguliert. Nachdem die Bakterien aus dem Mitteldarm in die Speicheldrüsen gewandert sind, bindet OspC an Salp15, ein Speichelprotein der Zecke, das offenbar immunsuppressive Wirkungen hat, die die Infektion fördern. Die erfolgreiche Infektion des Säugetierwirts hängt von der bakteriellen Expression von OspC ab. ⓘ
Zeckenbisse bleiben oft unbemerkt, da die Zecke in ihrem Nymphenstadium sehr klein ist und der Wirt aufgrund der Zeckensekrete weder Juckreiz noch Schmerzen beim Biss verspürt. Die Übertragung ist jedoch recht selten: Nur etwa 1,2 bis 1,4 Prozent der anerkannten Zeckenbisse führen zu einer Borreliose. ⓘ
In Europa ist der Hauptüberträger Ixodes ricinus, der auch als Schafszecke oder Rizinuszecke bezeichnet wird. In China ist Ixodes persulcatus (die Taiga-Zecke) wahrscheinlich der wichtigste Überträger. In Nordamerika ist die schwarzbeinige Zecke oder Hirschzecke (Ixodes scapularis) an der Ostküste der Hauptüberträger. ⓘ
Die einsame Sternzecke (Amblyomma americanum), die im gesamten Südosten der Vereinigten Staaten bis nach Texas vorkommt, überträgt die Spirochäten der Lyme-Borreliose wahrscheinlich nicht, obwohl sie mit einem verwandten Syndrom, der so genannten Southern Tick-associated Rash Disease, in Verbindung gebracht werden kann, das einer milden Form der Lyme-Borreliose ähnelt. ⓘ
An der Westküste der Vereinigten Staaten ist der Hauptüberträger die westliche schwarzbeinige Zecke (Ixodes pacificus). Die Tendenz dieser Zeckenart, sich vorwiegend von Wirtsarten wie der Westlichen Zauneidechse zu ernähren, die gegen Borrelien resistent sind, scheint die Übertragung der Lyme-Borreliose im Westen zu verringern. ⓘ
Während der Schwangerschaft kann es zu einer Übertragung über die Plazenta kommen, und wie bei einer Reihe anderer Spirochäten-Erkrankungen sind bei einer unbehandelten Infektion nachteilige Folgen für die Schwangerschaft möglich; eine sofortige Behandlung mit Antibiotika verringert oder beseitigt dieses Risiko. ⓘ
Es gibt keine wissenschaftlichen Belege für die Übertragung von Borreliose durch Bluttransfusionen, sexuellen Kontakt oder Muttermilch. ⓘ
Überträger des Bakteriums sind in der Regel Zecken, die den Erreger beim Saug- und Stechakt nach einigen Stunden (in der Regel in einem Zeitfenster von acht bis zwölf Stunden nach dem Einstich) auf den Menschen übertragen. In Deutschland werden die Erreger des Borrelia-burgdorferi-sensu-lato-Komplexes primär durch die Zecke Ixodes ricinus, auch Gemeiner Holzbock genannt, übertragen. ⓘ
Als weitere Überträger der Borreliose werden von Wissenschaftlern auch Stechmücken diskutiert, wobei in bisherigen Studien nur eine sehr geringe Durchseuchung von Mücken festgestellt wurde. Bei einer Untersuchung von mehr als 3600 Mücken an 42 Orten in Deutschland konnten bei 0,13 bis 8,33 Prozent der untersuchten Mücken Erreger gefunden werden. Untersucht wurde auf Borrelia afzelii, Borrelia bavariensis und Borrelia garinii. ⓘ
Es wurden Einzelfälle einer Übertragung durch Bremsen dokumentiert, wobei bislang keine Bestätigung durch breitere Studien vorliegt, ob diese Insekten tatsächlich als Vektor infrage kommen. ⓘ
Die als Nymphen bezeichneten juvenilen Entwicklungsstadien der Zecken sind mit bloßem Auge kaum erkennbar. Da die Nymphen nach ihrer meist unbemerkten Blutmahlzeit von der Haut abfallen, weiß der Gestochene in diesem Fall nichts von einer möglichen Borreliose-Infektion und wird erst aufmerksam, wenn die Symptome auftreten. ⓘ
Eine an Lyme-Borreliose erkrankte Person ist im Allgemeinen nicht ansteckend für andere Menschen. ⓘ
Durch Zecken übertragene Koinfektionen
Zecken, die B. burgdorferi auf den Menschen übertragen, können auch verschiedene andere Parasiten in sich tragen und übertragen, wie z. B. Babesia microti und Anaplasma phagocytophilum, die die Krankheiten Babesiose bzw. humane granulozytäre Anaplasmose (HGA) verursachen. Von den Menschen, die an einer frühen Borreliose erkrankt sind, haben je nach Standort 2-12 % auch eine HGA und 2-40 % eine Babesiose. Zecken in bestimmten Regionen, darunter die Gebiete entlang der östlichen Ostsee, übertragen auch Viren, die eine durch Zecken übertragene Enzephalitis verursachen. ⓘ
Koinfektionen erschweren die Lyme-Symptome, insbesondere die Diagnose und Behandlung. Es ist möglich, dass eine Zecke eine der Koinfektionen trägt und überträgt, aber keine Borrelien, was die Diagnose erschwert und oft schwer zu fassen ist. Die Centers for Disease Control and Prevention haben 100 Zecken im ländlichen New Jersey untersucht und festgestellt, dass 55 % der Zecken mit mindestens einem der Erreger infiziert waren. ⓘ
Pathophysiologie
B. burgdorferi kann sich im Verlauf der Krankheit im ganzen Körper ausbreiten und wurde in der Haut, im Herzen, in den Gelenken, im peripheren Nervensystem und im zentralen Nervensystem gefunden. Viele der Anzeichen und Symptome der Lyme-Borreliose sind eine Folge der Immunreaktion auf die Spirochäten in diesen Geweben. ⓘ
B. burgdorferi wird durch den Biss einer infizierten Ixodes-Zecke in die Haut injiziert. Der Zeckenspeichel, der die Spirochäten während des Fütterungsprozesses in die Haut begleitet, enthält Stoffe, die die Immunreaktion an der Bissstelle stören. Dadurch entsteht eine schützende Umgebung, in der die Spirochäten eine Infektion auslösen können. Die Spirochäten vermehren sich und wandern in der Dermis nach außen. Die Entzündungsreaktion des Wirts auf die Bakterien in der Haut verursacht die charakteristische kreisförmige EM-Läsion. Die neutrophilen Granulozyten, die zur Beseitigung der Spirochäten aus der Haut erforderlich sind, erscheinen jedoch nicht in der erforderlichen Anzahl in der sich entwickelnden EM-Läsion, da der Speichel der Zecke die Funktion der Neutrophilen hemmt. Dadurch können die Bakterien überleben und sich schließlich im ganzen Körper ausbreiten. ⓘ
Tage bis Wochen nach dem Zeckenstich verbreiten sich die Spirochäten über den Blutkreislauf in die Gelenke, das Herz, das Nervensystem und entfernte Hautstellen, wo ihre Anwesenheit zu den vielfältigen Symptomen der disseminierten Krankheit führt. Die Ausbreitung von B. burgdorferi wird durch die Bindung der Wirtsprotease Plasmin an die Oberfläche der Spirochäten begünstigt. ⓘ
Unbehandelt können die Bakterien trotz der Produktion von B. burgdorferi-Antikörpern durch das Immunsystem Monate oder sogar Jahre im Körper verbleiben. Die Spirochäten können die Immunreaktion umgehen, indem sie die Expression von Oberflächenproteinen, gegen die Antikörper gerichtet sind, verringern, das VlsE-Oberflächenprotein antigenisch variieren, wichtige Immunbestandteile wie Komplement inaktivieren und sich in der extrazellulären Matrix verstecken, was die Funktion von Immunfaktoren beeinträchtigen kann. ⓘ
Im Gehirn kann B. burgdorferi Astrozyten zu einer Astrogliose (Proliferation gefolgt von Apoptose) veranlassen, was zu Neurodysfunktion beitragen kann. Die Spirochäten können auch Wirtszellen dazu veranlassen, Chinolinsäure abzusondern, die den NMDA-Rezeptor auf den Nervenzellen stimuliert, was für die bei der Lyme-Enzephalopathie beobachtete Müdigkeit und das Unwohlsein verantwortlich sein kann. Darüber hinaus kann eine diffuse Pathologie der weißen Substanz während der Lyme-Enzephalopathie die Verbindungen der grauen Substanz stören und für Defizite in den Bereichen Aufmerksamkeit, Gedächtnis, visuell-räumliche Fähigkeiten, komplexe Kognition und emotionaler Status verantwortlich sein. Erkrankungen der weißen Substanz haben möglicherweise ein größeres Heilungspotenzial als Erkrankungen der grauen Substanz, vielleicht weil der Verlust von Neuronen weniger häufig ist. Eine Rückbildung der MRT-Hyperintensitäten der weißen Substanz nach einer Antibiotikabehandlung wurde beobachtet. ⓘ
Tryptophan, eine Vorstufe von Serotonin, scheint bei einer Reihe von Infektionskrankheiten, die das Gehirn befallen, einschließlich Lyme, im zentralen Nervensystem vermindert zu sein. Die Forscher untersuchen, ob diese Neurohormonausschüttung die Ursache für neuropsychiatrische Störungen ist, die bei einigen Borreliose-Patienten auftreten. ⓘ
Immunologische Studien
Die Exposition gegenüber dem Borrelienbakterium während der Lyme-Borreliose verursacht möglicherweise eine lang anhaltende und schädliche Entzündungsreaktion, eine Form der erregerinduzierten Autoimmunerkrankung. Die Entstehung dieser Reaktion könnte auf eine Form der molekularen Mimikry zurückzuführen sein, bei der Borrelien der Abtötung durch das Immunsystem entgehen, indem sie normalen Teilen des Körpergewebes ähneln. ⓘ
Chronische Symptome, die auf eine Autoimmunreaktion zurückzuführen sind, könnten erklären, warum einige Symptome auch dann noch auftreten, wenn die Spirochäten bereits aus dem Körper entfernt wurden. Diese Hypothese könnte erklären, warum die chronische Arthritis nach einer Antibiotikatherapie fortbesteht, ähnlich wie beim rheumatischen Fieber, aber ihre breitere Anwendung ist umstritten. ⓘ
Diagnose
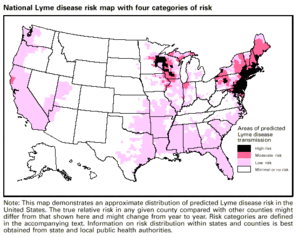
Die Diagnose der Lyme-Borreliose wird anhand von Symptomen, objektiven körperlichen Befunden (z. B. Erythema migrans (EM)-Ausschlag, Gesichtslähmung oder Arthritis), der Anamnese eines möglichen Kontakts mit infizierten Zecken und möglicherweise Labortests gestellt. Bei Personen mit Symptomen einer frühen Lyme-Borreliose sollte eine Ganzkörper-Hautuntersuchung auf EM-Ausschlag durchgeführt und gefragt werden, ob in den letzten 1 bis 2 Monaten Ausschläge vom EM-Typ aufgetreten sind. Das Vorhandensein eines EM-Ausschlags und eine kürzliche Zeckenexposition (d. h. Aufenthalt im Freien in einem wahrscheinlichen Zeckenhabitat, in dem Lyme häufig vorkommt, innerhalb von 30 Tagen nach Auftreten des Ausschlags) reichen für die Lyme-Diagnose aus; eine Laborbestätigung ist weder erforderlich noch empfehlenswert. Die meisten Infizierten erinnern sich nicht an eine Zecke oder einen Biss, und der EM-Ausschlag muss nicht wie ein Bullauge aussehen (die meisten EM-Ausschläge in den USA sehen nicht so aus) oder von anderen Symptomen begleitet sein. In den USA ist Lyme-Borreliose vor allem in den Neuengland- und Mittelatlantikstaaten sowie in Teilen von Wisconsin und Minnesota verbreitet, breitet sich aber auch in anderen Gebieten aus. In mehreren angrenzenden Gebieten Kanadas besteht ebenfalls ein hohes Lyme-Risiko. ⓘ
Wenn kein EM-Ausschlag oder eine Zeckenexposition in der Vorgeschichte vorliegt, hängt die Borreliose-Diagnose von einer Laborbestätigung ab. Die Bakterien, die die Lyme-Borreliose verursachen, lassen sich im Körpergewebe nur schwer direkt nachweisen, und auch die Anzucht im Labor ist schwierig und zu zeitaufwändig. Die am häufigsten verwendeten Tests suchen stattdessen nach Antikörpern gegen diese Bakterien im Blut. Ein positives Ergebnis des Antikörpertests beweist an sich noch keine aktive Infektion, kann aber eine Infektion bestätigen, die aufgrund von Symptomen, objektiven Befunden und einer früheren Zeckenexposition bei einer Person vermutet wird. Da bis zu 5-20 % der Normalbevölkerung Antikörper gegen Borreliose haben, sollten Personen ohne Vorgeschichte und Symptome, die auf eine Borreliose hindeuten, nicht auf Borreliose-Antikörper getestet werden: Ein positives Ergebnis wäre wahrscheinlich falsch und würde möglicherweise eine unnötige Behandlung nach sich ziehen. ⓘ
In einigen Fällen, in denen Anamnese, Anzeichen und Symptome stark auf eine frühe disseminierte Lyme-Borreliose hindeuten, kann eine empirische Behandlung eingeleitet und neu bewertet werden, sobald Labortestergebnisse vorliegen. ⓘ
Laboruntersuchungen
Die am weitesten verbreitete Methode zur Borreliose-Diagnose ist der Test auf Antikörper im Blut mittels ELISA und Western Blot. Die Centers for Disease Control and Prevention (CDC) empfehlen ein zweistufiges Protokoll: Zuerst wird der empfindliche ELISA-Test durchgeführt, und wenn dieser positiv oder zweideutig ist, wird der spezifischere Western Blot durchgeführt. Das Immunsystem braucht einige Zeit, um Antikörper in ausreichender Menge zu produzieren. Nach Beginn der Borreliose-Infektion können Antikörper des Typs IgM und IgG in der Regel erst nach 2 bis 4 Wochen bzw. 4 bis 6 Wochen nachgewiesen werden und erreichen ihren Höhepunkt nach 6 bis 8 Wochen. Wenn ein EM-Ausschlag erstmals auftritt, sind möglicherweise noch keine Antikörper nachweisbar. Daher wird empfohlen, keine Tests durchzuführen und die Diagnose auf das Vorhandensein des EM-Ausschlags zu stützen. Bis zu 30 Tage nach Beginn einer vermuteten Lyme-Infektion kann die Infektion durch den Nachweis von IgM- oder IgG-Antikörpern bestätigt werden; danach wird empfohlen, nur noch IgG-Antikörper zu berücksichtigen. Ein positives IgM- und ein negatives IgG-Testergebnis nach dem ersten Monat der Infektion ist im Allgemeinen ein Hinweis auf ein falsch-positives Ergebnis. Die Zahl der IgM-Antikörper geht in der Regel 4-6 Monate nach der Infektion zurück, während IgG-Antikörper noch über Jahre hinweg nachweisbar sein können. ⓘ
In Fällen von Neuroborreliose können auch andere Tests eingesetzt werden. In Europa wird die Neuroborreliose in der Regel durch Borrelia garinii verursacht und geht fast immer mit einer lymphozytären Pleozytose einher, d. h. die Lymphozyten- (Infektionsbekämpfungszellen) und Proteindichte im Liquor (Gehirn-Rückenmarks-Flüssigkeit) steigt typischerweise auf charakteristisch abnorme Werte an, während der Glukosespiegel normal bleibt. Darüber hinaus produziert das Immunsystem im intrathekalen Raum, der den Liquor enthält, Antikörper gegen Lyme. Der Nachweis einer Pleozytose und einer intrathekalen Antikörperproduktion durch Lumbalpunktion und Liquoranalyse ist in Europa Voraussetzung für die eindeutige Diagnose einer Neuroborreliose (außer bei peripherer Neuropathie im Zusammenhang mit Acrodermatitis chronica atrophicans, die in der Regel durch Borrelia afzelii verursacht und durch Antikörpertests im Blut bestätigt wird). In Nordamerika wird die Neuroborreliose durch Borrelia burgdorferi verursacht und geht möglicherweise nicht mit denselben Liquorsymptomen einher; sie bestätigen die Diagnose einer Neuroborreliose des zentralen Nervensystems (ZNS), wenn sie positiv ist, schließen sie aber nicht aus, wenn sie negativ ist. In den amerikanischen Leitlinien wird die Analyse des Liquors als fakultativ angesehen, wenn sich die Symptome auf das periphere Nervensystem (PNS) zu beschränken scheinen, z. B. bei Gesichtslähmung ohne offenkundige Meningitis-Symptome. Im Gegensatz zu Blut- und intrathekalen Antikörpertests kehren die Liquor-Pleozytose-Tests nach Beendigung der Infektion in den Normalbereich zurück und können daher als objektive Marker für den Behandlungserfolg und als Entscheidungsgrundlage für eine erneute Behandlung verwendet werden. Bei Infektionen, die das PNS betreffen, können Elektromyographie und Nervenleitfähigkeitsuntersuchungen eingesetzt werden, um das Ansprechen auf die Behandlung objektiv zu überwachen. ⓘ
Bei Lyme-Karditis werden Elektrokardiogramme zum Nachweis von Herzleitungsstörungen eingesetzt, während die Echokardiographie eine Myokarddysfunktion aufzeigen kann. Eine Biopsie und der Nachweis von Borrelienzellen im Herzmuskelgewebe können in bestimmten Fällen eingesetzt werden, werden aber in der Regel wegen der Risiken des Verfahrens nicht durchgeführt. ⓘ
Es wurden auch Polymerase-Kettenreaktionstests (PCR) für Borreliose entwickelt, um das genetische Material (DNA) der Borreliose-Spirochäten nachzuweisen. Kultur oder PCR sind die derzeitigen Mittel zum Nachweis des Organismus, da serologische Untersuchungen nur auf Antikörper von Borrelien testen. Die PCR hat den Vorteil, dass sie viel schneller ist als eine Kultur. Allerdings sind PCR-Tests anfällig für falsch-positive Ergebnisse, z. B. durch den Nachweis von Trümmern toter Borrelienzellen oder eine Kontamination der Probe. Selbst bei ordnungsgemäßer Durchführung zeigt die PCR häufig falsch-negative Ergebnisse, da bei einer Infektion nur wenige Borrelienzellen in Blut und Liquor gefunden werden können. Daher werden PCR-Tests nur in besonderen Fällen empfohlen, z. B. bei der Diagnose von Lyme-Arthritis, da sie eine hochempfindliche Methode zum Nachweis von ospA-DNA in Synovialflüssigkeit darstellen. Obwohl die Sensitivität der PCR in Liquor gering ist, kann ihr Einsatz in Betracht gezogen werden, wenn der Verdacht besteht, dass die Testergebnisse der intrathekalen Antikörperproduktion falsch negativ sind, z. B. bei sehr früher (< 6 Wochen) Neuroborreliose oder bei immunsupprimierten Personen. ⓘ
Es gibt mehrere andere Formen von Labortests für die Lyme-Borreliose, von denen einige nicht ausreichend validiert worden sind. OspA-Antigene, die von lebenden Borrelien in den Urin abgegeben werden, sind eine vielversprechende Technik, die derzeit untersucht wird. Die Verwendung von Nanotrap-Partikeln für ihren Nachweis wird derzeit geprüft, und OspA wurde mit aktiven Lyme-Symptomen in Verbindung gebracht. Hohe Titer von Immunglobulin-G- (IgG) oder Immunglobulin-M- (IgM) Antikörpern gegen Borrelien-Antigene deuten auf eine Erkrankung hin, aber niedrigere Titer können irreführend sein, da die IgM-Antikörper nach der Erstinfektion und die IgG-Antikörper über Jahre hinweg bestehen bleiben können. ⓘ
Die CDC empfiehlt keine Urin-Antigentests, PCR-Tests auf Urin, Immunfluoreszenzfärbungen für zellwanddefiziente Formen von B. burgdorferi und Lymphozytentransformationstests. ⓘ
Bildgebung
Es ist umstritten, ob die bildgebende Diagnostik spezifische, für die Neuroborreliose charakteristische Muster liefert, sie kann jedoch bei der Differentialdiagnose und beim Verständnis der Pathophysiologie der Krankheit hilfreich sein. Obwohl umstritten, gibt es Hinweise darauf, dass bestimmte bildgebende Untersuchungen Daten liefern können, die für die Diagnose einer Person hilfreich sind. Die Magnetresonanztomographie (MRT) und die Einzelphotonen-Emissions-Computertomographie (SPECT) sind zwei der Tests, mit denen sich Anomalien im Gehirn einer Person mit dieser Krankheit feststellen lassen. Zu den Neuroimaging-Befunden im MRT gehören Läsionen in der periventrikulären weißen Substanz sowie vergrößerte Ventrikel und kortikale Atrophie. Die Befunde gelten als eher unauffällig, da sich die Läsionen nach einer Antibiotikabehandlung als reversibel erwiesen haben. SPECT-Bilder zeigen zahlreiche Bereiche, in denen der Kortex und die subkortikale weiße Substanz nicht ausreichend mit Blut versorgt werden. SPECT-Bilder sind jedoch bekanntermaßen unspezifisch, da sie ein heterogenes Muster in der Bildgebung zeigen. Die auf den SPECT-Bildern zu sehenden Anomalien ähneln sehr denen, die bei Menschen mit zerebralen Vakuitäten und der Creutzfeldt-Jakob-Krankheit zu sehen sind, was sie fragwürdig macht. ⓘ
Differentialdiagnose
Es wurde berichtet, dass in Gemeinschaftskliniken 23-28 % der Erythema migrans (EM)-Ausschläge und 83 % der anderen objektiven Manifestationen der frühen Lyme-Krankheit falsch diagnostiziert werden. EM-Ausschläge werden häufig als Spinnenbisse, Zellulitis oder Gürtelrose fehldiagnostiziert. Viele Fehldiagnosen sind auf die weit verbreitete Fehleinschätzung zurückzuführen, dass EM-Ausschläge wie ein Bullauge aussehen sollten. Tatsächlich sind die wichtigsten Unterscheidungsmerkmale des EM-Ausschlags die Geschwindigkeit und das Ausmaß, in dem er sich ausbreitet, d. h. bis zu 2 bis 3 cm pro Tag und ein Durchmesser von mindestens 5 cm, in 50 % der Fälle sogar mehr als 16 cm. Der Ausschlag dehnt sich von seinem Zentrum weg aus, das anders aussehen kann oder nicht oder durch eine ringförmige Lichtung vom Rest des Ausschlags getrennt ist. Im Vergleich zu EM-Ausschlägen treten Spinnenbisse häufiger an den Gliedmaßen auf, sind in der Regel schmerzhafter und juckender oder schwellen an, und einige können Nekrosen (absinkende dunkelblaue Flecken toter Haut) verursachen. Eine Zellulitis entwickelt sich meist um eine Wunde oder ein Geschwür herum, ist selten kreisförmig und wird eher geschwollen und schmerzhaft. EM-Ausschläge treten häufig an Stellen auf, die für eine Zellulitis ungewöhnlich sind, z. B. in der Achselhöhle, der Leiste, dem Bauch oder den Kniekehlen. Wie die Lyme-Borreliose beginnt auch die Gürtelrose häufig mit Kopfschmerzen, Fieber und Müdigkeit, gefolgt von Schmerzen oder Taubheitsgefühlen. Im Gegensatz zur Lyme-Borreliose folgen diesen Symptomen bei der Gürtelrose jedoch in der Regel Hautausschläge, die aus mehreren kleinen Bläschen entlang des Dermatoms eines Nervs bestehen, und die Gürtelrose kann auch durch schnelle Labortests bestätigt werden. ⓘ
Die durch die Lyme-Borreliose verursachte Gesichtslähmung (LDFP) wird häufig als Bellsche Lähmung fehldiagnostiziert. Obwohl die Bell-Lähmung die häufigste Form der einseitigen Gesichtslähmung ist (etwa 70 % der Fälle), kann die LDFP in Gebieten, in denen Borreliose häufig vorkommt, etwa 25 % der Fälle von Gesichtslähmung ausmachen. Im Vergleich zur LDFP sind bei der Bellschen Lähmung viel seltener beide Gesichtshälften betroffen. Obwohl LDFP und Bell-Lähmung ähnliche Symptome aufweisen und sich unbehandelt ähnlich entwickeln, ist eine Kortikosteroidbehandlung bei der Bell-Lähmung von Vorteil, während sie bei der LDFP schädlich ist. Bei einer kürzlichen Exposition in einem wahrscheinlichen Zeckenhabitat während der wärmeren Monate, einem EM-Ausschlag, virusähnlichen Symptomen wie Kopfschmerzen und Fieber und/oder einer Lähmung beider Gesichtshälften sollte die Wahrscheinlichkeit einer LDFP geprüft werden; wenn diese mehr als minimal ist, sollte eine empirische Therapie mit Antibiotika ohne Kortikosteroide eingeleitet und nach Abschluss der Labortests für Borreliose erneut geprüft werden. ⓘ
Im Gegensatz zur viralen Meningitis verursacht die lymphozytäre Lyme-Meningitis in der Regel kein Fieber, dauert länger und tritt immer wieder auf. Die lymphozytäre Meningitis ist auch dadurch gekennzeichnet, dass sie möglicherweise zusammen mit einem EM-Ausschlag, einer Gesichtslähmung oder einer teilweisen Sehbehinderung auftritt und einen viel geringeren Prozentsatz an polymorphkernigen Leukozyten im Liquor aufweist. ⓘ
Eine Lyme-Radikulopathie, die die Gliedmaßen betrifft, wird häufig als Radikulopathie fehldiagnostiziert, die durch eine Nervenwurzelkompression verursacht wird, wie z. B. Ischias. Obwohl die meisten Fälle von Radikulopathie kompressiv sind und mit konservativer Behandlung (z. B. Ruhe) innerhalb von 4-6 Wochen abklingen, empfehlen die Leitlinien für die Behandlung von Radikulopathie, zunächst die Risiken anderer möglicher Ursachen zu bewerten, die zwar weniger häufig sind, aber eine sofortige Diagnose und Behandlung erfordern, einschließlich Infektionen wie Lyme-Borreliose und Gürtelrose. Eine Anamnese von Outdoor-Aktivitäten in wahrscheinlichen Zeckenhabitaten in den letzten drei Monaten, möglicherweise gefolgt von einem Hautausschlag oder virenähnlichen Symptomen, sowie aktuelle Kopfschmerzen, andere Symptome einer lymphozytären Meningitis oder Gesichtslähmung würden den Verdacht auf eine Lyme-Borreliose nahelegen und eine serologische Untersuchung oder eine Lumbalpunktion zur Bestätigung empfehlen. ⓘ
Eine Lyme-Radikulopathie, die den Rumpf betrifft, kann als eine Vielzahl anderer Erkrankungen fehldiagnostiziert werden, wie z. B. Divertikulitis und akutes Koronarsyndrom. Die Diagnose der Lyme-Borreliose im Spätstadium wird häufig durch ein vielgestaltiges Erscheinungsbild und unspezifische Symptome erschwert, was einen Rezensenten dazu veranlasste, die Lyme-Borreliose als den neuen "großen Imitator" zu bezeichnen. Borreliose kann als Multiple Sklerose, rheumatoide Arthritis, Fibromyalgie, chronisches Müdigkeitssyndrom, Lupus, Morbus Crohn, HIV oder andere Autoimmun- und neurodegenerative Krankheiten fehldiagnostiziert werden. Da alle Menschen mit einer Infektion im Spätstadium einen positiven Antikörpertest haben, können einfache Bluttests die Borreliose als mögliche Ursache für die Symptome einer Person ausschließen. ⓘ
Vorbeugung
Zeckenstichen kann vorgebeugt werden, indem der Aufenthalt in möglichen Zeckengebieten vermieden oder reduziert wird und Vorsichtsmaßnahmen getroffen werden, wenn man sich in einem solchen Gebiet aufhält oder es verlässt. ⓘ
Die meisten Lyme-Infektionen beim Menschen werden durch Bisse von Ixodes-Nymphen zwischen April und September verursacht. Zecken bevorzugen feuchte, schattige Standorte in Wäldern, Sträuchern, hohen Gräsern und Laubstreu oder Holzhaufen. Die Zeckendichte ist in der Regel in Wäldern am höchsten, gefolgt von ungepflegten Waldrändern und Rasenflächen (etwa halb so hoch), Zierpflanzen und mehrjährigen Bodendeckern (etwa ein Viertel) und Rasenflächen (etwa 30 Mal weniger). Ixodes-Larven und -Nymphen sind in der Regel auch dort zu finden, wo Mäuse nisten, z. B. an Steinmauern und Holzstämmen. Ixodes-Larven und -Nymphen warten in der Regel mit ausgestreckten Vorderbeinen auf Blättern oder Gräsern in Bodennähe auf potenzielle Wirte ("quest"); wenn ein Wirt gegen seine Gliedmaßen streift, klammert sich die Zecke schnell fest und klettert auf den Wirt, um eine Hautstelle zum Beißen zu finden. Im Nordosten der Vereinigten Staaten werden schätzungsweise 69 % der Zeckenbisse in Wohnungen, 11 % in Schulen oder Lagern, 9 % in Parks oder Erholungsgebieten, 4 % bei der Arbeit, 3 % bei der Jagd und 4 % in anderen Gebieten durchgeführt. Zu den Tätigkeiten, die mit Zeckenbissen in Wohngebieten in Verbindung gebracht werden, gehören Gartenarbeit, Beseitigen von Gestrüpp, Gartenarbeit, Spielen im Garten und das Mitbringen von Hunden oder Katzen ins Haus, die sich draußen in waldigen oder grasbewachsenen Gebieten aufhalten. In Parks kommt es häufig zu Zeckenstichen beim Wandern oder Zelten. Auf einem gemähten Rasen oder in der Mitte eines Weges zu gehen, ohne die angrenzende Vegetation zu berühren, ist weniger riskant als auf einem Baumstamm oder einer Steinmauer zu krabbeln oder zu sitzen. Haustiere sollten nicht frei in wahrscheinlichen Zeckenhabitaten herumlaufen dürfen. ⓘ
Als Vorsichtsmaßnahme empfiehlt die CDC, Kleidung, Schuhe und Campingausrüstung wie Zelte, Rucksäcke und Schlafsäcke mit einer 0,5 %igen Permethrinlösung zu tränken oder zu besprühen und vor der Benutzung zum Trocknen aufzuhängen. Permethrin ist geruchlos und für den Menschen ungefährlich, für Zecken jedoch hochgiftig. Nachdem sie nur 10 bis 20 Sekunden lang auf mit Permethrin behandeltem Stoff herumgekrabbelt sind, werden die Zeckennymphen irritiert und fallen ab oder sterben. Mit Permethrin behandelte geschlossene Schuhe und Socken verringern die Zahl der Bisse von Nymphen, die zum ersten Mal mit dem Schuh einer Person in Berührung kommen, die ebenfalls behandelte kurze Hosen trägt, um das 74-fache (da Nymphen in der Regel in Bodennähe suchen, ist dies ein typisches Kontaktszenario). Ein besserer Schutz kann erreicht werden, indem mit Permethrin behandelte Hosen in behandelte Socken und ein behandeltes langärmeliges Hemd in die Hose gesteckt werden, um die Lücken zu minimieren, durch die eine Zecke auf die Haut des Trägers gelangen könnte. Helle Kleidung kann es erleichtern, Zecken zu sehen und sie zu entfernen, bevor sie zustechen. Es wurde festgestellt, dass mit Permethrin behandelte Uniformen beim Militär und bei Arbeitern im Freien die Zahl der Bissverletzungen um 80-95 % verringern. Der Schutz durch Permethrin hält mehrere Wochen an, wenn die mit Permethrin behandelten Kleidungsstücke vom Kunden getragen und gewaschen werden, und bis zu 70 Mal, wenn die Kleidungsstücke in der Fabrik gewaschen werden. Permethrin sollte nicht auf menschlicher Haut, Unterwäsche oder Katzen verwendet werden. ⓘ
Die EPA empfiehlt verschiedene Zeckenabwehrmittel für die Verwendung auf ungeschützter Haut, darunter DEET, Picaridin, IR3535 (ein Derivat der Aminosäure Beta-Alanin), Zitronen-Eukalyptus-Öl (OLE, eine natürliche Verbindung) und den OLE-Wirkstoff Para-Menthan-Diol (PMD). Im Gegensatz zu Permethrin wirken Repellentien zwar abweisend, töten Zecken aber nicht, schützen nur für einige Stunden nach dem Auftragen und können durch Schweiß oder Wasser abgewaschen werden. Das beliebteste Repellent ist DEET in den USA und Picaridin in Europa. Im Gegensatz zu DEET ist Picaridin geruchlos und kann die Haut weniger reizen oder Stoffe und Kunststoffe angreifen. Repellentien mit höherer Konzentration halten zwar länger, sind aber nicht wirksamer; gegen Zecken können 20 % Picaridin 8 Stunden lang wirken im Vergleich zu 55-98,11 % DEET für 5-6 Stunden oder 30-40 % OLE für 6 Stunden. Repellentien sollten nicht unter der Kleidung, auf Augen, Mund, Wunden oder Schnitten oder bei Säuglingen unter 2 Monaten (3 Jahre bei OLE oder PMD) verwendet werden. Wenn Sonnenschutzmittel verwendet wird, sollte das Repellent darüber aufgetragen werden. Repellentien sollten nicht direkt auf das Gesicht gesprüht, sondern auf eine Hand gesprüht und dann auf das Gesicht gerieben werden. ⓘ
Wenn man ins Haus kommt, sollten Kleidung, Ausrüstung und Haustiere auf Zecken untersucht werden. Die Kleidung kann 10 Minuten lang in einen heißen Trockner gelegt werden, um Zecken abzutöten (nur Waschen oder ein warmer Trockner reichen nicht aus). So bald wie möglich zu duschen, am ganzen Körper nach Zecken zu suchen und sie zu entfernen, verringert das Infektionsrisiko. Ungenährte Zeckennymphen haben die Größe eines Mohnsamens, aber ein oder zwei Tage nach dem Biss und dem Anheften an den Menschen sehen sie wie eine kleine Blutblase aus. Die folgenden Bereiche sollten besonders sorgfältig untersucht werden: Achselhöhlen, zwischen den Beinen, Kniekehlen, Bauchnabel, Rumpf sowie bei Kindern Ohren, Nacken und Haare. ⓘ
Zeckenentfernung

Angeheftete Zecken sollten umgehend entfernt werden. Das Infektionsrisiko steigt mit dem Zeitpunkt der Anhaftung, aber in Nordamerika ist das Risiko einer Borreliose gering, wenn die Zecke innerhalb von 36 Stunden entfernt wird. Die CDC empfiehlt, eine feinspitzige Pinzette zwischen Haut und Zecke einzuführen, sehr fest zuzugreifen und die geschlossene Pinzette gerade von der Haut wegzuziehen, ohne die Zecke zu drehen, zu ruckeln, zu quetschen oder zu quetschen. Nach dem Entfernen der Zecke sollten alle in der Haut verbliebenen Zeckenteile möglichst mit einer sauberen Pinzette entfernt werden. Die Wunde und die Hände sollten dann mit Alkohol oder Wasser und Seife gereinigt werden. Die Zecke kann in einem Behälter mit Alkohol, einem versiegelten Beutel oder Klebeband entsorgt oder in der Toilette heruntergespült werden. Die gebissene Person sollte aufschreiben, wo und wann sie gebissen wurde, damit sie dies einem Arzt mitteilen kann, falls die Person in den folgenden Wochen einen Ausschlag oder grippeähnliche Symptome bekommt. Die CDC empfiehlt, die Zecke nicht mit den Fingern, Nagellack, Vaseline oder Hitze zu entfernen. ⓘ
In Australien, wo die Australische Lähmungszecke weit verbreitet ist, empfiehlt die Australasian Society of Clinical Immunology and Allergy, die Zecke nicht mit einer Pinzette zu entfernen, da dies bei einer Allergie zu Anaphylaxie führen könnte. Stattdessen sollte ein Produkt auf die Zecke gesprüht werden, das sie gefrieren lässt und dann abfällt. Ein Arzt würde flüssigen Stickstoff verwenden, aber auch in der Apotheke erhältliche Produkte zum Einfrieren von Warzen können verwendet werden. Eine andere, aus Australien stammende Methode besteht darin, mit einem etwa 20 cm langen Stück Zahnseide oder Angelschnur langsam einen Überhandknoten zwischen der Haut und der Zecke zu machen und sie dann aus der Haut zu ziehen. ⓘ
Vorbeugende Antibiotika
Das Risiko einer infektiösen Übertragung steigt mit der Dauer des Zeckenbefalls. Es dauert zwischen 36 und 48 Stunden, bis die Lyme-Bakterien aus dem Inneren der Zecke in deren Speichel übergehen. Wenn eine Hirschzecke, die mit hinreichender Wahrscheinlichkeit Borrelien trägt, an einer Person gefunden und entfernt wird, und wenn die Zecke 36 Stunden angeheftet oder verstopft ist, kann eine Einzeldosis Doxycyclin, die innerhalb von 72 Stunden nach der Entfernung verabreicht wird, das Risiko einer Lyme-Borreliose verringern. Diese Behandlung wird im Allgemeinen nicht für alle gebissenen Personen empfohlen, da die Entwicklung einer Infektion selten ist: Etwa 50 gebissene Personen müssten auf diese Weise behandelt werden, um einen Fall von Erythema migrans (d. h. den typischen Ausschlag, der bei etwa 70-80 % der Infizierten auftritt) zu verhindern. ⓘ
Landschaftsgestaltung im Garten
Verschiedene Maßnahmen zur Gartengestaltung können das Risiko von Zeckenbissen in Wohngärten verringern. Der Rasen sollte gemäht, Laubstreu und Unkraut entfernt und Bodendecker vermieden werden. Wälder, Sträucher, Steinmauern und Holzstapel sollten durch eine 3 Fuß breite Stein- oder Holzspanbarriere vom Rasen getrennt werden. Ohne Vegetation auf der Barriere werden Zecken diese in der Regel nicht überqueren; sie kann auch mit Akariziden besprüht werden, um Zecken abzutöten. Eine sonnenexponierte, zeckensichere Zone, die mindestens 3 m von der Barriere entfernt ist, sollte die menschlichen Aktivitäten im Garten einschränken, einschließlich Terrassen, Spielplätze und Gartenarbeit. Auf dem Boden unter Terrassen und Spielplätzen können Materialien wie Holzbeläge, Beton, Ziegelsteine, Kies oder Holzspäne verwendet werden, um Zecken abzuschrecken. Ein 8 Fuß hoher Zaun kann hinzugefügt werden, um Rehe von der zeckensicheren Zone fernzuhalten. ⓘ
Berufliche Exposition
Arbeitnehmer, die im Freien arbeiten, sind einem Borreliose-Risiko ausgesetzt, wenn sie an Standorten mit infizierten Zecken arbeiten. Dazu gehören Baugewerbe, Landschaftsbau, Forstwirtschaft, Entrümpelungsarbeiten, Landvermessung, Landwirtschaft, Eisenbahnarbeiten, Ölfeldarbeiten, Arbeiten an Versorgungsleitungen, Park- oder Wildtiermanagement. Das höchste Risiko, infizierten Zecken ausgesetzt zu sein, besteht für Arbeitnehmer in den nordöstlichen und nordzentralen Bundesstaaten der Vereinigten Staaten. Zecken können auch andere durch Zecken übertragene Krankheiten auf Arbeitnehmer in diesen und anderen Regionen des Landes übertragen. An Arbeitsplätzen mit Wäldern, Büschen, hohem Gras oder Laubstreu gibt es wahrscheinlich mehr Zecken. Arbeitnehmer, die im Freien arbeiten, sollten sich im späten Frühjahr und im Sommer, wenn die jungen Zecken am aktivsten sind, besonders sorgfältig schützen. ⓘ
Wirtstiere
Zecken können sich vom Blut einer breiten Palette möglicher Wirtsarten ernähren, darunter Eidechsen, Vögel, Mäuse, Katzen, Hunde, Rehe, Rinder und Menschen. Das Ausmaß, in dem sich eine Zecke ernähren, vermehren und verbreiten kann, hängt von der Art und Verfügbarkeit ihrer Wirte ab. Ob sie Krankheiten übertragen kann, hängt auch von den verfügbaren Wirten ab. Einige Arten, wie z. B. Eidechsen, werden als "Verdünnungswirte" bezeichnet, da sie nicht dazu neigen, Borreliose-Erreger zu beherbergen, und so die Wahrscheinlichkeit verringern, dass die Krankheit durch Zecken, die sich von ihnen ernähren, weitergegeben wird. Weißwedelhirsche sind sowohl eine Nahrungsquelle als auch ein "Fortpflanzungswirt", in dem sich Zecken zu paaren pflegen. Die Weißfußmaus ist ein Reservoirwirt, in dem der Erreger der Lyme-Borreliose überleben kann. Die Verfügbarkeit von Wirten kann erhebliche Auswirkungen auf die Übertragung der Lyme-Borreliose haben. Eine größere Vielfalt von Wirten oder von solchen, die den Erreger nicht beherbergen, verringert tendenziell die Wahrscheinlichkeit, dass die Krankheit übertragen wird. ⓘ
In den Vereinigten Staaten bestand ein Ansatz zur Verringerung des Auftretens der Lyme-Borreliose und anderer von Hirschzecken übertragener Krankheiten darin, die Hirschpopulation, von der die erwachsenen Zecken für ihre Ernährung und Fortpflanzung abhängen, stark zu reduzieren. Die Fälle von Lyme-Borreliose gingen nach der Ausrottung der Hirsche auf der Insel Monhegan (Maine) und nach der Kontrolle der Hirsche in Mumford Cove (Connecticut) zurück. Befürworter haben vorgeschlagen, die Hirschpopulation auf 8 bis 10 Rehe pro Quadratmeile zu reduzieren, während in den Gebieten des Landes mit den höchsten Borreliose-Raten 60 oder mehr Rehe pro Quadratmeile leben. ⓘ
Andere haben darauf hingewiesen, dass Rehe zwar Fortpflanzungswirte sind, aber keine Borrelienreservoire darstellen. Forscher vermuten, dass kleinere, weniger offensichtliche Borrelienreservoire wie Weißfußmäuse und Streifenhörnchen einen stärkeren Einfluss auf das Auftreten von Borreliose haben könnten. Ökosystemstudien im Bundesstaat New York deuten darauf hin, dass Weißfußmäuse gut gedeihen, wenn die Wälder in kleinere, isolierte Waldstücke mit weniger Nagetierräubern unterteilt sind. Je mehr Nagetiere die Krankheit beherbergen, desto größer ist die Wahrscheinlichkeit, dass sich eine Zecke von einem Nagetier ernährt, das die Krankheit in sich trägt, und dass jemand in seinem Garten oder bei einem Waldspaziergang eine Zecke aufnimmt, die die Krankheit überträgt. Die Daten deuten darauf hin, dass je kleiner das Waldgebiet ist, desto mehr Zecken sind dort anzutreffen und desto wahrscheinlicher ist es, dass sie die Borreliose übertragen, was den Gedanken stützt, dass Abholzung und Lebensraumfragmentierung Zecken, Wirte und die Krankheitsübertragung beeinflussen. ⓘ
Schätzungen zufolge sind weltweit etwa 80 % der Rinder von durch Zecken übertragenen Krankheiten betroffen. Sie betreffen auch Katzen, Hunde und andere Haustiere. Die routinemäßige tierärztliche Bekämpfung von Zecken bei Haustieren durch den Einsatz von Akariziden wurde als Möglichkeit vorgeschlagen, die Exposition des Menschen gegenüber Zecken zu verringern. Die chemische Bekämpfung mit Akariziden wird jedoch aus einer Reihe von Gründen kritisiert. Zecken scheinen eine Resistenz gegen Akarizide zu entwickeln, Akarizide sind teuer, und es bestehen Bedenken hinsichtlich ihrer Toxizität und der Möglichkeit, dass chemische Rückstände Lebensmittel und die Umwelt beeinträchtigen. ⓘ
In Europa sind 9 kleine Säugetiere, 7 mittelgroße Säugetiere und 16 Vogelarten (einschließlich Sperlingsvögel, Seevögel und Fasane) als Reservoir für Borrelia burgdorferi bekannt. Diese Tiere scheinen die Spirochäten auf Zecken zu übertragen und somit an der natürlichen Zirkulation von B. burgdorferi in Europa teilzunehmen. Auch die Hausmaus steht im Verdacht, ebenso wie andere Arten kleiner Nagetiere, insbesondere in Osteuropa und Russland. "Die Reservoir-Spezies, die die meisten Erreger enthalten, sind die europäischen Rehe (Capreolus capreolus); "sie scheinen nicht als Hauptreservoir für B. burgdorferi zu dienen", dachten Jaenson & al. (1992) (inkompetenter Wirt für B. burgdorferi und FSME-Virus), aber sie sind wichtig für die Fütterung der Zecken, wie Rothirsche und Wildschweine (Sus scrofa), bei denen eine Rickettsien- und drei Borrelien-Spezies identifiziert wurden", mit hohem Risiko einer Koinfektion bei Rehen. Dennoch wurden in den 2000er Jahren bei Rehen in Europa "zwei Rickettsia- und zwei Borrelia-Arten identifiziert". ⓘ
Impfung
Derzeit gibt es keine Impfstoffe für den Menschen gegen Borreliose. Mit dem Impfstoffkandidaten VLA15 soll im dritten Quartal 2022 eine Phase-3-Studie beginnen, und weitere Forschungsarbeiten laufen. Zur Vorbeugung der Lyme-Borreliose bei Hunden stehen mehrere Impfstoffe zur Verfügung. ⓘ
VLA15
Der Impfstoffkandidat VLA15 auf der Basis sechswertiger (OspA) Proteinuntereinheiten wurde von Valneva entwickelt. Im Juli 2017 erhielt er von der US-Arzneimittelbehörde FDA den Fast-Track-Status. Im April 2020 zahlte Pfizer 130 Millionen US-Dollar für die Rechte an dem Impfstoff, und die Unternehmen entwickeln ihn gemeinsam und führen mehrere Phase-2-Studien durch. ⓘ
Eine Phase-3-Studie mit VLA15 wird in Maine durchgeführt, die Registrierung beginnt im Juli 2022. Im Rahmen der Studie erhalten die Teilnehmer zwei Impfungen im Abstand von zwei Monaten und eine dritte Impfung nach sechs Monaten. Die Dauer der Studie ist auf 13 Monate angesetzt. ⓘ
LYMErix
Der Impfstoff LYMErix war von 1998 bis 2002 erhältlich. Der rekombinante Impfstoff gegen Borreliose, der auf dem äußeren Oberflächenprotein A (ospA) von B. burgdorferi basiert, wurde von SmithKline Beecham entwickelt. In klinischen Studien mit mehr als 10 000 Personen wurde festgestellt, dass der Impfstoff bei 76 % der Erwachsenen und 100 % der Kinder eine schützende Immunität gegen Borrelien verleiht, wobei nur leichte oder mäßige und vorübergehende unerwünschte Wirkungen auftraten. Auf der Grundlage dieser Studien wurde LYMErix am 21. Dezember 1998 von der Food and Drug Administration (FDA) zugelassen. ⓘ
Nach der Zulassung des Impfstoffs erfolgte die Einführung in die klinische Praxis aus verschiedenen Gründen nur langsam, u. a. wegen der Kosten, die von den Krankenkassen häufig nicht erstattet wurden. In der Folge berichteten Hunderte von Impflingen, dass sie Autoimmunerkrankungen und andere Nebenwirkungen entwickelt hatten. Unterstützt von einigen Interessengruppen wurde eine Reihe von Sammelklagen gegen GlaxoSmithKline eingereicht, in denen behauptet wurde, der Impfstoff habe diese Gesundheitsprobleme verursacht. Diese Behauptungen wurden von der FDA und den Centers for Disease Control untersucht, die keinen Zusammenhang zwischen dem Impfstoff und den Autoimmunbeschwerden feststellen konnten. ⓘ
Obwohl es keine Beweise dafür gab, dass die Beschwerden durch den Impfstoff verursacht wurden, brachen die Verkaufszahlen ein, so dass LYMErix im Februar 2002 von GlaxoSmithKline angesichts der negativen Medienberichterstattung und der Befürchtungen über Nebenwirkungen des Impfstoffs vom US-Markt genommen wurde. Das Schicksal von LYMErix wurde in der medizinischen Fachliteratur als "abschreckendes Beispiel" beschrieben; in einem Leitartikel in Nature wurde die Rücknahme von LYMErix als Beispiel dafür angeführt, dass "unbegründete Ängste in der Öffentlichkeit Druck auf die Entwickler von Impfstoffen ausüben, der über vernünftige Sicherheitsüberlegungen hinausgeht". Der ursprüngliche Entwickler des OspA-Impfstoffs am Max-Planck-Institut erklärte gegenüber Nature: "Das zeigt, wie irrational die Welt sein kann ... Es gab keine wissenschaftliche Rechtfertigung dafür, dass der erste OspA-Impfstoff LYMErix zurückgezogen wurde." ⓘ
Andere Forschung
Ein mRNA-Impfstoff, der eine starke und schnelle Immunreaktion auf Zeckenspeichel auslösen soll, ermöglichte es dem Immunsystem, die Zecken bei Versuchstieren aufzuspüren und zu entfernen, bevor sie in der Lage waren, die infektiösen Bakterien zu übertragen. Der Impfstoff enthält mRNAs, die den Körper veranlassen, 19 Proteine im Zeckenspeichel zu bilden, die durch die schnelle Entwicklung eines Erythems (juckende Rötung) an der Bissstelle die Meerschweinchen vor Borreliose schützen. Der Impfstoff schützt die Versuchstiere auch dann, wenn die Zecke nicht entfernt wird, wenn nur eine, aber nicht drei Zecken an ihr haften bleiben. ⓘ
Impfstoffe für Hunde
Für Hunde wurden Impfstoffe zur Vorbeugung der Borreliose bei Hunden entwickelt und zugelassen. Derzeit sind drei Borreliose-Impfstoffe erhältlich. Der von Fort Dodge Laboratories entwickelte Impfstoff LymeVax enthält intakte tote Spirochäten, die den Wirt dem Organismus aussetzen. Galaxy Lyme, der Impfstoff von Intervet-Schering-Plough, zielt auf die Proteine OspC und OspA ab. Die OspC-Antikörper töten alle Bakterien ab, die noch nicht von den OspA-Antikörpern abgetötet wurden. Canine Recombinant Lyme von Merial erzeugt Antikörper gegen das OspA-Protein, so dass eine Zecke, die sich von einem geimpften Hund ernährt, Blut voller Anti-OspA-Antikörper aufnimmt, die die Spirochäten im Darm der Zecke abtöten, bevor sie auf den Hund übertragen werden. ⓘ
Spätstadium
Mikrobiologische Untersuchungen weisen auf verschiedene Erschwernisse bei der antibiotischen Behandlung der Lyme-Borreliose im Spätstadium hin: die Bildung zystischer Formen, die Bildung eines sogenannten Biofilms, einer Erregerkolonie, die von extrazellulären polymeren Substanzen umgeben ist, die Antibiotika hindern einzudringen, sowie der intrazelluläre Aufenthalt und die Tatsache, dass sich ein beachtlicher Anteil der Erreger im ZNS aufhält. Insofern ist fraglich, ob Antibiotika im Spätstadium noch eine Erregereliminierung erreichen können. ⓘ
Die Verabreichungsform und Länge der Antibiotikatherapie richtet sich nach dem Krankheitsstadium, aber insbesondere nach der Krankheitsmanifestation. Hierbei sind individuelle Risikofaktoren der Patienten (wie z. B. eine Antibiotikaallergie oder eine Niereninsuffizienz) zu berücksichtigen. Je länger eine Borrelieninfektion dauert, umso schwieriger wird es, eine komplette Erregereliminierung zu erreichen. Es wird zwischen extrazellulären (außerhalb der Körperzellen) und intrazellulären Formen (in Zellen des Bindegewebes, des Knorpels, des Fettgewebes und der Haut) des Erregers unterschieden. Im Laborversuch hat sich dabei gezeigt, dass der Erreger binnen Stunden zwischen beiden Formen wechseln kann. Es ist jedoch bis heute nicht geklärt, ob es sich dabei um reversible Formen des Erregers handelt. Für die Therapie stehen grundsätzlich verschiedene Antibiotika zur Verfügung. ⓘ
Ein extrazellulär wirkendes Antibiotikum ist Ceftriaxon, das intravenös über 14 bis 21 Tage in einer Dosis von 2 g pro Tag gegeben wird. In einer Metaanalyse von acht europäischen Studien mit insgesamt 300 Patienten mit definitiver Neuroborreliose zeigte sich kein statistisch signifikanter Unterschied beim Behandlungserfolg zwischen einer oralen Doxycyclin-Therapie im Vergleich zur intravenösen Therapie mit Penicillin G oder Ceftriaxon. Therapieversager sind mit allen Antibiotika und darauf basierenden Behandlungsregimen festgestellt worden. Die antibiotische Behandlung nach Standard (IDSA, sonstige Leitlinien der AWMF) im Spätstadium weist eine Versagerquote von 50 % auf. Zur Antibiotika-Behandlung von mehr als 14 bis 30 Tagen bei Patienten mit Lyme-Borreliose gibt es bisher nur wenig Studienmaterial, entsprechend ist eine längere Antibiotikagabe bei der Lyme-Borreliose nicht hinreichend durch wissenschaftliche Studien erforscht. Bei einer Langzeitantibiose kann es zu schweren Nebenwirkungen kommen. Allen Antibiotika ist gemeinsam, dass eine längerfristige Einnahme das Mikrobiom irreversibel schädigt. Es kann bei monate- oder jahrelanger Antibiotikaeinnahme zu schweren Darminfektionen kommen, die mitunter einen lebensbedrohlichen Verlauf nehmen können. Besonders gefürchtet ist hierbei eine Infektion mit dem Bakterium Clostridioides difficile. Sie entsteht, wenn konkurrierende Arten der normalen Darmflora durch Antibiotika zurückgedrängt werden, sich C. difficile ungehindert vermehren kann und Gifte (Toxine) produziert. Aufgrund der Gefahr der Nebenwirkungen und fehlender wissenschaftlicher Evidenz für eine Langzeitantibiotikagabe wird von dieser Form der Behandlung von einem Großteil der Mediziner abgeraten. ⓘ
Eine placebokontrollierte Studie von 2008 konnte bei der Lyme-Enzephalopathie lediglich eine vorübergehende Besserung nach Durchführung einer zehnwöchigen Ceftriaxon-Behandlung zeigen. Offen blieb jedoch, ob diese Besserungen auf eine direkte Wirkung oder auf „positive Nebenwirkungen“ des Antibiotikums zurückzuführen waren. ⓘ
Wie in den Empfehlungen der Deutschen Gesellschaft für Neurologie zur Neuroborreliose ausgeführt ist, ist die optimale Behandlungsdauer vor allem mit den intravenös zu verabreichenden Antibiotika Ceftriaxon und Cefotaxim unklar. Eine Behandlungsdauer von mehr als drei Wochen ergebe jedoch laut der Gesellschaft keinen zusätzlichen Effekt. Inzwischen werden auch in fortgeschrittenen Stadien andere Antibiotika als Cephalosporine eingesetzt, unter anderem Doxycyclin (Tetracycline), da die β-Lactam-Antibiotika (wie Ceftriaxon, Cefotaxim) im Verdacht stehen, sogenannte zystische oder zellwandlose Formen zu verursachen und bei intrazellulärer Persistenz nicht zu wirken. Doxycyclin begünstigte jedoch bei neueren In-vitro-Untersuchungen ebenfalls die Biofilmbildung der Erreger. Einige Behandlungsformen bestehen aus einer Kombination von intravenösen und oralen Antibiotika. Es besteht ebenfalls die Möglichkeit einer Kombinationstherapie zweier oder mehrerer Antibiotika. ⓘ
Behandelt werden in diesem Stadium die chronische Neuroborreliose (den Leitlinien zufolge) mit Cephalosporin oder Doxycyclin, die Lyme-Arthritis sowie die Acrodermatitis chronica mit Doxycyclin, Amoxicillin oder Cefuroxim-Axetil. Für eine Behandlung der Lyme-Borreliose mit Cholestyramin ergibt sich weder eine wissenschaftliche Rationale, noch ergeben sich hierzu Argumente aus kontrollierten Studien. Eine solche Behandlung wird nicht empfohlen. ⓘ
Antibiotika sind die primäre Behandlung. Der spezifische Ansatz für ihren Einsatz hängt von der betroffenen Person und dem Stadium der Krankheit ab. Für die meisten Menschen mit einer frühen, lokal begrenzten Infektion wird die orale Verabreichung von Doxycyclin allgemein als erste Wahl empfohlen, da es nicht nur gegen Borrelien, sondern auch gegen eine Vielzahl anderer von Zecken übertragener Krankheiten wirksam ist. Menschen, die Doxycyclin einnehmen, sollten wegen des erhöhten Risikos eines Sonnenbrands die Sonne meiden. Doxycyclin ist kontraindiziert bei Kindern unter acht Jahren und bei Frauen, die schwanger sind oder stillen; Alternativen zu Doxycyclin sind Amoxicillin, Cefuroximaxetil und Azithromycin. Azithromycin wird nur bei einer Unverträglichkeit gegenüber den anderen Antibiotika empfohlen. Die Standardbehandlung für Zellulitis, Cephalexin, ist bei Borreliose nicht sinnvoll. Wenn unklar ist, ob ein Ausschlag durch Lyme-Borreliose oder Zellulitis verursacht wird, empfiehlt die IDSA eine Behandlung mit Cefuroxim oder Amoxicillin/Clavulansäure, da diese gegen beide Infektionen wirksam sind. Personen mit einer frühen disseminierten oder späten Lyme-Infektion können symptomatische Herzerkrankungen, Lyme-Arthritis oder neurologische Symptome wie Gesichtslähmung, Radikulopathie, Meningitis oder periphere Neuropathie aufweisen. Die intravenöse Verabreichung von Ceftriaxon wird in diesen Fällen als erste Wahl empfohlen; alternativ stehen Cefotaxim und Doxycyclin zur Verfügung. ⓘ
Die Gesichtslähmung kann sich ohne Behandlung zurückbilden; eine antibiotische Behandlung wird jedoch empfohlen, um andere Lyme-Komplikationen zu verhindern. Kortikosteroide werden nicht empfohlen, wenn die Gesichtslähmung durch Lyme-Borreliose verursacht wird. Bei Patienten mit Gesichtslähmung wird die häufige Verwendung von künstlichen Tränen im Wachzustand empfohlen, zusammen mit Salbe und einem Pflaster oder dem Abkleben des Auges im Schlaf. ⓘ
Etwa ein Drittel der Menschen mit Lyme-Karditis benötigt vorübergehend einen Herzschrittmacher, bis sich die Herzleitungsstörung zurückbildet, und 21 % müssen stationär behandelt werden. Lyme-Karditis sollte nicht mit Kortikosteroiden behandelt werden. ⓘ
Menschen mit Lyme-Arthritis sollten ihre körperliche Aktivität einschränken, um eine Schädigung der betroffenen Gelenke zu vermeiden, und beim Hinken Krücken benutzen. Schmerzen im Zusammenhang mit Lyme-Borreliose können mit nichtsteroidalen Antirheumatika (NSAIDs) behandelt werden. Kortikosteroid-Gelenkinjektionen werden bei Lyme-Arthritis, die mit Antibiotika behandelt wird, nicht empfohlen. Menschen mit Lyme-Arthritis, die mit intravenösen Antibiotika oder zwei Monate lang mit oralen Antibiotika behandelt wurden und zwei Monate nach der Behandlung weiterhin Gelenkschwellungen haben und bei denen der PCR-Test auf Borrelien-DNA in der Synovialflüssigkeit negativ ausfällt, leiden an einer antibiotikaresistenten Lyme-Arthritis; dies kommt häufiger nach einer Infektion mit bestimmten Borrelienstämmen bei Menschen mit bestimmten genetischen und immunologischen Merkmalen vor. Antibiotikarefraktäre Lyme-Arthritis kann symptomatisch mit NSAIDs, krankheitsmodifizierenden Antirheumatika (DMARDs) oder einer arthroskopischen Synovektomie behandelt werden. Für Erwachsene wird nach Abklingen der Lyme-Arthritis eine Physiotherapie empfohlen. ⓘ
Personen, die eine Behandlung erhalten, sollten darüber aufgeklärt werden, dass eine Reinfektion möglich ist und wie man sie verhindern kann. ⓘ
Da gerade im Frühstadium außer der Wanderröte kein sicherer Krankheitsnachweis möglich ist, stellt sich beim Auftreten von grippeähnlichen Symptomen oder Gelenkschmerzen kurz nach einem Zeckenstich die Frage einer Güterabwägung zwischen den Risiken und Nebenwirkungen einer auf Verdacht durchgeführten, eventuell überflüssigen mehrwöchigen Antibiotikatherapie einerseits und andererseits – bei Nichtdurchführung, aber auch einem denkbaren Misserfolg einer solchen Maßnahme – den möglichen gesundheitlichen, sozialen und finanziellen Folgen eines jahre- oder jahrzehntelangen chronischen Leidens, das bis hin zur Erwerbsunfähigkeit führen kann. ⓘ
Des Weiteren ist zu berücksichtigen, dass eine Herxheimer-Reaktion bei einer Behandlung mit Antibiotika auftreten kann. Entsprechende Untersuchungen zeigen, dass diese Reaktion vor allem bei einer Behandlung mit Cephalosporinen und Penicillinen, die zu den Betalactam-Antibiotika gehören, auftreten. Sie werden bislang bei der Lyme-Borreliose nicht sehr häufig beobachtet. Wichtig ist eine differentialdiagnostische Unterscheidung zu Nebenwirkungen des jeweiligen Antibiotikums, z. B. eine Superinfektion oder Allergie gegen Penicilline und Penicillin-Derivate. ⓘ
Vorhersage
Das typische erste Anzeichen der Lyme-Borreliose, der Ausschlag Erythema migrans (EM), verschwindet auch ohne Behandlung innerhalb weniger Wochen. Bei unbehandelten Menschen breitet sich die Infektion jedoch häufig auf das Nervensystem, das Herz oder die Gelenke aus und kann zu dauerhaften Schäden am Körpergewebe führen. ⓘ
Die besten Aussichten haben Menschen, die innerhalb weniger Tage nach Auftreten eines ersten EM-Ausschlags die empfohlene Antibiotikabehandlung erhalten. Eine vollständige oder sofortige Genesung ist nicht immer möglich. Der Prozentsatz der Personen, die in den Vereinigten Staaten eine vollständige Genesung erreichen, steigt von etwa 64-71 % am Ende der Behandlung des EM-Ausschlags auf etwa 84-90 % nach 30 Monaten; in Europa werden höhere Prozentsätze berichtet. Ein Behandlungsversagen, d. h. das Fortbestehen der ursprünglichen oder das Auftreten neuer Krankheitszeichen, tritt nur bei wenigen Menschen auf. Die übrigen Personen gelten als geheilt, leiden aber weiterhin unter subjektiven Symptomen, z. B. Gelenk- oder Muskelschmerzen oder Müdigkeit. Diese Symptome sind in der Regel leicht und nicht behindernd. ⓘ
Bei Menschen, die erst behandelt werden, nachdem sich die Krankheit im Nervensystem manifestiert hat, können zusätzlich zu den subjektiven Symptomen auch objektive neurologische Defizite auftreten. In Europa war durchschnittlich 32-33 Monate nach den ersten Lyme-Symptomen bei Personen, die hauptsächlich mit Doxycyclin 200 mg für 14-21 Tage behandelt wurden, der Prozentsatz der Personen mit anhaltenden Symptomen bei denjenigen, bei denen eine Neuroborreliose diagnostiziert wurde, viel höher (50 %) als bei denen, die nur einen EM-Ausschlag hatten (16 %). In einer anderen europäischen Studie waren 5 Jahre nach der Behandlung der Neuroborreliose anhaltende Symptome bei Kindern (15 %) seltener als bei Erwachsenen (30 %), und bei letzteren waren sie bei denjenigen, die innerhalb von 30 Tagen nach dem ersten Symptom behandelt wurden (16 %), seltener als bei denjenigen, die später behandelt wurden (39 %); von denjenigen mit anhaltenden Symptomen waren 54 % in ihren täglichen Aktivitäten eingeschränkt und 19 % waren krankgeschrieben oder arbeitsunfähig. ⓘ
Einige Daten deuten darauf hin, dass sich etwa 90 % der mit Antibiotika behandelten Lyme-Borreliose-Gesichtslähmungen im Median 24 Tage nach ihrem Auftreten vollständig erholen und die meisten anderen mit nur leichten Beeinträchtigungen zurückkehren. In Europa hatten jedoch 41 % der wegen einer Gesichtslähmung behandelten Personen bei der Nachuntersuchung bis zu sechs Monate später andere anhaltende Symptome, darunter 28 % mit Taubheitsgefühl oder veränderten Empfindungen und 14 % mit Müdigkeit oder Konzentrationsproblemen. Lähmungen in beiden Gesichtshälften sind mit einer schlechteren und längeren Erholungszeit verbunden. Historische Daten deuten darauf hin, dass unbehandelte Personen mit Gesichtslähmungen sich fast gleich schnell erholen, aber 88 % haben anschließend eine Lyme-Arthritis. Andere Untersuchungen zeigen, dass Synkinesen (unwillkürliche Bewegungen eines Gesichtsmuskels, wenn ein anderer Muskel willkürlich bewegt wird) erst 6-12 Monate nach der scheinbaren Behebung der Gesichtslähmung auftreten können, da geschädigte Nerven nachwachsen und sich manchmal mit falschen Muskeln verbinden. Synkinesen werden mit der Einnahme von Kortikosteroiden in Verbindung gebracht. Bei einer längerfristigen Nachbeobachtung erholen sich 16-23 % der Lyme-Gesichtslähmungen nicht vollständig. ⓘ
In Europa musste etwa ein Viertel der Personen mit Bannwarth-Syndrom (Lyme-Radikulopathie und lymphozytäre Meningitis), die durchschnittlich 30 Tage nach Auftreten der ersten Symptome 14 Tage lang mit intravenösem Ceftriaxon behandelt wurden, 3 bis 6 Monate später erneut behandelt werden, weil die klinische Reaktion nicht zufriedenstellend war oder weiterhin objektive Marker für eine Infektion im Liquor vorhanden waren; Nach 12 Monaten hatten sich 64 % vollständig erholt, 31 % hatten nicht behindernde leichte oder seltene Symptome, die keine regelmäßige Einnahme von Analgetika erforderten, und 5 % hatten Symptome, die behindernd waren oder eine erhebliche Einnahme von Analgetika erforderten. Die häufigsten anhaltenden, nicht behindernden Symptome waren Kopfschmerzen, Müdigkeit, veränderte Empfindungen, Gelenkschmerzen, Gedächtnisstörungen, Unwohlsein, radikuläre Schmerzen, Schlafstörungen, Muskelschmerzen und Konzentrationsstörungen. Zu den anhaltenden behindernden Symptomen gehörten Gesichtslähmungen und andere Bewegungseinschränkungen. ⓘ
Die Genesung von einer späten Neuroborreliose dauert in der Regel länger und ist weniger vollständig als bei einer frühen Neuroborreliose, wahrscheinlich wegen der irreversiblen neurologischen Schäden. ⓘ
Bei etwa der Hälfte der Menschen mit Lyme-Karditis kommt es zu einem vollständigen Herzblock, der sich jedoch in der Regel innerhalb einer Woche zurückbildet. Andere Lyme-Herzleitungsanomalien klingen in der Regel innerhalb von 6 Wochen ab. Etwa 94 % der Betroffenen erholen sich vollständig, aber 5 % benötigen einen dauerhaften Herzschrittmacher und 1 % leidet an einem anhaltenden Herzblock (der tatsächliche Prozentsatz kann aufgrund der nicht erkannten Fälle höher sein). Myokardiale Komplikationen durch Lyme-Borreliose sind in der Regel mild und selbstlimitierend. In einigen Fällen kann die Lyme-Karditis jedoch tödlich verlaufen. ⓘ
Die empfohlenen Antibiotikabehandlungen sind in etwa 90 % der Fälle von Lyme-Arthritis wirksam, obwohl es mehrere Monate dauern kann, bis die Entzündung abklingt, und häufig eine zweite Runde von Antibiotika erforderlich ist. Auch die antibiotikaresistente Lyme-Arthritis bildet sich schließlich zurück, in der Regel innerhalb von 9-14 Monaten (zwischen 4 Monaten und 4 Jahren); DMARDs oder eine Synovektomie können die Heilung beschleunigen. ⓘ
Eine Reinfektion ist nicht ungewöhnlich. In einer US-Studie hatten 6-11 % der wegen eines EM-Ausschlags behandelten Personen innerhalb von 30 Monaten einen weiteren EM-Ausschlag. Der zweite Ausschlag ist in der Regel auf eine Infektion mit einem anderen Borrelienstamm zurückzuführen. ⓘ
Menschen, die mehr als sechs Monate nach der empfohlenen Behandlung der Borreliose an unspezifischen, subjektiven Symptomen wie Müdigkeit, Gelenk- und Muskelschmerzen oder kognitiven Schwierigkeiten leiden, werden als Post-Treatment Lyme Disease Syndrome (PTLDS) bezeichnet. Bis 2016 war der Grund für die anhaltenden Symptome nicht bekannt; die Erkrankung wird im Allgemeinen ähnlich wie Fibromyalgie oder chronisches Müdigkeitssyndrom behandelt. ⓘ
Epidemiologie

Die Lyme-Borreliose tritt regelmäßig in den gemäßigten Regionen der nördlichen Hemisphäre auf. Es gibt Hinweise darauf, dass die Zeckenpopulationen und das Auftreten der Lyme-Borreliose zunehmen und sich in neue Gebiete ausbreiten, was zum Teil auf die mit dem Klimawandel einhergehenden wärmeren Temperaturen zurückzuführen ist. ⓘ
Afrika
In Nordafrika wurde B. burgdorferi sensu lato in Marokko, Algerien, Ägypten und Tunesien nachgewiesen. ⓘ
Die Lyme-Borreliose in den afrikanischen Ländern südlich der Sahara ist derzeit nicht bekannt, aber es gibt Hinweise darauf, dass sie beim Menschen in dieser Region auftreten kann. Die große Anzahl von Wirten und Zeckenvektoren würde die Verbreitung der Lyme-Borreliose in Afrika begünstigen. In Ostafrika wurden zwei Fälle von Lyme-Borreliose in Kenia gemeldet. ⓘ
Asien
Mit B. burgdorferi sensu lato infizierte Zecken werden immer häufiger in Japan sowie in Nordwestchina, Nepal, Thailand und im äußersten Osten Russlands gefunden. Auch in der Mongolei sind Borrelien isoliert worden. ⓘ
Europa
In Europa wird die Lyme-Borreliose durch eine Infektion mit einer oder mehreren pathogenen europäischen Genospezies der Spirochäte B. burgdorferi sensu lato verursacht, die hauptsächlich von der Zecke Ixodes ricinus übertragen wird. Fälle von mit B. burgdorferi sensu lato infizierten Zecken finden sich vor allem in Mitteleuropa, insbesondere in Slowenien und Österreich, wurden aber auch in fast allen anderen Ländern des Kontinents isoliert. Die Zahl der Fälle in Südeuropa, z. B. in Italien und Portugal, ist wesentlich geringer. Die Zahl der diagnostizierten Fälle in einigen westlichen Ländern, wie Island, steigt. ⓘ
Vereinigtes Königreich
Im Vereinigten Königreich ist die Zahl der im Labor bestätigten Borreliosefälle seit der Einführung der freiwilligen Meldepflicht im Jahr 1986, als im Vereinigten Königreich und in Irland zusammen 68 Fälle registriert wurden, stetig gestiegen. Im Vereinigten Königreich gab es 1988 23 und 1990 19 bestätigte Fälle, 2009 jedoch 973 und 2010 953. Die vorläufigen Zahlen für die ersten drei Quartale 2011 zeigen einen Anstieg um 26 % gegenüber dem gleichen Zeitraum 2010. ⓘ
Man geht jedoch davon aus, dass die tatsächliche Zahl der Fälle deutlich höher ist, als die oben genannten Zahlen vermuten lassen. Die britische Health Protection Agency schätzt, dass es zwischen 2.000 und 3.000 Fälle pro Jahr gibt (wobei durchschnittlich etwa 15 % der Infektionen im Ausland erworben werden), während Dr. Darrel Ho-Yen, Dr. Darrel Ho-Yen, Direktor des schottischen Toxoplasma-Referenzlabors und des Nationalen Borreliose-Testdienstes, ist der Ansicht, dass die Zahl der bestätigten Fälle mit 10 multipliziert werden sollte, "um falsch diagnostizierte Fälle, Tests mit falschen Ergebnissen, Betroffene, die nicht getestet wurden, Menschen, die infiziert sind, aber keine Symptome zeigen, Meldeversäumnisse und infizierte Personen, die keinen Arzt aufsuchen, zu berücksichtigen. " ⓘ
Obwohl die Borreliose (Infektion mit Borrelia burgdorferi) in Schottland seit Januar 1990 eine meldepflichtige Krankheit ist und daher auf der Grundlage eines klinischen Verdachts gemeldet werden sollte, wird davon ausgegangen, dass viele Allgemeinmediziner sich dieser Verpflichtung nicht bewusst sind. Die Meldepflicht, die sich nur auf Labortestergebnisse beschränkt, wurde im Oktober 2010 im gesamten Vereinigten Königreich mit den Health Protection (Notification) Regulations 2010 eingeführt. ⓘ
Obwohl es im New Forest, in der Salisbury-Ebene, im Exmoor, in den South Downs, in Teilen von Wiltshire und Berkshire, im Thetford Forest sowie an der Westküste und auf den Inseln Schottlands mehr Fälle von Borreliose gibt, sind infizierte Zecken weit verbreitet und kommen sogar in den Parks von London vor. In einem Bericht aus dem Jahr 1989 wurde festgestellt, dass 25 % der Forstarbeiter im New Forest seropositiv waren, ebenso wie zwischen 2 % und 4-5 % der allgemeinen lokalen Bevölkerung in diesem Gebiet. ⓘ
Tests an Haushunden, die 2009 landesweit durchgeführt wurden, ergaben, dass etwa 2,5 % der Zecken im Vereinigten Königreich infiziert sein könnten, was deutlich mehr ist als bisher angenommen. Man geht davon aus, dass die globale Erwärmung in Zukunft zu einer Zunahme der Zeckenaktivität führen könnte, ebenso wie zu einer Zunahme der Zeit, die Menschen in öffentlichen Parks verbringen, wodurch sich das Infektionsrisiko erhöht. ⓘ
Nord-Amerika
Zahlreiche Studien in Nordamerika haben ökologische und umweltbedingte Zusammenhänge mit der Zahl der an Borreliose erkrankten Menschen untersucht. Eine Studie aus dem Jahr 2005, in der die Klimaeignung von I. scapularis modelliert wurde, prognostizierte, dass der Klimawandel bis 2080 zu einer Zunahme des geeigneten Lebensraums für Vektoren um insgesamt 213 % führen würde, mit einer Ausdehnung nach Norden in Kanada, einer Zunahme der Eignung in der Mitte der USA und einer Abnahme des geeigneten Lebensraums und des Rückzugs der Vektoren im Süden der USA. Die Autoren vertraten die Ansicht, dass die Faktoren, die die Zeckendichte und das Risiko für den Menschen an verschiedenen Orten beeinflussen, noch nicht ausreichend bekannt sind und dass künftige Studien über längere Zeiträume durchgeführt werden sollten, dass sie über die Regionen hinweg stärker standardisiert werden sollten und dass die vorhandenen Kenntnisse über die regionale Ökologie der Lyme-Borreliose einbezogen werden sollten. ⓘ
Kanada
Das Verbreitungsgebiet der Zecken, die Borreliose übertragen können, hat sich von einem begrenzten Gebiet in Ontario auf Gebiete in Süd-Quebec, Manitoba, Nord-Ontario, Süd-Neubraunschweig, Südwest-Nova Scotia und begrenzte Teile von Saskatchewan und Alberta sowie British Columbia ausgedehnt. Es wurden Fälle bis zur Insel Neufundland gemeldet. Eine modellbasierte Vorhersage von Leighton et al. (2012) deutet darauf hin, dass sich das Verbreitungsgebiet der I. scapularis-Zecke in den nächsten zehn Jahren um 46 km/Jahr nach Kanada ausdehnen wird, wobei die Erwärmung des Klimas die Hauptursache für die zunehmende Ausbreitungsgeschwindigkeit darstellt. ⓘ
Mexiko
Eine Studie aus dem Jahr 2007 legt nahe, dass Borrelia burgdorferi-Infektionen in Mexiko endemisch sind. Zwischen 1999 und 2000 wurden vier Fälle gemeldet. ⓘ
Vereinigte Staaten
Im Jahr 2019 gab es nach Angaben der CDC etwa 35 000 bestätigte und wahrscheinliche Fälle in den USA, wobei die Fälle in fast allen Bundesstaaten auftraten. Die CDC führt derzeit Forschungen zur Bewertung und Diagnostik der Krankheit durch, und vorläufige Ergebnisse deuten darauf hin, dass die Zahl der neuen Fälle bei etwa 300.000 liegt. ⓘ
Die Borreliose ist die häufigste durch Zecken übertragene Krankheit in Nordamerika und Europa und eine der am schnellsten wachsenden Infektionskrankheiten in den Vereinigten Staaten. Bei den der CDC gemeldeten Fällen liegt das Verhältnis der Borreliose-Infektionen bei 7,9 Fällen pro 100.000 Personen. In den zehn Bundesstaaten, in denen die Lyme-Borreliose am häufigsten vorkommt, lag der Durchschnitt im Jahr 2005 bei 31,6 Fällen pro 100.000 Personen. ⓘ
Obwohl Borreliose in allen Bundesstaaten gemeldet wurde, beschränken sich 99 % aller gemeldeten Fälle auf nur fünf geografische Gebiete (Neuengland, Mittelatlantik, Ost-Nord-Zentral, Südatlantik und West-Nord-Zentral). Zur Bestimmung der bestätigten CDC-Überwachungsfälle werden die neuen CDC-Richtlinien zur Definition von Lyme-Fällen aus dem Jahr 2011 verwendet. ⓘ
Seit Januar 2008 misst die CDC dem Labornachweis von 1. einer positiven Kultur für B. burgdorferi, 2. einem zweistufigen Test (ELISA-Screening und Western-Blot-Bestätigung) oder 3. einem einstufigen IgG-Western-Blot (alte Infektion) das gleiche Gewicht bei. Bisher bezog die CDC nur Labornachweise auf der Grundlage von (1) und (2) in ihre Definition von Überwachungsfällen ein. Die Falldefinition umfasst nun auch die Verwendung des Western Blot ohne vorherigen ELISA-Screen. ⓘ
Die Zahl der gemeldeten Krankheitsfälle hat zugenommen, ebenso wie die Zahl der endemischen Regionen in Nordamerika. So ging man früher davon aus, dass sich B. burgdorferi sensu lato in Kalifornien nicht in einem enzootischen Zyklus halten kann, weil man davon ausging, dass die große Eidechsenpopulation die Zahl der von B. burgdorferi befallenen Menschen in den lokalen Zeckenpopulationen verdünnen würde; dies wurde inzwischen in Frage gestellt, da einige Hinweise darauf hindeuten, dass sich Eidechsen infizieren können. ⓘ
Mit Ausnahme einer Studie in Europa beruhen die meisten Daten, die auf Eidechsen hindeuten, auf dem DNA-Nachweis der Spirochäten und haben nicht gezeigt, dass Eidechsen in der Lage sind, Zecken zu infizieren, die sich von ihnen ernähren. Da einige Experimente darauf hindeuten, dass Eidechsen gegen eine Infektion mit Borrelien resistent sind, ist es wahrscheinlich, dass ihre Beteiligung am enzootischen Zyklus komplexer und artspezifisch ist. ⓘ
Während B. burgdorferi am häufigsten mit Zecken assoziiert ist, die von Weißwedelhirschen und weißfüßigen Mäusen beherbergt werden, wird Borrelia afzelii am häufigsten in sich von Nagetieren ernährenden Vektorzecken nachgewiesen, und Borrelia garinii und Borrelia valaisiana scheinen mit Vögeln assoziiert zu sein. Sowohl Nagetiere als auch Vögel sind kompetente Reservoirwirte für B. burgdorferi sensu stricto. Die Resistenz einer Genospezies von Lyme-Borreliose-Spirochäten gegen die bakteriolytischen Aktivitäten des alternativen Komplementwegs verschiedener Wirtsarten kann ihre Reservoirwirtsassoziation bestimmen. ⓘ
In Nordamerika können mehrere ähnliche, aber scheinbar unterschiedliche Erkrankungen auftreten, die von verschiedenen Borrelienarten oder -unterarten verursacht werden. Eine regional begrenzte Erkrankung, die möglicherweise mit einer Borrelieninfektion zusammenhängt, ist die Southern Tick-associated Rash Illness (STARI), auch bekannt als Masters-Krankheit. Amblyomma americanum, allgemein bekannt als die einsame Sternzecke, gilt als Hauptüberträger von STARI. In einigen Teilen des geografischen Verbreitungsgebiets von STARI ist die Lyme-Borreliose recht selten (z. B. in Arkansas), so dass Menschen in diesen Regionen, die Lyme-ähnliche Symptome haben - vor allem, wenn sie nach einem Biss einer Einsiedlerzecke auftreten -, STARI als Möglichkeit in Betracht ziehen sollten. Die Krankheit verläuft im Allgemeinen milder als Lyme-Borreliose und spricht in der Regel gut auf eine Antibiotikabehandlung an. ⓘ
In den letzten Jahren sind in Montana jährlich 5 bis 10 Fälle einer Lyme-ähnlichen Krankheit aufgetreten. Sie tritt hauptsächlich in Gebieten entlang des Yellowstone River in Zentral-Montana auf. Die Betroffenen bekommen einen roten Hautausschlag um einen Zeckenstich herum, gefolgt von wochenlanger Müdigkeit und Fieber. ⓘ
Die Auswirkungen der Borreliose sind bei Männern und Frauen vergleichbar. Ein breites Spektrum von Altersgruppen ist betroffen, wobei die Zahl der Fälle bei den 10- bis 19-Jährigen am höchsten ist. Aus unbekannten Gründen ist die Lyme-Borreliose bei Asiaten siebenmal häufiger anzutreffen. ⓘ
Südamerika
In Südamerika nehmen die Erkennung und das Auftreten von durch Zecken übertragenen Krankheiten zu. In Brasilien wurde eine Borreliose-ähnliche Krankheit, das Baggio-Yoshinari-Syndrom, festgestellt, die durch Mikroorganismen verursacht wird, die nicht zum B. burgdorferi sensu lato-Komplex gehören und von Zecken der Gattungen Amblyomma und Rhipicephalus übertragen werden. Der erste gemeldete Fall von BYS in Brasilien wurde 1992 in Cotia, São Paulo, festgestellt. ⓘ
Geschichte
Die Evolutionsgeschichte der Genetik von Borrelia burgdorferi ist Gegenstand neuerer Studien. Eine Studie hat ergeben, dass die Lyme-Borreliose vor der Wiederaufforstung, die mit der Aufgabe von Farmen in Neuengland nach der Kolonialzeit einherging, und vor der großen Einwanderung in den Mittleren Westen zu Beginn des 19. Jahrhunderts bereits seit Tausenden von Jahren in Amerika vorkam und sich zusammen mit ihren Zeckenwirten vom Nordosten in den Mittleren Westen ausgebreitet hatte. ⓘ
John Josselyn, der 1638 und erneut von 1663 bis 1670 Neuengland besuchte, schrieb: "Im Sommer hängen unendlich viele Zecken an den Büschen, die sich an den Kleidern der Menschen festkrallen und in die Hosen kriechen, um sich in kurzer Zeit in das Fleisch eines Menschen zu fressen. Ich habe gesehen, wie die Strümpfe derer, die durch den Wald gegangen sind, mit ihnen bedeckt waren." ⓘ
Dies wird auch durch die Schriften von Peter Kalm bestätigt, einem schwedischen Botaniker, der von Linnaeus nach Amerika gesandt wurde und bei seinem Besuch im Jahr 1749 feststellte, dass die Wälder von New York "reichlich" mit Zecken übersät waren. Als Kalms Reise 100 Jahre später zurückverfolgt wurde, waren die Wälder verschwunden, und das Lyme-Bakterium hatte sich wahrscheinlich auf einige wenige Gebiete entlang der Nordostküste, in Wisconsin und Minnesota beschränkt. ⓘ
Die vielleicht erste detaillierte Beschreibung dessen, was heute als Lyme-Borreliose bekannt ist, erschien in den Schriften von John Walker nach einem Besuch auf der Insel Jura (Deer Island) vor der Westküste Schottlands im Jahr 1764. Er beschreibt sowohl die Symptome der Lyme-Borreliose (mit "exquisiten Schmerzen [in] den inneren Teilen der Gliedmaßen") als auch den Zeckenüberträger selbst, den er als "Wurm" mit einem Körper "von rötlicher Farbe und zusammengedrückter Form mit einer Reihe von Füßen auf jeder Seite" beschreibt, der "in die Haut eindringt". Zwischen 1717 und dem Ende des 18. Jahrhunderts wanderten viele Menschen aus dieser Gegend Großbritanniens nach Nordamerika aus. ⓘ
Bei der Untersuchung konservierter Museumsexemplare wurde Borrelien-DNA in einer infizierten Ixodes ricinus-Zecke aus Deutschland gefunden, die aus dem Jahr 1884 stammt, sowie in einer infizierten Maus aus Cape Cod, die 1894 starb. Bei der Autopsie von Ötzi, dem Mann aus dem Eis, einer 5.300 Jahre alten Mumie, wurde 2010 die DNA-Sequenz von Borrelia burgdorferi nachgewiesen, was ihn zum frühesten bekannten Menschen mit Borreliose macht. ⓘ
Die frühen europäischen Studien über das, was heute als Borreliose bekannt ist, beschrieben die Hauterscheinungen. Die erste Studie stammt aus dem Jahr 1883 aus Breslau, Deutschland (heute Wrocław, Polen), wo der Arzt Alfred Buchwald einen Mann beschrieb, der 16 Jahre lang an einer degenerativen Hauterkrankung litt, die heute als Acrodermatitis chronica atrophicans bekannt ist. ⓘ
Auf einer Forschungskonferenz im Jahr 1909 stellte der schwedische Dermatologe Arvid Afzelius eine Studie über eine sich ausdehnende, ringförmige Läsion vor, die er bei einer älteren Frau nach dem Biss einer Schafszecke beobachtet hatte. Er nannte die Läsion Erythema migrans. Die heute als Borrelien-Lymphozytom bekannte Hauterkrankung wurde erstmals 1911 beschrieben. ⓘ
Die moderne Geschichte des medizinischen Verständnisses dieser Krankheit, einschließlich ihrer Ursache, Diagnose und Behandlung, war schwierig. ⓘ
Neurologische Probleme nach Zeckenbissen wurden erst in den 1920er Jahren erkannt. Die französischen Ärzte Garin und Bujadoux beschrieben einen Landwirt, der nach einem Zeckenbiss an einer schmerzhaften sensorischen Radikulitis und einer leichten Meningitis litt. Es wurde auch ein großer, ringförmiger Ausschlag festgestellt, den die Ärzte jedoch nicht mit der Meningoradikulitis in Verbindung brachten. 1930 war der schwedische Dermatologe Sven Hellerström der erste, der einen Zusammenhang zwischen EM und neurologischen Symptomen nach einem Zeckenbiss vorschlug. In den 1940er Jahren beschrieb der deutsche Neurologe Alfred Bannwarth mehrere Fälle von chronischer lymphozytärer Meningitis und Polyradikuloneuritis, von denen einige von erythematösen Hautläsionen begleitet waren. ⓘ
Carl Lennhoff, der am Karolinska-Institut in Schweden arbeitete, glaubte, dass viele Hautkrankheiten durch Spirochäten verursacht wurden. Im Jahr 1948 verwendete er eine spezielle Färbung, um mikroskopisch zu beobachten, was er für Spirochäten in verschiedenen Arten von Hautläsionen, einschließlich EM, hielt. Obwohl sich seine Schlussfolgerungen später als falsch herausstellten, wurde das Interesse an der Erforschung von Spirochäten geweckt. 1949 war Nils Thyresson, der ebenfalls am Karolinska-Institut arbeitete, der erste, der ACA mit Penicillin behandelte. In den 1950er Jahren wurde der Zusammenhang zwischen Zeckenbiss, Lymphozytom, EM und Bannwarth-Syndrom in ganz Europa erkannt, was zur weit verbreiteten Verwendung von Penicillin zur Behandlung in Europa führte. ⓘ
1970 erkannte ein Dermatologe in Wisconsin namens Rudolph Scrimenti eine EM-Läsion bei einer Person, nachdem er sich an einen Artikel von Hellerström erinnert hatte, der 1950 in einer amerikanischen Wissenschaftszeitschrift abgedruckt worden war. Dies war der erste dokumentierte Fall von EM in den Vereinigten Staaten. Auf der Grundlage der europäischen Literatur behandelte er die Person mit Penicillin. ⓘ
Das vollständige Syndrom, das heute als Lyme-Krankheit bekannt ist, wurde erst erkannt, als 1975 in drei Städten im Südosten von Connecticut, darunter die Städte Lyme und Old Lyme, eine Häufung von Fällen festgestellt wurde, die ursprünglich für juvenile rheumatoide Arthritis gehalten wurden und der Krankheit ihren populären Namen gaben. Dies wurde von den Ärzten David Snydman und Allen Steere vom Epidemic Intelligence Service und anderen von der Yale University untersucht, darunter Stephen Malawista, der als Mitentdecker der Krankheit gilt. Die Erkenntnis, dass die Menschen in den Vereinigten Staaten an EM erkrankt waren, führte zu der Erkenntnis, dass die "Lyme-Arthritis" eine Erscheinungsform der gleichen, in Europa bekannten, durch Zecken übertragenen Krankheit war. ⓘ
Vor 1976 wurden die Elemente einer Infektion mit B. burgdorferi sensu lato als durch Zecken übertragene Meningopolyneuritis, Garin-Bujadoux-Syndrom, Bannwarth-Syndrom, Afzelius-Krankheit, Montauk-Knie oder Schafszeckenfieber bezeichnet oder bekannt. Seit 1976 wird die Krankheit meist als Lyme-Krankheit, Lyme-Borreliose oder einfach als Borreliose bezeichnet. ⓘ
1980 begannen Steere et al. mit der Erprobung von Antibiotikaregimen bei Erwachsenen mit Lyme-Borreliose. Im selben Jahr übergab der Epidemiologe Jorge Benach vom New York State Health Dept. Willy Burgdorfer, einem Forscher am Rocky Mountain Biological Laboratory, Sammlungen von I. dammini [scapularis] von Shelter Island, New York, einem bekannten Lyme-Endemiegebiet, als Teil einer laufenden Untersuchung des Rocky Mountain Fleckfiebers. Bei der Untersuchung der Zecken auf Rickettsien bemerkte Burgdorfer "schlecht gefärbte, ziemlich lange, unregelmäßig gewundene Spirochäten". Bei einer weiteren Untersuchung wurden Spirochäten in 60 % der Zecken gefunden. Burgdorfer schrieb seine Vertrautheit mit der europäischen Literatur seiner Erkenntnis zu, dass die Spirochäten die "lange gesuchte Ursache von ECM und Lyme-Borreliose" sein könnten. Benach versorgte ihn mit weiteren Zecken von Shelter Island und Seren von Menschen, bei denen Borreliose diagnostiziert wurde. Alan Barbour, Forscher am University of Texas Health Science Center, "bot sein Fachwissen an, um den Organismus zu kultivieren und immunochemisch zu charakterisieren". Burgdorfer bestätigte daraufhin seine Entdeckung, indem er von Menschen mit Lyme-Borreliose Spirochäten isolierte, die mit den in Zecken gefundenen identisch waren. Im Juni 1982 veröffentlichte er seine Ergebnisse in Science, und die Spirochäte wurde ihm zu Ehren Borrelia burgdorferi genannt. ⓘ
Nach der Identifizierung von B. burgdorferi als Erreger der Lyme-Krankheit wurden Antibiotika für Tests ausgewählt, die sich an der Empfindlichkeit von In-vitro-Antibiotika orientierten, darunter Tetracyclin-Antibiotika, Amoxicillin, Cefuroximaxetil, intravenöses und intramuskuläres Penicillin und intravenöses Ceftriaxon. Der Mechanismus der Zeckenübertragung war ebenfalls Gegenstand zahlreicher Diskussionen. Im Jahr 1987 wurden B. burgdorferi-Spirochäten im Speichel von Zecken nachgewiesen, was die Hypothese bestätigte, dass die Übertragung über die Speicheldrüsen der Zecken erfolgt. ⓘ
Gesellschaft und Kultur
Die Verstädterung und andere anthropogene Faktoren können für die Ausbreitung der Lyme-Borreliose auf den Menschen mitverantwortlich sein. In vielen Gebieten hat die Ausbreitung von Vorstädten zu einer allmählichen Abholzung der umliegenden Waldgebiete und zu einem verstärkten Grenzkontakt zwischen Menschen und zeckendichten Gebieten geführt. Die Ausbreitung des Menschen hat auch zu einem Rückgang der Raubtiere geführt, die Hirsche, Mäuse, Streifenhörnchen und andere kleine Nagetiere jagen - die wichtigsten Reservoire für die Lyme-Borreliose. Durch den vermehrten Kontakt des Menschen mit Wirt und Vektor hat sich die Wahrscheinlichkeit einer Übertragung der Krankheit stark erhöht. Forscher untersuchen mögliche Zusammenhänge zwischen der globalen Erwärmung und der Ausbreitung von durch Vektoren übertragenen Krankheiten, einschließlich der Lyme-Borreliose. ⓘ
Kontroverse
Der Begriff "chronische Borreliose" ist umstritten und in der medizinischen Fachliteratur nicht anerkannt, und die meisten medizinischen Autoritäten raten von einer langfristigen Antibiotikabehandlung der Borreliose ab. Studien haben gezeigt, dass die meisten Menschen, bei denen eine "chronische Borreliose" diagnostiziert wird, entweder keine objektiven Beweise für eine frühere oder aktuelle Infektion mit B. burgdorferi haben oder dass es sich um Menschen handelt, die als "Post-Treatment Lyme Disease Syndrome" (PTLDS) eingestuft werden sollten. ⓘ
Der Dokumentarfilm Under Our Skin aus dem Jahr 2008 ist dafür bekannt, Verschwörungstheorien über die "chronische Borreliose" zu verbreiten. ⓘ
Andere Tiere
Haustiere
Die Prävention der Borreliose ist ein wichtiger Schritt, um Hunde in endemischen Gebieten zu schützen. Es gibt Aufklärungsmaßnahmen und eine Reihe von Präventionsmaßnahmen. Für Hundebesitzer, die in der Nähe von Zeckengebieten leben oder diese häufig aufsuchen, ist die routinemäßige Impfung ihrer Hunde ein wichtiger Schritt. ⓘ
Eine weitere wichtige Vorbeugungsmaßnahme ist die Verwendung von persistenten Akariziden, wie z. B. topische Repellentien oder Pestizide, die Triazapentadiene (Amitraz), Phenylpyrazole (Fipronil) oder Permethrin (Pyrethroide) enthalten. Diese Akarizide zielen in erster Linie auf die adulten Stadien der Lyme-übertragenden Zecken ab und verringern die Zahl der fortpflanzungsfähigen Zecken in der Umwelt. Formulierungen dieser Wirkstoffe sind in verschiedenen topischen Formen erhältlich, darunter Spot-ons, Sprays, Pulver, imprägnierte Halsbänder, Lösungen und Shampoos. ⓘ
Die Untersuchung eines Hundes auf Zecken, nachdem er sich in einem zeckenverseuchten Gebiet aufgehalten hat, ist eine wichtige Vorsichtsmaßnahme zur Vorbeugung von Borreliose. Zu den wichtigsten zu untersuchenden Stellen gehören Kopf, Hals und Ohren. ⓘ
Bei Hunden kann eine ernste Langzeitprognose zu einer glomerulären Erkrankung führen, einer Kategorie von Nierenschäden, die eine chronische Nierenerkrankung verursachen kann. Bei Hunden können auch chronische Gelenkerkrankungen auftreten, wenn die Krankheit unbehandelt bleibt. In der Mehrzahl der Fälle von Borreliose bei Hunden kommt es jedoch zu einer vollständigen Genesung mit und manchmal auch ohne Behandlung mit Antibiotika. In seltenen Fällen kann die Lyme-Borreliose sowohl für Menschen als auch für Hunde tödlich sein. ⓘ
Entdeckung, Namensgebung und Ursprung
Die Bezeichnung Lyme-Borreliose setzt sich zusammen aus dem Namen des amerikanischen Ortes Lyme, in dem das Krankheitsbild 1975 nach gehäuftem Auftreten von Gelenksentzündungen in Verbindung mit Zeckenstichen erstmals beschrieben wurde, und aus der Bezeichnung der Erregerfamilie, die nach dem französischen Bakteriologen Amédée Borrel benannt ist. Dem US-amerikanischen Bakteriologen Willy Burgdorfer gelang 1981 erstmals der Nachweis der neu entdeckten Borrelia-Art aus Zecken und 1982 ihre Anzucht. Ihm zu Ehren wurde diese Spezies Borrelia burgdorferi benannt. ⓘ
Biofilm
Mit dem Rasterkraftmikroskop konnte Eva Sapi beobachten, wie sich die Borrelien innerhalb weniger Tage zu symmetrischen Gebilden formieren und einen Biofilm bilden, der aus Extrazellulären polymeren Substanzen besteht. Er stellt ein erhebliches Hindernis für das körpereigene Immunsystem und Antibiotika dar. Unter den Erregern besteht eine chemische Kommunikation namens Quorum sensing, die maßgeblich zur Biofilmbildung beiträgt. ⓘ
Morphologische Veränderungen
In-vitro-Untersuchungen weisen darauf hin, dass Borrelien in der Lage sind, ihre ursprüngliche längliche Gestalt unter Stress in eine Kugelform umzuwandeln. Zudem zeigen entsprechende Studien, dass Borrelien auch noch in weiteren Formvarianten vorkommen können, die unter den Oberbegriffen L-Formen oder Sphaeroplasten zusammengefasst werden. Sphaeroplasten besitzen eine defizitäre Zellwand oder sind sogar zellwandlos (zystisch). Es gibt darüber hinaus Hinweise, dass diese Formen sowohl intrazellulär als auch extrazellulär vorkommen können und in der Lage sind, sich trotz ihrer zellwandlosen Form zu teilen und sich auch wieder in komplette Formen zurückzuentwickeln. ⓘ
Generationszeit
Die In vitro-Generationszeit von Borrelien ist mit etwa einem halben Tag mehr als zehnmal länger als die der meisten üblichen Bakterien. Ihre in vivo-Generationszeit sei wahrscheinlich noch länger. ⓘ
Wachstum und Stoffwechsel
Ihr Stoffwechsel ist mikroaerophil, sie wachsen also bevorzugt bei einer Sauerstoffkonzentration, die deutlich geringer ist als die von normaler Luft. Eine weitere Eigenheit dieser Gattung ist, dass sie ganz ohne Eisen auskommt und als Cofaktor für wichtige Enzyme stattdessen Mangan verwendet. ⓘ
Statistik
Verbreitung
Lyme-Borreliose ist in der nördlichen Hemisphäre die häufigste von Zecken übertragene Erkrankung. In Deutschland gibt es ein Süd-Nord-Gefälle bei der Durchseuchung des Holzbocks. Laut Angaben des Robert Koch-Instituts sind etwa 6–35 % der Zecken in Deutschland von Borrelien befallen. Nach einem Zeckenstich kommt es in 1,5–6 % der Fälle zu einer Infektion. In 0,3–1,4 % der Fälle kommt es zu einer Erkrankung. ⓘ
Es fehlen flächendeckende epidemiologische Studien und Daten über die Ausbreitung und das Infektionsrisiko sowie über die Verteilung der jeweiligen Genospezies. Ebenso gibt es nach wie vor Wissenslücken über die Pathomechanismen und den langfristigen Verlauf der Krankheit. Im Gegensatz zur artverwandten Syphilis, zur durch Läuse übertragenen Borrelia recurrentis sowie zur ebenfalls durch Zecken übertragenen FSME wurde die Borreliose nicht in das Infektionsschutzgesetz aufgenommen. Es besteht jedoch eine auf landesrechtlicher Ebene geregelte Meldepflicht für Rheinland-Pfalz und das Saarland, Bayern sowie Berlin und die neuen Bundesländer. Hier werden die Falldefinitionen des Robert Koch-Instituts zugrunde gelegt, die eine Meldung der Frühmanifestationen, d. h. des Erythema chronicum migrans, der frühen Neuroborreliose und der Lyme-Arthritis vorsehen. Das Erythema migrans als charakteristisches Symptom des ersten Krankheitsstadiums tritt allerdings nur bei etwa 50 % der Neuerkrankungen auf. ⓘ
Bei der DNA-Sequenzierung der 5300 Jahre alten Gletschermumie Ötzi wurden Spuren von Borrelia burgdorferi gefunden. Damit ist dies der älteste dokumentierte Borreliose-Fall in der Menschheitsgeschichte und der erste Nachweis in einem nicht mehr lebenden Individuum überhaupt. Allerdings wurde lediglich eine 60-prozentige Übereinstimmung des genetischen Materials festgestellt. Auch liegen keine Erkenntnisse darüber vor, um welche Borrelia-Art es sich handelt. ⓘ
Differenzialdiagnose
In Abhängigkeit vom Krankheitsstadium ist die Differenzialdiagnose weit gefächert. Es empfiehlt sich, weitere durch Zecken übertragene Erkrankungen (FSME, Anaplasmosen, Rickettsiosen) sowie weitere Infektionen, wie Syphilis und Leptospirose auszuschließen. ⓘ
Die Lyme-Borreliose kann, ähnlich wie eine Lues, eine Vielzahl von Erkrankungen „imitieren“. Es ist bei einer neurologischen Beteiligung an andere Ursachen, insbesondere eine Infektion mit neurotropen (auf die Nerven wirkende) Viren und Bakterien zu denken. Wichtig ist bei neurologischen Beschwerden die zuverlässige Abgrenzung gegenüber einer multiplen Sklerose, da eine Behandlung mit immunsuppressiv wirkenden Medikamenten bei einer bakteriellen Infektion kontraindiziert ist. Bei Gelenkentzündungen kommen differentialdiagnostisch die aktivierte Arthrose, die rheumatoide Arthritis und andere Gelenkentzündungen in Frage. Das Auftreten einer Lyme-Enzephalopathie wird bislang vor allem aus dem nordamerikanischen Raum berichtet, gilt in Europa jedoch als fragliche Manifestation der Lyme-Borreliose. Eine differentialdiagnostische Abgrenzung vom Chronischen Erschöpfungssyndrom ist schwierig, da die im Kriterienkatalog von 2011 aufgelisteten Symptome auch bei Lyme-Borreliose auftreten. Allerdings unterscheidet sich die Borreliose durch rezidivierende oder persistierende Muskel- und Gelenkschmerzen, wobei das Kniegelenk auffällig häufig betroffen ist. ⓘ
Weitere wichtige Differenzialdiagnosen – insbesondere bei erfolgloser Therapie – sind Tumoren und andere Systemerkrankungen. ⓘ
Negative Labortests (ELISA, Immunoblot) schließen die Lyme-Borreliose keineswegs aus, da sie eine hohe Fehlerrate aufweisen. Eine Liquoruntersuchung ist meist wenig aussagekräftig, da der Liquor nur bei akuter Neuroborreliose entzündet ist oder selbst dann fälschlicherweise unauffällig sein kann. ⓘ
Bei einem borreliosetypischen Krankheitszustand und -verlauf sollte, auch wenn entsprechende Tests negativ ausfallen, beim Ausschluss anderer Erkrankungen die Verdachtsdiagnose Lyme-Borreliose in Betracht gezogen werden. Deshalb gilt die Diagnose der Lyme-Borreliose unter einigen Ärzten auch als „Ausschlussdiagnose“. ⓘ
Krankheitsverlauf

Nach einer Infektion kann es zur Bildung von Antikörpern gegen Borrelia burgdorferi kommen, ohne dass es gleichzeitig zu Krankheitssymptomen kommt. Die Immunglobuline, sowohl IgM als auch IgG, können noch Jahre nach einer ausgeheilten Lyme-Borreliose positiv sein. Eine sichere Diagnose kann oft anhand der Krankheitssymptome, des Krankheitsverlaufs, der Krankengeschichte und der serologischen Befunde sowie sorgfältiger Erhebung anamnestischer Daten sowie der aktuellen psycho-sozialen Situation gestellt werden. Bei hinreichendem Verdacht, aber unklaren Befunden wird manchmal versuchsweise eine Antibiotika-Behandlung durchgeführt. Allerdings besagt das Ansprechen auf die Antibiotikagaben nicht, dass eine aktive Lyme-Borreliose vorliegt, und umgekehrt belegt ein Nicht-Ansprechen nicht, dass die Krankheit ausgeheilt ist. Insbesondere die optimale Antibiotika-Behandlung des späten Stadiums ist unklar und deshalb strittig. ⓘ
In der Regel äußert sich eine Lyme-Borreliose durch schwere Symptome, die sich im Laufe der Jahre verschlimmern. Symptomfreie Latenz-Zeiten sind allerdings möglich. Ein Verschwinden der Symptome bedeutet deshalb nicht, dass die Erreger eliminiert sind. In der Frühphase sind die Symptome einer Borreliose einem grippalen Infekt (ohne Husten und Schnupfen) ähnlich. In diesem Stadium kommt es häufig zu Myalgien (Muskelschmerzen) und Arthralgien (Gelenkschmerzen), die mit einer Fibromyalgie (chronische Schmerzerkrankung) verwechselt werden können. Ähnliche Symptome werden auch teilweise nach einer Antibiotikabehandlung beschrieben. Die häufigsten Fehldiagnosen bei einer Lyme-Borreliose sind multiple Sklerose, Fibromyalgie und das Chronic-Fatigue-Syndrom. Dabei kann eine sorgfältige Differentialdiagnose solche Fehldiagnosen zumeist vermeiden. Oftmals wird die Ursache auch in Depressionen, psychosomatischen Erkrankungen oder gar Hypochondrie gesehen. Hierbei muss beachtet werden, dass psychische Erkrankungen erst nach Ausschluss aller körperlichen Ursachen diagnostiziert werden dürfen. ⓘ
Nach einer durchgemachten Borreliose besteht keine Immunität. ⓘ
Stadien
Die Lyme-Borreliose verläuft in drei Stadien. Es gibt eine Reihe von Symptomen, die für die einzelnen Stadien typisch sind. Begleitend kann eine Vielzahl von Beschwerden wie Müdigkeit, Kopfschmerzen, Fieber, Nackensteifigkeit, Sehbeschwerden, Schwindel, Übelkeit und Erbrechen auftreten. ⓘ
2. Stadium: Streuung (Dissemination) des Erregers
Nach etwa 4 bis 16 Wochen, nach anderen Quellen nach 20 bis 59 Tagen breiten sich die Erreger im ganzen Körper aus. Die Inkubations- und Latenzzeit kann auch länger sein. Der Patient leidet dann an grippeähnlichen Symptomen wie Fieber und Kopfschmerzen, was die Erkennung der Krankheit erschwert. Charakteristisch sind starke Schweißausbrüche. Durch die Ausbreitung im Körper kann es zu einem Befall der Organe, der Gelenke und Muskeln sowie des zentralen und peripheren Nervensystems kommen. Leitsymptome in diesem Stadium sind oftmals das Bannwarth-Syndrom mit starken radikulitischen Schmerzen und einer Fazialisparese, die sich in einer Lähmung der mimischen Gesichtsmuskulatur zeigt, meist wirkt das Gesicht einseitig „schief“. Außerdem zeigen sich reaktiv benigne Hyperplasien lymphatischer Zellen, die in Form von Schwellungen vor allem im Bereich der Ohrläppchen sichtbar sind und als Lymphadenosis cutis benigna bezeichnet werden. Typisch sind auch von Gelenk zu Gelenk springende Arthritiden und Myalgien. Weiterhin kann es zu Störungen des Tastsinns, zu Sehstörungen und zu Herzproblemen, wie Sinustachykardien und Karditis, kommen, was sich manchmal durch Herzklopfen und hohen Blutdruck sowie Pulsbeschleunigung bemerkbar macht. Das Immunsystem ist in diesem Stadium oft nicht mehr in der Lage, die Infektion zu bewältigen. Es wird vermutet, dass sich Borrelien kurz im Blutkreislauf aufhalten, aber auch ins Bindegewebe übergehen können. ⓘ
Ein problematischer Sonderfall ist die sogenannte Neuroborreliose, die zu vielfältigen Erkrankungen der peripheren Nerven und bei circa 10 % der Erkrankungen auch des Zentralnervensystems führen kann. In aller Regel tritt sie in der frühen Erkrankungsphase auf (bis etwa 10 Wochen), in der noch keine Antikörper gebildet wurden. Deshalb müssen in diesem Stadium ausreichend Antibiotika gegeben werden. Erschwert wird die Diagnostik dadurch, dass oft keine intrathekal gebildeten Antikörper gefunden werden. Stattdessen ist von einem erhöhten Albumin- und Protein-Wert im Liquor auszugehen. Die Wahl des Antibiotikums richtet sich nach dem Befall und der Erkrankungsform. Wenn die Lyme-Borreliose nicht rechtzeitig und ausreichend mit Antibiotika therapiert wird, so kann die Erkrankung fortschreiten und zu bleibenden Organschäden führen. ⓘ
Therapie
Die Behandlung einer Lyme-Borreliose verlangt auf Grund der Möglichkeit des vielfachen Organbefalls die interdisziplinäre Zusammenarbeit von verschiedenen Fachdisziplinen. Die Prognose nach frühzeitiger antibiotischer Behandlung im ersten Stadium ist gut. Die in manchen Quellen zitierten 95 % „folgenloser“ Ausheilung von Neuroborreliose beziehen sich jedoch nur auf den Anteil der Patienten mit akuter Neuroborreliose, die nach einem Jahr beschwerdefrei waren. Bei chronischer Neuroborreliose betrug der Anteil dagegen nur 66 %. ⓘ
Leitlinien
Als praktische Leitlinie für Ärzte zur Behandlung der Lyme-Borreliose existieren Medizinische Leitlinien. Die im Jahr 2006 veröffentlichten Leitlinien der „Infectious Diseases Society of America“ (IDSA-Leitlinien) wurden im Konsens mit anderen großen amerikanischen Fachgesellschaften erarbeitet und geben unter Berücksichtigung der aktuellen, bisher noch dünnen Studienlage Empfehlungen zur Diagnostik und Therapie dieses Krankheitsbilds in den USA. Die Empfehlungen stützen sich größtenteils auf Expertenmeinung; groß angelegte randomisierte Studien zu diesem Thema mit hinreichender Evidenz liegen nicht vor. Daneben existiert eine weitere Leitlinie der International Lyme and Associated Diseases Society (ILADS-Leitlinien) welche seit 2015 in der amerikanischen National Guideline Clearinghouse Website aufgelistet ist und in der Praxis Anwendung findet. In Deutschland arbeiten einige große ärztliche Fachgesellschaften seit einiger Zeit an der Erstellung einer gemeinsamen S3-Leitlinie. Die Fertigstellung ist für Ende 2015 geplant. Bereits verfügbar sind die S2k-Leitlinien der Deutschen Dermatologischen Gesellschaft und die S3-Leitlinie der Deutschen Gesellschaft für Neurologie zur Behandlung der Neuroborreliose. Des Weiteren hat die deutsche Borreliose-Gesellschaft für alle Manifestationen der Borreliose eine eigene Empfehlung erstellt. Diese wurde nicht im Rahmen der AWMF entwickelt. Die Empfehlungen zur Diagnostik und Antibiotika-Behandlung weichen von denen der AWMF-Fachgesellschaften erheblich ab. ⓘ
Kritik an den Leitlinien
Das S3-Niveau der Leitlinie der Deutschen Gesellschaft für Neurologie wird kritisiert, da keine ausreichende evidenzbasierte wissenschaftliche Literatur zu diesem Thema vorliege. ⓘ
Dem Leitlinienkoordinator der Deutschen Gesellschaft für Neurologie, Rauer, werden mögliche Interessenkonflikte vorgeworfen. ⓘ
Kontroverse
Im Spätstadium können neben den Leitsymptomen Beschwerden auftreten, die sich auch nach einer Antibiotikatherapie nicht zurückbilden (Post-treatment Lyme disease syndrome, PTLDS). Die Symptomatik besteht aus Müdigkeit, Abgeschlagenheit und Muskel- und Gelenkschmerzen. Die Ursache ist noch nicht geklärt. Dass Borrelien im Spätstadium ursächlich für die Beschwerden sind, ist umstritten und gilt insbesondere in der Schulmedizin als unübliche These. Insbesondere die hohe Versagerquote bei der Antibiotikatherapie im Spätstadium spricht gegen diese These, dass ein infektiöses Geschehen vorliegt. ⓘ
Es werden postinfektiöse Prozesse und Organschädigungen aufgrund eines länger bestehenden Infektionsgeschehens als Ursache einer nicht anschlagenden Antibiose diskutiert. Chronische Beschwerden nach einer nachgewiesenen Lyme-Borreliose werden als chronische Borreliose oder Borreliose im Spätstadium bezeichnet. Es ist ebenfalls die Bezeichnung „Post-Lyme Syndrom“ üblich, die meint, dass die Krankheitssymptome nicht ursächlich durch Borrelien ausgelöst würden. Es wird diskutiert, ob es sich bei der Spätmanifestation der Lyme-Borreliose um eine Autoimmunerkrankung handelt, die ursprünglich durch ein infektiöses Geschehen ausgelöst wurde. Die Bakterien verursachen demnach im Frühstadium Entzündungen, die sich durch autoreaktive Prozesse verselbstständigen bzw. chronifizieren und zu immer weitergehenden Beschwerden und Schädigungen führen. ⓘ
Eine Minderheit der Ärzte befürwortet Therapieverfahren, zu denen auch antibiotische Langzeittherapien über Monate oder Jahre gehören, die aber nach Ansicht der Befürworter der medizinischen Leitlinien keine Evidenz haben. In den USA haben Ärzte und Patienten, die dieser Meinung sind und die für längere als 14-tägige bis vierwöchige Antibiotikatherapien eintreten, ein Verfahren gegen die Autoren der offiziellen Lyme-Borreliose-Leitlinien der IDSA angestrengt. Am 1. Mai 2008 ließ der Generalstaatsanwalt von Connecticut, Richard Blumenthal, diese IDSA-Leitlinien überprüfen. Es wurden geheim gehaltene Interessenskonflikte und Verstöße des Kartellrechts vermutet. Um den Beschuldigungen entgegenzutreten, setzte die IDSA eine erneute Prüfung der Leitlinien durch ein unabhängiges Ärztegremium fest. Nach einer erneuten Prüfung der aktuellen Studien- und Datenlage wurde die Gültigkeit der IDSA-Leitlinien 2010 bestätigt. In den USA gehören die International Lyme And Associated Diseases Society (ILADS) und in Deutschland die Deutsche Borreliose-Gesellschaft zu den Befürwortern der Antibiotika-Langzeitbehandlung. Es werden von einigen Medizinern zum Teil auch parenterale Antibiotikabehandlungen über viele Monate oder Jahre durchgeführt. ⓘ
Insbesondere wird vor gravierenden Nebenwirkungen bei Langzeitantibiotikatherapien gewarnt. In den USA sind Todesfälle durch Langzeitantibiose bekannt. ⓘ
Besonders umstritten war die neue S3-Leitlinie der Deutschen Gesellschaft für Neurologie (DGN), die Anfang 2018 von der mitbeteiligen Deutschen Borreliose Gesellschaft (DGB) und der Patientenorganisation Borreliose und FSME Bund Deutschland (BFBD) über eine einstweilige Verfügung gestoppt wurde. Die DGN wollte deren Dissenshinweise nur im anhängenden Leitlinienreport aufnehmen, während die beiden Verbände eine Aufnahme in den Leitlinientext forderten. Nach Entscheidung des Gerichts wurde im März 2018 die einstweilige Verfügung aufgehoben und die Leitlinie konnte in ihrer ursprünglichen Form in Kraft gesetzt werden. ⓘ