Leptospirose
| Leptospirose ⓘ | |
|---|---|
| Andere Namen | Rattenfieber, Feldfieber, Rattenfängervergilbung, Prätibialfieber |
 | |
| Leptospira in 200-facher Vergrößerung mit einem Dunkelfeldmikroskop. | |
| Fachgebiet | Ansteckende Krankheit |
| Symptome | Keine, Kopfschmerzen, Muskelschmerzen, Fieber |
| Komplikationen | Blutungen aus der Lunge, Meningitis, Nierenversagen |
| Gewöhnlicher Ausbruch | Ein bis zwei Wochen |
| Verursacher | Leptospira wird in der Regel durch Nagetiere verbreitet |
| Risikofaktoren | Kontakt mit infizierten Tieren oder kontaminiertem Wasser |
| Diagnostische Methode | Untersuchung des Blutes auf Antikörper gegen das Bakterium oder seine DNA |
| Differentialdiagnose | Malaria, enterisches Fieber, Rickettsiose, Dengue-Fieber |
| Vorbeugung | Persönliche Schutzausrüstung, Hygienemaßnahmen, Doxycyclin |
| Behandlung | Doxycyclin, Penicillin, Ceftriaxon |
| Prognose | Sterberisiko ~7,5% |
| Häufigkeit | Eine Million Menschen pro Jahr |
| Todesfälle | 58.900 pro Jahr |
Leptospirose ist eine Blutinfektion, die durch das Bakterium Leptospira verursacht wird. Die Anzeichen und Symptome können von nicht vorhanden über leicht (Kopf- und Muskelschmerzen, Fieber) bis hin zu schwer (Blutungen in der Lunge oder Meningitis) reichen. Die Weil-Krankheit, die akute, schwere Form der Leptospirose, führt bei den infizierten Personen zu Gelbsucht (Haut und Augen werden gelb), Nierenversagen und Blutungen. Blutungen aus der Lunge, die mit Leptospirose einhergehen, werden als schweres pulmonales Hämorrhagiesyndrom bezeichnet. ⓘ
Mehr als zehn genetische Typen von Leptospira verursachen beim Menschen Krankheiten. Sowohl Wild- als auch Haustiere können die Krankheit verbreiten, am häufigsten Nagetiere. Die Bakterien werden durch Tierurin oder mit Tierurin verunreinigtes Wasser und Erde, die mit Augen, Mund, Nase oder Hautverletzungen in Berührung kommen, auf den Menschen übertragen. In Entwicklungsländern tritt die Krankheit am häufigsten bei Landwirten und Menschen mit niedrigem Einkommen auf, die in Gegenden mit schlechten sanitären Einrichtungen leben. In den Industrieländern tritt sie bei starken Regenfällen auf und stellt ein Risiko für Arbeiter in der Abwasserentsorgung und für Menschen dar, die in warmen und feuchten Gebieten im Freien arbeiten. Die Diagnose erfolgt in der Regel durch einen Test auf Antikörper gegen die Bakterien oder den Nachweis bakterieller DNA im Blut. ⓘ
Zu den Maßnahmen zur Vorbeugung der Krankheit gehören Schutzausrüstungen, die den Kontakt mit potenziell infizierten Tieren verhindern, das Waschen nach dem Kontakt und die Reduzierung von Nagetieren in Gebieten, in denen Menschen leben und arbeiten. Das Antibiotikum Doxycyclin ist ein wirksames Mittel zur Verhinderung einer Leptospirose-Infektion. Impfstoffe für Menschen sind von begrenztem Nutzen; Impfstoffe für andere Tiere sind in größerem Umfang verfügbar. Die Behandlung einer Infektion erfolgt mit Antibiotika wie Doxycyclin, Penicillin oder Ceftriaxon. Das allgemeine Sterberisiko liegt bei 5-10 %. Wenn jedoch die Lunge betroffen ist, steigt das Sterberisiko auf 50-70 %. ⓘ
Es wird geschätzt, dass jedes Jahr eine Million schwerer Leptospirose-Fälle auftreten, die zu etwa 58 900 Todesfällen führen. Die Krankheit ist in den tropischen Gebieten der Welt am weitesten verbreitet, kann aber überall auftreten. Ausbrüche können nach starken Regenfällen auftreten. Die Krankheit wurde erstmals 1886 in Deutschland von dem Arzt Adolf Weil beschrieben. Infizierte Tiere können keine, leichte oder schwere Symptome aufweisen. Diese können je nach Tierart variieren. Bei einigen Tieren leben Leptospira im Fortpflanzungstrakt, was zu einer Übertragung während der Paarung führt. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| A27.0 | Leptospirosis icterohaemorrhagica (Weil-Krankheit) |
| A27.8 | Sonstige Formen der Leptospirose |
| ICD-10 online (WHO-Version 2019) | |
Leptospirose (oder Leptospirosis) ist eine Infektionskrankheit, die durch bestimmte Krankheitserreger der Bakterien-Gattung Leptospira (aus der Ordnung der Spirochäten) verursacht wird. Beim Menschen wird die Krankheit durch Leptospira interrogans verursacht. Sie kann unter anderem die Leber, die Niere und die Hirnhaut betreffen. Eine Leptospirose verursacht beim Patienten grippeähnliche Symptome und verläuft in Phasen. ⓘ
Es handelt sich dabei um eine meldepflichtige Zoonose, deren natürliche Wirte vor allem Ratten und Mäuse, im Falle der Schweinehüterkrankheit auch Schweine und Rinder sind. Die Übertragung auf den Menschen erfolgt durch Kontakt mit Urin, Blut oder Gewebe infizierter Tiere bzw. verunreinigtem Wasser, vor allem aus Bächen, Sümpfen, Tümpeln und der Kanalisation. ⓘ
Eine später als Leptospirose erkannte Krankheit wurde 1891 von Friedrich von Müller für die schlesische Schlammfieberepidemie (auch Feld- oder Erntefieber genannt) beschrieben. ⓘ
Anzeichen und Symptome


Die Symptome der Leptospirose treten in der Regel ein bis zwei Wochen nach der Infektion auf, die Inkubationszeit kann jedoch bis zu einem Monat betragen. In der Mehrzahl der symptomatischen Fälle verläuft die Krankheit biphasisch. Die Symptome der ersten Phase (akute oder leptospirämische Phase) dauern fünf bis sieben Tage. In der zweiten Phase (Immunphase) klingen die Symptome ab, da Antikörper gegen die Bakterien gebildet werden. In der zweiten Phase treten weitere Symptome auf. Die einzelnen Krankheitsphasen sind unter Umständen nicht klar voneinander abgrenzbar, insbesondere bei Patienten mit schwerer Erkrankung. Bei 90 % der Infizierten treten leichte Symptome auf, während 10 % eine schwere Leptospirose erleiden. ⓘ
Eine Leptospireninfektion beim Menschen verursacht eine Reihe von Symptomen, wobei bei einigen Infizierten keine Symptome auftreten können. Die Krankheit beginnt plötzlich mit Fieber, begleitet von Schüttelfrost, starken Kopfschmerzen, starken Muskelschmerzen und Bauchschmerzen. Leptospirose-bedingte Kopfschmerzen verursachen pochende Schmerzen und sind typischerweise in den beidseitigen Schläfen- oder Stirnregionen des Kopfes lokalisiert. Es können auch Schmerzen hinter den Augen und Lichtempfindlichkeit auftreten. Die Muskelschmerzen betreffen in der Regel die Wadenmuskeln und den unteren Rücken. Das charakteristischste Merkmal der Leptospirose ist die Bindehautsuffusion (Bindehautentzündung ohne Exsudat), die bei anderen fieberhaften Erkrankungen selten vorkommt. Weitere charakteristische Befunde am Auge sind subkonjunktivale Blutungen und Gelbsucht. Ein Ausschlag ist bei Leptospirose selten zu finden. Wird ein solcher festgestellt, sollten alternative Diagnosen wie Dengue-Fieber und Chikungunya-Fieber in Betracht gezogen werden. Trockener Husten wird bei 20-57 % der Menschen mit Leptospirose beobachtet. Daher kann dieses klinische Merkmal einen Arzt dazu verleiten, die Krankheit als Atemwegserkrankung zu diagnostizieren. Außerdem treten häufig gastrointestinale Symptome wie Übelkeit, Erbrechen, Bauchschmerzen und Durchfall auf. Erbrechen und Durchfall können zu einer Dehydrierung beitragen. Die Bauchschmerzen können auf eine akalkulöse Cholezystitis oder eine Entzündung der Bauchspeicheldrüse zurückzuführen sein. In seltenen Fällen können die Lymphknoten, die Leber und die Milz vergrößert und tastbar sein. ⓘ
Die Symptome klingen ein bis drei Tage lang ab. Danach beginnt die Immunphase, die vier bis 30 Tage dauern kann und von Gehirn- bis zu Nierenkomplikationen reichen kann. Kennzeichnend für die zweite Phase ist eine Entzündung der Hirnhäute. Zu den Anzeichen und Symptomen einer Meningitis gehören starke Kopfschmerzen und Nackensteifigkeit. Eine Nierenbeteiligung geht mit einer verminderten oder fehlenden Urinausscheidung einher. ⓘ
Die klassische Form der schweren Leptospirose, die so genannte Weil-Krankheit, ist durch Leberschäden (mit Gelbsucht), Nierenversagen und Blutungen gekennzeichnet und tritt bei 5-10 % der Infizierten auf. Auch Lungen- und Hirnschäden können auftreten. Bei denjenigen, die Anzeichen einer Entzündung der das Gehirn bedeckenden Membranen und des Gehirns selbst aufweisen, kann es zu Bewusstseinsstörungen kommen. Zu den Komplikationen gehören verschiedene neurologische Probleme wie die Lähmung einer Körperhälfte, die vollständige Entzündung eines ganzen horizontalen Abschnitts des Rückenmarks und Muskelschwäche aufgrund einer Immunschädigung der Nerven, die die Muskeln versorgen. Anzeichen für Blutungen wie nichttraumatische Blutergüsse von 1 mm, nichttraumatische Blutergüsse von mehr als 1 cm, Nasenbluten, schwärzlicher Stuhlgang aufgrund von Magenblutungen, Erbrechen von Blut und Blutungen aus der Lunge können ebenfalls auftreten. Eine Verlängerung der Prothrombinzeit bei Gerinnungstests ist mit schweren Blutungserscheinungen verbunden. Eine niedrige Thrombozytenzahl wird jedoch nicht mit schweren Blutungen in Verbindung gebracht. Bei der Lungenblutung handelt es sich um eine alveoläre Blutung (Blutung in die Lungenbläschen), die zu massivem Bluthusten führt und ein akutes Atemnotsyndrom verursacht, bei dem das Sterberisiko mehr als 50 % beträgt. In seltenen Fällen kann es zu einer Entzündung der Herzmuskeln, einer Entzündung der das Herz bedeckenden Membranen, zu Störungen des natürlichen Herzschrittmachers und zu abnormen Herzrhythmen kommen. ⓘ
Man unterscheidet klinisch die leichtere anikterische (ohne Gelbsucht einhergehende) Leptospirose von der schwereren, Weil’sche Krankheit genannten, ikterischen Form mit Gelbsucht (Icterus infectiosus). Beide Formen verlaufen in zwei Phasen. ⓘ
Es schließt sich eine zweite, fieberhafte Krankheitsphase an, die 4 bis 30 Tage dauert. Dieser Zeitraum ist am ehesten Ausdruck einer Immunreaktion mit zirkulierenden Immunkomplexen, ausgelöst durch die Endothelschädigung. Bei der schweren Verlaufsform, dem Morbus Weil, kann es in dieser Zeit zu Schädigungen der Leber kommen. Beim Canicolafieber, das mittelschwer verläuft, steht eine Meningitis im Vordergrund, ebenso beim eher gutartig verlaufenden Feldfieber. ⓘ
Ursache
Bakterien
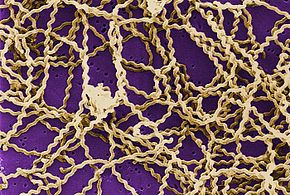
Leptospirose wird durch Spirochaeten der Gattung Leptospira verursacht, die aerob, rechtsgängig und 6 bis 20 Mikrometer lang sind. Wie gramnegative Bakterien haben Leptospira eine äußere Membran, die an der Oberfläche mit Lipopolysaccharid (LPS) besetzt ist, eine innere Membran und eine Schicht aus Peptidoglycan-Zellwand. Im Gegensatz zu gramnegativen Bakterien liegt die Peptidoglykanschicht bei Leptospira jedoch näher an der inneren als an der äußeren Membran. Dies führt zu einer flüssigen äußeren Membran, die locker mit der Zellwand verbunden ist. Darüber hinaus haben Leptospira ein Geißel im Periplasma, das mit korkenzieherartigen Bewegungen verbunden ist. Chemorezeptoren an den Polen des Bakteriums nehmen verschiedene Substrate wahr und ändern die Richtung der Bewegung. Die Bakterien werden traditionell durch Dunkelfeldmikroskopie ohne Färbung sichtbar gemacht. ⓘ
Insgesamt wurden 66 Arten von Leptospira identifiziert. Auf der Grundlage ihrer Genomsequenz werden sie in zwei Kladen und vier Unterkladen eingeteilt: P1, P2, S1 und S2. Zu den 19 Mitgliedern der P1-Subklade gehören die 8 Arten, die beim Menschen schwere Krankheiten verursachen können: L. alexanderi, L. borgpetersenii, L. interrogans, L. kirschneri, L. mayottensis, L. noguchii, L. santarosai, und L. weilii. Der P2-Klon umfasst 21 Arten, die beim Menschen leichte Krankheiten verursachen können. Die verbleibenden 26 Arten bilden die S1- und S2-Subkladen, zu denen "Saprophyten" gehören, von denen bekannt ist, dass sie sich von verrottendem Material ernähren (saprotrophe Ernährung). Die pathogenen Leptospira vermehren sich nicht in der Umwelt. Leptospira benötigen zum Überleben eine hohe Luftfeuchtigkeit, können aber in Umgebungen wie stehendem Wasser oder kontaminiertem Boden am Leben bleiben. Das Bakterium kann durch Temperaturen von 50 °C (122 °F) abgetötet und durch 70 %iges Ethanol, 1 %iges Natriumhypochlorit, Formaldehyd, Reinigungsmittel und Säuren inaktiviert werden. ⓘ
Leptospira werden auch nach ihrem Serovar klassifiziert. Die unterschiedliche Zuckerzusammensetzung des Lipopolysaccharids auf der Oberfläche der Bakterien ist für die antigene Differenz zwischen den Serovaren verantwortlich. Es sind etwa 300 pathogene Serovare von Leptospira bekannt. Antigenisch verwandte Serovare (die zur gleichen Serogruppe gehören) können aufgrund des horizontalen Gentransfers von LPS-Biosynthesegenen zwischen verschiedenen Arten zu unterschiedlichen Arten gehören. Derzeit werden der Kreuzagglutinations-Absorptionstest und die DNA-DNA-Hybridisierung zur Klassifizierung von Leptospira-Spezies verwendet, was jedoch zeitaufwändig ist. Daher könnte die totale genomische Sequenzierung diese beiden Methoden als neuer Goldstandard für die Klassifizierung von Leptospira-Arten ersetzen. ⓘ
Übertragung

Die Bakterien kommen in Teichen, Flüssen, Pfützen, Abwasserkanälen, landwirtschaftlichen Feldern und feuchter Erde vor. Pathogene Leptospira wurden in Form von aquatischen Biofilmen gefunden, die das Überleben in der Umwelt erleichtern können. ⓘ
Die Zahl der Leptospirose-Fälle steht in direktem Zusammenhang mit der Niederschlagsmenge, so dass die Krankheit in gemäßigten Klimazonen saisonal und in tropischen Klimazonen ganzjährig auftritt. Das Risiko, an Leptospirose zu erkranken, hängt vom Risiko der Übertragung der Krankheit in der Gemeinschaft und der Häufigkeit der Exposition ab. In ländlichen Gebieten sind Ackerbau und Viehzucht die Hauptrisikofaktoren für eine Ansteckung mit Leptospirose. Schlechte Wohnverhältnisse und unzureichende sanitäre Einrichtungen erhöhen ebenfalls das Infektionsrisiko. In tropischen und halbtropischen Gebieten breitet sich die Krankheit oft nach starken Regenfällen oder Überschwemmungen aus. ⓘ
Leptospiren sind vor allem bei Säugetieren zu finden. Es wurde jedoch nachgewiesen, dass auch Reptilien und Kaltblüter wie Frösche, Schlangen, Schildkröten und Kröten infiziert sind. Ob es Reservoirs für die Infektion des Menschen gibt, ist nicht bekannt. Ratten, Mäuse und Maulwürfe sind wichtige Primärwirte, aber auch andere Säugetiere wie Hunde, Rehe, Kaninchen, Igel, Kühe, Schafe, Schweine, Waschbären, Opossums und Stinktiere können die Krankheit übertragen. In Afrika wurde eine Reihe von Wildtieren als Überträger identifiziert, darunter der Mungo, der Ägyptische Fuchs, der Rusa-Hirsch und die Spitzmaus. Es gibt verschiedene Mechanismen, durch die sich Tiere gegenseitig anstecken können. Hunde können den Urin eines infizierten Tieres vom Gras oder Boden auflecken oder aus einer infizierten Pfütze trinken. Haushunde haben sich mit Leptospirose angesteckt, weil sie offenbar den Urin infizierter Mäuse im Haus geleckt haben. Leptospirose kann auch über das Sperma infizierter Tiere übertragen werden. Die Dauer der konstanten Anwesenheit von Bakterien im Urin von Tieren kann jahrelang andauern. ⓘ
Der Mensch ist der zufällige Wirt von Leptospira. Er infiziert sich durch den Kontakt mit Wasser oder feuchter Erde, die Urin von infizierten Tieren enthält. Die Bakterien gelangen durch Schnitt- und Schürfwunden, die Aufnahme kontaminierter Lebensmittel oder den Kontakt mit den Schleimhäuten des Körpers (z. B. Mund, Nase und Augen) in den Körper. Zu den gefährdeten Berufsgruppen gehören Landwirte, Fischer, Müllsammler und Arbeiter in der Abwasserentsorgung, die an Leptospirose erkranken können. Die Krankheit tritt auch im Zusammenhang mit Abenteuertourismus und Freizeitaktivitäten auf. Sie tritt häufig bei Wassersportlern in bestimmten Gebieten auf, z. B. bei Triathlons, Rafting, Kanufahrten und Schwimmen, da ein längeres Eintauchen in Wasser das Eindringen der Bakterien fördert. Es ist jedoch unwahrscheinlich, dass Leptospira in intakte Haut eindringen. Es ist nicht bekannt, dass sich die Krankheit von Mensch zu Mensch ausbreitet, und eine Verbreitung der Bakterien in der Erholungsphase ist beim Menschen äußerst selten. Ist der Mensch einmal infiziert, bleiben die Bakterien in der Regel bis zu 60 Tage lang in den Nieren hängen. ⓘ
In seltenen Fällen kann die Leptospirose durch eine Organtransplantation übertragen werden. Auch eine Infektion über die Plazenta während der Schwangerschaft ist möglich. Sie kann zu Fehlgeburten und Infektionen bei Säuglingen führen. Es wurde auch über eine Leptospirose-Übertragung durch den Verzehr von rohem Fleisch von Wildtieren berichtet (z. B. bei psychiatrischen Patienten mit Allotriophagie). ⓘ
Pathogenese

Die Pathogenese der Leptospirose ist trotz aller Forschungsanstrengungen nach wie vor kaum verstanden. ⓘ
Wenn Tiere die Bakterien aufnehmen, zirkulieren sie im Blutkreislauf und setzen sich dann über die glomerulären oder peritubulären Kapillaren in den Nieren fest. Die Bakterien gelangen dann in die Lumen der Nierentubuli und kolonisieren den Bürstensaum und den proximalen Tubulus convolutus. Dadurch kommt es zu einer kontinuierlichen Ausscheidung von Bakterien im Urin, ohne dass das Tier nennenswerte gesundheitliche Folgen verspürt. Diese Beziehung zwischen dem Tier und den Bakterien wird als Kommensale bezeichnet, und das Tier ist ein sogenannter Reservoirwirt. ⓘ
Die Bakterien gelangen durch Verletzungen der Haut oder der Schleimhaut in den menschlichen Körper und von dort in die Blutbahn. Später heften sich die Bakterien an die Endothelzellen der Blutgefäße und die extrazelluläre Matrix (ein komplexes Netzwerk aus Proteinen und Kohlenhydraten zwischen den Zellen). Die Bakterien benutzen ihre Geißeln, um sich zwischen den Zellschichten zu bewegen. Sie binden sich an Zellen wie Fibroblasten, Makrophagen, Endothelzellen und Nierenepithelzellen. Sie binden auch an verschiedene menschliche Proteine wie Komplementproteine, Thrombin, Fibrinogen und Plasminogen, indem sie leptospirale Immunglobulin-ähnliche (Lig) Oberflächenproteine wie LigB und LipL32 verwenden, deren Gene in allen pathogenen Arten vorkommen. ⓘ
Durch das angeborene Immunsystem werden die Endothelzellen der Kapillaren im menschlichen Körper durch die Anwesenheit dieser Bakterien aktiviert. Die Endothelzellen produzieren Zytokine und antimikrobielle Peptide gegen die Bakterien. Diese Produkte regulieren die Gerinnungskaskade und die Bewegungen der weißen Blutkörperchen. Die beim Menschen vorhandenen Makrophagen sind in der Lage, Leptospira zu verschlingen. Leptospira sind jedoch in der Lage, in der zytoplasmatischen Matrix zu verweilen und sich zu vermehren, nachdem sie von Makrophagen aufgenommen wurden. Bei Personen mit schwerer Leptospirose kann ein hoher Spiegel an Zytokinen wie Interleukin 6, Tumor-Nekrose-Faktor alpha (TNF-α) und Interleukin 10 auftreten. Der hohe Zytokinspiegel verursacht sepsisähnliche Symptome, die lebensbedrohlich sind, anstatt bei der Bekämpfung der Infektion zu helfen. Bei denjenigen, die während einer Leptospirose-Infektion ein hohes Sepsis-Risiko haben, findet man den Genotyp HLA-DQ6, möglicherweise aufgrund einer Superantigen-Aktivierung, die Körperorgane schädigt. ⓘ
Die humorale Immunität ist die wichtigste Immunreaktion gegen die Leptospira-Zellen. Es werden agglutinierende Antikörper wie Immunglobulin M und Immunglobulin G gegen die Bakterien gebildet. Diese Antikörper richten sich hauptsächlich gegen das LPS. Leptospira-LPS aktiviert nur den Toll-like-Rezeptor 2 (TLR2) in Monozyten des Menschen. Das Lipid-A-Molekül des Bakteriums wird von menschlichen TLR4-Rezeptoren nicht erkannt. Daher trägt die fehlende Erkennung von Leptospira durch TLR4-Rezeptoren wahrscheinlich zum Krankheitsprozess der Leptospirose beim Menschen bei. ⓘ
Obwohl es im menschlichen Körper verschiedene Mechanismen zur Bekämpfung der Bakterien gibt, ist Leptospira gut an die von ihm verursachten Entzündungszustände angepasst. Im Blutkreislauf kann es das Plasminogen des Wirtes zu Plasmin aktivieren, das die extrazelluläre Matrix aufbricht, Fibrinklümpchen und Komplementproteine (C3b und C5) abbaut, um eine Opsonisierung zu vermeiden. Es kann auch Komplementregulatoren wie Faktor H, C4b-bindendes Protein, Faktor H-ähnliches Bindungsprotein und Vitronectin rekrutieren, um die Aktivierung des Membranangriffskomplexes an seiner Oberfläche zu verhindern. Außerdem sezerniert es Proteasen, um Komplementproteine wie C3 abzubauen. Es kann an Thrombin binden, wodurch die Fibrinbildung verringert wird. Eine verringerte Fibrinbildung erhöht das Risiko von Blutungen. Leptospira sondert auch Sphingomyelinase und Hämolysin ab, die sich gegen rote Blutkörperchen richten. ⓘ
Leptospira breitet sich über den Blutkreislauf rasch in allen Organen aus. Sie befallen vor allem die Leber. Sie dringen in die Zwischenräume der Hepatozyten ein und verursachen Apoptose. Die geschädigten Hepatozyten und Hepatozyten-Zwischenzellverbindungen führen zum Austritt von Galle in den Blutkreislauf, was zu erhöhten Bilirubinwerten und damit zu Gelbsucht führt. Es wurde über verstopfte Lebersinusoide und perisinusoidale Räume berichtet. In der Lunge können Petechien oder offene Blutungen am Alveolarseptum und in den Alveolenzwischenräumen festgestellt werden. Leptospira sondert Toxine ab, die ein leichtes bis schweres Nierenversagen oder eine interstitielle Nephritis verursachen. Das Nierenversagen kann sich vollständig erholen oder zu Atrophie und Fibrose führen. Eine Entzündung der Herzmuskeln, der Herzkranzgefäße und der Aorta ist selten. ⓘ
Diagnose


Laboruntersuchungen
Bei Infizierten kann ein vollständiges Blutbild eine hohe Zahl weißer Blutkörperchen und eine niedrige Zahl von Blutplättchen ergeben. Wenn ein niedriger Hämoglobinwert zusammen mit einer niedrigen Zahl weißer Blutkörperchen und einer Thrombozytopenie vorliegt, sollte eine Knochenmarksuppression in Betracht gezogen werden. Die Erythrozytensenkungsgeschwindigkeit und das C-reaktive Protein können ebenfalls erhöht sein. ⓘ
Die Nieren sind bei Leptospirose häufig betroffen. Die Harnstoff- und Kreatininwerte im Blut werden erhöht sein. Leptospirose erhöht die Kaliumausscheidung im Urin, was zu einem niedrigen Kaliumspiegel und einem niedrigen Natriumspiegel im Blut führt. Bei der Urinanalyse können Eiweiß, weiße Blutkörperchen und eine mikroskopische Hämaturie festgestellt werden. Da sich die Bakterien in den Nieren ansiedeln, sind Urinkulturen ab der zweiten Krankheitswoche bis 30 Tage nach der Infektion positiv für Leptospirose. ⓘ
Bei Personen mit Leberbeteiligung sind die Transaminasen und das direkte Bilirubin in Leberfunktionstests erhöht. Die Serogruppe Icterohaemorrhagiae wird mit Gelbsucht und erhöhten Bilirubinwerten in Verbindung gebracht. Eine hämolytische Anämie trägt zur Gelbsucht bei. Ein Merkmal der Leptospirose ist eine akute hämolytische Anämie und konjugierte Hyperbilirubinämie, insbesondere bei Patienten mit Glucose-6-Phosphat-Dehydrogenase-Mangel. Abnormale Amylase- und Lipasespiegel im Serum (in Verbindung mit Pankreatitis) werden bei Patienten festgestellt, die wegen Leptospirose ins Krankenhaus eingeliefert werden. Eine eingeschränkte Nierenfunktion mit einer Kreatinin-Clearance von weniger als 50 ml/min ist mit erhöhten Pankreasenzymen verbunden. ⓘ
Bei Personen mit starken Kopfschmerzen, die Anzeichen einer Meningitis aufweisen, kann eine Lumbalpunktion versucht werden. Im Falle einer Infektion zeigt die Untersuchung des Liquors (CSF) ein Überwiegen der Lymphozyten mit einer Zellzahl von etwa 500/mm3, Eiweiß zwischen 50 und 100 mg/ml und normale Glukosewerte. Diese Befunde sind mit einer aseptischen Meningitis vereinbar. ⓘ
Serologische Tests
Der Schnellnachweis von Leptospira kann durch Quantifizierung der IgM-Antikörper mittels ELISA erfolgen. In der Regel wird zum Nachweis der IgM-Antikörper das L. biflexa-Antigen verwendet. Mit diesem Test kann die Diagnose schnell gestellt und eine frühzeitige Behandlung eingeleitet werden. Die Spezifität des Tests hängt jedoch von der Art des verwendeten Antigens und dem Vorhandensein von Antikörpern aus früheren Infektionen ab. Das Vorhandensein anderer Krankheiten wie Epstein-Barr-Virus-Infektionen, virale Hepatitis und Cytomegalovirus-Infektionen können zu falsch-positiven Ergebnissen führen. Es wurden weitere Schnelltests wie Dipsticks, Latex- und Objektträger-Agglutinationstests entwickelt. ⓘ
Der mikroskopische Agglutinationstest (MAT) ist der Referenztest für die Diagnose von Leptospirose. Der MAT ist ein Test, bei dem serielle Verdünnungen von Patientenseren mit verschiedenen Leptospira-Serotypen gemischt werden. Die Mischung wird dann unter einem Dunkelfeldmikroskop auf Agglutination untersucht. Die höchste Verdünnung, bei der 50 % Agglutination auftritt, ist das Ergebnis. MAT-Titer von 1:100 bis 1:800 sind diagnostisch für Leptospirose. Ein vierfacher oder höherer Titeranstieg bei zwei Seren, die zu Beginn der Symptome und drei bis 10 Tage nach Ausbruch der Krankheit entnommen wurden, bestätigt die Diagnose. In der akuten Phase der Krankheit ist der MAT aufgrund der Kreuzreaktivität zwischen den Serovaren nicht spezifisch für den Nachweis eines Leptospira-Serotyps. In der Rekonvaleszenzphase ist der MAT spezifischer für den Nachweis der Serovartypen. Der MAT erfordert ein Panel lebender Antigene und ist sehr arbeitsaufwändig. ⓘ
Molekulare Tests
Leptospira-DNA kann mit Hilfe der Polymerase-Kettenreaktion (PCR) aus Serum, Urin, Kammerwasser, Liquor und Autopsieproben amplifiziert werden. Mit der PCR kann Leptospira-DNA im Blut nachgewiesen werden, noch bevor die Antikörperreaktion einsetzt. Da die PCR das Vorhandensein von Leptospira-DNA nachweist, ist sie auch nach Beginn einer Antibiotikabehandlung nützlich. ⓘ
Bildgebung
Bei einer Lungenbeteiligung kann ein Röntgenbild der Brust diffuse alveoläre Trübungen zeigen. ⓘ
Diagnostische Kriterien
Im Jahr 1982 schlug die Weltgesundheitsorganisation (WHO) die Faine-Kriterien für die Diagnose von Leptospirose vor. Sie bestehen aus drei Teilen: A (klinische Befunde), B (epidemiologische Faktoren) und C (Laborbefunde und bakteriologische Daten). Da die ursprünglichen Faine-Kriterien in Teil C nur Kultur und MAT umfassten, die schwierig und komplex durchzuführen sind, wurden 2004 die modifizierten Faine-Kriterien vorgeschlagen, die auch ELISA- und Objektträger-Agglutinationstests umfassen, die einfacher durchzuführen sind. Im Jahr 2012 wurden die modifizierten Faine-Kriterien (mit Änderungen) vorgeschlagen, um Kurzatmigkeit und Bluthusten in die Diagnose einzubeziehen. Im Jahr 2013 empfahl Indien modifizierte Faine-Kriterien für die Diagnose von Leptospirose. ⓘ
Vorbeugung


Die Leptospiroserate kann durch die Verbesserung der Wohnverhältnisse, der Infrastruktur und der sanitären Einrichtungen gesenkt werden. Die Bekämpfung von Nagetieren und Projekte zur Eindämmung von Überschwemmungen können ebenfalls zur Prävention beitragen. Die ordnungsgemäße Verwendung von persönlicher Schutzausrüstung (PSA) durch Personen, die einem hohen Risiko beruflicher Exposition ausgesetzt sind, kann in den meisten Fällen Leptospirose-Infektionen verhindern. ⓘ
Es gibt keinen Impfstoff für den Menschen, der für den weltweiten Einsatz geeignet ist. Nur Kuba, Japan, Frankreich und China haben die Verwendung von Leptospirose-Impfstoffen zugelassen, und sie werden nur an Personen in Hochrisikoberufen und als Reaktion auf Überschwemmungen und Epidemien verabreicht. Die Impfstoffe bestehen aus abgetöteten Leptospira und verleihen Immunität nur gegen das im Impfstoff enthaltene Serovar. Nach der Injektion des Impfstoffs wurden Nebenwirkungen wie Übelkeit, Rötungen und Schwellungen an der Injektionsstelle gemeldet. Da die durch ein bestimmtes Leptospira-Serovar hervorgerufene Immunität nur gegen dieses Serovar schützt, wurden trivalente Impfstoffe entwickelt. Die Immunität nach der Impfung hält etwa ein Jahr lang an. ⓘ
Doxycyclin wird einmal wöchentlich als Prophylaxe verabreicht und ist wirksam bei der Verringerung der Leptospirose-Infektionsrate bei Hochrisikopersonen in überschwemmungsgefährdeten Gebieten. In einer Studie verringerte es die Zahl der Leptospirose-Fälle bei Militärangehörigen, die an Übungen im Dschungel teilnahmen. In einer anderen Studie verringerte es die Zahl der symptomatischen Fälle nach einer Leptospirose-Exposition bei starken Regenfällen in endemischen Gebieten. ⓘ
Behandlung
Die meisten Leptospirose-Fälle klingen spontan ab. Die frühzeitige Gabe von Antibiotika kann das Fortschreiten einer schweren Erkrankung verhindern. Daher kann in ressourcenbeschränkten Gebieten mit Antibiotika begonnen werden, sobald nach Anamnese und Untersuchung ein Verdacht auf Leptospirose besteht. ⓘ
Bei leichter Leptospirose beruhten die Empfehlungen für Antibiotika wie Doxycyclin, Azithromycin, Ampicillin und Amoxicillin ausschließlich auf In-vitro-Tests. Im Jahr 2001 empfahl die WHO orales Doxycyclin (2 mg/kg bis zu 100 mg alle 12 Stunden) für fünf bis sieben Tage bei leichter Leptospirose. Auch Tetracyclin, Ampicillin und Amoxicillin können in solchen Fällen eingesetzt werden. In Gebieten, in denen sowohl Rickettsien als auch Leptospirose endemisch sind, sind jedoch Azithromycin und Doxycyclin die Mittel der Wahl. ⓘ
Auf der Grundlage einer Studie aus dem Jahr 1988 wird intravenöses Benzylpenicillin (auch bekannt als Penicillin G) für die Behandlung schwerer Leptospirosen empfohlen. Intravenöses Benzylpenicillin (30 mg/kg bis zu 1,2 g alle sechs Stunden) wird fünf bis sieben Tage lang verabreicht. In schweren Fällen können auch Amoxicillin, Ampicillin und Erythromycin eingesetzt werden. Ceftriaxon (1 g intravenös alle 24 Stunden über sieben Tage) ist ebenfalls wirksam bei schwerer Leptospirose. Cefotaxim (1 g intravenös alle sechs Stunden über sieben Tage) und Doxycyclin (200 mg zu Beginn, gefolgt von 100 mg intravenös alle 12 Stunden über sieben Tage) sind ebenso wirksam wie Benzylpenicillin (1,5 Millionen Einheiten intravenös alle sechs Stunden über sieben Tage). Daher gibt es keine Hinweise auf Unterschiede bei der Verringerung der Todesfälle, wenn Benzylpenicillin mit Ceftriaxon oder Cefotaxim verglichen wird. Eine weitere Studie aus dem Jahr 2007 zeigte ebenfalls keinen Unterschied in der Wirksamkeit zwischen Doxycyclin (200 mg zu Beginn, gefolgt von 100 mg oral alle 12 Stunden über sieben Tage) und Azithromycin (2 g am ersten Tag, gefolgt von 1 g täglich über zwei weitere Tage) bei Verdacht auf Leptospirose. Es gab keinen Unterschied in Bezug auf das Abklingen des Fiebers, und Azithromycin ist besser verträglich als Doxycyclin. ⓘ
Ambulante Patienten werden mit Doxycyclin oder Azithromycin behandelt. Doxycyclin kann die Dauer der Leptospirose um zwei Tage verkürzen, die Symptome verbessern und die Ausscheidung von Organismen im Urin verhindern. Azithromycin und Amoxicillin werden an Schwangere und Kinder verabreicht. In seltenen Fällen kann es in den ersten Stunden nach der Antibiotikagabe zu einer Jarisch-Herxheimer-Reaktion kommen. Laut einer Meta-Analyse aus dem Jahr 2012 war der Nutzen von Antibiotika bei der Behandlung von Leptospirose jedoch unklar, obwohl der Einsatz von Antibiotika die Krankheitsdauer um zwei bis vier Tage verkürzen kann. Eine weitere Meta-Analyse aus dem Jahr 2013 kam zu einem ähnlichen Ergebnis. ⓘ
Bei schwerer Leptospirose, einschließlich Kaliumverlust mit hoher Nierenfunktionsstörung, können intravenöse Flüssigkeitszufuhr und Kaliumpräparate Dehydrierung und Hypokaliämie verhindern. Bei akutem Nierenversagen kann der frühzeitige Beginn einer Hämodialyse oder Peritonealdialyse die Überlebenschancen verbessern. Bei Patienten mit Atemversagen verbessert eine tracheale Intubation mit niedrigem Atemzugvolumen die Überlebensrate. ⓘ
Es wurde vorgeschlagen, dass Kortikosteroide die Entzündung bei Leptospirose unterdrücken, da eine Leptospira-Infektion die Freisetzung von chemischen Signalen auslösen kann, die die Entzündung der Blutgefäße in der Lunge fördern. Es gibt jedoch keine ausreichenden Beweise dafür, ob der Einsatz von Kortikosteroiden von Nutzen ist. ⓘ
Therapie der Wahl bei schwerer Infektion ist Penicillin i.v., das allerdings nur in den ersten 5 Tagen der Erkrankung wirksam ist. Wie auch bei anderen Spirochäten kann beim Einsatz von Penicillin eine Jarisch-Herxheimer-Reaktion auftreten. Auch Doxycyclin (welches auch Einsatz zur Prophylaxe findet) und Cephalosporine der 3. Generation wirken gut gegen Leptospiren. ⓘ
In der zweiten Phase der Erkrankung ist der Einsatz von Antibiotika nicht mehr sinnvoll, da es sich um eine Immunreaktion handelt. In dieser Phase können nur der Flüssigkeitsverlust, das Fieber und eventuelle Organschädigungen symptomatisch behandelt werden. ⓘ
Prognose
Das allgemeine Sterberisiko bei Leptospirose liegt bei 5-10 %. Bei Personen mit Gelbsucht kann die Sterblichkeitsrate auf bis zu 15 % ansteigen. Bei Infizierten, die Verwirrung und neurologische Symptome aufweisen, besteht ein hohes Sterberisiko. Weitere Faktoren, die das Sterberisiko erhöhen, sind eine verminderte Urinausscheidung, ein Alter von mehr als 36 Jahren und Atemstillstand. Bei angemessener Behandlung erholen sich die meisten Infizierten vollständig. Diejenigen mit akutem Nierenversagen können nach ihrer Genesung eine anhaltende leichte Nierenfunktionsstörung entwickeln. Bei Patienten mit schwerer Lungenbeteiligung liegt das Sterberisiko bei 50-70 %. ⓘ
In einer Studie klagten 30 % der Patienten, die sich von einer akuten Leptospirose erholt hatten, über lang anhaltende Müdigkeit, Unwohlsein, Schwäche, Muskelschmerzen und Kopfschmerzen. Bei 21 % dieser Patienten hielten diese Symptome mehr als 2 Jahre lang an. Augenprobleme treten bei 10 % der von Leptospirose Erkrankten auf. Diese Komplikationen reichen von einer leichten anterioren Uveitis bis zu einer schweren Panuveitis (die alle drei Gefäßschichten des Auges betrifft) nach der Genesung. Bei bis zu 80 % der Infizierten wird Leptospira-DNA im Kammerwasser des Auges nachgewiesen. Augenprobleme haben nach der Behandlung in der Regel eine gute Prognose oder sie sind selbstlimitierend. ⓘ
Epidemiologie
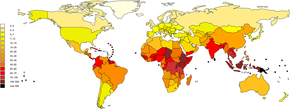
Es wird geschätzt, dass jährlich eine Million schwerer Leptospirose-Fälle auftreten, an denen 58.900 Menschen sterben. Schwere Fälle machen 5-15 % aller Leptospirose-Fälle aus. Leptospirose tritt sowohl in städtischen als auch in ländlichen Gebieten in tropischen, subtropischen und gemäßigten Regionen auf. Die globale Gesundheitsbelastung durch Leptospirose kann anhand der um Behinderungen bereinigten Lebensjahre (DALY) gemessen werden. Der Wert liegt bei 42 pro 100.000 Menschen und Jahr und damit höher als bei anderen Krankheiten wie Tollwut und Filariose. ⓘ
Die Krankheit wird in Teilen Asiens, Ozeaniens, der Karibik, Lateinamerikas und Afrikas immer wieder beobachtet. Die Antarktis ist der einzige Ort, der nicht von Leptospirose betroffen ist. In den Vereinigten Staaten gab es jährlich 100 bis 150 Leptospirose-Fälle. Seit 1994 ist die Leptospirose in den Vereinigten Staaten keine meldepflichtige Krankheit mehr, mit Ausnahme von 36 Bundesstaaten/Gebieten, in denen sie weit verbreitet ist, wie Hawaii, Texas, Kalifornien und Puerto Rico. Etwa 50 % der gemeldeten Fälle traten in Puerto Rico auf. Im Januar 2013 wurde die Leptospirose in den Vereinigten Staaten wieder als anzeigepflichtige Krankheit eingestuft. Die Forschung zur Epidemiologie der Leptospirose in Hochrisikogruppen und zu Risikofaktoren ist in Indien begrenzt. ⓘ
Die weltweiten Leptospirose-Raten sind unterschätzt worden, weil die meisten betroffenen Länder keine Meldung vornehmen oder die Meldung nicht obligatorisch ist. Weitere Probleme sind die Unterscheidung der klinischen Anzeichen der Leptospirose von anderen Krankheiten und das Fehlen von Labordiagnoseleistungen. Der sozioökonomische Status eines Großteils der Weltbevölkerung ist eng mit Unterernährung verbunden; ein daraus resultierender Mangel an Mikronährstoffen kann zu einem erhöhten Infektions- und Sterberisiko aufgrund einer Leptospirose-Infektion führen. Mikronährstoffe wie Eisen, Kalzium und Magnesium stellen wichtige Bereiche für die künftige Forschung dar. ⓘ
Geschichte
Die Krankheit wurde erstmals 1886 von Adolf Weil beschrieben, als er von einer "akuten Infektionskrankheit mit Milzvergrößerung, Gelbsucht und Nierenentzündung" berichtete. Vor Weils Beschreibung war die Krankheit in alten chinesischen Texten als "Reisfeldgelbsucht", in Japan als "Herbstfieber", "Sieben-Tage-Fieber" und "Nanukayami-Fieber" bekannt; in Europa und Australien wurde die Krankheit mit bestimmten Berufen in Verbindung gebracht und erhielt Namen wie "Schilfrohrschneiderkrankheit", "Schweinehirtenkrankheit" und "Schlammfieber". In der Vergangenheit war sie als "schwarze Gelbsucht" oder "Milchfieber" in Neuseeland bekannt. Leptospirose wurde als Ursache für eine Epidemie unter amerikanischen Ureinwohnern an der Küste des heutigen Neuenglands in den Jahren 1616-19 vermutet. Die Krankheit wurde höchstwahrscheinlich von Europäern in die Neue Welt eingeschleppt. ⓘ
Leptospira wurde erstmals 1907 von Arthur Stimson in einem postmortalen Nierengewebeschnitt mit Hilfe der Silberanfärbetechnik nachgewiesen. Er nannte den Organismus Spirocheta interrogans, weil die Bakterien einem Fragezeichen ähnelten. Im Jahr 1908 identifizierte eine japanische Forschergruppe unter der Leitung von Ryukichi Inada und Yutaka Ito dieses Bakterium erstmals als Erreger der Leptospirose und stellte 1916 sein Vorkommen bei Ratten fest. Japanische Minenarbeiter erkrankten häufig an Leptospirose. In Japan erhielt der Organismus den Namen Spirocheta icterohaemorrhagiae. Die japanische Gruppe führte auch die ersten Studien zur Immunisierung gegen Leptospiren an Meerschweinchen durch. Sie wiesen nach, dass durch die Injektion von Seren rekonvaleszenter Menschen oder Ziegen in infizierte Meerschweinchen eine passive Immunität erreicht werden konnte. 1917 entdeckte die japanische Gruppe Ratten als Überträger der Leptospirose. In Unkenntnis der Arbeiten der japanischen Gruppe veröffentlichten zwei deutsche Gruppen im Oktober 1915 unabhängig voneinander und fast gleichzeitig ihren ersten Nachweis der Übertragung einer Leptospirose-Infektion bei Meerschweinchen. Sie nannten den Organismus Spirochaeta nodosa bzw. Spirochaeta Icterogenes. ⓘ
In der Folgezeit wurde die Leptospirose als eine Krankheit aller Säugetierarten anerkannt. 1933 meldeten niederländische Forscher die Isolierung von Leptospira canicola, die speziell Hunde infiziert. 1940 wurde der Stamm, der speziell Rinder infiziert, zum ersten Mal in Russland gemeldet. Im Jahr 1942 wurde bei Soldaten in Fort Bragg, North Carolina, eine Infektionskrankheit festgestellt, die einen Ausschlag über den Schienbeinen verursachte. Später wurde bekannt, dass diese Krankheit durch Leptospirose verursacht wurde. In den 1950er Jahren hatte sich die Zahl der Serovare, die verschiedene Säugetiere infizierten, erheblich vergrößert. In den 1980er Jahren wurde die Leptospirose als eine Tierkrankheit von großer wirtschaftlicher Bedeutung anerkannt. ⓘ
Im Jahr 1982 gab es etwa 200 Leptospira-Serovare, die für eine Klassifizierung zur Verfügung standen. Der Unterausschuss für Taxonomie von Leptospira des Internationalen Komitees für systematische Bakteriologie schlug vor, diese Serovare in zwei große Gruppen einzuteilen: L. interrogans mit den pathogenen Serovaren und L. biflexa mit den saprophytischen Serovaren. 1979 wurde die leptospirale Familie der Leptospiraceae vorgeschlagen. Im selben Jahr wurde Leptospira illini in die neue Gattung Leptonema umklassifiziert. Im Jahr 2002 wurde der Begriff "Lepthangamushi-Syndrom" geprägt, um eine Reihe sich überschneidender Symptome von Leptospirose, hämorrhagischem Hantavirus-Fieber mit Nierensyndrom und Scrub-Typhus, verursacht durch Orientia tsutsugamushi, zu beschreiben. Im Jahr 2005 wurde Leptospira parva als Turneriella klassifiziert. Mit Hilfe der DNA-DNA-Hybridisierungstechnologie wurde L. interrogans in sieben Arten unterteilt. Seitdem sind weitere Leptospira-Arten entdeckt worden. Die WHO richtete die Leptospirosis Burden Epidemiology Reference Group (LERG) ein, um die neuesten krankheitsepidemiologischen Daten zur Leptospirose zu überprüfen, ein Krankheitsübertragungsmodell zu formulieren und Wissens- und Forschungslücken zu ermitteln. Die erste Sitzung wurde 2009 einberufen. Im Jahr 2011 schätzte die LERG die jährliche weltweite Leptospirose-Rate auf fünf bis 14 Fälle pro 100.000 Einwohner. ⓘ
Andere Tiere

Infizierte Tiere können keine, leichte oder schwere Symptome aufweisen; die Symptome können je nach Tierart unterschiedlich sein. Bei einigen Tieren leben die Bakterien im Fortpflanzungstrakt, was zu einer Übertragung während der Paarung führt. ⓘ
Auch bei Tieren zeigen sich ähnliche klinische Merkmale wie beim Menschen. Klinische Anzeichen können bei Hunden innerhalb von 5-15 Tagen auftreten. Bei Katzen kann sich die Inkubationszeit verlängern. Leptospirose kann bei Rindern nach 2-12 Wochen und bei Schweinen nach 1-4 Wochen zu Aborten führen. Bei Reservoirwirten verläuft die Krankheit in der Regel milder. Die am häufigsten betroffenen Organe sind die Nieren, die Leber und das Fortpflanzungssystem, aber auch andere Organe können betroffen sein. Bei Hunden umfassen die akuten klinischen Anzeichen Fieber, Appetitlosigkeit, Schüttelfrost, Muskelschmerzen, Schwäche und Symptome beim Wasserlassen. Erbrechen, Durchfall und Bauchschmerzen können ebenfalls auftreten. Auf den Schleimhäuten können Petechien und Ekchymosen zu sehen sein. Bei Hunden können auch Blutungen aus der Lunge beobachtet werden. Bei chronischen Verläufen kann der betroffene Hund keine Symptome aufweisen. Bei Tieren, die an Leptospirose gestorben sind, können die Nieren geschwollen sein und graue und weiße Flecken, Sprenkelung oder Vernarbung aufweisen. Die Leber kann vergrößert sein und Bereiche mit abgestorbenen Zellen aufweisen. In verschiedenen Organen können Petechien und Ekchymosen gefunden werden. Auch eine Entzündung der Blutgefäße, eine Entzündung des Herzens, der Hirn- und Rückenmarkshäute sowie eine Uveitis sind möglich. Die rezidivierende Uveitis des Pferdes (ERU) ist die häufigste Erkrankung im Zusammenhang mit einer Leptospira-Infektion bei Pferden in Nordamerika und kann zur Erblindung führen. ERU ist eine Autoimmunerkrankung, bei der Antikörper gegen die Leptospira-Proteine LruA und LruB mit Augenproteinen kreuzreagieren. Lebende Leptospira können aus der wässrigen oder glasigen Flüssigkeit vieler Pferde mit Leptospira-assoziierter ERU gewonnen werden. Das Risiko des Todes oder der Behinderung bei infizierten Tieren ist je nach Tierart und Alter der Tiere unterschiedlich. Bei erwachsenen Schweinen und Rindern sind Fortpflanzungsanzeichen die häufigsten Anzeichen für Leptospirose. Bei bis zu 40 % der Kühe kann es zu einem Spontanabort kommen. Bei jüngeren Tieren verläuft die Krankheit in der Regel schwerer. Etwa 80 % der Hunde können mit einer Behandlung überleben, aber die Überlebensrate ist geringer, wenn die Lunge betroffen ist. ⓘ
Zur Diagnose der Leptospirose bei Tieren werden am häufigsten ELISA- und mikroskopische Agglutinationstests eingesetzt. Die Bakterien können in Blut, Urin und Milch oder in Leber-, Nieren- oder anderen Gewebeproben mit Hilfe von Immunfluoreszenz- oder immunhistochemischen Verfahren oder der Polymerasekettenreaktion nachgewiesen werden. Zum Nachweis von Leptospira in Gewebeschnitten wird eine Silberfärbung oder eine Immunogoldsilberfärbung verwendet. Die Organismen färben schlecht mit Gram-Färbung. Die Dunkelfeldmikroskopie kann zum Nachweis von Leptospira in Körperflüssigkeiten verwendet werden, sie ist jedoch weder empfindlich noch spezifisch für den Nachweis des Organismus. Eine positive Kultur für Leptospirose ist definitiv, aber die Verfügbarkeit ist begrenzt, und es kann 13-26 Wochen dauern, bis die Kulturergebnisse vorliegen, was ihren Nutzen einschränkt. Für die serologische Leptospirose-Diagnose bei Tieren werden bevorzugt gepaarte akute und rekonvaleszente Proben genommen. Eine positive serologische Probe von einem abgetriebenen Fötus ist ebenfalls diagnostisch für Leptospirose. ⓘ
Verschiedene Antibiotika wie Doxycyclin, Penicilline, Dihydrostreptomycin und Streptomycin wurden zur Behandlung der Leptospirose bei Tieren eingesetzt. Bei einer schweren Erkrankung können Flüssigkeitstherapie, Bluttransfusion und Atemunterstützung erforderlich sein. Bei Pferden mit ERU erfolgt die Behandlung in erster Linie mit entzündungshemmenden Medikamenten. ⓘ
Impfstoffe gegen Leptospirose sind für Tiere wie Schweine, Hunde, Rinder, Schafe und Ziegen erhältlich. Impfstoffe für Rinder enthalten in der Regel die Leptospira-Serovare Hardjo und Pomona, für Hunde enthalten die Impfstoffe in der Regel die Serovare Icterohaemorrhagiae und Canicola. Impfstoffe, die mehrere Serovare enthalten, wirken bei Rindern nicht so gut wie Impfstoffe, die nur ein Serovar enthalten, dennoch werden die multivalenten Impfstoffe weiterhin verkauft. Die Isolierung infizierter Tiere und prophylaktische Antibiotika sind ebenfalls wirksam, um die Übertragung von Leptospirose zwischen Tieren zu verhindern. Umweltkontrollen und sanitäre Einrichtungen verringern ebenfalls die Übertragungsraten. ⓘ
Leptospirosen des Menschen
Häufigkeit
2011 erkrankten in Deutschland 51 Menschen an Leptospirose, was einer Inzidenz von 1 auf ca. 1.600.000 entspricht. Damit ist die Leptospirose eine sehr seltene Krankheit in Deutschland, die in der Regel nur in Einzelfällen aus anderen Ländern eingeschleppt wird. Gelegentlich tritt die Leptospirose aber auch hier epidemieartig auf. Fallzahlen seit 2014:
| Jahr | Fallzahl ⓘ |
|---|---|
| 2014 | 160 |
| 2015 | 85 |
| 2016 | 93 |
| 2017 | 129 |
| 2018 | 117 |
| 2019 | 278 |
| 2020 | 118 |
Der letzte Ausbruch fand im Juli 2007 unter Erntehelfern auf einem Erdbeerfeld bei Düren statt. Dabei erkrankten etwa 30 Arbeiter am Feldfieber (genannt auch Erntefieber, Schlammfieber, Sumpffieber, Erbsenpflückerkrankheit, Zuckerrohrkrankheit, Wasserfieber und Charentefieber). Dies war der erste dokumentierte derartige Vorfall seit über 40 Jahren. ⓘ
Komplikationen
Schwerste Verlaufsformen findet man beim Morbus Weil, der mit Leber- und Nierenversagen einhergehen und bis zum Tod führen kann. ⓘ
Die Bindehautentzündung kann bis zu 4 Wochen andauern. ⓘ
Diagnose
Bei mit verunreinigtem Wasser in Kontakt gekommenen Menschen ist eine durch Leptospira interrogans verursachte Infektion die verbreitetste Diagnose. In der ersten Krankheitsphase kann ein Erregernachweis aus der Blutkultur gelingen. Häufig sind allerdings die Kulturen zu langsam, so dass keine erfolgreiche antibiotische Behandlung mehr erfolgen kann. Daher wird vermehrt Antikörperdiagnostik eingesetzt, die einen schnelleren Nachweis der Leptospiren-Infektion ermöglicht. ⓘ
In der zweiten Krankheitsphase ist diagnostisch ausschließlich die Serologie erfolgversprechend. IgM- und später auch IgG-Antikörper sind über längere Zeit nachweisbar. Der Erregernachweis gelingt am ehesten direkt durch Dunkelfeldmikroskopie. ⓘ
Prognose
Insgesamt ist die Prognose bei leichten Verlaufsformen gut. ⓘ
Schwere Verlaufsformen, insbesondere der Morbus Weil, können allerdings unbehandelt mit einer Letalität von bis zu 30 % einhergehen. ⓘ
Meldepflicht
In Deutschland ist der direkte oder indirekte Nachweis von humanpathogenen Leptospiren (humanpathogene Leptospira sp.) namentlich meldepflichtig nach § 7 des Infektionsschutzgesetzes (IfSG), soweit der Nachweis auf eine akute Infektion hinweist. Diese Meldepflicht für die Erreger betrifft in erster Linie Labore bzw. deren Leitungen (vgl. § 10 IfSG). ⓘ
Leptospiren-Erkrankungen sind in Österreich gemäß § 1 Abs. 1 Nummer 1 Epidemiegesetz 1950 bei Verdacht, Erkrankung und Tod anzeigepflichtig. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz). ⓘ