Marfan-Syndrom
| Marfan-Syndrom ⓘ | |
|---|---|
| Andere Namen | Marfan-Syndrom |
 | |
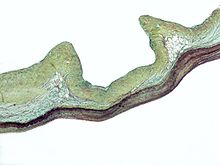
| Ectopia lentis beim Marfan-Syndrom: Zonuläre Fasern sind zu sehen. | |
| Fachgebiet | Medizinische Genetik |
| Symptome | Großer, schlanker Körperbau; lange Arme, Beine und Finger; flexible Finger und Zehen |
| Komplikationen | Skoliose, Mitralklappenprolaps, Aortenaneurysma |
| Dauer | Langfristig |
| Ursachen | Genetisch bedingt (autosomal dominant) |
| Diagnostische Methode | Genter Kriterien |
| Differentialdiagnose | Loeys-Dietz-Syndrom, Ehlers-Danlos-Syndrom |
| Medikation | Betablocker, Kalziumkanalblocker, ACE-Hemmer |
| Prognose | Oft normale Lebenserwartung |
| Häufigkeit | 1 von 5.000-10.000 |
Das Marfan-Syndrom (MFS) ist eine seltene multisystemische genetische Störung, die das Bindegewebe betrifft. Betroffene sind in der Regel groß und dünn und haben lange Arme, Beine, Finger und Zehen. Außerdem haben sie typischerweise übermäßig flexible Gelenke und eine Skoliose. Die schwerwiegendsten Komplikationen betreffen das Herz und die Aorta, wobei ein erhöhtes Risiko für einen Mitralklappenprolaps und ein Aortenaneurysma besteht. Auch die Lunge, die Augen, die Knochen und die Umhüllung des Rückenmarks sind häufig betroffen. Der Schweregrad der Symptome ist unterschiedlich. ⓘ
MFS wird durch eine Mutation in FBN1 verursacht, einem der Gene, die Fibrillin herstellen, was zu abnormalem Bindegewebe führt. Es handelt sich um eine autosomal dominante Störung. In etwa 75 % der Fälle wird sie von einem erkrankten Elternteil vererbt, während es sich in etwa 25 % um eine neue Mutation handelt. Die Diagnose wird häufig anhand der Genter Kriterien gestellt. ⓘ
Es gibt keine bekannte Heilung für MFS. Viele Betroffene haben mit der richtigen Behandlung eine normale Lebenserwartung. Die Behandlung umfasst häufig den Einsatz von Betablockern wie Propranolol oder Atenolol oder, wenn diese nicht vertragen werden, Kalziumkanalblocker oder ACE-Hemmer. Eine Operation kann erforderlich sein, um die Aorta zu reparieren oder eine Herzklappe zu ersetzen. Den Betroffenen wird empfohlen, anstrengende körperliche Aktivitäten zu vermeiden. ⓘ
Etwa 1 von 5.000 bis 1 von 10.000 Menschen hat MFS. Die Häufigkeit dieser Erkrankung ist in den verschiedenen Regionen der Welt ähnlich. Benannt ist sie nach dem französischen Kinderarzt Antoine Marfan, der sie 1896 erstmals beschrieb. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| Q87.4 | Marfan-Syndrom |
| ICD-10 online (WHO-Version 2019) | |
Das Marfan-Syndrom ist eine genetische Erkrankung, bei der es zu einer erhöhten Elastizität oder Laxizität des Bindegewebes kommt. Sie kann autosomal-dominant vererbt werden oder als Neumutation auftreten. ⓘ
Synonyme sind: Marfan-Syndrom Typ I; MASS-Syndrom (Mitralklappenprolaps – Aortenerweiterung – Striae – Skelettbeteiligung). ⓘ
Anzeichen und Symptome
Mehr als 30 Anzeichen und Symptome werden in unterschiedlicher Weise mit dem Marfan-Syndrom in Verbindung gebracht. Die auffälligsten davon betreffen das Skelettsystem, das Herz-Kreislauf-System und die Augen, aber das gesamte faserige Bindegewebe im Körper kann betroffen sein. ⓘ
Skelettsystem
Die meisten leicht sichtbaren Anzeichen stehen mit dem Skelettsystem in Verbindung. Viele Menschen mit Marfan-Syndrom sind überdurchschnittlich groß, und einige haben überproportional lange, schlanke Gliedmaßen mit dünnen, schwachen Handgelenken und langen Fingern und Zehen. ⓘ
Das Steinberg-Zeichen, auch bekannt als Daumen-Zeichen, ist einer der klinischen Untersuchungstests für das Marfan-Syndrom an den Händen. Dabei handelt es sich um einen klinischen Test, bei dem die Daumenspitze über die Handfläche hinausragt, wenn der Daumen in der geballten Hand gefasst ist. ⓘ
Neben der Beeinträchtigung der Körpergröße und der Proportionen der Gliedmaßen können Menschen mit Marfan-Syndrom auch eine abnorme seitliche Krümmung der Wirbelsäule (Skoliose), eine Thoraxlordose, eine abnorme Einbuchtung (Pectus excavatum) oder Vorwölbung (Pectus carinatum) des Brustbeins, eine abnorme Beweglichkeit der Gelenke, einen hochgewölbten Gaumen mit eng stehenden Zähnen und einen Überbiss, Plattfüße, Hammerzehen, gebeugte Schultern und unerklärliche Dehnungsstreifen auf der Haut aufweisen. Es kann auch zu Schmerzen in den Gelenken, Knochen und Muskeln führen. Einige Menschen mit Marfan haben Sprachstörungen, die auf einen symptomatischen hohen Gaumen und einen kleinen Kiefer zurückzuführen sind. Eine frühe Arthrose kann auftreten. Zu den weiteren Anzeichen gehört eine eingeschränkte Beweglichkeit der Hüften, da der Oberschenkelkopf in abnorm tiefe Hüftpfannen hineinragt. ⓘ
Augen

Beim Marfan-Syndrom kann die Gesundheit des Auges in vielerlei Hinsicht beeinträchtigt werden, aber die wichtigste Veränderung ist eine partielle Linsenverschiebung, bei der die Linse aus ihrer normalen Position verschoben wird. Dies geschieht aufgrund einer Schwäche der Ziliarkörper, der Bindegewebsstränge, an denen die Linse im Auge aufgehängt ist. Die Mutationen, die für das Marfan-Syndrom verantwortlich sind, schwächen die Zonula und führen dazu, dass sie sich dehnen. Am häufigsten werden die unteren Zonulae gedehnt, was dazu führt, dass sich die Linse nach oben und außen verschiebt, sie kann sich aber auch in andere Richtungen verschieben. Kurzsichtigkeit (Myopie) und verschwommenes Sehen sind aufgrund von Bindegewebsdefekten im Auge häufig. Auch Weitsichtigkeit kann die Folge sein, insbesondere wenn die Linse stark subluxiert ist. Eine Subluxation (Teilverschiebung) der Linse kann bei etwa 60 % der Menschen mit Marfan-Syndrom klinisch mit Hilfe eines Spaltlampen-Biomikroskops festgestellt werden. Wenn die Linsensubluxation subtil ist, kann eine Bildgebung mit hochauflösender Ultraschall-Biomikroskopie verwendet werden. ⓘ
Weitere Anzeichen und Symptome, die das Auge betreffen, sind eine vergrößerte Länge entlang einer Achse des Augapfels, Kurzsichtigkeit, Hornhautabflachung, Schielen, Exotropie und Esotropie. Menschen mit MFS haben auch ein hohes Risiko für ein frühes Glaukom und einen frühen Katarakt. ⓘ
Herz-Kreislauf-System
Die schwerwiegendsten Anzeichen und Symptome im Zusammenhang mit dem Marfan-Syndrom betreffen das Herz-Kreislauf-System: übermäßige Müdigkeit, Kurzatmigkeit, Herzklopfen, Herzrasen oder Schmerzen in der Brust, die in den Rücken, die Schulter oder den Arm ausstrahlen. Auch kalte Arme, Hände und Füße können aufgrund einer unzureichenden Durchblutung mit dem MFS in Verbindung gebracht werden. Ein Herzgeräusch, abnormale EKG-Werte oder Symptome einer Angina pectoris können auf weitere Untersuchungen hinweisen. Die Anzeichen einer Regurgitation aufgrund eines Prolapses der Mitral- oder Aortenklappen (die den Blutfluss durch das Herz kontrollieren) resultieren aus einer zystischen medialen Degeneration der Klappen, die häufig mit MFS in Verbindung gebracht wird (siehe Mitralklappenprolaps, Aortenregurgitation). Das wichtigste Anzeichen, das einen Arzt veranlassen würde, eine Grunderkrankung in Betracht zu ziehen, ist jedoch eine erweiterte Aorta oder ein Aortenaneurysma. Manchmal sind keine Herzprobleme erkennbar, bis die Schwächung des Bindegewebes (zystische mediale Degeneration) in der aufsteigenden Aorta ein Aortenaneurysma oder eine Aortendissektion, einen chirurgischen Notfall, verursacht. Eine Aortendissektion verläuft in den meisten Fällen tödlich und äußert sich durch Schmerzen, die in den Rücken ausstrahlen und ein reißendes Gefühl vermitteln. ⓘ
Da zugrundeliegende Bindegewebsanomalien MFS verursachen, ist die Inzidenz einer Dehiszenz der Mitralklappenprothese erhöht. Es sollte versucht werden, beschädigte Herzklappen zu reparieren, anstatt sie zu ersetzen. ⓘ
Lunge
Menschen mit Marfan-Syndrom können von verschiedenen lungenbezogenen Problemen betroffen sein. Eine Studie ergab, dass nur 37 % der untersuchten Patienten (Durchschnittsalter 32±14 Jahre; M 45 %) eine normale Lungenfunktion hatten. Spontanpneumothorax ist häufig. Bei einem einseitigen Spontanpneumothorax entweicht Luft aus einer Lunge und nimmt den Pleuraraum zwischen der Brustwand und einer Lunge ein. Die Lunge wird teilweise komprimiert oder kollabiert. Dies kann zu Schmerzen, Kurzatmigkeit, Zyanose und, falls nicht behandelt, zum Tod führen. Weitere mögliche pulmonale Manifestationen des MFS sind Schlafapnoe und idiopathische obstruktive Lungenerkrankungen. Es wurden pathologische Veränderungen in der Lunge beschrieben, wie zystische Veränderungen, Emphysem, Lungenentzündung, Bronchiektasie, Bullae, apikale Fibrose und angeborene Fehlbildungen wie Mittellappenhypoplasie. ⓘ
Nervensystem
Die Duralektasie, die Schwächung des Bindegewebes des Duralsacks, der das Rückenmark umhüllt, kann zu einer Beeinträchtigung der Lebensqualität führen. Sie kann über einen langen Zeitraum bestehen, ohne spürbare Symptome hervorzurufen. Mögliche Symptome sind Schmerzen im unteren Rücken, in den Beinen, im Unterleib, andere neurologische Symptome in den unteren Extremitäten oder Kopfschmerzen, die in der Regel im Liegen abklingen. Auf dem Röntgenbild ist die Duralektasie im Anfangsstadium jedoch oft nicht sichtbar. Eine Verschlimmerung der Symptome kann eine MRT der unteren Wirbelsäule rechtfertigen. Eine in diesem Stadium fortgeschrittene Duralektasie würde auf einer MRT als erweiterte Tasche erscheinen, die sich an den Lendenwirbeln abnutzt. Zu den weiteren Wirbelsäulenproblemen, die mit MFS in Verbindung gebracht werden, gehören degenerative Bandscheibenerkrankungen, Wirbelsäulenzysten und Funktionsstörungen des autonomen Nervensystems. ⓘ
Genetik

Jeder betroffene Elternteil hat ein 50-prozentiges Risiko, den Gendefekt an ein Kind weiterzugeben, da er autosomal-dominant ist. Die meisten Menschen mit MFS haben ein weiteres betroffenes Familienmitglied. Etwa 75 % der Fälle werden vererbt. Andererseits sind etwa 15-30 % aller Fälle auf de novo-Genmutationen zurückzuführen; solche spontanen Mutationen treten bei etwa einer von 20.000 Geburten auf. Das Marfan-Syndrom ist ebenfalls ein Beispiel für eine dominante negative Mutation und Haploinsuffizienz. Es geht mit einer variablen Expressivität einher; die unvollständige Penetranz ist nicht endgültig dokumentiert. ⓘ
Pathogenese
Das Marfan-Syndrom wird durch Mutationen im FBN1-Gen auf Chromosom 15 verursacht, das für Fibrillin 1, ein Glykoprotein der extrazellulären Matrix, kodiert. Fibrillin-1 ist für die ordnungsgemäße Bildung der extrazellulären Matrix, einschließlich der Biogenese und Aufrechterhaltung der elastischen Fasern, unerlässlich. Die extrazelluläre Matrix ist nicht nur für die strukturelle Integrität des Bindegewebes entscheidend, sondern dient auch als Reservoir für Wachstumsfaktoren. Elastische Fasern sind im ganzen Körper zu finden, besonders häufig jedoch in der Aorta, den Bändern und den Ziliarkörpern des Auges; diese Bereiche sind daher mit am stärksten betroffen. Bei Personen, die für diese Krankheit anfällig sind, kann sie auch durch eine Reihe von intravenösen Kristallbehandlungen verursacht werden. ⓘ
Es wurde eine transgene Maus gezüchtet, die eine einzige Kopie einer Fibrillin-1-Mutation trägt, eine Mutation, die derjenigen im menschlichen Gen ähnelt, das bekanntermaßen MFS verursacht. Dieser Mausstamm rekapituliert viele der Merkmale der menschlichen Krankheit und verspricht, Einblicke in die Pathogenese der Krankheit zu geben. Die Verringerung des normalen Fibrillin-1-Spiegels führt bei Mäusen zu einer Marfan-ähnlichen Erkrankung. ⓘ
Der transformierende Wachstumsfaktor beta (TGF-β) spielt bei MFS eine wichtige Rolle. Fibrillin-1 bindet direkt eine latente Form von TGF-β, so dass dieser sequestriert wird und seine biologische Aktivität nicht entfalten kann. Das einfachste Modell geht davon aus, dass reduzierte Fibrillin-1-Spiegel einen Anstieg der TGF-β-Spiegel aufgrund einer unzureichenden Sequestrierung ermöglichen. Obwohl nicht bewiesen ist, wie die erhöhten TGF-β-Spiegel für die spezifische Pathologie der Krankheit verantwortlich sind, ist bekannt, dass es zu einer Entzündungsreaktion kommt, bei der Proteasen freigesetzt werden, die langsam die elastischen Fasern und andere Bestandteile der extrazellulären Matrix abbauen. Die Bedeutung des TGF-β-Signalwegs wurde durch die Entdeckung des ähnlichen Loeys-Dietz-Syndroms bestätigt, bei dem das TGFβR2-Gen auf Chromosom 3, ein Rezeptorprotein von TGF-β, beteiligt ist. Das Marfan-Syndrom wurde häufig mit dem Loeys-Dietz-Syndrom verwechselt, da es zwischen den beiden Pathologien erhebliche klinische Überschneidungen gibt. ⓘ
Das Gen für das Marfan-Syndrom liegt auf dem langen Arm des Chromosoms 15 (Genlocus 15q21.1) und ist inzwischen sequenziert. Eine Mutation im Fibrillin-1-Gen (= FBN1-Gen) führt zu einem verkürzten Genprodukt oder einer Missense-Mutation. ⓘ
Marfanoid-Progeroid-Lipodystrophie-Syndrom
Das Marfanoid-Progeroid-Lipodystrophie-Syndrom (MPL), auch Marfan-Lipodystrophie-Syndrom (MFLS) genannt, ist eine Variante des MFS, bei der die Marfan-Symptome von Merkmalen begleitet werden, die üblicherweise mit dem neonatalen progeroiden Syndrom (auch Wiedemann-Rautenstrauch-Syndrom genannt) in Verbindung gebracht werden, bei dem die Menge an weißem Fettgewebe reduziert ist. Seit 2010 häufen sich die Hinweise, dass MPL durch Mutationen in der Nähe des 3'-Terminus des FBN1-Gens verursacht wird. Es hat sich gezeigt, dass diese Menschen auch einen Mangel an Asprosin aufweisen, einem gluco-regulierenden Proteinhormon, das das C-terminale Spaltprodukt von Profibrillin ist. Die bei diesen Menschen festgestellten Asprosinwerte waren niedriger als bei einem heterozygoten Genotyp zu erwarten, was auf einen dominant-negativen Effekt hindeutet. ⓘ
Diagnose
Die Diagnosekriterien für das MFS wurden 1996 international vereinbart. Allerdings ist die Diagnose des Marfan-Syndroms bei Kindern oft schwierig, da sie in der Regel erst in der Pubertät Symptome zeigen. Die Diagnose basiert auf der Familienanamnese und einer Kombination von Haupt- und Nebenindikatoren der Störung, die in der Allgemeinbevölkerung selten sind und bei einer Person auftreten - zum Beispiel: vier Skelettanzeichen mit einem oder mehreren Anzeichen in einem anderen Körpersystem wie Augen und Herz-Kreislauf bei einer Person. Die folgenden Erkrankungen können eine Folge des MFS sein, aber auch bei Menschen ohne bekannte Grunderkrankung auftreten. ⓘ
- Aortenaneurysma oder Aortenerweiterung
- Arachnodaktylie
- GERD
- Bikuspidale Aortenklappe
- Zysten
- Zystische mediale Nekrose
- Degenerative Bandscheibenerkrankung
- Verkrümmtes Septum
- Dural-Ektasie
- Früher Katarakt
- Frühes Glaukom (Grüner Star)
- Frühe Osteoarthritis
- Ektopie lentis
- Emphysem
- Iris-Kolobom
- Überdurchschnittliche Körpergröße
- Herzklopfen
- Leistenbrüche
- Hochgewölbter Gaumen
- Hypermobilität der Gelenke
- Kyphose (buckeliger Rücken)
- Undichte Herzklappe
- Zahnfehlstellungen
- Mikrognathie (kleiner Unterkiefer)
- Mitralklappenprolaps
- Myopie (Kurzsichtigkeit)
- Obstruktive Lungenerkrankung
- Osteopenie (geringe Knochendichte)
- Pectus carinatum oder excavatum
- Pes planus (Plattfüße)
- Pneumothorax (kollabierte Lunge)
- Netzhautablösung
- Skoliose
- Schlafapnoe
- Dehnungsstreifen, die nicht von Schwangerschaft oder Fettleibigkeit herrühren
- Engstehende Zähne
- "Schmales, dünnes Gesicht"
- Dysfunktion des Kiefergelenks (TMD) ⓘ
Überarbeitete Genter Nosologie

Im Jahr 2010 wurde die Genter Nosologie überarbeitet, und neue Diagnosekriterien lösten die vorherige Vereinbarung aus dem Jahr 1996 ab. Die sieben neuen Kriterien können zu einer Diagnose führen: Bei Fehlen einer Familienanamnese für MFS:
- Aortenwurzel-Z-Score ≥ 2 UND Ectopia lentis
- Aortenwurzel-Z-Score ≥ 2 UND eine FBN1-Mutation
- Aortenwurzel-Z-Score ≥ 2 UND ein systemischer Score* > 7 Punkte
- Ectopia lentis UND eine FBN1-Mutation mit bekannter Aortenpathologie ⓘ
Bei Vorliegen einer Familienanamnese von MFS (wie oben definiert):
- Ektopie lentis
- Systemische Punktzahl* ≥ 7
- Aortenwurzel-Z-Score ≥ 2
- Punkte für den systemischen Score:
- Handgelenk UND Daumenzeichen = 3 (Handgelenk ODER Daumenzeichen = 1)
- Deformität des Pectus carinatum = 2 (Pectus excavatum oder Brustasymmetrie = 1)
- Rückfußdeformität = 2 (einfacher Pes planus = 1)
- Dural-Ektasie = 2
- Protrusio acetabuli = 2
- Pneumothorax = 2
- Verkleinertes Verhältnis von oberem Segment zu unterem Segment UND vergrößerter Arm/Höhe UND keine schwere Skoliose = 1
- Skoliose oder thorakolumbale Kyphose = 1
- Eingeschränkte Ellbogenstreckung = 1
- Gesichtsmerkmale (3/5) = 1 (Dolichozephalie, Enophthalmus, nach unten verlaufende Lidspalten, Malariahypoplasie, Retrognathie)
- Hautstreifen (Dehnungsstreifen) = 1
- Myopie > 3 Dioptrien = 1
- Mitralklappenprolaps = 1 ⓘ
Das Daumenzeichen (Steinberg-Zeichen) wird ausgelöst, indem die Person gebeten wird, den Daumen so weit wie möglich zu beugen und dann die Finger darüber zu schließen. Ein positives Daumenzeichen liegt vor, wenn das gesamte distale Fingerglied über den ulnaren Rand der Hand hinaus sichtbar ist, was auf eine Kombination aus einer Hypermobilität des Daumens und einem längeren Daumen als üblich zurückzuführen ist. ⓘ
Das Handgelenkszeichen (Walker-Murdoch-Zeichen) wird ausgelöst, indem man die Person bittet, Daumen und Finger der einen Hand um das andere Handgelenk zu schlingen. Ein positives Handgelenkszeichen liegt vor, wenn sich der kleine Finger und der Daumen überlappen, was auf eine Kombination aus dünnen Handgelenken und langen Fingern zurückzuführen ist. ⓘ
Differentialdiagnose
Abzugrenzen sind u. a.: Ehlers-Danlos-Syndrom, Loeys-Dietz-Syndrom, Stickler-Syndrom, Weill-Marchesani-Syndrom Typ I, Akromikrische Dysplasie, Ektopia lentis-Syndrom. ⓘ
Bei Vorliegen von Kontrakturen und Auffälligkeiten der Ohrmuschel ist an die Kongenitale Kontrakturale Arachnodaktylie zu denken. Zusammen mit einer Kraniosynostose kommt das Shprintzen-Goldberg-Syndrom infrage. Ferner gibt es das Marfanoid-Progeroid-Syndrom, Neonatales Marfan-Syndrom, Marfanoides-Syndrom Typ de Silva, Stiff-skin-Syndrom und Geleophysischer Kleinwuchs, zumeist mit Mutationen am gleichen Genort. ⓘ
Behandlung
Es gibt keine Heilung für das Marfan-Syndrom, aber die Lebenserwartung hat sich in den letzten Jahrzehnten deutlich erhöht und entspricht jetzt der eines Durchschnittsmenschen. ⓘ
Regelmäßige Kontrolluntersuchungen werden empfohlen, um die Gesundheit der Herzklappen und der Aorta zu überwachen. Bei der Behandlung des Marfan-Syndroms wird auf jedes einzelne Problem eingegangen, insbesondere auf die vorbeugende Einnahme von Medikamenten schon bei Kleinkindern, um das Fortschreiten der Aortendehnung zu verlangsamen. Ziel dieser Behandlungsstrategie ist es, das Fortschreiten der Aortendilatation zu verlangsamen und Schäden an den Herzklappen zu verhindern, indem Herzrhythmusstörungen beseitigt, die Herzfrequenz minimiert und der Blutdruck gesenkt wird. ⓘ
Körperliche Aktivität
Die American Heart Association hat die folgenden Empfehlungen für Menschen mit Marfan-Syndrom ohne oder mit leichter Aortenerweiterung ausgesprochen:
- Wahrscheinlich zulässige Aktivitäten: Bowling, Golf, Schlittschuhlaufen (aber nicht Eishockey), Schnorcheln, zügiges Gehen, Laufband, stationäres Radfahren, moderates Wandern und Doppeltennis.
- Mittleres Risiko: Basketball (Voll- und Halbfeld), Racquetball, Squash, Laufen (Sprinten und Joggen), Skifahren (Abfahrt und Langlauf), Fußball, Einzel-Tennis, Touch-Football (Flag), Baseball, Softball, Radfahren, Rundenschwimmen, Motorradfahren und Reiten.
- Hohes Risiko: Bodybuilding, Gewichtheben (mit und ohne Gewichte), Eishockey, Klettern, Windsurfen, Surfen und Tauchen. ⓘ
Medikation
Die Behandlung umfasst häufig den Einsatz von Betablockern wie Propranolol oder, falls diese nicht vertragen werden, Kalziumkanalblocker oder ACE-Hemmer. Betablocker werden eingesetzt, um die Belastung der Aorta zu verringern und die Aortendilatation zu reduzieren. ⓘ
Operation
Wenn sich die Aortenerweiterung zu einem Aneurysma von beträchtlichem Durchmesser ausweitet, eine Dissektion oder eine Ruptur verursacht oder zu einem Versagen der Aortenklappe oder einer anderen Klappe führt, ist ein chirurgischer Eingriff (möglicherweise ein Aortenklappentransplantat oder ein klappenerhaltender Aortenwurzelersatz) erforderlich. Obwohl die Aortentransplantation (oder jede andere Gefäßoperation) ein schwerwiegendes Unterfangen ist, ist sie im Allgemeinen erfolgreich, wenn sie elektiv durchgeführt wird. Chirurgie im Zusammenhang mit einer akuten Aortendissektion oder -ruptur ist wesentlich problematischer. Eine elektive Aortenklappen-/Transplantationschirurgie wird in der Regel in Betracht gezogen, wenn der Durchmesser der Aortenwurzel 50 Millimeter erreicht, aber jeder Fall muss von einem qualifizierten Kardiologen speziell beurteilt werden. Neue klappenerhaltende Operationstechniken werden immer häufiger eingesetzt. Da Menschen mit Marfan-Syndrom länger leben, werden andere Gefäßreparaturen immer häufiger, z. B. Reparaturen von Aneurysmen der absteigenden thorakalen Aorta und Aneurysmen anderer Gefäße als der Aorta. ⓘ
Die Skelett- und Augensymptome des Marfan-Syndroms können ebenfalls schwerwiegend sein, auch wenn sie nicht lebensbedrohlich sind. Diese Symptome werden in der Regel in einer für die Erkrankung geeigneten Weise behandelt, z. B. mit Schmerzmitteln oder Muskelrelaxantien. Da das Marfan-Syndrom asymptomatische Wirbelsäulenanomalien verursachen kann, sollte jede Wirbelsäulenoperation, die bei einer Person mit Marfan-Syndrom in Erwägung gezogen wird, unabhängig von der Indikation zur Operation nur nach einer detaillierten Bildgebung und sorgfältigen chirurgischen Planung erfolgen. Die okulären Komplikationen des MFS können häufig chirurgisch behandelt werden. Die Ectopia lentis kann behandelt werden, indem Kunstlinsen operativ implantiert werden. Darüber hinaus können Glaukom und Katarakt operativ behandelt werden. ⓘ
Die Behandlung eines Spontanpneumothorax hängt von der Luftmenge im Pleuraraum und dem natürlichen Verlauf der Erkrankung des Betroffenen ab. Ein kleiner Pneumothorax kann sich ohne aktive Behandlung in ein bis zwei Wochen zurückbilden. Wiederkehrende Pneumothoraces erfordern möglicherweise eine Brustkorboperation. Bei mittelgroßen Pneumothoraces kann eine mehrtägige Drainagebehandlung im Krankenhaus erforderlich sein. Bei großen Pneumothoraces handelt es sich wahrscheinlich um medizinische Notfälle, die eine Notfalldekompression erfordern. ⓘ
Als Alternative werden auch maßgefertigte Stützen für die Aortenwurzel verwendet. Bis zum Jahr 2020 wurde dieses Verfahren bei über 300 Personen angewandt, wobei der erste Fall im Jahr 2004 auftrat. ⓘ
Schwangerschaft
Während der Schwangerschaft besteht für Frauen mit Marfan-Syndrom ein erhebliches Risiko, eine Aortendissektion zu erleiden, die selbst bei rascher Behandlung oft tödlich verläuft, selbst wenn vor der Geburt keine kardiovaskulären Anomalien vorliegen. Frauen mit Marfan-Syndrom sollten daher vor der Empfängnis gründlich untersucht werden, und während der Schwangerschaft sollte alle sechs bis zehn Wochen eine Echokardiographie durchgeführt werden, um den Durchmesser der Aortenwurzel zu bestimmen. Bei den meisten Frauen ist eine sichere vaginale Entbindung möglich. ⓘ
Bei Frauen mit Marfan-Syndrom können pränatale Tests durchgeführt werden, um festzustellen, ob die Erkrankung an ihr Kind vererbt wurde. In der 10. bis 12. Schwangerschaftswoche kann ein Stück Plazentagewebe mit einem Test namens Chorionzottenbiopsie untersucht werden, um eine Diagnose zu stellen. Ein weiterer pränataler Test kann in der 16. bis 18. Schwangerschaftswoche durchgeführt werden, die so genannte Amniozentese. ⓘ
Das Marfan-Syndrom wird dominant vererbt. Das bedeutet, dass ein Kind, bei dem ein Elternteil Träger des Gens ist, mit einer Wahrscheinlichkeit von 50 % an dem Syndrom erkrankt. Im Jahr 1996 wurde die erste genetische Präimplantationstestung (PGT) für Marfan durchgeführt; im Wesentlichen bedeutet PGT die Durchführung eines Gentests an Embryozellen im frühen IVF-Stadium und die Aussonderung der von der Marfan-Mutation betroffenen Embryonen. ⓘ
Prognose
Bevor es moderne kardiovaskuläre Operationstechniken und Medikamente wie Losartan und Metoprolol gab, war die Prognose von Menschen mit Marfan-Syndrom nicht gut: Eine Reihe von unbehandelbaren kardiovaskulären Problemen war häufig. Die Lebenserwartung verkürzte sich um mindestens ein Drittel, und viele starben bereits in ihren Teenager- und Zwanzigerjahren an den Folgen der Herz-Kreislaufprobleme. Heute sind die kardiovaskulären Symptome des Marfan-Syndroms immer noch das größte Problem bei der Diagnose und Behandlung der Krankheit, aber eine angemessene prophylaktische Überwachung und eine prophylaktische Therapie ermöglichen eine annähernd normale Lebenserwartung, und es werden immer mehr Erscheinungsformen der Krankheit entdeckt, da immer mehr Patienten länger leben. Frauen mit Marfan-Syndrom leben länger als Männer. ⓘ
Epidemiologie
Das Marfan-Syndrom betrifft Männer und Frauen gleichermaßen, und die Mutation weist keine ethnischen oder geografischen Unterschiede auf. Schätzungen zufolge ist etwa 1 von 5.000 bis 10.000 Personen vom Marfan-Syndrom betroffen. ⓘ
Erstbeschreibung

Das Syndrom wurde erstmals unter wissenschaftlichen Gesichtspunkten 1896 von dem französischen Kinderarzt Antoine Marfan (1858–1942) beschrieben. Er präsentierte vor der Société Médicale des Hôpitaux de Paris den Fall des fünfjährigen Mädchens Gabrielle, das sehr lange und feine Gliedmaßen aufwies, was er als Dolichostenomelie bezeichnete (griech. „dolicho“ = lang, „stenos“ = schmal, „melos“ = Gliedmaße). Er prägte für die schmalen langen Finger auch den Begriff der Spinnenfingrigkeit (Arachnodaktylie). ⓘ
Sechs Jahre später wurde das Mädchen von den Ärzten Méry und Babonneix untersucht, denen nun auch schon die Röntgen-Diagnostik zur Verfügung stand. Sie beschrieben eine Verkrümmung der Brustwirbelsäule und eine Asymmetrie des Thorax (Brustkorbes). Ebenfalls 1902 beschrieb Emile Charles Achard ein weiteres Mädchen mit ähnlichen Symptomen und stellte auch eine ausgeprägte Überbeweglichkeit seiner Gelenke (Hyperlaxizität) fest. ⓘ
Später wurden dem Symptomkomplex noch Veränderungen des Herz-Kreislauf-Systems und der Augen zugeordnet. In den 1930er Jahren erkannte man, dass die Besonderheit nicht geschlechtsgebunden (gonosomal) vererbt wird, sondern dass Veränderungen auf dem Chromosom 15 ursächlich sind (autosomal-dominanter Erbgang). Erstmals wurden diese Veränderungen 1931 von Utrechter Ärzten als Marfan-Syndrom beschrieben, als das es dann in die medizinische Literatur einging. ⓘ
Das französische Mädchen von Marfans Erstbeschreibung starb allerdings bereits im Jugendalter an Tuberkulose, so dass die Diagnose nie zweifelsfrei bestätigt werden konnte. Hingegen wurde mehrfach angezweifelt, dass Gabrielle an einem Marfan-Syndrom litt, so zuletzt 1972 von Hecht und Beals, die eine kongenitale Arachnodaktylie vermuteten. ⓘ
Die Annahme, dass Niccolò Paganini und Abraham Lincoln vom Marfan-Syndrom betroffen gewesen seien, ist umstritten. ⓘ
Das Marfan-Syndrom ist nach dem französischen Kinderarzt Antoine Marfan benannt, der die Krankheit 1896 erstmals beschrieb, nachdem er auffällige Merkmale bei einem fünfjährigen Mädchen festgestellt hatte. Das mit der Krankheit in Verbindung stehende Gen wurde erstmals 1991 von Francesco Ramirez am Mount Sinai Medical Center in New York City identifiziert. ⓘ
Berühmte Patienten
Berühmte Menschen, die am Marfan-Syndrom erkrankt sind, sind unter anderem:
- Isaiah Austin
- Javier Botet
- Austin Carlile
- Bradford Cox
- Euell Gibbons
- Flo Hyman
- Jonathan Jeanne
- Vincent Schiavelli
- Troye Sivan
- John Tavener ⓘ
Darüber hinaus tauchen die folgenden historischen Persönlichkeiten und Berühmtheiten häufig auf Listen von Menschen mit Marfan-Syndrom auf, aber von Fall zu Fall sind die Beweise spekulativ, fragwürdig oder sogar widerlegt.
- Echnaton (Künstlerische Darstellungen zeigen viele körperliche Merkmale von Menschen mit Marfan-Syndrom, z. B. einen verlängerten Schädel und ein größeres Becken mit vergrößerten Oberschenkeln und spindeldürren Waden. Die meisten Ägyptologen sind seit 2021 der Meinung, dass Echnatons Darstellungen nicht das Ergebnis einer genetischen oder medizinischen Erkrankung sind, sondern eher als stilisierte, vom Atenismus beeinflusste Darstellungen interpretiert werden sollten).
- Osama bin Laden (Marfan-Gerüchte werden von Journalisten als "wahrscheinlich falsch" eingestuft)
- Julius Caesar (spekulativ)
- Robert Johnson (spekulativ)
- Jonathan Larson (spekulativ)
- Abraham Lincoln (umstrittene spekulative Diagnose - Lincolns DNA wurde nicht getestet)
- Niccolò Paganini (spekulativ)
- Michael Phelps (von Phelps bestritten)
- Sergei Rachmaninoff (umstritten: "Rachmaninow wies keine der anderen für das Marfan-Syndrom typischen klinischen Merkmale auf. . . Er zeigte auch keine der klinischen Auswirkungen eines Marfan-bezogenen Syndroms")
- Jack Sullivan (spekulativ)
- Tutenchamun (litt nicht am Marfan-Syndrom) ⓘ
Auftrittshäufigkeit
Die Krankheit tritt mit einer Häufigkeit von etwa 1:5.000 bis 1:10.000 auf, wobei sechs bis sieben von zehn Fällen familiär bedingt sind. Der Anteil der Neumutationen beträgt 25 bis 40 %. Da die Definition „Marfan-Syndrom“ derzeit nach Hilfskriterien erfolgt und es mehrere verwechselbare „Parallelkrankheiten“ gibt, sollte besser vom Marfan-Phänotyp gesprochen werden. Dafür insgesamt ist die Häufigkeit etwa 1:6.000. Die Gruppe der Krankheiten des Marfan-Phänotyps wird neuerdings „Fibrillopathien“ genannt. ⓘ
Merkmale
Beim Marfan-Syndrom handelt es sich um einen angeborenen krankhaften Zustand des Bindegewebes, bei dem unter anderem Knochen, Muskeln, Bänder und der Skelettbau betroffen sein können. Meist sind die Betroffenen überdurchschnittlich groß, haben verlängerte Gliedmaßen sowie schmale Hände und Füße. Besteht eine Bindegewebsschwäche der Hauptschlagader, kann diese unerwartet reißen. ⓘ
Feingeweblich manifestiert sich das Marfan-Syndrom in der Feinstruktur des Bindegewebes (der Mikrofibrillen). Das Bindegewebe ist also fehlerhaft aufgebaut, das führt zu einer mehr oder weniger ausgeprägten Instabilität aller Bindegewebe des Körpers. ⓘ
Folgende Symptome kommen häufig bei Menschen mit Marfan-Syndrom vor, wobei nicht alle Merkmale bei allen Menschen in gleich starker Ausprägung vorliegen:
- Herz- und Gefäßsystem
- Herzklappenfehler (Schlussunfähigkeit der Aorten- oder Mitralklappe – Aneurysma der Aortenwurzel, bikuspide Aortenklappe)
- Aortendissektion (Aufspaltung oder Zerreißung der Aortenwand)
- Augen
- Lockerung des Halteapparates der Linsen (Linsenluxation)
- Kurzsichtigkeit
- Glaukom (Grüner Star = hoher Augeninnendruck)
- Katarakt (Grauer Star = Linsentrübung)
- Keratokonus (Erkrankung der Augenhornhaut)
- Netzhautablösung: Hierdurch kommt es zu dem Symptom der Lichtblitze (Differentialdiagnose)
- Blaue Skleren
- eventuell Iridodonesis (Irisschlottern bei Kopfbewegung)
- häufig Megalokornea
- Skelettsystem
- senkrechte Überentwicklung des Kopfes (Dolichocephalie/Langschädel)
- Hyperlaxizität (Überstreckbarkeit) der Gelenke
- hoher Gaumen (Gotischer Gaumen)
- Arachnodaktylie (Spinnenfingrigkeit); verschmälerte Finger (Madonnenfinger)
- Trichter- oder Kielbrust
- Hochwuchs
- Skoliose, bzw. Kyphoskoliose in etwa 50 % der Betroffenen
- schwach entwickelte Muskulatur (Muskelhypotrophie)
- Plattfüße
- samtartige Haut mit Neigung zu Striae (Dehnungsstreifen)
- Neigung zum Leistenbruch
- Neigung zu atlantoaxialer oder zervikookzipitaler Instabilität, dadurch unter anderem erhöhte Anfälligkeit für das Grisel-Syndrom
- zu tiefe Hüftpfannen (Coxa profunda), erhöhtes Risiko von Schmerzen infolge Impingement sowie von Koxarthrose
- Im Rückenmark finden sich gehäuft meningeale Zysten, sog. Tarlov-Zysten, außerdem sind sakrale Veränderungen, vor allem die sakrale Ektasie häufiger anzutreffen.
- Innere Organe
- Die Bindegewebsschwäche kann auch die Lunge angreifen, wodurch ein sogenannter Pneumothorax auftreten kann. ⓘ
Diagnose und Behandlung
Die Diagnostik und Behandlung sollte stets fachübergreifend (unter anderem durch Kinderkardiologen/Kardiologen, Orthopäden, Augenärzte) erfolgen gemäß der Genter Nosologie (systematische Beschreibung der Krankheiten). Mittels einer App ist es möglich, durch eine Fotoanalyse das Gesicht auf charakteristische Merkmale für das Marfan-Syndrom hin zu analysieren. ⓘ
Bislang existiert noch keine ursächlich heilende Therapie. ⓘ
Einen für die Zukunft denkbaren ursächlichen Therapieansatz zeigten die Ergebnisse einer im April 2006 im Wissenschaftsmagazin Science publizierten Studie, die in einem Mausmodell des Marfan-Syndroms das Zytokin TGF-β mit der typischen Entwicklung von Aortenaneurysmen und -dissektionen in Verbindung bringen konnten. Durch eine Behandlung mit dem als Blutdrucksenker bereits in der Humanmedizin verwandten AT1-Antagonisten Losartan konnten die Mäuse wirksam vor der Ausprägung dieser lebensgefährlichen Veränderungen der Gefäßwand geschützt werden, da Losartan die Wirkung des überaktiven TGF-β antagonisiert. Bereits bestehende Veränderungen am Herzen normalisierten sich zudem weitestgehend, solche in anderen Bereichen des Körpers zumindest teilweise. Eine Studie an über 600 jungen Patienten über die Jahre 2007 bis 2011 zeigt jedoch bezüglich der Vergrößerung der Aortenwurzel keinen signifikanten Unterschied in der Wirkung von Losartan gegenüber der (ohnehin schwachen) Wirkung von Betablockern. Im Tierexperiment konnten Statine die Wachstumsraten von Aortenaneurysmen reduzieren. Ebenfalls im Tierexperiment konnte bei der Marfan-Maus mittels des Wirkstoffs Resveratrol eine signifikante Reduktion des Aortenwurzeldiameters erreicht werden. ⓘ
Lebenserwartung
Die größte Bedeutung zur deutlichen Verlängerung der Lebenserwartung fällt in den Bereich der Kinderkardiologie/Kardiologie. Es gibt Hinweise darauf, dass die Geschwindigkeit der Entstehung einer Aortenerweiterung durch die Einnahme von Beta-Blockern vermindert werden kann. Wie weit eine frühe und prophylaktische Einnahme im Kindesalter eine Aortenerweiterung verhindert, ist noch unklar; erste Erfahrungen nach 14 Jahren Beta-Blocker-Therapie bei Kindern (2005), begonnen bei drei- bis vierjährigen betroffenen Kindern, zeigen aber, dass eine Progredienz der Erweiterung der Aortenwurzel in fast allen Fällen nicht eintritt und die Erweiterung unter der Medikation dann nur altersspezifisch erfolgt. ⓘ
Ist die Aortenwurzel bei Erwachsenen auf mehr als 55 mm erweitert, muss eine Operation erfolgen, um eine Aortendissektion oder -ruptur zu verhindern. Dies geschieht evtl. durch einen Aortenwurzelersatz mit künstlicher Herzklappe. Die postoperative Überlebensrate nach zehn Jahren beträgt zwischen 70 und 75 %. Bei Kindern leitet sich die Notwendigkeit einer Operation aus der Abweichung des aktuellen Aortendurchmessers vom altersbezogenen Normalwert ab, der individuell geprüft werden muss. Entscheidend ist, dass bei Kindern und Erwachsenen die Endokarditis-Prophylaxe besonders ernst genommen wird (selbst bei zahnärztlichen Eingriffen, kleinen Wunden, wundgelaufenen Füßen usw.), da eine Besiedlung/Vegetation an den besonders sensiblen Herzklappen und Klappenrändern ein Voranschreiten der Marfan-typischen Gewebeinstabilität auslösen kann. ⓘ
Bei schweren Verläufen können auch augenärztliche Eingriffe zum Erhalt oder Wiederherstellung der Sehfähigkeit erforderlich werden. Bei Überdehnung und zunehmendem Verlust (Einreißen) der Zonulafasern entsteht das so genannte „Linsenschlottern“. Schlotterlinsen müssen nicht operiert werden, nur das Verschieben der Linsen kann den Augendruck so stark werden lassen, dass die Entfernung der Linse notwendig wird. Es sind inzwischen neue OP-Techniken entwickelt worden, die unter Erhalt des Kapselsackes und Implantation einer Speziallinse bereits bei kleinen Kindern die Sehfähigkeit erhalten kann. ⓘ
Bei Verläufen mit schweren Wirbelsäulenverbiegungen sind Aufrichtungsoperationen wahrscheinlich. Es sind neue OP-Techniken entwickelt worden, die eine Aufrichtung der Wirbelsäule ohne Vollversteifung ermöglichen. ⓘ
In den 1970er Jahren ermittelte eine Studie die Lebenserwartung eines Menschen mit Marfan-Syndrom mit 30 bis 40 Jahren. Seit dieser Zeit wurden sowohl die Diagnostik als auch die medikamentöse und chirurgische Behandlung optimiert, so dass die Lebenserwartung sich annähernd der der Normalbevölkerung angeglichen hat. Trotzdem sterben noch immer viele der Betroffenen an einer Dissektion der thorakalen Aorta, weil die Diagnose nicht gestellt wurde und dementsprechend keine Therapie eingeleitet werden konnte. ⓘ
Mittlerweile haben sich spezielle Sprechstunden herausgebildet, an denen am Marfan-Syndrom Erkrankte interdisziplinär betreut werden. Die erste Marfan-Sprechstunde entstand 1997 am Universitätsklinikum Hamburg-Eppendorf. ⓘ
