Cannabinoide
| Teil einer Serie über ⓘ |
| Cannabis |
|---|
 |
Cannabinoide (/kəˈnæbənɔɪdzˌ ˈkænəbənɔɪdz/) sind in der Cannabispflanze enthaltene oder synthetische Verbindungen, die mit dem Endocannabinoid-System interagieren können. Das bekannteste Cannabinoid ist das Phytocannabinoid Tetrahydrocannabinol (THC) (Delta-9-THC), die wichtigste berauschende Verbindung in Cannabis. Cannabidiol (CBD) ist ein weiterer Hauptbestandteil einiger Cannabispflanzen. Mindestens 113 verschiedene Cannabinoide wurden aus Cannabis isoliert. Im Jahr 2020 wurde berichtet, dass Cannabinoide auch in anderen Pflanzen wie Rhododendron, Süßholz und Leberblümchen und früher auch in Echinacea vorkommen. ⓘ
Klassische Cannabinoide sind strukturell mit THC verwandt. ⓘ
Zu den nichtklassischen Cannabinoiden (Cannabimimetika) gehören Aminoalkylindole, 1,5-Diarylpyrazole, Chinoline und Arylsulfonamide sowie die mit den Endocannabinoiden verwandten Eicosanoide. ⓘ
Medizinisch werden Cannabinoide in verschiedenen Anwendungsgebieten eingesetzt, etwa bei neuropathischen Schmerzen und Spastiken (Zubereitungen aus Cannabisblüten), bei Appetitlosigkeit bei HIV/AIDS sowie Übelkeit und Erbrechen unter einer Chemotherapie (Nabilon, Dronabinol), sowie bei bestimmten kindlichen Epilepsieformen (Cannabidiol). ⓘ
Verwendungen
Zu den medizinischen Anwendungen gehören die Behandlung von Übelkeit aufgrund von Chemotherapie, Spastizität und möglicherweise neuropathischen Schmerzen. Zu den häufigen Nebenwirkungen gehören Schwindel, Sedierung, Verwirrung, Dissoziation und ein "Rauschgefühl". ⓘ
Cannabinoid-Rezeptoren
Vor den 1980er Jahren wurde spekuliert, dass Cannabinoide ihre physiologischen und verhaltensbezogenen Wirkungen durch unspezifische Interaktion mit Zellmembranen erzeugen, anstatt mit spezifischen membrangebundenen Rezeptoren zu interagieren. Die Entdeckung der ersten Cannabinoidrezeptoren in den 1980er Jahren trug dazu bei, diese Debatte zu klären. Diese Rezeptoren sind bei Tieren weit verbreitet. Zwei bekannte Cannabinoidrezeptoren werden als CB1 und CB2 bezeichnet, wobei es zunehmend Hinweise auf weitere gibt. Das menschliche Gehirn verfügt über mehr Cannabinoidrezeptoren als jeder andere G-Protein-gekoppelte Rezeptortyp (GPCR). ⓘ
Das Endocannabinoid-System (ECS) reguliert viele Funktionen des menschlichen Körpers. Das ECS spielt eine wichtige Rolle bei zahlreichen Aspekten der neuronalen Funktionen, unter anderem bei der Steuerung von Bewegung und motorischer Koordination, Lernen und Gedächtnis, Emotionen und Motivation, süchtigem Verhalten und Schmerzmodulation. ⓘ
Cannabinoid-Rezeptor Typ 1
CB1-Rezeptoren finden sich vor allem im Gehirn, genauer gesagt in den Basalganglien und im limbischen System, einschließlich des Hippocampus und des Striatums. Sie sind auch im Kleinhirn und in den männlichen und weiblichen Fortpflanzungsorganen zu finden. In der Medulla oblongata, dem Teil des Hirnstamms, der für die Atem- und Herz-Kreislauf-Funktionen zuständig ist, sind keine CB1-Rezeptoren vorhanden. CB1 findet sich auch im vorderen Auge und in der Netzhaut des Menschen. ⓘ
Cannabinoid-Rezeptor Typ 2
CB2-Rezeptoren sind vorwiegend im Immunsystem oder in vom Immunsystem abgeleiteten Zellen mit unterschiedlichen Expressionsmustern zu finden. Obwohl sie nur im peripheren Nervensystem zu finden sind, weist ein Bericht darauf hin, dass CB2 von einer Subpopulation von Mikroglia im menschlichen Kleinhirn exprimiert wird. CB2-Rezeptoren scheinen für immunmodulatorische und möglicherweise andere therapeutische Wirkungen von Cannabinoiden verantwortlich zu sein, wie sie in vitro und in Tiermodellen beobachtet wurden. ⓘ
Phytocannabinoide


Die klassischen Cannabinoide sind in einem zähflüssigen Harz konzentriert, das in Strukturen produziert wird, die als Drüsentrichome bekannt sind. Mindestens 113 verschiedene Cannabinoide wurden aus der Cannabispflanze isoliert. Auf der rechten Seite sind die wichtigsten Cannabinoid-Klassen von Cannabis dargestellt. ⓘ
Alle Klassen leiten sich von Verbindungen des Cannabigerol-Typs (CBG) ab und unterscheiden sich hauptsächlich in der Art und Weise, wie dieser Vorläufer zyklisiert wird. Die klassischen Cannabinoide werden von ihren jeweiligen 2-Carbonsäuren (2-COOH) durch Decarboxylierung (katalysiert durch Hitze, Licht oder alkalische Bedingungen) abgeleitet. ⓘ
Bekannte Cannabinoide
Zu den am besten untersuchten Cannabinoiden gehören Tetrahydrocannabinol (THC), Cannabidiol (CBD) und Cannabinol (CBN). ⓘ
Tetrahydrocannabinol
Tetrahydrocannabinol (THC) ist der wichtigste psychoaktive Bestandteil der Cannabispflanze. Delta-9-Tetrahydrocannabinol (Δ9-THC, THC) und Delta-8-Tetrahydrocannabinol (Δ8-THC) induzieren durch intrazelluläre CB1-Aktivierung die Synthese von Anandamid und 2-Arachidonoylglycerol, die im Körper und im Gehirn natürlich produziert werden. Diese Cannabinoide erzeugen die mit Cannabis assoziierten Wirkungen durch Bindung an die CB1-Cannabinoidrezeptoren im Gehirn. ⓘ
Cannabidiol
Cannabidiol (CBD) hat eine leicht psychotrope Wirkung. Es gibt Hinweise darauf, dass die Substanz kognitiven Beeinträchtigungen im Zusammenhang mit dem Konsum von Cannabis entgegenwirkt. Cannabidiol hat eine geringe Affinität für CB1- und CB2-Rezeptoren, wirkt aber als indirekter Antagonist von Cannabinoid-Agonisten. Es erwies sich als Antagonist des mutmaßlichen neuen Cannabinoidrezeptors GPR55, eines GPCR, der im Nucleus caudatus und im Putamen exprimiert wird. Cannabidiol hat sich auch als Agonist des 5-HT1A-Rezeptors erwiesen. CBD kann die Aufnahme von Adenosin beeinträchtigen, das eine wichtige Rolle bei biochemischen Prozessen wie der Energieübertragung spielt. Es kann eine Rolle bei der Förderung des Schlafs und der Unterdrückung der Erregung spielen. ⓘ
CBD hat eine gemeinsame Vorstufe mit THC und ist das wichtigste Cannabinoid in CBD-dominanten Cannabissorten. CBD spielt nachweislich eine Rolle bei der Verhinderung des mit THC verbundenen Verlusts des Kurzzeitgedächtnisses. ⓘ
Es gibt erste Hinweise darauf, dass CBD eine antipsychotische Wirkung hat, aber die Forschung in diesem Bereich ist begrenzt. ⓘ
Biosynthese
Die Cannabinoidproduktion beginnt, wenn ein Enzym Geranylpyrophosphat und Olivetolsäure miteinander verbindet und CBGA bildet. Anschließend wird CBGA unabhängig voneinander von vier separaten, FAD-abhängigen Dehydrogenase-Enzymen entweder in CBG, THCA, CBDA oder CBCA umgewandelt. Es gibt keine Hinweise auf eine enzymatische Umwandlung von CBDA oder CBD in THCA oder THC. Für die Propylhomologe (THCVA, CBDVA und CBCVA) gibt es einen analogen Weg, der auf CBGVA aus Divarinolsäure anstelle von Olivetolsäure beruht. ⓘ
Position der Doppelbindung
Darüber hinaus kann jede der oben genannten Verbindungen je nach der Position der Doppelbindung im alicyclischen Kohlenstoffring in verschiedenen Formen vorliegen. Dies kann zu Verwechslungen führen, da es verschiedene Nummerierungssysteme gibt, um die Position dieser Doppelbindung zu beschreiben. Nach dem heute weit verbreiteten Dibenzopyran-Nummerierungssystem wird die Hauptform von THC als Δ9-THC bezeichnet, während die Nebenform als Δ8-THC bezeichnet wird. Nach dem alternativen Terpen-Nummerierungssystem werden die gleichen Verbindungen als Δ1-THC bzw. Δ6-THC bezeichnet. ⓘ
Länge
Die meisten klassischen Cannabinoide sind 21-Kohlenstoff-Verbindungen. Einige weichen jedoch von dieser Regel ab, vor allem wegen der unterschiedlichen Länge der an den aromatischen Ring gebundenen Seitenkette. Bei THC, CBD und CBN ist diese Seitenkette eine Pentylkette (mit 5 Kohlenstoffatomen). Beim häufigsten Homologen ist die Pentylkette durch eine Propylkette (mit 3 Kohlenstoffatomen) ersetzt. Cannabinoide mit der Propyl-Seitenkette werden mit dem Suffix varin benannt und als THCV, CBDV oder CBNV bezeichnet, während diejenigen mit der Heptyl-Seitenkette mit dem Suffix phorol benannt und als THCP und CBDP bezeichnet werden. ⓘ
Cannabinoide in anderen Pflanzen
Es ist bekannt, dass Phytocannabinoide neben Cannabis auch in anderen Pflanzenarten vorkommen. Dazu gehören Echinacea purpurea, Echinacea angustifolia, Acmella oleracea, Helichrysum umbraculigerum und Radula marginata. Die bekanntesten Cannabinoide, die nicht von Cannabis stammen, sind die lipophilen Alkamide (Alkylamide) aus Echinacea-Arten, insbesondere die cis/trans-Isomere Dodeca-2E,4E,8Z,10E/Z-Tetraensäure-Isobutylamid. Es wurden mindestens 25 verschiedene Alkylamide identifiziert, von denen einige eine Affinität zum CB2-Rezeptor aufweisen. Bei einigen Echinacea-Arten sind Cannabinoide in der gesamten Pflanzenstruktur zu finden, am stärksten konzentriert sind sie jedoch in den Wurzeln und Blüten. Das in der Kava-Pflanze enthaltene Yangonin hat eine hohe Affinität zum CB1-Rezeptor. Die Katechine des Tees (Camellia sinensis) haben eine Affinität zu den menschlichen Cannabinoidrezeptoren. Ein weit verbreitetes Nahrungs-Terpen, Beta-Caryophyllen, ein Bestandteil des ätherischen Öls von Cannabis und anderen Heilpflanzen, wurde ebenfalls als selektiver Agonist von peripheren CB2-Rezeptoren in vivo identifiziert. Schwarze Trüffel enthalten Anandamid. Perrottetinen, ein mäßig psychoaktives Cannabinoid, wurde aus verschiedenen Radula-Sorten isoliert. ⓘ
Die meisten Phytocannabinoide sind nahezu unlöslich in Wasser, aber löslich in Lipiden, Alkoholen und anderen unpolaren organischen Lösungsmitteln. ⓘ
Profil der Cannabispflanze
Cannabispflanzen können große Unterschiede in der Menge und Art der von ihnen produzierten Cannabinoide aufweisen. Die Mischung der von einer Pflanze produzierten Cannabinoide wird als Cannabinoidprofil der Pflanze bezeichnet. Selektive Züchtung wurde eingesetzt, um die Genetik der Pflanzen zu kontrollieren und das Cannabinoidprofil zu verändern. So werden beispielsweise Sorten, die als Fasern verwendet werden (gemeinhin als Hanf bezeichnet), so gezüchtet, dass sie wenig psychoaktive Chemikalien wie THC enthalten. Sorten, die in der Medizin verwendet werden, werden häufig auf einen hohen CBD-Gehalt gezüchtet, und Sorten, die für Freizeitzwecke verwendet werden, werden in der Regel auf einen hohen THC-Gehalt oder auf ein bestimmtes chemisches Gleichgewicht gezüchtet. ⓘ
Die quantitative Analyse des Cannabinoidprofils einer Pflanze wird häufig durch Gaschromatographie (GC) oder - noch zuverlässiger - durch Gaschromatographie in Kombination mit Massenspektrometrie (GC/MS) bestimmt. Auch flüssigchromatographische (LC) Verfahren sind möglich und können im Gegensatz zu GC-Methoden zwischen den sauren und neutralen Formen der Cannabinoide unterscheiden. Es wurden systematische Versuche unternommen, das Cannabinoidprofil von Cannabis im Laufe der Zeit zu überwachen, aber ihre Genauigkeit wird durch den illegalen Status der Pflanze in vielen Ländern beeinträchtigt. ⓘ
Pharmakologie
Cannabinoide können durch Rauchen, Verdampfen, orale Einnahme, transdermale Pflaster, intravenöse Injektionen, sublinguale Aufnahme oder rektale Zäpfchen verabreicht werden. Nach der Aufnahme in den Körper werden die meisten Cannabinoide in der Leber verstoffwechselt, insbesondere durch Cytochrom-P450-Mischfunktionsoxidasen, hauptsächlich CYP 2C9. Eine Supplementierung mit CYP 2C9-Hemmern führt daher zu einer verlängerten Rauschwirkung. ⓘ
Ein Teil wird nicht nur in der Leber verstoffwechselt, sondern auch in Fett gespeichert. Δ9-THC wird zu 11-Hydroxy-Δ9-THC verstoffwechselt, das wiederum zu 9-Carboxy-THC metabolisiert wird. Einige Cannabis-Metaboliten können noch mehrere Wochen nach der Einnahme im Körper nachgewiesen werden. Diese Metaboliten sind die Chemikalien, die von den üblichen antikörperbasierten "Drogentests" erkannt werden; im Falle von THC oder anderen Stoffen stellen diese Belastungen keine Intoxikation dar (vergleichbar mit Ethanol-Atemtests, die den sofortigen Blutalkoholspiegel messen), sondern eine Integration des vergangenen Konsums über einen Zeitraum von etwa einem Monat hinweg. Der Grund dafür ist, dass es sich um fettlösliche, lipophile Moleküle handelt, die sich im Fettgewebe anreichern. ⓘ
Die Forschung zeigt, dass die Wirkung von Cannabinoiden durch aromatische Verbindungen, die von der Cannabispflanze produziert werden, so genannte Terpene, moduliert werden könnte. Diese Wechselwirkung würde zu dem Entourage-Effekt führen. ⓘ
Pharmazeutika auf Cannabinoidbasis
Nabiximols (Markenname Sativex) ist ein aerosolierter Nebel zur oralen Verabreichung, der ein Verhältnis von CBD und THC von nahezu 1:1 enthält. Außerdem sind kleinere Cannabinoide und Terpenoide, Ethanol und Propylenglykol als Hilfsstoffe und Pfefferminzaroma enthalten. Das von GW Pharmaceuticals hergestellte Medikament wurde erstmals 2005 von den kanadischen Behörden zur Linderung von Schmerzen im Zusammenhang mit Multipler Sklerose zugelassen und war damit das erste Medikament auf Cannabisbasis. In Kanada wird es von Bayer vermarktet. Sativex wurde in 25 Ländern zugelassen; in den Vereinigten Staaten laufen klinische Studien, um die FDA-Zulassung zu erhalten. Im Jahr 2007 wurde es für die Behandlung von Krebsschmerzen zugelassen. In Phase-III-Studien waren die häufigsten unerwünschten Wirkungen Schwindel, Schläfrigkeit und Desorientierung; 12 % der Probanden brachen die Einnahme des Medikaments aufgrund dieser Nebenwirkungen ab. ⓘ
Dronabinol (Markenname Marinol) ist ein THC-Medikament zur Behandlung von Appetitlosigkeit, Übelkeit und Schlafapnoe. Es ist von der FDA für die Behandlung von HIV/AIDS-induzierter Anorexie und durch Chemotherapie ausgelöster Übelkeit und Erbrechen zugelassen. ⓘ
Das CBD-Medikament Epidiolex wurde von der Food and Drug Administration für die Behandlung von zwei seltenen und schweren Formen der Epilepsie, dem Dravet- und dem Lennox-Gastaut-Syndrom, zugelassen. ⓘ
Abtrennung
Cannabinoide können durch Extraktion mit organischen Lösungsmitteln von der Pflanze getrennt werden. Häufig werden Kohlenwasserstoffe und Alkohole als Lösungsmittel verwendet. Diese Lösungsmittel sind jedoch entflammbar und viele sind giftig. Es kann auch Butan verwendet werden, das extrem schnell verdampft. Die überkritische Lösungsmittelextraktion mit Kohlendioxid ist eine alternative Technik. Nach der Extraktion können die isolierten Bestandteile durch Vakuumdestillation mit Wischfolie oder andere Destillationsverfahren abgetrennt werden. Auch Techniken wie SPE oder SPME sind für die Extraktion dieser Verbindungen nützlich. ⓘ
Geschichte
Die erste Entdeckung eines einzelnen Cannabinoids erfolgte, als der britische Chemiker Robert S. Cahn die Teilstruktur von Cannabinol (CBN) meldete, die er später im Jahr 1940 als vollständig ausgebildet identifizierte. ⓘ
Zwei Jahre später, im Jahr 1942, schrieb der amerikanische Chemiker Roger Adams Geschichte, als er Cannabidiol (CBD) entdeckte. Ausgehend von Adams' Forschungen identifizierte der israelische Professor Raphael Mechoulam 1963 die Stereochemie von CBD. Im folgenden Jahr, 1964, identifizierten Mechoulam und sein Team die Stereochemie von Tetrahydrocannabinol (THC). ⓘ
Aufgrund der molekularen Ähnlichkeit und der einfachen synthetischen Umwandlung glaubte man ursprünglich, dass CBD ein natürlicher Vorläufer von THC sei. Inzwischen weiß man jedoch, dass CBD und THC in der Cannabispflanze unabhängig voneinander aus dem Vorläufer CBG hergestellt werden. ⓘ
Phytocannabinoide der Hanfpflanze als tabellarische Übersicht
| Phytocannabinoide der Hanfpflanze ⓘ | ||||
|---|---|---|---|---|
| Cannabigerol-artige (CBG) | ||||

Cannabigerol |

Cannabigerol Monomethylether |
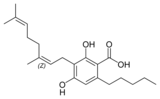
Cannabinerolsäure A |

Cannabigerovarin |
|
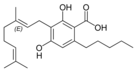
Cannabigerolsäure A |

Cannabigerolsäure A Monomethylether |

Cannabigerovarinsäure A |
||
| Cannabichromen-artige (CBC) | ||||

(±)-Cannabichromen |
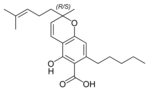
(±)-Cannabichromensäure A |
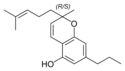
(±)-Cannabivarichromen, (±)-Cannabichromevarin |

(±)-Cannabichromevarinsäure A |
|
| Cannabidiol-artige (CBD) | ||||
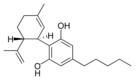
(−)-Cannabidiol |

Cannabidiol Monomethylether |
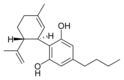
Cannabidiol-C4 |
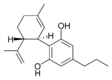
(−)-Cannabidivarin |

Cannabidiorcol |
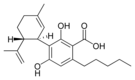
Cannabidiolsäure |

Cannabidivarinsäure |
|||
| Cannabinodiol-artige (CBND) | ||||

Cannabinodiol |
Cannabinodivarin |
|||
| Tetrahydrocannabinol-artige (THC) | ||||
Δ9-Tetrahydrocannabinol |

Δ9-Tetrahydrocannabinol-C4 |

Δ9-Tetrahydrocannabivarin |

Δ9-Tetrahydrocannabiorcol | |

Δ9-Tetrahydro- |
Δ9-Tetrahydro- |

Δ9-Tetrahydro- |
Δ9-Tetrahydro- |

Δ9-Tetrahydro- |

(−)-Δ8-trans-(6aR,10aR)- |

(−)-Δ8-trans-(6aR,10aR)- |

(−)-(6aS,10aR)-Δ9- |
||
| Cannabinol-artige (CBN) | ||||
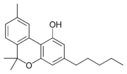
Cannabinol |

Cannabinol-C4 |

Cannabivarin |
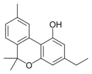
Cannabinol-C2 |

Cannabiorcol |
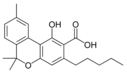
Cannabinolsäure A |
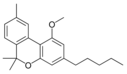
Cannabinolmethylether |
|||
| Cannabitriol-artige (CBT) | ||||
(−)-(9R,10R)-trans- |
(+)-(9S,10S)-Cannabitriol |

(±)-(9R,10S/9S,10R)- |

(−)-(9R,10R)-trans- |

(±)-(9R,10R/9S,10S)- |
8,9-Dihydroxy-Δ6a(10a)- |

Cannabidiolsäure A |

(−)-(6aR,9S,10S,10aR)- |

(−)-6a,7,10a-Trihydroxy- |
10-Oxo-Δ6a(10a)- |
| Cannabielsoin-artige (CBE) | ||||
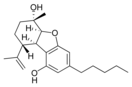
(5aS,6S,9R,9aR)- |
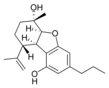
(5aS,6S,9R,9aR)- |
|||

(5aS,6S,9R,9aR)- |

(5aS,6S,9R,9aR)- |

(5aS,6S,9R,9aR)- |
||

Cannabiglendol-C3 |

Dehydrocannabifuran |

Cannabifuran |
||
| Isocannabinoide | ||||

(−)-Δ7-trans-(1R,3R,6R)- |
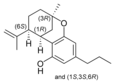
(±)-Δ7-1,2-cis- |
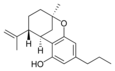
(−)-Δ7-trans-(1R,3R,6R)- |
||
| Cannabicyclol-artige (CBL) | ||||

(±)-(1aS,3aR,8bR,8cR)- |

(±)-(1aS,3aR,8bR,8cR)- |
(±)-(1aS,3aR,8bR,8cR)- |
||
| Cannabicitran-artige (CBT) | ||||
Cannabicitran |
||||
| Cannabichromanon-artige (CBCN) | ||||

Cannabichromanon |

Cannabichromanon-C3 |

Cannabicoumaronon |
||
Endocannabinoide

Endocannabinoide sind körpereigene Substanzen, die Cannabinoidrezeptoren aktivieren. Nach der Entdeckung des ersten Cannabinoidrezeptors im Jahr 1988 begannen Wissenschaftler mit der Suche nach einem endogenen Liganden für den Rezeptor. ⓘ
Anandamid, 2-Arachidonylglycerol, O-Arachidonylethanolamid, N-Arachidonoyldopamin, γ-Linolenoylethanolamid, Docosatetraenoylethanolamid und 2-Arachidonylglycerylether sind körpereigene Cannabinoide (Endocannabinoide), die als Neurotransmitter am Endocannabinoid-System wirken. ⓘ
Arten von Endocannabinoid-Liganden
Arachidonoylethanolamin (Anandamid oder AEA)
Anandamid war die erste Verbindung dieser Art, die als Arachidonoyl-Ethanolamin identifiziert wurde. Der Name leitet sich von dem Sanskrit-Wort für Glückseligkeit und -amid ab. Es hat eine ähnliche Pharmakologie wie THC, obwohl seine Struktur ganz anders ist. Anandamid bindet an die zentralen (CB1) und, in geringerem Maße, an die peripheren (CB2) Cannabinoidrezeptoren, wo es als partieller Agonist wirkt. Anandamid ist am CB1-Rezeptor etwa so stark wie THC. Anandamid findet sich in fast allen Geweben einer Vielzahl von Tieren. Anandamid wurde auch in Pflanzen gefunden, unter anderem in geringen Mengen in Schokolade. ⓘ
Zwei Analoga von Anandamid, 7,10,13,16-Docosatetraenoylethanolamid und Homo-γ-linolenoylethanolamin, haben eine ähnliche Pharmakologie. Alle diese Verbindungen gehören zu einer Familie von Signallipiden, den so genannten N-Acylethanolaminen, zu denen auch die nichtcannabimimetischen Palmitoylethanolamid und Oleoylethanolamid gehören, die entzündungshemmende bzw. magersüchtige Wirkungen haben. Zahlreiche N-Acylethanolamine wurden auch in Pflanzensamen und in Weichtieren nachgewiesen. ⓘ
2-Arachidonoylglycerin (2-AG)
Ein weiteres Endocannabinoid, 2-Arachidonoylglycerin, bindet mit ähnlicher Affinität sowohl an den CB1- als auch an den CB2-Rezeptor und wirkt an beiden als vollständiger Agonist. 2-AG ist im Gehirn in wesentlich höheren Konzentrationen vorhanden als Anandamid, und es gibt eine Kontroverse darüber, ob 2-AG und nicht Anandamid hauptsächlich für die Endocannabinoid-Signalgebung in vivo verantwortlich ist. Eine In-vitro-Studie deutet darauf hin, dass 2-AG in der Lage ist, eine stärkere G-Protein-Aktivierung als Anandamid zu stimulieren, obwohl die physiologischen Auswirkungen dieser Erkenntnis noch nicht bekannt sind. ⓘ
2-Arachidonylglycerinether (Noladinether)
Im Jahr 2001 wurde ein drittes Endocannabinoid vom Ether-Typ, 2-Arachidonylglycerylether (Noladinether), aus dem Gehirn von Schweinen isoliert. Vor dieser Entdeckung war es als stabiles Analogon von 2-AG synthetisiert worden; in der Tat bleibt eine gewisse Kontroverse über seine Einstufung als Endocannabinoid bestehen, da eine andere Gruppe die Substanz nicht in "nennenswerten Mengen" in den Gehirnen verschiedener Säugetierarten nachweisen konnte. Es bindet an den CB1-Cannabinoidrezeptor (Ki = 21,2 nmol/L) und bewirkt bei Mäusen Sedierung, Hypothermie, Unbeweglichkeit des Darms und leichte Antinozizeption. Es bindet hauptsächlich an den CB1-Rezeptor und nur schwach an den CB2-Rezeptor. ⓘ
N-Arachidonoyl-Dopamin (NADA)
Das im Jahr 2000 entdeckte NADA bindet vorzugsweise an den CB1-Rezeptor. Wie Anandamid ist auch NADA ein Agonist für den Vanilloidrezeptor-Subtyp 1 (TRPV1), ein Mitglied der Familie der Vanilloidrezeptoren. ⓘ
Virodhamin (OAE)
Ein fünftes Endocannabinoid, Virodhamin, oder O-Arachidonoyl-Ethanolamin (OAE), wurde im Juni 2002 entdeckt. Obwohl es ein vollständiger Agonist an CB2 und ein partieller Agonist an CB1 ist, verhält es sich in vivo wie ein CB1-Antagonist. Bei Ratten wurde festgestellt, dass Virodhamin in vergleichbaren oder etwas niedrigeren Konzentrationen als Anandamid im Gehirn vorhanden ist, aber in der Peripherie 2- bis 9-fach höhere Konzentrationen aufweist. ⓘ
Lysophosphatidylinositol (LPI)
Lysophosphatidylinositol ist der endogene Ligand des neuartigen Endocannabinoid-Rezeptors GPR55, was es zu einem starken Anwärter auf den Titel des sechsten Endocannabinoids macht. ⓘ
Funktion
Endocannabinoide dienen als interzelluläre "Lipid-Botenstoffe", d. h. als Signalmoleküle, die von einer Zelle freigesetzt werden und die Cannabinoidrezeptoren in anderen, nahe gelegenen Zellen aktivieren. Obwohl sie in dieser interzellulären Signalfunktion den bekannten Monoamin-Neurotransmittern wie Dopamin ähneln, unterscheiden sich Endocannabinoide in vielerlei Hinsicht von ihnen. So werden sie beispielsweise bei der retrograden Signalübertragung zwischen Neuronen eingesetzt. Außerdem sind Endocannabinoide lipophile Moleküle, die in Wasser nicht sehr gut löslich sind. Sie werden nicht in Vesikeln gespeichert und sind integraler Bestandteil der Membran-Doppelschichten, aus denen die Zellen bestehen. Man geht davon aus, dass sie "auf Abruf" synthetisiert werden und nicht für eine spätere Verwendung hergestellt und gelagert werden. ⓘ
Da es sich um hydrophobe Moleküle handelt, können Endocannabinoide in dem wässrigen Medium, das die Zellen, aus denen sie freigesetzt werden, umgibt, nicht ohne fremde Hilfe weite Strecken zurücklegen und wirken daher lokal auf nahe gelegene Zielzellen. Obwohl sie diffus von ihren Ursprungszellen ausgehen, haben sie daher einen viel begrenzteren Einflussbereich als Hormone, die Zellen im ganzen Körper beeinflussen können. ⓘ
Die Mechanismen und Enzyme, die der Biosynthese der Endocannabinoide zugrunde liegen, sind nach wie vor schwer zu ergründen und werden weiterhin aktiv erforscht. ⓘ
Das Endocannabinoid 2-AG wurde in der Muttermilch von Rindern und Menschen nachgewiesen. ⓘ
Eine Übersichtsarbeit von Matties et al. (1994) fasst das Phänomen der Geschmacksverstärkung durch bestimmte Cannabinoide zusammen. Der Süßstoffrezeptor (Tlc1) wird stimuliert, indem seine Expression indirekt erhöht und die Aktivität von Leptin, dem Tlc1-Antagonisten, unterdrückt wird. Es wird vorgeschlagen, dass die Konkurrenz von Leptin und Cannabinoiden um Tlc1 an der Energiehomöostase beteiligt ist. ⓘ
Retrogrades Signal
Herkömmliche Neurotransmitter werden von einer präsynaptischen" Zelle freigesetzt und aktivieren die entsprechenden Rezeptoren auf einer postsynaptischen" Zelle, wobei präsynaptisch" und postsynaptisch" die Sender- bzw. Empfängerseite einer Synapse bezeichnen. Endocannabinoide hingegen werden als retrograde Transmitter bezeichnet, weil sie sich meist entgegen dem üblichen synaptischen Transmitterfluss "rückwärts" bewegen. Sie werden nämlich von der postsynaptischen Zelle freigesetzt und wirken auf die präsynaptische Zelle, wo die Zielrezeptoren dicht an den axonalen Endigungen in den Zonen konzentriert sind, aus denen die herkömmlichen Neurotransmitter freigesetzt werden. Die Aktivierung der Cannabinoidrezeptoren verringert vorübergehend die Menge der freigesetzten konventionellen Neurotransmitter. Dieses Endocannabinoid-vermittelte System ermöglicht es der postsynaptischen Zelle, ihren eigenen eingehenden synaptischen Verkehr zu kontrollieren. Die letztendliche Wirkung auf die Endocannabinoid-freisetzende Zelle hängt von der Art des zu kontrollierenden konventionellen Transmitters ab. Wird zum Beispiel die Freisetzung des hemmenden Transmitters GABA reduziert, so führt dies zu einer Erhöhung der Erregbarkeit der Endocannabinoid-freisetzenden Zelle. Umgekehrt führt eine verringerte Freisetzung des erregenden Neurotransmitters Glutamat zu einer Abnahme der Erregbarkeit der Endocannabinoid-freisetzenden Zelle. ⓘ
Das "Läuferhoch"
Das "Runner's High", das Gefühl der Euphorie, das manchmal mit aerobem Training einhergeht, wurde oft auf die Freisetzung von Endorphinen zurückgeführt, aber neuere Forschungen legen nahe, dass es stattdessen auf Endocannabinoide zurückzuführen sein könnte. ⓘ
Synthetische Cannabinoide
In der Vergangenheit basierte die Laborsynthese von Cannabinoiden häufig auf der Struktur pflanzlicher Cannabinoide, und es wurde eine große Anzahl von Analoga hergestellt und getestet, insbesondere von einer Gruppe um Roger Adams bereits 1941 und später von einer Gruppe um Raphael Mechoulam. Neuere Verbindungen sind nicht mehr mit den natürlichen Cannabinoiden verwandt oder basieren auf der Struktur der körpereigenen Cannabinoide. ⓘ
Synthetische Cannabinoide eignen sich besonders gut für Experimente zur Bestimmung des Zusammenhangs zwischen Struktur und Aktivität von Cannabinoidverbindungen, indem Cannabinoidmoleküle systematisch und schrittweise verändert werden. ⓘ
Wenn synthetische Cannabinoide in der Freizeit konsumiert werden, bergen sie erhebliche Gesundheitsgefahren für die Konsumenten. Im Zeitraum von 2012 bis 2014 wurden in den Vereinigten Staaten über 10.000 Kontakte zu Giftnotrufzentralen im Zusammenhang mit dem Konsum synthetischer Cannabinoide verzeichnet. ⓘ
Medikamente, die natürliche oder synthetische Cannabinoide oder Cannabinoid-Analoga enthalten:
- Dronabinol (Marinol), ein Δ9-Tetrahydrocannabinol (THC), das als Appetitanreger, Antiemetikum und Analgetikum verwendet wird
- Nabilon (Cesamet, Canemes), ein synthetisches Cannabinoid und ein Analogon von Marinol. Es steht in Liste II, im Gegensatz zu Marinol, das in Liste III steht.
- Rimonabant (SR141716), ein selektiver Cannabinoid (CB1)-Rezeptor-Umkehragonist, der früher unter dem Markennamen Acomplia als Mittel gegen Fettleibigkeit eingesetzt wurde. Es wurde auch zur Raucherentwöhnung eingesetzt. ⓘ
Weitere bekannte synthetische Cannabinoide sind:
- JWH-018, ein starker synthetischer Cannabinoid-Agonist, der von John W. Huffman an der Clemson University entdeckt wurde. Es wurde häufig in legalen Rauchmischungen verkauft, die unter dem Namen "Spice" bekannt sind. Mehrere Länder und Staaten haben ein gesetzliches Verbot beantragt.
- JWH-073
- CP-55940, hergestellt 1974, dieser synthetische Cannabinoid-Rezeptor-Agonist ist um ein Vielfaches stärker als THC.
- Dimethylheptylpyran
- HU-210, etwa 100-mal so stark wie THC
- HU-211, ein synthetisches, von Cannabinoiden abgeleitetes Medikament, das auf das NMDA- statt auf das Endocannabinoid-System wirkt
- HU-331, ein potenzielles Krebsmedikament, das von Cannabidiol abgeleitet ist und speziell die Topoisomerase II hemmt.
- SR144528, ein CB2-Rezeptor-Antagonist/ inverser Agonist
- WIN 55,212-2, ein starker Cannabinoidrezeptor-Agonist
- JWH-133, ein potenter selektiver CB2-Rezeptor-Agonist
- Levonantradol (Nantrodolum), ein Antiemetikum und Analgetikum, das jedoch derzeit nicht in der Medizin verwendet wird
- AM-2201, ein potenter Cannabinoidrezeptor-Agonist
Kürzlich wurde der Begriff "Neocannabinoid" eingeführt, um diese Designerdrogen von synthetischen Phytocannabinoiden (THC oder CBD, die durch chemische Synthese gewonnen werden) oder synthetischen Endocannabinoiden zu unterscheiden. ⓘ

Künstliche Cannabinoide können sowohl halbsynthetisch hergestellt werden, d. h. aus natürlichen Cannabinoiden, als auch vollsynthetisch aus einfachen Grundstoffen. Synthetische Cannabinoide werden medizinisch genutzt und dienen in der Neurowissenschaft dazu, die Cannabinoidwirkung im Gehirn zu verstehen. Anwendung finden sie auch in Kräutermischungen als legaler Cannabisersatz. Einige synthetische Cannabinoide sind z. B. ⓘ
Analytik der Cannabinoide
Zur zuverlässigen Analytik der Cannabinoide kann die Kopplung von HPLC und Massenspektrometrie (HPLC-MS) nach Extraktion des Probenmaterials eingesetzt werden. Zur sicheren Identifizierung und Quantifizierung von AM-694 und seinen Metaboliten in biologischem Material kann zur Probenvorbereitung die SPE mit anschließender GC-MS oder HPLC-MS eingesetzt werden. ⓘ
Rechtslage
- Deutschland
Einige Cannabinoide sind dem Betäubungsmittelgesetz unterstellt bzw. fallen unter das Gesetz zur Bekämpfung der Verbreitung neuer psychoaktiver Stoffe und sind daher nur eingeschränkt oder nur mittels Rezept als Arzneimittel erhältlich. ⓘ
- Schweiz
In der Schweiz muss für eine Therapie mit Dronabinol vom Arzt eine patientenspezifische Ausnahmebewilligung bei dem Bundesamt für Gesundheit (BAG) beantragt werden. Da Dronabinol keine Pflichtleistung der Krankenkassen ist, muss eine Kostenübernahme im Vorfeld und im Einzelfall abgeklärt werden; bei manchen Kassen braucht es dafür eine Zusatzversicherung. Bereits über 500 Patienten mit Amyotrophe Lateralsklerose, Angststörungen, Epilepsie, Morbus Crohn, Parkinson-Krankheit, Polyarthritis, Restless-Legs-Syndrom, Tourette-Syndrom oder Tumorschmerzen profitieren von der ärztlichen Verschreibung von Cannabidiol. Multiple-Sklerose-Betroffene können das rezeptpflichtige Medikament Sativex, das CBD und THC enthält, gegen Verkrampfungen einnehmen. Im Bundesamt für Gesundheit wird angenommen, dass etwa 100.000 Personen illegal Cannabisprodukte zur Selbstmedikation anwenden. ⓘ
Seit 2011 ist in der Schweiz Cannabisanbau mit einem THC-Gehalt bis zu 1 % zulässig, dies vor allem wegen der natürlichen Schwankungen in den Hanfpflanzen; zuvor lag der Grenzwert bei 0,3 %, der aber nicht regelmäßig eingehalten werden konnte. ⓘ
