Denguefieber
| Dengue-Fieber ⓘ | |
|---|---|
| Andere Namen | Dengue-Fieber, Breakbone-Fieber |
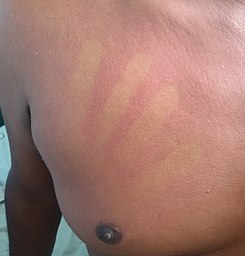
| Der typische Ausschlag bei Dengue-Fieber | |
| Aussprache |
|
| Fachgebiet | Infektiöse Krankheit |
| Symptome | Fieber, Kopfschmerzen, Muskel- und Gelenkschmerzen, Hautausschlag |
| Komplikationen | Blutungen, niedrige Blutplättchenzahl, gefährlich niedriger Blutdruck |
| Gewöhnlicher Ausbruch | 3-14 Tage nach der Exposition |
| Dauer | 2-7 Tage |
| Verursacht | Dengue-Virus durch Aedes-Mücken |
| Diagnostische Methode | Nachweis von Antikörpern gegen das Virus oder seine RNA |
| Differentialdiagnose | Malaria, Gelbfieber, virale Hepatitis, Leptospirose |
| Vorbeugung | Dengue-Fieber-Impfung, Verringerung der Mücken-Exposition |
| Behandlung | Unterstützende Behandlung, intravenöse Flüssigkeiten, Bluttransfusionen |
| Häufigkeit | 390 Millionen pro Jahr |
| Todesfälle | ~40,000 (2017) |
Dengue-Fieber ist eine durch Mücken übertragene Tropenkrankheit, die durch das Dengue-Virus verursacht wird. Die Symptome treten in der Regel drei bis vierzehn Tage nach der Infektion auf. Dazu gehören hohes Fieber, Kopfschmerzen, Erbrechen, Muskel- und Gelenkschmerzen sowie ein charakteristischer Juckreiz und Hautausschlag. Die Genesung dauert im Allgemeinen zwei bis sieben Tage. In einem kleinen Teil der Fälle entwickelt sich die Krankheit zu einem schwereren hämorrhagischen Dengue-Fieber, bei dem es zu Blutungen, niedrigen Blutplättchenwerten und Blutplasmaaustritt kommt, oder zu einem Dengue-Schocksyndrom, bei dem ein gefährlich niedriger Blutdruck auftritt. ⓘ
Dengue wird von mehreren Arten weiblicher Stechmücken der Gattung Aedes verbreitet, hauptsächlich von Aedes aegypti. Das Virus hat fünf Serotypen; die Infektion mit einem Typ verleiht in der Regel lebenslange Immunität gegen diesen Typ, aber nur kurzfristige Immunität gegen die anderen. Eine anschließende Infektion mit einem anderen Typ erhöht das Risiko schwerer Komplikationen. Zur Bestätigung der Diagnose stehen eine Reihe von Tests zur Verfügung, darunter der Nachweis von Antikörpern gegen das Virus oder seine RNA. ⓘ
Ein Impfstoff gegen Dengue-Fieber wurde zugelassen und ist in einer Reihe von Ländern im Handel erhältlich. Ab 2018 wird der Impfstoff nur noch bei Personen empfohlen, die bereits infiziert waren, oder in Bevölkerungsgruppen mit einer hohen Rate an Vorinfektionen im Alter von neun Jahren. Zu den weiteren Präventionsmethoden gehören die Verringerung des Lebensraums von Mücken und die Einschränkung der Exposition gegenüber Stichen. Dies kann geschehen, indem man stehendes Wasser beseitigt oder abdeckt und Kleidung trägt, die einen Großteil des Körpers bedeckt. Die Behandlung von akutem Dengue-Fieber ist unterstützend und umfasst bei leichter oder mittelschwerer Erkrankung die Verabreichung von Flüssigkeit entweder über den Mund oder intravenös. In schwereren Fällen kann eine Bluttransfusion erforderlich sein. Zur Fiebersenkung und Schmerzlinderung bei Dengue wird Paracetamol (Acetaminophen) anstelle von nichtsteroidalen Antirheumatika (NSAIDs) empfohlen, da bei der Einnahme von NSAIDs ein erhöhtes Blutungsrisiko besteht. ⓘ
Die frühesten Beschreibungen eines Ausbruchs stammen aus dem Jahr 1779. Die virale Ursache und die Ausbreitung waren zu Beginn des 20. Jahrhunderts bekannt. Seit dem Zweiten Weltkrieg hat sich Dengue zu einem globalen Problem entwickelt und ist in mehr als 120 Ländern verbreitet, hauptsächlich in Südostasien, Südasien und Südamerika. Jährlich infizieren sich rund 390 Millionen Menschen, etwa eine halbe Million muss ins Krankenhaus eingeliefert werden, und etwa 40 000 sterben. Im Jahr 2019 wurde ein deutlicher Anstieg der Zahl der Fälle festgestellt. Neben der Eliminierung der Moskitos wird an Medikamenten gearbeitet, die direkt gegen das Virus gerichtet sind. Es wird als vernachlässigte Tropenkrankheit eingestuft. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| A90 | Denguefieber [Klassische Dengue] |
| A91 | Hämorrhagisches Denguefieber |
| ICD-10 online (WHO-Version 2019) | |

Das Denguefieber [ˈdɛŋge-], auch Dandyfieber, Polkafieber, Knochenbrecherfieber, Siebentagefieber und kurz Dengue ist eine Krankheit, deren Ursache eine Infektion mit dem Dengue-Virus ist. Bei dem Virus handelt es sich um ein 40 bis 60 nm großes, behülltes RNA-Virus mit positiver Polarität aus der Familie der Flaviviren. ⓘ
Das Virus wird durch den Stich einer Stechmücke übertragen und ist in tropischen und subtropischen Gebieten verbreitet. Die einzigen bekannten Wirte des Virus sind Primaten und verschiedene Stechmückenarten. Es existieren vier verschiedene Serotypen (Untergruppen) des Virus, die innerhalb der letzten 2000 Jahre in Asien sehr wahrscheinlich unabhängig voneinander von nichtmenschlichen Primaten auf den Menschen übersprangen. Seit dem Zweiten Weltkrieg und der folgenden Globalisierung ist das Denguefieber unter anderem durch die Verbreitung seines Überträgers auf dem Vormarsch und wird oft auch als emerging disease (sich ausbreitende Krankheit) bezeichnet. Bei Denguefieber handelt es sich um die sich am schnellsten ausbreitende virale von Stechmücken übertragene Krankheit; die Fallzahlen haben sich von 1960 bis 2010 verdreißigfacht. ⓘ
Die Krankheit äußert sich häufig mit unspezifischen Symptomen oder solchen, die einer schweren Grippe ähneln; es kann aber auch zu inneren Blutungen kommen. Bei einem schweren Krankheitsverlauf können ein sogenanntes „Hämorrhagisches Denguefieber“ (DHF) oder ein Dengue-Schock-Syndrom (DSS) auftreten, die beide zum Tode führen können. Die WHO schätzt, dass jährlich 50 bis 100 Millionen Personen erkranken, 500.000 Personen einen schweren Krankheitsverlauf durchleiden und 22.000 Personen an Denguefieber sterben; die meisten der Todesopfer sind Kinder. Wissenschaftler aus Oxford und Heidelberg berichteten im April 2013 in der Zeitschrift Nature, dass sich tatsächlich aber laut ihren Untersuchungen jährlich rund 390 Millionen Menschen mit dem Erreger des Dengue-Fiebers infizierten. ⓘ
Lange gab es gegen die Erkrankung keine spezifische antivirale Behandlung. Ende 2015 wurde der erste Impfstoff „Dengvaxia“ von Sanofi zugelassen, der gegen alle vier Varianten des Virus wirksam sein und einen Impfschutz von 93 % bieten soll. Allerdings zeigten spätere Studien, dass diejenigen, die nie an Dengue-Fieber erkrankt waren und dann mit „Dengvaxia“ geimpft wurden, sich später dennoch infizieren und dann sogar stärkere Symptome entwickeln können als Personen, die nicht geimpft wurden. In Deutschland, Österreich und der Schweiz besteht eine Meldepflicht bei Verdacht, Erkrankung, Tod, direktem und indirektem Erregernachweis oder hämorrhagischem Krankheitsverlauf. ⓘ
Anzeichen und Symptome
Typischerweise sind mit dem Dengue-Virus infizierte Personen asymptomatisch (80 %) oder haben nur leichte Symptome wie unkompliziertes Fieber. Andere erkranken schwerer (5 %), und bei einem kleinen Teil ist die Krankheit lebensbedrohlich. Die Inkubationszeit (Zeit zwischen der Exposition und dem Auftreten von Symptomen) liegt zwischen 3 und 14 Tagen, meistens jedoch zwischen 4 und 7 Tagen. Daher ist es unwahrscheinlich, dass Reisende, die aus endemischen Gebieten zurückkehren, an Dengue-Fieber erkrankt sind, wenn die Symptome mehr als 14 Tage nach ihrer Ankunft in der Heimat auftreten. Bei Kindern treten häufig Symptome auf, die denen einer Erkältung und einer Gastroenteritis (Erbrechen und Durchfall) ähneln, und es besteht ein größeres Risiko für schwere Komplikationen, obwohl die ersten Symptome im Allgemeinen mild sind, aber hohes Fieber beinhalten. ⓘ
Klinischer Verlauf
Die charakteristischen Symptome des Denguefiebers sind plötzlich auftretendes Fieber, Kopfschmerzen (typischerweise hinter den Augen), Muskel- und Gelenkschmerzen sowie ein Hautausschlag. Ein alternativer Name für Dengue, "Knochenbrecherfieber", kommt von den damit verbundenen Muskel- und Gelenkschmerzen. Der Verlauf der Infektion wird in drei Phasen unterteilt: Fieber, kritische Phase und Genesung. ⓘ
Die fieberhafte Phase ist mit hohem Fieber, möglicherweise über 40 °C, verbunden und geht mit generalisierten Schmerzen und Kopfschmerzen einher; sie dauert in der Regel zwei bis sieben Tage. Auch Übelkeit und Erbrechen können auftreten. Ein Ausschlag tritt bei 50-80 % der Erkrankten am ersten oder zweiten Tag der Symptome in Form einer Hautrötung oder später im Krankheitsverlauf (Tage 4-7) in Form eines masernähnlichen Ausschlags auf. Es wurde auch ein Ausschlag beobachtet, der als "weiße Inseln in einem Meer von Rot" beschrieben wird. Einige Petechien (kleine rote Flecken, die nicht verschwinden, wenn man auf die Haut drückt, und die durch gebrochene Kapillaren verursacht werden) können zu diesem Zeitpunkt auftreten, ebenso wie einige leichte Blutungen aus den Schleimhäuten von Mund und Nase. Das Fieber selbst ist klassischerweise biphasisch oder sattelförmig, es bricht aus und kehrt dann für ein oder zwei Tage zurück. ⓘ
Bei manchen Menschen geht die Krankheit mit dem Abklingen des Fiebers in eine kritische Phase über. Während dieser Phase kommt es zu einem Austritt von Plasma aus den Blutgefäßen, der in der Regel ein bis zwei Tage andauert. Dies kann zu Flüssigkeitsansammlungen in der Brust- und Bauchhöhle sowie zu einem Flüssigkeitsverlust im Kreislauf und einer verminderten Blutzufuhr zu lebenswichtigen Organen führen. Es kann auch zu Organfunktionsstörungen und schweren Blutungen, typischerweise aus dem Magen-Darm-Trakt, kommen. Schock (Dengue-Schocksyndrom) und Blutungen (hämorrhagisches Dengue-Fieber) treten in weniger als 5 % aller Dengue-Fälle auf; ein erhöhtes Risiko besteht jedoch bei Personen, die sich zuvor mit anderen Serotypen des Dengue-Virus infiziert haben ("Sekundärinfektion"). Diese kritische Phase ist zwar selten, tritt aber relativ häufig bei Kindern und jungen Erwachsenen auf. ⓘ
Danach folgt die Erholungsphase, in der die ausgetretene Flüssigkeit wieder in den Blutkreislauf aufgenommen wird. Diese Phase dauert in der Regel zwei bis drei Tage. Die Besserung ist oft auffällig und kann mit starkem Juckreiz und einem langsamen Herzschlag einhergehen. Es kann ein weiterer Ausschlag auftreten, der entweder ein makulopapulöses oder ein vaskulitisches Aussehen hat, gefolgt von einer Schälung der Haut. In diesem Stadium kann es zu einer Flüssigkeitsüberlastung kommen, die, wenn sie das Gehirn betrifft, zu Bewusstseinsstörungen oder Krampfanfällen führen kann. Ein Gefühl der Müdigkeit kann bei Erwachsenen wochenlang anhalten. ⓘ
Assoziierte Probleme
Dengue-Fieber kann gelegentlich mehrere andere Körpersysteme beeinträchtigen, entweder isoliert oder zusammen mit den klassischen Dengue-Symptomen. In 0,5-6 % der schweren Fälle kommt es zu einer verminderten Bewusstseinslage, die entweder auf eine Entzündung des Gehirns durch das Virus oder indirekt auf eine Beeinträchtigung lebenswichtiger Organe, z. B. der Leber, zurückzuführen ist. ⓘ
Im Zusammenhang mit Dengue wurden auch andere neurologische Störungen wie transversale Myelitis und Guillain-Barré-Syndrom gemeldet. Eine Infektion des Herzens und akutes Leberversagen gehören zu den selteneren Komplikationen. ⓘ
Eine schwangere Frau, die an Dengue erkrankt, hat ein höheres Risiko für eine Fehlgeburt, ein niedriges Geburtsgewicht und eine Frühgeburt. ⓘ
Ursache
Virologie
Das Dengue-Fieber-Virus (DENV) ist ein RNA-Virus aus der Familie der Flaviviridae; Gattung Flavivirus. Andere Mitglieder derselben Gattung sind das Gelbfiebervirus, das West-Nil-Virus, das Zika-Virus, das St.-Louis-Enzephalitis-Virus, das Japanische Enzephalitis-Virus, das durch Zecken übertragene Enzephalitis-Virus, das Kyasanur-Waldkrankheits-Virus und das Virus des hämorrhagischen Fiebers von Omsk. Die meisten werden durch Arthropoden (Mücken oder Zecken) übertragen und werden daher auch als Arboviren (von Arthropoden übertragene Viren) bezeichnet. ⓘ
Das Genom (das genetische Material) des Dengue-Virus enthält etwa 11.000 Nukleotidbasen, die für die drei verschiedenen Arten von Proteinmolekülen (C, prM und E), die das Viruspartikel bilden, und sieben weitere nicht-strukturelle Proteinmoleküle (NS1, NS2a, NS2b, NS3, NS4a, NS4b, NS5) kodieren, die nur in infizierten Wirtszellen vorkommen und für die Replikation des Virus erforderlich sind. Es gibt fünf Stämme des Virus, die als Serotypen bezeichnet werden, von denen die ersten vier als DENV-1, DENV-2, DENV-3 und DENV-4 bezeichnet werden. Der fünfte Typ wurde im Jahr 2013 bekannt gegeben. Die Unterscheidung zwischen den Serotypen basiert auf ihrer Antigenität. ⓘ
Übertragung

Das Dengue-Virus wird hauptsächlich von Aedes-Mücken übertragen, insbesondere von A. aegypti. Diese Stechmücken leben in der Regel zwischen 35° nördlicher und 35° südlicher Breite in einer Höhe von weniger als 1.000 Metern. Sie stechen in der Regel am frühen Morgen und am Abend, können aber zu jeder Tageszeit stechen und so die Infektion verbreiten. Andere Aedes-Arten, die die Krankheit übertragen, sind A. albopictus, A. polynesiensis und A. scutellaris. Der Mensch ist der Hauptwirt für das Virus, aber es zirkuliert auch in nichtmenschlichen Primaten. Eine Infektion kann durch einen einzigen Stich erworben werden. Eine weibliche Stechmücke, die eine Blutmahlzeit von einer mit Dengue-Fieber infizierten Person zu sich nimmt, infiziert sich während der anfänglichen 2- bis 10-tägigen Fieberphase in den Zellen ihres Darms selbst mit dem Virus. Etwa 8-10 Tage später breitet sich das Virus auf andere Gewebe aus, darunter auch auf die Speicheldrüsen der Mücke, und wird dann in ihren Speichel abgegeben. Das Virus scheint keine schädlichen Auswirkungen auf die Stechmücke zu haben, die lebenslang infiziert bleibt. Aedes aegypti ist besonders betroffen, da sie ihre Eier bevorzugt in künstlichen Wasserbehältern ablegt, in unmittelbarer Nähe des Menschen lebt und sich eher von Menschen als von anderen Wirbeltieren ernährt. ⓘ
Dengue kann auch über infizierte Blutprodukte und durch Organspenden übertragen werden. In Ländern wie Singapur, wo Dengue endemisch ist, wird das Risiko auf 1,6 bis 6 pro 10 000 Transfusionen geschätzt. Es wurde über eine vertikale Übertragung (von der Mutter auf das Kind) während der Schwangerschaft oder bei der Geburt berichtet. Andere Formen der Übertragung von Mensch zu Mensch, einschließlich der sexuellen Übertragung, wurden ebenfalls berichtet, sind aber sehr ungewöhnlich. Die genetische Variation der Dengue-Viren ist regionalspezifisch, was darauf hindeutet, dass die Ausbreitung in neue Gebiete relativ selten ist, obwohl Dengue in den letzten Jahrzehnten in neuen Regionen aufgetreten ist. ⓘ
Prädisposition
Schwere Erkrankungen treten häufiger bei Säuglingen und Kleinkindern auf, und im Gegensatz zu vielen anderen Infektionen treten sie häufiger bei Kindern auf, die relativ gut ernährt sind. Weitere Risikofaktoren für eine schwere Erkrankung sind das weibliche Geschlecht, ein hoher Body-Mass-Index und die Viruslast. Während jeder Serotyp das gesamte Krankheitsspektrum verursachen kann, ist der Virusstamm ein Risikofaktor. Man geht davon aus, dass die Infektion mit einem Serotyp eine lebenslange Immunität gegen diesen Typ, aber nur einen kurzfristigen Schutz gegen die anderen drei Serotypen bewirkt. Das Risiko einer schweren Erkrankung durch eine Sekundärinfektion steigt, wenn eine Person, die zuvor dem Serotyp DENV-1 ausgesetzt war, sich mit dem Serotyp DENV-2 oder DENV-3 infiziert, oder wenn eine Person, die zuvor DENV-3 ausgesetzt war, sich DENV-2 zuzieht. Dengue kann bei Menschen mit chronischen Krankheiten wie Diabetes und Asthma lebensbedrohlich sein. ⓘ
Polymorphismen (normale Abweichungen) in bestimmten Genen wurden mit einem erhöhten Risiko für schwere Dengue-Komplikationen in Verbindung gebracht. Beispiele hierfür sind die Gene, die für die Proteine TNFα, Mannan-bindendes Lektin, CTLA4, TGFβ, DC-SIGN, PLCE1 und bestimmte Formen des menschlichen Leukozytenantigens aus Genvariationen von HLA-B kodieren. Eine vor allem bei Afrikanern verbreitete genetische Anomalie, der so genannte Glucose-6-Phosphat-Dehydrogenase-Mangel, scheint das Risiko zu erhöhen. Polymorphismen in den Genen für den Vitamin-D-Rezeptor und den FcγR scheinen bei einer sekundären Dengue-Infektion einen Schutz vor schweren Erkrankungen zu bieten. ⓘ
Mechanismus
Wenn eine Mücke, die das Dengue-Virus trägt, einen Menschen sticht, dringt das Virus zusammen mit dem Speichel der Mücke in die Haut ein. Es bindet sich an weiße Blutkörperchen, dringt in diese ein und vermehrt sich in den Zellen, während sie sich durch den Körper bewegen. Die weißen Blutkörperchen reagieren mit der Produktion verschiedener Signalproteine wie Zytokine und Interferone, die für viele der Symptome wie Fieber, grippeähnliche Symptome und starke Schmerzen verantwortlich sind. Bei einer schweren Infektion ist die Virusproduktion im Körper stark erhöht, und viele weitere Organe (z. B. die Leber und das Knochenmark) können betroffen sein. Flüssigkeit aus dem Blutkreislauf sickert aufgrund der Kapillardurchlässigkeit durch die Wand der kleinen Blutgefäße in Körperhöhlen. Infolgedessen zirkuliert weniger Blut in den Blutgefäßen, und der Blutdruck wird so niedrig, dass er die lebenswichtigen Organe nicht mehr ausreichend mit Blut versorgen kann. Darüber hinaus führt eine Funktionsstörung des Knochenmarks aufgrund einer Infektion der Stromazellen zu einer verminderten Anzahl von Blutplättchen, die für eine wirksame Blutgerinnung erforderlich sind; dies erhöht das Risiko von Blutungen, der anderen Hauptkomplikation des Dengue-Fiebers. ⓘ
Virale Replikation
Sobald das Dengue-Virus in der Haut ist, bindet es an Langerhans-Zellen (eine Population dendritischer Zellen in der Haut, die Krankheitserreger erkennt). Das Virus dringt in die Zellen durch die Bindung zwischen viralen Proteinen und Membranproteinen auf der Langerhans-Zelle ein, insbesondere durch die C-Typ-Lektine DC-SIGN, Mannose-Rezeptor und CLEC5A. DC-SIGN, ein unspezifischer Rezeptor für Fremdmaterial auf dendritischen Zellen, scheint der Haupteintrittspunkt zu sein. Die dendritische Zelle bewegt sich zum nächstgelegenen Lymphknoten. In der Zwischenzeit wird das Virusgenom in membrangebundene Vesikel am endoplasmatischen Retikulum der Zelle übersetzt, wo der Proteinsyntheseapparat der Zelle neue virale Proteine produziert, die die virale RNA replizieren und mit der Bildung viraler Partikel beginnen. Unreife Viruspartikel werden zum Golgi-Apparat transportiert, dem Teil der Zelle, in dem einige der Proteine notwendige Zuckerketten (Glykoproteine) erhalten. Die nun reifen neuen Viren werden durch Exozytose freigesetzt. Sie können dann in andere weiße Blutkörperchen, wie Monozyten und Makrophagen, eindringen. ⓘ
Die erste Reaktion der infizierten Zellen ist die Produktion von Interferon, einem Zytokin, das über das angeborene Immunsystem zahlreiche Abwehrmechanismen gegen eine Virusinfektion aktiviert, indem es die Produktion einer großen Gruppe von Proteinen steigert, die über den JAK-STAT-Weg vermittelt werden. Einige Serotypen des Dengue-Virus scheinen über Mechanismen zur Verlangsamung dieses Prozesses zu verfügen. Interferon aktiviert auch das adaptive Immunsystem, was zur Bildung von Antikörpern gegen das Virus sowie von T-Zellen führt, die jede mit dem Virus infizierte Zelle direkt angreifen. Es werden verschiedene Antikörper gebildet; einige binden eng an die Virusproteine und zielen auf deren Phagozytose (Aufnahme durch spezialisierte Zellen und Zerstörung) ab, andere binden das Virus jedoch weniger gut und scheinen es stattdessen in einen Teil der Phagozyten zu befördern, wo es nicht zerstört wird, sondern sich weiter vermehren kann. ⓘ
Schwere Krankheit

Es ist nicht ganz klar, warum eine Sekundärinfektion mit einem anderen Dengue-Virusstamm das Risiko eines hämorrhagischen Dengue-Fiebers und eines Dengue-Schocksyndroms erhöht. Die am weitesten akzeptierte Hypothese ist die des Antikörper-abhängigen Enhancements (ADE). Der genaue Mechanismus hinter ADE ist unklar. Möglicherweise wird sie durch eine schlechte Bindung von nicht neutralisierenden Antikörpern und die Abgabe an das falsche Kompartiment der weißen Blutkörperchen verursacht, die das Virus zur Zerstörung aufgenommen haben. Es besteht der Verdacht, dass ADE nicht der einzige Mechanismus ist, der den schweren Dengue-bedingten Komplikationen zugrunde liegt, und verschiedene Forschungsrichtungen haben eine Rolle für T-Zellen und lösliche Faktoren wie Zytokine und das Komplementsystem angedeutet. ⓘ
Eine schwere Erkrankung ist gekennzeichnet durch Probleme mit der Kapillardurchlässigkeit (ein Durchlass von Flüssigkeit und Proteinen, die normalerweise im Blut enthalten sind) und eine gestörte Blutgerinnung. Diese Veränderungen scheinen mit einem gestörten Zustand der endothelialen Glykokalyx verbunden zu sein, die als molekularer Filter für Blutbestandteile fungiert. Es wird angenommen, dass undichte Kapillaren (und die kritische Phase) durch eine Reaktion des Immunsystems verursacht werden. Weitere interessante Prozesse sind infizierte Zellen, die nekrotisch werden - was sowohl die Blutgerinnung als auch die Fibrinolyse (die gegensätzlichen Systeme der Blutgerinnung und des Blutgerinnselabbaus) beeinträchtigt - sowie ein niedriger Thrombozytengehalt im Blut, der ebenfalls ein Faktor für die normale Blutgerinnung ist. ⓘ
Diagnose
Warnzeichen ⓘ
| ||||
| Sich verschlimmernde Bauchschmerzen | ||||
| Anhaltendes Erbrechen | ||||
| Vergrößerung der Leber | ||||
| Blutungen der Schleimhäute | ||||
| Hoher Hämatokrit mit niedrigen Blutplättchen | ||||
| Lethargie oder Unruhe | ||||
| Seröse Ergüsse | ||||
Die Diagnose des Dengue-Fiebers wird in der Regel klinisch anhand der berichteten Symptome und der körperlichen Untersuchung gestellt; dies gilt vor allem in endemischen Gebieten. Im Frühstadium der Erkrankung kann es jedoch schwierig sein, sie von anderen Virusinfektionen zu unterscheiden. Eine wahrscheinliche Diagnose basiert auf Fieber und zwei der folgenden Symptome: Übelkeit und Erbrechen, Hautausschlag, generalisierte Schmerzen, niedrige Anzahl weißer Blutkörperchen, positiver Tourniquet-Test oder Warnzeichen (siehe Tabelle) bei Personen, die in einem endemischen Gebiet leben. Warnzeichen treten in der Regel vor dem Ausbruch eines schweren Dengue-Fiebers auf. Der Tourniquet-Test, der besonders nützlich ist, wenn keine Laboruntersuchungen zur Verfügung stehen, beinhaltet das Anlegen einer Blutdruckmanschette bei diastolischem und systolischem Druck für fünf Minuten, gefolgt von der Zählung aller petechialen Blutungen; eine höhere Anzahl macht die Diagnose von Dengue wahrscheinlicher, wobei der Grenzwert bei mehr als 10 bis 20 pro 1 inch2 (6,25 cm2) liegt. ⓘ
Die Diagnose sollte bei jedem in Betracht gezogen werden, der innerhalb von zwei Wochen nach einem Aufenthalt in den Tropen oder Subtropen Fieber entwickelt. Es kann schwierig sein, Dengue-Fieber von Chikungunya zu unterscheiden, einer ähnlichen Virusinfektion, die viele Symptome aufweist und in ähnlichen Teilen der Welt auftritt wie Dengue. Oft werden Untersuchungen durchgeführt, um andere Krankheiten auszuschließen, die ähnliche Symptome verursachen, wie Malaria, Leptospirose, virales hämorrhagisches Fieber, Typhus, Meningokokken, Masern und Influenza. Auch das Zika-Fieber hat ähnliche Symptome wie das Dengue-Fieber. ⓘ
Die erste Veränderung, die bei Laboruntersuchungen festgestellt werden kann, ist eine niedrige Anzahl weißer Blutkörperchen, auf die eine niedrige Thrombozytenzahl und eine metabolische Azidose folgen können. Ein mäßig erhöhter Aminotransferase-Spiegel (AST und ALT) in der Leber geht häufig mit niedrigen Blutplättchen und weißen Blutkörperchen einher. Bei schwerer Erkrankung führt der Austritt von Plasma zu einer Hämokonzentration (erkennbar an einem steigenden Hämatokrit) und Hypoalbuminämie. Pleuraergüsse oder Aszites können durch körperliche Untersuchung festgestellt werden, wenn sie groß sind, aber der Nachweis von Flüssigkeit im Ultraschall kann bei der Früherkennung des Dengue-Schock-Syndroms hilfreich sein. Der Einsatz von Ultraschall ist in vielen Fällen nur begrenzt möglich, da er nicht überall verfügbar ist. Ein Dengue-Schock-Syndrom liegt vor, wenn der Pulsdruck auf ≤ 20 mm Hg fällt und ein peripherer Gefäßkollaps auftritt. Der periphere Gefäßkollaps wird bei Kindern durch verzögerte Kapillarfüllung, schnelle Herzfrequenz oder kalte Extremitäten festgestellt. Obwohl Warnzeichen ein wichtiger Aspekt für die Früherkennung einer potenziell schweren Erkrankung sind, ist der Nachweis für einen spezifischen klinischen oder Labormarker nur schwach. ⓘ
Klassifizierung
Die Klassifizierung der Weltgesundheitsorganisation von 2009 teilt das Dengue-Fieber in zwei Gruppen ein: unkompliziertes und schweres Fieber. Sie ersetzt die WHO-Klassifikation von 1997, die vereinfacht werden musste, da sie sich als zu restriktiv erwiesen hatte. Die ältere Klassifikation wird jedoch nach wie vor häufig verwendet, unter anderem seit 2011 vom Regionalbüro der Weltgesundheitsorganisation für Südostasien. Schweres Dengue wird definiert als Dengue, das mit schweren Blutungen, schweren Organfunktionsstörungen oder schwerem Plasmaaustritt einhergeht, während alle anderen Fälle als unkompliziert gelten. Die Klassifizierung von 1997 unterteilt Dengue in undifferenziertes Fieber, Dengue-Fieber und hämorrhagisches Dengue-Fieber. Das hämorrhagische Dengue-Fieber wurde weiter in die Grade I-IV unterteilt. Grad I ist das Vorhandensein von leichten Blutergüssen oder ein positiver Tourniquet-Test bei einer Person mit Fieber, Grad II ist das Vorhandensein von spontanen Blutungen in die Haut und an anderen Stellen, Grad III ist der klinische Nachweis eines Schocks und Grad IV ist ein so schwerer Schock, dass Blutdruck und Puls nicht festgestellt werden können. Die Schweregrade III und IV werden als "Dengue-Schocksyndrom" bezeichnet. ⓘ
Laboruntersuchungen

Die Diagnose von Dengue-Fieber kann durch mikrobiologische Labortests bestätigt werden. Dies kann durch Virusisolierung in Zellkulturen, Nukleinsäurenachweis mittels PCR, Nachweis viraler Antigene (z. B. für NS1) oder spezifischer Antikörper (Serologie) erfolgen. Die Virusisolierung und der Nukleinsäurenachweis sind genauer als der Antigennachweis, doch sind diese Tests aufgrund ihrer höheren Kosten nicht überall verfügbar. Der Nachweis von NS1 während der fieberhaften Phase einer Primärinfektion kann eine Empfindlichkeit von mehr als 90 % aufweisen, liegt aber bei nachfolgenden Infektionen nur bei 60-80 %. In den frühen Stadien der Krankheit können alle Tests negativ sein. Die PCR und der Nachweis viraler Antigene sind in den ersten sieben Tagen genauer. Im Jahr 2012 wurde ein PCR-Test eingeführt, der mit den für die Influenza-Diagnose verwendeten Geräten durchgeführt werden kann; dies dürfte den Zugang zur PCR-basierten Diagnose verbessern. ⓘ
Diese Labortests sind mit Ausnahme der Serologie nur in der akuten Phase der Erkrankung von diagnostischem Wert. Tests auf Dengue-Virus-spezifische Antikörper, Typen IgG und IgM, können zur Bestätigung der Diagnose in den späteren Stadien der Infektion nützlich sein. Sowohl IgG als auch IgM werden nach 5-7 Tagen gebildet. Die höchsten Werte (Titer) von IgM werden nach einer Primärinfektion nachgewiesen, aber IgM wird auch bei einer Reinfektion gebildet. IgM ist 30-90 Tage nach einer Erstinfektion nicht mehr nachweisbar, bei Reinfektionen jedoch früher. IgG hingegen bleibt über 60 Jahre lang nachweisbar und ist bei fehlenden Symptomen ein nützlicher Indikator für eine frühere Infektion. Nach einer Primärinfektion erreicht der IgG-Spiegel im Blut nach 14-21 Tagen seinen Höchststand. Bei späteren Reinfektionen erreichen die Werte ihren Höhepunkt früher und die Titer sind in der Regel höher. Sowohl IgG als auch IgM bieten eine schützende Immunität gegen den infektiösen Serotyp des Virus. Bei der Untersuchung auf IgG- und IgM-Antikörper kann es zu einer Kreuzreaktivität mit anderen Flaviviren kommen, was nach kürzlichen Infektionen oder Impfungen mit dem Gelbfiebervirus oder der Japanischen Enzephalitis zu einem falsch positiven Ergebnis führen kann. Der Nachweis von IgG allein gilt nur dann als diagnostisch, wenn Blutproben im Abstand von 14 Tagen entnommen werden und ein mehr als vierfacher Anstieg der spezifischen IgG-Werte festgestellt wird. Bei einer Person mit Symptomen gilt der Nachweis von IgM als diagnostisch. ⓘ
Die klinische Diagnosestellung ist wegen der Vielzahl der möglichen Erreger für Infektionskrankheiten mit ähnlichen Anfangssymptomen schwierig. Sporadische und nur milde Verläufe sind nur durch eine virologische Untersuchung sicher zu erkennen. ⓘ
Antigen-Tests basierend auf dem direkten Nachweis des NS1-Proteins (das innerhalb der vier Serotypen stark konserviert ist) sind ebenfalls kommerziell erhältlich. Sie zeichnen sich durch ihre einfache Handhabung (kein Labor notwendig) aus, sind aber deutlich weniger sensitiv und spezifisch als aufwendigere Testverfahren. ⓘ
Der Umgang mit sämtlichem Untersuchungsmaterial des Patienten, insbesondere Blut, unterliegt strengen Sicherheitsvorschriften und darf nur in Laboren der Schutzstufe 3 durchgeführt werden. ⓘ
Vorbeugung

Die Prävention hängt von der Kontrolle und dem Schutz vor den Stichen der übertragenden Mücken ab. Die Weltgesundheitsorganisation empfiehlt ein integriertes Vektorkontrollprogramm, das aus fünf Elementen besteht:
- Überzeugungsarbeit, soziale Mobilisierung und Gesetzgebung, um sicherzustellen, dass öffentliche Gesundheitseinrichtungen und Gemeinden gestärkt werden;
- Zusammenarbeit zwischen dem Gesundheitswesen und anderen Sektoren (öffentlich und privat);
- Ein integrierter Ansatz zur Krankheitsbekämpfung, um den Einsatz der Ressourcen zu maximieren;
- evidenzbasierte Entscheidungsfindung, um sicherzustellen, dass alle Maßnahmen zielgerichtet sind; und
- Aufbau von Kapazitäten, um eine angemessene Reaktion auf die lokale Situation zu gewährleisten. ⓘ
Die wichtigste Methode zur Bekämpfung von A. aegypti besteht in der Beseitigung ihrer Lebensräume. Dies geschieht durch die Beseitigung offener Wasserquellen oder, falls dies nicht möglich ist, durch den Einsatz von Insektiziden oder biologischen Bekämpfungsmitteln in diesen Gebieten. Das generelle Besprühen mit Organophosphat- oder Pyrethroid-Insektiziden wird zwar manchmal durchgeführt, gilt aber als nicht wirksam. Die Verringerung offener Wasseransammlungen durch Umweltveränderungen ist die bevorzugte Bekämpfungsmethode, da negative gesundheitliche Auswirkungen von Insektiziden befürchtet werden und der Einsatz von Bekämpfungsmitteln mit größeren logistischen Schwierigkeiten verbunden ist. Menschen können Mückenstiche verhindern, indem sie Kleidung tragen, die die Haut vollständig bedeckt, Moskitonetze verwenden, wenn sie sich ausruhen, und/oder Insektenschutzmittel auftragen (DEET ist am wirksamsten). Diese Maßnahmen können zwar das Expositionsrisiko des Einzelnen wirksam verringern, sie tragen jedoch nur wenig dazu bei, die Häufigkeit der Ausbrüche zu reduzieren, die in einigen Gebieten zuzunehmen scheinen, was wahrscheinlich auf die Verstädterung zurückzuführen ist, die den Lebensraum von A. aegypti vergrößert. Auch das Verbreitungsgebiet der Krankheit scheint sich auszudehnen, möglicherweise aufgrund des Klimawandels. ⓘ
Als Larvenbiotope reichen unverschlossene Wasserbehälter und kleine Mengen stehenden Wassers aus, das sich in Eimern, Dosen, Flaschen, Autoreifen oder Plastikfolien sammelt. Zudem sind die Eier der Tigermücken trockenresistent und können so Trockenzeiten überdauern. All dies erschwert es, die Mücken zu bekämpfen. ⓘ
Die persönlichen Vorbeugemaßnahmen gegen Denguefieber umfassen das Vermeiden von Mückenstichen in Gebieten, in denen Denguefieber endemisch vorkommt. Institutionelle Maßnahmen zur Prävention von Denguefieber umfassen Maßnahmen zur Kontrolle der krankheitsübertragenden Stechmücken. ⓘ
Impfstoff
Im Jahr 2016 wurde auf den Philippinen und in Indonesien ein teilweise wirksamer Impfstoff gegen Dengue-Fieber auf den Markt gebracht. Er ist in Mexiko, Brasilien, El Salvador, Costa Rica, Singapur, Paraguay, weiten Teilen Europas und den Vereinigten Staaten zugelassen. Der Impfstoff wird nur für Personen empfohlen, die bereits eine Dengue-Infektion durchgemacht haben, oder in Bevölkerungsgruppen, in denen die meisten (>80 %) der Menschen bis zum Alter von 9 Jahren infiziert waren. Bei Personen, die noch keine Infektion durchgemacht haben, gibt es Hinweise darauf, dass die Impfung spätere Infektionen verschlimmern kann. Aus diesem Grund hält Prescrire den Impfstoff nicht für eine großflächige Immunisierung geeignet, auch nicht in Gebieten, in denen die Krankheit häufig vorkommt. ⓘ
Der Impfstoff wird von Sanofi hergestellt und trägt den Markennamen Dengvaxia. Er basiert auf einer abgeschwächten Kombination aus dem Gelbfiebervirus und jedem der vier Dengue-Serotypen. Studien zu diesem Impfstoff ergaben, dass er zu 66 % wirksam ist und mehr als 80 bis 90 % der schweren Fälle verhindert. Das ist weniger, als von einigen gewünscht wird. In Indonesien kostet er etwa 207 US-Dollar für die empfohlenen drei Dosen. ⓘ
Angesichts der Grenzen des derzeitigen Impfstoffs wird die Forschung an Impfstoffen fortgesetzt, und der fünfte Serotyp könnte in Betracht gezogen werden. Eine der Befürchtungen ist, dass ein Impfstoff das Risiko einer schweren Erkrankung durch antikörperabhängige Verstärkung (ADE) erhöhen könnte. Der ideale Impfstoff ist sicher, nach einer oder zwei Injektionen wirksam, deckt alle Serotypen ab, trägt nicht zu ADE bei, ist leicht zu transportieren und zu lagern und ist sowohl erschwinglich als auch kosteneffektiv. ⓘ
Anti-dengue-Tag

Der Internationale Anti-Dengue-Tag wird jedes Jahr am 15. Juni begangen. Die Idee wurde erstmals 2010 beschlossen und die erste Veranstaltung fand 2011 in Jakarta, Indonesien, statt. Weitere Veranstaltungen fanden 2012 in Yangon, Myanmar, und 2013 in Vietnam statt. Ziel ist es, das öffentliche Bewusstsein für Dengue zu schärfen, Ressourcen für die Prävention und Bekämpfung der Krankheit zu mobilisieren und das Engagement der südostasiatischen Region im Kampf gegen die Krankheit zu demonstrieren. ⓘ
Persönliche Vorbeugung
Stiche können insbesondere durch geeignete Kleidung und Repellentien wie mückenabweisende Sprays vermieden werden. Da die erwachsenen Tigermücken tagaktiv sind, kann man sich nur beschränkt durch Bettnetze schützen, die beispielsweise gegen Malaria wirkungsvoll sind. Mückenabweisende Sprays mit einem hohen DEET-Gehalt können das Risiko eines Stiches weiterhin vermindern. ⓘ
Strategische Vorbeugung


Obwohl es seit Ende 2015 einen ersten Impfstoff gegen Dengueviren gibt, kommt aber nach wie vor der Bekämpfung der Überträgermücken eine zentrale Rolle zu. Die Gelbfiebermücke Stegomyia aegypti brütet bevorzugt in Wasseransammlungen, die von Bewohnern in Gebieten mit problematischer Trinkwasserversorgung selbst angelegt wurden oder die sich im Hausmüll ansammeln; insbesondere in Reifen, aber auch in alten Dosen und Plastikgefäßen. Besonders in der Nähe von urbanen Zentren von Entwicklungsländern sind diese Bedingungen oft anzutreffen und bilden ein ausgezeichnetes Habitat für die Gelbfiebermücke. Bei der Bekämpfung der Mücke werden zwei Strategien verfolgt:
- Bekämpfung der sich entwickelnden Larven. Eine der zurzeit wichtigsten Strategien fußt auf der möglichst umfassenden und durch die Allgemeinheit unterstützten Beseitigung der Larvengewässer. Neben Maßnahmen zur Verminderung der Larvengewässer werden vor allem chemische Larvizide sowie larvenfressende Fische und Ruderfußkrebse (Copepoda) eingesetzt, welche direkt die Anzahl der Larven und somit indirekt die Anzahl der krankheitsübertragenden Mücken verringern. Die vietnamesische Regierung experimentiert seit 1998 systematisch mit Ruderfußkrebsen der Gattung Mesocyclops zur biologischen Kontrolle der Denguefieber-Erreger. Dies führte dazu, dass in den betroffenen Gebieten zwischen 2002 und 2005 kein Fall von Denguefieber mehr auftrat. Das erfolgreiche Programm wurde in der Folge auf weitere Regionen ausgeweitet, unter Einbeziehung der Lokalbevölkerung. Als chemisches Larvizid wird vorwiegend Pyriproxyfen empfohlen, da es für Menschen ungefährlich und bereits in kleinen Mengen wirksam ist. ⓘ
- Bekämpfung der erwachsenen Gelbfiebermücken. Dabei werden Vorhänge und Abdeckungen von Wasserbehältern mit Insektizid behandelt. Sie töten ruhende oder auf der Suche nach Eiablagegewässern befindliche Mückenweibchen. Weiterhin kann Insektizid in den Innenräumen versprüht werden, was aber von der WHO nicht empfohlen wird. Eine neuere Methode ist der Einsatz spezieller, für den Fang von Tigermücken optimierter Fallen mit einer Lockstoffmischung. ⓘ
- die Verbreitung von Mücken, die durch Bakterien der Art Wolbachia pipientis gegen das Virus immunisiert sind. In einer Studie um die Forschungsgruppe von Adi Utarini mit mehr als 8000 Freiwilligen in der indonesischen Stadt Yogyakarta reduzierte sich mit dieser Methode die Zahl der Infektionen um 77 Prozent, die Zahl der Krankenhauseinweisungen wegen Denguefieber ging um 86 Prozent zurück.
Weitere Ansätze sind:
- die Ausbringung genetisch veränderter Männchen der Gelbfiebermücke. Gegen die Freisetzung von etwa 10 Millionen gentechnisch veränderten männlichen Mücken in Brasilien gab und gibt es zahlreiche Bedenken.
- ein parasitärer Pilz (Beauveria bassiana), der die Mücken tötet oder schwächt.
- die systematische Verfolgung und physische Tötung in den Haushalten. Ruhende Stechmücken können mit geeigneten Gegenständen (z. B. Fliegenklatsche), fliegende mit etwas Übung mit den Händen oder mit einer elektrischen Fliegenklatsche unschädlich gemacht werden. ⓘ
Behandlung
Es gibt keine spezifischen antiviralen Medikamente gegen Dengue-Fieber; wichtig ist jedoch die Aufrechterhaltung eines ausgeglichenen Flüssigkeitshaushalts. Die Behandlung hängt von den Symptomen ab. Diejenigen, die trinken können, Urin abgeben, keine "Warnzeichen" haben und ansonsten gesund sind, können zu Hause mit täglicher Nachsorge und oraler Rehydratationstherapie behandelt werden. Diejenigen, die andere Gesundheitsprobleme haben, "Warnzeichen" aufweisen oder nicht in der Lage sind, regelmäßige Nachuntersuchungen durchzuführen, sollten im Krankenhaus behandelt werden. Personen mit schwerem Dengue-Fieber sollten in einem Gebiet betreut werden, in dem eine Intensivstation zur Verfügung steht. ⓘ
Eine intravenöse Flüssigkeitszufuhr, falls erforderlich, ist in der Regel nur für ein oder zwei Tage erforderlich. Bei Kindern mit Dengue-bedingtem Schock ist eine schnelle Dosis von 20 ml/kg angemessen. Die Geschwindigkeit der Flüssigkeitszufuhr wird dann bis zu einer Urinausscheidung von 0,5-1 ml/kg/h, stabilen Vitalzeichen und einer Normalisierung des Hämatokrits titriert. Es wird die kleinste Flüssigkeitsmenge empfohlen, die zur Erreichung dieses Ziels erforderlich ist. ⓘ
Invasive medizinische Eingriffe wie nasogastrale Intubation, intramuskuläre Injektionen und arterielle Punktionen werden wegen des Blutungsrisikos vermieden. Paracetamol (Paracetamol) wird bei Fieber und Unwohlsein eingesetzt, während NSAIDs wie Ibuprofen und Aspirin vermieden werden, da sie das Blutungsrisiko erhöhen können. Bei Menschen mit instabilen Vitalzeichen und sinkendem Hämatokrit wird frühzeitig eine Bluttransfusion eingeleitet, anstatt zu warten, bis die Hämoglobinkonzentration auf einen bestimmten "Transfusionsauslösewert" sinkt. Empfohlen werden gepackte rote Blutkörperchen oder Vollblut, während Thrombozyten und gefrorenes Frischplasma in der Regel nicht empfohlen werden. Es gibt nicht genügend Beweise, um festzustellen, ob Kortikosteroide bei Dengue-Fieber eine positive oder negative Wirkung haben. ⓘ
Während der Erholungsphase wird die intravenöse Flüssigkeitszufuhr eingestellt, um eine Flüssigkeitsüberlastung zu vermeiden. Wenn es zu einer Flüssigkeitsüberlastung kommt und die Vitalzeichen stabil sind, kann es ausreichen, die weitere Flüssigkeitszufuhr einzustellen. Befindet sich eine Person außerhalb der kritischen Phase, kann ein Schleifendiuretikum wie Furosemid eingesetzt werden, um überschüssige Flüssigkeit aus dem Kreislauf zu entfernen. ⓘ
Für Denguefieber existiert wie für alle von Flaviviren ausgelösten Krankheiten keine ursächliche Therapie. In schweren Fällen ist eine Einweisung in ein Krankenhaus (Hospitalisierung) vorzunehmen und aufgrund des in manchen Fällen sich schnell verschlechternden Krankheitszustandes ist eine intensivmedizinische Überwachung angebracht. Eine symptomatische Behandlung umfasst Maßnahmen zur Flüssigkeitsauffüllung (Rehydratation) und Gabe von Mitteln wie Paracetamol zur Schmerzlinderung. Auf Acetylsalicylsäure (z. B. Aspirin) ist aufgrund ihrer gerinnungshemmenden Wirkung zu verzichten, da diese im Falle von inneren Blutungen, die bei Denguefieber auftreten können, verheerende Folgen für den Patienten hat. Weiterhin kann die frühe, intravenöse Gabe von Flüssigkeit von entscheidender Bedeutung sein. ⓘ
Prognose
Die meisten Menschen mit Dengue erholen sich ohne anhaltende Probleme. Das Risiko, an einer schweren Dengue-Erkrankung zu sterben, liegt bei 0,8 % bis 2,5 %, bei angemessener Behandlung bei weniger als 1 %. Bei Menschen, die einen deutlich zu niedrigen Blutdruck entwickeln, kann die Sterblichkeitsrate jedoch bis zu 26 % betragen. Das Sterberisiko bei Kindern unter fünf Jahren ist viermal höher als bei Kindern über 10 Jahren. Ältere Menschen haben ebenfalls ein höheres Risiko für einen schlechten Ausgang. ⓘ
Epidemiologie

Dengue-Fieber ist in mehr als 120 Ländern verbreitet. Im Jahr 2013 verursachte es weltweit etwa 60 Millionen symptomatische Infektionen, wobei 18 % der Erkrankten ins Krankenhaus eingewiesen wurden und etwa 13 600 Menschen starben. Die weltweiten Kosten von Dengue-Fällen werden auf 9 Milliarden US-Dollar geschätzt. Für das Jahrzehnt der 2000er Jahre wurden für 12 Länder in Südostasien jährlich etwa 3 Millionen Infektionen und 6.000 Todesfälle geschätzt. Im Jahr 2019 erklärten die Philippinen eine nationale Dengue-Epidemie, da in diesem Jahr 622 Menschen starben. In Afrika wird die Krankheit in mindestens 22 Ländern gemeldet; wahrscheinlich ist sie jedoch in allen Ländern vorhanden, wobei 20 % der Bevölkerung gefährdet sind. Damit ist sie eine der weltweit am häufigsten durch Vektoren übertragenen Krankheiten. ⓘ
Infektionen werden am häufigsten in städtischen Umgebungen erworben. In den letzten Jahrzehnten haben die Ausbreitung von Dörfern, Städten und Gemeinden in den Verbreitungsgebieten und die erhöhte Mobilität der Menschen die Zahl der Epidemien und der zirkulierenden Viren erhöht. Das Dengue-Fieber, das früher auf Südostasien beschränkt war, hat sich inzwischen auf Südchina in Ostasien, Länder im Pazifischen Ozean und auf dem amerikanischen Kontinent ausgebreitet und könnte auch eine Bedrohung für Europa darstellen. ⓘ
Die Dengue-Raten sind zwischen 1960 und 2010 um das 30-fache gestiegen. Man geht davon aus, dass dieser Anstieg auf eine Kombination aus Verstädterung, Bevölkerungswachstum, zunehmendem internationalen Reiseverkehr und globaler Erwärmung zurückzuführen ist. Die geografische Verbreitung liegt rund um den Äquator. Von den 2,5 Milliarden Menschen, die in Gebieten leben, in denen die Krankheit häufig vorkommt, stammen 70 % aus der WHO-Region Südostasien und der Region Westpazifik. Eine Infektion mit Dengue-Fieber ist nach Malaria die zweithäufigste diagnostizierte Fieberursache bei Reisenden, die aus den Entwicklungsländern zurückkehren. Es handelt sich um die häufigste durch Arthropoden übertragene Viruserkrankung, deren Krankheitslast auf 1.600 behinderungsbereinigte Lebensjahre pro Million Einwohner geschätzt wird. Die Weltgesundheitsorganisation zählt Dengue als eine von siebzehn vernachlässigten tropischen Krankheiten. ⓘ
Wie die meisten Arboviren wird auch das Dengue-Virus in der Natur in Zyklen gehalten, an denen bevorzugte blutsaugende Vektoren und Wirbeltierwirte beteiligt sind. Die Viren werden in den Wäldern Südostasiens und Afrikas durch die Übertragung von weiblichen Aedes-Mücken - anderen Arten als A. aegypti - auf ihre Nachkommen und auf niedere Primaten erhalten. In Städten wird das Virus in erster Linie von der stark domestizierten A. aegypti übertragen. In ländlichen Gebieten wird das Virus durch A. aegypti und andere Aedes-Arten wie A. albopictus auf den Menschen übertragen. Beide Arten haben sich in der zweiten Hälfte des 20. Jahrhunderts ausgebreitet. In allen Fällen erhöhen die infizierten niederen Primaten oder Menschen die Zahl der zirkulierenden Dengue-Viren in einem Prozess, der als Amplifikation bezeichnet wird, erheblich. Eine Prognose geht davon aus, dass durch den Klimawandel, die Verstädterung und andere Faktoren bis zum Jahr 2080 mehr als 6 Milliarden Menschen dem Risiko einer Dengue-Infektion ausgesetzt sein könnten. ⓘ
Geschichte
Der erste Bericht über einen wahrscheinlichen Fall von Dengue-Fieber findet sich in einer chinesischen medizinischen Enzyklopädie aus der Jin-Dynastie (266-420), in der von einem "Wassergift" die Rede ist, das mit fliegenden Insekten in Verbindung gebracht wird. Der Hauptüberträger, A. aegypti, breitete sich im 15. bis 19. Jahrhundert aus Afrika aus, was zum Teil auf die zunehmende Globalisierung infolge des Sklavenhandels zurückzuführen ist. Es gibt Beschreibungen von Epidemien aus dem 17. Jahrhundert, aber die plausibelsten frühen Berichte über Dengue-Epidemien stammen aus den Jahren 1779 und 1780, als eine Epidemie über Südostasien, Afrika und Nordamerika hinwegfegte. Von diesem Zeitpunkt an bis 1940 traten Epidemien nur noch selten auf. ⓘ
Im Jahr 1906 wurde die Übertragung durch die Aedes-Mücke bestätigt, und 1907 war Dengue die zweite Krankheit (nach Gelbfieber), die nachweislich durch ein Virus verursacht wurde. Weitere Untersuchungen von John Burton Cleland und Joseph Franklin Siler vervollständigten das grundlegende Verständnis der Dengue-Übertragung. ⓘ
Die starke Ausbreitung des Denguefiebers während und nach dem Zweiten Weltkrieg wurde auf ökologische Störungen zurückgeführt. Dieselben Trends führten auch zur Ausbreitung verschiedener Serotypen der Krankheit in neue Gebiete und zum Auftreten des hämorrhagischen Dengue-Fiebers. Diese schwere Form der Krankheit wurde erstmals 1953 auf den Philippinen gemeldet; in den 1970er Jahren war sie zu einer der Hauptursachen für Kindersterblichkeit geworden und hatte sich im Pazifik und in Amerika ausgebreitet. Das hämorrhagische Dengue-Fieber und das Dengue-Schock-Syndrom wurden 1981 erstmals in Mittel- und Südamerika festgestellt, als DENV-2 von Menschen übertragen wurde, die sich einige Jahre zuvor mit DENV-1 infiziert hatten. ⓘ
Etymologie
Der Name kam im frühen 19. Jahrhundert aus dem westindischen Spanisch ins Englische, das ihn von dem Kisuaheli-Begriff dinga (vollständig kidingapopo, "von einem bösen Geist verursachte Krankheit") entlehnt hat. Der entlehnte Begriff wurde im Spanischen zu Dengue umgewandelt, da dieses Wort im Spanischen die Bedeutung "Fresssucht" hat und sich diese Volksetymologie auf die Bewegungsunlust der betroffenen Patienten bezieht. Sklaven auf den Westindischen Inseln, die an Dengue erkrankt waren, wurde nachgesagt, sie hätten die Haltung und den Gang eines Dandys, und die Krankheit wurde als "Dandy-Fieber" bezeichnet. ⓘ
Der Begriff Knochenbrecherfieber wurde von dem Arzt und Gründervater der Vereinigten Staaten, Benjamin Rush, in einem Bericht von 1789 über die Epidemie von 1780 in Philadelphia verwendet. Im Titel des Berichts verwendet er die formellere Bezeichnung "bilious remitting fever". Der Begriff Dengue-Fieber wurde erst nach 1828 allgemein verwendet. Andere historische Bezeichnungen sind "breakheart fever" und "la dengue". Zu den Begriffen für schwere Erkrankungen gehören "infektiöse thrombozytopenische Purpura" und "philippinisches", "thailändisches" oder "hämorrhagisches Singapur-Fieber". ⓘ
Gesellschaft und Kultur
Blutspende
Ausbrüche des Dengue-Fiebers erhöhen den Bedarf an Blutprodukten, während die Zahl der potenziellen Blutspender aufgrund einer möglichen Infektion mit dem Virus sinkt. Personen, die eine Dengue-Infektion haben, dürfen in der Regel mindestens sechs Monate lang kein Blut spenden. ⓘ
Aufklärungsarbeit
In Indien wird am 16. Mai ein nationaler Dengue-Tag begangen, um das Bewusstsein in den betroffenen Ländern zu schärfen. Ab 2019 wird daran gearbeitet, diesen Tag zu einem globalen Ereignis zu machen. Auf den Philippinen gibt es seit 1998 einen Sensibilisierungsmonat im Juni. ⓘ
Forschung
Im 20. Jahrhundert wurden die ersten Schritte zur Identifizierung und Bekämpfung des Erregers der Krankheit unternommen. Nach der erfolgreichen wissenschaftlichen Untersuchung des Gelbfieber-Virus durch Finlay, Reed und andere wurde die Aufmerksamkeit auf das Denguefieber gelenkt. Percy M. Ashburn und Charles F. Craig zeigten 1907, dass Denguefieber durch einen nichtfiltrierbaren Faktor verursacht wird, also ein Virus genauso wie Gelbfieber. Stegomyia aegypti wurde 1926 von Joseph Franklin Siler, Milton W. Hall und Arthur Parker Hitchens als Vektor identifiziert. ⓘ
Ende der 1960er Jahre und Anfang der 1970er Jahre stellte Scott B. Halstead seine Hypothese zu infektionsverstärkenden Antikörpern auf, die besagt, dass eine Zweitinfektion gefährlicher sein kann als eine Erstinfektion. 1970 wurde durch Isolation eines Virus aus einem Menschen die Hypothese bestätigt, dass silvatische Erreger auch Menschen infizieren können. ⓘ
Denguefieber wurde von der US-amerikanischen Regierung als potentielle biologische Waffe untersucht. Dieses Programm wurde 1970 offiziell eingestellt. Dennoch wurden die Vereinigten Staaten beschuldigt, für den Ausbruch von Dengue im Jahr 1981 in Kuba verantwortlich zu sein. ⓘ
Die von privaten und öffentlichen Stellen finanzierte sogenannte Pediatric Dengue Vaccine Initiative versucht, einen sicheren Dengue-Virus-Impfstoff zu entwickeln. Verschiedene Impfstämme befanden sich in den klinischen Testphasen I, II und III. Der französische Pharmakonzern Sanofi Pasteur MSD hat im Oktober 2010 erklärt, bis 2015 einen Impfstoff zu entwickeln. Dieser tetravalente Impfstoff gegen alle vier bekannten Subtypen von Dengue ist in einer Phase-III-Studie 2015 getestet worden. Andere Forscher versuchten mit Hilfe von Wolbachia die Übertragung zu stoppen. ⓘ
Als erstes mögliche Gegenmittel gegen das Dengue-Fieber haben Forschende bei der Überprüfung tausender Wirkstoff-Kandidaten durch Tests in Zellkulturen und an lebenden Mäusen einen Wirkstoff mit der Bezeichnung JNJ-A07 entdeckt, der das Dengue-Virus und die von diesem verursachte Erkrankungen effektiv bekämpfen und auch zur Vorbeugung eingesetzt werden kann. Der gefundene Hemmstoff blockiert dabei die Interaktion zwischen zwei Virenproteinen des Erregers, die für seine Replikation entscheidend sind, und verhindert damit seine Vermehrung. Bei Tests in Menschen- und Mosquito-Zellen hat sich gezeigt, dass „JNJ-A07“ sehr effektiv gegen alle vier Untergruppen des Dengue-Virus eingesetzt werden könnte. Laut dem Forscherteam sind bis zum Einsatz in der Praxis aber noch weitere Untersuchungen erforderlich. ⓘ
Die Forschungsanstrengungen zur Vorbeugung und Behandlung des Dengue-Fiebers umfassen verschiedene Methoden der Vektorkontrolle, die Entwicklung von Impfstoffen und antiviralen Medikamenten. ⓘ
Ein Impfstoffkandidat, TAK-003, hat in einer klinischen Studie mit mehr als 20 000 Kindern in endemischen Regionen eine Wirksamkeit von 73 % und bei hospitalisierten Patienten eine Wirksamkeit von 90 % gezeigt. ⓘ
Vektor
Im Rahmen der Vektorkontrolle wurde eine Reihe neuartiger Methoden angewandt, um die Zahl der Moskitos mit einigem Erfolg zu verringern, darunter das Aussetzen von Guppys (Poecilia reticulata) oder Copepoden in stehendes Wasser, die die Moskitolarven fressen. Es gibt auch Versuche mit gentechnisch veränderten männlichen A. aegypti, die sich nach der Freisetzung in der freien Natur mit Weibchen paaren und deren Nachkommen flugunfähig machen. ⓘ
Wolbachia
Im Jahr 2021 infizierten Forscher in Yogyakarta, Indonesien, A. aegypti mit dem wMel-Stamm von Wolbachia pipientis. Die infizierten Stechmücken waren weniger anfällig für eine Infektion mit dem Dengue-Virus. Die Odds Ratio der Interventionscluster im Vergleich zu den Kontrollclustern betrug 0,23 (95% Konfidenzintervall [CI], 0,15 bis 0,35; P=0,004). ⓘ
Behandlung
Neben den Versuchen, die Ausbreitung der Aedes-Mücke einzudämmen, gibt es laufende Bemühungen, antivirale Medikamente zu entwickeln, die zur Behandlung von Dengue-Fieberanfällen und zur Verhinderung schwerer Komplikationen eingesetzt werden könnten. Die Entdeckung der Struktur der viralen Proteine könnte die Entwicklung wirksamer Medikamente erleichtern. Es gibt mehrere plausible Angriffspunkte. Der erste Ansatz ist die Hemmung der viralen RNA-abhängigen RNA-Polymerase (kodiert durch NS5), die das virale genetische Material kopiert, mit Nukleosid-Analoga. Zweitens könnte es möglich sein, spezifische Hemmstoffe für die virale Protease (NS3) zu entwickeln, die virale Proteine spleißt. Schließlich könnten Hemmstoffe entwickelt werden, die das Eindringen des Virus in die Zellen verhindern, oder Hemmstoffe des 5′-Capping-Prozesses, der für die virale Replikation erforderlich ist. ⓘ
Der Extrakt aus den Blättern der Carica Papaya wurde bereits untersucht und zur Behandlung und in Krankenhäusern eingesetzt. Ab 2020 haben Studien positive Auswirkungen auf klinische Blutparameter gezeigt, aber eine positive Wirkung auf den Krankheitsverlauf muss noch untersucht werden, und Papayablattextrakt wird nicht als Standardtherapie angesehen. ⓘ
Differentialdiagnose
Bei Verdacht auf Dengue-Fieber sollten andere virale (Influenza, Masern, Rubella, Chikungunyafieber, Gelbfieber und Japanische Enzephalitis) und bakterielle (Typhus, Leptospirose, Sepsis, Meningokokken und Rickettsien) Erkrankungen sowie Malaria ausgeschlossen werden. ⓘ
Nach Empfehlungen der WHO sollte das Blut eines Patienten mit Verdacht auf Denguefieber immer dann auf Antikörper gegen das Chikungunya-Virus untersucht werden, wenn eine Infektion mit Dengueviren nicht nachgewiesen werden kann und der Patient sich in einem Gebiet aufgehalten hat, in dem das Chikungunyafieber vorkommt. ⓘ
Meldepflicht
Dengue-Fieber ist in Österreich gemäß § 1 Abs. 1 Z 1 Epidemiegesetz 1950 bei Erkrankung und Tod anzeigepflichtig. Zur Anzeige verpflichtet sind unter anderen Ärzte und Labore (§ 3 Epidemiegesetz). ⓘ
In der Schweiz besteht Meldepflicht bei positiven laboranalytischen Befunden für die Erkrankung Dengue-Fieber bzw. für den Erreger Dengue-Virus durch Ärzte, Spitäler usw. bzw. durch das untersuchende Labor. Dies ergibt sich aus dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 bzw. Anhang 3 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. ⓘ
In Deutschland ist Denguefieber gemäß § 6 Infektionsschutzgesetz (IfSG) bei Verdacht auf ein virusbedingtes hämorrhagisches Fieber bzw. gemäß § 7 IfSG bei Nachweis des Krankheitserregers Dengue-Virus seitens des Arztes bzw. des Labors namentlich meldepflichtig. Meldepflichtig sind im zweiten Fall vor allem die Leitungen der Labore usw., nur bei hämorrhagischem Fieber auch der feststellende Arzt (§ 8 IfSG). ⓘ