Typhus
| Typhus ⓘ | |
|---|---|
| Andere Namen | Enterisches Fieber, langsames Fieber |
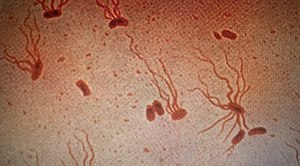 | |
| Erreger: Salmonella enterica serologische Variante Typhi (unter dem Mikroskop mit Geißelfärbung dargestellt) | |
| Symptome | Fieber, das niedrig beginnt und täglich ansteigt und bis zu 40,5 °C (104,9 °F) erreichen kann Kopfschmerzen, Schwäche und Müdigkeit, Muskelschmerzen, Schwitzen, trockener Husten, Appetitlosigkeit, Gewichtsverlust, Bauchschmerzen, Durchfall oder Verstopfung, Hautausschlag, geschwollener Bauch (vergrößerte Leber oder Milz) |
| Übliches Auftreten | 1-2 Wochen nach der Einnahme |
| Dauer | Normalerweise 7-10 Tage nach Beginn der Antibiotikabehandlung. Länger, wenn Komplikationen oder Arzneimittelresistenz auftreten. |
| Auslöser | Gastrointestinale Infektion mit Salmonella enterica serovar Typhi |
| Risikofaktoren | Leben in oder Reisen in Gebiete, in denen Typhus verbreitet ist, Arbeit als klinischer Mikrobiologe im Umgang mit Salmonella typhi-Bakterien, enger Kontakt mit einer Person, die infiziert ist oder kürzlich an Typhus erkrankt war, Trinken von Wasser, das mit Salmonella typhi verunreinigt ist |
| Vorbeugung | Durch Impfung vermeidbar. Reisenden in Regionen mit hoher Typhusprävalenz wird in der Regel empfohlen, sich vor der Reise impfen zu lassen. |
| Behandlung | Antibiotika, Flüssigkeitszufuhr, Operation in extremen Fällen. Quarantäne, um eine Ansteckung anderer zu vermeiden (in der heutigen Zeit nicht mehr üblich). |
| Vorhersage | Bei frühzeitiger Diagnose und Verabreichung geeigneter Antibiotika ist eine komplikationslose Genesung wahrscheinlich. Wenn der Erregerstamm multiresistent oder extensiv resistent gegen Medikamente ist, ist die Prognose schwieriger zu bestimmen.
Von den unbehandelten akuten Fällen scheiden 10 % noch drei Monate nach Auftreten der ersten Symptome Bakterien aus, und 2-5 % werden zu chronischen Typhus-Trägern. Einige Träger werden durch eine positive Gewebeprobe diagnostiziert. Chronische Träger sind per definitionem asymptomatisch. |
Typhus, auch als Typhus bekannt, ist eine Krankheit, die durch Bakterien des Salmonella-Serotyps Typhi verursacht wird. Die Symptome reichen von leicht bis schwer und beginnen in der Regel sechs bis 30 Tage nach der Exposition. Oft setzt das hohe Fieber über mehrere Tage hinweg allmählich ein. Dies wird häufig von Schwäche, Bauchschmerzen, Verstopfung, Kopfschmerzen und leichtem Erbrechen begleitet. Manche Menschen entwickeln einen Hautausschlag mit rosafarbenen Flecken. In schweren Fällen können die Betroffenen verwirrt sein. Ohne Behandlung können die Symptome Wochen oder Monate andauern. Durchfall kann schwerwiegend sein, ist aber ungewöhnlich. Andere Menschen können das Bakterium in sich tragen, ohne davon betroffen zu sein, aber sie können die Krankheit dennoch auf andere übertragen. Typhus ist eine Form des enterischen Fiebers, ebenso wie das paratyphische Fieber. Bislang ist nur bekannt, dass S. enterica Typhi den Menschen infiziert und sich in ihm vermehrt. ⓘ
Typhus wird durch das Bakterium Salmonella enterica subsp. enterica serovar Typhi verursacht, das im Darm, in den Peyerschen Flecken, den mesenterialen Lymphknoten, der Milz, der Leber, der Gallenblase, dem Knochenmark und dem Blut wächst. Typhus wird durch Essen oder Trinken von Lebensmitteln oder Wasser übertragen, die mit den Fäkalien einer infizierten Person verunreinigt sind. Zu den Risikofaktoren gehören begrenzter Zugang zu sauberem Trinkwasser und schlechte sanitäre Einrichtungen. Wer noch nicht mit dem Erreger in Berührung gekommen ist und verunreinigtes Trinkwasser oder Lebensmittel zu sich nimmt, ist am meisten gefährdet, Symptome zu entwickeln. Nur Menschen können infiziert werden; es gibt keine bekannten tierischen Reservoire. ⓘ
Die Diagnose erfolgt durch Kultivierung und Identifizierung von S. enterica Typhi aus Patientenproben oder durch den Nachweis einer Immunreaktion auf den Erreger in Blutproben. In jüngster Zeit haben neue Fortschritte in der groß angelegten Datenerfassung und -analyse es den Forschern ermöglicht, bessere Diagnosemethoden zu entwickeln, wie z. B. den Nachweis veränderter Mengen kleiner Moleküle im Blut, die spezifisch auf Typhus hinweisen können. In den Regionen, in denen Typhus am häufigsten vorkommt, sind die Diagnosemöglichkeiten in Bezug auf Genauigkeit und Spezifität recht begrenzt, und auch die für eine ordnungsgemäße Diagnose erforderliche Zeit, die zunehmende Verbreitung von Antibiotikaresistenzen und die Kosten für die Tests stellen für die unterfinanzierten Gesundheitssysteme ein Problem dar. ⓘ
Ein Typhus-Impfstoff kann in den ersten zwei Jahren etwa 40 bis 90 % der Fälle verhindern. Der Impfstoff kann bis zu sieben Jahre lang eine gewisse Wirkung haben. Für Personen mit hohem Risiko oder Personen, die in Gebiete reisen, in denen die Krankheit häufig vorkommt, wird eine Impfung empfohlen. Weitere Maßnahmen zur Vorbeugung der Krankheit sind die Bereitstellung von sauberem Trinkwasser, gute sanitäre Einrichtungen und Händewaschen. Solange eine Infektion nicht bestätigt ist, sollte die infizierte Person keine Lebensmittel für andere zubereiten. Typhus wird mit Antibiotika wie Azithromycin, Fluorchinolonen oder Cephalosporinen der dritten Generation behandelt. Gegen diese Antibiotika haben sich Resistenzen entwickelt, die die Behandlung erschweren. ⓘ
Im Jahr 2015 wurden 12,5 Millionen neue Typhusfälle gemeldet. Am häufigsten tritt die Krankheit in Indien auf. Kinder sind am häufigsten betroffen. In den 1940er Jahren ging die Zahl der Typhusfälle in den Industrieländern aufgrund verbesserter sanitärer Einrichtungen und des Einsatzes von Antibiotika zurück. Jedes Jahr werden in den USA etwa 400 Fälle gemeldet, und schätzungsweise 6.000 Menschen sind an Typhus erkrankt. Im Jahr 2015 gab es weltweit etwa 149.000 Todesfälle - gegenüber 181.000 im Jahr 1990. Ohne Behandlung kann das Sterberisiko bis zu 20 % betragen. Mit Behandlung liegt es zwischen 1 % und 4 %. ⓘ
Typhus ist eine andere Krankheit. Aufgrund ihrer ähnlichen Symptome wurden sie bis in die 1800er Jahre nicht als eigenständige Krankheiten anerkannt. "Typhus" bedeutet "typhusähnlich". ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| A01.0 | Typhus abdominalis |
| ICD-10 online (WHO-Version 2019) | |
Typhus oder Typhus abdominalis (auch Abdominaltyphus, deutsch Bauchtyphus, auch Unterleibstyphus, typhoides Fieber oder enterisches Fieber, früher auch „Nervenfieber“ genannt) ist eine systemische Infektionskrankheit, die durch das Bakterium Salmonella enterica ssp. enterica Serovar Typhi hervorgerufen wird. Aus praktischen Gründen wird häufig der alte Name Salmonella Typhi verwendet. Der zweite Name Typhi wird dabei groß geschrieben, weil es sich nicht um einen Artnamen handelt, sondern um ein Serovar. ⓘ
Der Krankheitsverlauf ist vor allem durch hohes Fieber gekennzeichnet. Unbehandelt kann die Krankheit gefährlich verlaufen und zum Tode führen. In Deutschland, Österreich und in der Schweiz ist Typhus meldepflichtig. ⓘ
Als Paratyphus bezeichnet man hingegen ein dem Typhus ähnelndes abgeschwächtes Krankheitsbild, dessen Erreger nicht Salmonella Typhi, sondern Salmonella Paratyphi ist. ⓘ
In älteren Texten und im Englischen bezeichnet Typhus das Fleckfieber. ⓘ
Krankheitsstadien
Die Inkubationszeit beträgt, in Abhängigkeit von der Menge der aufgenommenen Erreger, in der Regel 1–3 Wochen, Extremwerte können jedoch auch zwischen 3 und 60 Tagen liegen. ⓘ
1. Woche (Stadium incrementi): Es kommt zunächst zu unspezifischen Allgemeinsymptomen wie Mattigkeit, Kopfschmerzen, Verstopfung sowie zu einem treppenförmigen Fieberanstieg. ⓘ
2.–3. Woche (Stadium fastigii): Nach ca. 8 Tagen wird ein Stadium von anhaltendem hohen Fieber erreicht (Fieberkontinuum mit 40 bis 41 °C), das über Wochen andauern kann. Bei einigen Patienten findet sich nur das hohe Fieber, öfter ist es aber von unspezifischen, sich langsam entwickelnden Allgemeinsymptomen begleitet. Typische Veränderungen finden sich jedoch seltener. Mögliche Symptome sind:
- Müdigkeit und Abgeschlagenheit, Kopfschmerzen, unproduktiver Husten, allgemeines abdominales Unwohlsein.
- Durchfall und Verstopfung können gelegentlich auftreten.
- Relative Bradykardie, also ein für Fieber ungewöhnlich langsamer Herzschlag. Fieber geht sonst häufig mit einem schnelleren Herzschlag (Tachykardie) einher.
- Mangel an weißen Blutkörperchen (Leukopenie). Dies ist bei einer bakteriellen Infektion ebenfalls die Ausnahme. Ebenso kann aber auch eine Leukozytose auftreten, eine erhöhte Konzentration an weißen Blutkörperchen. Dazu können eine Thrombozytopenie und eine Anämie vorliegen.
- Hinzu kommen bisweilen Bewusstseinsstörungen (daher der Name)
- Es kann selten zu einer Hepatomegalie (Leberschwellung) mit gering erhöhten Leberwerten im Labor (Transaminasenanstieg) und zu einer Splenomegalie (Milzschwellung, früher auch „Milztumor“ genannt) kommen.
- Ein rosa-rötlicher fleckförmiger Hautausschlag (Roseolen) am Rumpf und an Armen und Beinen ist selten, nur kurzzeitig sichtbar, aber typisch. Diesen Typhus exanthematicus, der im 16. Jahrhundert in ganz Europa auftrat, hat zuerst Girolamo Fracastoro 1546 beschrieben.
- Typisch und selten ist auch die sogenannte Typhuszunge, die in der Mitte deutlich grau-weißlich belegt ist, an den Rändern und der Zungenspitze jedoch freie rote Ränder zeigt. ⓘ
Im Verlauf der Erkrankung kann es unbehandelt zu schweren Komplikationen kommen:
- Durch die Zerstörung der Peyer-Plaques im Dünndarm, über die die Erreger in die Blutbahn gelangen, kann es zu einem charakteristischen erbsenbreiartigen Durchfall kommen, der erst nach etwa 14 Tagen auftritt, aber auch völlig fehlen kann. Dabei können starke Schmerzen im Nierenbereich und Unterbauch einsetzen.
- Gastrointestinale Blutungen können ebenfalls durch die Zerstörung der Peyer-Plaques ausgelöst werden
- Darmperforationen können durch eine nekrotisierende Lymphadenitis entstehen und haben eine sehr hohe Letalität, weshalb eine sofortige chirurgische Intervention bei Verdacht auf Perforation notwendig ist.
Auch Abszesse, Bronchopneumonie und Meningitis können auftreten. ⓘ
Auslöser

Bakterien
Das gramnegative Bakterium, das Typhus verursacht, ist Salmonella enterica subsp. enterica serovar Typhi. Auf der Grundlage des MLST-Subtypisierungsschemas sind die beiden wichtigsten Sequenztypen von S. Typhi ST1 und ST2, die weltweit verbreitet sind. Eine globale phylogeografische Analyse zeigte die Dominanz des Haplotyps 58 (H58), der wahrscheinlich in den späten 1980er Jahren in Indien entstanden ist und sich nun weltweit mit einer Multidrogenresistenz ausbreitet. Im Jahr 2016 wurde ein detaillierteres Genotypisierungsschema vorgestellt, das nun weithin verwendet wird. Mit diesem Schema wurde die Nomenklatur von H58 in den Genotyp 4.3.1 umklassifiziert. ⓘ
Übertragung
Im Gegensatz zu anderen Salmonellenstämmen sind keine tierischen Träger von Typhus bekannt. Der Mensch ist der einzige bekannte Träger des Bakteriums. S. enterica subsp. enterica serovar Typhi wird über den fäkal-oralen Weg von infizierten Menschen und von asymptomatischen Trägern des Bakteriums übertragen. Ein asymptomatischer menschlicher Träger ist jemand, der ein Jahr nach dem akuten Stadium der Infektion immer noch Typhusbakterien in seinem Stuhl ausscheidet. ⓘ

Diagnose
Die Stellung der Diagnose stützt sich auf die typische Klinik, die Anamnese (Reise in tropische Regionen, vor allem Indien, Nepal und Indonesien) und labormedizinische und bakteriologische Befunde. ⓘ
Der bakteriologische Erregernachweis gelingt mithilfe von Blutkulturen in den ersten zwei Wochen der Krankheit nur in 40 % der Fälle, bei Stuhl- und Urinkulturen ist die Sensitivität noch niedriger. Stuhlproben können nur im frühesten Erkrankungsstadium und nach zwei Wochen positiv ausfallen, haben aber eine geringe Sensitivität. ⓘ
Die vom Immunsystem des Organismus gebildeten Antikörper, die sich gegen spezielle Bakterienantigene richten (Antikörper gegen O/h Antigen), lassen sich etwa ab Ende der ersten Krankheitswoche serologisch mithilfe der Gruber-Widal-Reaktion nachweisen. Erst ab der dritten Krankheitswoche werden hohe Titer an Antikörpern erreicht (1:400–800). Bei initial begonnener Therapie mit Antibiotika kann der Nachweis von Antikörpern misslingen. Zudem können sich falsch-positive Werte finden, weil beispielsweise in Endemiegebieten bereits früher eine Infektion vorlag. ⓘ
Daher muss bei ausreichendem klinischen Verdacht eine Therapie umgehend und auch ohne Erregernachweis empirisch erfolgen. ⓘ
Die Diagnose wird durch Blut-, Knochenmark- oder Stuhlkulturen sowie durch den Widal-Test (Nachweis von Antikörpern gegen die Salmonella-Antigene O-somatisch und H-flagellar) gestellt. In Epidemien und weniger wohlhabenden Ländern wird nach Ausschluss von Malaria, Ruhr oder Lungenentzündung in der Regel eine therapeutische Probezeit mit Chloramphenicol durchgeführt, bis die Ergebnisse des Widal-Tests und der Blut- und Stuhlkulturen vorliegen. ⓘ
Widal-Test
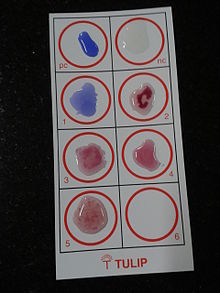
Der Widal-Test dient dem Nachweis spezifischer Antikörper im Serum von Typhuskranken unter Ausnutzung von Antigen-Antikörper-Wechselwirkungen. ⓘ
Bei diesem Test wird das Serum mit einer toten Bakteriensuspension von Salmonellen mit spezifischen Antigenen vermischt. Wenn das Serum des Patienten Antikörper gegen diese Antigene enthält, lagern sie sich an diese an und verklumpen. Kommt es nicht zur Verklumpung, ist der Test negativ. Der Widal-Test ist zeitaufwändig und neigt zu erheblichen falsch-positiven Ergebnissen. Außerdem kann er bei kürzlich infizierten Personen falsch negativ ausfallen. Doch im Gegensatz zum Typhidot-Test quantifiziert der Widal-Test die Probe mit Titern. ⓘ
Diagnostische Schnelltests
Schnelldiagnosetests wie Tubex, Typhidot und Test-It haben eine mäßige diagnostische Genauigkeit gezeigt. ⓘ
Typhidot
Typhidot basiert auf dem Vorhandensein von spezifischen IgM- und IgG-Antikörpern gegen ein spezifisches 50Kd OMP-Antigen. Dieser Test wird auf einer Zellulosenitratmembran durchgeführt, an der ein spezifisches S. typhi Außenmembranprotein als fixierte Testlinien angebracht ist. Er weist IgM- und IgG-Antikörper separat nach. IgM zeigt eine kürzlich erfolgte Infektion an; IgG weist auf eine weit zurückliegende Infektion hin. ⓘ
Das Probenpad dieses Kits enthält kolloidales Gold-Antihuman-IgG oder Gold-Antihuman-IgM. Wenn die Probe IgG- und IgM-Antikörper gegen diese Antigene enthält, reagieren sie und färben sich rot. Der Typhidot-Test wird innerhalb von 2-3 Tagen nach der Infektion positiv. ⓘ
Zwei farbige Banden zeigen einen positiven Test an. Eine einzelne Kontrollbande zeigt einen negativen Test an. Eine einzelne erste feste Linie oder gar keine Bande zeigt einen ungültigen Test an. Die größte Einschränkung des Typhidot-Tests ist, dass er nicht quantitativ ist, sondern nur positiv oder negativ. ⓘ
Tubex-Test
Der Tubex-Test enthält zwei Arten von Partikeln: braune, mit Antigen beschichtete Magnetpartikel und blaue, mit O9-Antikörpern beschichtete Indikatorpartikel. Wenn während des Tests Antikörper im Serum vorhanden sind, lagern sie sich an die braunen magnetischen Partikel an und setzen sich am Boden ab, während die blauen Indikatorpartikel in der Lösung verbleiben und eine blaue Farbe erzeugen, was bedeutet, dass der Test positiv ist. ⓘ
Wenn das Serum keine Antikörper enthält, lagern sich die blauen Partikel an die braunen Partikel an und setzen sich am Boden ab, so dass eine farblose Lösung entsteht, was bedeutet, dass der Test negativ ist. ⓘ
Vorbeugung

Sauberkeit und Hygiene sind wichtig, um Typhus zu verhindern. Typhus kann sich nur dort ausbreiten, wo menschliche Fäkalien mit Lebensmitteln oder Trinkwasser in Berührung kommen können. Die sorgfältige Zubereitung von Lebensmitteln und das Waschen der Hände sind entscheidend, um Typhus zu verhindern. Die Industrialisierung trug wesentlich zur Ausrottung von Typhus bei, da sie die Gefahren für die öffentliche Gesundheit beseitigte, die mit der Lagerung von Pferdemist auf öffentlichen Straßen verbunden waren, was zu einer großen Anzahl von Fliegen führte, die Überträger vieler Krankheitserreger sind, einschließlich Salmonella spp. Laut Statistiken der US-Zentren für Krankheitskontrolle und -prävention hat die Chlorierung von Trinkwasser zu einem dramatischen Rückgang der Typhusübertragung geführt. ⓘ
Impfung
Zwei Typhusimpfstoffe sind zur Prävention von Typhus zugelassen: der orale Ty21a-Lebendimpfstoff (vertrieben als Vivotif von Crucell Switzerland AG) und der injizierbare Typhus-Polysaccharid-Impfstoff (vertrieben als Typhim Vi von Sanofi Pasteur und Typherix von GlaxoSmithKline). Beide sind wirksam und werden für Reisende in Gebiete empfohlen, in denen Typhus endemisch ist. Auffrischungen werden für den Schluckimpfstoff alle fünf Jahre und für die injizierbare Form alle zwei Jahre empfohlen. Ein älterer, abgetöteter Ganzzellimpfstoff wird noch in Ländern verwendet, in denen die neueren Präparate nicht verfügbar sind. Dieser Impfstoff wird jedoch nicht mehr empfohlen, da er mehr Nebenwirkungen hat (hauptsächlich Schmerzen und Entzündungen an der Injektionsstelle). ⓘ

Um die Typhusrate in Entwicklungsländern zu senken, hat die Weltgesundheitsorganisation (WHO) ab 1999 ein Impfprogramm empfohlen. Die Impfung hat sich bei der Bekämpfung von Ausbrüchen in Gebieten mit hoher Inzidenz als wirksam erwiesen und ist zudem sehr kosteneffizient: Die Preise liegen normalerweise unter 1 US-Dollar pro Dosis. Da der Preis niedrig ist, sind arme Gemeinden eher bereit, die Impfungen in Anspruch zu nehmen. Obwohl sich Impfprogramme gegen Typhus als wirksam erwiesen haben, können sie allein Typhus nicht beseitigen. Die Kombination von Impfstoffen mit Maßnahmen des öffentlichen Gesundheitswesens ist die einzige bewährte Methode zur Bekämpfung dieser Krankheit. ⓘ
Seit den 1990er Jahren empfiehlt die WHO zwei Typhusimpfstoffe. Der ViPS-Impfstoff wird als Injektion verabreicht, der Ty21a-Impfstoff in Form von Kapseln. Eine Impfung mit dem ViPS-Impfstoff wird nur für Personen über zwei Jahren empfohlen und erfordert eine Auffrischungsimpfung nach zwei bis drei Jahren, wobei die Wirksamkeit 55 % bis 72 % beträgt. Der Ty21a-Impfstoff wird für Personen ab fünf Jahren empfohlen und hat eine Wirksamkeit von 51%-67%, die 5-7 Jahre anhält. Die beiden Impfstoffe haben sich bei der Bekämpfung von Epidemien in mehreren Regionen als sicher und wirksam erwiesen. ⓘ
Eine Version des Impfstoffs in Kombination mit einem Hepatitis-A-Impfstoff ist ebenfalls erhältlich. ⓘ
Die Ergebnisse einer Phase-3-Studie mit dem Typhus-Konjugatimpfstoff (TCV) vom Dezember 2019 zeigen, dass 81 % weniger Fälle bei Kindern auftreten. ⓘ
Hygiene ist der beste Schutz. Dazu zählt auch häufiges Händewaschen. Die auf Tropenreisen üblichen Maßnahmen, wie beispielsweise der Verzicht auf unzureichend gegarte Speisen, Säfte, Eiswürfel und Leitungswasser, sollten auf jeden Fall beachtet werden („cook it, peel it or leave it“ – „Koche es, schäle es, oder lass es liegen“). ⓘ
Eine Impfprophylaxe gegen Typhus kann sowohl mit Tot- als auch mit Lebendimpfstoffen durchgeführt werden. Der Lebendimpfstoff (Vivotif; in Deutschland Typhoral) enthält nicht-krankheitserregende (apathogene) Salmonella-Typhi-Bakterien, die das Immunsystem zur Bildung von schützenden Antikörpern anregen. Der Lebendimpfstoff wird oral in magensaftresistenten Kapseln verabreicht, ist gut verträglich und schützt etwa 60 Prozent der Impflinge in Endemiegebieten für mindestens ein Jahr. Bei Mehrfachreisenden wird eine Auffrischimpfung nach einem Jahr empfohlen. Der Totimpfstoff enthält ein Polysaccharid der Kapsel von Salmonella Typhi, welches ebenfalls beim Impfling zur Bildung von Antikörpern führt. Der Impfstoff wird intramuskulär oder subkutan appliziert, ist gut verträglich und bietet etwa 60 Prozent der Geimpften einen Schutz für maximal drei Jahre. ⓘ
Behandlung

Die möglichst frühzeitig zu beginnende Therapie der Typhusinfektion erfolgt mit Antibiotika. Vor Beginn der Therapie werden Blut- und Stuhlproben entnommen, um den Erreger nachzuweisen und – nach gelungener Anzucht des Erregers – eine Resistenzbestimmung gegenüber gebräuchlichen Antibiotika durchzuführen. Antibiotika der Wahl bei Erwachsenen sind neuere Chinolon-Antibiotika wie Ciprofloxacin oder Ofloxacin für sieben bis zehn Tage. Da Salmonella Typhi ein intrazellulärer Erreger ist, kommt es meist nicht zu einer sofortigen Fiebersenkung und Symptomverbesserung, das Fieber kann noch mehrere Tage anhalten, was aber nicht auf eine falsche Antibiotika-Wahl hinweist. ⓘ
Alternativ kann bei voll sensiblen Stämmen auch Amoxicillin oder Cotrimoxazol und bei Sorge um eine Resistenz gegen Chinolon-Antibiotika, wie bei Rückkehrern aus Indien, Pakistan oder Bangladesch, sollte Azithromycin eingesetzt werden. ⓘ
Bei schwerer Erkrankung sollte eine intravenöse Antibiose mit einem Cephalosporin der 3. Generation, z. B. mit Ceftriaxon für ein bis zwei Wochen durchgeführt werden. ⓘ
Falls die genannten Substanzen aufgrund von Gegenanzeigen nicht eingesetzt werden können oder die Erreger resistent sind, kann die Therapie mit Cefixim, Ampicillin, Cotrimoxazol oder Chloramphenicol durchgeführt werden. Insbesondere gegen die drei zuletzt genannten Wirkstoffe bestehen jedoch ebenfalls häufig Resistenzen. ⓘ
Bei schwerer Erkrankung und Bewusstseinsstörung oder Enzephalopathie kann eine hochdosierte Dexamethason-Gabe die Mortalität senken. ⓘ
Orale Rehydratationstherapie
Die Wiederentdeckung der oralen Rehydratationstherapie in den 1960er Jahren bot eine einfache Möglichkeit, viele Todesfälle durch Durchfallerkrankungen im Allgemeinen zu verhindern. ⓘ
Antibiotika
Bei seltenen Resistenzen ist die Behandlung der Wahl ein Fluorchinolon wie Ciprofloxacin. Ansonsten ist ein Cephalosporin der dritten Generation wie Ceftriaxon oder Cefotaxim die erste Wahl. Cefixim ist eine geeignete orale Alternative. ⓘ
Richtig behandelt, ist Typhus in den meisten Fällen nicht tödlich. Antibiotika wie Ampicillin, Chloramphenicol, Trimethoprim-Sulfamethoxazol, Amoxicillin und Ciprofloxacin werden in der Regel zur Behandlung eingesetzt. Die Behandlung mit Antibiotika senkt die Sterblichkeitsrate auf etwa 1 %. ⓘ
Ohne Behandlung entwickeln einige Patienten anhaltendes Fieber, Bradykardie, Hepatosplenomegalie, abdominelle Symptome und gelegentlich eine Lungenentzündung. Bei weißhäutigen Patienten treten in bis zu 20 % der Fälle rosa Flecken auf der Haut des Rumpfes auf, die bei Druck verblassen. In der dritten Woche können unbehandelte Fälle gastrointestinale und zerebrale Komplikationen entwickeln, die in 10-20 % der Fälle tödlich verlaufen können. Die höchste Sterblichkeitsrate ist bei Kindern unter 4 Jahren zu verzeichnen. Etwa 2-5 % der an Typhus Erkrankten werden zu chronischen Trägern, da die Bakterien nach Abklingen der Symptome in den Gallenwegen verbleiben. ⓘ
Chirurgie
Eine Operation ist in der Regel angezeigt, wenn es zu einer Darmperforation kommt. Eine Studie ergab eine 30-Tage-Sterblichkeitsrate von 9 % (8/88) und Infektionen an der Operationsstelle von 67 % (59/88), wobei die Krankheitslast vor allem von Ländern mit geringen Ressourcen getragen wird. ⓘ
Bei der chirurgischen Behandlung bevorzugen die meisten Chirurgen einen einfachen Verschluss der Perforation mit Drainage des Peritoneums. Bei Patienten mit multiplen Perforationen ist eine Dünndarmresektion angezeigt. Wenn eine Antibiotikabehandlung die hepatobiliäre Übertragung nicht beseitigt, sollte die Gallenblase entfernt werden. Die Cholezystektomie ist manchmal erfolgreich, vor allem bei Patienten mit Gallensteinen, führt aber nicht immer zur Beseitigung des Trägers, da die Leberinfektion bestehen bleibt. ⓘ
Resistenz
Da Resistenzen gegen Ampicillin, Chloramphenicol, Trimethoprim-Sulfamethoxazol und Streptomycin inzwischen weit verbreitet sind, werden diese Mittel nicht mehr als Erstbehandlung von Typhus eingesetzt. Typhus, der gegen diese Mittel resistent ist, wird als multiresistenter Typhus bezeichnet. ⓘ
Die Ciprofloxacin-Resistenz ist ein zunehmendes Problem, insbesondere auf dem indischen Subkontinent und in Südostasien. Viele Zentren wechseln von Ciprofloxacin zu Ceftriaxon als erste Wahl bei der Behandlung von Typhusverdacht aus Südamerika, Indien, Pakistan, Bangladesch, Thailand oder Vietnam. Es gibt auch Hinweise darauf, dass Azithromycin bei der Behandlung von resistentem Typhus besser geeignet ist als Fluorchinolone und Ceftriaxon. Azithromycin kann durch den Mund eingenommen werden und ist kostengünstiger als Ceftriaxon, das durch eine Injektion verabreicht wird. ⓘ
Ein gesondertes Problem besteht bei der Laboruntersuchung auf verminderte Empfindlichkeit gegenüber Ciprofloxacin; die derzeitigen Empfehlungen lauten, dass Isolate gleichzeitig gegen Ciprofloxacin (CIP) und gegen Nalidixinsäure (NAL) getestet werden sollten, dass Isolate, die sowohl gegen CIP als auch gegen NAL empfindlich sind, als "empfindlich gegenüber Ciprofloxacin" gemeldet werden sollten, und dass Isolate, die zwar gegen CIP, nicht aber gegen NAL empfindlich sind, als "verminderte Empfindlichkeit gegenüber Ciprofloxacin" gemeldet werden sollten. Eine Analyse von 271 Isolaten ergab jedoch, dass etwa 18 % der Isolate mit einer verminderten Empfindlichkeit gegenüber Fluorchinolonen, der Klasse, zu der CIP gehört (MHK 0,125-1,0 mg/l), mit dieser Methode nicht erkannt würden. ⓘ
Epidemiologie
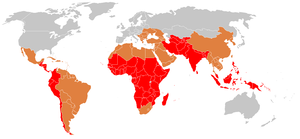
Im Jahr 2000 verursachte Typhus schätzungsweise 21,7 Millionen Krankheitsfälle und 217.000 Todesfälle. Am häufigsten erkranken Kinder und junge Erwachsene im Alter zwischen 5 und 19 Jahren. Im Jahr 2013 gab es etwa 161.000 Todesfälle - gegenüber 181.000 im Jahr 1990. Säuglinge, Kinder und Jugendliche in Süd-, Zentral- und Südostasien weisen die höchsten Typhusraten auf. Ausbrüche werden auch häufig aus Afrika südlich der Sahara und Südostasien gemeldet. Im Jahr 2000 traten mehr als 90 % der Morbidität und Mortalität aufgrund von Typhus in Asien auf. In den USA treten jedes Jahr etwa 400 Fälle auf, von denen 75 % auf internationalen Reisen erworben werden. ⓘ
Vor der Ära der Antibiotika lag die Sterblichkeitsrate bei Typhus bei 10-20 %. Heute liegt sie bei rechtzeitiger Behandlung unter 1 %, aber 3-5 % der Infizierten entwickeln eine chronische Infektion der Gallenblase. Da S. enterica subsp. enterica serovar Typhi auf den Menschen beschränkt ist, werden diese chronischen Träger zum entscheidenden Reservoir, das jahrzehntelang für die weitere Ausbreitung der Krankheit bestehen kann, was ihre Identifizierung und Behandlung weiter erschwert. In jüngster Zeit hat die Untersuchung von S. enterica subsp. enterica serovar Typhi im Zusammenhang mit einem großen Ausbruch und einem Träger auf Genomebene neue Einblicke in die Pathogenese des Erregers ermöglicht. ⓘ
In den Industrieländern ist die Zahl der Typhusfälle durch Verbesserungen der Wasserhygiene und der Lebensmittelverarbeitung zurückgegangen. In den Entwicklungsländern, beispielsweise in Teilen Asiens und Afrikas, sind die Raten am höchsten. In diesen Gebieten gibt es keinen Zugang zu sauberem Wasser, angemessenen sanitären Anlagen und geeigneten Gesundheitseinrichtungen. In diesen Gebieten ist in naher Zukunft nicht damit zu rechnen, dass ein solcher Zugang zu den Grundbedürfnissen des Gesundheitswesens möglich sein wird. ⓘ
In den Jahren 2004 und 2005 führte ein Ausbruch in der Demokratischen Republik Kongo zu mehr als 42.000 Fällen und 214 Todesfällen. Seit November 2016 gibt es in Pakistan einen Ausbruch von extensiv arzneimittelresistentem Typhus (XDR). ⓘ
In Europa meldeten 22 EU-/EWR-Länder laut einem Bericht über die Verteilung der bestätigten Typhus- und Paratyphusfälle, der auf Daten des Europäischen Überwachungssystems (TESSy) für 2017 basiert, insgesamt 1 098 Fälle, von denen 90,9 % reisebedingt waren und hauptsächlich bei Reisen nach Südasien erworben wurden. ⓘ
Heutzutage ist Typhus vor allem ein Problem der Entwicklungsländer mit unzureichenden hygienischen Bedingungen. Betroffen sind Mittel- und Südamerika, die Karibik, Afrika und Asien, dort vor allem Südasien. Nach einer neueren Schätzung von 2014 erkranken jährlich etwa 11,9 Millionen Menschen an Typhus, und es sterben 129.000 Menschen. ⓘ
In Nordamerika und Europa kommt es nur noch selten zu Typhus-Erkrankungen, wenige Hundert werden jährlich in den USA gemeldet. Davon sind etwa 90 % von Fernreisenden eingeschleppt, mehrheitlich aus Indien, Pakistan und Bangladesch. Dort finden sich zugleich auch hohe Raten von Antibiotika-Resistenz. So konnten bei mehr als 90 % der infizierten zurückkehrenden Amerikaner eine Resistenz oder intermediäre Sensibilität gegen Ciprofloxazin nachgewiesen werden. 2016 kam es in Deutschland zu 60 nachgewiesenen Fällen, 2017 zu 78, 2018 wurden 58 Erkrankungen verzeichnet und 2019 stieg die Zahl auf 84. ⓘ
Geschichte
Über die Infektionsherde für Typhus war man sich lange Zeit im Unklaren. Nach der verheerenden Choleraepidemie in Hamburg 1892 und der Typhusepidemie in Gelsenkirchen 1901 schenkte man aber dem Trinkwasser als Verbreitungsweg ansteckender Krankheiten erhöhte Aufmerksamkeit. ⓘ
Der Südwesten Deutschlands, in dem Typhus überdurchschnittlich stark verbreitet war, wurde gegen Ende des 19. Jahrhunderts Versuchsgebiet der Medizin. Malstatt-Burbach, Ottweiler und Hülzweiler etwa waren in den 1880er- und 1890er-Jahren Schauplätze größerer Epidemien, bei denen zahlreiche Menschen starben. Neben den im Bergbau beschäftigten Menschen, die meist unter hygienisch bedenklichen Verhältnissen in überbelegten Quartieren hausten, war auch das Militär gefährdet. So starben im Jahre 1898 40 Soldaten des 8. Rheinischen Infanterie-Regiments Nr. 70 in Saarbrücken an Typhus, den ein Mannschaftskoch verbreitet hatte. Er hatte einen Kartoffelsalat zubereitet, nachdem er zuvor eine Kloake gesäubert und sich dann die Hände nicht gründlich genug gereinigt hatte. Bei der Typhusepidemie von Lebach im Saarland erkrankten im Winter 1902/1903 mehr als 50 Menschen. ⓘ
Da man davon ausging, dass die Kreisärzte allein nicht in der Lage sein könnten, umfassende Untersuchungen über diese Seuchen anzustellen, wurde die Untersuchungskommission eingesetzt, die aus Fachleuten des Reichsgesundheitsamts und des Instituts für Infektionskrankheiten in Berlin bestand. Zunächst im Trierer Raum tätig, wurde diese Kommission 1902 erweitert. Teile des Regierungsbezirks Koblenz wurden neben dem Bezirk Trier untersucht, und in Saarbrücken wurde eine zweite Untersuchungsstation eingerichtet. Später wurde der Apparat noch deutlich erweitert. Hauptaufgabe war das Untersuchen verdächtigen Materials und das Nachvollziehen der Ausbreitungswege der Epidemien. Unterstützt wurde diese Arbeit durch das preußische Seuchenschutzgesetz vom 28. August 1905, eine Sonderanweisung bezüglich des Typhus aus dem Jahr 1906 und finanzielle Unterstützung durch die Reichsregierung. 1914 ging aus den bakteriologischen Untersuchungsstationen das Staatliche Institut für Hygiene und Infektionskrankheiten in Saarbrücken hervor. ⓘ
Hatten zunächst die hygienischen Verhältnisse in den Städten Anlass zur Sorge gegeben, traten um die Jahrhundertwende ländliche Ortschaften wie im Raum Lebach in den Vordergrund des Interesses der Behörden. Das Hauptaugenmerk der Mediziner galt der Wasser- und Abwasserbehandlung in den betroffenen Gebieten. Medizinalrat Schlecht aus Trier klagte etwa: „Die Zahl der Aborte ist gering, die Defäkation findet im Viehstall, auf der Düngerstätte vor dem Hause, im Garten hinter dem Hause, im Hofraum oder sogar im Keller statt. Eine ordnungsgemäße Abortgrube ist kaum zu finden; die Abortgruben werden selten geleert; der Abort und die Abortgrube befinden sich häufig in einem Zustand, der die Benutzung […] nicht zuläßt.“ Auch die Wasserversorgung gab Anlass zur Klage, da nicht nur zahlreiche Brunnen häufig verunreinigt waren, sondern wie im Falle der Lebacher Typhusepidemie viele Menschen ihr Trink- und Brauchwasser aus offenen Wasserläufen entnehmen mussten. ⓘ
Zwar wurden im Untersuchungszeitraum zwischen 1903 und 1914 in Südwestdeutschland zusätzliche 39 Krankenhäuser, davon 34 mit Isolierabteilungen, eingerichtet und 132 Desinfektionsapparate angeschafft sowie Desinfektoren und Gemeindeschwestern ausgebildet, hauptsächlich aber drang man auf eine hygienisch unbedenkliche Versorgung der Bevölkerung mit Wasser. Im Jahr 1900 wurden die Landräte darauf aufmerksam gemacht, dass ein Erlass bestand, der es der Polizei ermöglichte, zwangsweise den Bau von Wasserleitungen zu verfügen. 1904 wurden darüber hinaus die Kreisärzte verpflichtet, regelmäßige Ortsbesichtigungen vorzunehmen. Schließlich trat der Erlaß vom 23. April 1907, betreffend die Gesichtspunkte für Beschaffung eines brauchbaren, hygienisch einwandfreien Wassers in Kraft. ⓘ
Doch beispielsweise im Regierungsbezirk Trier bestand auch im Anschluss an die staatliche Typhusbekämpfungskampagne noch keine flächendeckende zentrale Wasserversorgung; die Verhältnisse besserten sich vorrangig in den größeren Ortschaften mit mehr als 1000 Einwohnern. Kleinere Ortschaften waren bei der Durchführung meist auf Finanzhilfe durch die Provinz oder die preußische Regierung angewiesen. Viele Gemeinden mussten daher noch jahrzehntelang auf eine zentrale Wasserversorgung warten. ⓘ
Auch verhielten sich traditionsbewusste Befürworter des alten Brunnensystems häufig ablehnend gegenüber der Planung einer zentralen Wasserversorgung; andere waren mit dem Anschluss ihres Grundstücks an eine zentrale Wasserversorgung zwar prinzipiell einverstanden, wollten jedoch gleichzeitig die Nutzung ihres bisherigen Brunnens nicht aufgeben. Der Fall der Witwe Wacht-Thiel aus Söst bei Saarburg, die ihr Vieh weiterhin mit Brunnenwasser tränken wollte, ging bis vor das Königlich Preußische Oberverwaltungsgericht in Trier. Auch einige Großbauern aus Berschweiler widersetzten sich der zwangsweisen Versorgung mit unbedenklichem Trinkwasser. Sie konnten tatsächlich die Erhebung der Gebühren weitgehend gerichtlich abwehren. Der Streit um die Erhebung von Gebühren für die Entnahme von Trinkwasser führte in einigen Gemeinden dazu, dass erst in den 1950er-Jahren Pauschalregelungen aufgehoben und Wasseruhren in den einzelnen Häusern installiert wurden. In Schwemlingen etwa geschah dies erst 1956. ⓘ
Frühe Beschreibungen
Bei der Pest von Athen während des Peloponnesischen Krieges handelte es sich höchstwahrscheinlich um einen Ausbruch von Typhus. Während des Krieges zogen sich die Athener in eine ummauerte Stadt zurück, um einem Angriff der Spartaner zu entgehen. Dieser massive Zustrom von Menschen auf engstem Raum überforderte die Wasserversorgung und die Abfallentsorgung, was wahrscheinlich zu unhygienischen Verhältnissen führte, da es immer schwieriger wurde, frisches Wasser zu erhalten und Abfälle zu sammeln und über die Stadtmauern hinaus zu entsorgen. Im Jahr 2006 ergab die Untersuchung der Überreste eines Massengrabes aus Athen aus der Zeit der Pest (~430 v. Chr.), dass DNA-Fragmente nachgewiesen wurden, die der heutigen S. Typhi-DNA ähneln, während Yersinia pestis (Pest), Rickettsia prowazekii (Typhus), Mycobacterium tuberculosis, Kuhpockenvirus und Bartonella henselae in keinem der untersuchten Überreste nachgewiesen wurden. ⓘ
Es ist möglich, dass der römische Kaiser Augustus Caesar entweder an einem Leberabszess oder an Typhus litt und überlebte, indem er Eisbäder und kalte Kompressen zur Behandlung seines Fiebers verwendete. Es gibt eine Statue des griechischen Arztes Antonius Musa, der sein Fieber behandelte. ⓘ
Definition und Nachweis der Übertragung
Den französischen Ärzten Pierre-Fidele Bretonneau und Pierre-Charles-Alexandre Louis kommt das Verdienst zu, Typhus als eine spezifische Krankheit beschrieben zu haben, die sich von Typhus unterscheidet. Beide Ärzte führten Autopsien an Personen durch, die in Paris an Fieber starben - und stellten fest, dass viele von ihnen Läsionen an den Peyer'schen Flecken aufwiesen, die mit eindeutigen Symptomen vor dem Tod korrelierten. Britische Mediziner waren skeptisch, was die Unterscheidung zwischen Typhus und Typhus anging, da beide zu dieser Zeit in Großbritannien endemisch waren. In Frankreich zirkulierte jedoch nur Typhus in der Bevölkerung. Pierre-Charlles-Alexandre Louis führte auch Fallstudien und statistische Analysen durch, um nachzuweisen, dass Typhus ansteckend war - und dass Personen, die bereits erkrankt waren, offenbar geschützt waren. Später bestätigten mehrere amerikanische Ärzte diese Ergebnisse, und Sir William Jenner überzeugte die verbliebenen Skeptiker davon, dass Typhus eine spezifische Krankheit ist, die an Läsionen in den Peyer'schen Flecken zu erkennen ist, indem er sechsundsechzig Autopsien von Fieberpatienten untersuchte und zu dem Schluss kam, dass die Symptome Kopfschmerzen, Durchfall, Hautausschlag und Bauchschmerzen nur bei Patienten auftraten, die nach dem Tod Darmläsionen aufwiesen; dies festigte die Assoziation der Krankheit mit dem Darmtrakt und gab den ersten Hinweis auf den Übertragungsweg. ⓘ
1847 erfuhr William Budd von einer Typhusepidemie in Clifton und stellte fest, dass alle 13 von 34 Einwohnern, die sich die Krankheit zugezogen hatten, ihr Trinkwasser aus demselben Brunnen bezogen. Bemerkenswert ist, dass diese Beobachtung zwei Jahre vor John Snow gemacht wurde, der den Weg des verunreinigten Wassers als Ursache für einen Choleraausbruch entdeckte. Budd wurde später Gesundheitsbeauftragter von Bristol und sorgte für eine saubere Wasserversorgung. Im Laufe seiner Karriere dokumentierte er weitere Beweise für Typhus als eine durch Wasser übertragene Krankheit. ⓘ
Ursache
Der polnische Wissenschaftler Tadeusz Browicz beschrieb 1874 einen kurzen Bazillus in den Organen und Fäkalien von Typhusopfern. Browicz konnte die Bazillen isolieren und züchten, ging aber nicht so weit, zu behaupten oder zu beweisen, dass sie die Krankheit verursachten. ⓘ
Im April 1880, drei Monate vor Eberths Veröffentlichung, beschrieb Edwin Klebs kurze und fadenförmige Bazillen in den Peyerschen Flecken bei Typhusopfern. Die Rolle des Bakteriums bei der Krankheit wurde vermutet, aber nicht bestätigt. ⓘ
Im Jahr 1880 beschrieb Karl Joseph Eberth einen Bazillus, den er als Ursache für Typhus vermutete. Eberth ist es zu verdanken, dass er das Bakterium endgültig entdeckte, indem er es aus 18 von 40 Typhusopfern isolierte, während er bei den "Kontrollopfern" anderer Krankheiten das Bakterium nicht fand. Im Jahr 1884 bestätigte der Pathologe Georg Theodor August Gaffky (1850-1918) Eberths Ergebnisse. Gaffky isolierte dasselbe Bakterium wie Eberth aus der Milz eines Typhusopfers und konnte es auf festen Nährböden züchten. Der Organismus erhielt Namen wie Eberths Bazillus, Eberthella Typhi und Gaffky-Eberth-Bazillus. Heute trägt der Bazillus, der Typhus verursacht, den wissenschaftlichen Namen Salmonella enterica serovar Typhi. ⓘ

Chlorierung von Wasser
In den meisten Industrieländern gingen die Typhusraten in der ersten Hälfte des 20. Jahrhunderts dank Impfungen und Fortschritten bei der öffentlichen Hygiene zurück. 1893 wurde in Hamburg (Deutschland) versucht, die Wasserversorgung zu chlorieren, und 1897 war Maidstone (England) die erste Stadt, die ihre gesamte Wasserversorgung chlorieren ließ. Im Jahr 1905 führte die Stadt Lincoln, England, nach einem Typhusausbruch eine permanente Chlorierung des Wassers ein. Die erste permanente Desinfektion von Trinkwasser in den USA wurde 1908 in der Wasserversorgung von Jersey City, New Jersey, vorgenommen. Die Entscheidung für den Bau des Chlorierungssystems wurde John L. Leal zugeschrieben. Die Chlorierungsanlage wurde von George W. Fuller entworfen. ⓘ
Ausbrüche bei reisenden Militärgruppen führten 1915 zur Entwicklung des Lyster-Bags, eines Beutels mit einem Wasserhahn, der an einem Baum oder einer Stange aufgehängt und mit Wasser gefüllt werden kann und dem eine Chlortablette beiliegt, die ins Wasser geworfen wird. Der Lyster-Beutel war für die amerikanischen Soldaten im Vietnamkrieg überlebenswichtig. ⓘ
Direkte Übertragung und Träger
Es gab mehrere Fälle, in denen Milchlieferanten in den Gemeinden, die sie belieferten, Typhus verbreiteten. Obwohl Typhus nicht durch die Milch selbst übertragen wird, gab es mehrere Beispiele dafür, dass Milchlieferanten vielerorts ihre Milch mit verunreinigtem Wasser verwässerten oder die Glasflaschen, in denen die Milch abgefüllt war, mit verunreinigtem Wasser reinigten. In Boston gab es um die Wende zum 20. Jahrhundert zwei solcher Fälle. Jahrhunderts. 1899 gab es 24 Typhusfälle, die auf einen einzigen Milchmann zurückgeführt wurden, dessen Frau eine Woche vor dem Ausbruch an Typhus gestorben war. Im Jahr 1908 starb J.J. Fallon, der ebenfalls Milchmann war, an Typhus. Nach seinem Tod und der Bestätigung der Typhusdiagnose führte die Stadt eine Untersuchung der Typhussymptome und -fälle entlang seiner Route durch und fand Hinweise auf einen signifikanten Ausbruch. Einen Monat nach Bekanntwerden des Ausbruchs veröffentlichte der Boston Globe eine kurze Erklärung, in der er den Ausbruch für beendet erklärte und feststellte: "In Jamaica Plain ist ein leichter Anstieg zu verzeichnen, die Gesamtzahl beträgt 272 Fälle. In der gesamten Stadt gibt es insgesamt 348 Fälle." Mindestens ein Todesfall wurde während dieses Ausbruchs gemeldet: Mrs. Sophia S. Engstrom, 46 Jahre alt. Im Laufe des Jahres 1908 wütete der Typhus vor allem im Viertel Jamaica Plain weiter, und es wurden mehrere weitere Todesfälle durch Typhus gemeldet, die jedoch nicht ausdrücklich mit dem Ausbruch in Verbindung gebracht wurden. Im Viertel Jamaica Plain lebten zu dieser Zeit viele arme Einwanderer aus der Arbeiterklasse, vor allem aus Irland. ⓘ
Die berüchtigtste Überträgerin von Typhus, aber keineswegs die tödlichste, war Mary Mallon, bekannt als Typhoid Mary. Obwohl zu dieser Zeit bereits andere Fälle von Typhusübertragungen von Mensch zu Mensch bekannt waren, war das Konzept eines asymptomatischen Überträgers, der in der Lage war, die Krankheit zu übertragen, nur eine Hypothese und noch nicht identifiziert oder bewiesen. Mary Mallon war das erste bekannte Beispiel eines asymptomatischen Trägers einer Infektionskrankheit, wodurch Typhus zur ersten bekannten Krankheit wurde, die durch asymptomatische Wirte übertragen werden konnte. Die von Mallon verursachten Fälle und Todesfälle betrafen hauptsächlich Familien der Oberschicht in New York City. Zu der Zeit, als Mallon als persönlicher Koch für Familien der Oberschicht arbeitete, wurden in New York City jährlich 3.000 bis 4.500 Fälle von Typhus gemeldet. Im Sommer 1906 erkrankten zwei Töchter einer wohlhabenden Familie und die in ihrem Haus arbeitenden Dienstmädchen an Typhus. Nachdem die Familie die Wasserquellen ihres Hauses untersucht und eine Verunreinigung des Wassers ausgeschlossen hatte, beauftragte sie den Bauingenieur George Soper mit der Untersuchung der möglichen Quelle von Typhus im Haus. Soper bezeichnete sich selbst als "Epidemiebekämpfer". Seine Untersuchung schloss viele Nahrungsquellen aus und führte ihn zu der Frage, ob die Köchin Mallon, die die Familie kurz vor dem Ausbruch des Typhus im Haushalt eingestellt hatte, die Ursache war. Da sie bereits abgereist war und eine andere Stelle angenommen hatte, machte er sich auf die Suche nach ihr, um eine Stuhlprobe zu erhalten. Als er Mallon schließlich persönlich kennenlernte, beschrieb er sie mit den Worten: "Mary hatte eine gute Figur und hätte man als sportlich bezeichnen können, wenn sie nicht ein wenig zu schwer gewesen wäre. In den Berichten über Sopers Verfolgung von Mallon scheint sein einziges Bedauern darin zu bestehen, dass er für seine unerbittliche Verfolgung und die Veröffentlichung ihrer persönlichen Daten nicht genug Anerkennung erhielt, indem er erklärte, dass die Medien "mir jegliche Anerkennung für die Entdeckung des ersten Typhus-Trägers, der in Amerika gefunden wurde, rauben". Letztendlich wurden 51 Fälle und 3 Todesfälle als von Mallon verursacht vermutet. ⓘ
1924 kam es in der Stadt Portland, Oregon, zu einem Ausbruch von Typhus mit 26 Fällen und 5 Todesfällen, die alle auf Darmblutungen zurückzuführen waren. Man kam zu dem Schluss, dass alle Fälle auf einen einzigen Milchbauern zurückzuführen waren, der große Mengen des Typhuserregers in seinem Urin ausscheidete. Eine falsche Identifizierung der Krankheit aufgrund ungenauer Widal-Testergebnisse verzögerte die Identifizierung des Erregers und eine angemessene Behandlung. Letztlich waren vier Proben verschiedener Sekrete von allen Milcharbeitern erforderlich, um den Erreger erfolgreich zu identifizieren. Nach der Entdeckung wurde der Milcharbeiter sieben Wochen lang zwangsweise unter Quarantäne gestellt, und es wurden regelmäßig Proben entnommen, wobei die Stuhlproben meist keinen Typhus ergaben und der Urin oft den Erreger enthielt. Der Erreger war 72 Jahre alt und schien bei bester Gesundheit zu sein und keine Symptome zu zeigen. Die pharmazeutische Behandlung verringerte die Menge der ausgeschiedenen Bakterien, die Infektion wurde jedoch nie vollständig aus dem Urin entfernt, und der Träger wurde entlassen, "mit der Anweisung, sich nie wieder mit Lebensmitteln für den menschlichen Verzehr zu befassen." Zum Zeitpunkt der Entlassung stellten die Autoren fest: "Da er seit mehr als fünfzig Jahren seinen Lebensunterhalt hauptsächlich durch das Melken von Kühen verdient und nur wenig andere Arbeit kennt, muss man davon ausgehen, dass strengste Überwachung notwendig sein wird, um sicherzustellen, dass er diese Tätigkeit nicht wieder aufnimmt." ⓘ
Zu Beginn des 20. Jahrhunderts begann die Ärzteschaft, Träger der Krankheit zu identifizieren und Beweise für eine von der Wasserverschmutzung unabhängige Übertragung zu finden. In einer Veröffentlichung der American Medical Association aus dem Jahr 1933 wird der Umgang der Ärzte mit asymptomatischen Trägern am besten durch die einleitende Zeile "Carriers of typhoid bacilli are a menace" zusammengefasst. In derselben Veröffentlichung wird die erste offizielle Schätzung der Typhus-Träger angegeben: 2 bis 5 % aller Typhus-Patienten, wobei zwischen vorübergehenden Trägern und chronischen Trägern unterschieden wird. Die Autoren schätzen ferner, dass auf einen männlichen Träger vier bis fünf chronische Trägerinnen kommen, bieten jedoch keine Daten an, um diese Behauptung eines geschlechtsspezifischen Unterschieds in der Rate der Typhus-Träger zu erklären. Was die Behandlung betrifft, so schlagen die Autoren vor: "Wenn sie erkannt werden, müssen die Träger über die Entsorgung von Ausscheidungen und die Bedeutung der persönlichen Sauberkeit belehrt werden. Ihnen sollte der Umgang mit Lebensmitteln und Getränken, die für andere bestimmt sind, untersagt werden, und ihre Bewegungen und ihr Aufenthaltsort müssen den Gesundheitsämtern gemeldet werden". ⓘ

Heutzutage gibt es überall auf der Welt Typhus-Träger, aber die höchste Inzidenz asymptomatischer Infektionen ist wahrscheinlich in süd-/südostasiatischen und subsaharischen Ländern zu verzeichnen. Das Los Angeles County Department of Public Health verfolgt Typhus-Träger und meldet jährlich die Anzahl der im Bezirk identifizierten Träger; zwischen 2006 und 2016 wurden 0-4 neue Fälle von Typhus-Trägern pro Jahr identifiziert. Fälle von Typhus müssen innerhalb eines Arbeitstages nach der Identifizierung gemeldet werden. Ab 2018 müssen chronische Typhusüberträger eine "Überträgervereinbarung" unterzeichnen und sich zweimal jährlich, idealerweise alle 6 Monate, auf Typhusausscheidungen testen lassen. Die Träger können von ihrer Vereinbarung entbunden werden, wenn sie die Voraussetzungen für die "Entlassung" erfüllen und einen persönlichen Behandlungsplan erfüllen, der gemeinsam mit medizinischen Fachkräften erstellt wurde. Anforderungen für die Entlassung aus der fäkalen oder Gallenblasen-Trägerschaft: 6 aufeinanderfolgende negative Stuhl- und Urinproben, die in Abständen von mindestens 1 Monat eingereicht werden, beginnend mindestens 7 Tage nach Beendigung der Therapie. Anforderungen für die Freigabe von Urin- oder Nierenträgern: 6 aufeinanderfolgende negative Urinproben, die in Abständen von mindestens 1 Monat oder mehr, beginnend mindestens 7 Tage nach Beendigung der Therapie, eingereicht werden. Im Jahr 2016 lag das Verhältnis von männlichen zu weiblichen Trägern im Bezirk Los Angeles bei 3:1. ⓘ
Da es sich um asymptomatische Fälle handelt, bleiben viele Fragen darüber offen, wie Personen in der Lage sind, eine Infektion über einen langen Zeitraum zu tolerieren, wie solche Fälle identifiziert werden können und welche effizienten Behandlungsmöglichkeiten es gibt. Forscher arbeiten derzeit daran, die asymptomatische Infektion mit Salmonella-Spezies zu verstehen, indem sie Infektionen bei Labortieren untersuchen, was letztendlich zu verbesserten Präventions- und Behandlungsmöglichkeiten für Typhus-Träger führen wird. Im Jahr 2002 beschrieb Dr. John Gunn die Fähigkeit von Salmonella sp. zur Bildung von Biofilmen auf Gallensteinen bei Mäusen und stellte damit ein Modell zur Untersuchung der Übertragung in der Gallenblase bereit. Dr. Denise Monack und Dr. Stanley Falkow beschrieben 2004 ein Mausmodell für eine asymptomatische intestinale und systemische Infektion, und Dr. Monack wies nach, dass eine Teilpopulation von Superspreadern für den Großteil der Übertragung auf neue Wirte verantwortlich ist, entsprechend der 80/20-Regel der Krankheitsübertragung, und dass die Darmmikrobiota wahrscheinlich eine Rolle bei der Übertragung spielt. Das Mausmodell von Dr. Monack ermöglicht die langfristige Übertragung von Salmonellen in Mesenteriallymphknoten, Milz und Leber. ⓘ
Entwicklung eines Impfstoffs

Der britische Bakteriologe Almroth Edward Wright entwickelte an der Army Medical School in Netley, Hampshire, den ersten wirksamen Typhusimpfstoff. Er wurde 1896 eingeführt und von den Briten während des Zweiten Burenkrieges in Südafrika erfolgreich eingesetzt. Damals starben im Krieg oft mehr Soldaten an Typhus als durch Feindeinwirkung verloren gingen. Wright entwickelte seinen Impfstoff ab 1902 in einer neu eröffneten Forschungsabteilung der St Mary's Hospital Medical School in London weiter, wo er eine Methode zur Messung von Schutzstoffen (Opsonin) im menschlichen Blut entwickelte. Wrights Version des Typhusimpfstoffs wurde hergestellt, indem das Bakterium bei Körpertemperatur in Brühe gezüchtet und dann auf 60 °C erhitzt wurde, um den Erreger "hitzeinaktiv" zu machen, d. h. abzutöten, während die Oberflächenantigene intakt blieben. Die hitzeabgetöteten Bakterien wurden dann einem Patienten injiziert. Um die Wirksamkeit des Impfstoffs nachzuweisen, entnahm Wright einige Wochen nach der Impfung Serumproben von Patienten und testete die Fähigkeit des Serums, lebende Typhusbakterien zu verklumpen. Ein "positives" Ergebnis zeigte sich in der Verklumpung der Bakterien, was darauf hindeutete, dass der Körper Antiserum (heute Antikörper genannt) gegen den Erreger produzierte. ⓘ
Am Beispiel des Zweiten Burenkrieges, in dem viele Soldaten an leicht vermeidbaren Krankheiten starben, überzeugte Wright die britische Armee davon, dass 10 Millionen Impfdosen für die an die Westfront entsandten Truppen hergestellt werden sollten, wodurch im Ersten Weltkrieg bis zu einer halben Million Menschenleben gerettet werden konnten. Zum ersten Mal übertrafen die Verluste durch Kampfhandlungen die durch Krankheiten verursachten Verluste. ⓘ
1909 übernahm Frederick F. Russell, ein Arzt der US-Armee, den Typhus-Impfstoff von Wright für die Armee, und zwei Jahre später war sein Impfprogramm das erste, bei dem eine ganze Armee immunisiert wurde. Damit wurde Typhus als eine der Hauptursachen für Morbidität und Mortalität in der US-Armee beseitigt. Im Jahr 1911 wurde die Typhusimpfung für Angehörige des amerikanischen Militärs obligatorisch. Vor der Impfung lag die Rate der Typhuserkrankungen beim Militär bei 14.000 oder mehr pro 100.000 Soldaten. Im Ersten Weltkrieg lag die Typhusrate bei den amerikanischen Soldaten bei 37 pro 100.000. ⓘ
Während des Zweiten Weltkriegs genehmigte die US-Armee die Verwendung eines dreiwertigen Impfstoffs, der hitzeinaktivierte Typhus-, Paratyphi-A- und Paratyphi-B-Erreger enthielt. ⓘ
Im Jahr 1934 ermöglichte die Entdeckung des Vi-Kapselantigens durch Arthur Felix und Miss S. R. Margaret Pitt die Entwicklung des sichereren V-Antigen-Impfstoffs, der heute weit verbreitet ist. Arthur Felix und Margaret Pitt isolierten auch den Stamm Ty2, der zum Ausgangsstamm von Ty21a wurde, dem Stamm, der heute als abgeschwächter Lebendimpfstoff gegen Typhus verwendet wird. ⓘ
Antibiotika und Resistenz
Chloramphenicol wurde in den 1940er Jahren von Dr. David Gotlieb aus Streptomyces isoliert. Im Jahr 1948 testeten amerikanische Armeeärzte seine Wirksamkeit bei der Behandlung von Typhuspatienten in Kuala Lumpur, Malaysia. Bei Personen, die eine vollständige Behandlung erhielten, verschwand die Infektion, während Patienten, die eine niedrigere Dosis erhielten, einen Rückfall erlitten. Asymptomatische Träger schieden trotz Chloramphenicol-Behandlung weiterhin Bazillen aus - nur bei kranken Patienten führte Chloramphenicol zu einer Besserung. Resistenzen gegen Chloramphenicol traten in den 1950er Jahren in Südostasien häufig auf, und heute wird Chloramphenicol aufgrund der hohen Resistenzprävalenz nur noch als letztes Mittel eingesetzt. ⓘ
Terminologie
Für die Krankheit gibt es verschiedene Bezeichnungen, oft in Verbindung mit den Symptomen, wie z. B. Magenfieber, enterisches Fieber, Bauchtyphus, infantiles remittierendes Fieber, langsames Fieber, Nervenfieber, pythogenes Fieber, Abflussfieber und niedriges Fieber. ⓘ
Bemerkenswerte Personen
- Kaiser Augustus von Rom (aufgrund historischer Aufzeichnungen vermutet, aber nicht bestätigt), überlebte.
- Albert, Prinzgemahl, Ehemann von Königin Victoria des Vereinigten Königreichs, starb 24 Tage nach der ersten Meldung, dass er sich "furchtbar krank" fühlte. Er starb am 14. Dezember 1861, nachdem er unter Appetitlosigkeit, Schlaflosigkeit, Fieber, Schüttelfrost, Schweißausbrüchen, Erbrechen, Hautausschlägen, Wahnvorstellungen, der Unfähigkeit, Familienmitglieder zu erkennen, einem sich verschlimmernden Ausschlag am Bauch, einer Veränderung der Zungenfarbe und schließlich einem Zustand extremer Müdigkeit gelitten hatte. Der behandelnde Arzt William Jenner, damals ein Experte für Typhus, diagnostizierte ihn.
- Edward VII. von Großbritannien, Sohn von Königin Victoria, erkrankte als Prinz von Wales fast tödlich an Typhus.
- Zar Nikolaus II. von Russland überlebte, die Krankheit trat etwa 1900-1901 auf.
- William Henry Harrison, der 9. Präsident der Vereinigten Staaten von Amerika, starb 1841, 32 Tage nach Beginn seiner Amtszeit. Dies ist die kürzeste Amtszeit, die ein Präsident der Vereinigten Staaten hatte.
- Stephen A. Douglas, politischer Gegner von Abraham Lincoln in den Jahren 1858 und 1860, starb am 3. Juni 1861 an Typhus.
- Ignacio Zaragoza, mexikanischer General und Politiker, stirbt am 8. September 1862 im Alter von 33 Jahren an Typhus.
- William Wallace Lincoln, der Sohn von US-Präsident Abraham und Mary Todd Lincoln, starb 1862 an Typhus.
- Martha Bulloch Roosevelt, die Mutter von Präsident Theodore Roosevelt und Großmutter väterlicherseits von Eleanor Roosevelt, starb 1884 an Typhus.
- Mary Mallon, "Typhoid Mary" - siehe Abschnitt Geschichte, "Träger" für weitere Einzelheiten
- Leland Stanford jr., Sohn des amerikanischen Tycoons und Politikers A. Leland Stanford und Namensgeber der Leland Stanford Junior University, starb 1884 im Alter von 15 Jahren an Typhus.
- Drei der fünf Kinder von Louis Pasteur starben an Typhus.
- Gerard Manley Hopkins, englischer Dichter, starb 1889 an Typhus.
- Lizzie van Zyl, südafrikanisches Kind und Insassin des Konzentrationslagers Bloemfontein während des Zweiten Burenkrieges, starb 1901 an Typhus.
- Dr. HJH "Tup" Scott, Kapitän des australischen Kricket-Teams, das 1886 auf England-Tournee war, starb 1910 an Typhus.
- Arnold Bennett, englischer Schriftsteller, starb 1932 an Typhus, zwei Monate nachdem er in einem Pariser Hotel ein Glas Wasser getrunken hatte, um zu beweisen, dass es ungefährlich war.
- Hakaru Hashimoto, japanischer Mediziner, starb 1934 an Typhus. ⓘ
Ausbrüche

- Pest von Athen (vermutet)
- Ausbruch des "Brennenden Fiebers" unter amerikanischen Ureinwohnern. Zwischen 1607 und 1624 starben 85 % der Bevölkerung am James River an einer Typhusepidemie. Die Weltgesundheitsorganisation schätzt die Zahl der Todesopfer in dieser Zeit auf über 6.000.
- Maidstone, Kent Ausbruch in den Jahren 1897-1898: Bei 1.847 Patienten wurde Typhus festgestellt. Dieser Ausbruch ist insofern bemerkenswert, als hier zum ersten Mal ein Typhusimpfstoff bei einem zivilen Ausbruch eingesetzt wurde. Der Impfstoff von Almoth Edward Wright wurde 200 Gesundheitsdienstleistern angeboten, und von den 84 Personen, die den Impfstoff erhielten, erkrankte keiner an Typhus, während 4 Personen, die nicht geimpft worden waren, krank wurden.
- Amerikanische Armee im Spanisch-Amerikanischen Krieg: Regierungsangaben zufolge erkrankten über 21.000 Soldaten an Typhus, was zu 2.200 Todesfällen führte.
- 1902 erkrankten die Gäste von Bürgermeisterbanketten in Southampton und Winchester, England, und vier von ihnen starben nach dem Verzehr von Austern, darunter der Dekan von Winchester. Die Infektion war auf Austern aus Emsworth zurückzuführen, wo die Austernbänke mit rohem Abwasser verseucht worden waren.
- Jamaica Plain, Boston, 1908 - in Verbindung mit einer Milchlieferung. Weitere Einzelheiten finden Sie im Abschnitt Geschichte, "Träger".
- Ausbruch bei New Yorker Oberschichtbewohnern, die Mary Mallon beschäftigten - 51 Fälle und 3 Todesfälle zwischen 1907 und 1915.
- Aberdeen, Schottland, im Sommer 1964 - zurückgeführt auf kontaminiertes Rindfleisch in Dosen, das aus Argentinien stammte und auf Märkten verkauft wurde. Mehr als 500 Patienten wurden im Krankenhaus für mindestens vier Wochen unter Quarantäne gestellt, und der Ausbruch wurde ohne Todesfälle eingedämmt.
- Duschanbe, Tadschikistan, 1996-1997: 10.677 gemeldete Fälle, 108 Todesfälle
- Kinshasa, Demokratische Republik Kongo, im Jahr 2004: 43.000 Fälle und über 200 Todesfälle. Eine prospektive Studie von Proben, die zwischen 2007 und 2011 in derselben Region gesammelt wurden, ergab, dass etwa ein Drittel der aus Patientenproben gewonnenen Proben gegen mehrere Antibiotika resistent waren.
- Kampala, Uganda im Jahr 2015: 10.230 gemeldete Fälle ⓘ
Wortherkunft und Bezeichnungen
Der Name Typhus leitet sich vom altgriechischen τῦφος typhos ab, was ‚Dunst‘, ‚Nebel‘, ‚Rauch‘, ‚Dampf‘, aber auch im übertragenen Sinne „Umnebelung der Sinne“ bzw. Schwindel‘ oder ‚benebelter Geisteszustand‘ bedeutet. Dies bezieht sich auf die neurologischen Symptome der Krankheit, insbesondere die Benommenheit als „umnebeltes Bewusstsein“. ⓘ
Im internationalen Sprachgebrauch, wie z. B. im Englischen, ist die Krankheit unter dem Namen typhoid fever bekannt, während das Wort typhus (vgl. griechisch typho, „verbrenne langsam“) die im Deutschen Fleckfieber, gelegentlich aber auch „Flecktyphus“, genannte, durch Rickettsien verursachte Krankheit bezeichnet. Das Fleckfieber wurde früher auch als Typhus levissimus oder Typhus ambulatorius bezeichnet. Das Deutsche Institut für Medizinische Dokumentation und Information (DIMDI) folgt der internationalen Nomenklatur und bezeichnet die hier beschriebene Krankheit als „typhoides Fieber“. ⓘ
Schweiz
In der Schweiz gab es vermutlich in der frühen Neuzeit mehrere Epidemien. Die Zahl der Typhusfälle schwankte bis 1905 erheblich, danach verringerte sie sich kontinuierlich. Während des Zweiten Weltkriegs traten nochmals viele Typhusfälle auf. 1987 starb zum letzten Mal in der Schweiz eine Person an Typhus. Die Erkrankungsrate lag 2008 unter einem Fall auf 100.000 Personen. Im März 1963 grassierte in Zermatt eine Typhusepidemie mit über 400 Erkrankten und drei Toten. ⓘ
Klinisches Bild
Dauerausscheider
In der Folge scheiden ca. 10 % der unbehandelten Erkrankten für bis zu 3 Monate Typhusbakterien mit dem Stuhl oder Urin aus; 5 % der unbehandelten Erkrankten werden zu sogenannten Dauerausscheidern (Ausscheidung > 1 Jahr) der Salmonellen, da die Erreger in der Gallenblase und den Gallenwegen persistieren können (siehe: Mary Mallon). Begünstigt wird dies durch Anomalien der Gallenwege, z. B. Gallensteine. Die Dauerausscheider können, ohne selbst Krankheitszeichen zu zeigen, andere Personen anstecken. Auch behandelte Patienten scheiden nach überstandenem Typhus in etwa 2 bis 5 Prozent der Fälle dauerhaft (> 6 Monate) Erreger aus. ⓘ
Personen, die an Typhus abdominalis oder Paratyphus erkrankt oder dessen verdächtig sind, dürfen nicht beim Herstellen, Behandeln oder Inverkehrbringen von Lebensmitteln, wenn sie dabei mit diesen in Berührung kommen, oder in Küchen von Gaststätten und sonstigen Einrichtungen mit oder zur Gemeinschaftsverpflegung tätig sein oder beschäftigt werden. ⓘ
Meldepflicht
In Deutschland ist Typhus eine meldepflichtige Krankheit nach § 6 Absatz 1 des Infektionsschutzgesetzes. Die namentliche Meldepflicht besteht bei Verdacht, Erkrankung und Tod. ⓘ
In Österreich ist Typhus auch eine anzeigepflichtige Krankheit gemäß § 1 Abs. 1 Epidemiegesetz 1950. Die Meldepflicht bezieht sich auf Verdachts-, Erkrankungs- und Todesfälle. ⓘ
In der Schweiz ist Typhus ebenfalls eine meldepflichtige Krankheit und zwar nach dem Epidemiengesetz (EpG) in Verbindung mit der Epidemienverordnung und Anhang 1 der Verordnung des EDI über die Meldung von Beobachtungen übertragbarer Krankheiten des Menschen. Meldungpflichtig ist ein positiver laboranalytischer Befund. ⓘ