Lysin
 Skelettformel von L-Lysin
| |||
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnungen
L-Lysin
D-Lysin | |||
| Systematische IUPAC-Bezeichnung
(2S)-2,6-Diaminohexansäure (L-Lysin)
(2R)-2,6-Diaminohexansäure (D-Lysin) | |||
| Andere Bezeichnungen
Lysin, D-Lysin, L-Lysin, LYS, h-Lys-OH
| |||
| Bezeichner | |||
3D-Modell (JSmol)
|
| ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
IUPHAR/BPS
|
|||
| KEGG | |||
PubChem CID
|
|||
| UNII |
| ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C6H14N2O2 | ||
| Molekulare Masse | 146.190 g-mol-1 | ||
Löslichkeit in Wasser
|
1,5 kg/L | ||
| Pharmakologie | |||
ATC-Code
|
B05XB03 (WHO) | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox-Referenzen
| |||
Lysin (Symbol Lys oder K) ist eine α-Aminosäure, die eine Vorstufe zu vielen Proteinen ist. Sie enthält eine α-Aminogruppe (die unter biologischen Bedingungen in der protonierten Form -NH3+ vorliegt), eine α-Carbonsäuregruppe (die unter biologischen Bedingungen in der deprotonierten Form -COO- vorliegt) und eine Seitenkette Lysyl ((CH2)4NH2), wodurch sie als basische, geladene (bei physiologischem pH-Wert), aliphatische Aminosäure klassifiziert wird. Sie wird durch die Codons AAA und AAG kodiert. Wie bei fast allen anderen Aminosäuren ist der α-Kohlenstoff chiral, und Lysin kann sich auf eines der beiden Enantiomere oder ein racemisches Gemisch aus beiden beziehen. Für die Zwecke dieses Artikels bezieht sich Lysin auf das biologisch aktive Enantiomer L-Lysin, bei dem der α-Kohlenstoff in der S-Konfiguration vorliegt. ⓘ
Der menschliche Körper kann Lysin nicht synthetisieren. Es ist für den Menschen essentiell und muss daher über die Nahrung aufgenommen werden. In Organismen, die Lysin synthetisieren, gibt es zwei Hauptbiosynthesewege, den Diaminopimelat- und den α-Aminoadipat-Weg, die unterschiedliche Enzyme und Substrate verwenden und in verschiedenen Organismen zu finden sind. Der Abbau von Lysin erfolgt über einen von mehreren Stoffwechselwegen, von denen der Saccharopin-Weg der häufigste ist. ⓘ
Lysin spielt beim Menschen mehrere Rollen, vor allem bei der Proteinogenese, aber auch bei der Vernetzung von Kollagenpolypeptiden, der Aufnahme essenzieller Mineralstoffe und bei der Produktion von Carnitin, das eine Schlüsselrolle im Fettsäurestoffwechsel spielt. Lysin ist auch häufig an Histonmodifikationen beteiligt und wirkt sich somit auf das Epigenom aus. Die ε-Aminogruppe ist häufig an Wasserstoffbrückenbindungen beteiligt und dient als allgemeine Base bei der Katalyse. Die ε-Ammoniumgruppe (NH3+) ist an den vierten Kohlenstoff des α-Kohlenstoffs gebunden, der mit der Carboxylgruppe (C=OOH) verbunden ist. ⓘ
Aufgrund seiner Bedeutung für verschiedene biologische Prozesse kann ein Mangel an Lysin zu verschiedenen Krankheiten führen, darunter Bindegewebsschwäche, gestörter Fettsäurestoffwechsel, Blutarmut und systemischer Protein-Energie-Mangel. Im Gegensatz dazu kann ein Überschuss an Lysin, der durch einen ineffektiven Stoffwechsel verursacht wird, schwere neurologische Störungen verursachen. ⓘ
Lysin wurde erstmals 1889 von dem deutschen Biochemiker Ferdinand Heinrich Edmund Drechsel aus dem Milcheiweiß Kasein isoliert. Er nannte es "Lysin". Im Jahr 1902 bestimmten die deutschen Chemiker Emil Fischer und Fritz Weigert die chemische Struktur von Lysin, indem sie es synthetisierten. ⓘ
| Strukturformel ⓘ | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Strukturformel des natürlich vorkommenden L-Lysins | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Lysin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C6H14N2O2 | |||||||||||||||
| Kurzbeschreibung |
farblose Nadeln oder hexagonale Plättchen | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 146,19 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt |
| |||||||||||||||
| pKS-Wert |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Lysin, abgekürzt Lys oder K, ist in seiner natürlichen L-Form eine essentielle proteinogene α-Aminosäure. ⓘ
Biosynthese
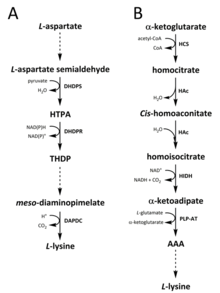
In der Natur wurden zwei Wege für die Synthese von Lysin identifiziert. Der Diaminopimelatweg (DAP) gehört zur Familie der von Aspartat abgeleiteten Biosynthesewege, die auch an der Synthese von Threonin, Methionin und Isoleucin beteiligt sind. Der α-Aminoadipat (AAA)-Stoffwechselweg hingegen gehört zur Familie der Glutamatbiosynthese. ⓘ
Der DAP-Weg ist sowohl in Prokaryonten als auch in Pflanzen zu finden und beginnt mit der durch die Dihydrodipicolinat-Synthase (DHDPS) (E.C 4.3.3.7) katalysierten Kondensationsreaktion zwischen dem Aspartat-Derivat L-Aspartat-Semialdehyd und Pyruvat zur Bildung von (4S)-4-Hydroxy-2,3,4,5-Tetrahydro-(2S)-Dipicolinsäure (HTPA). Das Produkt wird dann von der Dihydrodipicolinat-Reduktase (DHDPR) (E.C. 1.3.1.26) mit NAD(P)H als Protonendonator reduziert, um 2,3,4,5-Tetrahydrodipicolinat (THDP) zu erhalten. Von diesem Punkt an wurden vier verschiedene Wege gefunden, nämlich der Acetylase-, Aminotransferase-, Dehydrogenase- und Succinylase-Weg. Sowohl die Acetylase- als auch die Succinylase-Variante verwenden vier enzymkatalysierte Schritte, der Aminotransferase-Weg zwei Enzyme und der Dehydrogenase-Weg ein einziges Enzym. Diese vier Varianten konvergieren bei der Bildung des vorletzten Produkts, Meso-Diaminopimelat, das anschließend in einer irreversiblen Reaktion, die von der Diaminopimelat-Decarboxylase (DAPDC) (E.C 4.1.1.20) katalysiert wird, enzymatisch decarboxyliert wird, um L-Lysin herzustellen. Der DAP-Stoffwechselweg wird auf mehreren Ebenen reguliert, u. a. stromaufwärts bei den Enzymen, die an der Aspartatverarbeitung beteiligt sind, sowie beim ersten durch DHDPS katalysierten Kondensationsschritt. Lysin übt eine starke negative Rückkopplung auf diese Enzyme aus und reguliert in der Folge den gesamten Stoffwechselweg. ⓘ
Der AAA-Weg beinhaltet die Kondensation von α-Ketoglutarat und Acetyl-CoA über das Zwischenprodukt AAA zur Synthese von L-Lysin. Dieser Stoffwechselweg ist bei mehreren Hefearten, aber auch bei Protisten und höheren Pilzen nachgewiesen worden. Es wurde auch berichtet, dass eine alternative Variante des AAA-Weges in Thermus thermophilus und Pyrococcus horikoshii gefunden wurde, was darauf hindeuten könnte, dass dieser Weg in Prokaryoten weiter verbreitet ist als ursprünglich angenommen. Der erste und geschwindigkeitsbeschränkende Schritt des AAA-Weges ist die Kondensationsreaktion zwischen Acetyl-CoA und α-Ketoglutarat, die durch die Homocitrat-Synthase (HCS) (E.C. 2.3.3.14) katalysiert wird, um das Zwischenprodukt Homocitryl-CoA zu bilden, das durch dasselbe Enzym zu Homocitrat hydrolysiert wird. Homocitrat wird durch Homoaconitase (HAc) (E.C 4.2.1.36) enzymatisch dehydriert, wobei cis-Homoaconitat entsteht. HAc katalysiert dann eine zweite Reaktion, bei der cis-Homoaconitat rehydriert wird und Homoisocitrat entsteht. Das resultierende Produkt wird durch Homoisocitrat-Dehydrogenase (HIDH) (E.C 1.1.1.87) oxidativ decarboxyliert, wobei α-Ketoadipat entsteht. AAA wird dann über eine pyridoxal 5′-Phosphat (PLP)-abhängige Aminotransferase (PLP-AT) (E.C 2.6.1.39) unter Verwendung von Glutamat als Aminodonator gebildet. Von diesem Punkt an variiert der AAA-Weg je nach [hier fehlt etwas ? -> zumindest die Abschnittsüberschrift! In Pilzen wird AAA über AAA-Reduktase (E.C 1.2.1.95) in einem einzigartigen Prozess, der sowohl Adenylierung als auch Reduktion umfasst und durch eine Phosphopantetheinyltransferase (E.C 2.7.8.7) aktiviert wird, zu α-Aminoadipat-Semialdehyd reduziert. Sobald der Semialdehyd gebildet ist, katalysiert die Saccharopin-Reduktase (E.C 1.5.1.10) eine Kondensationsreaktion mit Glutamat und NAD(P)H als Protonendonator, und das Imin wird zum vorletzten Produkt, Saccharopin, reduziert. Der letzte Schritt des Stoffwechselwegs in Pilzen beinhaltet die durch die Saccharopin-Dehydrogenase (SDH) (E.C 1.5.1.8) katalysierte oxidative Desaminierung von Saccharopin, wodurch L-Lysin entsteht. In einer Variante des AAA-Wegs, die in einigen Prokaryoten vorkommt, wird AAA zunächst in N-Acetyl-α-aminoadipat umgewandelt, das phosphoryliert und dann reduktiv zum ε-Aldehyd dephosphoryliert wird. Der Aldehyd wird dann zu N-Acetyl-Lysin transaminiert, das deacetyliert wird und L-Lysin ergibt. Die an dieser Variante des Stoffwechselweges beteiligten Enzyme müssen jedoch noch weiter validiert werden. ⓘ
Katabolismus
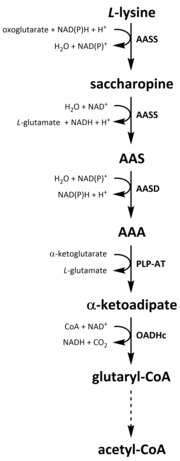
Wie alle Aminosäuren wird der Katabolismus von Lysin durch die Aufnahme von Lysin aus der Nahrung oder durch den Abbau von intrazellulärem Protein ausgelöst. Der Katabolismus dient auch dazu, die intrazelluläre Konzentration von freiem Lysin zu kontrollieren und einen Gleichgewichtszustand aufrechtzuerhalten, um die toxischen Auswirkungen von übermäßigem freiem Lysin zu verhindern. Am Lysin-Katabolismus sind mehrere Wege beteiligt, doch der am häufigsten genutzte ist der Saccharopin-Weg, der bei Tieren hauptsächlich in der Leber (und vergleichbaren Organen), insbesondere in den Mitochondrien, stattfindet. Es handelt sich dabei um den umgekehrten Weg des zuvor beschriebenen AAA-Wegs. Bei Tieren und Pflanzen werden die ersten beiden Schritte des Saccharopinwegs durch das bifunktionelle Enzym α-Aminoadipinsäure-Semialdehyd-Synthase (AASS) katalysiert, das sowohl Lysin-Ketoglutarat-Reduktase (LKR) (E.C 1.5.1.8) als auch SDH-Aktivitäten besitzt, während in anderen Organismen wie Bakterien und Pilzen beide Enzyme von separaten Genen kodiert werden. Der erste Schritt besteht in der LKR-katalysierten Reduktion von L-Lysin in Gegenwart von α-Ketoglutarat zur Bildung von Saccharopin, wobei NAD(P)H als Protonendonator fungiert. Saccharopin durchläuft dann eine Dehydratisierungsreaktion, die von SDH in Gegenwart von NAD+ katalysiert wird, um AAS und Glutamat zu bilden. Die AAS-Dehydrogenase (AASD) (E.C 1.2.1.31) dehydriert dann das Molekül weiter zu AAA. Anschließend katalysiert PLP-AT die umgekehrte Reaktion zu der des AAA-Biosynthesewegs, wodurch AAA in α-Ketoadipat umgewandelt wird. Das Produkt, α-Ketoadipat, wird in Gegenwart von NAD+ und Coenzym A zu Glutaryl-CoA decarboxyliert, wobei das daran beteiligte Enzym noch nicht vollständig geklärt ist. Einiges deutet darauf hin, dass der 2-Oxoadipat-Dehydrogenase-Komplex (OADHc), der strukturell homolog zur E1-Untereinheit des Oxoglutarat-Dehydrogenase-Komplexes (OGDHc) ist (E.C 1.2.4.2), für die Decarboxylierungsreaktion verantwortlich ist. Schließlich wird Glutaryl-CoA durch die Glutaryl-CoA-Dehydrogenase (E.C 1.3.8.6) oxidativ zu Crotonyl-CoA decarboxyliert, das in mehreren enzymatischen Schritten zu Acetyl-CoA weiterverarbeitet wird, einem essentiellen Kohlenstoffmetaboliten, der am Tricarbonsäurezyklus (TCA) beteiligt ist. ⓘ
Ernährungsphysiologischer Wert
Lysin ist eine für den Menschen essentielle Aminosäure. Der Nährstoffbedarf des Menschen schwankt zwischen ~60 mg-kg-1-d-1 im Säuglingsalter und ~30 mg-kg-1-d-1 im Erwachsenenalter. Dieser Bedarf wird in der westlichen Gesellschaft in der Regel durch die Aufnahme von Lysin aus Fleisch und pflanzlichen Quellen gedeckt, die weit über dem empfohlenen Bedarf liegt. Bei vegetarischer Ernährung ist die Lysinzufuhr aufgrund der im Vergleich zu Fleisch begrenzten Lysinmenge in Getreide geringer. ⓘ
Angesichts der begrenzten Lysinkonzentration in Getreidepflanzen wird seit langem spekuliert, dass der Lysingehalt durch gentechnische Veränderungen erhöht werden kann. Häufig wurde dabei der DAP-Stoffwechsel absichtlich dysreguliert, indem lysin-rückkopplungsunempfindliche Orthologe des DHDPS-Enzyms eingeführt wurden. Diese Methoden waren nur begrenzt erfolgreich, was wahrscheinlich auf die toxischen Nebenwirkungen des erhöhten freien Lysins und die indirekten Auswirkungen auf den TCA-Zyklus zurückzuführen ist. Pflanzen akkumulieren Lysin und andere Aminosäuren in Form von Saatgut-Speicherproteinen, die sich in den Samen der Pflanze befinden und den essbaren Bestandteil von Getreidepflanzen darstellen. Dies unterstreicht die Notwendigkeit, nicht nur den Gehalt an freiem Lysin zu erhöhen, sondern Lysin auch auf die Synthese stabiler Proteine für die Saatgutspeicherung zu lenken und damit den Nährwert der verzehrbaren Komponente der Kulturpflanzen zu erhöhen. Während die gentechnische Veränderung nur in begrenztem Umfang erfolgreich war, konnten durch traditionellere selektive Züchtungsverfahren "Qualitätsproteinmais" isoliert werden, der einen deutlich höheren Gehalt an Lysin und Tryptophan, ebenfalls eine essenzielle Aminosäure, aufweist. Dieser erhöhte Lysingehalt wird auf eine opaque-2-Mutation zurückgeführt, die die Transkription von lysinarmen, mit Zein verwandten Speicherproteinen reduziert und infolgedessen die Häufigkeit anderer lysinreicher Proteine erhöht. Um den Mangel an Lysin im Tierfutter zu beheben, wird in der Regel industriell hergestelltes Lysin zugesetzt. Das industrielle Verfahren umfasst die fermentative Züchtung von Corynebacterium glutamicum und die anschließende Reinigung von Lysin. ⓘ
Ernährungsbedingte Quellen
Lysin ist eine für den Menschen und andere Säugetiere, wie beispielsweise Schweine, essentielle Aminosäure und muss mit der Nahrung zugeführt werden. Die folgenden Beispiele für den Gehalt an Lysin beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil am Gesamtprotein angegeben:

| Lebensmittel | Gesamtprotein | Lysin | Anteil ⓘ |
|---|---|---|---|
| Rindfleisch, roh | 21,26 g | 1,797 g | 8,5 % |
| Hähnchenbrustfilet, roh | 23,09 g | 1,962 g | 8,5 % |
| Kürbiskern | 35,49 g | 2,283 g | 6,4 % |
| Lachs, roh | 20,42 g | 1,870 g | 9,2 % |
| Erbsen, getrocknet | 24,55 g | 1,772 g | 7,2 % |
| Tofu, fest | 15,51 g | 1,000 g | 6,4 % |
| Hühnerei | 12,58 g | 0,914 g | 7,3 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 0,260 g | 7,9 % |
| Walnüsse | 15,23 g | 0,424 g | 2,8 % |
| Weizen-Vollkornmehl | 13,70 g | 0,378 g | 2,8 % |
| Mais-Vollkornmehl | 6,93 g | 0,195 g | 2,8 % |
| Reis, ungeschält | 7,94 g | 0,303 g | 3,8 % |
| Buchweizen-Mehl | 11,73 g | 0,595 g | 5,1 % |
| Quinoa | 13 g | 0,860 g | 6,6 % |
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes L-Lysin als Proteinbestandteil, jedoch kein freies L-Lysin. Getreide enthalten meist geringere L-Lysin-Anteile unter den Aminosäuren des Proteinbestandteils, als es für die menschliche Ernährung optimal ist. ⓘ
Die Einschätzungen des Tagesbedarfs für gesunde Erwachsene reichen, je nach verwendeter Methode, von 8 bis 45 mg Lysin pro Kilogramm Körpergewicht. Eine Expertenkommission der FAO/WHO/UNU ging im Jahr 2002 von einem täglichen Bedarf zwischen 30 mg und 64 mg pro Kilogramm Körpergewicht für Säuglinge und Erwachsene aus. ⓘ
Gute Lysinquellen sind eiweißreiche Lebensmittel wie Eier, Fleisch (insbesondere rotes Fleisch, Lamm, Schwein und Geflügel), Soja, Bohnen und Erbsen, Käse (insbesondere Parmesan) und bestimmte Fische (wie Kabeljau und Sardinen). Lysin ist die limitierende Aminosäure (die essenzielle Aminosäure mit dem geringsten Anteil in einem bestimmten Lebensmittel) in den meisten Getreidearten, aber reichlich in den meisten Hülsenfrüchten enthalten. Eine vegetarische Ernährung oder eine Ernährung mit wenig tierischem Eiweiß kann eine ausreichende Versorgung mit Eiweiß, einschließlich Lysin, gewährleisten, wenn sie sowohl Getreidekörner als auch Hülsenfrüchte enthält, aber es ist nicht erforderlich, dass die beiden Lebensmittelgruppen in denselben Mahlzeiten verzehrt werden. ⓘ
Biologische Funktionen
Die häufigste Rolle von Lysin ist die Proteinogenese. Lysin spielt häufig eine wichtige Rolle beim Aufbau von Proteinen. Da seine Seitenkette eine positiv geladene Gruppe an einem Ende und einen langen hydrophoben Kohlenstoffschwanz in der Nähe des Rückgrats enthält, gilt Lysin als eher amphipathisch. Aus diesem Grund findet man Lysin sowohl vergraben als auch häufiger in Lösungsmittelkanälen und an der Außenseite von Proteinen, wo es mit der wässrigen Umgebung wechselwirken kann. Lysin kann auch zur Proteinstabilität beitragen, da seine ε-Aminogruppe häufig an Wasserstoffbrücken, Salzbrücken und kovalenten Wechselwirkungen zur Bildung einer Schiffschen Base beteiligt ist. ⓘ
Eine zweite wichtige Rolle von Lysin besteht in der epigenetischen Regulierung durch Histonmodifikation. Es gibt verschiedene Arten von kovalenten Histonmodifikationen, bei denen in der Regel Lysinreste im hervorstehenden Schwanz der Histone betroffen sind. Zu den Modifikationen gehören häufig das Hinzufügen oder Entfernen einer Acetylgruppe (-CH3CO), wodurch Acetyllysin gebildet wird, oder die Rückverwandlung in Lysin, bis zu drei Methylgruppen (-CH3), Ubiquitin oder eine Sumo-Protein-Gruppe. Die verschiedenen Modifikationen haben nachgeschaltete Auswirkungen auf die Genregulation, bei der Gene aktiviert oder unterdrückt werden können. ⓘ
Lysin wird auch eine Schlüsselrolle bei anderen biologischen Prozessen zugeschrieben, darunter Strukturproteine des Bindegewebes, Kalziumhomöostase und Fettsäurestoffwechsel. Lysin ist nachweislich an der Vernetzung zwischen den drei helikalen Polypeptiden im Kollagen beteiligt, was zu dessen Stabilität und Zugfestigkeit führt. Dieser Mechanismus ähnelt der Rolle von Lysin in bakteriellen Zellwänden, in denen Lysin (und Meso-Diaminopimelat) für die Bildung von Querverbindungen und damit für die Stabilität der Zellwand entscheidend sind. Dieses Konzept wurde bereits früher als Mittel zur Umgehung der unerwünschten Freisetzung potenziell pathogener gentechnisch veränderter Bakterien erforscht. Es wurde vorgeschlagen, einen auxotrophen Stamm von Escherichia coli (X1776) für alle gentechnischen Veränderungen zu verwenden, da dieser Stamm ohne die Zufuhr von DAP nicht überleben kann und daher außerhalb einer Laborumgebung nicht überleben kann. Lysin soll auch an der Kalziumabsorption im Darm und der Retention in den Nieren beteiligt sein und könnte somit eine Rolle bei der Kalziumhomöostase spielen. Schließlich hat sich gezeigt, dass Lysin ein Vorläufer von Carnitin ist, das Fettsäuren zu den Mitochondrien transportiert, wo sie zur Energiegewinnung oxidiert werden können. Carnitin wird aus Trimethyllysin synthetisiert, einem Abbauprodukt bestimmter Proteine, so dass Lysin zunächst in Proteine eingebaut und methyliert werden muss, bevor es in Carnitin umgewandelt werden kann. Bei Säugetieren wird Carnitin jedoch in erster Linie durch die Nahrung und nicht durch die Umwandlung von Lysin zugeführt. ⓘ
In Opsinen wie Rhodopsin und den visuellen Opsinen (die von den Genen OPN1SW, OPN1MW und OPN1LW kodiert werden) bildet Retinaldehyd eine Schiffsbase mit einem konservierten Lysinrest, und die Interaktion von Licht mit der Retinylidengruppe bewirkt die Signalübertragung beim Farbensehen (Einzelheiten siehe Sehzyklus). ⓘ
Umstrittene Rollen
Es wird seit langem diskutiert, dass Lysin, wenn es intravenös oder oral verabreicht wird, die Freisetzung von Wachstumshormonen erheblich steigern kann. Dies hat dazu geführt, dass Athleten Lysin als Mittel zur Förderung des Muskelwachstums während des Trainings einsetzen, jedoch wurden bisher keine signifikanten Beweise für diese Anwendung von Lysin gefunden. ⓘ
Da die Proteine des Herpes-simplex-Virus (HSV) reicher an Arginin und ärmer an Lysin sind als die Zellen, die sie infizieren, wurden Lysin-Ergänzungen als Behandlung versucht. Da die beiden Aminosäuren im Darm aufgenommen, in der Niere wiedergewonnen und über dieselben Aminosäuretransporter in die Zellen transportiert werden, würde ein Überschuss an Lysin theoretisch die für die Virusreplikation verfügbare Argininmenge begrenzen. Klinische Studien liefern keine stichhaltigen Beweise für die Wirksamkeit als Prophylaxe oder bei der Behandlung von HSV-Ausbrüchen. Als Reaktion auf Produktbehauptungen, dass Lysin die Immunreaktion auf HSV verbessern könnte, ergab eine Überprüfung durch die Europäische Behörde für Lebensmittelsicherheit keine Hinweise auf einen Ursache-Wirkungs-Zusammenhang. Die gleiche Überprüfung, die 2011 veröffentlicht wurde, ergab keine Belege für die Behauptung, Lysin könne den Cholesterinspiegel senken, den Appetit steigern, die Proteinsynthese in irgendeiner anderen Funktion als der eines gewöhnlichen Nährstoffs unterstützen oder die Kalziumabsorption oder -speicherung erhöhen. ⓘ
Rolle bei Krankheiten
Krankheiten, die mit Lysin in Zusammenhang stehen, sind das Ergebnis der nachgeschalteten Verarbeitung von Lysin, d. h. des Einbaus in Proteine oder der Modifizierung in andere Biomoleküle. Ein Mangel an Lysin und Hydroxylysin, die an der Vernetzung von Kollagenpeptiden beteiligt sind, wurde jedoch mit einer Erkrankung des Bindegewebes in Verbindung gebracht. Da Carnitin ein wichtiger, aus Lysin gewonnener Metabolit ist, der am Fettsäurestoffwechsel beteiligt ist, kann eine unzureichende Ernährung mit einem Mangel an Carnitin und Lysin zu einem verringerten Carnitinspiegel führen, der erhebliche Auswirkungen auf die Gesundheit des Einzelnen haben kann. Lysin spielt nachweislich auch eine Rolle bei Anämie, da vermutet wird, dass Lysin die Eisenaufnahme und in der Folge die Konzentration von Ferritin im Blutplasma beeinflusst. Der genaue Wirkmechanismus ist jedoch noch nicht geklärt. Am häufigsten tritt Lysinmangel in nicht-westlichen Gesellschaften auf und äußert sich als Protein-Energie-Mangelernährung, die tiefgreifende und systemische Auswirkungen auf die Gesundheit des Einzelnen hat. Es gibt auch eine genetisch bedingte Erbkrankheit, die mit Mutationen in den für den Lysinabbau verantwortlichen Enzymen einhergeht, nämlich dem bifunktionalen AASS-Enzym des Saccharopinweges. Aufgrund des fehlenden Lysinabbaus reichert sich die Aminosäure im Plasma an, und die Patienten entwickeln eine Hyperlysinämie, die sich als asymptomatische bis schwere neurologische Störungen äußern kann, darunter Epilepsie, Ataxie, Spastizität und psychomotorische Störungen. Die klinische Bedeutung der Hyperlysinämie ist in der Fachwelt umstritten, wobei einige Studien keine Korrelation zwischen körperlichen oder geistigen Behinderungen und Hyperlysinämie feststellen konnten. Darüber hinaus wurden Mutationen in Genen, die mit dem Lysinstoffwechsel in Zusammenhang stehen, bei mehreren Krankheiten festgestellt, darunter die pyridoxinabhängige Epilepsie (ALDH7A1-Gen), die α-Ketoadipinsäure- und α-Aminoadipinsäureurie (DHTKD1-Gen) und die Glutarsäureurie Typ 1 (GCDH-Gen). ⓘ
Die Hyperlysinurie ist durch hohe Lysinmengen im Urin gekennzeichnet. Sie ist häufig auf eine Stoffwechselerkrankung zurückzuführen, bei der ein am Lysinabbau beteiligtes Protein aufgrund einer genetischen Mutation nicht funktionsfähig ist. Sie kann auch aufgrund einer Störung des renalen Tubulustransports auftreten. ⓘ
Verwendung von Lysin in der Tierernährung
Die Herstellung von Lysin für Tierfutter ist weltweit ein bedeutender Wirtschaftszweig, der im Jahr 2009 fast 700 000 Tonnen mit einem Marktwert von über 1,22 Milliarden Euro erreichte. Lysin ist ein wichtiger Zusatzstoff für Tierfutter, da es eine limitierende Aminosäure bei der Optimierung des Wachstums bestimmter Tiere wie Schweine und Hühner für die Fleischerzeugung ist. Der Zusatz von Lysin ermöglicht die Verwendung kostengünstigerer pflanzlicher Proteine (z. B. Mais anstelle von Soja) bei gleichbleibend hohen Wachstumsraten und einer geringeren Belastung durch Stickstoffausscheidungen. Die Verschmutzung durch Phosphat wiederum stellt einen großen Kostenfaktor für die Umwelt dar, wenn Mais als Futtermittel für Geflügel und Schweine verwendet wird. ⓘ
Lysin wird industriell durch mikrobielle Fermentation auf der Basis von Zucker hergestellt. In der gentechnischen Forschung wird aktiv an Bakterienstämmen gearbeitet, um die Effizienz der Produktion zu verbessern und die Herstellung von Lysin aus anderen Substraten zu ermöglichen. ⓘ
In der Populärkultur
Im Film Jurassic Park aus dem Jahr 1993 (nach dem gleichnamigen Roman von Michael Crichton aus dem Jahr 1990) kommen Dinosaurier vor, die genetisch so verändert wurden, dass sie kein Lysin produzieren konnten, ein Beispiel für künstliche Auxotrophie. Dies war als "Lysin-Kontingenz" bekannt und sollte verhindern, dass die geklonten Dinosaurier außerhalb des Parks überlebten, so dass sie auf Lysin-Zusätze angewiesen waren, die von den Tierärzten des Parks bereitgestellt wurden. In Wirklichkeit ist kein Tier in der Lage, Lysin zu produzieren (es handelt sich um eine essenzielle Aminosäure). ⓘ
1996 stand Lysin im Mittelpunkt eines Preisfestsetzungsverfahrens, des größten in der Geschichte der Vereinigten Staaten. Die Archer Daniels Midland Company zahlte eine Geldstrafe in Höhe von 100 Millionen US-Dollar, und drei ihrer Führungskräfte wurden zu Haftstrafen verurteilt. Auch zwei japanische Unternehmen (Ajinomoto, Kyowa Hakko) und ein südkoreanisches Unternehmen (Sewon) wurden in dem Preisabspracheverfahren für schuldig befunden. Geheime Videoaufnahmen der Verschwörer bei der Festsetzung des Lysinpreises können im Internet abgerufen oder beim US-Justizministerium, Abteilung Kartellrecht, angefordert werden. Dieser Fall diente als Grundlage für den Film The Informant! und ein Buch mit demselben Titel. ⓘ
Stereoisomerie
In den Proteinen kommt, neben anderen Aminosäuren, ausschließlich L-Lysin [Synonym: (S)-Lysin] peptidisch gebunden vor. Enantiomer dazu ist das spiegelbildliche D-Lysin [Synonym: (R)-Lysin], das in Proteinen nicht vorkommt. Racemisches DL-Lysin [Synonyme: (RS)-Lysin und (±)-Lysin] hat eine geringere Bedeutung als L-Lysin, besitzt jedoch kommerzielle Bedeutung als basische Komponente in Arzneistoff-Salzen, z. B. mit Acetylsalicylsäure. ⓘ
Wenn in diesem Text oder in der wissenschaftlichen Literatur „Lysin“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist L-Lysin gemeint. ⓘ
| Isomere von Lysin ⓘ | ||
| Name | L-Lysin | D-Lysin |
| Andere Namen | (S)-Lysin | (R)-Lysin |
| Strukturformel | 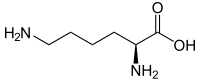 |

|
| CAS-Nummer | 56-87-1 | 923-27-3 |
| 70-54-2 (DL) | ||
| EG-Nummer | 200-294-2 | 213-091-9 |
| 200-740-6 (DL) | ||
| ECHA-Infocard | 100.000.268 | 100.011.902 |
| 100.000.673 (DL) | ||
| PubChem | 5962 | 57449 |
| 866 (DL) | ||
| DrugBank | DB00123 | - |
| - (DL) | ||
| FL-Nummer | 17.026 | - |
| 17.013 (DL) | ||
| Wikidata | Q20816880 | Q27077084 |
| Q178430 (DL) | ||
Geschichte
Nach der Entdeckung des Phenylalanins ging der deutsche Chemiker Ernst Schulze davon aus, dass die Proteine aus weiteren Aminosäuren zusammengesetzt sein müssten als den bis dahin bekannten Aminosäuren. Unter anderem diese Erwägungen veranlassten Edmund Drechsel erneut die Bestandteile der Salzsäurespaltung von Casein zu untersuchen. Nach der Behandlung mit Phosphorwolframsäure gelang es Drechsel 1889 die Platinsalze von Lysin zu isolieren. Die richtige Zusammensetzung dieser Aminosäure wurde 1891 durch seinen Schüler Max Siegfried veröffentlicht und die finale Aufklärung der Strukturformel erfolgte 1902 über die Synthese von Lysin durch den Nobelpreisträger Emil Fischer und seinen Assistenten Fritz Weigert. ⓘ
Eigenschaften

Gemeinsam mit L-Arginin und L-Histidin gehört L-Lysin in die Gruppe der basischen und zugleich proteinogenen α-Aminosäuren oder Hexonbasen. Lysin besitzt zwei basische primäre Aminogruppen, eine in α-Position zur Carboxygruppe und eine in der ε-Position der Seitenkette. Die Ladung des Lysins ist – wie bei allen Aminosäuren – vom pH-Wert abhängig. Lysin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe zum freien Elektronenpaar des Stickstoffatoms der ε-Aminogruppe wandert, die stärker basisch ist als die α-Aminogruppe: Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert, hier 9,82) der Fall, bei dem das Lysin auch seine geringste Löslichkeit in Wasser besitzt. ⓘ
Weitere physikochemische Daten für Lysin sind:
- isoelektrischer Punkt: 9,74
- Van-der-Waals-Volumen: 135 Å3
- Hydrophobizitätsgrad: −3,9 ⓘ
Industrielle Herstellung
Industriell werden mehrere 100.000 Tonnen L-Lysin pro Jahr hergestellt. L-Lysin wird heute ausschließlich nach der Fermentationsmethode hergestellt, obgleich organisch-chemische Syntheserouten entwickelt wurden. ⓘ
Funktionen

Lysin ist eine der Aminosäuren, die bevorzugt posttranslational modifiziert werden. Dabei kann die Ladung erhalten bleiben (mono- und di-Methylierung) oder verschwinden (Acetylierung). Im Kollagen wurde ein modifiziertes Lysin gefunden, das Hydroxylysin mit einer OH-Gruppe in der Seitenkette, katalysiert unter Mitwirkung des Enzyms Lysylhydroxylase und des Cofaktors Ascorbinsäure (Vitamin C). Hydroxylysin erlaubt die nachfolgende O-Glykosylierung des Kollagenmoleküls im Endoplasmatischen Retikulum und Golgi-Apparat. Die Glykosylierung bestimmt die Packungsdichte dieses wichtigen Bindegewebeproteins und wird auch mit der Steuerung der Kollagenabgabe aus der Zelle (Exozytose) in Verbindung gebracht. ⓘ
Eine weitere Modifikation ist die Ubiquitinierung in Proteinen, die damit für den Abbau durch das Proteasom markiert werden. ⓘ
Beim Abbau des Lysins (Eiweißfäule) entsteht über Pipecolinsäure das Leichengift Cadaverin. ⓘ
Verwendung
Die Hauptmengen des industriell erzeugten L-Lysins werden in der Futtermittelsupplementierung eingesetzt, um den Nährwert natürlicher Futtermittel (Getreide) mit einem geringen Gehalt an L-Lysin deutlich zu steigern. ⓘ
Racemisches DL-Lysin besitzt kommerzielle Bedeutung als basische Komponente in Arzneistoff-Salzen, z. B. mit Acetylsalicylsäure (ASS). ⓘ
L-Lysin ist Bestandteil von Infusionslösungen zur parenteralen Ernährung und zur Behandlung hypochlorämischer Alkalosen. ⓘ
Lysin wird auch zur Wirkbeschleunigung bei schmerzhemmenden Mitteln verwendet, insbesondere in Verbindung mit Ibuprofen. ⓘ
Biochemie
Für detaillierte Strukturformeln siehe auch Abschnitt Weblinks ⓘ
L-Lysin kann in zwei Moleküle Acetyl-CoA abgebaut werden. ⓘ

