Kawasaki-Syndrom
| Kawasaki-Krankheit ⓘ | |
|---|---|
| Andere Namen | Kawasaki-Syndrom, mukokutanes Lymphknotensyndrom |
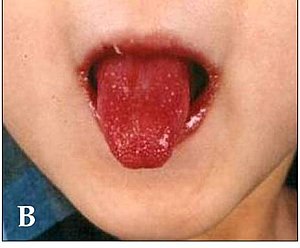 | |
| Ein Kind mit der charakteristischen "Erdbeerzunge", die bei der Kawasaki-Krankheit auftritt | |
| Fachgebiet | Pädiatrie, Rheumatologie, Immunologie |
| Symptome | Fieber > 5 Tage, große Lymphknoten, Hautausschlag, Halsschmerzen, Durchfall |
| Komplikationen | Koronararterien-Aneurysmen |
| Gewöhnlicher Ausbruch | < 5 Jahre alt |
| Dauer | ~ etwa 3 Wochen |
| Ursachen | Unbekannt |
| Risikofaktoren | Alter von < 5 Jahren |
| Diagnostische Methode | Anhand der Symptome, Ultraschall des Herzens |
| Differentialdiagnose | Scharlach, juvenile rheumatoide Arthritis, pädiatrisches multisystemisches Entzündungssyndrom |
| Medikation | Aspirin, Immunglobulin |
| Prognose | Sterblichkeit 0,2% mit Behandlung |
| Häufigkeit | 8-124 pro 100.000 Menschen unter fünf Jahren |
Die Kawasaki-Krankheit ist ein Syndrom unbekannter Ursache, das mit Fieber einhergeht und hauptsächlich Kinder unter 5 Jahren betrifft. Es handelt sich um eine Form der Vaskulitis, bei der sich die Blutgefäße im gesamten Körper entzünden. Das Fieber hält in der Regel mehr als fünf Tage an und wird von den üblichen Medikamenten nicht beeinflusst. Weitere häufige Symptome sind große Lymphknoten im Nacken, ein Ausschlag im Genitalbereich, an den Lippen, Handflächen oder Fußsohlen sowie rote Augen. Innerhalb von drei Wochen nach Ausbruch der Krankheit kann sich die Haut an Händen und Füßen schälen, danach tritt in der Regel eine Besserung ein. Bei einigen Kindern bilden sich Aneurysmen der Koronararterien im Herzen. ⓘ
Die genaue Ursache ist nicht bekannt, aber man geht davon aus, dass sie durch eine übermäßige Reaktion des Immunsystems auf eine Infektion bei Kindern entstehen, die genetisch dazu veranlagt sind. Sie ist nicht von Mensch zu Mensch übertragbar. Die Diagnose wird in der Regel anhand der Anzeichen und Symptome einer Person gestellt. Andere Untersuchungen wie eine Ultraschalluntersuchung des Herzens und Bluttests können die Diagnose unterstützen. Bei der Diagnose müssen viele andere Krankheiten berücksichtigt werden, die ähnliche Merkmale aufweisen können, darunter Scharlach und juvenile rheumatoide Arthritis. Eine neu auftretende "Kawasaki"-ähnliche Krankheit, die zeitlich mit COVID-19 verbunden ist, scheint ein eigenständiges Syndrom zu sein. ⓘ
Die Erstbehandlung der Kawasaki-Krankheit besteht in der Regel aus hohen Dosen von Aspirin und Immunglobulin. In der Regel verschwindet das Fieber mit der Behandlung innerhalb von 24 Stunden, und es tritt eine vollständige Genesung ein. Wenn die Koronararterien betroffen sind, kann gelegentlich eine kontinuierliche Behandlung oder eine Operation erforderlich sein. Ohne Behandlung treten in bis zu 25 % der Fälle Koronararterien-Aneurysmen auf, von denen etwa 1 % tödlich verlaufen. Mit einer Behandlung sinkt das Sterberisiko auf 0,17 %. Menschen, die nach der Kawasaki-Krankheit ein Koronararterien-Aneurysma hatten, müssen lebenslang von spezialisierten Teams kardiologisch überwacht werden. ⓘ
Die Kawasaki-Krankheit ist selten. Sie betrifft zwischen 8 und 67 von 100.000 Menschen unter fünf Jahren, außer in Japan, wo sie 124 von 100.000 betrifft. Jungen sind häufiger betroffen als Mädchen. Die Krankheit ist nach dem japanischen Kinderarzt Tomisaku Kawasaki benannt, der sie 1967 erstmals beschrieb. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| M30.3 | mukokutanes Lymphknotensyndrom (MCLS) |
| ICD-10 online (WHO-Version 2019) | |
Das Kawasaki-Syndrom oder mukokutane (die Schleimhaut betreffend) Lymphknotensyndrom (englisch mucocutaneous lymph node syndrome (MCLS)) ist eine akute, fieberhafte, systemische Erkrankung, die durch Entzündungen der kleinen und mittleren Arterien (nekrotisierende Vaskulitis) gekennzeichnet ist. Zusätzlich ist eine systemische Entzündung in vielen Organen vorhanden. Die Ursache ist unbekannt; man vermutet eine infektiöse, wahrscheinlich virale Entstehung, die durch eine erbliche Grundlage begünstigt wird. Das Kawasaki-Syndrom betrifft vor allem Kleinkinder. Benannt ist die Erkrankung nach dem japanischen Kinderarzt Tomisaku Kawasaki. Die Prognose der Patienten mit diesem Syndrom ist gut. Für die Erkrankung bedeutsame aneurysmatische Veränderungen, insbesondere der Herzkranzgefäße, lassen sich gegebenenfalls in der Echokardiographie erkennen. Die meist durch Herzinfarkt bedingte Letalität beträgt etwa 1 Prozent. ⓘ
Anzeichen und Symptome
Die Kawasaki-Krankheit beginnt häufig mit hohem und anhaltendem Fieber, das auf eine normale Behandlung mit Paracetamol (Paracetamol) oder Ibuprofen kaum anspricht. Dies ist das auffälligste Symptom der Kawasaki-Krankheit und ein charakteristisches Zeichen dafür, dass sich die Krankheit in der akuten Phase befindet; das Fieber ist normalerweise hoch (über 39-40 °C) und remittierend und wird von extremer Reizbarkeit begleitet. Kürzlich wurde berichtet, dass es auch bei Patienten mit atypischer oder inkompletter Kawasaki-Krankheit auftritt; es ist jedoch nicht in 100 % der Fälle vorhanden. ⓘ
Der erste Tag des Fiebers gilt als der erste Tag der Krankheit, und die Dauer beträgt in der Regel ein bis zwei Wochen; ohne Behandlung kann sie sich auf drei bis vier Wochen ausdehnen. Längeres Fieber ist mit einer höheren Inzidenz von Herzbeteiligung verbunden. Es spricht teilweise auf fiebersenkende Medikamente an und verschwindet auch nicht durch die Gabe von Antibiotika. Wenn jedoch eine geeignete Therapie - intravenöses Immunglobulin und Aspirin - eingeleitet wird, klingt das Fieber nach zwei Tagen ab. ⓘ
Als häufigstes Symptom nach dem Fieber wird eine bilaterale Bindehautentzündung berichtet. Sie betrifft in der Regel die bulbären Bindehäute, geht nicht mit einer Eiterung einher und ist nicht schmerzhaft. Sie beginnt in der Regel kurz nach dem Auftreten von Fieber im akuten Stadium der Krankheit. Bei der Spaltlampenuntersuchung kann eine anteriore Uveitis festgestellt werden. Auch Iritis kann auftreten. Keratischer Niederschlag ist eine weitere Augenmanifestation (mit der Spaltlampe nachweisbar, aber normalerweise zu klein, um mit dem bloßen Auge gesehen zu werden). ⓘ
Die Kawasaki-Krankheit äußert sich auch durch eine Reihe von Symptomen im Mund, von denen eine rote Zunge, geschwollene Lippen mit vertikalen Rissen und Blutungen am charakteristischsten sind. Die Mund- und Rachenschleimhaut kann leuchtend rot sein, und die Zunge kann ein typisches "Erdbeerzungen"-Erscheinungsbild aufweisen (ausgeprägte Rötung mit hervorstehenden Geschmackspapillen). Diese Symptome im Mund werden durch eine nekrotisierende Mikrovaskulitis mit fibrinoider Nekrose verursacht. ⓘ
Eine zervikale Lymphadenopathie tritt bei 50 % bis 75 % der Kinder auf, während die anderen Merkmale bei schätzungsweise 90 % der Kinder vorkommen, manchmal aber auch das vorherrschende Symptom sein können. Gemäß den Diagnosekriterien sollte mindestens ein beeinträchtigter Lymphknoten mit einem Durchmesser von ≥ 15 mm betroffen sein. Befallene Lymphknoten sind schmerzlos oder minimal schmerzhaft, nicht fluktuierend und nicht nässend; Erytheme der benachbarten Haut können auftreten. Bei Kindern mit Fieber und Halsadenitis, die nicht auf Antibiotika ansprechen, sollte die Kawasaki-Krankheit als Teil der Differentialdiagnose in Betracht gezogen werden. ⓘ
| Weniger häufige Manifestationen ⓘ | |
|---|---|
| System | Manifestationen |
| GIT | Durchfall, Brustschmerzen, Bauchschmerzen, Erbrechen, Leberfunktionsstörungen, Pankreatitis, Gallenblasenhydrops, Parotitis, Cholangitis, Intussuszeption, intestinale Pseudoobstruktion, Aszites, Milzinfarkt |
| MSS | Polyarthritis und Arthralgie |
| CVS | Myokarditis, Perikarditis, Tachykardie, Herzklappenerkrankung |
| GU | Urethritis, Prostatitis, Zystitis, Priapismus, interstitielle Nephritis, Orchitis, nephrotisches Syndrom |
| ZNS | Lethargie, Semikom, aseptische Meningitis und sensorineurale Taubheit |
| RS | Kurzatmigkeit, grippeähnliche Erkrankung, Pleuraerguss, Atelektase |
| Haut | Erythem und Verhärtung an der BCG-Impfstelle, Beau'sche Linien und Finger-Gangrän |
| Quelle: Übersicht, Tabelle. | |
In der akuten Phase der Erkrankung können die Veränderungen an den peripheren Extremitäten Erytheme der Handflächen und Fußsohlen umfassen, die oft auffällig und scharf abgegrenzt sind und oft von schmerzhaften, bulligen Ödemen der Dorsa der Hände oder Füße begleitet werden, so dass sich die betroffenen Kinder häufig weigern, Gegenstände in den Händen zu halten oder ihre Füße zu belasten. Später, in der Rekonvaleszenz- oder subakuten Phase, beginnt die Abschuppung der Finger und Zehen in der Regel innerhalb von zwei bis drei Wochen nach Fieberbeginn in der periungualen Region und kann sich auch auf die Handflächen und Fußsohlen ausdehnen. Bei etwa 11 % der erkrankten Kinder kann die Hautabschuppung über viele Jahre anhalten. Ein bis zwei Monate nach Ausbruch des Fiebers können sich tiefe Querrillen quer über die Nägel entwickeln (Beau'sche Linien), und gelegentlich werden die Nägel abgeworfen. ⓘ
Die häufigste Hautmanifestation ist ein diffuser, makulopapulöser, erythematöser Ausschlag, der recht unspezifisch ist. Der Ausschlag variiert im Laufe der Zeit und tritt typischerweise am Rumpf auf; er kann sich weiter ausbreiten und das Gesicht, die Extremitäten und das Perineum betreffen. Es wurde über viele andere Formen von Hautläsionen berichtet; dazu können skarlatiniforme, papulöse, urtikariforme, multiform-ähnliche Erytheme und purpurne Läsionen gehören; sogar über Mikropusteln wurde berichtet. Sie kann polymorph sein, juckt nicht und wird normalerweise bis zum fünften Tag des Fiebers beobachtet. Sie ist jedoch nie bullös oder vesikulär. ⓘ
Im akuten Stadium der Kawasaki-Krankheit sind systemische entzündliche Veränderungen in vielen Organen zu beobachten. Gelenkschmerzen (Arthralgie) und -schwellungen, häufig symmetrisch, sowie Arthritis können ebenfalls auftreten. Myokarditis, Durchfall, Perikarditis, Valvulitis, aseptische Meningitis, Pneumonitis, Lymphadenitis und Hepatitis können auftreten und zeigen sich durch das Vorhandensein von Entzündungszellen in den betroffenen Geweben. Unbehandelt gehen einige Symptome mit der Zeit zurück, aber die Koronararterien-Aneurysmen bessern sich nicht, so dass ein erhebliches Risiko für Tod oder Behinderung durch Herzinfarkt besteht. Bei schneller Behandlung kann dieses Risiko weitgehend vermieden und der Krankheitsverlauf verkürzt werden. ⓘ
Zu den weiteren berichteten unspezifischen Symptomen gehören Husten, Rhinorrhoe, Sputum, Erbrechen, Kopfschmerzen und Krampfanfälle. ⓘ
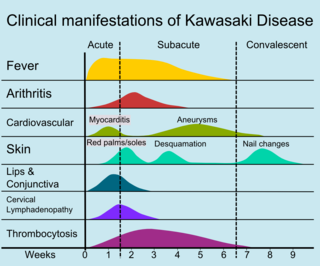
Der Krankheitsverlauf lässt sich in drei klinische Phasen einteilen.
- Die akute febrile Phase, die in der Regel ein bis zwei Wochen dauert, ist gekennzeichnet durch Fieber, konjunktivale Injektion, Erythem der Mundschleimhaut, Erythem und Schwellung der Hände und Füße, Ausschlag, zervikale Adenopathie, aseptische Meningitis, Durchfall und hepatische Dysfunktion. Eine Myokarditis ist in dieser Zeit häufig, und es kann ein Perikarderguss auftreten. Es kann eine Koronararteriitis vorliegen, aber Aneurysmen sind in der Regel noch nicht echokardiographisch sichtbar.
- Die subakute Phase beginnt, wenn Fieber, Hautausschlag und Lymphadenopathie etwa ein bis zwei Wochen nach Fieberbeginn abklingen, aber Reizbarkeit, Anorexie und konjunktivale Injektionen fortbestehen. Desquamation der Finger und Zehen und Thrombozytose sind in diesem Stadium zu beobachten, das in der Regel bis etwa vier Wochen nach dem Fieberbeginn andauert. In dieser Zeit entwickeln sich in der Regel Aneurysmen der Koronararterien, und das Risiko eines plötzlichen Todes ist am höchsten.
- Die Rekonvaleszenzphase beginnt, wenn alle klinischen Krankheitsanzeichen verschwunden sind, und dauert an, bis sich die Blutsenkungsgeschwindigkeit wieder normalisiert hat, in der Regel sechs bis acht Wochen nach Krankheitsbeginn.
Das Auftreten der Kawasaki-Krankheit im Erwachsenenalter ist selten. Das Krankheitsbild unterscheidet sich zwischen Erwachsenen und Kindern: Insbesondere scheinen Erwachsene häufiger zervikale Lymphadenopathie, Hepatitis und Arthralgie zu haben. ⓘ
Bei einigen Kindern, insbesondere bei Kleinkindern, treten atypische Verläufe ohne die klassischen Symptome auf. Solche Präsentationen sind mit einem höheren Risiko für Herzarterien-Aneurysmen verbunden. ⓘ

Herz
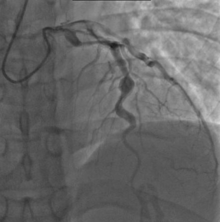
Herzkomplikationen sind der wichtigste Aspekt der Kawasaki-Krankheit, die in den Vereinigten Staaten und Japan die häufigste Ursache für Herzerkrankungen im Kindesalter ist. In den Industrieländern scheint sie das akute rheumatische Fieber als häufigste Ursache für erworbene Herzkrankheiten bei Kindern abgelöst zu haben. Koronararterien-Aneurysmen treten als Folge der Vaskulitis bei 20-25 % der unbehandelten Kinder auf. Sie werden im Durchschnitt 10 Tage nach Beginn der Erkrankung entdeckt, und die Häufigkeit von Koronararterienerweiterungen oder Aneurysmen erreicht ihren Höhepunkt innerhalb von vier Wochen nach Beginn der Erkrankung. Aneurysmen werden in kleine (Innendurchmesser der Gefäßwand < 5 mm), mittlere (Durchmesser von 5-8 mm) und riesige (Durchmesser > 8 mm) eingeteilt. Sacculäre und fusiforme Aneurysmen entwickeln sich in der Regel zwischen 18 und 25 Tagen nach Krankheitsbeginn. ⓘ
Selbst bei einer Behandlung mit hochdosiertem IVIG innerhalb der ersten 10 Tage der Erkrankung entwickeln 5 % der Kinder mit Kawasaki-Krankheit zumindest eine vorübergehende Erweiterung der Koronararterien und 1 % ein Riesenaneurysma. Der Tod kann entweder durch einen Myokardinfarkt infolge der Bildung eines Blutgerinnsels in einem Koronararterien-Aneurysma oder durch die Ruptur eines großen Koronararterien-Aneurysmas eintreten. Der Tod tritt am häufigsten zwei bis 12 Wochen nach Beginn der Erkrankung ein. ⓘ
Es wurden viele Risikofaktoren identifiziert, die Koronararterienaneurysmen vorhersagen, darunter anhaltendes Fieber nach einer IVIG-Therapie, niedrige Hämoglobinkonzentrationen, niedrige Albuminkonzentrationen, hohe Anzahl weißer Blutkörperchen, hohe Bandenzahl, hohe CRP-Konzentrationen, männliches Geschlecht und ein Alter von weniger als einem Jahr. Koronararterienläsionen infolge der Kawasaki-Krankheit verändern sich mit der Zeit dynamisch. Bei der Hälfte der Gefäße mit Koronaraneurysmen wurde eine Auflösung ein bis zwei Jahre nach Ausbruch der Erkrankung beobachtet. Die Verengung der Koronararterie, die als Folge des Heilungsprozesses der Gefäßwand auftritt, führt oft zu einer erheblichen Verengung des Blutgefäßes und dazu, dass das Herz nicht genügend Blut und Sauerstoff erhält. Dies kann schließlich zum Absterben des Herzmuskelgewebes, d. h. zum Herzinfarkt (MI), führen. ⓘ
Ein MI, der durch einen thrombotischen Verschluss in einer aneurysmatischen, stenotischen oder sowohl aneurysmatischen als auch stenotischen Koronararterie verursacht wird, ist die Haupttodesursache der Kawasaki-Krankheit. Das höchste Risiko für einen Herzinfarkt besteht im ersten Jahr nach Ausbruch der Krankheit. Ein MI bei Kindern weist andere Symptome auf als bei Erwachsenen. Die Hauptsymptome waren Schock, Unruhe, Erbrechen und Bauchschmerzen; Brustschmerzen traten am häufigsten bei älteren Kindern auf. Bei den meisten dieser Kinder trat der Infarkt im Schlaf oder in Ruhe auf, und etwa ein Drittel der Infarkte verlief asymptomatisch. ⓘ
Klappeninsuffizienzen, insbesondere der Mitral- oder Trikuspidalklappen, werden häufig in der akuten Phase der Kawasaki-Krankheit beobachtet, und zwar aufgrund einer Entzündung der Herzklappe oder einer durch eine Entzündung des Herzmuskels verursachten Myokarddysfunktion, unabhängig von einer koronaren Beteiligung. Diese Läsionen verschwinden meist mit dem Abklingen der akuten Erkrankung, aber eine sehr kleine Gruppe von Läsionen bleibt bestehen und schreitet fort. Es gibt auch eine spät auftretende Aorten- oder Mitralinsuffizienz, die durch Verdickung oder Verformung fibröser Klappen verursacht wird, wobei der Zeitpunkt mehrere Monate bis Jahre nach Ausbruch der Kawasaki-Krankheit liegt. Einige dieser Läsionen erfordern einen Klappenersatz. ⓘ
Andere
Es wurden weitere Komplikationen der Kawasaki-Krankheit beschrieben, wie z. B. Aneurysmen anderer Arterien: Aortenaneurysma, wobei eine größere Anzahl von Fällen die Bauchaorta betraf, Aneurysma der Achselhöhle, Aneurysma der Arteria brachiocephalica, Aneurysma der Arteria iliaca und der Arteria femoralis sowie Aneurysma der Nierenarterie. Es können auch andere vaskuläre Komplikationen auftreten, wie z. B. eine erhöhte Wanddicke und eine verringerte Dehnbarkeit der Karotisarterien, der Aorta und der Arteria brachioradialis. Diese Veränderung des Gefäßtonus ist eine Folge der endothelialen Dysfunktion. Darüber hinaus können Kinder mit Kawasaki-Krankheit, mit oder ohne Komplikationen der Koronararterien, ein ungünstigeres kardiovaskuläres Risikoprofil aufweisen, wie z. B. Bluthochdruck, Fettleibigkeit und ein abnormales Serumlipidprofil. ⓘ
Gastrointestinale Komplikationen bei der Kawasaki-Krankheit ähneln denen, die bei der Henoch-Schönlein-Purpura beobachtet werden, wie z. B. Darmverschluss, Dickdarmschwellung, Darmischämie, intestinale Pseudoobstruktion und akutes Abdomen. ⓘ
Augenveränderungen im Zusammenhang mit der Krankheit wurden seit den 1980er Jahren beschrieben und treten als Uveitis, Iridozyklitis, Bindehautblutung, Sehnervenentzündung, Amaurose und Verschluss der Augenarterien auf. Sie kann auch als nekrotisierende Vaskulitis auftreten, die in eine periphere Gangrän übergeht. ⓘ
Zunehmend wird über neurologische Komplikationen durch Läsionen des zentralen Nervensystems berichtet. Zu den neurologischen Komplikationen zählen Meningoenzephalitis, subduraler Erguss, zerebrale Hypoperfusion, zerebrale Ischämie und Infarkt, Kleinhirninfarkt, der sich mit Krampfanfällen, Chorea, Halbseitenlähmung, geistiger Verwirrung, Lethargie und Koma äußert, oder auch ein Hirninfarkt ohne neurologische Manifestationen. Andere neurologische Komplikationen, die auf eine Beteiligung der Hirnnerven zurückzuführen sind, sind Ataxie, Gesichtslähmung und sensorineuraler Hörverlust. Es wird angenommen, dass die Verhaltensänderungen durch eine lokalisierte zerebrale Hypoperfusion verursacht werden und Aufmerksamkeitsdefizite, Lerndefizite, emotionale Störungen (emotionale Labilität, Angst vor der Nacht und Nachtangst) und Internalisierungsprobleme (ängstliches, depressives oder aggressives Verhalten) umfassen können. ⓘ
Ursachen
Die spezifische Ursache der Kawasaki-Krankheit ist unbekannt. Eine plausible Erklärung ist, dass sie durch eine Infektion verursacht wird, die bei einer kleinen Anzahl genetisch veranlagter Kinder eine unangemessene immunologische Kaskade auslöst. Die Pathogenese ist komplex und unvollständig geklärt. Es gibt verschiedene Erklärungen. (Siehe #Klassifizierung) ⓘ
Indizien deuten auf eine infektiöse Ursache hin. Da Rezidive bei der Kawasaki-Krankheit ungewöhnlich sind, geht man davon aus, dass der Auslöser eher ein einzelner Erreger ist als eine Reihe von viralen oder bakteriellen Erregern. Verschiedene Erreger wurden in Betracht gezogen, darunter eine Infektion der oberen Atemwege durch ein neuartiges RNA-Virus. Trotz intensiver Suche konnte kein einzelner Erreger identifiziert werden. Es wurde diskutiert, ob es sich bei dem Infektionserreger um ein Superantigen handeln könnte (d. h. ein Erreger, der häufig mit einer übermäßigen Aktivierung des Immunsystems einhergeht). Der derzeitige Konsens spricht für eine übermäßige Immunreaktion auf ein herkömmliches Antigen, das in der Regel einen künftigen Schutz bietet. Die Forschung weist auf ein nicht identifiziertes ubiquitäres Virus hin, das möglicherweise über die Atemwege eindringt. ⓘ
Saisonale Trends beim Auftreten neuer Fälle der Kawasaki-Krankheit wurden mit troposphärischen Windmustern in Verbindung gebracht, was darauf schließen lässt, dass der Wind etwas transportiert, das eine immunologische Kaskade auslösen kann, wenn es von genetisch anfälligen Kindern eingeatmet wird. Winde, die aus Zentralasien wehen, korrelieren mit der Zahl der neuen Fälle der Kawasaki-Krankheit in Japan, Hawaii und San Diego. Diese Zusammenhänge werden ihrerseits durch saisonale und interannuelle Ereignisse im Rahmen der El-Niño-Südlichen Oszillation bei Winden und Meeresoberflächentemperaturen über dem tropischen Ostpazifik beeinflusst. Es wurden Anstrengungen unternommen, um einen möglichen Erreger in Luftfiltern zu identifizieren, die in großer Höhe über Japan geflogen werden. Eine Quelle wurde im Nordosten Chinas vermutet. ⓘ
Genetik
Die erhöhte Inzidenz bei Kindern japanischer Abstammung in der ganzen Welt sowie bei engen und erweiterten Familienmitgliedern der Betroffenen deutet auf eine genetische Anfälligkeit hin. Es wird angenommen, dass genetische Faktoren auch die Entwicklung von Koronararterienaneurysmen und das Ansprechen auf die Behandlung beeinflussen. Der genaue genetische Beitrag ist jedoch noch unbekannt. Genomweite Assoziationsstudien und Studien einzelner Kandidatengene haben zur Identifizierung spezifischer Einzelnukleotid-Polymorphismen (SNPs) beigetragen, die meist in Genen mit immunregulatorischen Funktionen zu finden sind. Die assoziierten Gene und ihre Expressionsniveaus scheinen zwischen verschiedenen ethnischen Gruppen zu variieren, sowohl mit asiatischem als auch mit nicht-asiatischem Hintergrund. ⓘ
SNPs in FCGR2A, CASP3, BLK, ITPKC, CD40 und ORAI1 wurden mit der Anfälligkeit, der Prognose und dem Risiko der Entwicklung von Koronararterienaneurysmen in Verbindung gebracht. Es wurden verschiedene andere mögliche Anfälligkeitsgene vorgeschlagen, darunter Polymorphismen in der HLA-Region, deren Bedeutung jedoch umstritten ist. Die genetische Anfälligkeit für die Kawasaki-Krankheit scheint komplex zu sein. Auch Gen-Gen-Wechselwirkungen scheinen die Anfälligkeit und die Prognose zu beeinflussen. Auf epigenetischer Ebene wurde eine veränderte DNA-Methylierung als ein früher mechanistischer Faktor während der akuten Phase der Krankheit vorgeschlagen. ⓘ
Diagnose
| Kriterien für die Diagnose ⓘ |
|---|
| Fieber von ≥5 Tagen Dauer in Verbindung mit mindestens vier† der fünf genannten Veränderungen |
| Beidseitige nicht-supprimative Bindehautentzündung |
| Eine oder mehrere Veränderungen der Schleimhäute der oberen Atemwege, einschließlich Rötung des Rachens, trockene, rissige Lippen, rote Lippen und "erdbeerartige" Zunge |
| Eine oder mehrere Veränderungen an Armen und Beinen, einschließlich Rötung, Schwellung, Abschälen der Haut um die Nägel und allgemeines Abschälen |
| Polymorpher Ausschlag, vor allem am Rumpf |
| Große Lymphknoten am Hals (>15 mm groß) |
| Die Krankheit kann nicht durch einen anderen bekannten Krankheitsprozess erklärt werden |
| †Die Diagnose der Kawasaki-Krankheit kann gestellt werden, wenn Fieber und nur drei Veränderungen vorhanden sind, wenn eine koronare Herzkrankheit durch zweidimensionale Echokardiographie oder Koronarangiographie nachgewiesen wird. |
| Quelle: Nelson's essentials of pediatrics, Rezension |
Da es keinen spezifischen Labortest für die Kawasaki-Krankheit gibt, muss die Diagnose auf der Grundlage der klinischen Anzeichen und Symptome zusammen mit den Laborbefunden gestellt werden. Eine rechtzeitige Diagnose erfordert eine sorgfältige Anamneseerhebung und eine gründliche körperliche Untersuchung. Die Diagnosestellung ist schwierig, vor allem zu Beginn der Erkrankung, und häufig wird die Diagnose erst gestellt, nachdem die Kinder mehrere Ärzte aufgesucht haben. Viele andere schwere Krankheiten können ähnliche Symptome hervorrufen und müssen bei der Differenzialdiagnose berücksichtigt werden, darunter Scharlach, das toxische Schocksyndrom, die juvenile idiopathische Arthritis und die Quecksilbervergiftung im Kindesalter (infantile Akrodynie). ⓘ
Klassischerweise müssen fünf Tage Fieber und vier von fünf Diagnosekriterien erfüllt sein, um die Diagnose zu stellen. Die Kriterien sind:
- Rötung der Lippen oder der Mundhöhle oder Aufplatzen der Lippen
- Ausschlag am Rumpf
- Schwellungen oder Rötungen an Händen oder Füßen
- gerötete Augen (konjunktivale Injektion)
- geschwollene Lymphknoten im Nacken von mindestens 15 mm ⓘ
Viele Kinder, insbesondere Säuglinge, bei denen schließlich die Kawasaki-Krankheit diagnostiziert wird, weisen nicht alle der oben genannten Kriterien auf. Viele Experten empfehlen inzwischen, die Kawasaki-Krankheit auch dann zu behandeln, wenn das Fieber erst drei Tage alt ist und mindestens drei diagnostische Kriterien erfüllt sind, insbesondere wenn andere Tests Anomalien ergeben, die auf die Kawasaki-Krankheit hindeuten. Darüber hinaus kann die Diagnose allein durch den Nachweis von Koronararterien-Aneurysmen in der richtigen klinischen Umgebung gestellt werden. ⓘ
Laborbefunde können die Erkrankung nicht beweisen oder widerlegen; sie können die Verdachtsdiagnose bei nicht eindeutigen klinischen Zeichen wahrscheinlicher oder unwahrscheinlicher machen:
- Serologie
- AECA (anti-endothelial cell antibodies Endothelzellantikörper)
- Leukozyten
- Leukozytose mit Linksverschiebung (50 % der Patienten haben > 15 Leukozyten/nl).
- Blutkörperchensenkungsgeschwindigkeit, CRP
- Häufig erhöht, manchmal stark erhöht.
- α2-Globuline
- erhöht
- Hämoglobin
- Zunehmende Anämie bei längerer Krankheitsdauer.
- Thrombozyten
- Stark erhöhte Anzahl, oft ab der zweiten bis dritten Krankheitswoche, dann auch > 1 000 Thrombozyten/nl.
- Transaminasen
- Häufig gering erhöhte Serumspiegel.
- Albumin
- Erniedrigt, ausgeprägter bei längerer und schwerer Erkrankung.
- Natrium
- Erniedrigt, eventuell auch als Ausdruck einer erhöhten ADH-Sekretion.
- Urin
- Sterile Leukozyturie.
- Liquor
- Bei 30 bis 50 % vermehrt Monozyten, oft ohne Eiweißerhöhung.
- Gelenkflüssigkeit
- Steril, > 100 000 Leukozyten/ml. ⓘ
Neuer Marker im Urin. Amerikanischen Forschern ist es 2012 gelungen, Marker im Harn betroffener Kinder zu finden, welche die Erkrankung schneller sicher diagnostizierbar machen. Diese Biomarker sind das Filamin C (wird aus nekrotischen Herz- und Skelettmuskelzellen über den Urin ausgeschieden) und das Meprin A (Enzym der Entzündungsreaktion). Die Diagnose anhand dieser Marker erfolgte in einer Studie mit 107 Patienten mit 98%iger Genauigkeit. ⓘ
Untersuchungen
Bei der körperlichen Untersuchung werden viele der oben genannten Merkmale festgestellt. ⓘ
Blutuntersuchungen
- Das vollständige Blutbild kann eine normozytäre Anämie und eventuell eine Thrombozytose aufzeigen.
- Die Erythrozytensedimentationsrate ist erhöht.
- Das C-reaktive Protein wird erhöht sein.
- Leberfunktionstests können Hinweise auf eine Leberentzündung und niedrige Serumalbuminwerte zeigen. ⓘ
Weitere optionale Tests sind:
- Das Elektrokardiogramm kann Hinweise auf eine ventrikuläre Dysfunktion oder gelegentlich auf Herzrhythmusstörungen aufgrund einer Myokarditis zeigen.
- Das Echokardiogramm kann subtile Veränderungen der Koronararterien oder später echte Aneurysmen zeigen.
- Ultraschall oder Computertomographie können einen Hydrops (Vergrößerung) der Gallenblase zeigen.
- Die Urinanalyse kann weiße Blutkörperchen und Eiweiß im Urin (Pyurie und Proteinurie) zeigen, ohne dass ein bakterielles Wachstum nachgewiesen werden kann.
- Eine Lumbalpunktion kann Hinweise auf eine aseptische Meningitis liefern.
- Die Angiographie wurde in der Vergangenheit zum Nachweis von Koronararterienaneurysmen eingesetzt und ist nach wie vor der Goldstandard für den Nachweis von Koronararterienaneurysmen, wird aber heute nur noch selten eingesetzt, es sei denn, es wurden bereits Koronararterienaneurysmen durch Echokardiographie nachgewiesen. ⓘ
Eine Biopsie wird selten durchgeführt, da sie für die Diagnose nicht erforderlich ist. ⓘ
Untertypen
Auf der Grundlage der klinischen Befunde kann eine diagnostische Unterscheidung zwischen dem "klassischen" / "typischen" Erscheinungsbild der Kawasaki-Krankheit und dem "unvollständigen" / "atypischen" Erscheinungsbild einer "vermuteten" Form der Krankheit getroffen werden. Hinsichtlich der "unvollständigen" / "atypischen" Präsentation heißt es in den Richtlinien der American Heart Association, dass die Kawasaki-Krankheit "bei der Differentialdiagnose von anhaltendem unerklärlichem Fieber im Kindesalter in Verbindung mit einem der wichtigsten klinischen Merkmale der Krankheit in Betracht gezogen werden sollte, und die Diagnose kann als bestätigt angesehen werden, wenn bei solchen Patienten Koronararterien-Aneurysmen durch Echokardiographie identifiziert werden". ⓘ
Eine weitere Unterscheidung zwischen "unvollständigen" und "atypischen" Subtypen kann auch beim Vorhandensein von untypischen Symptomen getroffen werden. ⓘ
Falldefinition
Für Studienzwecke, einschließlich der Überwachung der Impfstoffsicherheit, wurde eine internationale Falldefinition vorgeschlagen, um "eindeutige" (d. h. vollständige/unvollständige), "wahrscheinliche" und "mögliche" Fälle der Kawasaki-Krankheit zu kategorisieren. ⓘ
Differentialdiagnose
Die Breite der Differenzialdiagnose ist eine Herausforderung für die rechtzeitige Diagnose der Kawasaki-Krankheit. Zu den infektiösen und nichtinfektiösen Erkrankungen, die in Betracht gezogen werden müssen, gehören: Masern und andere Virusinfektionen (z. B. Adenovirus, Enterovirus), durch Staphylokokken und Streptokokken verursachte toxinvermittelte Krankheiten wie Scharlach und toxisches Schocksyndrom, Überempfindlichkeitsreaktionen auf Arzneimittel (einschließlich Stevens-Johnson-Syndrom), systemisch auftretende juvenile idiopathische Arthritis, Rocky-Mountain-Fleckfieber oder andere Rickettsieninfektionen und Leptospirose. Zu den Infektionskrankheiten, die die Kawasaki-Krankheit imitieren können, gehören periorbitale Zellulitis, peritonsillärer Abszess, retropharyngealer Abszess, zervikale Lymphadenitis, Parvovirus B19, Mononukleose, rheumatisches Fieber, Meningitis, Staphylokokkenverbrühung, toxische epidermale Nekrolyse und Lyme-Krankheit. ⓘ
Kawasakiähnliche Krankheit in zeitlichem Zusammenhang mit COVID-19
Im Jahr 2020 tauchten in den USA und in Europa Berichte über eine Kawasakiähnliche Krankheit nach einer Exposition gegenüber SARS-CoV-2, dem für COVID-19 verantwortlichen Virus, auf. Die Weltgesundheitsorganisation prüft derzeit mögliche Verbindungen zu COVID-19. Diese neu auftretende Erkrankung wurde vom Royal College of Paediatrics and Child Health als "pädiatrisches Multisystem-Entzündungssyndrom" und von den Centers for Disease Control and Prevention als "Multisystem-Entzündungssyndrom bei Kindern" bezeichnet. Diese Organisationen haben Leitlinien für die Diagnose und Meldung von Fällen herausgegeben. ⓘ
Klassifizierung
Es ist umstritten, ob die Kawasaki-Krankheit als charakteristische Immunreaktion auf einen infektiösen Erreger, als Autoimmunprozess oder als autoinflammatorische Erkrankung (d. h. mit Beteiligung des angeborenen und nicht des adaptiven Immunsystems) betrachtet werden sollte. Insgesamt deuten immunologische Forschungen darauf hin, dass die Kawasaki-Krankheit mit einer Reaktion auf ein herkömmliches Antigen (und nicht auf ein Superantigen) einhergeht, die sowohl die Aktivierung des angeborenen Immunsystems als auch Merkmale einer adaptiven Immunantwort beinhaltet. Die Identifizierung der genauen Art des Immunprozesses, der an der Kawasaki-Krankheit beteiligt ist, könnte die Forschung bei der Verbesserung der klinischen Behandlung unterstützen. ⓘ
Entzündungen oder Vaskulitiden der Arterien und Venen treten überall im Körper auf und werden in der Regel durch eine erhöhte Produktion von Zellen des Immunsystems gegen einen Krankheitserreger oder durch Autoimmunität verursacht. Systemische Vaskulitiden können nach der Art der an der Proliferation beteiligten Zellen sowie nach der spezifischen Art der Gewebeschädigung in den Venen- oder Arterienwänden klassifiziert werden. Nach diesem Klassifizierungsschema für systemische Vaskulitiden gilt die Kawasaki-Krankheit als nekrotisierende Vaskulitis (auch nekrotisierende Angiitis genannt), die histologisch durch das Auftreten von Nekrose (Gewebetod), Fibrose und Proliferation von Zellen in Verbindung mit Entzündungen in der inneren Schicht der Gefäßwand identifiziert werden kann. ⓘ
Andere Krankheiten, die mit einer nekrotisierenden Vaskulitis einhergehen, sind Polyarteritis nodosa, Granulomatose mit Polyangiitis, Henoch-Schönlein Purpura und eosinophile Granulomatose mit Polyangiitis. ⓘ
Die Kawasaki-Krankheit kann weiter als Vaskulitis der mittleren Gefäße klassifiziert werden, die mittlere und kleine Blutgefäße betrifft, wie z. B. die kleineren kutanen Gefäße (Venen und Arterien in der Haut) mit einem Durchmesser von 50 bis 100 µm. Die Kawasaki-Krankheit wird auch als primäre Vaskulitis im Kindesalter betrachtet, eine Erkrankung, die mit Vaskulitis einhergeht und hauptsächlich Kinder unter 18 Jahren betrifft. Eine kürzlich durchgeführte, auf einem Konsens basierende Bewertung von Vaskulitiden, die hauptsächlich bei Kindern auftreten, führte zu einem Klassifizierungsschema für diese Erkrankungen, um sie voneinander abzugrenzen und eine konkretere Reihe von Diagnosekriterien für jede Erkrankung vorzuschlagen. Innerhalb dieser Klassifizierung von Vaskulitiden im Kindesalter ist die Kawasaki-Krankheit wiederum eine Vaskulitis mit vorwiegend mittelgroßen Gefäßen. ⓘ
Sie kann auch als eine Autoimmunform der Vaskulitis eingestuft werden. Sie ist nicht mit anti-neutrophilen zytoplasmatischen Antikörpern assoziiert, im Gegensatz zu anderen vaskulitischen Erkrankungen, die mit diesen Antikörpern assoziiert sind (wie Granulomatose mit Polyangiitis, mikroskopische Polyangiitis und eosinophile Granulomatose mit Polyangiitis). Diese Form der Kategorisierung ist für eine angemessene Behandlung von Bedeutung. ⓘ
Behandlung
Kinder mit Kawasaki-Krankheit sollten stationär aufgenommen und von einem Arzt betreut werden, der Erfahrung mit dieser Krankheit hat. In einem akademischen medizinischen Zentrum wird die Behandlung häufig von Spezialisten für Kinderkardiologie, Kinderrheumatologie und pädiatrische Infektionskrankheiten gemeinsam durchgeführt (obwohl noch kein spezifischer Infektionserreger identifiziert wurde). Um eine Schädigung der Herzkranzgefäße zu verhindern, sollte die Behandlung unmittelbar nach der Diagnose eingeleitet werden. ⓘ
Intravenöses Immunglobulin (IVIG) ist die Standardbehandlung der Kawasaki-Krankheit und wird in hohen Dosen verabreicht, wobei in der Regel innerhalb von 24 Stunden eine deutliche Besserung eintritt. Wenn das Fieber nicht anspricht, kann eine zusätzliche Dosis in Betracht gezogen werden. In seltenen Fällen kann auch eine dritte Dosis verabreicht werden. IVIG ist vor allem innerhalb der ersten sieben Tage nach Auftreten des Fiebers sinnvoll, um ein Koronararterien-Aneurysma zu verhindern. IVIG, das innerhalb der ersten 10 Tage der Erkrankung verabreicht wird, verringert das Risiko einer Schädigung der Koronararterien bei Kindern, ohne dass es zu schwerwiegenden unerwünschten Wirkungen kommt. ⓘ
Die Salicylattherapie, insbesondere Aspirin, ist nach wie vor ein wichtiger Bestandteil der Behandlung (auch wenn sie von einigen in Frage gestellt wird), aber Salicylate allein sind nicht so wirksam wie IVIG. Es gibt nur wenige Hinweise darauf, ob Kinder weiterhin Salicylate als Teil ihrer Behandlung erhalten sollten. Die Aspirin-Therapie wird mit hohen Dosen begonnen, bis das Fieber abklingt, und dann mit einer niedrigen Dosis fortgesetzt, wenn der Patient nach Hause zurückkehrt, normalerweise für zwei Monate, um die Bildung von Blutgerinnseln zu verhindern. Abgesehen von der Kawasaki-Krankheit und einigen anderen Indikationen wird Aspirin aufgrund der Assoziation mit dem Reye-Syndrom in der Regel nicht für Kinder empfohlen. Da Kinder mit Kawasaki-Krankheit bis zu mehreren Monaten Aspirin einnehmen müssen, ist eine Impfung gegen Windpocken und Influenza erforderlich, da diese Infektionen am ehesten das Reye-Syndrom auslösen können. ⓘ
Hochdosiertes Aspirin wird mit Anämie in Verbindung gebracht und wirkt sich nicht positiv auf den Krankheitsverlauf aus. ⓘ
Etwa 15-20 % der Kinder zeigen nach der ersten IVIG-Infusion anhaltendes oder wiederkehrendes Fieber und werden als IVIG-resistent eingestuft. Der Einsatz von TNF-alpha-Blockern (TNF-α) könnte die Behandlungsresistenz und die Infusionsreaktion nach Behandlungsbeginn verringern, doch sind weitere Untersuchungen erforderlich. Aufgrund der möglichen Beteiligung des hochregulierten Kalzium-Kernfaktor-der-aktivierten-T-Zellen-Wegs an der Entwicklung der Krankheit wurde in einer Studie aus dem Jahr 2019 festgestellt, dass die Kombination von Ciclosporin und IVIG-Infusion Anomalien der Koronararterien unterdrücken kann. Weitere Untersuchungen sind erforderlich, um festzustellen, welche Patienten am besten auf diese Behandlung ansprechen. ⓘ
Auch Kortikosteroide werden eingesetzt, insbesondere wenn andere Behandlungen versagen oder die Symptome wiederkehren. In einer randomisierten kontrollierten Studie führte die Kombination von Kortikosteroiden mit Immunglobulin und Aspirin jedoch nicht zu einer Verbesserung der Ergebnisse. Darüber hinaus ist die Anwendung von Kortikosteroiden bei der Kawasaki-Krankheit mit einem erhöhten Risiko für ein Koronararterien-Aneurysma verbunden, so dass ihre Anwendung in dieser Situation generell kontraindiziert ist. In Fällen der Kawasaki-Krankheit, die auf IVIG nicht ansprechen, wurden Cyclophosphamid und Plasmaaustausch als mögliche Behandlungsmethoden untersucht, wobei die Ergebnisse unterschiedlich ausfielen. Ein 2017 veröffentlichter (und 2022 aktualisierter) Cochrane-Review ergab jedoch, dass der Einsatz von Kortikosteroiden in der akuten Phase der KD bei Kindern mit einer Verbesserung der Koronararterienanomalien, kürzeren Krankenhausaufenthalten, einer geringeren Dauer der klinischen Symptome und einer Verringerung der Entzündungsmarkerwerte verbunden war. Patientenpopulationen in Asien, Menschen mit höheren Risikowerten und solche, die länger mit Steroiden behandelt werden, könnten einen größeren Nutzen aus dem Einsatz von Steroiden ziehen. ⓘ
Prognose
Bei frühzeitiger Behandlung ist eine rasche Erholung von den akuten Symptomen zu erwarten, und das Risiko von Koronararterien-Aneurysmen wird stark reduziert. Unbehandelt sind die akuten Symptome der Kawasaki-Krankheit selbstbegrenzend (d. h. der Patient erholt sich irgendwann), aber das Risiko einer Beteiligung der Koronararterien ist viel größer, selbst viele Jahre später. Viele Fälle von Myokardinfarkten bei jungen Erwachsenen werden inzwischen auf die Kawasaki-Krankheit zurückgeführt, die in der Kindheit nicht diagnostiziert worden war. Insgesamt sterben etwa 2 % der Patienten an den Komplikationen der koronaren Vaskulitis. ⓘ
Labornachweise einer verstärkten Entzündung in Verbindung mit demografischen Merkmalen (männliches Geschlecht, Alter unter sechs Monaten oder über acht Jahre) und unvollständigem Ansprechen auf eine IVIG-Therapie ergeben das Profil eines Hochrisikopatienten mit Kawasaki-Krankheit. Die Wahrscheinlichkeit, dass sich ein Aneurysma zurückbildet, scheint in hohem Maße von seiner anfänglichen Größe abhängig zu sein, wobei kleinere Aneurysmen eine größere Rückbildungswahrscheinlichkeit aufweisen. Andere Faktoren stehen in einem positiven Zusammenhang mit der Rückbildung von Aneurysmen, darunter ein Alter von weniger als einem Jahr bei Ausbruch der Kawasaki-Krankheit, die Morphologie eines fusiformen statt eines sackförmigen Aneurysmas und die Lage des Aneurysmas in einem distalen Koronarsegment. Die höchste Progressionsrate zur Stenose tritt bei denjenigen auf, die große Aneurysmen entwickeln. Die schlechteste Prognose haben Kinder mit Riesenaneurysmen. Dieses schwere Ergebnis kann weitere Behandlungen wie perkutane transluminale Angioplastie, Koronarstenting, Bypass-Transplantation und sogar eine Herztransplantation erforderlich machen. ⓘ
Kurz nach der Erstbehandlung mit IVIG kann es zu einem Rückfall der Symptome kommen. Dies erfordert in der Regel eine erneute Einweisung in ein Krankenhaus und eine erneute Behandlung. Die Behandlung mit IVIG kann allergische und nicht-allergische akute Reaktionen, aseptische Meningitis, Flüssigkeitsüberladung und selten auch andere schwerwiegende Reaktionen hervorrufen. Insgesamt sind lebensbedrohliche Komplikationen infolge der Therapie der Kawasaki-Krankheit äußerst selten, insbesondere im Vergleich zum Risiko einer Nichtbehandlung. Es gibt Hinweise darauf, dass die Kawasaki-Krankheit einen veränderten Fettstoffwechsel hervorruft, der über das klinische Abklingen der Krankheit hinaus bestehen bleibt. ⓘ
In seltenen Fällen kann es bei der Kawasaki-Krankheit mit oder ohne Behandlung zu einem Rezidiv kommen. ⓘ
Epidemiologie
Die Kawasaki-Krankheit betrifft mehr Jungen als Mädchen und Menschen asiatischer Abstammung, insbesondere Japaner. Es wird angenommen, dass die höhere Inzidenz in asiatischen Bevölkerungsgruppen mit einer genetischen Anfälligkeit zusammenhängt. Die Inzidenzraten variieren von Land zu Land. ⓘ
Derzeit ist die Kawasaki-Krankheit die weltweit am häufigsten diagnostizierte pädiatrische Vaskulitis. Die bei weitem höchste Inzidenz der Kawasaki-Krankheit findet sich in Japan, wo die jüngste Studie eine Erkrankungsrate von 218,6 pro 100.000 Kinder unter fünf Jahren (etwa eines von 450 Kindern) angibt. Bei dieser derzeitigen Anfallsrate wird mehr als eines von 150 Kindern in Japan im Laufe seines Lebens an der Kawasaki-Krankheit erkranken. ⓘ
Die Häufigkeit der Erkrankung in den Vereinigten Staaten nimmt jedoch zu. Die Kawasaki-Krankheit ist vorwiegend eine Erkrankung von Kleinkindern, wobei 80 % der Patienten jünger als fünf Jahre sind. Jedes Jahr werden in den USA etwa 2.000 bis 4.000 Fälle festgestellt (9 bis 19 pro 100.000 Kinder unter fünf Jahren). In den kontinentalen Vereinigten Staaten tritt die Kawasaki-Krankheit häufiger im Winter und zu Beginn des Frühjahrs auf, die Zahl der erkrankten Jungen übersteigt die der Mädchen um ≈1,5-1,7:1, und 76 % der betroffenen Kinder sind jünger als fünf Jahre. ⓘ
Im Vereinigten Königreich wurde die Krankheit bis zum Jahr 2000 bei weniger als einem von 25 000 Menschen pro Jahr diagnostiziert. Von 1991 bis 2000 verdoppelte sich die Inzidenz der Krankheit jedoch: 1991 gab es vier Fälle pro 100 000 Kinder, im Jahr 2000 waren es acht Fälle pro 100 000. Bis 2017 stieg diese Zahl auf 12 von 100.000 Menschen mit 419 diagnostizierten Fällen der Kawasaki-Krankheit im Vereinigten Königreich. ⓘ
In Japan liegt die Rate bei 240 von 100.000 Menschen. ⓘ
Man geht davon aus, dass 5 % der Fälle von akutem Koronarsyndrom bei Erwachsenen unter 40 Jahren auf Koronararterien-Aneurysmen infolge der Kawasaki-Krankheit zurückzuführen sind. ⓘ
Geschichte
Die Krankheit wurde erstmals im Januar 1961 von Tomisaku Kawasaki bei einem vierjährigen Kind mit Ausschlag und Fieber im Rote-Kreuz-Krankenhaus in Tokio festgestellt, und er veröffentlichte später einen Bericht über 50 ähnliche Fälle. Später waren Kawasaki und Kollegen davon überzeugt, dass das Herz definitiv betroffen war, als sie 23 Fälle untersuchten und berichteten, von denen 11 (48 %) Patienten Anomalien aufwiesen, die durch ein Elektrokardiogramm festgestellt wurden. 1974 wurde die erste Beschreibung dieser Störung in der englischsprachigen Literatur veröffentlicht. Im Jahr 1976 beschrieben Melish et al. die gleiche Krankheit bei 16 Kindern auf Hawaii. Melish und Kawasaki hatten unabhängig voneinander dieselben Diagnosekriterien für die Erkrankung entwickelt, die auch heute noch für die Diagnose der klassischen Kawasaki-Krankheit verwendet werden. Dr. Kawasaki starb am 5. Juni 2020 im Alter von 95 Jahren. ⓘ
Es wurde die Frage aufgeworfen, ob die Krankheit nur in der Zeit zwischen 1960 und 1970 auftrat, aber später wurde ein konserviertes Herz eines siebenjährigen Jungen, der 1870 gestorben war, untersucht und zeigte drei Aneurysmen der Koronararterien mit Gerinnseln sowie pathologische Veränderungen, die mit der Kawasaki-Krankheit vereinbar waren. Die Kawasaki-Krankheit ist heute weltweit anerkannt. Warum die ersten Fälle auf allen Kontinenten in den 1960er und 1970er Jahren auftraten, ist unklar. Mögliche Erklärungen sind die Verwechslung mit anderen Krankheiten wie Scharlach und die leichtere Erkennbarkeit aufgrund moderner medizinischer Faktoren wie dem weit verbreiteten Einsatz von Antibiotika. Insbesondere decken sich alte pathologische Beschreibungen der infantilen Polyarteriitis nodosa aus westlichen Ländern mit Berichten über tödliche Fälle der Kawasaki-Krankheit. ⓘ
In den Vereinigten Staaten und anderen Industrieländern scheint die Kawasaki-Krankheit das akute rheumatische Fieber als häufigste Ursache für erworbene Herzerkrankungen bei Kindern abgelöst zu haben. ⓘ
Das Kawasaki-Syndrom wurde in Japan seit 1961 beobachtet und als eigenständiges Krankheitsbild 1967 durch den Arzt Tomisaku Kawasaki beschrieben. Eine Studie aus dem Jahr 2011 bringt die Erkrankung in Zusammenhang mit Luftströmungen vom Meer. Wegweisend für die Entdeckung des Kawasaki-Syndroms in Deutschland war Hansjörg Cremer. ⓘ
Nebensymptome
- Herz- und Gefäßsymptome
- Diese treten hauptsächlich in der Frühphase auf und sind maßgeblich für die Langzeitmorbidität und -letalität verantwortlich: Myokarditis (50 %), Perikarditis, Herzklappenprobleme, Aneurysmabildung der Herzkranzgefäße und anderer Arterien, Raynaud-Symptomatik.
- Neurologische Symptome
- Oft ausgeprägte Irritabilität, nicht-infektiöse Hirnhautentzündung, zentraler Hörverlust.
- Atemwege
- Husten, Schnupfen, Heiserkeit.
- Bauchsymptome (bei 30 % aller Patienten)
- Bauchschmerzen, Durchfall, Erbrechen, paralytischer Ileus, Gallenblasenhydrops (bei 15 % aller Patienten sonographisch nachweisbar), Vergrößerung von Leber und Milz.
- Harnwege
- Harnröhrenentzündung mit Schmerzen beim Wasserlassen und Leukozyten im Urin.
- Gelenke
- Schmerzen und seltener Entzündungen in der ersten Krankheitswoche an multiplen Gelenken, bei Beginn dieser Beschwerden nach dem 10. Tag eher an großen gewichtstragenden Gelenken.
- Augen
- Uveitis anterior, die sich rasch wieder bessert und ohne Folgen abheilt. ⓘ
Differentialdiagnosen
Virale und bakterielle Erkrankungen, Leptospiren, systemische Form der juvenilen idiopathischen Arthritis, Polyarteriitis nodosa, Quecksilbervergiftung. Bei inkomplettem Kawasaki-Syndrom bestehen zahlreiche weitere Verwechslungsmöglichkeiten. Bei Fieber unklarer Ursache sollte besonders beim kleinen Kind frühzeitig an die Differentialdiagnose Kawasaki-Syndrom gedacht werden und neben den Laboruntersuchungen auch eine Echokardiographie durchgeführt werden mit Untersuchung der Herzkranzgefäße. ⓘ
Komplikationen
- Entzündung der Herzkranzgefäße (Koronararterien)
- mit Aneurysmabildung
- oder nach Jahren auftretenden Stenosen
- Myokarditis oder Perikarditis (Herzbeutelentzündung) in der akuten Phase
- Herzinfarkt (häufigste Todesursache: 1 bis 2 %)
- Herzrhythmusstörungen ⓘ
Therapie
Die Krankheit wird gemeinhin stationär behandelt. Die Therapie hat eine Reduktion der Entzündung und die Vermeidung von Aneurysmen der Herzkranzgefäße zum Ziel, welche meistens in der zweiten bis dritten Woche entstehen. Es konnte gezeigt werden, dass durch eine Therapie das Auftreten von Herzkranzgefäßveränderungen von 25 % auf 2 bis 4 % gesenkt werden konnte. Deshalb ist ein Therapiebeginn vor dem zehnten Tag entscheidend für einen günstigen Verlauf. Die initiale Therapie ist:
- Immunglobuline hochdosiert: 2 g/kg Körpergewicht in zwölf Stunden als Infusion, nach einer sehr frühen Gabe und unbefriedigendem Ansprechen eventuell ein weiteres Mal.
- Acetylsalicylsäure (ASS) bis zum Abklingen der akuten Entzündung hochdosiert (30 bis 100 mg/kg KG/Tag) für 14 Tage. Die Dosis wird kontrovers diskutiert.
- Ob kortisonähnliche Medikamente bei „Therapieversagern“ hilfreich sind, ist noch Gegenstand der Forschung, sie zeigen wohl zumindest einen additiven Effekt. Eine Kortisonpulsbehandlung war nicht besser als Placebo. ⓘ
Eine längerdauernde Behandlung im Anschluss wird zur Thromboseprophylaxe mit Acetylsalicylsäure 3 bis 5 mg/kg KG/Tag für zirka sechs bis acht Wochen empfohlen, weitere Maßnahmen richten sich nach dem Auftreten von Koronaraneurysmen: So lange ein Aneurysma besteht, sollte ASS in der niedrigen Dosierung keinesfalls abgesetzt werden. Hat sich ein großes Aneurysma mit Verengungen gebildet, sollte gegebenenfalls die Blutgerinnung mittels anderer Medikamente wie beispielsweise Phenprocoumon gehemmt werden. Ferner kommen eventuell Bypässe etc. in Frage. ⓘ
Langzeiterwartungen
Die akute Erkrankung heilt in aller Regel ohne Komplikationen aus. Wenn Komplikationen an den Herzkranzgefäßen auftreten, ist nach heutiger Einschätzung das Arteriosklerose-Risiko aufgrund der veränderten Gefäßwand erhöht. Aus diesem Grund sollten Kawasaki-Patienten langfristig kardiologisch nachuntersucht werden. Ein weiteres Symptom ist eine eingeschränkte Leistungsfähigkeit des Körpers bei Belastung (Sport). ⓘ