Elektroenzephalografie
| Elektroenzephalographie ⓘ | |
|---|---|
 EEG-überwachte epileptische Spike- und Wellenentladungen |
Die Elektroenzephalographie (EEG) ist eine Methode zur Aufzeichnung eines Elektrogramms der elektrischen Aktivität auf der Kopfhaut, die nachweislich die makroskopische Aktivität der darunter liegenden Oberflächenschicht des Gehirns darstellt. Sie ist in der Regel nicht invasiv, wobei die Elektroden entlang der Kopfhaut angebracht werden. Die Elektrokortikographie, bei der invasive Elektroden verwendet werden, wird manchmal als "intrakranielles EEG" bezeichnet. ⓘ
Das EEG misst Spannungsschwankungen, die durch Ionenströme in den Neuronen des Gehirns entstehen. In der klinischen Praxis bezieht sich das EEG auf die Aufzeichnung der spontanen elektrischen Aktivität des Gehirns über einen bestimmten Zeitraum, die über mehrere auf der Kopfhaut angebrachte Elektroden aufgezeichnet wird. Diagnostische Anwendungen konzentrieren sich im Allgemeinen entweder auf ereigniskorrelierte Potenziale oder auf den spektralen Inhalt des EEG. Ersteres untersucht Potenzialschwankungen, die zeitlich an ein Ereignis gebunden sind, wie z. B. das Einsetzen eines Reizes oder das Drücken einer Taste. Letzteres analysiert die Art der neuronalen Oszillationen (im Volksmund "Gehirnwellen" genannt), die in EEG-Signalen im Frequenzbereich beobachtet werden können. ⓘ
Das EEG wird am häufigsten zur Diagnose von Epilepsie eingesetzt, die Anomalien in den EEG-Messwerten verursacht. Es wird auch zur Diagnose von Schlafstörungen, Narkosetiefe, Koma, Enzephalopathien und Hirntod verwendet. Früher war das EEG die erste Diagnosemethode bei Tumoren, Schlaganfällen und anderen fokalen Hirnstörungen, doch mit dem Aufkommen hochauflösender anatomischer Bildgebungsverfahren wie der Magnetresonanztomographie (MRT) und der Computertomographie (CT) ist diese Verwendung zurückgegangen. Trotz der begrenzten räumlichen Auflösung ist das EEG weiterhin ein wertvolles Instrument für Forschung und Diagnose. Es ist eine der wenigen verfügbaren mobilen Techniken und bietet eine zeitliche Auflösung im Millisekundenbereich, die mit CT, PET oder MRT nicht möglich ist. ⓘ
Zu den Ableitungen der EEG-Technik gehören die evozierten Potenziale (EP), bei denen die EEG-Aktivität in Abhängigkeit von der Darbietung eines bestimmten Reizes (visuell, somatosensorisch oder auditiv) gemittelt wird. Die ereigniskorrelierten Potenziale (ERP) beziehen sich auf gemittelte EEG-Reaktionen, die zeitlich mit einer komplexeren Verarbeitung von Reizen verbunden sind; diese Technik wird in der Kognitionswissenschaft, der kognitiven Psychologie und der psychophysiologischen Forschung eingesetzt. ⓘ


Die Elektroenzephalografie (EEG, von altgriechisch ἐγκέφαλος enképhalos, deutsch ‚Gehirn‘, γράφειν gráphein, deutsch ‚schreiben‘) ist eine Methode der medizinischen Diagnostik und der neurologischen Forschung zur Messung der summierten elektrischen Aktivität des Gehirns durch Aufzeichnung der Spannungsschwankungen an der Kopfoberfläche. Das Elektroenzephalogramm (ebenfalls EEG abgekürzt) ist die grafische Darstellung dieser Schwankungen. Das EEG ist neben der Elektroneurografie (ENG) und der Elektromyografie (EMG) eine standardmäßige Untersuchungsmethode in der Neurologie. ⓘ
Geschichte


1875 stellte der in Liverpool praktizierende Arzt Richard Caton (1842-1926) im British Medical Journal seine Erkenntnisse über elektrische Phänomene an den freiliegenden Gehirnhälften von Kaninchen und Affen vor. 1890 veröffentlichte der polnische Physiologe Adolf Beck eine Untersuchung der spontanen elektrischen Aktivität des Gehirns von Kaninchen und Hunden, die rhythmische, durch Licht veränderte Schwingungen enthielt. Beck begann mit Experimenten über die elektrische Hirnaktivität von Tieren. Beck setzte Elektroden direkt auf die Oberfläche des Gehirns, um sensorische Stimulationen zu testen. Seine Beobachtung der fluktuierenden Hirnaktivität führte zu dem Schluss, dass es sich um Gehirnwellen handelt. ⓘ
1912 veröffentlichte der ukrainische Physiologe Vladimir Vladimirovich Pravdich-Neminsky das erste EEG bei Tieren und das evozierte Potenzial bei Säugetieren (Hunden). 1914 fotografierten Napoleon Cybulski und Jelenska-Macieszyna EEG-Aufzeichnungen von experimentell ausgelösten Krampfanfällen. ⓘ
Der deutsche Physiologe und Psychiater Hans Berger (1873-1941) zeichnete 1924 das erste menschliche EEG auf. In Erweiterung der zuvor von Richard Caton und anderen an Tieren durchgeführten Arbeiten erfand Berger auch das Elektroenzephalogramm (das dem Gerät seinen Namen gab), eine Erfindung, die als "eine der überraschendsten, bemerkenswertesten und folgenreichsten Entwicklungen in der Geschichte der klinischen Neurologie" beschrieben wird. Seine Entdeckungen wurden erstmals 1934 von den britischen Wissenschaftlern Edgar Douglas Adrian und B. H. C. Matthews bestätigt und von ihnen weiterentwickelt. ⓘ
Im Jahr 1934 wiesen Fisher und Lowenbach erstmals epileptiforme Spikes nach. 1935 beschrieben Gibbs, Davis und Lennox interiktale Spike-Wellen und das Drei-Zyklen-Muster klinischer Abwesenheitsanfälle, womit der Bereich der klinischen Elektroenzephalographie begann. In der Folge beschrieben Gibbs und Jasper 1936 die interiktalen Spikes als fokale Signatur der Epilepsie. Im selben Jahr wurde am Massachusetts General Hospital das erste EEG-Labor eröffnet. ⓘ
Franklin Offner (1911-1999), Professor für Biophysik an der Northwestern University, entwickelte einen EEG-Prototyp, der eine piezoelektrische Schreibmaschine, den so genannten Crystograph, enthielt (das gesamte Gerät wurde typischerweise als Offner-Dynograph bezeichnet). ⓘ
1947 wurde die Amerikanische EEG-Gesellschaft gegründet, und der erste internationale EEG-Kongress wurde abgehalten. Im Jahr 1953 beschrieben Aserinsky und Kleitman den REM-Schlaf. ⓘ
In den 1950er Jahren entwickelte William Grey Walter eine Ergänzung zum EEG, die so genannte EEG-Topographie, mit der sich die elektrische Aktivität auf der Gehirnoberfläche abbilden ließ. Diese Methode erfreute sich in den 1980er Jahren kurzzeitig großer Beliebtheit und schien besonders für die Psychiatrie vielversprechend. Sie wurde von den Neurologen nie akzeptiert und bleibt in erster Linie ein Forschungsinstrument. ⓘ

Ein von Beckman Instruments hergestelltes Elektroenzephalographensystem wurde bei mindestens einem der bemannten Raumflüge des Projekts Gemini (1965-1966) eingesetzt, um die Gehirnströme der Astronauten während des Flugs zu überwachen. Es war eines von vielen Beckman-Instrumenten, die für die NASA entwickelt und von ihr eingesetzt wurden. ⓘ
1988 berichteten Stevo Bozinovski, Mihail Sestakov und Liljana Bozinovska über die EEG-Steuerung eines physischen Objekts, eines Roboters. ⓘ
Im Oktober 2018 verbanden Wissenschaftler die Gehirne von drei Personen, um mit dem Prozess des Gedankenaustauschs zu experimentieren. Fünf Gruppen mit je drei Personen nahmen an dem Experiment mit EEG teil. Die Erfolgsquote des Experiments lag bei 81 %. ⓘ
Im Jahr 1919 führte Walter Dandy in Baltimore die Pneumoenzephalografie ein, welche erstmals eine direkte Hirndiagnostik ermöglichte. ⓘ
Der Russe Nikolai Prawdicz-Neminski gehört zu den Forschern, die Catons Entdeckung tierexperimentell bestätigten, und prägte 1925 den Begriff Elektrocerebrogramm. ⓘ
Der Begriff Elektroenzephalographie geht auf den Neurologen Hans Berger zurück, der 1924 an der Universität Jena die ersten Elektroenzephalographien des Menschen vornahm. Er nannte sie „Elektrenkephalogramme“. Die 1929 publizierte Arbeit nahm auch die populärwissenschaftliche Presse wahr. Die Zeitschrift Kosmos meldete 1930:
„Er hat […] bei Menschen mit Schädellücken Nadelelektroden an der Lücke angesetzt und mit einem hochempfindlichen Galvanometer verbunden, wobei er eine regelmäßige Kurve erhielt.“ ⓘ
Berger entdeckte auch das Phänomen des Alpha-Blocks (auch Berger-Effekt). Hierbei handelt es sich um eine sehr auffällige Veränderung des EEGs, die einsetzt, wenn ein gesunder Proband seine Augen öffnet oder zu erhöhter mentaler Aktivität angehalten wird. ⓘ
Medizinische Anwendung

Das EEG ist einer der wichtigsten diagnostischen Tests für Epilepsie. Eine routinemäßige klinische EEG-Aufzeichnung dauert in der Regel 20-30 Minuten (plus Vorbereitungszeit). Es handelt sich um einen Test, bei dem die elektrische Aktivität im Gehirn mit Hilfe von kleinen, auf der Kopfhaut angebrachten Metallscheiben (Elektroden) gemessen wird. Routinemäßig wird das EEG im klinischen Bereich eingesetzt, um Veränderungen der Hirnaktivität festzustellen, die für die Diagnose von Hirnleistungsstörungen, insbesondere von Epilepsie oder anderen Anfallsleiden, nützlich sein könnten. Ein EEG kann auch bei der Diagnose oder Behandlung der folgenden Erkrankungen hilfreich sein:
- Hirntumor
- Hirnschäden durch Kopfverletzungen
- Hirnfunktionsstörung, die verschiedene Ursachen haben kann (Enzephalopathie)
- Entzündungen des Gehirns (Enzephalitis)
- Schlaganfall
- Schlafstörungen ⓘ
Es kann auch:
- epileptische Anfälle von anderen Arten von Anfällen unterscheiden, wie z. B. psychogene nicht-epileptische Anfälle, Synkopen (Ohnmachtsanfälle), subkortikale Bewegungsstörungen und Migränevarianten
- eine "organische" Enzephalopathie oder ein Delirium von primären psychiatrischen Syndromen wie der Katatonie zu unterscheiden
- als zusätzlicher Test für den Hirntod bei komatösen Patienten dienen
- Prognosen bei komatösen Patienten (in bestimmten Fällen)
- um festzustellen, ob Antiepileptika abgesetzt werden sollen. ⓘ
Manchmal reicht ein Routine-EEG nicht aus, um die Diagnose zu stellen oder die beste Behandlungsmethode zu bestimmen. In diesem Fall kann versucht werden, ein EEG aufzuzeichnen, während ein Anfall auftritt. Dies wird als iktale Aufzeichnung bezeichnet, im Gegensatz zu einer interiktalen Aufzeichnung, die sich auf die EEG-Aufzeichnung zwischen den Anfällen bezieht. Um eine ictal-Aufnahme zu erhalten, wird in der Regel ein verlängertes EEG mit einer zeitsynchronen Video- und Audioaufnahme durchgeführt. Dies kann entweder ambulant (zu Hause) oder während einer Krankenhauseinweisung erfolgen, vorzugsweise in einer Epilepsieüberwachungsstation (EMU) mit Krankenschwestern und anderem Personal, das in der Betreuung von Patienten mit Anfällen geschult ist. Ambulante Video-EEGs dauern in der Regel ein bis drei Tage. Die Aufnahme in eine Epilepsieüberwachungsstation dauert in der Regel mehrere Tage, kann aber auch eine Woche oder länger dauern. Während des Krankenhausaufenthalts werden in der Regel Anfallsmedikamente abgesetzt, um die Wahrscheinlichkeit zu erhöhen, dass während der Aufnahme ein Anfall auftritt. Aus Sicherheitsgründen werden die Medikamente während eines EEG außerhalb des Krankenhauses nicht abgesetzt. Ambulante Video-EEGs haben daher den Vorteil der Bequemlichkeit und sind kostengünstiger als eine Krankenhauseinweisung, haben aber den Nachteil einer geringeren Wahrscheinlichkeit der Aufzeichnung eines klinischen Ereignisses. ⓘ
Die Epilepsieüberwachung wird in der Regel durchgeführt, um epileptische Anfälle von anderen Arten von Anfällen zu unterscheiden, z. B. von psychogenen nicht-epileptischen Anfällen, Synkopen (Ohnmachtsanfällen), subkortikalen Bewegungsstörungen und Migränevarianten, um Anfälle für die Behandlung zu charakterisieren und um die Hirnregion zu lokalisieren, von der ein Anfall ausgeht, um eine mögliche Anfallschirurgie vorzubereiten. Krankenhäuser verwenden einen EEG-Monitor, um die Diagnose eines Anfalls zu unterstützen. Sie nutzen diese Informationen, um den Behandlungsprozess zu unterstützen und Risiken zu erkennen. "Viele Fachleute haben erklärt, wie wichtig EEGs bei Verdacht auf Anfälle für die Diagnose und Bewertung sind. Die Ärzte werden das EEG-Überwachungssystem nutzen können, um einige Behandlungsmöglichkeiten und Risikofaktoren zu ermitteln. Im Zuge des technologischen Fortschritts finden die Forscher neue Überwachungsgeräte, die Anfälle genauer erkennen können. "Fortgeschrittene Techniken mit kontinuierlichem EEG und vereinfachte Techniken mit aEEG ermöglichen es den Ärzten, mehr Anfälle am Krankenbett zu erkennen". Ein aEEG steht für amplitudenintegrierte Elektroenzephalographie und kann wie ein EEG-Monitor jede elektrische Hirnaktivität erkennen. Ein aEEG-Monitor kann die Hirnfunktion über einen langen Zeitraum überwachen, während ein EEG-Monitor die Hirnfunktion nur für ein paar Stunden bis Tage überwachen kann. Auf diese Weise können mehr Anfälle schneller erkannt werden, und Frühgeborene, bei denen Anfälle auftreten, können früher behandelt werden und haben weniger Langzeitfolgen. ⓘ
Darüber hinaus kann das EEG zur Überwachung der Narkosetiefe, als indirekter Indikator für die zerebrale Durchblutung bei der Karotisendarteriektomie oder zur Überwachung der Amobarbitalwirkung während des Wada-Tests eingesetzt werden. ⓘ
Das EEG kann auch auf Intensivstationen zur Überwachung der Hirnfunktion eingesetzt werden, um nicht konvulsive Anfälle/nicht konvulsiver Status epilepticus zu überwachen, um die Wirkung von Sedativa/Anästhetika bei Patienten im medikamentös induzierten Koma (zur Behandlung refraktärer Anfälle oder erhöhten Hirndrucks) zu überwachen und um sekundäre Hirnschäden bei Zuständen wie Subarachnoidalblutungen zu erkennen (derzeit eine Forschungsmethode). ⓘ
Wenn bei einem Patienten mit Epilepsie ein resektiver Eingriff in Betracht gezogen wird, ist es oft notwendig, den Fokus (die Quelle) der epileptischen Hirnaktivität mit einer höheren Auflösung zu lokalisieren, als dies mit dem Kopfhaut-EEG möglich ist. Dies liegt daran, dass Liquor, Schädel und Kopfhaut die mit dem Kopf-EEG aufgezeichneten elektrischen Potenziale verschmieren. In diesen Fällen implantieren Neurochirurgen üblicherweise Elektrodenstreifen und -gitter (oder Tiefenelektroden) unter die Dura mater, entweder durch eine Kraniotomie oder ein Bohrloch. Die Aufzeichnung dieser Signale wird als Elektrokortikographie (EKoG), subdurales EEG (sdEEG) oder intrakranielles EEG (icEEG) bezeichnet - alles Begriffe, die dasselbe bedeuten. Das vom EKoG aufgezeichnete Signal liegt auf einer anderen Aktivitätsskala als die vom Kopfhaut-EEG aufgezeichnete Gehirnaktivität. Niederspannungs- und Hochfrequenzkomponenten, die im Kopfhaut-EEG nur schwer (oder gar nicht) zu erkennen sind, können im EKoG deutlich gesehen werden. Darüber hinaus können mit kleineren Elektroden (die einen kleineren Teil der Hirnoberfläche abdecken) sogar niedrigere Spannungen und schnellere Komponenten der Hirnaktivität erkannt werden. An einigen klinischen Orten werden Aufzeichnungen von eindringenden Mikroelektroden gemacht. ⓘ
Das EEG ist für die Diagnose von Kopfschmerzen nicht geeignet. Da es sich bei wiederkehrenden Kopfschmerzen um ein häufiges Schmerzproblem handelt, wird dieses Verfahren gelegentlich bei der Suche nach einer Diagnose eingesetzt, bietet jedoch keine Vorteile gegenüber einer klinischen Routineuntersuchung. ⓘ
Das Elektroenzephalogramm dient zur Diagnose und Verlaufskontrolle der Epilepsie. Außer durch die hochamplitudige Aktivität während eines Anfalls, fallen besonders geformte Graphoelemente auch im anfallsfreien Intervall auf. ⓘ
Einsatz in der Forschung
Das EEG und die damit zusammenhängende Untersuchung von ERPs werden in den Neurowissenschaften, der Kognitionswissenschaft, der kognitiven Psychologie, der Neurolinguistik und der psychophysiologischen Forschung, aber auch zur Untersuchung menschlicher Funktionen wie dem Schlucken, in großem Umfang eingesetzt. Viele EEG-Techniken, die in der Forschung eingesetzt werden, sind für den klinischen Einsatz nicht ausreichend standardisiert, und viele ERP-Studien geben nicht alle notwendigen Verarbeitungsschritte für die Datenerfassung und -reduktion an, was die Reproduzierbarkeit und Wiederholbarkeit vieler Studien einschränkt. Die Forschung über geistige Behinderungen, wie z. B. die auditive Verarbeitungsstörung (APD), ADS oder ADHS, wird jedoch immer bekannter, und EEGs werden zu Forschungs- und Behandlungszwecken eingesetzt. ⓘ
Vorteile
Es gibt mehrere andere Methoden zur Untersuchung der Hirnfunktion, darunter die funktionelle Magnetresonanztomographie (fMRI), die Positronenemissionstomographie (PET), die Magnetoenzephalographie (MEG), die Kernspinresonanzspektroskopie (NMR oder MRS), die Elektrokortikographie (EKoG), die Einzelphotonen-Emissions-Computertomographie (SPECT), die Nahinfrarotspektroskopie (NIRS) und das ereigniskorrelierte optische Signal (EROS). Trotz der relativ geringen räumlichen Empfindlichkeit des EEG machen die eindimensionalen Signale aus lokalisierten peripheren Regionen des Kopfes es aufgrund seiner einfachen Genauigkeit attraktiv und haben einen hohen Durchsatz in der klinischen Forschung und der Grundlagenforschung ermöglicht". Somit hat das EEG einige Vorteile gegenüber anderen Techniken:
- Die Hardwarekosten sind deutlich niedriger als bei den meisten anderen Techniken.
- EEG verhindert die begrenzte Verfügbarkeit von Technologen für die sofortige Versorgung in stark frequentierten Krankenhäusern.
- EEG erfordert nur einen ruhigen Raum und Geräte in der Größe eines Aktenkoffers, während fMRI, SPECT, PET, MRS oder MEG sperrige und unbewegliche Geräte erfordern. MEG beispielsweise erfordert Geräte, die aus mit flüssigem Helium gekühlten Detektoren bestehen, die nur in magnetisch abgeschirmten Räumen verwendet werden können und insgesamt mehrere Millionen Dollar kosten; und fMRI erfordert die Verwendung eines 1-Tonnen-Magneten in einem abgeschirmten Raum.
- EEG kann ohne weiteres eine hohe zeitliche Auflösung haben (obwohl die Auflösung im Sub-Millisekundenbereich weniger aussagekräftige Daten erzeugt), weil die zwei bis 32 Datenströme, die von dieser Anzahl von Elektroden erzeugt werden, leicht gespeichert und verarbeitet werden können, während räumliche 3D-Technologien Tausende oder Millionen Mal so viele Eingangsdatenströme liefern und daher durch Hardware und Software begrenzt sind. Im klinischen Bereich und in der Forschung wird das EEG in der Regel mit Abtastraten zwischen 250 und 2000 Hz aufgezeichnet.
- Im Gegensatz zu den meisten anderen Neuroimaging-Verfahren ist das EEG relativ unempfindlich gegenüber Bewegungen der Versuchsperson. Es gibt sogar Methoden zur Minimierung und sogar zur Beseitigung von Bewegungsartefakten in EEG-Daten.
- Das EEG ist geräuschlos, was eine bessere Untersuchung der Reaktionen auf auditive Reize ermöglicht.
- Im Gegensatz zu fMRI, PET, MRS, SPECT und manchmal MEG verursacht das EEG keine Klaustrophobie.
- Das EEG ist nicht mit hochintensiven Magnetfeldern (>1 Tesla) verbunden, wie dies bei einigen anderen Techniken, insbesondere MRI und MRS, der Fall ist. Diese können eine Reihe von unerwünschten Problemen mit den Daten verursachen und verbieten auch den Einsatz dieser Techniken bei Teilnehmern, die Metallimplantate in ihrem Körper haben, wie z. B. metallhaltige Herzschrittmacher.
- Im Gegensatz zur Positronen-Emissions-Tomographie ist das EEG nicht mit einer Exposition gegenüber radioaktiven Substanzen verbunden.
- ERP-Studien können mit relativ einfachen Paradigmen durchgeführt werden, verglichen mit fMRI-Studien im IE-Block-Design
- Relativ nicht-invasiv, im Gegensatz zur Elektrokortikographie, bei der Elektroden auf der Oberfläche des Gehirns angebracht werden müssen. ⓘ
Das EEG hat auch einige Eigenschaften, die sich mit Verhaltenstests vergleichen lassen:
- Das EEG kann verdeckte Prozesse aufdecken (d. h. Prozesse, die keine Reaktion erfordern).
- EEG kann bei Personen eingesetzt werden, die nicht in der Lage sind, eine motorische Reaktion zu zeigen.
- Einige ERP-Komponenten können auch dann erfasst werden, wenn die Versuchsperson nicht auf die Reize achtet.
- Im Gegensatz zu anderen Mitteln zur Untersuchung der Reaktionszeit können ERPs die Phasen der Verarbeitung (und nicht nur das Ergebnis) aufklären
- Die Einfachheit des EEG ermöglicht es, die Veränderungen des Gehirns in verschiedenen Lebensphasen zu verfolgen. Die EEG-Schlafanalyse kann wichtige Aspekte der zeitlichen Entwicklung des Gehirns aufzeigen, einschließlich der Bewertung der Gehirnreifung bei Jugendlichen. ⓘ
- Im Vergleich zu anderen Forschungstechniken, z. B. der BOLD-Antwort in der MRT, ist beim EEG besser bekannt, welches Signal gemessen wird. ⓘ
Nachteile
- Geringe räumliche Auflösung auf der Kopfhaut. fMRI kann beispielsweise aktive Hirnregionen direkt anzeigen, während EEG eine intensive Interpretation erfordert, nur um zu vermuten, welche Bereiche durch eine bestimmte Reaktion aktiviert werden.
- Das EEG misst nur unzureichend die neuronale Aktivität, die unter den oberen Schichten des Gehirns (der Hirnrinde) stattfindet.
- Im Gegensatz zu PET und MRS können keine spezifischen Stellen im Gehirn identifiziert werden, an denen verschiedene Neurotransmitter, Drogen usw. gefunden werden können.
- Der Anschluss einer Versuchsperson an das EEG nimmt oft viel Zeit in Anspruch, da Dutzende von Elektroden präzise am Kopf platziert werden müssen und verschiedene Gele, Kochsalzlösungen und/oder Pasten verwendet werden müssen, um eine gute Leitfähigkeit aufrechtzuerhalten, und eine Kappe verwendet wird, um sie an Ort und Stelle zu halten. Der Zeitaufwand ist zwar je nach verwendetem EEG-Gerät unterschiedlich, doch in der Regel dauert die Vorbereitung einer Versuchsperson für MEG, fMRI, MRS und SPECT wesentlich kürzer.
- Das Signal-Rausch-Verhältnis ist schlecht, so dass eine ausgefeilte Datenanalyse und eine relativ große Anzahl von Probanden erforderlich sind, um nützliche Informationen aus dem EEG zu gewinnen. ⓘ
Bei anderen Neuroimaging-Techniken
Die gleichzeitige Aufzeichnung von EEG- und fMRT-Scans wurde bereits erfolgreich durchgeführt. Allerdings müssen bei der gleichzeitigen Aufzeichnung mehrere technische Schwierigkeiten überwunden werden, wie z. B. das Vorhandensein von ballistokardiografischen Artefakten, MRT-Pulsartefakten und die Induktion elektrischer Ströme in EEG-Drähten, die sich in den starken Magnetfeldern des MRT bewegen. Diese Herausforderungen wurden in einer Reihe von Studien erfolgreich gemeistert. ⓘ
MRTs erzeugen detaillierte Bilder, indem sie starke Magnetfelder erzeugen, die potenziell schädliche Verschiebungskräfte und Drehmomente hervorrufen können. Diese Felder erzeugen eine potenziell schädliche Hochfrequenzerwärmung und erzeugen Bildartefakte, die die Bilder unbrauchbar machen. Aufgrund dieser potenziellen Risiken können nur bestimmte medizinische Geräte in einer MR-Umgebung verwendet werden. ⓘ
In ähnlicher Weise wurden auch gleichzeitige Aufzeichnungen mit MEG und EEG durchgeführt, was mehrere Vorteile gegenüber der Verwendung einer der beiden Techniken allein hat:
- Das EEG erfordert genaue Informationen über bestimmte Aspekte des Schädels, die nur geschätzt werden können, z. B. den Schädelradius und die Leitfähigkeiten verschiedener Schädelbereiche. Bei der MEG gibt es dieses Problem nicht, und eine gleichzeitige Analyse ermöglicht es, dies zu korrigieren.
- Sowohl MEG als auch EEG erkennen Aktivitäten unterhalb der Oberfläche des Kortex nur sehr schlecht, und wie beim EEG nimmt der Fehler mit der Tiefe unterhalb der Oberfläche des Kortex zu, die man zu untersuchen versucht. Allerdings sind die Fehler zwischen den beiden Techniken sehr unterschiedlich, so dass eine Kombination der beiden Techniken eine Korrektur eines Teils dieses Rauschens ermöglicht.
- MEG hat praktisch keinen Zugang zu den Quellen der Hirnaktivität unterhalb einiger Zentimeter unter dem Kortex. Das EEG hingegen kann Signale aus größerer Tiefe empfangen, wenn auch mit einem hohen Maß an Rauschen. Durch die Kombination der beiden Verfahren lässt sich leichter feststellen, was im EEG-Signal von der Oberfläche kommt (da das MEG bei der Untersuchung von Signalen von der Gehirnoberfläche sehr genau ist) und was aus der Tiefe des Gehirns stammt. ⓘ
Kürzlich wurde ein kombinierter EEG/MEG-Ansatz (EMEG) zum Zweck der Quellenrekonstruktion bei der Epilepsiediagnose untersucht. ⓘ
Das EEG wurde auch mit der Positronen-Emissions-Tomographie kombiniert. Dies hat den Vorteil, dass die Forscher sehen können, welche EEG-Signale mit verschiedenen Arzneimittelwirkungen im Gehirn verbunden sind. ⓘ
Jüngste Studien, bei denen Techniken des maschinellen Lernens wie neuronale Netze mit statistischen zeitlichen Merkmalen, die aus den EEG-Hirnstromdaten des Frontallappens extrahiert wurden, eingesetzt wurden, haben gezeigt, dass die Klassifizierung von mentalen Zuständen (entspannt, neutral, konzentriert), mentalen emotionalen Zuständen (negativ, neutral, positiv) und thalamokortikalen Rhythmusstörungen sehr erfolgreich ist. ⓘ
Mechanismen
Die elektrische Ladung des Gehirns wird durch Milliarden von Neuronen aufrechterhalten. Neuronen werden durch Membrantransportproteine, die Ionen durch ihre Membranen pumpen, elektrisch aufgeladen (oder "polarisiert"). Neuronen tauschen ständig Ionen mit dem extrazellulären Milieu aus, zum Beispiel um das Ruhepotenzial aufrechtzuerhalten und Aktionspotenziale weiterzuleiten. Ionen mit ähnlicher Ladung stoßen sich gegenseitig ab, und wenn viele Ionen gleichzeitig aus vielen Neuronen ausgestoßen werden, können sie ihre Nachbarn stoßen, die wiederum ihre Nachbarn stoßen, und so weiter, in einer Welle. Dieser Vorgang wird als Volumenleitung bezeichnet. Wenn die Welle von Ionen die Elektroden auf der Kopfhaut erreicht, können sie Elektronen auf das Metall in den Elektroden schieben oder ziehen. Da Metall den Schub und die Anziehung von Elektronen leicht leitet, kann die Differenz der Schub- oder Anzugsspannungen zwischen zwei beliebigen Elektroden mit einem Voltmeter gemessen werden. Die Aufzeichnung dieser Spannungen über die Zeit ergibt das EEG. ⓘ
Das von einem einzelnen Neuron erzeugte elektrische Potenzial ist viel zu klein, um von einem EEG oder MEG erfasst zu werden. Die EEG-Aktivität spiegelt daher immer die Summe der synchronen Aktivität von Tausenden oder Millionen von Neuronen wider, die eine ähnliche räumliche Ausrichtung haben. Wenn die Zellen keine ähnliche räumliche Ausrichtung haben, reihen sich ihre Ionen nicht aneinander und erzeugen Wellen, die erfasst werden können. Man geht davon aus, dass die Pyramidenneuronen des Kortex die meisten EEG-Signale erzeugen, da sie gut ausgerichtet sind und gemeinsam feuern. Da die Spannungsfeldgradienten mit dem Quadrat der Entfernung abnehmen, sind Aktivitäten aus der Tiefe schwieriger zu erkennen als Ströme in der Nähe des Schädels. ⓘ
Die EEG-Aktivität der Kopfhaut zeigt Oszillationen mit einer Vielzahl von Frequenzen. Mehrere dieser Oszillationen haben charakteristische Frequenzbereiche und räumliche Verteilungen und werden mit verschiedenen Zuständen der Gehirnfunktion in Verbindung gebracht (z. B. Wachsein und die verschiedenen Schlafstadien). Diese Oszillationen stellen eine synchronisierte Aktivität in einem Netzwerk von Neuronen dar. Die neuronalen Netzwerke, die einigen dieser Oszillationen zugrunde liegen, sind bekannt (z. B. die thalamokortikale Resonanz, die den Schlafspindeln zugrunde liegt), während viele andere nicht bekannt sind (z. B. das System, das den hinteren Grundrhythmus erzeugt). Forschungen, die sowohl das EEG als auch die Spike-Aktivität von Neuronen messen, haben ergeben, dass die Beziehung zwischen beiden komplex ist, wobei eine Kombination aus EEG-Leistung im Gamma-Band und Phase im Delta-Band am stärksten mit der Spike-Aktivität von Neuronen zusammenhängt. ⓘ
Methode

Beim herkömmlichen Kopfhaut-EEG werden die Elektroden mit einem leitfähigen Gel oder einer Paste auf der Kopfhaut angebracht, in der Regel nachdem der Kopfhautbereich durch leichtes Abschleifen vorbereitet wurde, um die Impedanz aufgrund abgestorbener Hautzellen zu verringern. Viele Systeme verwenden typischerweise Elektroden, von denen jede an einem einzelnen Draht befestigt ist. Einige Systeme verwenden Kappen oder Netze, in die Elektroden eingebettet sind; dies ist vor allem dann üblich, wenn eine hohe Elektrodendichte erforderlich ist. ⓘ
Für die meisten klinischen und Forschungsanwendungen werden die Elektrodenpositionen und -bezeichnungen durch das internationale 10-20-System festgelegt (außer bei der Verwendung von hochdichten Arrays). Mit diesem System wird sichergestellt, dass die Benennung der Elektroden in allen Labors einheitlich ist. Bei den meisten klinischen Anwendungen werden 19 Aufzeichnungselektroden (plus Masse und Systemreferenz) verwendet. Bei der Ableitung des EEG von Neugeborenen wird in der Regel eine geringere Anzahl von Elektroden verwendet. Zusätzliche Elektroden können zum Standard-Setup hinzugefügt werden, wenn eine klinische oder Forschungsanwendung eine höhere räumliche Auflösung für einen bestimmten Bereich des Gehirns erfordert. Arrays mit hoher Dichte (in der Regel über eine Kappe oder ein Netz) können bis zu 256 Elektroden enthalten, die mehr oder weniger gleichmäßig um die Kopfhaut verteilt sind. ⓘ
Jede Elektrode ist mit einem Eingang eines Differenzverstärkers verbunden (ein Verstärker pro Elektrodenpaar); eine gemeinsame Systemreferenzelektrode ist mit dem anderen Eingang jedes Differenzverstärkers verbunden. Diese Verstärker verstärken die Spannung zwischen der aktiven Elektrode und der Referenzelektrode (in der Regel um das 1.000- bis 100.000-fache, d. h. um 60 bis 100 dB Spannungsverstärkung). Beim analogen EEG wird das Signal dann gefiltert (nächster Abschnitt), und das EEG-Signal wird als Auslenkung von Stiften beim Vorbeifahren von Papier ausgegeben. Die meisten heutigen EEG-Systeme sind jedoch digital, und das verstärkte Signal wird über einen Analog-Digital-Wandler digitalisiert, nachdem es durch einen Anti-Aliasing-Filter geleitet wurde. Die Analog-Digital-Abtastung erfolgt beim klinischen Kopfhaut-EEG in der Regel mit 256-512 Hz; in einigen Forschungsanwendungen werden Abtastraten von bis zu 20 kHz verwendet. ⓘ
Während der Aufzeichnung kann eine Reihe von Aktivierungsverfahren angewendet werden. Diese Verfahren können normale oder abnormale EEG-Aktivitäten hervorrufen, die sonst vielleicht nicht zu sehen wären. Zu diesen Verfahren gehören Hyperventilation, photische Stimulation (mit einem Stroboskop), Augenschluss, geistige Aktivität, Schlaf und Schlafentzug. Während der (stationären) Epilepsieüberwachung können die typischen Anfallsmedikamente eines Patienten abgesetzt werden. ⓘ
Das digitale EEG-Signal wird elektronisch gespeichert und kann für die Anzeige gefiltert werden. Typische Einstellungen für den Hochpassfilter und einen Tiefpassfilter sind 0,5-1 Hz bzw. 35-70 Hz. Der Hochpassfilter filtert in der Regel langsame Artefakte wie elektrogalvanische Signale und Bewegungsartefakte heraus, während der Tiefpassfilter hochfrequente Artefakte wie elektromyographische Signale herausfiltert. Ein zusätzlicher Kerbfilter wird in der Regel verwendet, um Artefakte zu entfernen, die durch elektrische Stromleitungen (60 Hz in den Vereinigten Staaten und 50 Hz in vielen anderen Ländern) verursacht werden. ⓘ
Die EEG-Signale können mit Open-Source-Hardware wie OpenBCI aufgezeichnet und mit frei verfügbarer EEG-Software wie EEGLAB oder der Neurophysiological Biomarker Toolbox verarbeitet werden. ⓘ
Im Rahmen einer epilepsiechirurgischen Untersuchung kann es erforderlich sein, Elektroden in der Nähe der Hirnoberfläche, unter der Dura mater, einzuführen. Dies geschieht über eine Bohrung oder Kraniotomie. Dies wird als "Elektrokortikographie (EKoG)", "intrakranielles EEG (I-EEG)" oder "subdurales EEG (SD-EEG)" bezeichnet. Tiefenelektroden können auch in Hirnstrukturen wie der Amygdala oder dem Hippocampus platziert werden, Strukturen, die häufig Epilepsieherde sind und mit dem Kopfhaut-EEG möglicherweise nicht deutlich "gesehen" werden. Das elektrokortikografische Signal wird auf dieselbe Weise verarbeitet wie das digitale Kopfhaut-EEG (siehe oben), allerdings mit einigen Einschränkungen. Aufgrund der Anforderungen des Nyquist-Theorems wird das EKoG in der Regel mit höheren Abtastraten aufgezeichnet als das Kopfhaut-EEG - das subdurale Signal besteht aus einer größeren Dominanz höherer Frequenzkomponenten. Außerdem wirken sich viele der Artefakte, die das Kopfhaut-EEG beeinflussen, nicht auf das EKG aus, so dass eine Filterung der Anzeige oft nicht erforderlich ist. ⓘ
Ein typisches EEG-Signal eines erwachsenen Menschen hat eine Amplitude von etwa 10 µV bis 100 µV, wenn es an der Kopfhaut gemessen wird. ⓘ
Da ein EEG-Spannungssignal eine Differenz zwischen den Spannungen an zwei Elektroden darstellt, kann die Anzeige des EEG für den ablesenden Enzephalographen auf eine von mehreren Arten erfolgen. Die Darstellung der EEG-Kanäle wird als Montage bezeichnet. ⓘ
- Sequentielle Montage
- Jeder Kanal (d. h. jede Wellenform) stellt die Differenz zwischen zwei benachbarten Elektroden dar. Die gesamte Montage besteht aus einer Reihe dieser Kanäle. Zum Beispiel stellt der Kanal "Fp1-F3" die Spannungsdifferenz zwischen der Fp1-Elektrode und der F3-Elektrode dar. Der nächste Kanal in der Montage, "F3-C3", stellt die Spannungsdifferenz zwischen F3 und C3 dar, und so weiter durch die gesamte Elektrodenanordnung. ⓘ
- Referentielle Montage
- Jeder Kanal stellt die Differenz zwischen einer bestimmten Elektrode und einer bestimmten Referenzelektrode dar. Für diese Referenz gibt es keine Standardposition; sie befindet sich jedoch an einer anderen Stelle als die "Aufzeichnungs"-Elektroden. Häufig werden Mittellinienpositionen verwendet, da sie das Signal in einer Hemisphäre nicht gegenüber der anderen verstärken, wie z. B. Cz, Oz, Pz usw. als Online-Referenz. Andere beliebte Offline-Referenzen sind:
- REST-Referenz: Es handelt sich um eine rechnerische Offline-Referenz im Unendlichen, wo das Potenzial gleich Null ist. REST (Referenz-Elektroden-Standardisierungstechnik) nimmt die äquivalenten Quellen im Gehirn eines beliebigen Satzes von Kopfhautaufzeichnungen als Sprungbrett, um die tatsächlichen Aufzeichnungen mit einer beliebigen Online- oder Offline-Referenz (Durchschnitt, verknüpfte Ohren usw.), die nicht Null ist, zu den neuen Aufzeichnungen mit Unendlich Null als standardisierter Referenz zu verknüpfen.
- "Verknüpfte Ohren": ein physikalischer oder mathematischer Mittelwert von Elektroden, die an beiden Ohrläppchen oder Mastoiden angebracht sind. ⓘ
- Durchschnittliche Referenzmontage
- Die Ausgänge aller Verstärker werden summiert und gemittelt, und dieses gemittelte Signal wird als gemeinsame Referenz für jeden Kanal verwendet. ⓘ
- Laplacian-Montage
- Jeder Kanal stellt die Differenz zwischen einer Elektrode und einem gewichteten Durchschnitt der umliegenden Elektroden dar. ⓘ
Bei analogen EEGs (Papier-EEGs) schaltet der Techniker während der Aufzeichnung zwischen den Montagen um, um bestimmte Merkmale des EEGs hervorzuheben oder besser zu charakterisieren. Beim digitalen EEG werden in der Regel alle Signale digitalisiert und in einer bestimmten (in der Regel referenziellen) Montage gespeichert; da jede Montage mathematisch aus jeder anderen konstruiert werden kann, kann das EEG vom Elektroenzephalographen in jeder gewünschten Anzeigemontage betrachtet werden. ⓘ
Das EEG wird von einem klinischen Neurophysiologen oder Neurologen (je nach den örtlichen Gepflogenheiten und Gesetzen in Bezug auf medizinische Fachgebiete) gelesen, der im Idealfall eine spezielle Ausbildung in der Interpretation von EEGs für klinische Zwecke hat. Dies geschieht durch visuelle Inspektion der Wellenformen, die so genannten Graphoelements. Der Einsatz der Computersignalverarbeitung des EEG - der so genannten quantitativen Elektroenzephalographie - ist bei der Verwendung für klinische Zwecke etwas umstritten (auch wenn es viele Anwendungen in der Forschung gibt). ⓘ
Da die auf der Kopfhaut zu messenden Signale in der Größenordnung von 5 bis 100 µV (1 Mikrovolt = 1 Millionstel Volt) liegen, wird ein empfindlicher Messverstärker benötigt. Zur Unterdrückung des allgegenwärtigen Netzbrummens und anderer Störungen wird ein Differenzverstärker mit hoher Gleichtaktunterdrückung benutzt. Aus Gründen der Patientensicherheit ist dieser bei als Medizingerät zugelassenen Elektroenzephalographen als Isolationsverstärker implementiert, wodurch gleichzeitig aber auch die Gleichtaktunterdrückung erhöht wird. ⓘ
Die vor dem Einsatz von Computern benutzten Geräte leiteten den Ausgang der Differenzverstärker auf einen Messschreiber, das Elektroenzephalogramm wurde auf Endlospapier geschrieben. Die Papiermenge entsprach etwa 120 Blättern für eine Standarduntersuchung von 20 Minuten. ⓘ
Beim papierlosen oder Computer-EEG wird das Signal digitalisiert und auf Festplatte oder optischen Medien festgehalten und das EEG vom Neurologen oder Psychiater meist am Bildschirm ausgewertet. ⓘ
Trockene EEG-Elektroden
In den frühen 1990er Jahren demonstrierte Babak Taheri an der University of California, Davis, die ersten ein- und mehrkanaligen aktiven Elektrodenarrays, die durch Mikrobearbeitung hergestellt wurden. Die Konstruktion der einkanaligen trockenen EEG-Elektroden und die Ergebnisse wurden 1994 veröffentlicht. Die Elektrodenanordnung erwies sich im Vergleich zu Silber-/Silberchlorid-Elektroden als sehr leistungsfähig. Das Gerät bestand aus vier Sensorstellen mit integrierter Elektronik, um das Rauschen durch Impedanzanpassung zu verringern. Die Vorteile solcher Elektroden sind: (1) keine Verwendung von Elektrolyten, (2) keine Vorbereitung der Haut, (3) deutlich geringere Sensorgröße und (4) Kompatibilität mit EEG-Überwachungssystemen. Die aktive Elektrodenanordnung ist ein integriertes System, das aus einer Anordnung von kapazitiven Sensoren mit lokalen integrierten Schaltkreisen besteht, die in einem Gehäuse mit Batterien zur Stromversorgung der Schaltkreise untergebracht sind. Dieses Maß an Integration war erforderlich, um die von der Elektrode erreichte funktionelle Leistung zu erreichen. Die Elektrode wurde auf einem elektrischen Prüfstand und an menschlichen Probanden in vier Modalitäten der EEG-Aktivität getestet, nämlich: (1) spontanes EEG, (2) sensorische ereigniskorrelierte Potenziale, (3) Hirnstammpotenziale und (4) kognitive ereigniskorrelierte Potenziale. Die Leistung der Trockenelektrode war im Vergleich zu den nassen Standardelektroden im Hinblick auf die Hautvorbereitung, den Wegfall des Gelbedarfs (trocken) und das höhere Signal-Rausch-Verhältnis günstig. ⓘ
1999 verwendeten Forscher der Case Western Reserve University in Cleveland, Ohio, unter der Leitung von Hunter Peckham eine EEG-Schädeldecke mit 64 Elektroden, um dem Tetraplegiker Jim Jatich eingeschränkte Handbewegungen zurückzugeben. Während sich Jatich auf einfache, aber gegensätzliche Begriffe wie "auf" und "ab" konzentrierte, wurde sein Beta-Rhythmus-EEG-Ausgang mit einer Software analysiert, um Muster im Rauschen zu erkennen. Ein Grundmuster wurde identifiziert und zur Steuerung eines Schalters verwendet: Eine überdurchschnittliche Aktivität wurde eingeschaltet, eine unterdurchschnittliche ausgeschaltet. Die Signale ermöglichten es Jatich nicht nur, einen Computercursor zu steuern, sondern auch die in seinen Händen eingebetteten Nervensteuerungen anzusteuern, so dass er sich wieder etwas bewegen konnte. ⓘ
2018 wurde über eine funktionelle Trockenelektrode berichtet, die aus einem Polydimethylsiloxan-Elastomer besteht, das mit leitfähigen Kohlenstoff-Nanofasern gefüllt ist. Diese Forschung wurde am U.S. Army Research Laboratory durchgeführt. Bei der EEG-Technologie wird häufig ein Gel auf die Kopfhaut aufgetragen, das ein hohes Signal-Rausch-Verhältnis ermöglicht. Dies führt zu reproduzierbareren und zuverlässigeren Versuchsergebnissen. Da die Patienten es nicht mögen, wenn ihr Haar mit Gel gefüllt wird, und die langwierige Einrichtung geschultes Personal erfordert, kann die Anwendung des EEG außerhalb des Labors schwierig sein. Außerdem wurde beobachtet, dass die Leistung der Sensoren mit nassen Elektroden nach einigen Stunden nachlässt. Daher wurde die Forschung auf die Entwicklung trockener und halbtrockener bioelektronischer EEG-Schnittstellen ausgerichtet. ⓘ
Trockene Elektrodensignale hängen vom mechanischen Kontakt ab. Daher kann es aufgrund der Impedanz zwischen Haut und Elektrode schwierig sein, ein brauchbares Signal zu erhalten. Einige EEG-Systeme versuchen, dieses Problem zu umgehen, indem sie eine Kochsalzlösung auftragen. Andere sind halbtrocken und geben bei Kontakt mit der Kopfhaut kleine Mengen des Gels ab. Eine andere Lösung verwendet federbelastete Stifte. Diese können unangenehm sein. Sie können auch gefährlich sein, wenn sie in einer Situation verwendet werden, in der sich ein Patient den Kopf stoßen könnte, da sie bei einem Aufpralltrauma stecken bleiben könnten. ⓘ
ARL hat auch ein Visualisierungswerkzeug entwickelt, Customizable Lighting Interface for the Visualization of EEGs oder CLIVE, das zeigt, wie gut zwei Gehirne synchronisiert sind. ⓘ
Derzeit gibt es Headsets mit Trockenelektroden und bis zu 30 Kanälen. Solche Geräte sind in der Lage, einen Teil der durch hohe Impedanzen bedingten Verschlechterung der Signalqualität zu kompensieren, indem die Vorverstärkung, die Abschirmung und die Stützmechanik optimiert werden. ⓘ
Beschränkungen
Das EEG hat mehrere Einschränkungen. Die wichtigste ist seine geringe räumliche Auflösung. Das EEG ist am empfindlichsten für eine bestimmte Gruppe von postsynaptischen Potenzialen: diejenigen, die in den oberflächlichen Schichten des Kortex, auf den Kämmen der Gyri, die direkt an den Schädel grenzen, und radial zum Schädel erzeugt werden. Dendriten, die tiefer im Kortex, in Sulci, in der Mittellinie oder in tiefen Strukturen (wie dem Gyrus cinguli oder dem Hippocampus) liegen oder Ströme erzeugen, die tangential zum Schädel verlaufen, tragen weit weniger zum EEG-Signal bei. ⓘ
EEG-Aufzeichnungen erfassen axonale Aktionspotenziale nicht direkt. Ein Aktionspotenzial kann genau als Stromquadrupol dargestellt werden, was bedeutet, dass das daraus resultierende Feld schneller abnimmt als das durch den Stromdipol der postsynaptischen Potenziale erzeugte. Da EEGs Durchschnittswerte von Tausenden von Neuronen darstellen, ist außerdem eine große Population von Zellen mit synchroner Aktivität erforderlich, um eine signifikante Ablenkung bei den Aufzeichnungen zu verursachen. Aktionspotenziale sind sehr schnell, so dass die Chancen für eine Feldsummierung gering sind. Die neuronale Backpropagation als typischerweise längerer dendritischer Stromdipol kann jedoch von EEG-Elektroden erfasst werden und ist ein zuverlässiger Hinweis auf das Auftreten neuronaler Leistung. ⓘ
EEGs erfassen nicht nur fast ausschließlich dendritische Ströme im Gegensatz zu axonalen Strömen, sondern sie zeigen auch eine Vorliebe für Aktivität auf Populationen paralleler Dendriten, die gleichzeitig Strom in dieselbe Richtung leiten. Pyramidale Neuronen der kortikalen Schichten II/III und V haben apikale Dendriten, die bis zur Schicht I reichen. ⓘ
Daher liefert das EEG Informationen, die stark auf bestimmte Neuronentypen ausgerichtet sind, und sollte im Allgemeinen nicht verwendet werden, um Aussagen über die Gesamtaktivität des Gehirns zu machen. Die Hirnhäute, der Liquor und der Schädel "verschmieren" das EEG-Signal und verschleiern seine intrakranielle Quelle. ⓘ
Es ist mathematisch unmöglich, eine eindeutige intrakranielle Stromquelle für ein gegebenes EEG-Signal zu rekonstruieren, da einige Ströme Potenziale erzeugen, die sich gegenseitig aufheben. Dies wird als inverses Problem bezeichnet. Es wurde jedoch viel Arbeit geleistet, um zumindest einen lokalisierten elektrischen Dipol, der die aufgezeichneten Ströme repräsentiert, bemerkenswert gut zu schätzen. ⓘ
EEG im Vergleich zu fMRI, fNIRS, fUS und PET
Das EEG hat mehrere Stärken als Instrument zur Erforschung der Gehirnaktivität. EEGs können Veränderungen innerhalb von Millisekunden erkennen, was hervorragend ist, wenn man bedenkt, dass ein Aktionspotenzial je nach Art des Neurons etwa 0,5-130 Millisekunden braucht, um sich über ein einzelnes Neuron auszubreiten. Andere Methoden zur Untersuchung der Gehirnaktivität wie PET, fMRI oder fUS haben eine Zeitauflösung von Sekunden bis Minuten. Das EEG misst die elektrische Aktivität des Gehirns direkt, während andere Methoden Veränderungen des Blutflusses (z. B. SPECT, fMRI, fUS) oder der Stoffwechselaktivität (z. B. PET, NIRS) aufzeichnen, die indirekte Marker für die elektrische Aktivität des Gehirns sind. ⓘ
EEG kann gleichzeitig mit fMRI oder fUS verwendet werden, so dass zeitlich hochaufgelöste Daten zur gleichen Zeit wie räumlich hochaufgelöste Daten aufgezeichnet werden können. Da die von beiden abgeleiteten Daten jedoch einen unterschiedlichen Zeitverlauf aufweisen, repräsentieren die Datensätze nicht notwendigerweise genau dieselbe Gehirnaktivität. Die Kombination von EEG und fMRI ist mit technischen Schwierigkeiten verbunden, wie z. B. der Notwendigkeit, die bei der MRT-Aufnahme auftretenden Gradientenartefakte zu entfernen. Außerdem können durch das Magnetfeld der MRT Ströme in den sich bewegenden EEG-Elektrodenkabeln induziert werden. ⓘ
EEG kann ohne größere technische Schwierigkeiten gleichzeitig mit NIRS oder fUS verwendet werden. Es gibt keine gegenseitige Beeinflussung dieser Modalitäten, und eine kombinierte Messung kann nützliche Informationen über die elektrische Aktivität und die Hämodynamik bei mittlerer räumlicher Auflösung liefern. ⓘ
EEG vs. MEG
Das EEG spiegelt die korrelierte synaptische Aktivität wider, die durch die postsynaptischen Potenziale der kortikalen Neuronen verursacht wird. Die Ionenströme, die an der Erzeugung schneller Aktionspotenziale beteiligt sind, tragen möglicherweise nicht wesentlich zu den gemittelten Feldpotenzialen bei, die das EEG darstellen. Genauer gesagt, geht man davon aus, dass die elektrischen Kopfhautpotenziale, die das EEG erzeugen, durch extrazelluläre Ionenströme verursacht werden, die durch dendritische elektrische Aktivität hervorgerufen werden, während die Felder, die magnetoenzephalographische Signale erzeugen, mit intrazellulären Ionenströmen verbunden sind. ⓘ
Das EEG kann gleichzeitig mit dem MEG aufgezeichnet werden, so dass die Daten dieser komplementären Techniken mit hoher Zeitauflösung kombiniert werden können. ⓘ
Es wurden auch Studien zur numerischen Modellierung von EEG und MEG durchgeführt. ⓘ
Normale Aktivität
Menschliches EEG mit ausgeprägter Aktivität im Ruhezustand - Alpha-Rhythmus. Links: EEG-Kurven (horizontal - Zeit in Sekunden; vertikal - Amplituden, Skala 100 μV). Rechts: Leistungsspektren der dargestellten Signale (vertikale Linien - 10 und 20 Hz, Skala ist linear). Der Alpha-Rhythmus besteht aus sinusähnlichen Wellen mit Frequenzen im Bereich von 8-12 Hz (in diesem Fall 11 Hz), die in den posterioren Arealen stärker ausgeprägt sind. Der Alpha-Bereich ist im Leistungsspektrum rot dargestellt.
Menschliches EEG im Ruhezustand. Links: EEG-Kurven (horizontal - Zeit in Sekunden; vertikal - Amplituden, Skala 100 μV). Rechts: Leistungsspektren der dargestellten Signale (vertikale Linien - 10 und 20 Hz, Skala ist linear). 80-90 % der Menschen haben ausgeprägte sinusförmige Wellen mit Frequenzen im Bereich von 8-12 Hz - Alpha-Rhythmus. Bei anderen (wie diesem) fehlt diese Art von Aktivität.
Häufige Artefakte im menschlichen EEG. 1: Elektrookulographisches Artefakt, verursacht durch die Erregung der Muskeln des Augapfels (z. B. beim Blinzeln). Eine langsame, positive Welle mit großer Amplitude, die bei frontalen Elektroden auffällt. 2: Elektrodenartefakt, verursacht durch schlechten Kontakt (und damit größere Impedanz) zwischen P3-Elektrode und Haut. 3: Artefakt beim Schlucken. 4: Artefakt der gemeinsamen Referenzelektrode, verursacht durch schlechten Kontakt zwischen Referenzelektrode und Haut. Riesige, in allen Kanälen ähnliche Wellen. ⓘ
Das EEG wird typischerweise in Form von (1) rhythmischer Aktivität und (2) Transienten beschrieben. Die rhythmische Aktivität wird nach Frequenz in Bänder unterteilt. Bis zu einem gewissen Grad sind diese Frequenzbänder eine Frage der Nomenklatur (d. h. jede rhythmische Aktivität zwischen 8 und 12 Hz kann als "Alpha" bezeichnet werden), aber diese Bezeichnungen entstanden, weil festgestellt wurde, dass die rhythmische Aktivität innerhalb eines bestimmten Frequenzbereichs eine bestimmte Verteilung über die Kopfhaut oder eine bestimmte biologische Bedeutung hat. Frequenzbänder werden in der Regel mit spektralen Methoden (z. B. Welch) extrahiert, wie sie z. B. in frei verfügbarer EEG-Software wie EEGLAB oder der Neurophysiological Biomarker Toolbox implementiert sind. Die computergestützte Verarbeitung des EEG wird häufig als quantitative Elektroenzephalographie (qEEG) bezeichnet. ⓘ
Der größte Teil des im Kopfhaut-EEG beobachteten zerebralen Signals fällt in den Bereich von 1-20 Hz (Aktivitäten unterhalb oder oberhalb dieses Bereichs sind bei klinischen Standardaufzeichnungstechniken wahrscheinlich artefaktisch). Die Wellenformen werden in Bandbreiten unterteilt, die als Alpha, Beta, Theta und Delta bekannt sind, um den Großteil des in der klinischen Praxis verwendeten EEGs zu kennzeichnen. ⓘ
Vergleich der EEG-Bänder
| Band | Frequenz (Hz) | Ort | Normalerweise | Pathologisch |
|---|---|---|---|---|
| Delta | < 4 | frontal bei Erwachsenen, posterior bei Kindern; Wellen mit hoher Amplitude |
|
|
| Theta | 4–7 | Wird an Stellen gefunden, die nicht mit der jeweiligen Aufgabe zusammenhängen |
|
|
| Alpha | 8–12 | hintere Regionen des Kopfes, beidseitig, mit höherer Amplitude auf der dominanten Seite. Zentrale Bereiche (c3-c4) in Ruhe |
|
|
| Beta | 13–30 | beidseitig, symmetrische Verteilung, am deutlichsten frontal; Wellen mit niedriger Amplitude |
|
|
| Gamma | > 32 | Somatosensorischer Kortex |
|
|
| Mu | 8–12 | Sensomotorischer Kortex |
|
|
Die Praxis, in den Definitionen nur ganze Zahlen zu verwenden, hat ihren Ursprung in praktischen Erwägungen aus der Zeit, als auf Papieraufzeichnungen nur ganze Zyklen gezählt werden konnten. Dies führt zu Lücken in den Definitionen, wie an anderer Stelle auf dieser Seite zu sehen ist. Die theoretischen Definitionen wurden immer sorgfältiger definiert, um alle Frequenzen zu erfassen. Leider gibt es in den Standardwerken keine Einigung darüber, wie diese Bereiche aussehen sollten - die Werte für das obere Ende von Alpha und das untere Ende von Beta umfassen 12, 13, 14 und 15. Wird der Schwellenwert mit 14 Hz angesetzt, dann hat die langsamste Betawelle etwa die gleiche Dauer wie der längste Spike (70 ms), was diesen Wert am sinnvollsten macht. ⓘ
| Band | Frequenz (Hz) |
|---|---|
| Delta | < 4 |
| Theta | ≥ 4 und < 8 |
| Alpha | ≥ 8 und < 13 |
| Beta | ≥ 13 |
Andere unterteilen die Bänder zum Zwecke der Datenanalyse manchmal in Unterbänder. ⓘ

Wellenmuster

- Deltawellen sind der Frequenzbereich bis zu 4 Hz. Sie haben in der Regel die höchste Amplitude und sind die langsamsten Wellen. Sie treten normalerweise bei Erwachsenen im Slow-Wave-Schlaf auf. Auch bei Säuglingen sind sie normal. Es kann fokal bei subkortikalen Läsionen und in allgemeiner Verteilung bei diffusen Läsionen, metabolischer Enzephalopathie, Hydrozephalus oder tiefen Mittellinienläsionen auftreten. Bei Erwachsenen ist es in der Regel frontal am stärksten ausgeprägt (z. B. FIRDA - frontales intermittierendes rhythmisches Delta) und bei Kindern posterior (z. B. OIRDA - okzipitales intermittierendes rhythmisches Delta). ⓘ

- Theta ist der Frequenzbereich von 4 Hz bis 7 Hz. Theta-Wellen treten normalerweise bei kleinen Kindern auf. Bei älteren Kindern und Erwachsenen kann es bei Schläfrigkeit oder Erregung auftreten; es kann auch bei Meditation beobachtet werden. Ein für das Alter übermäßiges Theta stellt eine abnorme Aktivität dar. Es kann als fokale Störung bei fokalen subkortikalen Läsionen auftreten; es kann bei diffusen Störungen oder metabolischer Enzephalopathie oder tiefen Störungen der Mittellinie oder in einigen Fällen von Hydrozephalus generalisiert auftreten. Im Gegenteil, dieser Bereich wurde mit Berichten über entspannte, meditative und kreative Zustände in Verbindung gebracht. ⓘ

- Alpha ist der Frequenzbereich von 8 Hz bis 12 Hz. Hans Berger nannte die erste rhythmische EEG-Aktivität, die er beobachtete, "Alphawelle". Es handelte sich um den "posterioren Grundrhythmus" (auch "posteriorer dominanter Rhythmus" oder "posteriorer Alpha-Rhythmus" genannt), der in den hinteren Regionen des Kopfes auf beiden Seiten auftritt, wobei die Amplitude auf der dominanten Seite höher ist. Er entsteht beim Schließen der Augen und bei Entspannung und schwächt sich ab, wenn man die Augen öffnet oder sich geistig anstrengt. Der hintere Grundrhythmus ist bei Kleinkindern sogar langsamer als 8 Hz (daher technisch gesehen im Theta-Bereich). ⓘ

- Neben dem posterioren Grundrhythmus gibt es weitere normale Alpha-Rhythmen wie den Mu-Rhythmus (Alpha-Aktivität in den kontralateralen sensorischen und motorischen Kortikalbereichen), der auftritt, wenn die Hände und Arme untätig sind, und den "dritten Rhythmus" (Alpha-Aktivität in den Temporal- oder Frontallappen). Alpha kann abnormal sein; ein EEG mit diffusem Alpha, das im Koma auftritt und nicht auf äußere Reize reagiert, wird beispielsweise als "Alpha-Koma" bezeichnet. ⓘ

- Beta ist der Frequenzbereich von 13 Hz bis etwa 30 Hz. Sie treten in der Regel beidseitig in symmetrischer Verteilung auf und sind frontal am stärksten ausgeprägt. Die Beta-Aktivität ist eng mit dem motorischen Verhalten verknüpft und wird im Allgemeinen bei aktiven Bewegungen abgeschwächt. Beta mit niedriger Amplitude und mehreren und variierenden Frequenzen wird oft mit aktivem, geschäftigem oder ängstlichem Denken und aktiver Konzentration in Verbindung gebracht. Rhythmisches Beta mit einer dominanten Reihe von Frequenzen wird mit verschiedenen Pathologien, wie dem Dup15q-Syndrom, und Drogenwirkungen, insbesondere Benzodiazepinen, in Verbindung gebracht. Sie kann in Bereichen mit kortikalen Schäden fehlen oder reduziert sein. Er ist der dominante Rhythmus bei Patienten, die wach oder ängstlich sind oder die Augen geöffnet haben. ⓘ

- Gamma ist der Frequenzbereich von etwa 30-100 Hz. Es wird angenommen, dass Gamma-Rhythmen die Verbindung verschiedener Neuronenpopulationen zu einem Netzwerk darstellen, um eine bestimmte kognitive oder motorische Funktion auszuführen.
- Der Mu-Bereich liegt bei 8-13 Hz und überschneidet sich teilweise mit anderen Frequenzen. Er spiegelt das synchrone Feuern der motorischen Neuronen im Ruhezustand wider. Man geht davon aus, dass die Mu-Unterdrückung motorische Spiegelneuronen-Systeme widerspiegelt, denn wenn eine Aktion beobachtet wird, erlischt das Muster, möglicherweise weil die normalen und die Spiegelneuronen-Systeme "aus dem Takt geraten" und sich gegenseitig stören. ⓘ
Die "ultraslow" oder "near-DC"-Aktivität wird in einigen Forschungszusammenhängen mit Gleichstromverstärkern aufgezeichnet. Sie wird in der Regel nicht im klinischen Kontext aufgezeichnet, da das Signal bei diesen Frequenzen für eine Reihe von Artefakten anfällig ist. ⓘ
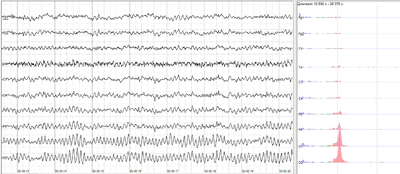
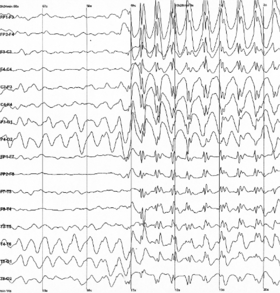
Einige Merkmale des EEG sind nicht rhythmisch, sondern vorübergehend. Spikes und scharfe Wellen können Anfallsaktivität oder interiktale Aktivität bei Personen mit Epilepsie oder einer Veranlagung für Epilepsie darstellen. Andere vorübergehende Merkmale sind normal: Scheitelwellen und Schlafspindeln sind im normalen Schlaf zu beobachten. ⓘ
Beachten Sie, dass es Aktivitätsarten gibt, die statistisch gesehen ungewöhnlich sind, aber nicht mit einer Funktionsstörung oder Krankheit einhergehen. Diese werden oft als "normale Varianten" bezeichnet. Der mu-Rhythmus ist ein Beispiel für eine normale Variante. ⓘ
Das normale Elektroenzephalogramm (EEG) variiert je nach Alter. Das pränatale EEG und das EEG von Neugeborenen unterscheiden sich deutlich vom EEG Erwachsener. Föten im dritten Trimester und Neugeborene zeigen zwei gemeinsame Hirnaktivitätsmuster: "diskontinuierliche" und "alternierende Spuren". "Diskontinuierliche" elektrische Aktivität bezieht sich auf scharfe Ausbrüche elektrischer Aktivität, gefolgt von niederfrequenten Wellen. "Die alternierende elektrische Aktivität beschreibt scharfe Ausbrüche, gefolgt von kurzen Intervallen mit hoher Amplitude, und weist in der Regel auf einen ruhigen Schlaf bei Neugeborenen hin. Das EEG im Kindesalter weist im Allgemeinen langsamere Frequenzschwingungen auf als das EEG von Erwachsenen. ⓘ
Auch das normale EEG variiert je nach Zustand. Das EEG wird zusammen mit anderen Messungen (EOG, EMG) zur Bestimmung der Schlafstadien in der Polysomnographie verwendet. Das Stadium I des Schlafs (in einigen Systemen gleichbedeutend mit Schläfrigkeit) zeigt sich im EEG als Ausbleiben des hinteren Grundrhythmus. Es kann zu einem Anstieg der Theta-Frequenzen kommen. Santamaria und Chiappa haben eine Reihe von Mustern katalogisiert, die mit Schläfrigkeit einhergehen. Das Stadium II des Schlafs ist durch Schlafspindeln gekennzeichnet - vorübergehende Ausläufer rhythmischer Aktivität im Bereich von 12-14 Hz (manchmal auch als "Sigma"-Band bezeichnet), die ein frontal-zentrales Maximum aufweisen. Der Großteil der Aktivität in Phase II liegt im Bereich von 3-6 Hz. Die Schlafstadien III und IV sind durch das Vorhandensein von Delta-Frequenzen gekennzeichnet und werden oft als "Slow-Wave-Schlaf" bezeichnet. Die Stadien I-IV umfassen den Nicht-REM-Schlaf (oder "NREM"-Schlaf). Das EEG im REM-Schlaf (Rapid Eye Movement) ähnelt in gewisser Weise dem EEG im Wachzustand. ⓘ
Das EEG unter Vollnarkose hängt von der Art des verwendeten Narkosemittels ab. Bei halogenierten Anästhetika wie Halothan oder intravenösen Mitteln wie Propofol ist ein schnelles (Alpha oder niedriges Beta), nicht reaktives EEG-Muster über den größten Teil der Kopfhaut zu sehen, insbesondere im vorderen Bereich; in einer älteren Terminologie wurde dies als WAR-Muster (widespread anterior rapid) bezeichnet, im Gegensatz zu einem WAIS-Muster (widespread slow), das mit hohen Opiatdosen in Verbindung gebracht wird. Die Auswirkungen von Anästhetika auf EEG-Signale werden allmählich auf der Ebene der Wirkungen der Medikamente auf verschiedene Arten von Synapsen und die Schaltkreise, die eine synchronisierte neuronale Aktivität ermöglichen, verstanden (siehe: http://www.stanford.edu/group/maciverlab/). ⓘ
Artefakte
Biologische Artefakte

Elektrische Signale, die von einem EEG entlang der Kopfhaut erfasst werden, aber nicht zerebralen Ursprungs sind, werden als Artefakte bezeichnet. EEG-Daten sind fast immer durch solche Artefakte verunreinigt. Die Amplitude der Artefakte kann im Verhältnis zur Größe der Amplitude der interessierenden kortikalen Signale recht groß sein. Dies ist einer der Gründe, warum es viel Erfahrung erfordert, EEGs klinisch korrekt zu interpretieren. Zu den häufigsten Arten von biologischen Artefakten gehören:
- augeninduzierte Artefakte (einschließlich Augenblinzeln, Augenbewegungen und extraokulare Muskelaktivität)
- EKG-(Herz-)Artefakte
- EMG (Muskelaktivierung)-induzierte Artefakte
- glossokinetische Artefakte
- Schädeldefekt-Artefakte, wie sie bei Patienten nach einer Kraniotomie auftreten und als "Brucheffekt" oder "Brucherhythmus" beschrieben werden können ⓘ
Die auffälligsten augeninduzierten Artefakte werden durch den Potenzialunterschied zwischen Hornhaut und Netzhaut verursacht, der im Vergleich zu den zerebralen Potenzialen recht groß ist. Wenn die Augen und Augenlider völlig ruhig sind, hat dieser korneo-retinale Dipol keinen Einfluss auf das EEG. Das Blinzeln erfolgt jedoch mehrmals pro Minute, die Augenbewegungen erfolgen mehrmals pro Sekunde. Lidbewegungen, die meist während des Blinzelns oder vertikaler Augenbewegungen auftreten, lösen ein großes Potenzial aus, das sich vor allem in der Differenz zwischen den Elektrookulographiekanälen (EOG) über und unter den Augen zeigt. Eine gängige Erklärung für dieses Potenzial sieht die Augenlider als Gleitelektroden, die die positiv geladene Hornhaut mit der extraokularen Haut kurzschließen. Die Drehung der Augäpfel und damit des korneo-retinalen Dipols erhöht das Potenzial in den Elektroden, in deren Richtung die Augen gedreht werden, und verringert die Potenziale in den gegenüberliegenden Elektroden. Augenbewegungen, so genannte Sakkaden, erzeugen ebenfalls transiente elektromyografische Potenziale, die als sakkadische Spike-Potenziale (SPs) bezeichnet werden. Das Spektrum dieser SPs überschneidet sich mit dem Gamma-Band (siehe Gamma-Welle) und beeinträchtigt die Analyse der induzierten Gamma-Band-Antworten erheblich, so dass maßgeschneiderte Verfahren zur Artefaktkorrektur erforderlich sind. Gezieltes oder reflexartiges Blinzeln erzeugt ebenfalls elektromyografische Potenziale, aber noch wichtiger ist die reflexartige Bewegung des Augapfels während des Blinzelns, die dem EEG ein charakteristisches artefaktisches Aussehen verleiht (siehe Bell'sches Phänomen). ⓘ
Augenlidflatternde Artefakte eines charakteristischen Typs wurden früher als Kappa-Rhythmus (oder Kappa-Wellen) bezeichnet. Sie treten gewöhnlich in den präfrontalen Ableitungen auf, d. h. direkt über den Augen. Manchmal werden sie bei geistiger Aktivität beobachtet. Sie liegen normalerweise im Theta- (4-7 Hz) oder Alpha-Bereich (7-14 Hz). Sie wurden so benannt, weil man glaubte, sie kämen aus dem Gehirn. Spätere Studien ergaben, dass sie durch schnelles Flattern der Augenlider entstehen, das manchmal so winzig ist, dass es schwer zu erkennen ist. Tatsächlich handelt es sich um ein Rauschen in der EEG-Messung, das technisch nicht als Rhythmus oder Welle bezeichnet werden sollte. Daher wird dieses Phänomen in der Elektroenzephalographie als Artefakt des Augenlidflatterns und nicht als Kappa-Rhythmus (oder -Welle) bezeichnet. ⓘ
Einige dieser Artefakte können in verschiedenen Anwendungen nützlich sein. Die EOG-Signale können beispielsweise zur Erkennung und Verfolgung von Augenbewegungen verwendet werden, was in der Polysomnographie sehr wichtig ist, und auch im herkömmlichen EEG zur Bewertung möglicher Veränderungen von Wachsamkeit, Schläfrigkeit oder Schlaf. ⓘ
EKG-Artefakte sind recht häufig und können mit Spike-Aktivität verwechselt werden. Aus diesem Grund wird bei der modernen EEG-Akquisition in der Regel ein Ein-Kanal-EKG von den Extremitäten abgeleitet. Auf diese Weise können mit dem EEG auch Herzrhythmusstörungen erkannt werden, die eine wichtige Differenzialdiagnose zu Synkopen oder anderen episodischen/anfallartigen Störungen darstellen. ⓘ
Glossokinetische Artefakte werden durch den Potenzialunterschied zwischen Zungengrund und Zungenspitze verursacht. Leichte Zungenbewegungen können das EEG verunreinigen, insbesondere bei Parkinson- und Tremorerkrankungen. ⓘ
Umweltbedingte Artefakte
Neben den körpereigenen Artefakten gibt es viele Artefakte, die von außerhalb des Körpers stammen. Bewegungen des Patienten oder auch nur das Aufsetzen der Elektroden können Elektrodenknackser verursachen, d. h. Spikes, die durch eine kurzzeitige Änderung der Impedanz einer bestimmten Elektrode entstehen. Eine schlechte Erdung der EEG-Elektroden kann je nach der Frequenz des örtlichen Stromnetzes erhebliche 50- oder 60-Hz-Artefakte verursachen. Eine dritte mögliche Störquelle ist das Vorhandensein einer Infusion; solche Geräte können rhythmische, schnelle, niedrige Spannungsstöße verursachen, die mit Spikes verwechselt werden können. ⓘ
Bewegungsartefakte führen zu Signalrauschen, das das interessierende neuronale Signal verdecken kann. ⓘ
Ein mit EEG ausgestatteter Phantomkopf kann auf eine Bewegungsplattform gestellt und sinusförmig bewegt werden. Diese Vorrichtung ermöglichte es den Forschern, die Wirksamkeit von Algorithmen zur Beseitigung von Bewegungsartefakten zu untersuchen. Bei Verwendung desselben Modells von Phantomkopf und Bewegungsplattform wurde festgestellt, dass das Schwanken des Kabels einer der Hauptverursacher von Bewegungsartefakten ist. Eine Vergrößerung der Elektrodenoberfläche hatte jedoch einen kleinen, aber signifikanten Effekt auf die Reduzierung der Artefakte. Diese Forschung wurde vom U.S. Army Research Laboratory als Teil der Cognition and Neuroergonomics Collaborative Technical Alliance gefördert. ⓘ
Korrektur von Artefakten
Ein einfacher Ansatz zur Behandlung von Artefakten besteht darin, einfach Epochen von Daten zu entfernen, die einen bestimmten Schwellenwert für Verunreinigungen überschreiten, z. B. Epochen mit Amplituden von mehr als ±100 μV. Dies könnte jedoch zum Verlust von Daten führen, die noch artefaktfreie Informationen enthalten. Ein anderer Ansatz ist die Anwendung von Raum- und Frequenzbandfiltern, um Artefakte zu entfernen. Allerdings können sich Artefakte mit dem interessierenden Signal im Spektralbereich überschneiden, was diesen Ansatz ineffizient macht. In letzter Zeit wurden Techniken der unabhängigen Komponentenanalyse (ICA) zur Korrektur oder Entfernung von EEG-Verunreinigungen eingesetzt. Mit diesen Verfahren wird versucht, die EEG-Signale in eine bestimmte Anzahl zugrunde liegender Komponenten zu zerlegen ("unmix"). Es gibt viele Quellentrennungsalgorithmen, die oft von verschiedenen Verhaltensweisen oder Eigenschaften des EEG ausgehen. Unabhängig davon erlaubt das Prinzip hinter einer bestimmten Methode in der Regel, nur die Komponenten "neu zu mischen", die zu einem "sauberen" EEG führen, indem das Gewicht der unerwünschten Komponenten aufgehoben (auf Null gesetzt) wird. ⓘ
Normalerweise wird die Artefaktkorrektur von EEG-Daten, einschließlich der Klassifizierung der artefaktbehafteten Komponenten der ICA, von EEG-Experten durchgeführt. Mit dem Aufkommen von EEG-Arrays mit 64 bis 256 Elektroden und der Zunahme von Studien mit großen Populationen ist die manuelle Artefaktkorrektur jedoch extrem zeitaufwändig geworden. Um dies und die Subjektivität vieler Artefaktkorrekturen in den Griff zu bekommen, wurden auch vollautomatische Pipelines zur Artefaktunterdrückung entwickelt. ⓘ
In den letzten Jahren wurde durch den Vergleich von Daten gelähmter und nicht gelähmter Probanden gezeigt, dass die EEG-Kontamination durch Muskeln weitaus stärker ausgeprägt ist als bisher angenommen, insbesondere im Gamma-Bereich über 20 Hz. Es hat sich jedoch gezeigt, dass die Laplacian-Oberfläche Muskelartefakte wirksam eliminiert, insbesondere bei zentralen Elektroden, die weiter von den stärksten Verunreinigungen entfernt sind. In einer Folgestudie erwies sich die Kombination von Surface Laplacian mit automatisierten Techniken zur Entfernung von Muskelkomponenten mittels ICA als besonders effektiv. ⓘ
Abnorme Aktivität
Abnormale Aktivität kann grob in epileptiforme und nicht-epileptiforme Aktivität unterteilt werden. Sie kann auch in fokal oder diffus unterschieden werden. ⓘ
Bei fokalen epileptiformen Entladungen handelt es sich um schnelle, synchrone Potenziale in einer großen Anzahl von Neuronen in einem abgegrenzten Bereich des Gehirns. Sie können als interiktale Aktivität zwischen den Anfällen auftreten und repräsentieren einen Bereich kortikaler Reizbarkeit, der für die Entstehung epileptischer Anfälle prädisponiert sein kann. Interiktale Entladungen sind nicht gänzlich zuverlässig, um festzustellen, ob ein Patient an Epilepsie leidet oder wo sein Anfall seinen Ursprung haben könnte. (Siehe fokale Epilepsie.) ⓘ
Generalisierte epileptiforme Entladungen haben oft ein anteriores Maximum, sind aber im gesamten Gehirn synchron zu beobachten. Sie sind ein deutlicher Hinweis auf eine generalisierte Epilepsie. ⓘ
Fokale nicht-epileptiforme abnorme Aktivität kann in Bereichen des Gehirns auftreten, in denen eine fokale Schädigung des Kortex oder der weißen Substanz vorliegt. Sie besteht oft aus einer Zunahme der langsamen Frequenzrhythmen und/oder einem Verlust der normalen höherfrequenten Rhythmen. Sie kann auch als fokale oder einseitige Abnahme der Amplitude des EEG-Signals auftreten. ⓘ
Diffuse nicht-epileptiforme abnorme Aktivität kann sich als diffuse abnorm langsame Rhythmen oder als bilaterale Verlangsamung normaler Rhythmen, wie z. B. des PBR, manifestieren. ⓘ
Intrakortikale Enzephalogrammelektroden und subdurale Elektroden können zusammen verwendet werden, um Artefakte von epileptiformen und anderen schwerwiegenden neurologischen Ereignissen zu unterscheiden und abzugrenzen. ⓘ
Weitergehende Messungen abnormaler EEG-Signale haben in jüngster Zeit auch als mögliche Biomarker für verschiedene Erkrankungen wie die Alzheimer-Krankheit Aufmerksamkeit erregt. ⓘ
Fernkommunikation
Das United States Army Research Office stellte 2009 4 Millionen Dollar für Forscher an der University of California, Irvine, zur Verfügung, um EEG-Verarbeitungstechniken zu entwickeln, mit denen Korrelate der imaginierten Sprache und der beabsichtigten Richtung identifiziert werden können, damit Soldaten auf dem Schlachtfeld über eine computergestützte Rekonstruktion der EEG-Signale von Teammitgliedern in Form von verständlichen Signalen wie Worten kommunizieren können. Systeme zur Dekodierung imaginärer Sprache aus dem EEG finden auch außerhalb des militärischen Bereichs Anwendung, z. B. in Gehirn-Computer-Schnittstellen. ⓘ
EEG-Diagnostik
Das Verteidigungsministerium (DoD), das Ministerium für Veteranenangelegenheiten (VA) und das U.S. Army Research Laboratory (ARL) haben bei der EEG-Diagnostik zusammengearbeitet, um leichte bis mittelschwere traumatische Hirnverletzungen (mTBI) bei Soldaten zu erkennen. Zwischen 2000 und 2012 wurden 75 Prozent der Gehirnverletzungen bei US-Militäreinsätzen als mTBI eingestuft. Als Reaktion darauf hat das Verteidigungsministerium neue Technologien entwickelt, die eine schnelle, genaue, nicht-invasive und feldtaugliche Erkennung von mTBI ermöglichen, um diese Verletzungen zu behandeln. ⓘ
Bei Kampfpersonal treten PTBS und mTBI häufig in Wechselwirkung zueinander auf. Bei beiden Erkrankungen kommt es zu veränderten niederfrequenten Hirnstromschwingungen. Die veränderten Hirnströme von PTBS-Patienten zeigen eine Abnahme der niederfrequenten Oszillationen, während mTBI-Verletzungen mit erhöhten niederfrequenten Oszillationen verbunden sind. Eine wirksame EEG-Diagnostik kann Ärzten dabei helfen, Erkrankungen genau zu erkennen und Verletzungen angemessen zu behandeln, um Langzeitfolgen zu mildern. ⓘ
Bei der klinischen Bewertung von EEGs wird traditionell eine visuelle Inspektion durchgeführt. Anstelle einer visuellen Bewertung der Topografie der Hirnwellenschwingungen analysiert die quantitative Elektroenzephalografie (qEEG), eine computergestützte algorithmische Methode, eine bestimmte Hirnregion und wandelt die Daten in ein aussagekräftiges "Leistungsspektrum" des Bereichs um. Die genaue Unterscheidung zwischen einer mTBI und einer PTBS kann die Genesungsaussichten der Patienten erheblich verbessern, zumal langfristige Veränderungen der neuronalen Kommunikation auch nach einem mTBI-Vorfall bestehen bleiben können. ⓘ
Eine weitere gängige Messung, die anhand von EEG-Daten vorgenommen wird, sind Komplexitätsmaße wie die Lempel-Ziv-Komplexität, die fraktale Dimension und die spektrale Ebenheit, die mit bestimmten Pathologien oder Pathologiestadien in Verbindung gebracht werden. ⓘ
Wirtschaftlichkeit
Es gibt preisgünstige EEG-Geräte für den Forschungs- und Verbrauchermarkt. In jüngster Zeit haben einige Unternehmen die medizinische EEG-Technologie so miniaturisiert, dass sie auch für die breite Öffentlichkeit zugänglich ist. Einige dieser Unternehmen haben kommerzielle EEG-Geräte gebaut, die im Einzelhandel für weniger als 100 US-Dollar erhältlich sind.
- Im Jahr 2004 veröffentlichte OpenEEG seinen ModularEEG als Open-Source-Hardware. Die kompatible Open-Source-Software umfasst ein Spiel zum Balancieren eines Balls.
- Im Jahr 2007 brachte NeuroSky das erste erschwingliche EEG für Verbraucher zusammen mit dem Spiel NeuroBoy auf den Markt. Dies war auch das erste groß angelegte EEG-Gerät, das die Trockensensortechnologie verwendete.
- 2008 entwickelte OCZ Technology ein Gerät für den Einsatz in Videospielen, das hauptsächlich auf Elektromyografie basiert.
- 2008 gab der Final Fantasy-Entwickler Square Enix bekannt, dass er mit NeuroSky zusammenarbeitet, um das Spiel Judecca zu entwickeln.
- 2009 brachte Mattel in Zusammenarbeit mit NeuroSky das Spiel Mindflex auf den Markt, bei dem ein Ball mittels EEG durch einen Hindernisparcours gelenkt wird. Es ist bis heute das mit Abstand meistverkaufte EEG für Verbraucher.
- 2009 brachte Uncle Milton Industries in Zusammenarbeit mit NeuroSky den Star Wars Force Trainer heraus, ein Spiel, das die Illusion erzeugt, die Macht zu besitzen.
- Im Jahr 2009 brachte Emotiv das EPOC auf den Markt, ein 14-Kanal-EEG-Gerät. Das EPOC ist das erste kommerzielle BCI, das keine Trockensensortechnologie verwendet und bei dem der Benutzer eine Kochsalzlösung auf die Elektrodenpads auftragen muss (die nach ein oder zwei Stunden Benutzung wieder befeuchtet werden müssen).
- Im Jahr 2010 erweiterte NeuroSky das MindSet um eine Blinzel- und Elektromyografie-Funktion.
- Im Jahr 2011 brachte NeuroSky das MindWave auf den Markt, ein EEG-Gerät, das für Bildungszwecke und Spiele entwickelt wurde. Der MindWave wurde im Guinness-Buch der Rekorde als "Schwerste Maschine, die mit einer Gehirnsteuerungsschnittstelle bewegt wird" ausgezeichnet.
- Im Jahr 2012 brachte das japanische Projekt Neurowear das Necomimi heraus: ein Headset mit motorisierten Katzenohren. Bei dem Headset handelt es sich um ein NeuroSky MindWave-Gerät mit zwei Motoren am Kopfbügel, wo sich die Ohren einer Katze befinden könnten. Über den Motoren sitzen Schutzhüllen in Form von Katzenohren, so dass sich die Ohren bewegen, wenn das Gerät den emotionalen Zustand registriert. Wenn sie entspannt sind, fallen die Ohren beispielsweise zur Seite und spitzen sich bei Erregung wieder zu.
- 2014 veröffentlichte OpenBCI nach einer erfolgreichen Kickstarter-Kampagne im Jahr 2013 eine gleichnamige Open-Source-Gehirn-Computer-Schnittstelle. Die Basisversion von OpenBCI hat 8 Kanäle, die auf 16 erweitert werden können, und unterstützt EEG, EKG und EMG. Das OpenBCI basiert auf dem Texas Instruments ADS1299 IC und dem Arduino- oder PIC-Mikrocontroller und kostet in der Grundversion 399 US-Dollar. Es verwendet Standard-Metallbecherelektroden und leitfähige Paste.
- Im Jahr 2015 brachte Mind Solutions Inc. das bisher kleinste BCI für Verbraucher auf den Markt, den NeuroSync. Dieses Gerät funktioniert wie ein Trockensensor und ist nicht größer als ein Bluetooth-Ohrhörer.
- 2015 brachte das chinesische Unternehmen Macrotellect BrainLink Pro und BrainLink Lite auf den Markt, ein EEG-Wearable-Produkt für Verbraucher, das in den App Stores von Apple und Android 20 Apps zur Verbesserung der Gehirnleistung anbietet.
- Im Jahr 2021 bringt BioSerenity das Neuronaute und Icecap auf den Markt, ein Einweg-EEG-Headset, das Aufzeichnungen in gleicher Qualität wie herkömmliche Schalen-Elektroden ermöglicht. ⓘ
Künftige Forschung
Das EEG wurde neben den herkömmlichen Anwendungen der klinischen Diagnose und der konventionellen kognitiven Neurowissenschaft für viele andere Zwecke eingesetzt. Eine frühe Anwendung war während des Zweiten Weltkriegs durch das U.S. Army Air Corps, um anfallsgefährdete Piloten auszusortieren; Langzeit-EEG-Aufzeichnungen bei Epilepsiepatienten werden auch heute noch zur Anfallsvorhersage verwendet. Neurofeedback ist nach wie vor eine wichtige Erweiterung und wird in seiner fortgeschrittensten Form auch als Grundlage für Gehirn-Computer-Schnittstellen verwendet. Das EEG wird auch im Bereich des Neuromarketings in großem Umfang eingesetzt. ⓘ
Das EEG wird durch Medikamente verändert, die die Hirnfunktionen beeinflussen, die Chemikalien, die die Grundlage der Psychopharmakologie bilden. Bergers frühe Experimente zeichneten die Auswirkungen von Medikamenten auf das EEG auf. Die Wissenschaft der Pharmako-Elektroenzephalographie hat Methoden entwickelt, um Substanzen zu identifizieren, die die Gehirnfunktionen für therapeutische und Freizeitzwecke systematisch verändern. ⓘ
Honda versucht, ein System zu entwickeln, mit dem ein Bediener seinen Asimo-Roboter mit Hilfe des EEG steuern kann, eine Technologie, die das Unternehmen später in seine Autos integrieren möchte. ⓘ
Im indischen Bundesstaat Maharashtra wurden EEGs bereits als Beweismittel in Strafprozessen verwendet. Brain Electrical Oscillation Signature Profiling (BEOS), eine EEG-Technik, wurde im Prozess Staat Maharashtra gegen Sharma eingesetzt, um nachzuweisen, dass Sharma sich daran erinnerte, ihren Ex-Verlobten mit Arsen vergiftet zu haben, obwohl die Zuverlässigkeit und die wissenschaftliche Grundlage von BEOS umstritten sind. ⓘ
Derzeit wird viel geforscht, um EEG-Geräte kleiner, tragbarer und einfacher in der Anwendung zu machen. Das so genannte "Wearable EEG" basiert auf der Entwicklung von drahtloser Elektronik mit geringem Stromverbrauch und "trockenen" Elektroden, die kein leitfähiges Gel benötigen, um verwendet zu werden. Ziel des "Wearable EEG" ist es, kleine EEG-Geräte zu entwickeln, die nur am Kopf getragen werden und das EEG über Tage, Wochen oder Monate hinweg aufzeichnen können, wie das Ohr-EEG. Eine solche verlängerte und einfach zu handhabende Überwachung könnte die Diagnose chronischer Krankheiten wie Epilepsie entscheidend verbessern und die Akzeptanz von BCI-Systemen beim Endnutzer erheblich steigern. Außerdem wird an spezifischen Lösungen geforscht, um die Batterielebensdauer von tragbaren EEG-Geräten durch Datenreduzierung zu verlängern. Im Zusammenhang mit der Epilepsie-Diagnose wurde beispielsweise die Datenreduzierung eingesetzt, um die Batterielebensdauer von EEG-Wearable-Geräten zu verlängern, indem diagnostisch relevante EEG-Daten intelligent ausgewählt und nur diese übertragen wurden. ⓘ
In der Forschung wird EEG derzeit häufig in Kombination mit maschinellem Lernen eingesetzt. EEG-Daten werden vorverarbeitet, um sie an Algorithmen für maschinelles Lernen weiterzuleiten. Diese Algorithmen werden dann darauf trainiert, verschiedene Krankheiten wie Schizophrenie, Epilepsie oder Demenz zu erkennen. Darüber hinaus werden sie zunehmend zur Erforschung der Anfallserkennung eingesetzt. Durch den Einsatz von maschinellem Lernen können die Daten automatisch analysiert werden. Langfristig zielt diese Forschung darauf ab, Algorithmen zu entwickeln, die Ärzte in ihrer klinischen Praxis unterstützen und weitere Erkenntnisse über Krankheiten liefern. In diesem Zusammenhang werden häufig Komplexitätsmaße von EEG-Daten berechnet, wie die Lempel-Ziv-Komplexität, die fraktale Dimension und die spektrale Ebenheit. Es hat sich gezeigt, dass die Kombination oder Multiplikation solcher Maße bisher verborgene Informationen in EEG-Daten aufdecken kann. ⓘ
EEG-Signale von Musikern wurden vom Brainwave Music Project, das am Computer Music Center der Columbia University von Brad Garton und Dave Soldier geleitet wird, zur Erstellung von Sofortkompositionen und einer CD verwendet. In ähnlicher Weise wurde eine einstündige Aufzeichnung der Gehirnströme von Ann Druyan in die Goldene Schallplatte der Voyager-Sonde von 1977 aufgenommen, für den Fall, dass eine außerirdische Intelligenz ihre Gedanken entschlüsseln könnte, zu denen auch die Frage gehörte, wie es ist, sich zu verlieben. ⓘ
Einführung
Ursache dieser Potentialschwankungen sind physiologische Vorgänge einzelner Gehirnzellen, die durch ihre elektrischen Zustandsänderungen zur Informationsverarbeitung des Gehirns beitragen. Entsprechend ihrer spezifischen räumlichen Anordnung addieren sich die von einzelnen Neuronen erzeugten Potentiale auf, so dass sich über den gesamten Kopf verteilte Potentialänderungen messen lassen. ⓘ
Zur klinischen Bewertung wird eine Aufzeichnung in mindestens zwölf Kanälen von verschiedenen Elektrodenkombinationen benötigt. ⓘ
Die Ortsauflösung des üblichen EEGs liegt bei mehreren Zentimetern. Wenn eine höhere Ortsauflösung benötigt wird, so müssen die Elektroden nach neurochirurgischer Eröffnung des Schädels direkt auf die zu untersuchende Hirnrinde aufgelegt werden. Das ist jedoch nur in Sonderfällen z. B. vor epilepsiechirurgischen Eingriffen erforderlich. In diesem Falle spricht man von einem Elektrocorticogramm (ECoG; in deutscher Schreibung Elektrokortikogramm). Das ECoG ermöglicht eine räumliche Auflösung von unter 1 cm und bietet zusätzlich die Möglichkeit, durch selektive elektrische Reizung einer der Elektroden die Funktion der darunterliegenden Hirnrinde zu testen. Dies kann für den Neurochirurgen z. B. bei Eingriffen in der Nähe der Sprachregion von größter Wichtigkeit sein, um zu entscheiden, welche Teile er entfernen darf, ohne eine Funktionseinbuße fürchten zu müssen (vgl. Wachkraniotomie). Eine noch detailliertere Erfassung von Einzelzellaktivität ist nur im Tierexperiment möglich. ⓘ
Die resultierenden Daten können von geübten Spezialisten auf auffällige Muster untersucht werden. Es gibt aber auch umfangreiche Software-Pakete zur automatischen Signalanalyse. Eine weitverbreitete Methode zur Analyse des EEGs ist die Fouriertransformation der Daten vom Zeitbereich (also der gewohnten Darstellung von Spannungsänderungen im Verlauf der Zeit) in den sogenannten Frequenzbereich. Die so gewonnene Darstellung erlaubt die schnelle Bestimmung von rhythmischer Aktivität. ⓘ
Verwandte und abgeleitete Methoden
Durch Mittelwertbildung von EEG-Abschnitten, die bestimmten Stimuli folgen, werden evozierte Potentiale und ereigniskorrelierte Potentiale abgeleitet. Hierbei ist teilweise eine größere Bandbreite und Empfindlichkeit der Verstärker nötig, insbesondere bei den Frühen Akustisch Evozierten Potentialen. ⓘ
Ein anderes Verfahren zur Messung von Hirnströmen, das ebenfalls eine vielfältige Anwendung in der Medizintechnik findet, ist die Indizierung der Gehirnströme anhand ihres Magnetfeldes, welches mithilfe der SQUID-Technologie vermessen wird (siehe auch Magnetoenzephalographie). ⓘ
EEG-Frequenzbänder und Graphoelemente
Gamma-Wellen

Als Gamma-Welle wird ein Signal im Frequenzbereich ab etwa 30 Hz bezeichnet. Sie tritt zum Beispiel bei starker Konzentration, Lernprozessen oder dem Meditieren auf. Bei Mönchen mit langjähriger Meditationspraxis werden über 30-fach erhöhte Amplituden gemessen. Neuere Forschungen zeigten das Auftreten des Gammabandes bei der sogenannten Top-Down-Regulierung und der Synchronisation von verschiedenen Hirnarealen zur Integration verschiedener Qualitäten eines Stimulus. Sie sind auf einem EEG-Streifen mit bloßem Auge nicht zu sehen. ⓘ
Sharp-Waves
Steile Wellen (englisch sharp waves) bezeichnen, wie ihr Name sagt, steil ansteigende bzw. abfallende EEG-Linien. Sie sind epilepsietypische Potentiale (ETPs). Sie dauern etwa 80–200 ms an, ragen aus der Grundaktivität hervor und sind von den kürzeren Spikes abzugrenzen. ⓘ
Typisch sind EEG-Muster mit Sharp Waves z. B. für die Rolando-Epilepsie mit zentro-temporalen Sharp Waves. Auch bei der Creutzfeldt-Jakob-Krankheit zeigt sich ein auffälliges EEG mit periodischen Sharp-Wave-Komplexen und beim Martin-Bell-Syndrom sind fokale Sharp Waves nachweisbar. ⓘ
Sharp-Slow-Wave
Bei einer Sharp-Slow-Wave handelt es sich um eine Sharp-Wave mit einer nachfolgenden hochgespannten langsamen Welle. Dieses sind meist Delta-Wellen. Auch Sharp-Slow-Waves können in Komplexen auftreten. Dies ist der Fall, falls die Frequenz unter 3 Hz liegt. ⓘ
Spike-Waves
Bei einer spitzen Welle (engl. spike wave) handelt es sich um eine nachfolgende hochgespannte langsame Welle. Dieses sind meist Delta-Wellen. Treten diese über einen längeren Zeitraum auf, so spricht man von sog. Spikes-Waves-Komplexen. SW-Komplexe treten meist in Gruppen oder Serien, allerdings überwiegend generalisiert, auf. Der „klassische“ SW-Komplex hat eine Frequenz um 3 Hz und tritt vermehrt in REM-Schlafphasen auf. ⓘ
generalisierter Spike-Wave-Komplex über 35 Sekunden während der REM-Phase ⓘ
Slow Cortical Potentials
Slow Cortical Potentials (SCP) ‚langsam veränderliche kortikale Potentialschwankungen‘ sind Potentialschwankungen in der Größenordnung von 100 bis 200 µV und einer zeitlichen Dauer von einer bis wenige Sekunden. Diese sind damit um ein Vielfaches größer als die EEG-Wellen Delta bis Gamma, sind aber in einem herkömmlichen Elektroenzephalogramm nicht sichtbar, da sie mittels Hochpass-Filter üblicherweise herausgefiltert werden. ⓘ
Schlafspindeln

Schlafspindeln sind typische Wellenmuster für die Non-REM-Schlafphase 2 (N2), können aber auch sporadisch bereits in Stadium 1 (N1) nachweisbar sein und treten auch noch im Tiefschlaf (N3, Slow wave sleep SWS) auf. Sie entstehen durch Rückkoppelung in thalamocorticalen Netzwerken und deuten auf eine Hemmung von Wahrnehmungsreizen im Thalamus hin. Schlafspindeln werden daher als schlafstabilisierend angesehen. Durch Frequenzanalyse lassen sich zwei Arten von Spindeln abgrenzen: Spindeln mit 11,5–13,5 Hz haben ein frontales, Spindeln mit 12,5–14,5 Hz ein zentrales Maximum. Unter Barbituraten (z. B. Phenobarbital) und Benzodiazepinen (z. B. Diazepam) kommt es zu einer Zunahme und Frequenzbeschleunigung (bis 15,5 Hz) von Spindeln. ⓘ
K-Komplexe
K-Komplexe sind Wellenmuster, die typischerweise in der Non-REM-Schlafphase N2 auftreten, vereinzelt bereits im Wach-Schlaf-Übergang (N1) nachweisbar sein können und auch im Tiefschlaf (N3, SWS) noch anhalten. Die Wellenform ist biphasisch (s. Abb.) mit einem steilen Aufstrich bis zum negativen Maximum, einem etwas langsameren Abfall zur Positivität und anschließend einer Rückkehr zur Nulllinie. Die Amplitude beträgt über 75 µV, teilweise über 200 µV. Eine Schlafspindel kann unmittelbar folgen. Auch Weckreaktionen (Arousals) können durch K-Komplexe eingeleitet werden. Physiologisch handelt es sich um eine EEG-Aktivierung durch externe oder interne Stimuli, so dass K-Komplexe auch als Form evozierter Potentiale angesehen werden können. ⓘ
So können K-Komplexe spontan auftreten oder durch akustische Reize evoziert werden. ⓘ
Vertex-Wellen
Vertex-Wellen sind charakteristisch für den Wach-Schlaf-Übergang, treten aber auch im weiteren Schlafverlauf vor allem im stabilen Leichtschlaf auf. Sie haben eine Dauer von weniger als 200 ms, sind weitgehend symmetrisch und zeigen eine scharfe negative Spitze. Ihr Maximum liegt über dem Vertex. Physiologisch handelt es sich wahrscheinlich um eine stadienspezifische Subgruppe der K-Komplexe. ⓘ
In der Jugend sind die Vertex-Wellen am steilsten und höchsten, mit zunehmendem Alter werden sie stumpfer. ⓘ
Anwendungen in der Medizin
Das Elektroenzephalogramm ist eine Standarduntersuchung der Neurologie. ⓘ
Hirntod
Das Erlöschen der „Hirnströme“ (also ein Ausbleiben von Spannungsschwankungen im EEG) ist ein Hilfskriterium bei der Bestimmung des Hirntods. ⓘ
Koma- und Narkosetiefe
Anhand spezifischer Kriterien, welche sich auf Graphoelemente und Frequenzmodulation des EEG beziehen, können Koma- und Narkosetiefe bestimmt werden. ⓘ
Schlafmedizin
In der Schlafmedizin wird (häufig mit einem reduzierten Elektrodensatz) ein Ganznacht-EEG abgeleitet. Aus diesem lassen sich Informationen über die Einschlaflatenz, die Verteilung der Schlafstadien (dargestellt als Hypnogramm), Weckreaktionen (spontan oder infolge äußerer bzw. innerer Störquellen wie z. B. Lärm oder schlafbezogene Atmungsstörungen) und weitere physiologische und pathologische Prozesse im Schlaf gewinnen. Meist wird das EEG im Rahmen der Polysomnographie mit der Messung weiterer physiologischer Parameter kombiniert. Beim EEG, welches zur Schlafstadienanalyse im Schlaflabor verwendet wird, werden – im Vergleich zum kompletten EEG des 10-20-Systems – meist nur einige wenige Ableitungen vollzogen. Standardmäßig, nach Allan Rechtschaffen und Anthony Kales, werden die Kanäle C3 / A2, C4 / A1 abgeleitet. ⓘ
Anwendungen außerhalb der medizinischen Diagnostik
Funktionsphasen
Den oben genannten Grundfrequenzen in den Gehirnströmen können spezifische Funktionsphasen des Gehirns zugeordnet werden. Mit Hilfe von computergestützten Frequenzanalysen wie FFT lassen sich die Übergänge auch in Echtzeit analysieren. ⓘ
Die Spalte 'Priorisierung' verweist auf die in dieser Phase beobachtete Priorität der Gehirnleistung, die sich ggf. durch gezielte Anregung der Hirnaktivität erzielen lassen oder auch spontan z. B. durch Reizüberflutung oder Reizdeprivation (Meditation) entstehen können. Die Ausprägung dieser Ausrichtung befindet sich noch in der wissenschaftlichen Diskussion. ⓘ
| Frequenzband | Frequenz | Zustand | Priorisierung | |
|---|---|---|---|---|
| Delta (δ) | 0,5–<4 Hz | Tiefschlaf, Trance | ||
| Theta (θ) | Niedrig (Theta 1) | 4–6,5 Hz | Hypnagogisches Bewusstsein (Einschlafen), Hypnose, Wachträumen | |
| Hoch (Theta 2) | 6,5–<8 Hz | Tiefe Entspannung, Meditation, Hypnose, Wachträumen | Erhöhte Erinnerungs- und Lernfähigkeit, Konzentration, Kreativität, Erleichterung des Meditationszustands | |
| Alpha (α) | 8–13 Hz | Leichte Entspannung, Super Learning (Unterbewusstes Lernen), nach innen gerichtete Aufmerksamkeit, geschlossene Augen | Erhöhte Erinnerungs- und Lernfähigkeit | |
| Beta (β) | Niedrig (Sensorimotor Rhythm, SMR) | >13–15 Hz | Entspannte nach außen gerichtete Aufmerksamkeit | Gute Aufnahmefähigkeit und Aufmerksamkeit |
| Mittel | 15–21 Hz | Hellwach, normale bis erhöhte nach außen gerichtete Aufmerksamkeit und Konzentration | Gute Intelligenzleistung | |
| Hoch | 21–38 Hz | Hektik, Stress, Angst oder Überaktivierung | Sprunghafte Gedankenführung | |
| Gamma (γ) | 38–70 Hz | Anspruchsvolle Tätigkeiten mit hohem Informationsfluss | Transformation oder neuronale Reorganisation | |
Bestimmung des Intelligenzquotienten
Viele wissenschaftliche Publikationen legen nahe, dass EEG-Messungen zur Einschätzung des Intelligenzquotienten (IQ) genutzt werden können. Insbesondere die Leistungsdichte der Alpha- und Beta-Bänder korreliert mit dem IQ. Inwieweit die Methode zur Bestimmung in Einzelfällen abseits statistischer Größen angewendet werden kann, ist umstritten. ⓘ
Beeinflussung der Gehirnwellen
Gehirnwellen lassen sich nicht nur messen, sondern auch beeinflussen. Das kann durch einen visuellen oder akustischen Reiz geschehen, durch Neurofeedback, durch direkte Manipulation der Gehirnwellen mittels elektrischer Wechselfelder (siehe auch: Transkranielle Magnetstimulation, TMS) oder durch transkranielle Wechselstromstimulation (tACS). Geräte, die das ermöglichen sollen, sind seit den 1980er Jahren unter dem Begriff Mindmachines oder Brainwave Stimulator erhältlich, mit umstrittenem Erfolg. ⓘ
Beim Neurofeedback wird auf die o. g. Einteilung der EEG-Bänder und damit verbundener Funktionsphasen Bezug genommen. Teils wird zudem eine erhöhte Amplitude innerhalb eines Frequenzbereichs mit spezifischen mentalen Zuständen oder Aktivitäten korreliert. ⓘ
Die wissenschaftlich umstrittene Hemisphärensynchronisation ist eine Methode, die Hirnaktivitäten dahingehend zu verändern versucht, dass in beiden Hirnhälften gleichartige Hirnwellen gemessen werden. ⓘ
Steuerung durch Gehirnwellen
Neuere Forschungen unter dem Schlagwort Brain-Computer-Interface (BCI) erzielen Fortschritte beim direkten Steuern von Computern durch kognitive Prozesse. Unter anderem können Probanden des New York State Department of Health, der State University of New York in Albany sowie der TU Graz (Laboratory of Brain-Computer Interfaces) mit Hilfe des EEGs einen Mauscursor nach einiger Übung präzise bewegen. Das ist ein gewaltiger Fortschritt, wenn man bedenkt, dass bisherige Studien mit Tieren und Menschen noch mit implantierten Drähten zur Messung der Hirnströme arbeiteten. Diese wurden als Fremdkörper behandelt und vom Körper abgestoßen, die betreffenden Affen überlebten nur wenige Monate. ⓘ
Seit Ende Mai 2008 bietet die Firma OCZ Technology ein BCI Tool für den Consumer-Markt an, den Neural Impulse Actuator. ⓘ
Inzwischen haben Brain-Computer-Interfaces mittels EEG bereits Einzug in die medizinische Praxis gehalten und dienen schwergelähmten Menschen zur Kommunikation mit der Außenwelt. Zusätzlich können sie mittels Brainpainting auch ihrer Kreativität Ausdruck verleihen. ⓘ
Inwieweit Steuerung via EEG in der Militärtechnologie zum Einsatz kommt, ist der Öffentlichkeit nicht unumschränkt zugänglich. Sicher ist, dass es seit Jahren Versuchsprojekte zur kurzzeitigen „körperlosen“ Steuerung von Kampfjets bei extremen Beschleunigungs-Belastungen gibt. Der Trend hierbei geht jedoch eher zu einer rein maschinellen Steuerung, da unter den hohen g-Belastungen auch die Zuverlässigkeit des menschlichen Bewusstseins leidet. ⓘ
Gedankenübertragung
Forschern gelang es 2014 in einem Experiment, einfache Gedanken via EEG in binäre Signale umzuwandeln. Diese wurden anschließend über das Internet von Indien nach Frankreich übertragen. Mittels transkranieller Magnetstimulation wurde dort das Signal in das Gehirn eines Versuchsteilnehmers übertragen, wodurch dieser Lichtblitze am Rande seines Blickfeldes wahrnehmen und dadurch die empfangene Botschaft (in Form von binären Nullen und Einsen) verstehen konnte. Die Forscher wollten mit dem Experiment herausfinden, ob es möglich ist, eine direkte Kommunikation zwischen zwei Menschen durch Auslesen und Injizieren der Gehirnaktivität zu ermöglichen. ⓘ
Beispiele in Science Fiction, Phantastischer Literatur und Kunst
Im Thriller Firefox von Craig Thomas wird ein experimenteller Düsenjäger durch Gedanken gesteuert. Ein Helm wandelt die Signale des Gehirns in Steuerungsbefehle um. Auch taucht die Idee, Geräte durch Gedankenkraft zu steuern, in vielen Science-Fiction-Büchern auf. ⓘ
Ein durch den Film Matrix aktuelles Beispiel ist auch die Idee, das Gehirn direkt mit einem Computer zu verbinden und so mit einer virtuellen Welt zu interagieren. Ursprünglich stammt diese Idee von William Gibson (Neuromancer). ⓘ
Die Performance-Gruppe A Rose Is verwendet seit 2000 Echtzeit-Transformationen ihrer EEGs in Licht und Klang, die sie über ein akustisches Biofeedback aktiv kontrollieren können. ⓘ
Im Film Futureworld – Das Land von Übermorgen können Träume als Video aufgezeichnet werden, indem die Gehirnströme des Schlafenden in Bildsignale umgewandelt werden. ⓘ
In der Light-Novel-Reihe Sword Art Online wird ein NerveGear genanntes Gerät verwendet, das sowohl die sensorischen und motorischen Areale im Gehirn auslesen und stimulieren kann um eine künstliche Computerspiel-Realität zu schaffen. ⓘ