Netzhaut
| Netzhaut ⓘ | |
|---|---|
 Rechtes menschliches Auge im Querschnitt; die Augen unterscheiden sich von Tier zu Tier erheblich. | |
| Einzelheiten | |
| Aussprache | UK: /ˈrɛtɪnə/, US: /ˈrɛtənə/, pl. retinae /-ni/ |
| Teil des | Auge |
| System | Visuelles System |
| Arterie | Zentrale Netzhautarterie |
| Bezeichner | |
| Lateinisch | Rēte, tunica interna bulbi |
| Anatomische Terminologie [Bearbeiten auf Wikidata] | |
Die Netzhaut (von lateinisch: rete "Netz") ist die innerste, lichtempfindliche Gewebeschicht des Auges der meisten Wirbeltiere und einiger Weichtiere. Die Optik des Auges erzeugt ein fokussiertes zweidimensionales Bild der visuellen Welt auf der Netzhaut, die dann dieses Bild innerhalb der Netzhaut verarbeitet und Nervenimpulse entlang des Sehnervs an die Sehrinde sendet, um die visuelle Wahrnehmung zu erzeugen. Die Netzhaut erfüllt eine Funktion, die in vielerlei Hinsicht mit der des Films oder des Bildsensors in einer Kamera vergleichbar ist. ⓘ
Die neuronale Netzhaut besteht aus mehreren Schichten von Neuronen, die durch Synapsen miteinander verbunden sind, und wird von einer äußeren Schicht pigmentierter Epithelzellen getragen. Die wichtigsten Lichtsinneszellen in der Netzhaut sind die Fotorezeptoren, von denen es zwei Arten gibt: Stäbchen und Zapfen. Die Stäbchen funktionieren hauptsächlich bei schwachem Licht und ermöglichen monochromatisches Sehen. Die Zapfen funktionieren bei hellem Licht und sind für die Farbwahrnehmung durch eine Reihe von Opsinen sowie für das scharfe Sehen verantwortlich, das für Aufgaben wie das Lesen benötigt wird. Ein dritter Typ von Lichtsinneszellen, die lichtempfindlichen Ganglienzellen, sind wichtig für die Steuerung des zirkadianen Rhythmus und für reflexartige Reaktionen wie den Pupillen-Lichtreflex. ⓘ
Das auf die Netzhaut auftreffende Licht löst eine Kaskade chemischer und elektrischer Ereignisse aus, die schließlich Nervenimpulse auslösen, die über die Fasern des Sehnervs an verschiedene Sehzentren des Gehirns weitergeleitet werden. Die neuronalen Signale der Stäbchen und Zapfen werden von anderen Neuronen verarbeitet, deren Output in Form von Aktionspotentialen in den Ganglienzellen der Netzhaut, deren Axone den Sehnerv bilden, entsteht. Mehrere wichtige Merkmale der visuellen Wahrnehmung lassen sich auf die retinale Kodierung und Verarbeitung von Licht zurückführen. ⓘ
In der Embryonalentwicklung der Wirbeltiere entstehen die Netzhaut und der Sehnerv als Auswüchse des sich entwickelnden Gehirns, insbesondere des embryonalen Zwischenhirns; daher wird die Netzhaut als Teil des Zentralnervensystems (ZNS) betrachtet und ist eigentlich Gehirngewebe. Sie ist der einzige Teil des ZNS, der nicht-invasiv sichtbar gemacht werden kann. Ähnlich wie der Rest des Gehirns durch die Blut-Hirn-Schranke vom Gefäßsystem isoliert ist, ist auch die Netzhaut durch die Blut-Retina-Schranke geschützt. ⓘ

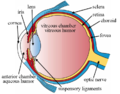
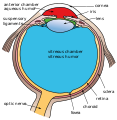
1. Lederhaut (Sclera)
2. Aderhaut (Choroidea)
3. Schlemm-Kanal (Sinus venosus sclerae)
4. Arterieller Gefäßring (Circulus arteriosus iridis major)
5. Hornhaut (Cornea)
6. Regenbogenhaut (Iris)
7. Pupille (Pupilla)
8. vordere Augenkammer (Camera anterior bulbi)
9. hintere Augenkammer (Camera posterior bulbi)
10. Ziliarkörper (Corpus ciliare)
11. Linse (Lens)
12. Glaskörper (Corpus vitreum)
13. Netzhaut (Retina) und Pigmentepithel
14. Sehnerv (Nervus opticus)
15. Zonulafasern (Fibrae zonulares)
Äußere Augenhaut (Tunica externa bulbi): 1. + 5.
Mittlere Augenhaut (Tunica media bulbi): 2. + 6. + 10.
Innere Augenhaut (Tunica interna bulbi): 13. ⓘ
Die Netzhaut oder Retina (von lateinisch rete ‚Netz‘), auch Innere Augenhaut (Tunica interna bulbi) genannt, ist das mehrschichtige spezialisierte Nervengewebe, das die Innenseite der Augenwand bei Wirbeltieren sowie einigen Tintenfischen und Schnecken auskleidet. Im optischen Teil der Netzhaut wird das einfallende Licht – nachdem es die Hornhaut, die Linse und den Glaskörper durchquert hat – in Nervenimpulse umgewandelt. Dem abdunkelnden retinalen Pigmentepithel liegt von innen die Schicht der lichtempfindlichen Sinneszellen (Fotorezeptoren) an. Deren Impulse werden in weiteren, nach innen folgenden Netzhautschichten von Nervenzellen verarbeitet und weitergeleitet. Daneben enthält die Retina verschiedene unterstützende und versorgende Strukturen. ⓘ
Vereinfacht ausgedrückt wird die Netzhaut damit zu einer Art Projektionsfläche für die Abbildung unserer Umgebung, ähnlich einer Leinwand oder einem lichtempfindlichen Film, und leitet die durch Lichtreize hervorgerufenen Erregungen weiter an Hirnregionen. ⓘ
Die Struktur der Netzhaut hatte im 19. Jahrhundert der britische Anatom und Augenarzt William Bowman erkannt. ⓘ
Aufbau
Umgekehrte versus nicht umgekehrte Netzhaut
Die Netzhaut der Wirbeltiere ist insofern umgekehrt, als sich die lichtempfindlichen Zellen im hinteren Teil der Netzhaut befinden, so dass das Licht Schichten von Neuronen und Kapillaren durchlaufen muss, bevor es die lichtempfindlichen Abschnitte der Stäbchen und Zapfen erreicht. Die Ganglienzellen, deren Axone den Sehnerv bilden, befinden sich an der Vorderseite der Netzhaut; daher muss der Sehnerv auf dem Weg zum Gehirn die Netzhaut durchqueren. In dieser Region gibt es keine Photorezeptoren, was den blinden Fleck zur Folge hat. Im Gegensatz dazu befinden sich in der Netzhaut der Kopffüßer die Photorezeptoren im Vordergrund und die verarbeitenden Neuronen und Kapillaren dahinter. Aus diesem Grund haben Kopffüßer keinen blinden Fleck. ⓘ
Obwohl das darüber liegende Nervengewebe teilweise transparent ist und die begleitenden Gliazellen nachweislich als faseroptische Kanäle fungieren, um Photonen direkt zu den Photorezeptoren zu transportieren, kommt es zur Lichtstreuung. Einige Wirbeltiere, darunter der Mensch, verfügen über einen Bereich der zentralen Netzhaut, der für das scharfe Sehen geeignet ist. Dieser Bereich, die so genannte Fovea centralis, ist avaskulär (ohne Blutgefäße) und verfügt über minimales Nervengewebe vor den Photorezeptoren, wodurch die Lichtstreuung minimiert wird. ⓘ
Kopffüßer haben eine nicht invertierte Netzhaut, die in ihrem Auflösungsvermögen mit den Augen vieler Wirbeltiere vergleichbar ist. Die Augen der Tintenfische haben kein analoges retinales Pigmentepithel (RPE) wie die der Wirbeltiere. Obwohl ihre Photorezeptoren ein Protein, das Retinochrom, enthalten, das Retinal recycelt und eine der Funktionen des RPE der Wirbeltiere nachahmt, könnte man argumentieren, dass die Photorezeptoren der Cephalopoden nicht so gut erhalten werden wie die der Wirbeltiere und dass daher die Lebensdauer der Photorezeptoren bei Wirbeltieren viel kürzer ist als bei Wirbeltieren. Leicht ersetzbare Stielaugen (einige Hummer) oder Netzhäute (einige Spinnen wie Deinopis) kommen nur selten vor. ⓘ
Die Netzhaut der Kopffüßer entsteht nicht wie bei den Wirbeltieren als Auswuchs des Gehirns. Es ist anzunehmen, dass dieser Unterschied zeigt, dass die Augen von Wirbeltieren und Kopffüßern nicht homolog sind, sondern sich getrennt entwickelt haben. Aus evolutionärer Sicht kann eine komplexere Struktur wie die umgekehrte Netzhaut im Allgemeinen als Folge von zwei alternativen Prozessen entstehen: (a) als vorteilhafter "guter" Kompromiss zwischen konkurrierenden Funktionseinschränkungen oder (b) als historisches maladaptives Relikt des verschlungenen Pfades der Organentwicklung und -umwandlung. Das Sehvermögen ist eine wichtige Anpassung bei höheren Wirbeltieren. ⓘ
Eine dritte Sichtweise des "umgekehrten" Wirbeltierauges besteht darin, dass es zwei Vorteile vereint: die Erhaltung der oben erwähnten Photorezeptoren und die Verringerung der Lichtintensität, die notwendig ist, um die Photorezeptoren nicht zu blenden, die auf den extrem empfindlichen Augen der Vorfahren der modernen Schleimaale (ein Fisch, der in sehr tiefem, dunklem Wasser lebt) basieren. ⓘ
Netzhautschichten




Die Netzhaut von Wirbeltieren besteht aus zehn verschiedenen Schichten. Von der nächstgelegenen zur am weitesten vom Glaskörper entfernten Schicht:
- Innere Begrenzungsmembran - Basalmembran, die von Müllerzellen gebildet wird.
- Nervenfaserschicht - Axone der Ganglienzellkörper (beachten Sie, dass zwischen dieser Schicht und der inneren Grenzmembran eine dünne Schicht von Müllerzellen-Fußplatten vorhanden ist).
- Ganglienzellschicht - enthält die Kerne der Ganglienzellen, deren Axone zu den Sehnervenfasern werden, sowie einige verlagerte amakrine Zellen.
- Innere plexiforme Schicht - enthält die Synapse zwischen den Axonen der bipolaren Zellen und den Dendriten der Ganglienzellen und der amakrinen Zellen.
- Innere Kernschicht - enthält die Kerne und umgebenden Zellkörper (Perikarya) der amakrinen Zellen, bipolaren Zellen und horizontalen Zellen.
- Äußere plexiforme Schicht - Fortsätze von Stäbchen und Zapfen, die in der Stäbchenkugel bzw. dem Zapfenstiel enden. Diese bilden Synapsen mit den Dendriten der bipolaren Zellen und der horizontalen Zellen. In der Makularegion wird dies als Faserschicht von Henle bezeichnet.
- Äußere Kernschicht - Zellkörper der Stäbchen und Zapfen.
- Äußere Begrenzungsmembran - Schicht, die die inneren Segmentteile der Photorezeptoren von ihren Zellkernen trennt.
- Innere Segment-/Außensegmentschicht - innere Segmente und äußere Segmente der Stäbchen und Zapfen. Die äußeren Segmente enthalten einen hochspezialisierten Lichtempfindungsapparat.
- Retinales Pigmentepithel - einzelne Schicht aus quaderförmigen Epithelzellen (mit Ausstülpungen, die in der Abbildung nicht dargestellt sind). Diese Schicht liegt der Aderhaut am nächsten und versorgt die neurale Netzhaut mit Nährstoffen und hat unterstützende Funktionen. Das schwarze Pigment Melanin in der Pigmentschicht verhindert Lichtreflexionen im gesamten Augapfel; dies ist äußerst wichtig für klares Sehen. ⓘ
Diese Schichten lassen sich in vier Hauptverarbeitungsstufen einteilen: Photorezeption, Weiterleitung an die Bipolarzellen, Weiterleitung an die Ganglienzellen, die ebenfalls Photorezeptoren enthalten, die lichtempfindlichen Ganglienzellen, und Weiterleitung entlang des Sehnervs. Auf jeder synaptischen Stufe gibt es auch seitlich anschließende horizontale und amakrine Zellen. ⓘ
Der Sehnerv ist ein zentraler Trakt mit vielen Axonen von Ganglienzellen, die in erster Linie mit dem lateralen Genicularkörper verbunden sind, einer visuellen Relaisstation im Zwischenhirn (im hinteren Teil des Vorderhirns). Er projiziert auch zum Colliculus superior, zum Nucleus suprachiasmaticus und zum Nucleus der Sehbahn. Sie durchquert die anderen Schichten und bildet bei Primaten den Sehnervenkopf. ⓘ
Weitere Strukturen, die nicht direkt mit dem Sehen in Verbindung stehen, finden sich als Auswüchse der Netzhaut bei einigen Wirbeltiergruppen. Bei Vögeln ist das Pektin eine komplex geformte Gefäßstruktur, die von der Netzhaut in den Glaskörper hineinragt; es versorgt das Auge mit Sauerstoff und Nährstoffen und kann auch beim Sehen helfen. Reptilien haben eine ähnliche, aber viel einfachere Struktur. ⓘ
Beim erwachsenen Menschen besteht die gesamte Netzhaut zu etwa 72 % aus einer Kugel mit einem Durchmesser von etwa 22 mm. Die gesamte Netzhaut enthält etwa 7 Millionen Zapfen und 75 bis 150 Millionen Stäbchen. Der Sehnervenkopf, ein Teil der Netzhaut, der manchmal als "blinder Fleck" bezeichnet wird, weil er keine Fotorezeptoren enthält, befindet sich an der Papille des Sehnervs, wo die Sehnervenfasern das Auge verlassen. Er erscheint als ovaler weißer Bereich von 3 mm². Temporal (in Richtung der Schläfen) zu dieser Scheibe befindet sich die Makula, in deren Zentrum sich die Fovea befindet, eine Vertiefung, die für unser scharfes zentrales Sehen verantwortlich ist, aber aufgrund des Fehlens von Stäbchen weniger lichtempfindlich ist. Menschliche und nicht-menschliche Primaten besitzen eine Fovea, im Gegensatz zu bestimmten Vogelarten, wie z. B. Falken, die bifoviat sind, und Hunden und Katzen, die keine Fovea, sondern ein zentrales Band, den so genannten Sehstreifen, besitzen. Um die Fovea herum erstreckt sich die zentrale Netzhaut für etwa 6 mm und dann die periphere Netzhaut. Der äußerste Rand der Netzhaut wird durch die Ora serrata definiert. Der Abstand von einer Ora zur anderen (oder Makula), dem empfindlichsten Bereich entlang des horizontalen Meridians, beträgt etwa 32 mm. ⓘ
Im Schnitt ist die Netzhaut nicht mehr als 0,5 mm dick. Sie hat drei Schichten von Nervenzellen und zwei von Synapsen, darunter die einzigartige Bandsynapse. Der Sehnerv führt die Axone der Ganglienzellen zum Gehirn und zu den Blutgefäßen, die die Netzhaut versorgen. Die Ganglienzellen liegen im Inneren des Auges, während die photorezeptiven Zellen außerhalb liegen. Aufgrund dieser kontraintuitiven Anordnung muss das Licht zunächst durch und um die Ganglienzellen herum und durch die Dicke der Netzhaut (einschließlich ihrer Kapillargefäße, nicht abgebildet) gelangen, bevor es die Stäbchen und Zapfen erreicht. Das Licht wird vom Pigmentepithel der Netzhaut oder der Aderhaut (die beide undurchsichtig sind) absorbiert. ⓘ
Die weißen Blutkörperchen in den Kapillaren vor den Photorezeptoren können als winzige helle, sich bewegende Punkte wahrgenommen werden, wenn man in blaues Licht schaut. Dies ist als entoptisches Phänomen des blauen Feldes (oder Scheerer-Phänomen) bekannt. ⓘ
Zwischen der Ganglienzellenschicht und den Stäbchen und Zapfen befinden sich zwei Schichten von Neuropillen, in denen die synaptischen Kontakte hergestellt werden. Die Neuropil-Schichten sind die äußere plexiforme Schicht und die innere plexiforme Schicht. In der äußeren Neuropilschicht verbinden sich die Stäbchen und Zapfen mit den vertikal verlaufenden Bipolarzellen und die horizontal ausgerichteten Horizontalzellen mit den Ganglienzellen. ⓘ
Die zentrale Netzhaut enthält überwiegend Zapfen, während die periphere Netzhaut überwiegend Stäbchen enthält. Insgesamt gibt es etwa sieben Millionen Zapfen und hundert Millionen Stäbchen. Im Zentrum der Makula befindet sich die foveale Grube, in der die Zapfen schmal und lang sind und in einem sechseckigen Mosaik angeordnet die größte Dichte aufweisen, im Gegensatz zu den viel dickeren Zapfen, die sich weiter in der Netzhautperipherie befinden. In der Fovea-Grube werden die anderen Netzhautschichten verdrängt, bevor sie sich entlang des Fovea-Abhangs aufbauen, bis der Rand der Fovea, die Parafovea, erreicht ist, die den dicksten Teil der Netzhaut darstellt. Die Makula hat eine gelbe Pigmentierung, die von Abschirmungspigmenten herrührt, und wird als Makula lutea bezeichnet. In der unmittelbaren Umgebung der Fovea ist die Dichte der Stäbchen am höchsten, die auf einzelnen Bipolarzellen zusammenlaufen. Da die Zapfen eine viel geringere Konvergenz der Signale aufweisen, ermöglicht die Fovea das schärfste Sehen, das das Auge erreichen kann. ⓘ
Obwohl die Stäbchen und Zapfen eine Art Mosaik bilden, erfolgt die Übertragung von den Rezeptoren zu den Bipolarzellen und den Ganglienzellen nicht direkt. Da es etwa 150 Millionen Rezeptoren und nur 1 Million Sehnervenfasern gibt, muss es eine Konvergenz und damit eine Vermischung der Signale geben. Außerdem kann die horizontale Wirkung der horizontalen und amakrinen Zellen dazu führen, dass ein Bereich der Netzhaut einen anderen kontrolliert (z. B. ein Reiz hemmt einen anderen). Diese Hemmung ist der Schlüssel zur Verringerung der Summe der an die höheren Regionen des Gehirns gesendeten Nachrichten. Bei einigen niederen Wirbeltieren (z. B. der Taube) gibt es eine "zentrifugale" Kontrolle der Botschaften, d. h. eine Schicht kann eine andere kontrollieren, oder höhere Hirnregionen können die Nervenzellen der Netzhaut steuern, aber bei Primaten kommt dies nicht vor. ⓘ
Mit optischer Kohärenztomographie darstellbare Schichten
Mit der optischen Kohärenztomografie (OCT) lassen sich 18 Schichten in der Netzhaut erkennen. Die Schichten und ihre anatomische Zuordnung sind wie folgt:

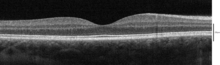

Von der innersten zur äußersten Schicht sind die mit OCT erkennbaren Schichten wie folgt:
| # | OCT-Schicht / Konventionelle Bezeichnung | Anatomisches Korrelat | Reflexionsvermögen
auf OCT |
Spezifisch
anatomische Grenzen? |
Zusätzliche
Referenzen ⓘ |
|---|---|---|---|---|---|
| 1 | Hinterer kortikaler Glaskörper | Hinterer kortikaler Glaskörper | Hyper-reflektierend | Ja | |
| 2 | Präretinaler Raum | Bei Augen, bei denen sich der Glaskörper ganz oder teilweise von der Netzhaut abgelöst hat, ist dies der Raum, der zwischen der hinteren kortikalen Glaskörperfläche und der inneren Begrenzungsmembran der Netzhaut entsteht. | Hypo-reflektierend | ||
| 3 | Innere Begrenzungsmembran (ILM) | Gebildet durch Müllerzell-Endfüße
(unklar, ob sie im OCT beobachtet werden kann) |
Hyper-reflektierend | Keine | |
| Nervenfaserschicht (NFL) | Axone der Ganglienzellen, die zum Sehnerv wandern | ||||
| 4 | Ganglienzellschicht (GCL) | Ganglienzellkörper (und einige verlagerte amakrine Zellen) | Hypo-reflektierend | ||
| 5 | Innere plexiforme Schicht (IPL) | Synapsen zwischen bipolaren, amakrinen und Ganglienzellen | Hyper-reflektierend | ||
| 6 | Innere Kernschicht (INL) | a) Horizontale, bipolare und amakrine Zellkörper
b) Kerne der Müllerzellen |
Hypo-reflektierend | ||
| 7 | Äußere plexiforme Schicht (OPL) | Synapsen zwischen Photorezeptoren, bipolaren und horizontalen Zellen | Hyper-reflektierend | ||
| 8 | (Innere Hälfte) Henle'sche Nervenfaserschicht (HL) | Axone der Photorezeptoren
(schräg orientierte Fasern; nicht in der mittleren oder peripheren Netzhaut vorhanden) |
Hypo-reflektierend | Keine | |
| (Äußere Hälfte) Äußere Kernschicht (ONL) | Die Zellkörper der Photorezeptoren | ||||
| 9 | Äußere Begrenzungsmembran (ELM) | Besteht aus Zonulae adherens zwischen Müllerzellen und Photorezeptor-Innensegmenten | Hyper-reflektierend | ||
| 10 | Myoide Zone (MZ) | Der innerste Teil des inneren Photorezeptorensegments (IS), der Folgendes enthält:
|
Hypo-reflektierend | Keine | |
| 11 | Ellipsoide Zone (EZ) | Der äußerste Teil des inneren Photorezeptorensegments (IS), der mit Mitochondrien gefüllt ist | Sehr hyper-reflektierend | Keine | |
| IS/OS-Übergang oder Photorezeptor-Integritätslinie (PIL) | Die Photorezeptor-Verbindungswimpern, die die inneren und äußeren Segmente der Photorezeptorzellen überbrücken. | ||||
| 12 | Photorezeptor-Außensegmente (OS) | Die äußeren Photorezeptorsegmente (OS) enthalten Scheiben, die mit Opsin, dem Molekül, das Photonen absorbiert, gefüllt sind. | Hypo-reflektierend | ||
| 13 | Interdigitale Zone (IZ) | Apizes der RPE-Zellen, die einen Teil der Zapfen-OS umschließen.
Schlecht vom RPE zu unterscheiden. Frühere Bezeichnung: "cone outer segment tips line" (COST) |
Hyper-reflektierend | Keine | |
| 14 | RPE/Bruch'scher Komplex | RPE-Phagosomen-Zone | Sehr hyper-reflektierend | Keine | |
| RPE-Melanosomenzone | Hypo-reflektierend | ||||
| RPE-Mitochondrien-Zone + Übergang zwischen RPE und Bruch'scher Membran | Sehr hyper-reflektierend | ||||
| 15 | Choriocapillaris | Dünne Schicht mit mäßigem Reflexionsvermögen in der inneren Aderhaut | Keine | ||
| 16 | Sattlersche Schicht | Dicke Schicht mit runden oder ovalen hyperreflektierenden Profilen, mit hyporeflektierenden Kernen in der mittleren Aderhaut | |||
| 17 | Haller'sche Schicht | Dicke Schicht aus ovalen hyperreflektierenden Profilen, mit hyporeflektierenden Kernen in der äußeren Aderhaut | |||
| 18 | Übergang zwischen Choroidea und Sklera | Zone in der äußeren Aderhaut mit einer ausgeprägten Veränderung der Textur, in der große kreisförmige oder eiförmige Profile an einen
homogenen Bereich mit variablem Reflexionsvermögen |
|||
Entwicklung
Die Entwicklung der Netzhaut beginnt mit der Bildung der Augenfelder, die durch die Proteine SHH und SIX3 vermittelt wird. Die anschließende Entwicklung der Sehnervenbläschen wird durch die Proteine PAX6 und LHX2 gesteuert. Die Rolle von Pax6 bei der Augenentwicklung wurde von Walter Gehring und Kollegen auf elegante Weise nachgewiesen. Sie zeigten, dass die ektopische Expression von Pax6 zur Bildung von Augen an den Antennen, Flügeln und Beinen von Drosophila führen kann. Aus der Sehnervenblase gehen drei Strukturen hervor: die neurale Retina, das retinale Pigmentepithel und der Sehnervenstiel. Die neurale Retina enthält die retinalen Vorläuferzellen (RPCs), aus denen sich die sieben Zelltypen der Retina entwickeln. Die Differenzierung beginnt mit den retinalen Ganglienzellen und endet mit der Bildung der Müllerschen Glia. Obwohl sich jeder Zelltyp in einer bestimmten Reihenfolge aus den RPCs differenziert, gibt es erhebliche Überschneidungen bei den Zeitpunkten, zu denen sich die einzelnen Zelltypen differenzieren. Die Hinweise, die das Schicksal der RPC-Tochterzellen bestimmen, werden von mehreren Transkriptionsfaktor-Familien kodiert, darunter die bHLH- und Homeodomain-Faktoren. ⓘ
Zusätzlich zur Bestimmung des Zellschicksals gibt es in der Retina Anhaltspunkte für die Festlegung der dorsal-ventralen (D-V) und nasal-temporalen (N-T) Achse. Die D-V-Achse wird durch einen Gradienten von VAX2 von ventral nach dorsal festgelegt, während die N-T-Achse durch die Expression der Forkhead-Transkriptionsfaktoren FOXD1 und FOXG1 koordiniert wird. Weitere Gradienten werden innerhalb der Retina gebildet. Diese räumliche Verteilung kann zur richtigen Ausrichtung der RGC-Axone beitragen, die für die Erstellung der retinotopischen Karte verantwortlich sind. ⓘ
Blutversorgung
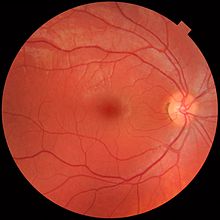
Die Netzhaut ist in verschiedene Schichten unterteilt, die jeweils spezifische Zelltypen oder Zellkompartimente enthalten, die einen Stoffwechsel mit unterschiedlichen Nährstoffanforderungen haben. Um diese Anforderungen zu erfüllen, verzweigt sich die Augenarterie und versorgt die Netzhaut über zwei verschiedene Gefäßnetze: das Aderhautnetz, das die Aderhaut und die äußere Netzhaut versorgt, und das Netzhautnetz, das die innere Schicht der Netzhaut versorgt. ⓘ
Mechanismen der Durchblutung
Auf den ersten Blick könnte man meinen, dass die Netzhaut der Wirbeltiere "falsch verdrahtet" oder "schlecht konstruiert" ist; tatsächlich aber könnte die Netzhaut nicht funktionieren, wenn sie nicht umgekehrt wäre. Die Photorezeptorschicht muss in das retinale Pigmentepithel (RPE) eingebettet sein, das mindestens sieben lebenswichtige Funktionen erfüllt, von denen eine der offensichtlichsten die Versorgung mit Sauerstoff und anderen für die Funktion der Photorezeptoren notwendigen Nährstoffen ist. Zu diesen Nährstoffen gehören Glukose, Fettsäuren und Netzhaut. Der Verstärkungsprozess der Photorezeptoren von Säugetieren verbraucht unter photopischen Bedingungen große Mengen an Energie für das Sehen (unter skotopischen Bedingungen ist der Energiebedarf geringer) und benötigt daher eine große Menge an Nährstoffen, die von den Blutgefäßen in der Aderhaut, die hinter dem RPE liegt, geliefert werden. Die Aderhaut liefert etwa 75 % dieser Nährstoffe an die Netzhaut, das Netzhautgefäßsystem nur 25 %. ⓘ
Wenn Licht auf 11-cis-Retinal (in den Scheiben der Stäbchen und Zapfen) trifft, verwandelt sich 11-cis-Retinal in all-trans-Retinal, was wiederum Veränderungen in den Opsinen auslöst. Nun regenerieren die äußeren Segmente das Retinal nicht wieder in die cis-Form, nachdem es durch Licht verändert wurde. Stattdessen wird das Retinal in das umgebende RPE gepumpt, wo es regeneriert und zurück in die äußeren Segmente der Photorezeptoren transportiert wird. Diese Recyclingfunktion des RPE schützt die Photorezeptoren vor photooxidativen Schäden und ermöglicht den Photorezeptorzellen eine jahrzehntelange Lebensdauer. ⓘ
Bei Vögeln
Die Netzhaut von Vögeln ist frei von Blutgefäßen, vielleicht um einen ungehinderten Durchgang des Lichts für die Bilderzeugung und damit eine bessere Auflösung zu ermöglichen. Man geht daher davon aus, dass die Netzhaut der Vögel für ihre Ernährung und Sauerstoffversorgung von einem spezialisierten Organ abhängt, das "pecten" oder "pecten oculi" genannt wird und sich auf dem blinden Fleck oder der Sehscheibe befindet. Dieses Organ ist extrem reich an Blutgefäßen und versorgt die Vogelnetzhaut vermutlich durch Diffusion durch den Glaskörper mit Nährstoffen und Sauerstoff. Das Pecten ist sehr reich an alkalischer Phosphatase und polarisierten Zellen in seinem Brückenteil - beides passt zu seiner sekretorischen Funktion. Die Pektenzellen sind voll mit dunklen Melaninkörnchen, von denen man annimmt, dass sie dieses Organ durch die Absorption von Streulicht, das auf den Pekten fällt, warm halten. Es wird davon ausgegangen, dass dies die Stoffwechselrate des Pektins erhöht, wodurch mehr Nährstoffmoleküle exportiert werden, um den strengen Energiebedarf der Netzhaut während langer Lichteinwirkung zu decken. ⓘ
Biometrische Identifizierung und Diagnose von Krankheiten
Es ist bekannt, dass die Bifurkationen und andere physische Merkmale des inneren Netzhautgefäßnetzes von Person zu Person variieren, und diese individuellen Abweichungen wurden für die biometrische Identifizierung und die frühzeitige Erkennung des Ausbruchs von Krankheiten genutzt. Die Kartierung von Gefäßverzweigungen ist einer der grundlegenden Schritte bei der biometrischen Identifizierung. Die Ergebnisse solcher Analysen der retinalen Blutgefäßstruktur können anhand der aus dem DRIVE-Datensatz gewonnenen Grunddaten der Gefäßverzweigungen von Netzhautfundusbildern bewertet werden. Darüber hinaus wurden auch die Gefäßklassen des DRIVE-Datensatzes identifiziert, und eine automatische Methode zur genauen Extraktion dieser Verzweigungen ist ebenfalls verfügbar. Veränderungen in der Durchblutung der Netzhaut werden mit dem Alter und der Luftverschmutzung beobachtet und können auf kardiovaskuläre Erkrankungen wie Bluthochdruck und Atherosklerose hinweisen. Die Bestimmung der äquivalenten Breite von Arteriolen und Venolen in der Nähe des Sehnervenkopfes ist ebenfalls eine weit verbreitete Technik zur Erkennung kardiovaskulärer Risiken. ⓘ
Funktion
Die Netzhaut setzt ein optisches Bild in Nervenimpulse um, die mit der gemusterten Erregung der farbempfindlichen Pigmente ihrer Stäbchen und Zapfen, den Photorezeptorzellen der Netzhaut, beginnen. Die Erregung wird vom neuronalen System und verschiedenen Teilen des Gehirns verarbeitet, die parallel arbeiten, um eine Darstellung der äußeren Umgebung im Gehirn zu bilden. ⓘ
Die Zapfen reagieren auf helles Licht und vermitteln bei Tageslicht ein hochauflösendes Farbsehen (auch photopisches Sehen genannt). Die Reaktionen der Stäbchen sind bei Tageslicht gesättigt und tragen nicht zum Mustersehen bei. Die Stäbchen reagieren jedoch auf gedämpftes Licht und vermitteln das monochromatische Sehen mit geringerer Auflösung bei sehr geringer Beleuchtung (skotopisches Sehen). Die Beleuchtungsstärke in den meisten Büroumgebungen liegt zwischen diesen beiden Werten und wird als mesopisches Sehen bezeichnet. Bei mesopischen Lichtverhältnissen tragen sowohl die Stäbchen als auch die Zapfen aktiv zur Musterinformation bei. Welchen Beitrag die Stäbcheninformationen unter diesen Umständen zum Mustersehen leisten, ist unklar. ⓘ
Die Reaktion der Zapfen auf verschiedene Wellenlängen des Lichts wird als spektrale Empfindlichkeit bezeichnet. Beim normalen menschlichen Sehen fällt die spektrale Empfindlichkeit eines Zapfens in einen der drei Subtypen, die oft als blau, grün und rot bezeichnet werden, aber genauer als kurz-, mittel- und langwellensensitive Zapfen-Subtypen bekannt sind. Das Fehlen eines oder mehrerer dieser Subtypen führt bei manchen Menschen zu Farbfehlsichtigkeit oder verschiedenen Arten von Farbenblindheit. Diese Personen sind nicht blind für Objekte einer bestimmten Farbe, können aber nicht zwischen Farben unterscheiden, die von Menschen mit normalem Sehvermögen unterschieden werden können. Der Mensch hat dieses trichromatische Sehen, während den meisten anderen Säugetieren Zapfen mit rotempfindlichen Pigmenten fehlen und sie daher ein schlechteres dichromatisches Farbensehen haben. Einige Tiere haben jedoch vier spektrale Untertypen, z. B. die Forelle, die zu den kurzen, mittleren und langen Untertypen noch eine ultraviolette Untergruppe hinzufügt, die der des Menschen ähnlich ist. Einige Fische sind auch für die Polarisation des Lichts empfindlich. ⓘ
In den Photorezeptoren wird die Membran durch Lichteinwirkung in einer Reihe von abgestuften Verschiebungen hyperpolarisiert. Das äußere Zellsegment enthält ein Photopigment. Im Inneren der Zelle halten die normalen Mengen an zyklischem Guanosinmonophosphat (cGMP) den Na+-Kanal offen, so dass die Zelle im Ruhezustand depolarisiert ist. Das Photon veranlasst das an das Rezeptorprotein gebundene Retinal, sich in trans-Retinal zu isomerisieren. Dadurch wird der Rezeptor zur Aktivierung mehrerer G-Proteine veranlasst. Dies wiederum führt dazu, dass die Ga-Untereinheit des Proteins eine Phosphodiesterase (PDE6) aktiviert, die cGMP abbaut, was zum Schließen der Na+-zyklischen Nukleotid-gesteuerten Ionenkanäle (CNGs) führt. Dadurch wird die Zelle hyperpolarisiert. Die Menge des freigesetzten Neurotransmitters ist bei hellem Licht reduziert und steigt bei abnehmendem Licht an. Das eigentliche Photopigment wird bei hellem Licht ausgebleicht und nur durch einen chemischen Prozess ersetzt, so dass das Auge beim Übergang von hellem Licht zu Dunkelheit bis zu dreißig Minuten brauchen kann, um seine volle Empfindlichkeit zu erreichen. ⓘ
Wenn der Photorezeptor also durch Licht angeregt wird, sendet er eine proportionale Antwort synaptisch an die Bipolarzellen, die wiederum den Ganglienzellen der Netzhaut ein Signal geben. Die Photorezeptoren sind auch durch horizontale Zellen und amakrine Zellen vernetzt, die das synaptische Signal modifizieren, bevor es die Ganglienzellen erreicht, wobei die neuronalen Signale miteinander vermischt und kombiniert werden. Von den Nervenzellen der Netzhaut erzeugen nur die retinalen Ganglienzellen und einige wenige amakrine Zellen Aktionspotentiale. ⓘ
Bei den retinalen Ganglienzellen gibt es zwei Arten von Reaktionen, je nach dem rezeptiven Feld der Zelle. Die rezeptiven Felder der retinalen Ganglienzellen bestehen aus einem zentralen, annähernd kreisförmigen Bereich, in dem das Licht eine Wirkung auf das Feuern der Zelle hat, und einem ringförmigen Bereich, in dem das Licht die entgegengesetzte Wirkung hat. Bei eingeschalteten Zellen führt eine Erhöhung der Lichtintensität im Zentrum des rezeptiven Feldes zu einem Anstieg der Feuerrate. In ausgeschalteten Zellen nimmt sie ab. In einem linearen Modell wird dieses Reaktionsprofil gut durch eine Gauß-Differenz beschrieben und ist die Grundlage für Algorithmen zur Kantenerkennung. Neben diesem einfachen Unterschied werden Ganglienzellen auch nach ihrer chromatischen Empfindlichkeit und der Art der räumlichen Summierung unterschieden. Zellen, die eine lineare räumliche Summierung aufweisen, werden als X-Zellen (auch parvozelluläre, P- oder Zwergganglienzellen genannt) bezeichnet, und solche, die eine nichtlineare Summierung aufweisen, sind Y-Zellen (auch magnozelluläre, M- oder parasolare retinale Ganglienzellen genannt), obwohl die Entsprechung zwischen X- und Y-Zellen (in der Katzennetzhaut) und P- und M-Zellen (in der Primatennetzhaut) nicht so einfach ist, wie es einst schien. ⓘ
Bei der Übertragung der visuellen Signale an das Gehirn, der Sehbahn, ist die Netzhaut vertikal in zwei Hälften geteilt, eine temporale (näher an der Schläfe) und eine nasale (näher an der Nase). Die Axone der nasalen Hälfte durchqueren das Gehirn am Chiasma opticum, um sich mit den Axonen der temporalen Hälfte des anderen Auges zu vereinen, bevor sie in den lateralen Genicularkörper übergehen. ⓘ
Obwohl es mehr als 130 Millionen Netzhautrezeptoren gibt, verfügt der Sehnerv nur über etwa 1,2 Millionen Fasern (Axone). Daher wird ein großer Teil der Vorverarbeitung in der Netzhaut durchgeführt. Die Fovea liefert die genauesten Informationen. Obwohl sie nur etwa 0,01 % des Gesichtsfeldes einnimmt (weniger als 2° Sehwinkel), sind etwa 10 % der Axone des Sehnervs auf die Fovea ausgerichtet. Die Auflösungsgrenze der Fovea wurde auf etwa 10.000 Punkte festgelegt. Die Informationskapazität wird auf 500.000 Bits pro Sekunde geschätzt (weitere Informationen über Bits finden Sie in der Informationstheorie), ohne Farbe und mit Farbe auf etwa 600.000 Bits pro Sekunde. ⓘ
Räumliche Kodierung

Wenn die Netzhaut Nervenimpulse, die ein Bild repräsentieren, an das Gehirn sendet, werden diese Impulse räumlich kodiert (komprimiert), um sie an die begrenzte Kapazität des Sehnervs anzupassen. Die Komprimierung ist notwendig, weil es 100 Mal mehr Photorezeptorzellen als Ganglienzellen gibt. Dies geschieht durch "Dekorrelation", die von den "Zentrum-Umgebung-Strukturen" durchgeführt wird, die von den Bipolar- und Ganglienzellen implementiert werden. ⓘ
Es gibt zwei Arten von Zentrum-Umfeld-Strukturen in der Netzhaut - On-Centers und Off-Centers. On-centres haben ein positiv gewichtetes Zentrum und eine negativ gewichtete Umgebung. Bei Off-Centres ist es genau umgekehrt. Die positive Gewichtung wird allgemein als erregend und die negative Gewichtung als hemmend bezeichnet. ⓘ
Diese Zentrum-Umgebung-Strukturen sind nicht physisch sichtbar, d. h., man kann sie nicht sehen, wenn man Gewebeproben anfärbt und die Anatomie der Netzhaut untersucht. Die Zentrum-Umgebung-Strukturen sind insofern logisch (d. h. mathematisch abstrakt), als sie von den Verbindungsstärken zwischen Bipolar- und Ganglienzellen abhängen. Man geht davon aus, dass die Verbindungsstärke zwischen den Zellen durch die Anzahl und die Art der Ionenkanäle in den Synapsen zwischen den Bipolar- und Ganglienzellen bedingt ist. ⓘ
Die Zentrum-Umgebung-Strukturen sind mathematisch äquivalent zu den Algorithmen zur Kantenerkennung, die von Computerprogrammierern verwendet werden, um die Kanten in einem digitalen Foto zu extrahieren oder zu verbessern. So führt die Netzhaut Operationen an den bilddarstellenden Impulsen durch, um die Kanten von Objekten in ihrem Gesichtsfeld zu verbessern. Bei einem Bild mit einem Hund, einer Katze und einem Auto sind es zum Beispiel die Kanten dieser Objekte, die die meisten Informationen enthalten. Damit höhere Funktionen im Gehirn (oder auch in einem Computer) Objekte wie einen Hund und eine Katze extrahieren und klassifizieren können, ist die Netzhaut der erste Schritt zur Unterscheidung der verschiedenen Objekte innerhalb der Szene. ⓘ
Die folgende Matrix ist zum Beispiel das Herzstück eines Computeralgorithmus, der die Kantenerkennung durchführt. Diese Matrix ist das Computer-Äquivalent zur Zentrum-Rand-Struktur. In diesem Beispiel wäre jedes Kästchen (Element) innerhalb dieser Matrix mit einem Photorezeptor verbunden. Der Fotorezeptor in der Mitte ist der aktuelle Rezeptor, der verarbeitet wird. Der mittlere Photorezeptor wird mit dem Gewichtungsfaktor +1 multipliziert. Die umliegenden Fotorezeptoren sind die "nächsten Nachbarn" des Zentrums und werden mit dem Wert -1/8 multipliziert. Schließlich wird die Summe aller neun dieser Elemente berechnet. Diese Summierung wird für jeden Photorezeptor im Bild wiederholt, indem nach links zum Ende einer Zeile und dann nach unten zur nächsten Zeile gesprungen wird. ⓘ
| -1/8 | -1/8 | -1/8 ⓘ |
| -1/8 | +1 | -1/8 |
| -1/8 | -1/8 | -1/8 |
Die Gesamtsumme dieser Matrix ist Null, wenn alle Eingaben der neun Photorezeptoren den gleichen Wert haben. Ein Ergebnis von Null bedeutet, dass das Bild in diesem kleinen Bereich einheitlich war (sich nicht veränderte). Negative oder positive Summen bedeuten, dass sich das Bild innerhalb dieses kleinen Bereichs von neun Photorezeptoren verändert hat. ⓘ
Die obige Matrix ist nur eine Annäherung an das, was wirklich im Inneren der Netzhaut geschieht. Die Unterschiede sind:
- Das obige Beispiel wird als "ausgeglichen" bezeichnet. Der Begriff "ausgeglichen" bedeutet, dass die Summe der negativen Gewichte gleich der Summe der positiven Gewichte ist, so dass sie sich perfekt aufheben. Retinale Ganglienzellen sind fast nie perfekt ausgeglichen.
- Der Tisch ist quadratisch, während die Strukturen in der Mitte der Netzhaut kreisförmig sind.
- Neuronen arbeiten mit Spike Trains, die sich entlang der Nervenzellachsen bewegen. Computer arbeiten mit einer einzigen Gleitkommazahl, die bei jedem Eingabepixel im Wesentlichen konstant ist. (Das Computerpixel ist im Grunde das Äquivalent zu einem biologischen Photorezeptor).
- Die Netzhaut führt all diese Berechnungen parallel durch, während der Computer jedes Pixel einzeln bearbeitet. Die Retina führt keine wiederholten Summierungen und Verschiebungen durch, wie es ein Computer tun würde.
- Schließlich spielen auch die horizontalen und amakrinen Zellen eine wichtige Rolle in diesem Prozess, die hier jedoch nicht dargestellt wird. ⓘ
Hier ist ein Beispiel für ein Eingangsbild und wie die Kantenerkennung es verändern würde. ⓘ
Sobald das Bild von den Zentrum-Rand-Strukturen räumlich kodiert wurde, wird das Signal entlang des Sehnervs (über die Axone der Ganglienzellen) durch das Chiasma opticum zum LGN (Nucleus geniculatus lateralis) weitergeleitet. Die genaue Funktion des LGN ist derzeit noch unbekannt. Der Ausgang des LGN wird dann in den hinteren Teil des Gehirns geleitet. Genauer gesagt "strahlt" der Ausgang des LGN auf den primären visuellen Kortex V1 aus. ⓘ
Vereinfachter Signalfluss: Photorezeptoren → Bipolar → Ganglion → Chiasma → LGN → V1-Kortex ⓘ
Klinische Bedeutung
Es gibt viele ererbte und erworbene Krankheiten oder Störungen, die die Netzhaut beeinträchtigen können. Einige von ihnen sind:
- Retinitis pigmentosa ist eine Gruppe genetisch bedingter Krankheiten, die die Netzhaut betreffen und den Verlust des Nachtsehens und des peripheren Sehens verursachen.
- Makuladegeneration beschreibt eine Gruppe von Krankheiten, die durch den Verlust des zentralen Sehens aufgrund des Absterbens oder der Beeinträchtigung der Zellen in der Makula gekennzeichnet sind.
- Die Zapfen-Stäbchen-Dystrophie (CORD) beschreibt eine Reihe von Krankheiten, bei denen der Sehverlust durch eine Verschlechterung der Zapfen und/oder Stäbchen in der Netzhaut verursacht wird.
- Bei der Netzhautablösung löst sich die Netzhaut vom hinteren Teil des Augapfels ab. Die Ignipunktur ist eine überholte Behandlungsmethode. Der Begriff Netzhautablösung bezeichnet eine Ablösung der neurosensorischen Netzhaut vom retinalen Pigmentepithel. Es gibt mehrere moderne Behandlungsmethoden, um eine Netzhautablösung zu beheben: pneumatische Retinopexie, Skleralschnalle, Kryotherapie, Laser-Photokoagulation und Pars-Plana-Vitrektomie.
- Sowohl Bluthochdruck als auch Diabetes mellitus können die winzigen Blutgefäße, die die Netzhaut versorgen, schädigen, was zu hypertensiver Retinopathie und diabetischer Retinopathie führt.
- Das Retinoblastom ist ein Krebsgeschwür in der Netzhaut.
- Zu den Netzhauterkrankungen bei Hunden gehören Netzhautdysplasie, progressive Netzhautatrophie und plötzliche Netzhautdegeneration.
- Lipämie retinalis ist eine weiße Erscheinung der Netzhaut, die durch Lipidablagerungen bei Lipoproteinlipasemangel entstehen kann.
- Netzhautablösung. Gelegentlich löst sich die neurale Netzhaut vom Pigmentepithel ab. In einigen Fällen ist die Ursache für eine solche Ablösung eine Verletzung des Augapfels, durch die sich Flüssigkeit oder Blut zwischen der neuralen Netzhaut und dem Pigmentepithel ansammeln kann. Gelegentlich wird die Ablösung auch durch die Kontraktion feiner kollagener Fibrillen im Glaskörper verursacht, die Teile der Netzhaut in das Innere des Augapfels ziehen.
- Nachtblindheit: Nachtblindheit tritt bei jedem Menschen mit schwerem Vitamin-A-Mangel auf. Der Grund dafür ist, dass ohne Vitamin A die Mengen an Netzhaut und Rhodopsin, die gebildet werden können, stark vermindert sind. Dieser Zustand wird als Nachtblindheit bezeichnet, weil die nachts verfügbare Lichtmenge zu gering ist, um bei Menschen mit Vitamin-A-Mangel ein ausreichendes Sehen zu ermöglichen. ⓘ
Darüber hinaus wurde die Netzhaut als "Fenster" zum Gehirn und zum Körper bezeichnet, da durch eine Untersuchung der Netzhaut festgestellte Anomalien sowohl neurologische als auch systemische Krankheiten aufdecken können. ⓘ
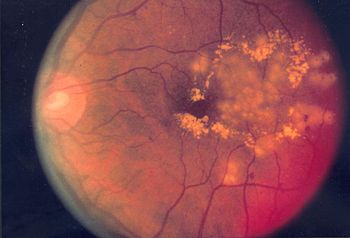
Beispiele für Erkrankungen der Netzhaut sind:
- Diabetische Retinopathie, infolge einer Zuckerkrankheit auftretende Netzhauterkrankung
- hypertensive Retinopathie, durch Bluthochdruck hervorgerufene Netzhauterkrankung
- eklamptische Retinopathie, bei Schwangeren im Rahmen einer Eklampsie auftretende Netzhauterkrankung
- Retinopathia praematurorum, bei Frühgeborenen vorkommende Netzhauterkrankung
- Retinopathia pigmentosa, auch Retinitis pigmentosa (RP) genannte angeborene Netzhautkrankheit
- Retinopathia centralis serosa, schwellungsbedingte zentrale Netzhautabhebung
- Retinoblastom, bösartige Tumoren im Säuglings- und Kleinkindalter
- Netzhautdystrophie
- Netzhautablösung
- Netzhautforamen
- Netzhautspaltung
- Gefäßverschlüsse, arteriell mit Ischämie, und Infarkte
- Makuladegeneration
- Makuläre Teleangiektasien
- Azoor Akute zonale okkulte äußere Retinopathie
- periphere Netzhautdegeneration mit Verdünnung der Netzhaut und Glitzerwolken ⓘ
Diagnose
Eine Standardmethode zur Untersuchung der Netzhaut stellt die direkte beziehungsweise indirekte Ophthalmoskopie oder Funduskopie (Augenspiegelung) dar. Sie besteht in der Beleuchtung des Augenhintergrundes und der Betrachtung des reflektierten Bildes mit einer Lupe. Seit der Erfindung des Augenspiegels 1851 durch Hermann von Helmholtz ist dieses Verfahren in der ophthalmoskopischen Diagnostik etabliert. ⓘ
In den letzten Jahrzehnten wurden weitere Verfahren zur Netzhautdiagnostik entwickelt:

- Eine relativ neue, technisch herausragende und teurere Methode ist die Optische Kohärenztomografie (OCT), die die Abbildung des Untersuchungsgebietes um die dritte Dimension erweitert. Sie ermöglicht die Anfertigung hochauflösender Schnittbilder oder auch dreidimensionaler Tomografien mit einer zum histologischen Bilde vergleichbaren Qualität (Auflösungsvermögen bis 3 µm im Vergleich zu 0,3 µm beim Lichtmikroskop). Hier können die einzelnen Netzhautschichten aufgelöst und in ihrer Dicke vermessen werden. Dadurch lassen sich feinste Unterschiede feststellen, die für die adäquate Therapie bestimmter Netzhauterkrankungen oder auch beim Testen von Medikamenten maßgeblich sein können.
- Weitere bildgebende Verfahren bieten neuartige Scanning-Laser-Ophthalmoskope, wie der Heidelberg Retina Tomograph (HRT), die mittels punkt- oder zeilenweisem Abtasten der Netzhaut und konfokaler Blenden- und Beleuchtungstechnik hochauflösende dreidimensionale Schicht- oder Reliefdarstellungen erzeugen können. ⓘ
Weitere Untersuchungs- und Beurteilungsmöglichkeiten bestehen auf elektrophysiologischer Ebene durch
- das Elektroretinogramm (ERG)
- das Elektrookulogramm (EOG)
sowie zur Darstellung der retinalen Durchblutung durch
- die Fluoreszenzangiographie (auch FLA, FAG oder Angio abgekürzt)
- die Indocyaningrün-Angiographie
- die Retinale Gefäßanalyse mit dem Retinal Vessel Analyzer, die nicht nur bei Diabetes mellitus, sondern auch zur Diagnostik allgemeiner Veränderungen der Mikrogefäße („Spiegelbild der Mikrovaskulatur“) eingesetzt wird. ⓘ
Für die Diagnose von Krankheiten und Störungen, die die Netzhaut betreffen, stehen eine Reihe verschiedener Instrumente zur Verfügung. Die Ophthalmoskopie und die Fundusfotografie werden seit langem zur Untersuchung der Netzhaut eingesetzt. Kürzlich wurde die adaptive Optik eingesetzt, um einzelne Stäbchen und Zapfen in der lebenden menschlichen Netzhaut abzubilden, und ein in Schottland ansässiges Unternehmen hat eine Technologie entwickelt, die es Ärzten ermöglicht, die gesamte Netzhaut zu betrachten, ohne dass dies für den Patienten unangenehm ist. ⓘ
Das Elektroretinogramm dient zur nicht-invasiven Messung der elektrischen Aktivität der Netzhaut, die durch bestimmte Krankheiten beeinträchtigt wird. Eine relativ neue Technologie, die inzwischen weit verbreitet ist, ist die optische Kohärenztomographie (OCT). Diese nicht-invasive Technik ermöglicht die Erstellung eines 3D-Volumen- oder hochauflösenden Querschnittstomogramms der feinen Strukturen der Netzhaut in histologischer Qualität. Die retinale Gefäßanalyse ist eine nicht-invasive Methode zur Untersuchung der kleinen Arterien und Venen in der Netzhaut, die Rückschlüsse auf die Morphologie und die Funktion der kleinen Gefäße an anderen Stellen des menschlichen Körpers zulässt. Sie hat sich als Prädiktor für kardiovaskuläre Erkrankungen etabliert und scheint laut einer 2019 veröffentlichten Studie Potenzial für die Früherkennung der Alzheimer-Krankheit zu haben. ⓘ
Behandlung
Die Behandlung hängt von der Art der Krankheit oder Störung ab. ⓘ
Übliche Behandlungsmodalitäten
Die folgenden Modalitäten sind gängige Behandlungsmethoden für Netzhauterkrankungen:
- Intravitreale Medikamente, wie Anti-VEGF- oder Kortikosteroid-Wirkstoffe
- Vitreoretinale Chirurgie
- Verwendung von Nahrungsergänzungsmitteln
- Änderung der systemischen Risikofaktoren für Netzhauterkrankungen ⓘ
Ungewöhnliche Behandlungsmodalitäten
Seltene oder ungewöhnliche Methoden zur Behandlung von Netzhauterkrankungen ⓘ
|
|---|
|
Gentherapie der Netzhaut Die Gentherapie ist ein vielversprechender Weg zur Heilung einer Vielzahl von Netzhauterkrankungen. Dabei wird ein nicht-infektiöses Virus verwendet, um ein Gen in einen Teil der Netzhaut zu schleusen. Rekombinante Adeno-assoziierte Virusvektoren (rAAV-Vektoren) besitzen eine Reihe von Eigenschaften, die sie für die retinale Gentherapie ideal geeignet machen. Dazu gehören fehlende Pathogenität, minimale Immunogenität und die Fähigkeit, postmitotische Zellen stabil und effizient zu transduzieren. rAAV-Vektoren werden zunehmend wegen ihrer Fähigkeit eingesetzt, eine effiziente Transduktion von retinalem Pigmentepithel (RPE), Photorezeptorzellen und retinalen Ganglienzellen zu vermitteln. Jeder Zelltyp kann durch die Wahl der geeigneten Kombination von AAV-Serotyp, Promotor und intraokulärer Injektionsstelle gezielt angesprochen werden. Mehrere klinische Studien haben bereits über positive Ergebnisse bei der Behandlung der kongenitalen Leber-Amaurose mit rAAV berichtet und gezeigt, dass die Therapie sowohl sicher als auch wirksam ist. Es traten keine schwerwiegenden unerwünschten Ereignisse auf, und die Patienten in allen drei Studien zeigten eine Verbesserung ihrer Sehfunktion, die mit einer Reihe von Methoden gemessen wurde. Die in den drei Studien verwendeten Methoden variierten, umfassten jedoch sowohl funktionelle Methoden wie die Sehschärfe und die funktionelle Beweglichkeit als auch objektive Messwerte, die weniger anfällig für Verzerrungen sind, wie die Fähigkeit der Pupille, auf Licht zu reagieren, und Verbesserungen im funktionellen MRT. Die Verbesserungen hielten langfristig an, wobei die Patienten auch nach mehr als 1,5 Jahren noch gut abschnitten. Die einzigartige Architektur der Netzhaut und ihre relativ immunfreundliche Umgebung begünstigen diesen Prozess. Tight Junctions, die die Blut-Retina-Schranke bilden, trennen den subretinalen Raum von der Blutversorgung ab und schützen ihn so vor Mikroben und den meisten immunvermittelten Schäden und erhöhen sein Potenzial, auf vektorvermittelte Therapien zu reagieren. Die hochkompartimentierte Anatomie des Auges erleichtert die präzise Verabreichung von therapeutischen Vektorsuspensionen an bestimmte Gewebe unter direkter Visualisierung mit Hilfe mikrochirurgischer Techniken. In der geschützten Umgebung der Netzhaut sind AAV-Vektoren in der Lage, eine hohe Expression von Transgenen im retinalen Pigmentepithel (RPE), in den Photorezeptoren oder in den Ganglienzellen über lange Zeiträume nach einer einzigen Behandlung aufrechtzuerhalten. Darüber hinaus können das Auge und das visuelle System nach der Injektion routinemäßig und einfach mit nicht-invasiver, fortschrittlicher Technologie auf die Sehfunktion und strukturelle Veränderungen der Netzhaut überwacht werden, wie z. B. Sehschärfe, Kontrastempfindlichkeit, Fundus-Autofluoreszenz (FAF), dunkeladaptierte Sehschwellen, Gefäßdurchmesser, Pupillometrie, Elektroretinographie (ERG), multifokales ERG und optische Kohärenztomographie (OCT). Diese Strategie ist bei einer Reihe von untersuchten Netzhauterkrankungen wirksam, darunter neovaskuläre Erkrankungen, die Merkmale der altersbedingten Makuladegeneration, der diabetischen Retinopathie und der Frühgeborenen-Retinopathie sind. Da die Regulierung der Gefäßbildung in der reifen Netzhaut ein Gleichgewicht zwischen endogenen positiven Wachstumsfaktoren wie dem vaskulären endothelialen Wachstumsfaktor (VEGF) und Inhibitoren der Angiogenese wie dem aus dem Pigmentepithel stammenden Faktor (PEDF) beinhaltet, hat sich gezeigt, dass die rAAV-vermittelte Expression von PEDF, Angiostatin und dem löslichen VEGF-Rezeptor sFlt-1, die alle antiangiogene Proteine sind, die abnorme Gefäßbildung in Tiermodellen reduziert. Da spezifische Gentherapien nicht ohne weiteres eingesetzt werden können, um einen bedeutenden Teil der Patienten mit Netzhautdystrophie zu behandeln, besteht ein großes Interesse an der Entwicklung einer allgemeiner anwendbaren Therapie mit Überlebensfaktoren. Neurotrophe Faktoren haben die Fähigkeit, das neuronale Wachstum während der Entwicklung zu modulieren, um vorhandene Zellen zu erhalten und die Wiederherstellung verletzter neuronaler Populationen im Auge zu ermöglichen. AAV, die für neurotrophe Faktoren wie Mitglieder der Fibroblasten-Wachstumsfaktor-Familie (FGF) und GDNF kodieren, haben Photorezeptoren entweder vor Apoptose geschützt oder den Zelltod verlangsamt. Organtransplantation Die Transplantation von Netzhäuten ist bereits versucht worden, jedoch ohne großen Erfolg. Am MIT, der University of Southern California, der RWTH Aachen und der University of New South Wales wird derzeit eine "künstliche Netzhaut" entwickelt: ein Implantat, das die Photorezeptoren der Netzhaut umgeht und die angeschlossenen Nervenzellen direkt mit Signalen von einer Digitalkamera stimuliert. |
Geschichte
Um 300 v. Chr. identifizierte Herophilos die Netzhaut anhand von Sektionen von Kadaveraugen. Er nannte sie Arachnoidea, weil sie einem Spinnennetz ähnelt, und retiform, weil sie einem Wurfnetz ähnelt. Der Begriff arachnoid bezeichnete eine Schicht um das Gehirn, der Begriff retiform die Netzhaut. ⓘ
Zwischen 1011 und 1021 n. Chr. veröffentlichte Ibn Al-Haytham zahlreiche Experimente, in denen er nachwies, dass das Sehvermögen durch Licht entsteht, das von Objekten ins Auge reflektiert wird. Dies steht im Einklang mit der Intrusionstheorie und im Gegensatz zur Emissionstheorie, die besagt, dass das Sehvermögen durch von den Augen ausgesandte Strahlen entsteht. Ibn Al-Haytham kam jedoch zu dem Schluss, dass die Netzhaut nicht für den Beginn des Sehens verantwortlich sein kann, da das auf ihr entstehende Bild invertiert ist. Stattdessen beschloss er, dass das Sehen an der Oberfläche der Linse beginnen müsse. ⓘ
1604 erarbeitete Johannes Kepler die Optik des Auges und kam zu dem Schluss, dass die Netzhaut der Beginn des Sehens sein muss. Er überließ es anderen Wissenschaftlern, das umgekehrte Netzhautbild mit unserer Wahrnehmung der Welt als aufrecht stehend in Einklang zu bringen. ⓘ
1894 veröffentlichte Santiago Ramón y Cajal in Retina der Wirbeltiere die erste umfassende Charakterisierung der Netzhautneuronen. ⓘ
George Wald, Haldan Keffer Hartline und Ragnar Granit erhielten 1967 den Nobelpreis für Physiologie oder Medizin für ihre wissenschaftlichen Forschungen über die Netzhaut. ⓘ
In einer aktuellen Studie der University of Pennsylvania wurde berechnet, dass die ungefähre Bandbreite der menschlichen Netzhaut 8,75 Megabit pro Sekunde beträgt, während die Übertragungsrate der Netzhaut eines Meerschweinchens 875 Kilobit pro Sekunde beträgt. ⓘ
MacLaren & Pearson und Kollegen vom University College London und dem Moorfields Eye Hospital in London zeigten 2006, dass Photorezeptorzellen erfolgreich in die Netzhaut von Mäusen transplantiert werden können, wenn sich die Spenderzellen in einem kritischen Entwicklungsstadium befinden. Kürzlich zeigten Ader und Kollegen in Dublin mit Hilfe des Elektronenmikroskops, dass transplantierte Photorezeptoren synaptische Verbindungen bilden. ⓘ
2012 riefen Sebastian Seung und sein Labor am MIT EyeWire ins Leben, ein Citizen-Science-Online-Spiel, bei dem Spieler Neuronen in der Netzhaut aufspüren. Ziel des EyeWire-Projekts ist es, bestimmte Zelltypen innerhalb der bekannten großen Klassen von Netzhautzellen zu identifizieren und die Verbindungen zwischen den Neuronen in der Netzhaut zu kartieren, was dazu beitragen wird, die Funktionsweise des Sehens zu verstehen. ⓘ
Zusätzliche Bilder
Illustration des Bildes, wie es von der Netzhaut unabhängig von der Verarbeitung durch den Sehnerv und den striatischen Kortex "gesehen" wird. ⓘ
Anatomie der Netzhaut des Menschen
Richtungs- und Lagebezeichnungen
Die Schichten der Netzhaut betreffend bezeichnet man als außen die Seite der Netzhaut, die näher zur Außenwand des Augapfels liegt. Als innen wird entsprechend die näher zur Augapfelmitte liegende Seite bezeichnet. Das durch die Pupille in den Augapfel eingefallene Licht erreicht also zunächst die inneren Netzhautschichten, und dann erst die äußeren; die äußerste Schicht der Netzhaut wird von einer Lage dunkel pigmentierter Zellen gebildet, dem retinalen Pigmentepithel. ⓘ

Als vorn, anterior oder distal, bezeichnet man die Netzhautanteile, die den Strukturen des vorderen Augenabschnitts, der Iris und der Linse, nahe sind. Hinten, posterior oder proximal, heißen somit Netzhautanteile an jener der Linse gegenüber liegenden Augapfelwand. Für die Angabe von Richtungen in der Querachse werden die Ausdrücke nasenseitig (nasal) und schläfenseitig (temporal) gebraucht. ⓘ
Abschnitte und Grenzen
Den weitaus größten Teil der Innenfläche des Augapfels bildet die Pars optica retinae genannte Neuroretina, welche die Fotorezeptoren trägt. Nach vorne zu ist sie etwa 3 mm hinter dem Ziliarkörper (Corpus ciliare) mit einer zackenförmigen Grenze, der Ora serrata, von der Pars caeca retinae (lat. caecus ‚blind‘) abgesetzt, die ganz vorn als Pars ciliaris retinae den Ziliarkörper überzieht. Die vorderen Netzhautabschnitte können am intakten Auge bei der Kontaktglasuntersuchung mit einem Dreispiegelkontaktglas betrachtet werden. ⓘ
Der Netzhaut liegt außen die Aderhaut (Choroidea) auf, welche per Diffusion die äußeren Netzhautschichten mit Nährstoffen versorgt. Innen liegt der Netzhaut der Glaskörper (Corpus vitreum) an. Hinten geht die Netzhaut in der Sehnervenpapille in den Sehnerv (Nervus opticus) über, welcher die Nervenfasern der Ganglienzellschicht enthält. ⓘ
Dem Schutz der Netzhaut dient die sogenannte Blut-Retina-Schranke. ⓘ
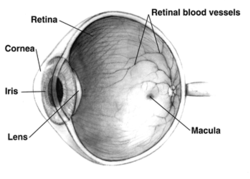
Makroskopisches Bild der Netzhaut, Augenhintergrund
Beim Blick auf den Augenhintergrund (Fundus oculi oder Fundus) durch die Pupille schaut man durch die farblose und durchsichtige Neuroretina hindurch auf das dunkel pigmentierte retinale Pigmentepithel (RPE) und die darunterliegende, typabhängig mehr oder weniger dunkel pigmentierte Aderhaut. Als auffällige Landmarke findet man etwa 15° nasal von der optischen Achse die Austrittsstelle des Sehnerven mit seiner Papille (Papilla nervi optici). Sie hebt sich durch ihre rosa bis hellrote Farbe vom übrigen Braunorange des Fundus ab. Die Papille hat einen Durchmesser von durchschnittlich etwa 1,5 mm und ist mit individuell unterschiedlich ausgeprägtem Rand rund oder oval geformt. ⓘ
Der blinde Fleck
Als blinder Fleck wird im Gesichtsfeld die Stelle bezeichnet, auf die sich die Papille des Sehnerven projiziert (etwa 15° schläfenseitig vom Fixierpunkt). Dort, wo die Nervenfasern von Ganglienzellen der inneren Schicht zusammenlaufen und durch alle Netzhautschichten hindurchtretend den Augapfel verlassen, den Sehnerv bilden, befinden sich keine Lichtrezeptoren (siehe unten). Das Gebiet der Sehnervenpapille ist also wirklich lichtunempfindlich, „blind“. ⓘ
Dass dieser „blinde“ Fleck auch bei einäugigem Sehen nicht wahrgenommen wird, liegt am sogenannten Ergänzungseffekt. Das visuelle System verwendet Informationen, die die Rezeptoren in der Umgebung der Papille liefern, um das Bild zu ergänzen. ⓘ
Gefäße der Netzhaut, Macula lutea
Auch die großen Netzhautgefäße, Arteriola und Venola centralis retinae, die wesentlich zum okulären Blutfluss beitragen, passieren die Augapfelwand und treten im Zentrum der Papille durch. Sie verzweigen sich hier in ein oberes und ein unteres Büschel und teilen sich meist noch einmal in einen nasalen und einen schläfenseitigen Ast auf. An ihrer unterschiedlichen Rottönung und am Kaliber lassen sich die Arteriolen von den Venolen unterscheiden. ⓘ
Die schläfenseitigen Gefäßzweige umrunden bogenförmig ein gefäßarmes und im Zentrum gefäßfreies Gebiet, das den gelben Fleck (Macula lutea) darstellt. Die gelbliche Färbung dieses im Durchmesser rund 3 mm großen Netzhautareals wird durch die hier eingelagerten Carotinoide Lutein und Zeaxanthin hervorgerufen. Diese filtern energiereiches (UV-)Licht und schützen die Netzhautzellen so vor photooxidativen Schäden. Inmitten der Macula lutea liegt eine seichte Vertiefung, die Fovea centralis, kurz Fovea oder Sehgrube genannt; um die Fovea centralis herum ist die Netzhaut zu einem flachen Wall verdickt. Diese Oberflächenform kommt durch Verlagerungen von Netzhautschichten zustande und kann bei Spiegelung des Augenhintergrundes an Lichtreflexen, dem sogenannten Wallreflex, erkannt werden. ⓘ
Die Sehgrube im „gelben Fleck“ enthält die Stelle des schärfsten Sehens. Hier besitzt die Netzhaut die größte Auflösung, wie man sie etwa beim Lesen von Kleingedrucktem braucht. Die umgebende Netzhaut hat ein geringeres Auflösungsvermögen; diese peripheren Netzhautregionen dienen im Wesentlichen der Umfeldwahrnehmung, dem Erkennen von Dingen „aus den Augenwinkeln“, und sind die Grundlage des peripheren Gesichtsfeldes. Die zentrale Retina mit der Fovea centralis repräsentiert in der Foveola mit deren Mitte als motorischem Nullpunkt den Richtungswert geradeaus, auch Hauptsehrichtung genannt. Jeder periphere Netzhautpunkt besitzt ein anderes Richtungsempfinden, was zu entsprechend vielen Nebensehrichtungen führt. ⓘ
Schwere Schädigungen der Macula lutea, z. B. durch die altersbedingte Makuladegeneration (AMD), können zu erheblichen Verlusten der Sehschärfe führen, sodass sie beispielsweise zum Lesen oder Autofahren nicht mehr ausreicht. ⓘ
Nervenzellen der Netzhaut
Ganglienzellen
Den Bipolar- und Amakrinzellen nachgeschaltet sind die Ganglienzellen. Sie sind die Ausgangsneurone der Netzhaut und leiten die visuelle Information über den Sehnerv (Nervus opticus) weiter zur nächsten Schaltstation im Gehirn, dem Corpus geniculatum laterale. Insgesamt lassen sich mindestens 30 Ganglienzelltypen unterscheiden. ⓘ
Schichten der Netzhaut
Das durch die Pupille einfallende Licht durchdringt Linse und Glaskörper als transparente Medien und passiert dann mehrere Schichten der Netzhaut, bevor es von den Photorezeptorzellen des Neuroepithels detektiert wird, die dem außen anliegenden Pigmentepithel zugewandt sind. Vom Glaskörper her zur Aderhaut hin, also bezogen auf das Auge von innen nach außen, zeigt die lichtempfindliche Netzhaut einen schichtartigen Aufbau aus Zellkörpern im Wechsel mit Zellfortsätzen. Hierbei lassen sich meist zehn Schichten unterscheiden, im Bereich der Sehgrube des Gelben Flecks sind einige seitwärts verlagert. ⓘ
Epiretinale Membran (ERM) oder innere Grenzmembran
Die innere Grenzmembran (Membrana limitans interna), englisch epiretinal membrane (ERM) oder internal limiting membrane (ILM) genannt, setzt die Retina vom Glaskörper ab. Diese innere Begrenzung der Netzhaut wird von der Basalmembran und der Plasmamembran der Müllerschen Zellen sowie möglicherweise anderer Gliazellen gebildet. Darüber hinaus besteht sie aus Kollagenfasern und Proteoglykosiden. Die im Lichtmikroskop homogen erscheinende Schicht bedeckt die gesamte Retina und geht vorne mit einer etwas vergröberten Struktur in die Zonulalamelle über. ⓘ
Die älteren Histologen waren der Ansicht, dass die pinselartigen Endfüße der Müllerschen Stützfasern fest in der Grenzmembran verankert sind, letztere also als gliöses Produkt zu werten ist. Das Elektronenmikroskop konnte jedoch zeigen, dass die innere Grenzmembran den Charakter einer Basalmembran hat und von den Fußpunkten der Müllerschen Zellen klar abgegrenzt werden kann. Die klinisch nachweisbare starke Haftung der Membran an der Retina kommt wahrscheinlich durch die mit Kittsubstanz gefüllte Zwischenschicht zustande, welche die Gliafortsätze der Müllerschen Zellen mit der Grenzmembran verbindet. ⓘ
Die innere Grenzmembran wird auch als periphere Verdichtung des Glaskörpergewebes aufgefasst, da sich ihre Faserlamellen schichtweise von der Retina abheben und in die Glaskörpermembran übergehen. Die Dicke der Grenzmembran beträgt ca. 2–3 µm. ⓘ
Ganglienzellschicht

Legende linkerseits:
RPE retinales Pigmentepithel
OS Außensegmente der Photorezeptorzellen
IS Innensegmente der Photorezeptorzellen
ONL äußere nukleäre Schicht
OPL äußere plexiforme Schicht
INL innere nukleäre Schicht
IPL innere plexiforme Schicht
GC Ganglienzellschicht
Legende rechterseits:
BM Bruch-Membran, P Pigmentepithelzelle
R Stäbchen, C Zapfen
Pfeil: Membrana limitans externa
H Horizontalzelle, Bi Bipolarzelle
M Müller-Zelle, A Amakrinzelle
G Ganglienzelle, Ax Axone
Lichteinfall von innen (unten, GC) nach außen (oben, RPE) ⓘ
Die Ganglienzellschicht (Stratum ganglionare), englisch ganglion cell layer (GCL), enthält die Zellkörper der retinalen Ganglienzellen. ⓘ
Die Dendriten der Ganglienzellen ziehen in die angrenzende innere plexiforme Schicht (IPL), wo sie sich verzweigen und die Signale von den Bipolarzellen und den Amakrinzellen entgegennehmen. Weitergeleitet an Regionen im Gehirn werden die Signale schließlich über die Axone der Ganglienzellen, welche in der Nervenfaserschicht verlaufen und sich zum Nervus opticus bündeln. ⓘ
Die Größe der Zellkörper ist verschieden, die Anordnung der Zellen in der peripheren Retina meist einschichtig, in mittleren und zentralen Zonen mehrschichtig. Neben den Ganglienzellen sind in der GCL noch einige Typen von Amakrinzellen ('displaced amacrine cells') und Gliazellen zu finden. Die Dicke der GCL beträgt ca. 20–30 µm. ⓘ
Innere plexiforme Schicht
In der inneren plexiformen Schicht (Stratum plexiforme internum), englisch inner plexiform layer (IPL), findet eine Stufe der Vorverarbeitung statt, bevor die Information beispielsweise weitergeleitet wird an visuelle Zentren im Gehirn. ⓘ
Die IPL besteht aus einem dichten Geflecht, das von den Axonterminalen der Bipolarzellen und von Dendriten der Amakrinzellen und der Ganglienzellen gebildet wird. Die Bipolarzellen liefern aufgearbeitete Signale der Photorezeptoren aus den äußeren Retinaschichten. Die IPL lässt sich untergliedern in fünf Subschichten. Diese Struktur ergibt sich aus den Verschaltungen der Bipolarzellen. Die tonischen OFF-Bipolarzellen bilden Synapsen in der ersten Subschicht der IPL. Die phasischen OFF-Bipolarzellen verschalten in der zweiten. Die phasischen ON-Bipolarzellen verschalten in Subschicht vier und die tonischen ON-Bipolarzellen in der fünften. ⓘ
Die Signalweitergabe wird jeweils durch synaptische Interaktionen mit Amakrinzellen moduliert und erreicht so schließlich die retinalen Ganglienzellen. ⓘ
Gelegentlich finden sich in der IPL auch Zellkörper von „deplatzierten“ (misplaced) Neuronen, außerdem Neuroglia. Die Dicke dieser Schicht beträgt etwa 50–70 µm. ⓘ
Innere Körnerschicht
Die innere Körnerschicht (Stratum nucleare internum), englisch inner nuclear layer (INL), enthält die Zellkörper von funktionell stark unterschiedlichen Zellen. ⓘ
In der INL sind die Zellkörper von Bipolar-, Amakrin- und Horizontalzellen für die Vorverarbeitung von Signalen angesiedelt, sowie die Zellkörper des neuronalen Stützgewebes, der Müller-Zellen. Am weitesten außen liegen die Horizontalzellen, dann folgen die Zellkörper der Bipolarzellen und Müller-Zellen, an der inneren Begrenzung liegen die amakrinen Zellen. Innerhalb der Macula im Wall um die Sehgrube ist die INL mit einem Dutzend Zellreihen besonders dick, sie verjüngt sich peripher auf eine zwei- bis dreireihige Anordnung der Zellkerne. Die Dicke der inneren Körnerschicht beträgt 30 µm. ⓘ
Äußere Grenzmembran (ÄGM)
Die äußere Grenzmembran (Membrana limitans externa), englisch external limiting membrane (ELM), ist eine weitgehend undurchlässige Trennschicht, auch Stratum limitans externum genannt. ⓘ
Sie wird durch eine horizontal gelegene Reihe von Zelladhäsions-Verbindungen (Zonulae adhaerentes, adhering junctions) gebildet, welche zwischen Ausläufern der Müllerschen Zellen und den Photorezeptorzellen ausgebildet sind. Durch die Lücken dieses fibrillären Netzwerks treten die Innenglieder der Rezeptorzellen. In der Region der Ora serrata setzt sich die äußere Grenzmembran in jene Substanz fort, welche die beiden Schichten des Ziliarepithels verbindet. ⓘ
Innensegment (IS)
Das Innensegment oder Innenglied, englisch inner segment (IS), besteht aus stoffwechselreichen Kompartimenten der Photorezeptoren. ⓘ
Das IS ist der Bereich der Photorezeptorzellen, der Mitochondrien und endoplasmatisches Retikulum (ER) enthält. Hier erfolgt unter anderem die Proteinbiosynthese und andere Stoffwechselaktivität. Getrennt werden die inneren von den äußeren Segmenten durch ein schmales Verbindungscilium, durch welche alle Stoffe für das Außensegment aktiv transportiert werden müssen. ⓘ
Außensegment (AS)
Das Außensegment oder Außenglied, englisch outer segment (OS), ist das lichtsensitive Kompartiment der Photorezeptoren. Hier erstrecken sich die Außensegmente der Photorezeptoren vom Verbindungscilium bis zum RPE. Am Verbindungscilium entstehen neue Diskmembranen, Membranabschnürungen bepackt mit Rhodopsin. Rhodopsin ist in die Disks eingelagert und initiiert die visuelle Signaltransduktion. Durch die Neusynthese bewegen sich diese Disks zum RPE und werden dort phagozytiert. ⓘ
Retinales Pigmentepithel (RPE)
Das retinale Pigmentepithel (Stratum pigmentosum), englisch retinal pigment epithelium (RPE), ist zunächst ein abschattender Lichtfilter. Dort findet aber auch ein Stoffaustausch mit Photorezeptoren statt. ⓘ
Mit dem Pigmentepithel, einem hexagonal aufgebauten, einschichtigen Epithel, das aus dem äußeren Blatt des embryonalen Augenbechers hervorgeht, wird die Netzhaut gegen die Aderhaut (Choroidea) abgesetzt. Die Zellen des RPE enthalten durch Melanin schwarz gefärbte Melanosomen, welche funktionell Lichtfilter darstellen. Apikal umgreifen fingerartige, mikrovilläre Fortsätze des RPE die Photorezeptorzellen, welche der Ernährung der Photorezeptoren, dem Recycling der alten Diskmembranen der Photorezeptoraußensegmente sowie der Regeneration des gebleichten Retinals aus aktiviertem Rhodopsin dienen. Basal zeigen diese Zellen tiefe Furchen, die dem besseren Stoffaustausch mit den Blutgefäßen der Choroidea dienen. RPE-Zellen verhindern ein Eintreten von Blut aus der stark vaskularisierten Choriocapillaris (die stark durchblutete Grenzschicht der Aderhaut). In der Pars optica retinae wird die Verbindung zwischen dem RPE und der Neuroretina nur durch einen vom RPE aktiv erzeugten Sog aufrechterhalten, eine feste Verbindung existiert nur an der Ora serrata. Eine Fixierung der RPE-Schicht an die Lamina choriocapillaris erfolgt im übrigen durch die Bruch-Membran. ⓘ
Acetylsalicylsäure
Eine US-amerikanische Langzeitstudie aus Wisconsin legt die Vermutung nahe, dass die regelmäßige Einnahme von Acetylsalicylsäure möglicherweise zu Netzhautschädigungen führen könne und das Risiko einer altersbedingten Makuladegeneration (AMD) deutlich erhöhe. Ein kausaler Zusammenhang mit der Krankheitsentstehung konnte jedoch nicht nachgewiesen werden. ⓘ