Makuladegeneration
| Makuladegeneration ⓘ | |
|---|---|
| Andere Namen | Altersbedingte Makuladegeneration |
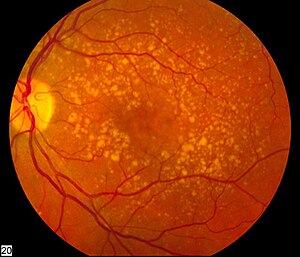 | |
| Bild des Augenhintergrunds mit intermediärer altersbedingter Makuladegeneration | |
| Fachgebiet | Ophthalmologie, Optometrie |
| Symptome | Verschwommenes oder fehlendes Sehen in der Mitte des Gesichtsfeldes |
| Komplikationen | Visuelle Halluzinationen |
| Häufiges Auftreten | Ältere Menschen |
| Arten | Früh, mittel, spät |
| Ursachen | Schädigung der Makula der Netzhaut |
| Risikofaktoren | Genetik, Rauchen |
| Diagnostische Methode | Augenuntersuchung |
| Vorbeugung | Bewegung, gesunde Ernährung, nicht rauchen |
| Behandlung | In das Auge injizierte Anti-VEGF-Medikamente, Laserkoagulation, photodynamische Therapie |
| Häufigkeit | 8,7% der weltweiten Prävalenz im Jahr 2020 |
Makuladegeneration, auch altersbedingte Makuladegeneration (AMD oder ARMD) genannt, ist eine Krankheit, die zu verschwommenem oder fehlendem Sehen im Zentrum des Gesichtsfelds führen kann. Im Anfangsstadium treten oft keine Symptome auf. Im Laufe der Zeit kommt es jedoch bei manchen Menschen zu einer allmählichen Verschlechterung des Sehvermögens, die ein oder beide Augen betreffen kann. Der Verlust des zentralen Sehvermögens führt zwar nicht zur vollständigen Erblindung, kann aber das Erkennen von Gesichtern, das Autofahren, das Lesen oder andere Aktivitäten des täglichen Lebens erschweren. Es können auch visuelle Halluzinationen auftreten, die jedoch keine Geisteskrankheit darstellen. ⓘ
Makuladegeneration tritt typischerweise bei älteren Menschen auf. Genetische Faktoren und Rauchen spielen ebenfalls eine Rolle. Sie ist auf eine Schädigung der Makula der Netzhaut zurückzuführen. Die Diagnose wird durch eine vollständige Augenuntersuchung gestellt. Der Schweregrad wird in frühe, mittlere und späte Formen unterteilt. Der Spättyp wird zusätzlich in "trockene" und "feuchte" Formen unterteilt, wobei die trockene Form 90 % der Fälle ausmacht. ⓘ
Der Unterschied zwischen den beiden Formen ist die Veränderung der Makula. Bei der trockenen Form der AMD bilden sich Drusen, Zelltrümmer in der Makula, die die lichtempfindlichen Zellen allmählich schädigen und zum Sehverlust führen. Bei der feuchten Form der AMD wachsen Blutgefäße unter der Makula, wodurch Blut und Flüssigkeit in die Netzhaut eindringen. ⓘ
Zu den vorbeugenden Maßnahmen gehören körperliche Betätigung, gesunde Ernährung und Nichtrauchen. Es gibt keine Heilung oder Behandlung, die die bereits verlorene Sehkraft zurückbringt. Bei der feuchten Form können Anti-VEGF-Medikamente, die in das Auge gespritzt werden, oder seltener die Laserkoagulation oder die photodynamische Therapie die Verschlechterung der Erkrankung verlangsamen. Antioxidative Vitamine und Mineralien scheinen zur Vorbeugung nicht nützlich zu sein. Allerdings können Nahrungsergänzungsmittel das Fortschreiten der Krankheit bei denjenigen, die bereits erkrankt sind, verlangsamen. ⓘ
Die altersbedingte Makuladegeneration ist weltweit eine der Hauptursachen für zentrale Erblindung in der Bevölkerung im erwerbsfähigen Alter. Im Jahr 2020 sind weltweit mehr als 190 Millionen Menschen davon betroffen, und es wird erwartet, dass die Prävalenz bis 2040 auf 288 Millionen Menschen ansteigen wird, da der Anteil älterer Menschen an der Bevölkerung zunimmt. Sie tritt bei Männern und Frauen gleichermaßen auf und ist bei Menschen europäischer oder nordamerikanischer Abstammung häufiger. Im Jahr 2013 war sie die vierthäufigste Erblindungsursache nach Katarakten, Frühgeburten und Glaukomen. Sie tritt am häufigsten bei Menschen über fünfzig Jahren auf und ist in den Vereinigten Staaten die häufigste Ursache für den Verlust des Sehvermögens in dieser Altersgruppe. Etwa 0,4 % der Menschen zwischen 50 und 60 Jahren sind betroffen, 0,7 % der 60- bis 70-Jährigen, 2,3 % der 70- bis 80-Jährigen und fast 12 % der über 80-Jährigen. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| H35.3 | Degeneration der Makula und des hinteren Poles |
| ICD-10 online (WHO-Version 2019) | |

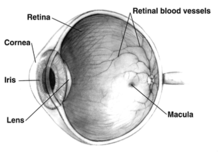
Unter dem Begriff Makuladegeneration oder Makulopathie wird eine Gruppe von Erkrankungen der Netzhaut des Auges zusammengefasst, die die Macula lutea („Gelber Fleck“) betreffen. Bestandteil dieses Areals ist der „Punkt des schärfsten Sehens“ (Fovea centralis), dessen unterschiedliche Zellen einem allmählichen Funktionsverlust erliegen, was mit dem Nachlassen der zentralen Sehschärfe (Visus) in vielen Fällen zu hochgradiger Sehbehinderung und Blindheit führen kann. ⓘ
Anzeichen und Symptome


Eine frühe oder intermediäre AMD kann asymptomatisch sein oder sich durch verschwommenes oder vermindertes Sehen auf einem oder beiden Augen bemerkbar machen. Dies kann sich zunächst als Schwierigkeiten beim Lesen oder Autofahren (insbesondere in schlecht beleuchteten Bereichen) äußern. Weitere Symptome der AMD sind Sehstörungen und blinde Flecken (vor allem im und um das zentrale Gesichtsfeld). ⓘ
Weitere Anzeichen und Symptome der Makuladegeneration sind:
- Verzerrtes Sehen in Form von Metamorphopsie, bei der ein Gitter aus geraden Linien wellenförmig erscheint und Teile des Gitters leer erscheinen können: Die Patienten bemerken dies oft zuerst, wenn sie Dinge wie Miniblinden in ihrer Wohnung oder Telefonmasten beim Autofahren betrachten. Es können auch zentrale Skotome, Schatten oder fehlende Bereiche des Sehens auftreten.
- Langsame Erholung der Sehfunktion nach Exposition gegenüber hellem Licht (Photostresstest)
- Drastische Verschlechterung der Sehschärfe (um zwei oder mehr Stufen), z. B.: 20/20 bis 20/80
- Verschwommenes Sehen: Menschen mit nicht-exsudativer Makuladegeneration können asymptomatisch sein oder einen allmählichen Verlust des zentralen Sehvermögens bemerken, während Menschen mit exsudativer Makuladegeneration oft einen schnell einsetzenden Sehverlust bemerken (oft verursacht durch Undichtigkeiten und Blutungen abnormaler Blutgefäße).
- Schwierigkeiten, Farben zu unterscheiden, insbesondere dunkle von dunklen und helle von hellen Farben
- Verlust der Kontrastempfindlichkeit
- Gebildete visuelle Halluzinationen und blinkende Lichter wurden auch mit schwerem Sehverlust als Folge der feuchten AMD in Verbindung gebracht. ⓘ
Die Makuladegeneration allein führt nicht zur völligen Erblindung. Im Übrigen ist nur ein kleiner Teil der Menschen mit Sehbehinderung völlig blind. In fast allen Fällen bleibt ein gewisses Sehvermögen erhalten, vor allem im peripheren Bereich. Andere komplizierende Bedingungen können zu einem solchen akuten Zustand führen (schwerer Schlaganfall oder Trauma, unbehandeltes Glaukom usw.), aber nur wenige Patienten mit Makuladegeneration erleiden einen vollständigen Sehverlust. ⓘ
Der Bereich der Makula macht nur etwa 2,1 % der Netzhaut aus, und die restlichen 97,9 % (das periphere Feld) bleiben von der Krankheit unberührt. Obwohl die Makula nur einen so kleinen Teil des Gesichtsfeldes ausmacht, ist fast die Hälfte des visuellen Kortex mit der Verarbeitung von Makulainformationen befasst. ⓘ
Außerdem haben Menschen mit trockener Makuladegeneration oft keine Symptome, können aber allmählich ein verschwommenes Sehen auf einem oder beiden Augen bemerken. Bei Menschen mit feuchter Makuladegeneration kann es zu einem akuten Auftreten von Sehsymptomen kommen. ⓘ
Risikofaktoren
Die wichtigsten Risikofaktoren sind Alter, Rauchen und familiäre Vorbelastung. Fortgeschrittenes Alter ist der stärkste Prädiktor für AMD, insbesondere über 50. ⓘ
Umwelt und Lebensstil
- Rauchen: Das Rauchen von Tabak erhöht das AMD-Risiko um das Zwei- bis Dreifache im Vergleich zu jemandem, der nie geraucht hat, und ist möglicherweise der wichtigste veränderbare Faktor bei der Prävention der AMD. Eine Überprüfung früherer Studien ergab "einen starken Zusammenhang zwischen aktuellem Rauchen und AMD. ... Zigarettenrauchen hat wahrscheinlich toxische Auswirkungen auf die Netzhaut".
- Hypertonie (Bluthochdruck): In der ALIENOR-Studie 2013 waren frühe und späte AMD nicht signifikant mit systolischem oder diastolischem Blutdruck (BP), Bluthochdruck oder der Einnahme von blutdrucksenkenden Medikamenten verbunden, aber ein erhöhter Pulsdruck [(PP) systolischer BP minus diastolischer BP] war signifikant mit einem erhöhten Risiko für späte AMD verbunden.
- Atherosklerose
- Hoher Cholesterinspiegel: Erhöhter Cholesterinspiegel kann das AMD-Risiko erhöhen.
- Fettleibigkeit: Bauchfettleibigkeit ist ein Risikofaktor, insbesondere bei Männern
- Fettkonsum: Der Verzehr großer Mengen bestimmter Fette, einschließlich gesättigter Fette, Transfette und Omega-6-Fettsäuren, trägt wahrscheinlich zur AMD bei, während einfach ungesättigte Fette potenziell schützend wirken. Vor allem Omega-3-Fettsäuren können das AMD-Risiko verringern.
- Die Exposition gegenüber UV-Licht aus dem Sonnenlicht wird möglicherweise mit einem erhöhten AMD-Risiko in Verbindung gebracht, obwohl die Beweise schwächer sind als bei anderen Ursachen.
- Digitale Bildschirme strahlen keine schädliche Energie auf die menschlichen Augen ab, aber langes Starren auf den Bildschirm ohne Pausen führt zu einer erhöhten Belastung der Augen. Es gibt keine Belege für die Behauptung, dass die Exposition gegenüber digitalen Bildschirmen zum Risiko einer Makuladegeneration beiträgt. ⓘ
Genetik
AMD ist eine stark vererbbare Krankheit. Die Häufigkeit des Wiederauftretens ist bei Geschwistern eines Betroffenen drei- bis sechsmal höher als in der Allgemeinbevölkerung. Genetische Kopplungsanalysen haben 5 Genvarianten an drei Stellen auf verschiedenen Chromosomen (1, 6 und 10) identifiziert, die mindestens 50 % des Risikos erklären. Diese Gene spielen eine Rolle bei der Regulierung der Immunantwort, von Entzündungsprozessen und der Homöostase der Netzhaut. Varianten dieser Gene führen zu verschiedenen Arten von Funktionsstörungen in diesen Prozessen. Im Laufe der Zeit führt dies zu einer Anhäufung von intra- und extrazellulärem Stoffwechselschutt. Dies kann zur Vernarbung der Netzhaut oder zum Zusammenbruch ihrer Gefäßversorgung führen. ⓘ
Die Liste der genetischen Variationen, die mit AMD in Verbindung gebracht werden, umfasst Komplementfaktoren, Apolipoprotein E, Fibroblasten-Wachstumsfaktor 2, DNA-Exzisionsreparaturprotein und altersbedingtes Makulopathie-Anfälligkeitsprotein 2. ⓘ
Obwohl Gentests zur Identifizierung von genetischen Variationen führen können, die für AMD prädisponieren, verhindert die komplexe Pathogenese der Erkrankung den Einsatz dieser Tests in der Routinepraxis. Dennoch können sie bei der Auswahl von Patienten für klinische Studien und bei der Analyse ihres Ansprechens auf die Behandlung nützlich sein. Die drei Loci, an denen die identifizierten Genvarianten zu finden sind, werden wie folgt bezeichnet:
- Komplementfaktor H (CFH) auf Chromosom 1 an der Position 1q31.3
- HTRA-Serinpeptidase 1/Age Related Maculopathy Susceptibility 2 (HTRA1/ARMS2) auf Chromosom 10 an der Stelle 10q26
- Komplementfaktor B/Komplementkomponente 2 (CFB/CC2) auf Chromosom 6 an 6p21.3 ⓘ
Spezifische Gene
- Polymorphismen in Genen für Proteine des Komplementsystems: Variationen in den Genen für die Komplementsystemproteine Faktor H (CFH), Faktor B (CFB) und Faktor 3 (C3) stehen unter anderem in starkem Zusammenhang mit dem Risiko einer Person, an AMD zu erkranken. CFH ist an der Hemmung der Entzündungsreaktion beteiligt. Die Mutation in CFH (Y402H) führt zu einer verminderten Fähigkeit des Proteins, sich in Geweben wie der Netzhaut zu lokalisieren und diese vor einer Überaktivierung des Komplements zu schützen. Das Fehlen der mit dem Komplementfaktor H verbundenen Gene R3 und R1 schützt vor AMD. Zwei unabhängige Studien aus dem Jahr 2007 zeigten, dass eine bestimmte häufige Mutation Arg80Gly im C3-Gen, einem zentralen Protein des Komplementsystems, stark mit dem Auftreten von AMD verbunden ist. Die Autoren beider Arbeiten sind der Ansicht, dass ihre Studie den Einfluss des Komplementwegs auf die Entstehung dieser Krankheit unterstreicht.
- In zwei Studien aus dem Jahr 2006 wurde ein weiteres Gen mit der Bezeichnung HTRA1 (das für eine sezernierte Serinprotease kodiert) identifiziert, das Auswirkungen auf die Krankheit hat.
- Sechs Mutationen des Gens SERPING1 (Serpin Peptidase Inhibitor, Clade G (C1 Inhibitor), Member 1) werden mit AMD in Verbindung gebracht. Mutationen in diesem Gen können auch ein hereditäres Angioödem verursachen.
- Fibulin-5-Mutation: Seltene Formen der Krankheit werden durch genetische Defekte in Fibulin-5 verursacht, und zwar auf autosomal dominante Weise. Im Jahr 2004 führten Stone et al. ein Screening bei 402 AMD-Patienten durch und stellten einen statistisch signifikanten Zusammenhang zwischen Mutationen in Fibulin-5 und dem Auftreten der Krankheit fest.
- Mitochondrienbezogene Genpolymorphismen, wie der im MT-ND2-Molekül, sagen die feuchte AMD voraus. ⓘ
Pathophysiologie
Die Pathogenese der altersbedingten Makuladegeneration ist nicht genau bekannt, obwohl einige Theorien aufgestellt wurden, darunter oxidativer Stress, mitochondriale Dysfunktion und entzündliche Prozesse. ⓘ
Das Ungleichgewicht zwischen der Produktion geschädigter Zellbestandteile und dem Abbau führt zur Anhäufung schädlicher Produkte, z. B. intrazelluläres Lipofuszin und extrazelluläre Drusen. Eine beginnende Atrophie ist durch Bereiche mit einer Ausdünnung oder Depigmentierung des retinalen Pigmentepithels (RPE) gekennzeichnet, die der geografischen Atrophie in den frühen Stadien der AMD vorausgehen. In fortgeschrittenen Stadien der AMD führt die Atrophie des RPE (geografische Atrophie) und/oder die Entwicklung neuer Blutgefäße (Neovaskularisation) zum Absterben der Photorezeptoren und zum Verlust des zentralen Sehvermögens. ⓘ
Bei der trockenen (nicht-exsudativen) Form lagern sich Drusen zwischen der Netzhaut und der Aderhaut ab und verursachen eine Atrophie und Vernarbung der Netzhaut. Bei der feuchten (exsudativen) Form, die schwerwiegender ist, wachsen Blutgefäße aus der Aderhaut (Neovaskularisation) hinter der Netzhaut hervor, aus denen Exsudat und Flüssigkeit austreten und auch Blutungen verursachen können. ⓘ
Frühe Arbeiten zeigten, dass eine Familie von Immunmediatoren in Drusen reichlich vorhanden ist. Der Komplementfaktor H (CFH) ist ein wichtiger Inhibitor dieser Entzündungskaskade, und ein krankheitsassoziierter Polymorphismus im CFH-Gen ist stark mit AMD assoziiert. Daher wurde ein pathophysiologisches Modell der AMD entwickelt, das von einer chronischen, geringgradigen Komplementaktivierung und Entzündung in der Makula ausgeht. Die Entdeckung von krankheitsassoziierten genetischen Polymorphismen in anderen Elementen der Komplementkaskade, einschließlich der Komplementkomponente 3 (C3), verleiht diesem Modell mehr Glaubwürdigkeit. ⓘ
Ein starker Prädiktor für AMD befindet sich auf Chromosom 10q26 bei LOC 387715. Ein Insertions/Deletions-Polymorphismus an dieser Stelle reduziert die Expression des ARMS2-Gens durch Destabilisierung seiner mRNA durch Deletion des Polyadenylierungssignals. Das ARMS2-Protein könnte in den Mitochondrien lokalisiert sein und am Energiestoffwechsel beteiligt sein, obwohl noch viel über seine Funktion herausgefunden werden muss. ⓘ
Zu den weiteren Genmarkern für das Progressionsrisiko gehört TIMP3 (Tissue Inhibitor of Metalloproteinase 3), was auf eine Rolle des Stoffwechsels der extrazellulären Matrix bei der AMD-Progression hindeutet. Variationen in Cholesterin metabolisierenden Genen wie der hepatischen Lipase, der Cholesterinester-Transferase, der Lipoproteinlipase und der ATP-bindenden Kassette A1 korrelieren mit dem Fortschreiten der Krankheit. Die frühen Stigmata der Krankheit, die Drusen, sind reich an Cholesterin, was den Ergebnissen der genomweiten Assoziationsstudien eine gewisse Gültigkeit verleiht. ⓘ
Stadien
Bei der AMD kommt es zu einer fortschreitenden Anhäufung charakteristischer gelber Ablagerungen, so genannter Drusen (Ansammlungen von extrazellulären Proteinen und Lipiden), in der Makula (einem Teil der Netzhaut), zwischen dem retinalen Pigmentepithel und der darunter liegenden Aderhaut. Es wird angenommen, dass diese Anhäufung die Netzhaut mit der Zeit schädigt. Amyloid beta, das sich in Alzheimer-Gehirnen ansammelt, ist eines der Proteine, die sich bei AMD ansammeln, weshalb AMD manchmal als "Alzheimer des Auges" oder "Alzheimer der Netzhaut" bezeichnet wird. Die AMD kann in drei Stadien eingeteilt werden: früh, mittel und spät, die teilweise auf dem Ausmaß (Größe und Anzahl) der Drusen basieren. ⓘ
Die AMD-ähnliche Pathologie beginnt mit kleinen gelben Ablagerungen (Drusen) in der Makula, zwischen dem Pigmentepithel der Netzhaut und der darunter liegenden Aderhaut. Die meisten Menschen mit diesen frühen Veränderungen (die als altersbedingte Makulopathie bezeichnet werden) haben noch ein gutes Sehvermögen. Menschen mit Drusen können eine AMD entwickeln, müssen es aber nicht. Tatsächlich hat die Mehrheit der über 60-Jährigen Drusen, die keine negativen Auswirkungen haben. Das Risiko, Symptome zu entwickeln, ist höher, wenn die Drusen groß und zahlreich sind und mit einer Störung der Pigmentzellschicht unter der Makula einhergehen. Es wird angenommen, dass große und weiche Drusen mit erhöhten Cholesterinablagerungen zusammenhängen. ⓘ
Frühe AMD
Die frühe AMD wird anhand des Vorhandenseins mittelgroßer Drusen diagnostiziert, die etwa so breit sind wie ein durchschnittliches menschliches Haar. Die frühe AMD ist in der Regel asymptomatisch. ⓘ
Intermediäre AMD
Die intermediäre AMD wird durch große Drusen und/oder Pigmentanomalien der Netzhaut diagnostiziert. Die intermediäre AMD kann zu einem gewissen Sehverlust führen, ist aber wie die frühe AMD in der Regel asymptomatisch. ⓘ
Kürzlich wurden Untergruppen der intermediären AMD identifiziert, die ein sehr hohes Risiko für das Fortschreiten der späten AMD haben. Diese Untergruppe wird (je nach genauer Definition) als naszierende GA und/oder iRORA (unvollständige Atrophie des retinalen Pigmentepithels und der äußeren Netzhaut) bezeichnet. Diese "Hochrisiko"-Untergruppen der intermediären AMD können verwendet werden, um Patienten über ihre Prognose zu informieren. Darüber hinaus können sie in klinischen Studien als Endpunkte verwendet werden. ⓘ
Späte AMD
Bei der späten AMD ist die Netzhaut so stark geschädigt, dass zusätzlich zu den Drusen auch ein symptomatischer zentraler Sehverlust auftritt. Bei den Schäden kann es sich entweder um die Entwicklung einer Atrophie oder um das Auftreten einer neovaskulären Erkrankung handeln. Die späte AMD wird je nach Art der Schädigung in zwei Untertypen eingeteilt: Geografische Atrophie und feuchte AMD (auch neovaskuläre AMD genannt). ⓘ
Trockene AMD
Trockene AMD (auch nicht-exsudative AMD genannt) ist eine weit gefasste Bezeichnung, die alle Formen von AMD umfasst, die nicht neovaskulär (feuchte AMD) sind. Dazu gehören frühe und mittlere Formen der AMD sowie die fortgeschrittene Form der trockenen AMD, die als geografische Atrophie bezeichnet wird. Patienten mit trockener AMD haben in den frühen Stadien in der Regel nur minimale Symptome; der Verlust der Sehfunktion tritt häufiger auf, wenn die Krankheit zur geografischen Atrophie fortschreitet. Die trockene AMD macht 80-90 % der Fälle aus und schreitet in der Regel langsam voran. Bei 10-20 % der Betroffenen geht die trockene AMD in eine feuchte Form über. ⓘ
Geografische Atrophie
Die geografische Atrophie (auch atrophische AMD genannt) ist eine fortgeschrittene Form der AMD, bei der ein fortschreitender und irreversibler Verlust von Netzhautzellen zu einem Verlust der Sehfunktion führt. Die Netzhaut besteht aus mehreren Schichten, und bei der geografischen Atrophie sind es drei bestimmte Schichten, die verkümmern: die Choriocapillaris, das retinale Pigmentepithel und die darüber liegenden Photorezeptoren. ⓘ
Die drei Schichten, die bei geografischer Atrophie verkümmern, liegen alle nebeneinander. Die Photorezeptoren sind die oberflächlichsten Zellen, die für die Umwandlung der Energie des Lichts aus der Außenwelt in ein elektrisches Signal verantwortlich sind, das an das Gehirn weitergeleitet wird. Das retinale Pigmentepithel hat mehrere Funktionen. Eine der Hauptfunktionen des retinalen Pigmentepithels besteht darin, oxidativen Stress zu minimieren. Dies geschieht, indem es Licht absorbiert und so verhindert, dass es in die darunter liegenden Schichten gelangt. Die Schichten, die unter dem retinalen Pigmentepithel liegen, sind stark vaskularisiert, so dass sie eine sehr hohe Sauerstoffspannung aufweisen. Wenn also Licht in diese Schichten gelangt, würden sich viele freie Radikale bilden und das umliegende Gewebe schädigen. Die tiefste Schicht, die bei geografischer Atrophie verkümmert, ist die Choriocappilaris. Es handelt sich um ein Kapillarnetz, das das Pigmentepithel der Netzhaut mit Nährstoffen versorgt. ⓘ
Die Pathophysiologie der geografischen Atrophie ist noch unklar. In einigen Studien wurde die Frage aufgeworfen, ob die Atrophie auf einen Mangel des retinalen Pigmentepithels zurückzuführen ist, der zu einem erhöhten oxidativen Stress führt. Andere Studien haben nach entzündlichen Ursachen für die Schädigung gesucht. Bislang ist sich die medizinische Gemeinschaft noch nicht sicher. Neuere Studien haben begonnen, jede Schicht einzeln zu untersuchen. Sie haben herausgefunden, dass ein verminderter Blutfluss in der Choriocapillaris der Atrophie des retinalen Pigmentepithels und der darüber liegenden Photorezeptoren vorausgeht. Da es sich bei der Choriocapillaris um eine Gefäßschicht handelt, kann dies als Argument dafür herangezogen werden, warum die geografische Atrophie eine Krankheit sein könnte, die auf einen verminderten Blutfluss zurückzuführen ist. ⓘ
Feuchte AMD
Die neovaskuläre oder exsudative AMD, die "feuchte" Form der fortgeschrittenen AMD, verursacht einen Sehverlust aufgrund eines abnormen Blutgefäßwachstums (choroidale Neovaskularisation) in der Choriokapillaris durch die Bruchsche Membran. Ihr geht in der Regel, aber nicht immer, die trockene Form der AMD voraus. Die Proliferation abnormaler Blutgefäße in der Netzhaut wird durch den vaskulären endothelialen Wachstumsfaktor (VEGF) stimuliert. Da diese Blutgefäße abnormal sind, sind sie auch brüchiger als typische Blutgefäße, was letztlich zu Blut- und Eiweißaustritt unterhalb der Makula führt. Blutungen, Undichtigkeiten und Vernarbungen aus diesen Blutgefäßen führen schließlich zu irreversiblen Schäden an den Photorezeptoren und zu einem raschen Sehverlust, wenn sie nicht behandelt werden. ⓘ
Oxidativer Stress
Die altersbedingte Anhäufung von niedermolekularen, phototoxischen, pro-oxidativen Melaninoligomeren in den Lysosomen des retinalen Pigmentepithels (RPE) ist möglicherweise mitverantwortlich für die Verringerung der Verdauungsrate der äußeren Stäbchensegmente (POS) der Photorezeptoren durch das RPE - die Autophagie. Eine Verringerung der Verdauungsrate von POS ist nachweislich mit der Bildung von Lipofuszin verbunden - ein klassisches Anzeichen für AMD. ⓘ
Die Rolle des oxidativen Stresses in der Netzhaut bei der Entstehung der AMD, der zu einer weiteren Entzündung der Makula führt, wird durch die erhöhte Erkrankungsrate bei Rauchern und Personen, die UV-Strahlung ausgesetzt sind, nahegelegt. ⓘ
Eine mitochondriale Dysfunktion könnte eine Rolle spielen. Kürzlich wurden Beweise dafür überprüft, dass die Schädigung der mitochondrialen DNA ein wesentliches Element der AMD-Pathogenese sein könnte und dass die Überproduktion reaktiver Sauerstoffspezies bei diesem Prozess eine Rolle spielen könnte. ⓘ
Diagnose

Die Diagnose der altersbedingten Makuladegeneration hängt von den Anzeichen in der Makula ab, nicht unbedingt vom Sehvermögen. Eine frühzeitige Diagnose der AMD kann eine weitere Verschlechterung des Sehvermögens verhindern und die Sehkraft möglicherweise verbessern. ⓘ
Die Diagnose der trockenen AMD (oder eines frühen Stadiums) kann die folgenden klinischen Untersuchungen sowie Verfahren und Tests umfassen:
- Der Übergang von trockener zu feuchter AMD kann rasch erfolgen und unbehandelt bereits nach sechs Monaten zur Erblindung führen. Um dies zu verhindern und präventive Strategien in einem früheren Stadium des Krankheitsprozesses einzuleiten, kann ein Dunkeladaptationstest durchgeführt werden. Mit einem Dunkeladaptometer kann eine subklinische AMD mindestens drei Jahre früher erkannt werden, als sie klinisch sichtbar ist.
- Es kommt zu einem Verlust der Kontrastempfindlichkeit, so dass Konturen, Schatten und Farben weniger deutlich zu sehen sind. Der Verlust der Kontrastempfindlichkeit kann schnell und einfach mit einem Kontrastempfindlichkeitstest wie dem Pelli-Robson-Test gemessen werden, der entweder zu Hause oder von einem Augenarzt durchgeführt wird.
- Bei der Betrachtung eines Amsler-Gitters erscheinen einige gerade Linien gewellt und einige Felder leer.
- Bei der Betrachtung einer Snellen-Tafel nehmen mindestens 2 Linien ab.
- Bei trockener Makuladegeneration, die in 85-90 Prozent der AMD-Fälle auftritt, sind Drusenflecken auf der Fundusfotografie zu sehen.
- Mit Hilfe eines Elektroretinogramms können Punkte in der Makula mit einer schwachen oder fehlenden Reaktion im Vergleich zu einem normalen Auge gefunden werden
- Farnsworth-Munsell 100 hue test und Maximum Color Contrast Sensitivity test (MCCS) zur Beurteilung der Farbschärfe und der Farbkontrasteinstellung
- Die optische Kohärenztomographie wird heute von den meisten Augenärzten bei der Diagnose und der Verlaufsbeurteilung des Ansprechens auf die Behandlung mit antiangiogenen Medikamenten eingesetzt. ⓘ
Die Diagnose der feuchten AMD (oder eines späten Stadiums) kann zusätzlich zu den oben genannten Tests folgende Untersuchungen umfassen
- Bevorzugte Hyperakuitätsperimetrie-Veränderungen (bei feuchter AMD). Die präferentielle Hyperakuitätsperimetrie ist ein Test, mit dem drastische Veränderungen des Sehvermögens festgestellt werden können. Dabei wird die Makula mit verzerrten Punktmustern stimuliert, und der Patient gibt an, an welcher Stelle des Gesichtsfelds dies geschieht.
- Bei feuchter Makuladegeneration kann die Angiografie den Blutaustritt hinter der Makula sichtbar machen. Die Fluorescein-Angiografie ermöglicht die Identifizierung und Lokalisierung abnormaler Gefäßprozesse. ⓘ
Zur frühzeitigen, überschlägigen Diagnostik eignet sich der Amsler-Gitter-Test, der auch von den Patienten selbst durchgeführt werden kann. Dabei wird das jeweils andere Auge mit der flachen Hand bei einer Distanz von etwa 40–50 cm vollständig abgedeckt. Sollte man scheinbare Löcher, dunkle Stellen oder Verkrümmungen der Rasterlinien bemerken, ist ein sofortiger Besuch beim Augenarzt anzuraten. Darüber hinaus ist eine detaillierte Untersuchung des zentralen Gesichtsfeldes mittels Perimetrie angezeigt. ⓘ
Für die differenziertere Diagnostik eignen sich Verfahren der Scanning-Laser-Ophthalmoskopie (bspw. Heidelberg Retina Tomograph), der optischen Kohärenztomografie, die Fluoreszenzangiografie oder hochauflösende Mikroskopieuntersuchungen. ⓘ
Histologie
- Pigmentveränderungen in der Netzhaut - Zusätzlich zu den Pigmentzellen in der Iris (dem farbigen Teil des Auges) gibt es auch Pigmentzellen unter der Netzhaut. Wenn diese Zellen zerfallen und ihr Pigment freisetzen, können dunkle Klumpen des freigesetzten Pigments und später Bereiche mit geringerer Pigmentierung auftreten
- Exsudative Veränderungen: Hämorrhagien im Auge, harte Exsudate, subretinale/sub-RPE/intraretinale Flüssigkeit
- Drusen, winzige Ansammlungen von extrazellulärem Material, die sich auf der Netzhaut ablagern. Es besteht zwar die Tendenz, Drusen für den fortschreitenden Verlust des Sehvermögens verantwortlich zu machen, doch können Drusenablagerungen in der Netzhaut auch ohne Sehverlust vorhanden sein. Einige Patienten mit großen Drusenablagerungen haben eine normale Sehschärfe. Wenn in einer Netzhaut mit hohen Drusenkonzentrationen manchmal eine normale Netzhautrezeption und Bildübertragung möglich sind, dann muss es, selbst wenn Drusen für den Verlust der Sehfunktion verantwortlich gemacht werden können, mindestens einen anderen Faktor geben, der für den Verlust des Sehvermögens verantwortlich ist. ⓘ
Vorbeugung
Ein Cochrane-Review aus dem Jahr 2017 ergab, dass die Einnahme von Vitamin- und Mineralstoffpräparaten, allein oder in Kombination, in der Allgemeinbevölkerung keinen Einfluss darauf hat, ob eine AMD beginnt oder nicht. ⓘ
Der Verzicht auf das Rauchen, die Aufnahme von Fisch in die Ernährung und die Aufrechterhaltung eines gesunden Gewichts können ebenfalls AMD vorbeugen. ⓘ
Behandlung
Die Behandlung der AMD hängt von der Kategorie der Krankheit zum Zeitpunkt der Diagnose ab. Im Allgemeinen zielt die Behandlung darauf ab, das Fortschreiten der AMD zu verlangsamen. Bis zum Jahr 2018 gibt es keine Behandlung, die die Auswirkungen der AMD rückgängig macht. Bei AMD im frühen und mittleren Stadium werden bekannte Risikofaktoren wie Raucherentwöhnung, Behandlung von Bluthochdruck und Atherosklerose sowie Ernährungsumstellung behandelt. Bei AMD im mittleren Stadium umfasst die Behandlung auch die Einnahme von Antioxidantien und Mineralien. Die Behandlung der fortgeschrittenen AMD richtet sich nach dem Vorhandensein von choroidalen Neovaskularisationen (CNV): trockene AMD (keine CNV) oder feuchte AMD (CNV). Für die trockene AMD gibt es keine wirksamen Behandlungen. Die CNV bei feuchter AMD wird mit Hemmstoffen des vaskulären endothelialen Wachstumsfaktors (VEGF) behandelt. Die tägliche Verwendung eines Amsler-Gitters oder anderer Hilfsmittel zur Überwachung des Sehvermögens zu Hause kann dazu dienen, die Entwicklung einer verzerrten Sicht zu überwachen, die ein Zeichen für das Fortschreiten der Krankheit sein kann. ⓘ
Vitamin- und Mineralstoffergänzung
Die Studien 1 und 2 zu altersbedingten Augenerkrankungen (AREDS) haben gezeigt, dass Menschen mit beidseitiger früher oder mittlerer AMD oder mittlerer AMD auf einem Auge und fortgeschrittener AMD auf dem anderen Auge von einer spezifischen Vitamin- und Mineralstoffergänzung profitieren können. Bei den spezifischen Vitaminen und Mineralien in AREDS-1 handelt es sich um Vitamin C (500 mg), Zink (80 mg), Vitamin E (400 IE), Kupfer (2 mg) und Beta-Carotin (15 mg). In der AREDS-2-Formulierung wurde Beta-Carotin durch Lutein (10 mg) und Zeaxanthin (2 mg) ersetzt, da bei Rauchern, die Beta-Carotin einnehmen, ein Lungenkrebsrisiko besteht. Diese spezifischen Mikronährstoffergänzungen wurden mit einem geringeren Risiko des Fortschreitens zu schwereren Formen der AMD und einer besseren Sehschärfe nach 5 Jahren in Verbindung gebracht. Es gibt keine Belege dafür, dass eine Mikronährstoffsupplementierung das Fortschreiten der AMD bei Menschen mit schwerer Erkrankung oder den Ausbruch der Krankheit bei Menschen ohne AMD verhindert. ⓘ
Trockene AMD
Es gibt keine Heilung für trockene AMD. Zwar besteht ein zunehmendes akademisches und pharmazeutisches Interesse an der Entwicklung von Komplementinhibitoren zur Behandlung von Augenentzündungen, und es laufen mehrere klinische Studien zur trockenen AMD, doch der erste Wirkstoff, der die Phase-3-Studien bei AMD abschließen konnte (der Wirkstoff Lampalizumab, der gegen Faktor D gerichtet ist), führte nicht zu einer signifikanten Verbesserung der Krankheitsprogressionsrate. Dennoch gibt es derzeit Strategien, die auf verschiedene Aspekte des Komplementsystems abzielen. ⓘ
Feuchte AMD
Ranibizumab, Aflibercept, Brolucizumab und Faricimab sind zugelassene VEGF-Inhibitoren für die Behandlung der CNV bei feuchter AMD. Alle drei Medikamente werden mittels intravitrealer Injektion verabreicht, das heißt, sie werden direkt ins Auge gespritzt. Bevacizumab ist ein weiterer VEGF-Hemmer, der nachweislich eine ähnliche Wirksamkeit und Sicherheit wie die beiden anderen Medikamente aufweist, aber derzeit nicht für die AMD zugelassen ist. Die AMD kann auch mit einer Laserkoagulationstherapie behandelt werden. ⓘ
In einer randomisierten Kontrollstudie wurde festgestellt, dass Bevacizumab und Ranibizumab ähnlich wirksam sind und dass Bevacizumab keine signifikante Zunahme unerwünschter Ereignisse mit sich bringt. Ein Cochrane-Review aus dem Jahr 2014 ergab, dass die systemische Sicherheit von Bevacizumab und Ranibizumab bei der Behandlung der neovaskulären AMD ähnlich ist, mit Ausnahme von gastrointestinalen Störungen. Bevacizumab ist jedoch nicht von der FDA für die Behandlung der Makuladegeneration zugelassen. Eine Kontroverse im Vereinigten Königreich betraf den Off-Label-Einsatz des billigeren Bevacizumab gegenüber dem zugelassenen, aber teuren Ranibizumab. Ranibizumab ist ein kleineres Fragment, das Fab-Fragment, des Bevacizumab-Moleküls, das speziell für die Injektion ins Auge entwickelt wurde. Weitere zugelassene antiangiogene Medikamente für die Behandlung der neovaskulären AMD sind Pegaptanib und Aflibercept. ⓘ
Diese Anti-VEGF-Mittel können monatlich oder adaptiv verabreicht werden. Bei der adaptiven Anti-VEGF-Behandlung werden üblicherweise zwei Ansätze verfolgt. Bei der pro re nata-Behandlung kommt der Patient in festen Abständen, aber die Behandlung wird nur verabreicht, wenn eine Aktivität (d. h. das Vorhandensein von Flüssigkeit) festgestellt wird. Beim Treat-and-Extend-Verfahren werden die Patienten immer behandelt, aber das Intervall bis zum nächsten Besuch wird verlängert, wenn die Läsion inaktiv war. In jüngster Zeit haben Forscher damit begonnen, KI-Algorithmen zur Vorhersage des künftigen Behandlungsbedarfs einzusetzen. Diese Ansätze sind jedoch bis heute nicht für den klinischen Einsatz validiert worden. ⓘ
Die Praxisrichtlinien der American Academy of Ophthalmology empfehlen die Laserkoagulationstherapie bei Makuladegeneration nicht, erklären aber, dass sie bei Menschen mit neuen Blutgefäßen in der Aderhaut außerhalb der Fovea, die nicht auf eine medikamentöse Behandlung ansprechen, nützlich sein kann. Es gibt deutliche Hinweise darauf, dass die Laserkoagulation zum Verschwinden von Drusen führt, die choroidale Neovaskularisation jedoch nicht beeinflusst. Eine Cochrane-Review aus dem Jahr 2007 ergab, dass die Laser-Photokoagulation neuer Blutgefäße in der Aderhaut außerhalb der Fovea eine wirksame und wirtschaftliche Methode ist, dass aber die Vorteile für Gefäße in der Nähe oder unterhalb der Fovea begrenzt sind. ⓘ
Die photodynamische Therapie wurde auch zur Behandlung der feuchten AMD eingesetzt. Das Medikament Verteporfin wird intravenös verabreicht; anschließend wird Licht einer bestimmten Wellenlänge auf die abnormen Blutgefäße gerichtet. Dadurch wird das Verteporfin aktiviert und die Gefäße werden zerstört. ⓘ
Eine Kataraktoperation könnte die Sehkraft von Menschen mit AMD verbessern, obwohl es Bedenken gibt, dass die Operation das Fortschreiten der AMD beschleunigen könnte. Eine randomisierte, kontrollierte Studie ergab, dass Menschen, die sich einer sofortigen Kataraktoperation (innerhalb von zwei Wochen) unterzogen, eine bessere Sehschärfe und eine bessere Lebensqualität aufwiesen als diejenigen, die sich einer verzögerten Kataraktoperation (6 Monate) unterzogen. ⓘ
Eine Strahlentherapie wurde zur Behandlung der feuchten AMD vorgeschlagen, doch die Beweise für den Einsatz der modernen stereotaktischen Strahlentherapie in Kombination mit Anti-VEGF sind derzeit noch ungewiss und die Ergebnisse laufender Studien stehen noch aus. ⓘ
Nukleosidische Reverse-Transkriptionshemmer, wie sie in der Anti-HIV-Therapie eingesetzt werden, wurden mit einem geringeren Risiko für die Entwicklung einer atrophischen Makuladegeneration in Verbindung gebracht. Dies ist darauf zurückzuführen, dass Alu-Elemente im Zytoplasma eine L1 (Protein)-vermittelte reverse Transkription erfahren, die zur DNA-Synthese führt. Erste klinische Versuche werden ab Januar 2021 vorbereitet. ⓘ
Weitere Hemmer des Gefäßwachstums sind Cortistatine. In einer Studie, die in der Fachzeitschrift Ophthalmology erschien, wurde die Hypothese unterstützt, dass Menschen, die regelmäßig (mindestens einmal pro Woche) fetthaltigen Fisch verzehren, ein geringeres Risiko tragen, an der altersbedingten Makuladegeneration zu erkranken. Hierbei handele es sich um den Verzehr von Fisch mit einem hohen Anteil an Omega-3-Fettsäuren wie etwa Lachs, Makrele oder Weißer Thun. Hohe Dosen der antioxidantisch wirkenden Vitamine C und E, Beta-Carotin und Zink könnten den krankhaften Verlauf bei Makuladegeneration wirksam verlangsamen. ⓘ
Adaptive Geräte

Da das periphere Sehen nicht beeinträchtigt ist, können Menschen mit Makuladegeneration lernen, ihr verbliebenes Sehvermögen zu nutzen, um es teilweise zu kompensieren. In vielen Ländern und in jedem Bundesstaat der USA gibt es Unterstützung und Hilfsmittel. Es werden Kurse für ein "unabhängiges Leben" angeboten, und einige Technologien können bei den staatlichen Rehabilitationsbehörden erworben werden. ⓘ
Anpassungsfähige Geräte können Menschen beim Lesen helfen. Dazu gehören Lupen, spezielle Brillengläser, Bildschirmlesegeräte, elektronische Brillen und TV-Systeme, die das Lesematerial vergrößern. ⓘ
Computer-Bildschirmlesegeräte wie JAWS oder Thunder funktionieren mit Standard-Windows-Computern. Auch Apple-Geräte bieten eine breite Palette von Funktionen (Voice-Over, Bildschirmleser, Braille-Schrift usw.). ⓘ
Videokameras können in Standard- oder Spezialcomputermonitore eingespeist werden, und das Bild kann vergrößert und verkleinert werden. Diese Systeme umfassen häufig einen beweglichen Tisch, auf dem das Schriftmaterial bewegt werden kann. ⓘ
Das barrierefreie Verlagswesen bietet größere Schriftarten für gedruckte Bücher, Muster zur Erleichterung der Verfolgung, Hörbücher und DAISY-Bücher mit Text und Ton. ⓘ
Epidemiologie

Die Prävalenz jeder altersbedingten Makuladegeneration ist bei Europäern höher als bei Asiaten und Afrikanern. Es gibt keinen Unterschied in der Prävalenz zwischen Asiaten und Afrikanern. Die Inzidenz der altersbedingten Makuladegeneration und ihrer Begleiterscheinungen nimmt mit dem Alter zu und ist bei Personen unter 55 Jahren gering. Rauchen ist der stärkste modifizierbare Risikofaktor. Im Jahr 2008 war die altersbedingte Makuladegeneration für mehr als 54 % aller Sehkraftverluste in der weißen Bevölkerung in den USA verantwortlich. Schätzungsweise 8 Millionen Amerikaner sind von einer frühen altersbedingten Makuladegeneration betroffen, von denen über 1 Million innerhalb der nächsten 5 Jahre eine fortgeschrittene altersbedingte Makuladegeneration entwickeln werden. Im Vereinigten Königreich ist die altersbedingte Makuladegeneration die Ursache für die Erblindung von fast 42 % der Erblindeten im Alter von 65 bis 74 Jahren, von fast zwei Dritteln der 75- bis 84-Jährigen und von fast drei Vierteln der 85-Jährigen und Älteren. ⓘ
Forschungsrichtungen
Zusammenhang mit anderen altersbedingten Krankheiten
Studien deuten darauf hin, dass Drusen, die mit AMD assoziiert sind, in ihrer molekularen Zusammensetzung den Amyloid-beta (Aβ)-Plaques und -Ablagerungen bei anderen altersbedingten Krankheiten wie der Alzheimer-Krankheit und Atherosklerose ähnlich sind. Dies deutet darauf hin, dass bei der Entstehung von AMD und anderen altersbedingten Krankheiten ähnliche Mechanismen eine Rolle spielen könnten. Die AMD hat auch mehrere genetische und umweltbedingte Risikofaktoren mit den Nieren gemeinsam, die eine ähnliche Struktur wie das Auge haben. ⓘ
Genetische Tests
Mit Hilfe von Gentests kann festgestellt werden, ob ein Patient mit AMD ein erhöhtes Risiko hat, die Krankheit zu entwickeln, und es können Informationen über den Krankheitsverlauf gewonnen werden. Mit Hilfe von Gentests können Forscher auch feststellen, ob Patienten eher oder weniger auf Behandlungen wie Anti-VEGF-Medikamente oder Komplementinhibitoren ansprechen. Es gibt jedoch nach wie vor mehrere Probleme bei der Verwendung von prädiktiven Instrumenten, die genetische Variationen in der klinischen Praxis berücksichtigen. Wir verstehen nur begrenzt, wie verschiedene genetische Varianten und Umweltfaktoren das AMD-Risiko beeinflussen, und die in der Bevölkerung verbreiteten Einzelnukleotid-Polymorphismen haben nur geringe Auswirkungen auf einzelne Patienten mit AMD. Daher besteht ein zunehmendes Interesse daran, die funktionellen Folgen seltener Mutationen zu verstehen, die oft ausgeprägtere Auswirkungen haben. Genetische Tests zur Steuerung des klinischen Managements werden derzeit nicht empfohlen. ⓘ
Stammzellentransplantation
Zellbasierte Therapien mit Stammzellen aus dem Knochenmark sowie die Transplantation von retinalen Pigmentepithelzellen werden derzeit untersucht. Eine Reihe von Versuchen wurde am Menschen mit ermutigenden Ergebnissen durchgeführt. ⓘ
Genom-Editierung
CRISPR-Cas9-Genom-Editing kann zur Behandlung der feuchten altersbedingten Makuladegeneration, die durch VEGFA verursacht wird, eingesetzt werden. Die Wissenschaftler haben einen Ansatz beschrieben, bei dem manipulierte Lentiviren in die betroffenen anatomischen Regionen injiziert werden, um eine vorübergehende Genom-Editierung durchzuführen, die den Bereich der choroidalen Neovaskularisation um 63 % reduzieren könnte, ohne unerwünschte Off-Target-Editierungen oder Anti-Cas9-Immunreaktionen auszulösen. ⓘ
Andere Arten
Es gibt noch einige andere (seltene) Formen der Makuladegeneration mit ähnlichen Symptomen, die jedoch nicht mit der feuchten oder trockenen altersbedingten Makuladegeneration in Verbindung stehen. Es handelt sich dabei um genetische Störungen, die in der Kindheit oder im mittleren Alter auftreten können.
- Vitelliforme Makuladystrophie
- Die Sorsby-Fundusdystrophie ist eine autosomal dominante Netzhauterkrankung, die durch einen plötzlichen Sehkraftverlust infolge einer unbehandelbaren submakulären Neovaskularisation gekennzeichnet ist.
- Die Stargardt-Krankheit (juvenile Makuladegeneration, STGD) ist eine autosomal rezessive Netzhauterkrankung, die durch eine Makuladystrophie im Jugendalter, Veränderungen der peripheren Netzhaut und subretinale Ablagerungen von lipofuszinähnlichem Material gekennzeichnet ist.
Ähnliche Symptome mit einer ganz anderen Ätiologie und einer anderen Behandlung können durch eine epiretinale Membran oder einen Makula-Pucker oder eine andere die Makula betreffende Erkrankung, wie z. B. eine zentrale seröse Retinopathie, verursacht werden. ⓘ
Bemerkenswerte Fälle
- Judi Dench
- Joan Plowright
- Peter Sallis
- June Brown
- S. Robert Morgan ⓘ
Formen
Feuchte Makuladegeneration
Bei der feuchten (exsudativen) Makuladegeneration bilden sich unter der Netzhaut flächige Gefäßmembranen aus (Choroidale Neovaskularisationen, CNV), die zu Flüssigkeitsansammlungen oder Blutungen neigen. Diese Form der Makuladegeneration führte früher schnell zur Leseblindheit. Inzwischen steht mit VEGF-Hemmstoffen jedoch eine effiziente Behandlungsmöglichkeit zur Verfügung. ⓘ
Im Endstadium kommt es zu einer ausgedehnten narbigen Umwandlung der Macula lutea, die zur Entstehung einer prominenten, oft unterbluteten Läsion – der sogenannten „Junius-Kuhnt-Narbe“ – führt. ⓘ
In äußerst seltenen Fällen können sich auch bei einer Retinopathia centralis serosa (RCS) Gefäßmembrane bilden, die dann ebenfalls wie eine feuchte Makuladegeneration behandelt werden müssen. ⓘ
Funktionelle Auswirkungen
Die Schädigung der Makula kann zur
- Abnahme der Sehschärfe und damit der Lesefähigkeit,
- Abnahme des Kontrastempfindens,
- Abnahme des Farbensehens,
- Abnahme der Anpassungsfähigkeit an veränderte Lichtverhältnisse (Adaption),
- Erhöhung der Blendungsempfindlichkeit und zu
- zentralen Gesichtsfeldausfällen
führen. ⓘ
Fixiert der Betroffene einen Gegenstand, so ist es nicht mehr möglich, ihn deutlich zu erkennen. So kann der Betroffene eine Uhr sehen, aber die Uhrzeit nicht erkennen oder einen Gesprächspartner sehen, nicht aber dessen Gesichtszüge. Erkrankungsalter und Ausprägung der Symptome variieren und hängen von der Erkrankungsform ab. ⓘ
Da die Erkrankung in der Regel auf die Makula beschränkt ist, bleibt das äußere Gesichtsfeld und somit die Orientierungsmöglichkeit der Betroffenen erhalten. Auch bei Dunkelheit sehen die Betroffenen in der Regel relativ gut, da die Stäbchen außerhalb der zentralen Netzhaut funktionstüchtig bleiben. ⓘ
Von den Makuladegenerationen abzugrenzen sind Degenerationen der peripheren Netzhautanteile (zum Beispiel Retinitis Pigmentosa, RP). ⓘ
Therapien und Vorbeugung
Bei der Therapie muss zwischen der feuchten und der trockenen Form der Makuladegeneration unterschieden werden. Bei der trockenen AMD sind vorbeugende Maßnahmen sinnvoll. Nikotin und Alkohol sollen vermieden werden, sie sind Gift für das Auge; langandauernder Stress ebenso. Die Phototoxizität von kaltweißen LED-Leuchtmitteln, und die Förderung der Makuladegeneration, konnte bei Versuchen an Ratten nachgewiesen werden. UV-Licht sollte abgeschirmt werden und eine Ernährung mit augenschützenden Inhaltsstoffen ist zu bevorzugen. Die feuchte Form kann zu einem sehr schnellen Verlust der Sehkraft führen. Deshalb versuchen Augenärzte, die Gefäße, die zur Makula sprießen, mit intravitrealer operativer Medikamentengabe (IVOM) zurückzudrängen bzw. mit einer Lasertherapie oder einer photodynamischen Therapie zu veröden. Dadurch soll das Fortschreiten der Krankheit verhindert werden. Die verlorene Sehkraft kann lediglich bei rechtzeitiger Therapie mit Anti-VEGF-IVOM und auch nur bei einem Teil der betroffenen Augen teilweise oder vollständig wiederhergestellt werden. ⓘ
Sehhilfen bei Makuladegeneration
Zur Verbesserung der Lesefähigkeit in Ferne und Nähe dienen vergrößernde Sehhilfen. Das Hilfsmittelspektrum reicht von der einfachen Handlupe über Lupen- und Fernrohrbrillen bis hin zu elektronisch vergrößernden Sehhilfen wie Bildschirmlesegeräten. Spezialfiltergläser, die sogenannten Kantenfilter oder Blaublocker, können das Sehen ebenfalls verbessern. Bei Bildschirmtätigkeiten am PC können Text- und Bildvergrößerungs-Tools hilfreich sein. Wichtig ist die optimale Anpassung und Erprobung der Sehhilfen bei einem Spezialisten wie Sehbehindertenambulanzen, Blindenstudienanstalten, spezialisierten Augenarztpraxen oder Augenoptikern. Zunehmend qualifizieren sich auch Orthoptisten im Bereich des Low-Vision-Trainings. ⓘ
Beratung und Unterstützung im Alltag
Low-Vision-Fachkräfte
Low-Vision-Fachkräfte unterstützen Betroffene darin, vorhandenes Sehvermögen durch Hilfsmittel oder durch spezielle Techniken optimal zu nutzen. ⓘ
Fachpersonen für Orientierung und Mobilität
Betroffene Personen können gemeinsam mit Fachpersonen für Orientierung und Mobilität erarbeiten, wie sie sich am besten im Alltagsleben, beispielsweise in der Stadt oder im öffentlichen Verkehr fortbewegen können. ⓘ
Fachpersonen für Lebenspraktische Fertigkeiten
Fachpersonen für Lebenspraktische Fertigkeiten zeigen den Betroffenen Hilfsmittel und Strategien für alltägliche Situationen, wie beispielsweise das Kochen. ⓘ
Ergotherapie
In der Ergotherapie werden Betroffene darin unterstützt, möglichst lange selbstständig zu bleiben. Alltagsaktivitäten wie das Lesen oder Haushaltstätigkeiten werden gemeinsam mit den Betroffenen analysiert. Strategien und der Einsatz von Hilfsmitteln werden entwickelt. Besonders bei älteren, sturzgefährdeten Menschen mit Makuladegeneration können Ergotherapeutinnen und Ergotherapeuten Unterstützung zur Sturzprävention bieten. Sie können abklären, wie die Wohnungseinrichtung zur Verhinderung von Stürzen beitragen kann und praktische Maßnahmen empfehlen. ⓘ
Siehe auch
- Morbus Stargardt
- EEM-Syndrom ⓘ
Literatur
- Ronald D. Gerste: AMD-Ratgeber. Altersabhängige Makuladegeneration: was sie bedeutet, wie man ihr vorbeugt, wie man sie behandelt. Verlag ad manum medici. Germering 2011, ISBN 978-3-928027-34-2.
- J. Donald, M. Gass: Stereoscopic atlas of macular diseases. 1997, ISBN 0-8151-3416-9.
- L. Wendt: Das Krankheitssymptom der Arteriosklerose. In: Ärztezeitschrift für Naturheilverfahren. 27, 1986, S. 137–164.
- L. Wendt, Th. Wendt: Überfüllung des Eiweißspeichers kann Folgekrankheiten bewirken. In: natura-med. 10, 1990, S. 455–460.
- Andreas Schaufler: Low Vision. DOZ Verlag, Heidelberg 2012, ISBN 978-3-942873-06-2.
- Erika Wegscheider: Die Altersbedingte Makuladegeneration und deren Therapie: Ein Fallbeispiel aus der Augenheilkunde. In: Chinesische Medizin. 2012;2, S. 88–96.
- Gerd Antes u. a.: Therapie der altersabhängigen Makuladegeneration. Evidenzbericht. Bremen/Freiburg 2009 (hta.uni-bremen.de PDF; 697 kB). ⓘ
Studien (Auswahl)
Referenzierte Studien zur Makuladegeneration sind unter anderem:
- JR Evans, JG Lawrenson; Antioxidant vitamin and mineral supplements for slowing the progression of age-related macular degeneration (Review), Cochrane Database of Systematic Reviews. Juli 2017.
- EY Chew et al; National Eye Institute (NEI). Age-Related Eye Disease Study 2 (AREDS2): Lutein + zeaxanthin and omega-3 fatty acids for age-related macular degeneration: The Age-Related Eye Disease Study 2 (AREDS2) - Randomized clinical trial. Mai 2013.
- AY Lee, Butt T, Chew E, et al.: Cost-effectiveness of age-related macular degeneration study supplements in the UK: combined trial and real-world outcomes data. 2017. ⓘ