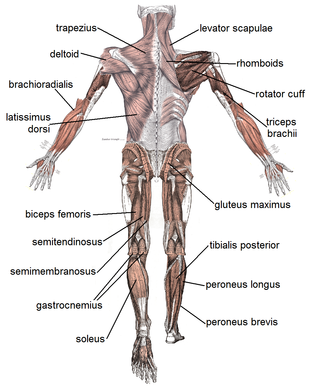
Skelettmuskel
| Skelettmuskel ⓘ | |
|---|---|
 Der Skelettmuskel in der Draufsicht | |
| Einzelheiten | |
| Synonyme | Gestreifter Skelettmuskel / Gestreifter willentlicher Muskel |
| System | Muskelsystem |
| Bezeichner | |
| Lateinisch | muscularis skeletalis |
| Anatomische Terminologie [Bearbeiten auf Wikidata] | |
Skelettmuskeln (allgemein als Muskeln bezeichnet) sind Organe der Wirbeltiermuskulatur, die meist durch Sehnen an den Knochen des Skeletts befestigt sind. Die Muskelzellen der Skelettmuskeln sind viel länger als die anderer Arten von Muskelgewebe und werden oft als Muskelfasern bezeichnet. Das Muskelgewebe eines Skelettmuskels ist quergestreift - aufgrund der Anordnung der Sarkomere hat es ein gestreiftes Aussehen. ⓘ
Skelettmuskeln sind willkürliche Muskeln, die durch das somatische Nervensystem gesteuert werden. Die anderen Muskeltypen sind der Herzmuskel, der ebenfalls quergestreift ist, und die glatte Muskulatur, die nicht quergestreift ist; beide Arten von Muskelgewebe werden als unwillkürlich eingestuft oder stehen unter der Kontrolle des autonomen Nervensystems. ⓘ
Ein Skelettmuskel enthält mehrere Faszikel - Bündel von Muskelfasern. Jede einzelne Faser und jeder Muskel ist von einer Art Bindegewebsschicht, den Faszien, umgeben. Muskelfasern entstehen durch die Verschmelzung von sich entwickelnden Myoblasten in einem Prozess, der als Myogenese bezeichnet wird und zu langen Zellen mit mehreren Kernen führt. In diesen Zellen befinden sich die als Myonuklei bezeichneten Kerne entlang der Innenseite der Zellmembran. Muskelfasern haben auch mehrere Mitochondrien, um den Energiebedarf zu decken. ⓘ
Die Muskelfasern sind wiederum aus Myofibrillen aufgebaut. Die Myofibrillen bestehen aus Aktin- und Myosinfilamenten, den so genannten Myofilamenten, die sich in Einheiten, den so genannten Sarkomeren, wiederholen und die die grundlegenden funktionellen, kontraktilen Einheiten der Muskelfaser darstellen, die für die Muskelkontraktion erforderlich sind. Die Muskeln werden hauptsächlich durch die Oxidation von Fetten und Kohlenhydraten angetrieben, aber auch anaerobe chemische Reaktionen werden genutzt, insbesondere von den schnell zuckenden Fasern. Bei diesen chemischen Reaktionen werden Adenosintriphosphatmoleküle (ATP) erzeugt, die für die Bewegung der Myosinköpfe verwendet werden. ⓘ
Die Skelettmuskeln kann man in rote und weiße Muskulatur unterteilen. Die rote Muskulatur, die ihre Rotfärbung einem höheren Gehalt an Muskelfasern mit oxidativer Energiegewinnung verdankt, ist eher für die ausdauernden Bewegungen zuständig (überwiegt also bei Ausdauersportlern). Die weiße Muskulatur kann schneller kontrahieren und stärkere Bewegungen ausführen (bildet also bei Kraftsportlern einen erheblichen Teil der Muskelmasse). ⓘ
Die Skelettmuskeln sind über Sehnen oder Faszien am Skelett befestigt. Man unterscheidet Ursprung und Ansatz, dazwischen liegt der Muskelbauch. ⓘ
Aufbau


Ein Skelettmuskel besteht aus mehreren Muskelfaserbündeln, die jeweils aus einzelnen Muskelfasern bestehen, die bis zu 15 cm lang sein können (im Schneidermuskel des Oberschenkels sogar bis zu 30 oder gar 40 cm) und außen von Bindegewebe, der Faszie, umhüllt sind. Ein Skelettmuskel ist in seiner Gesamtheit von Bindegewebe umgeben (Epimysium), von dem sogenannte Septen in das Innere ziehen, und sowohl die einzelnen Muskelfasern umhüllen (Endomysium) als auch Gruppen von Muskelfasern zu Muskelfaserbündeln zusammenfassen (Perimysium). ⓘ
Jede Muskelfaser ist aus Tausenden fadenförmiger Strukturen aufgebaut, den sogenannten Myofibrillen. Diese durchziehen nebeneinander die Muskelfaser der Länge nach und sind aus kleineren Einheiten aufgebaut, den Myofilamenten. In diesen Eiweißstrukturen verläuft die Muskelkontraktion durch gegenseitiges Ineinanderschieben. Die Anordnung der Myofilamente in den Sarkomeren bedingt die mikroskopisch sichtbare Querstreifung der Muskelfasern. ⓘ
Zu unterscheiden von der Skelettmuskulatur ist die glatte Muskulatur, die für die unwillkürlichen Bewegungen des Magen-Darm-Traktes, die Erweiterung der Blutgefäße etc. zuständig ist. ⓘ
Grobe Anatomie
Im menschlichen Körper gibt es mehr als 600 Skelettmuskeln, die etwa 40 bis 50 % des Körpergewichts ausmachen. Die meisten Muskeln treten in beidseitig angeordneten Paaren auf und dienen beiden Seiten des Körpers. Muskeln werden oft als Gruppen von Muskeln bezeichnet, die zusammenarbeiten, um eine bestimmte Aktion auszuführen. Im Rumpf gibt es mehrere große Muskelgruppen, darunter die Brust- und die Bauchmuskeln; intrinsische und extrinsische Muskeln sind Unterteilungen von Muskelgruppen in der Hand, im Fuß, in der Zunge und in den extraokularen Muskeln des Auges. Die Muskeln werden auch in Kompartimente unterteilt, darunter vier Gruppen im Arm, und die vier Gruppen in den Beinen. ⓘ
Neben dem kontraktilen Teil eines Muskels, der aus seinen Fasern besteht, enthält ein Muskel einen nicht kontraktilen Teil aus dichtem faserigem Bindegewebe, das an jedem Ende die Sehne bildet. Die Sehnen verbinden die Muskeln mit den Knochen, um die Bewegung des Skeletts zu ermöglichen. Die Länge eines Muskels schließt die Sehnen mit ein. Bindegewebe ist in allen Muskeln als tiefe Faszie vorhanden. Die tiefe Faszie ist innerhalb der Muskeln so spezialisiert, dass sie jede Muskelfaser als Endomysium, jeden Muskelfaszikel als Perimysium und jeden einzelnen Muskel als Epimysium umschließt. Zusammen werden diese Schichten als Mysien bezeichnet. Die tiefe Faszie trennt auch die Muskelgruppen in Muskelkompartimente. ⓘ
Zwei Arten von Sinnesrezeptoren in den Muskeln sind die Muskelspindeln und die Golgi-Sehnenorgane. Muskelspindeln sind Dehnungsrezeptoren, die sich im Muskelbauch befinden. Golgi-Sehnen-Organe sind Propriozeptoren, die sich an der myotendinösen Verbindung befinden und die Spannung des Muskels anzeigen. ⓘ
Skelettmuskelfasern

Skelettmuskelzellen sind die einzelnen kontraktilen Zellen innerhalb eines Muskels und werden oft als Muskelfasern bezeichnet. Ein einzelner Muskel wie der Bizeps eines jungen erwachsenen Mannes enthält etwa 253.000 Muskelfasern. ⓘ
Skelettmuskelfasern sind die einzigen Muskelzellen, die aus mehreren Kernen bestehen, wobei die Kerne oft als Myonuklei bezeichnet werden. Dies geschieht während der Myogenese durch die Verschmelzung von Myoblasten, die jeweils einen Kern beisteuern. Die Fusion hängt von muskelspezifischen Proteinen ab, den so genannten Fusogenen, auch Myomaker und Myomerger genannt. ⓘ
Die Skelettmuskelzelle benötigt viele Kerne für die großen Mengen an Proteinen und Enzymen, die für die normale Funktion der Zelle produziert werden müssen. Eine einzige Muskelfaser kann Hunderte bis Tausende von Zellkernen enthalten. Eine Muskelfaser, zum Beispiel im menschlichen Bizeps mit einer Länge von 10 cm, kann bis zu 3000 Kerne haben. Anders als in einer Nicht-Muskelzelle, wo der Kern zentral angeordnet ist, ist der Myonukleus länglich und befindet sich in der Nähe des Sarkolemmas. Die Myonuklei sind recht gleichmäßig entlang der Faser angeordnet, wobei jeder Kern seine eigene myonukleäre Domäne hat, in der er für die Unterstützung des Zytoplasma-Volumens in diesem bestimmten Abschnitt der Myofaser verantwortlich ist. ⓘ
Zwischen der Basalmembran und dem Sarkolemm der Muskelfasern befindet sich eine Gruppe von Muskelstammzellen, die als Myosatellitenzellen oder Satellitenzellen bezeichnet werden. Diese Zellen befinden sich normalerweise im Ruhezustand, können aber durch körperliche Anstrengung oder Pathologie aktiviert werden, um zusätzliche Myonuklei für das Muskelwachstum oder die Reparatur bereitzustellen. ⓘ
Anheftung an Sehnen
Die Muskeln setzen an den Sehnen in einem komplexen Übergangsbereich an, der als muskulotendinöser Übergang oder auch als myotendinöser Übergang bezeichnet wird und auf die primäre Kraftübertragung spezialisiert ist. An der Schnittstelle zwischen Muskel und Sehne wird die Kraft von den Sarkomeren in den Muskelzellen auf die Sehne übertragen. Muskeln und Sehnen entwickeln sich in enger Verbindung und bilden nach ihrem Zusammenschluss am myotendinösen Übergang eine dynamische Einheit für die Übertragung der Kraft von der Muskelkontraktion auf das Skelettsystem. ⓘ
Anordnung der Muskelfasern


Die Muskelarchitektur bezieht sich auf die Anordnung der Muskelfasern in Bezug auf die Achse der Krafterzeugung, die vom Ursprung des Muskels zu seinem Ansatz verläuft. Die üblichen Anordnungen sind die parallelen und die pennaten Muskeltypen. Bei parallelen Muskeln verlaufen die Faszikel parallel zur Achse der Krafterzeugung, aber die Faszikel können in ihrer Beziehung zueinander und zu ihren Sehnen variieren. Diese Variationen sind bei fusiformen, bandförmigen und konvergenten Muskeln zu beobachten. Ein konvergenter Muskel hat eine dreieckige oder fächerförmige Form, da die Fasern an seinem Ansatz zusammenlaufen und am Ursprung weit aufgefächert sind. Ein selteneres Beispiel für einen parallelen Muskel ist ein kreisförmiger Muskel wie der Orbicularis oculi, bei dem die Fasern in Längsrichtung angeordnet sind, aber vom Ursprung bis zum Ansatz einen Kreis bilden. Diese unterschiedlichen Strukturen können zu Schwankungen in der Spannung führen, die ein Muskel zwischen seinen Sehnen erzeugen kann. ⓘ
Die Fasern in pennaten Muskeln verlaufen in einem Winkel zur Achse der Krafterzeugung. Dieser Winkel reduziert die effektive Kraft jeder einzelnen Faser, da sie effektiv aus der Achse herausgezogen wird. Aufgrund dieses Winkels können jedoch mehr Fasern in dasselbe Muskelvolumen gepackt werden, wodurch sich die physiologische Querschnittsfläche (PCSA) vergrößert. Dieser Effekt wird als Faserpackung bezeichnet und gleicht in Bezug auf die Krafterzeugung den Effizienzverlust durch die außermittige Ausrichtung mehr als aus. Der Kompromiss besteht in der Gesamtgeschwindigkeit der Muskelverkürzung und in der Gesamtauslenkung. Die Gesamtgeschwindigkeit der Muskelverkürzung ist im Vergleich zur Geschwindigkeit der Faserverkürzung geringer, ebenso wie die Gesamtstrecke der Verkürzung. Alle diese Effekte sind mit dem Wimpelwinkel skalierbar; größere Winkel führen zu größerer Kraft aufgrund erhöhter Faserpackung und PCSA, aber mit größeren Verlusten bei der Verkürzungsgeschwindigkeit und der Auslenkung. Es gibt unipennate, bipennate und multipennate Muskeltypen. Ein unipennater Muskel hat ähnlich gewinkelte Fasern, die sich auf einer Seite einer Sehne befinden. Bei einem zweiflächigen Muskel befinden sich die Fasern auf zwei Seiten der Sehne. Bei mehrwinkligen Muskeln sind die Fasern in mehreren Winkeln entlang der krafterzeugenden Achse ausgerichtet, und dies ist die allgemeinste und häufigste Architektur. ⓘ
Wachstum der Muskelfasern
Muskelfasern wachsen, wenn sie trainiert werden, und schrumpfen, wenn sie nicht benutzt werden. Dies ist darauf zurückzuführen, dass das Training die Vergrößerung der Myofibrillen anregt, die die Gesamtzahl der Muskelzellen vergrößern. Gut trainierte Muskeln können nicht nur an Größe zunehmen, sondern auch mehr Mitochondrien, Myoglobin, Glykogen und eine höhere Dichte an Kapillaren entwickeln. Allerdings können sich die Muskelzellen nicht teilen, um neue Zellen zu bilden, und deshalb gibt es bei einem Erwachsenen weniger Muskelzellen als bei einem Neugeborenen. ⓘ
Benennung der Muskeln
Es gibt eine Reihe von Begriffen, die bei der Benennung von Muskeln verwendet werden, darunter solche, die sich auf Größe, Form, Wirkung, Lage, Ausrichtung und Anzahl der Köpfe beziehen.
- Nach Größe
- brevis bedeutet kurz; longus bedeutet lang; longissimus bedeutet am längsten; magnus bedeutet groß; major bedeutet größer; maximus bedeutet am größten; minor bedeutet kleiner, und minimus bedeutet am kleinsten; latissimus bedeutet am breitesten, und vastus bedeutet riesig. Diese Bezeichnungen werden oft nach dem jeweiligen Muskel verwendet, z. B. gluteus maximus und gluteus minimus.
- Nach relativer Form
- deltoid bedeutet dreieckig; quadratus bedeutet vierseitig; rhomboideus bedeutet rautenförmig; teres bedeutet rund oder zylindrisch, und trapezius bedeutet trapezförmig; serratus bedeutet sägezahnförmig; orbicularis bedeutet kreisförmig; pectinate bedeutet kammartig; piriformis bedeutet birnenförmig; platys bedeutet flach und gracilis bedeutet schlank. Beispiele sind der Pronator teres und der Pronator quadratus.
- Durch Aktion
- Abduktor, der sich von der Mittellinie wegbewegt; Adduktor, der sich zur Mittellinie hinbewegt; Depressor, der sich nach unten bewegt; Elevator, der sich nach oben bewegt; Flexor, der einen Winkel verkleinert; Extensor, der einen Winkel vergrößert oder aufrichtet; Pronator, der sich nach unten bewegt; Supinator, der sich nach oben bewegt; Innenrotator, der sich zum Körper hin dreht; Außenrotator, der sich vom Körper wegdreht; Sphinkter, der die Größe verkleinert, und Tensor, der Spannung erzeugt; Fixatormuskeln dienen dazu, ein Gelenk in einer bestimmten Position zu fixieren, indem sie die Antriebskraft stabilisieren, während andere Gelenke sich bewegen.
- Nach Anzahl der Köpfe
- Bizeps zwei, Trizeps drei und Quadrizeps vier.
- Nach Lage
- benannt nach der nahe gelegenen Hauptstruktur, z. B. der Schläfenmuskel (Temporalis) in der Nähe des Schläfenbeins. Auch supra- oberhalb, infra- unterhalb und sub-unter.
- Nach der Ausrichtung des Faszikels
- In Bezug auf die Mittellinie bedeutet geradlinig parallel zur Mittellinie; quer bedeutet senkrecht zur Mittellinie und schräg bedeutet diagonal zur Mittellinie. Bezogen auf die Achse der Krafterzeugung - Typen von parallelen und Typen von pennaten Muskeln. ⓘ
Fasertypen
Im Großen und Ganzen gibt es zwei Arten von Muskelfasern: Typ I, der langsam ist, und Typ II, der schnell ist. Typ II hat zwei Unterteilungen, Typ IIA (oxidativ) und Typ IIX (glykolytisch), was drei Hauptfasertypen ergibt. Diese Fasern haben relativ unterschiedliche metabolische, kontraktile und motorische Eigenschaften. In der nachstehenden Tabelle werden diese Arten von Eigenschaften unterschieden. Diese Arten von Eigenschaften hängen zwar teilweise von den Eigenschaften einzelner Fasern ab, sind aber eher auf der Ebene der motorischen Einheit als auf der Ebene der einzelnen Faser relevant und messbar. ⓘ
| Eigenschaften | Typ I-Fasern | Typ IIA-Fasern | Typ IIX-Fasern |
|---|---|---|---|
| Motorische Einheit Typ | Langsam oxidativ (SO) | Schnell Oxidativ/Glykolytisch (FOG) | Schnell glykolytisch (FG) |
| Zuckungsgeschwindigkeit | Langsam | Schnell | Schnell |
| Zuckungskraft | Klein | Mittel | Groß |
| Widerstandsfähigkeit gegen Ermüdung | Hoch | Hoch | Niedrig |
| Glykogengehalt | Niedrig | Hoch | Hoch |
| Kapillare Versorgung | Reich | Reich | Schlecht |
| Kapillardichte | Hoch | Durchschnittlich | Niedrig |
| Myoglobin | Hoch | Hoch | Niedrig |
| Rote Farbe | Dunkel | Dunkel | Blass |
| Mitochondriale Dichte | Hoch | Hoch | Niedrig |
| Kapazität der oxidativen Enzyme | Hoch | Mittel-hoch | Niedrig |
| Z-Linien-Breite | Durchschnittlich | Breit | Schmal |
| Alkalische ATPase-Aktivität | Niedrig | Hoch | Hoch |
| Saure ATPase-Aktivität | Hoch | Mittel-hoch | Niedrig |
Farbe der Fasern
Traditionell wurden die Fasern nach ihrer unterschiedlichen Farbe kategorisiert, die den Myoglobingehalt widerspiegelt. Typ-I-Fasern erscheinen aufgrund des hohen Myoglobingehalts rot. Rote Muskelfasern haben tendenziell mehr Mitochondrien und eine größere lokale Kapillardichte. Diese Fasern sind eher für die Ausdauer geeignet und ermüden langsam, da sie den oxidativen Stoffwechsel zur Erzeugung von ATP (Adenosintriphosphat) nutzen. Die weniger oxidativen Typ-II-Fasern sind weiß, da sie relativ wenig Myoglobin enthalten und auf glykolytische Enzyme angewiesen sind. ⓘ
Zuckungsgeschwindigkeit
Die Fasern können auch nach ihren Zuckungsfähigkeiten in schnell und langsam zuckende Fasern eingeteilt werden. Diese Merkmale überschneiden sich weitgehend, aber nicht vollständig, mit den Klassifizierungen nach Farbe, ATPase oder MHC. ⓘ
Einige Autoren definieren eine schnell zuckende Faser als eine, bei der das Myosin ATP sehr schnell spalten kann. Dazu gehören vor allem die ATPase-Typ-II- und MHC-Typ-II-Fasern. Schnell zuckende Fasern weisen jedoch auch eine höhere Fähigkeit zur elektrochemischen Übertragung von Aktionspotenzialen und eine schnelle Kalziumfreisetzung und -aufnahme durch das sarkoplasmatische Retikulum auf. Die schnell zuckenden Fasern sind auf ein gut entwickeltes, anaerobes, kurzzeitiges glykolytisches System für den Energietransfer angewiesen und können sich mit der 2-3-fachen Geschwindigkeit der langsam zuckenden Fasern zusammenziehen und Spannung aufbauen. Schnell zuckende Muskeln sind viel besser in der Lage, kurze Kraft- oder Geschwindigkeitsschübe zu erzeugen als langsame Muskeln und ermüden daher schneller. ⓘ
Die langsam zuckenden Fasern erzeugen Energie für die ATP-Resynthese durch ein langfristiges System der aeroben Energieübertragung. Dazu gehören vor allem die ATPase-Fasern vom Typ I und die MHC-Fasern vom Typ I. Sie haben in der Regel eine geringe ATPase-Aktivität, eine langsamere Kontraktionsgeschwindigkeit und eine weniger gut entwickelte glykolytische Kapazität. Langsam zuckende Fasern weisen eine größere Anzahl von Mitochondrien und Kapillaren auf, was sie für längere Arbeit besser geeignet macht. ⓘ
- Verteilung der Typen
Einzelne Muskeln bestehen in der Regel aus einer Mischung verschiedener Fasertypen, deren Anteile jedoch je nach den Aufgaben des jeweiligen Muskels variieren. Beim Menschen enthalten die Quadrizepsmuskeln beispielsweise ~52 % Fasern des Typs I, während der Fußsohlenmuskel ~80 % des Typs I aufweist. Der Augenmuskel (Orbicularis oculi) besteht nur zu ~15 % aus Fasern des Typs I. Die motorischen Einheiten innerhalb des Muskels weisen jedoch nur minimale Unterschiede zwischen den Fasern der jeweiligen Einheit auf. Diese Tatsache macht das Größenprinzip der Rekrutierung von motorischen Einheiten praktikabel. ⓘ
Traditionell wurde angenommen, dass sich die Gesamtzahl der Skelettmuskelfasern nicht ändert. Es wird angenommen, dass es keine geschlechts- oder altersbedingten Unterschiede in der Verteilung der Fasern gibt; die Anteile der Fasertypen variieren jedoch erheblich von Muskel zu Muskel und von Mensch zu Mensch. Zwischen den verschiedenen Spezies gibt es große Unterschiede in den Anteilen der Muskelfasertypen. ⓘ
Bei sitzenden Männern und Frauen (sowie bei Kleinkindern) beträgt der Anteil der Typ-II-Fasern 45 % und der Anteil der Typ-I-Fasern 55 %. Menschen, die in einer Sportart Spitzenleistungen erbringen, weisen in der Regel ein anderes Muster der Faserverteilung auf, z. B. weisen Ausdauersportler einen höheren Anteil an Typ-I-Fasern auf. Sprintsportler hingegen benötigen eine große Anzahl von Typ-IIX-Fasern. Bei Mittelstrecklern ist die Verteilung der beiden Typen ungefähr gleich. Dies ist auch bei Kraftsportlern wie Werfern und Springern häufig der Fall. Es wurde vermutet, dass verschiedene Arten von Training Veränderungen in den Fasern eines Skelettmuskels hervorrufen können. ⓘ
Es wird vermutet, dass sich einige der Fasern des Typs IIX in Fasern des Typs IIA umwandeln, wenn man über einen längeren Zeitraum Ausdauerleistungen erbringt. Es gibt jedoch keinen Konsens zu diesem Thema. Es könnte durchaus sein, dass die Fasern vom Typ IIX nach einem hochintensiven Ausdauertraining eine Verbesserung der oxidativen Kapazität aufweisen, die sie auf ein Niveau bringt, auf dem sie in der Lage sind, den oxidativen Stoffwechsel ebenso effektiv durchzuführen wie die langsam zuckenden Fasern untrainierter Personen. Dies wäre auf eine Zunahme der Größe und Anzahl der Mitochondrien und die damit verbundenen Veränderungen zurückzuführen, nicht auf eine Änderung des Fasertyps. ⓘ
Methoden zur Fasertypisierung

Es gibt zahlreiche Methoden zur Fasertypisierung, die von Laien häufig verwechselt werden. Zwei häufig verwechselte Methoden sind die histochemische Färbung der Myosin-ATPase-Aktivität und die immunhistochemische Färbung der schweren Myosinkette (MHC). Die Myosin-ATPase-Aktivität wird üblicherweise - und korrekterweise - einfach als "Fasertyp" bezeichnet und ergibt sich aus der direkten Bestimmung der ATPase-Aktivität unter verschiedenen Bedingungen (z. B. pH-Wert). Die Färbung der schweren Myosinkette wird am genauesten als "MHC-Fasertyp" bezeichnet, z. B. "MHC-IIa-Fasern", und ergibt sich aus der Bestimmung verschiedener MHC-Isoformen. Diese Methoden sind physiologisch eng miteinander verwandt, da der MHC-Typ die primäre Determinante der ATPase-Aktivität ist. Keine der beiden Typisierungsmethoden ist jedoch direkt auf den Stoffwechsel ausgerichtet; sie befassen sich nicht direkt mit der oxidativen oder glykolytischen Kapazität der Faser. ⓘ
Wenn allgemein von "Typ I"- oder "Typ II"-Fasern die Rede ist, bezieht sich dies am genauesten auf die Summe der numerischen Fasertypen (I vs. II), wie sie durch die Färbung der Myosin-ATPase-Aktivität bestimmt werden (z. B. bezieht sich "Typ II"-Fasern auf Typ IIA + Typ IIAX + Typ IIXA ... usw.). ⓘ
Die nachstehende Tabelle zeigt die Beziehung zwischen diesen beiden Methoden, beschränkt auf die beim Menschen vorkommenden Fasertypen. Die Großschreibung des Subtyps wird bei der Fasertypisierung im Gegensatz zur MHC-Typisierung verwendet, und einige ATPase-Typen enthalten tatsächlich mehrere MHC-Typen. Außerdem wird ein Subtyp B oder b beim Menschen durch keine der beiden Methoden ausgedrückt. Frühe Forscher glaubten, dass der Mensch einen MHC IIb exprimiert, was zur ATPase-Klassifizierung IIB führte. Spätere Forschungen zeigten jedoch, dass der menschliche MHC IIb in Wirklichkeit IIx ist, was darauf hindeutet, dass IIB besser als IIX bezeichnet wird. Da IIb auch bei anderen Säugetieren vorkommt, wird es in der Literatur (zusammen mit IIB) immer noch genau angegeben. Zu den nicht menschlichen Fasertypen gehören echte IIb-Fasern, IIc, IId usw. ⓘ
| ATPase-Typ | MHC schwere Kette(n) |
|---|---|
| Typ I | MHC Iβ |
| Typ IC | MHC Iβ > MHC IIa |
| Typ IIC | MHC IIa > MHC Iβ |
| Typ IIA | MHC IIa |
| Typ IIAX | MHC IIa > MHC IIx |
| Typ IIXA | MHC IIx > MHC IIa |
| Typ IIX | MHC IIx |
Weitere Fasertypisierungsmethoden sind weniger formell abgegrenzt und umfassen eher ein Spektrum. Sie konzentrieren sich eher auf metabolische und funktionelle Kapazitäten (d. h. oxidative vs. glykolytische, schnelle vs. langsame Kontraktionszeit). Wie bereits erwähnt, werden diese Parameter bei der Fasertypisierung nach ATPase oder MHC nicht direkt gemessen oder vorgeschrieben. Viele der verschiedenen Methoden sind jedoch mechanistisch miteinander verbunden, während andere in vivo korreliert sind. So steht beispielsweise der ATPase-Fasertyp mit der Kontraktionsgeschwindigkeit in Zusammenhang, da eine hohe ATPase-Aktivität einen schnelleren Crossbridge-Zyklus ermöglicht. Die ATPase-Aktivität ist zwar nur eine Komponente der Kontraktionsgeschwindigkeit, aber Fasern vom Typ I sind "langsam", weil sie im Vergleich zu Fasern vom Typ II eine geringere ATPase-Aktivität aufweisen. Die Messung der Kontraktionsgeschwindigkeit ist jedoch nicht dasselbe wie die Typisierung der ATPase-Fasern. ⓘ
Mikroanatomie


Skelettmuskeln weisen unter dem Mikroskop ein ausgeprägtes Bändermuster auf, das auf die Anordnung der beiden kontraktilen Proteine Myosin und Aktin zurückzuführen ist, die zwei der Myofilamente in den Myofibrillen bilden. Das Myosin bildet die dicken Filamente und das Aktin die dünnen Filamente, die in sich wiederholenden Einheiten, den so genannten Sarkomeren, angeordnet sind. Das Zusammenspiel der beiden Proteine führt zur Muskelkontraktion. ⓘ
Das Sarkomer ist über Zwischenfilamente im Zytoskelett mit anderen Organellen wie den Mitochondrien verbunden. Das Costamere verbindet das Sarkomer mit dem Sarkolemma. ⓘ
Jedes einzelne Organell und Makromolekül einer Muskelfaser ist so angeordnet, dass es die gewünschten Funktionen erfüllt. Die Zellmembran wird als Sarkolemm bezeichnet, das Zytoplasma als Sarkoplasma. Im Sarkoplasma befinden sich die Myofibrillen. Die Myofibrillen sind lange Proteinbündel mit einem Durchmesser von etwa einem Mikrometer. An die Innenseite des Sarkolemmas sind die ungewöhnlich abgeflachten Myonuklei gepresst. Zwischen den Myofibrillen befinden sich die Mitochondrien. ⓘ
Die Muskelfaser hat zwar keine glatten endoplasmatischen Zisternen, aber sie enthält ein sarkoplasmatisches Retikulum. Das sarkoplasmatische Retikulum umgibt die Myofibrillen und enthält eine Reserve an Kalziumionen, die für die Muskelkontraktion benötigt werden. In regelmäßigen Abständen weist es erweiterte Endsäcke auf, die als terminale Zisternen bezeichnet werden. Diese durchqueren die Muskelfaser von einer Seite zur anderen. Zwischen zwei terminalen Zisternen befindet sich eine röhrenförmige Ausbuchtung, die als Quertubulus (T-Tubulus) bezeichnet wird. Die T-Tubuli sind der Weg für Aktionspotenziale, die dem sarkoplasmatischen Retikulum signalisieren, Kalzium freizusetzen, wodurch eine Muskelkontraktion ausgelöst wird. Zwei terminale Zisternen und ein Quertubulus bilden zusammen eine Triade. ⓘ
Entwicklung

Alle Muskeln stammen vom paraxialen Mesoderm ab. Während der Embryonalentwicklung wird das paraxiale Mesoderm im Prozess der Somitogenese entlang der Länge des Embryos geteilt, um Somiten zu bilden, die der Segmentierung des Körpers entsprechen, die am deutlichsten an der Wirbelsäule zu erkennen ist. Jeder Somit hat drei Abteilungen, das Sklerotom (das die Wirbel bildet), das Dermatom (das die Haut bildet) und das Myotom (das die Muskeln bildet). Das Myotom ist in zwei Abschnitte unterteilt, das Epimere und das Hypomere, die epaxiale bzw. hypaxiale Muskeln bilden. Die einzigen epaxialen Muskeln beim Menschen sind der Erector spinae und die kleinen Wirbelmuskeln, die von den dorsalen Rami der Spinalnerven innerviert werden. Alle anderen Muskeln, auch die der Gliedmaßen, sind hypaxial und werden von den ventralen Ästen der Spinalnerven innerviert. ⓘ
Während der Entwicklung verbleiben die Myoblasten (Muskelvorläuferzellen) entweder im Somiten, um die mit der Wirbelsäule verbundenen Muskeln zu bilden, oder sie wandern in den Körper aus, um alle anderen Muskeln zu bilden. Der Wanderung der Myoblasten geht die Bildung von Bindegewebsgerüsten voraus, die in der Regel aus dem somatischen Seitenplattenmesoderm gebildet werden. Die Myoblasten folgen chemischen Signalen zu den entsprechenden Stellen, wo sie zu langgestreckten, vielkernigen Skelettmuskelzellen verschmelzen. ⓘ
Zwischen der zehnten und der achtzehnten Schwangerschaftswoche haben alle Muskelzellen schnelle Myosinketten; beim sich entwickelnden Fötus werden zwei Typen von Myotuben unterschieden - beide haben schnelle Ketten, aber eine hat schnelle und langsame Ketten. Zwischen 10 und 40 Prozent der Fasern exprimieren die langsame Myosinkette. ⓘ
Die Fasertypen werden während der Embryonalentwicklung festgelegt und später im Erwachsenenalter durch neuronale und hormonelle Einflüsse umgestaltet. Die unter der Basallamina befindliche Population von Satellitenzellen ist für die postnatale Entwicklung der Muskelzellen notwendig. ⓘ
Funktion
Die Hauptfunktion des Muskels ist die Kontraktion. Nach der Kontraktion fungiert der Skelettmuskel als endokrines Organ, indem er Myokine - eine breite Palette von Zytokinen und anderen Peptiden, die als Signalmoleküle fungieren - abgibt. Man geht davon aus, dass Myokine wiederum die gesundheitlichen Vorteile von Bewegung vermitteln. Myokine werden nach der Muskelkontraktion in den Blutkreislauf ausgeschüttet. Interleukin 6 (IL-6) ist das am meisten untersuchte Myokin, andere durch Muskelkontraktion ausgelöste Myokine sind BDNF, FGF21 und SPARC. ⓘ
Die Muskulatur dient auch der Erzeugung von Körperwärme. Die Muskelkontraktion ist für die Erzeugung von 85 % der Körperwärme verantwortlich. Diese Wärme entsteht als Nebenprodukt der Muskeltätigkeit und wird größtenteils vergeudet. Als homöostatische Reaktion auf extreme Kälte wird den Muskeln signalisiert, dass sie Kontraktionen auslösen, um Wärme zu erzeugen. ⓘ
Kontraktion


Die Kontraktion wird durch die strukturelle Einheit des Muskels, die Muskelfaser, und durch seine funktionelle Einheit, die motorische Einheit, erreicht. Muskelfasern sind erregbare Zellen, die von motorischen Neuronen stimuliert werden. Die motorische Einheit besteht aus einem motorischen Neuron und den vielen Fasern, mit denen es in Kontakt steht. Ein einzelner Muskel wird durch viele motorische Einheiten stimuliert. Muskelfasern werden Die Muskelfasern werden durch den Neurotransmitter Acetylcholin, der von den Motoneuronen an den neuromuskulären Knotenpunkten freigesetzt wird, depolarisiert. ⓘ
Neben den Myofilamenten Aktin und Myosin in den Myofibrillen, aus denen die kontraktilen Sarkomere bestehen, gibt es zwei weitere wichtige regulatorische Proteine - Troponin und Tropomyosin -, die die Muskelkontraktion ermöglichen. Diese Proteine sind mit Aktin assoziiert und arbeiten zusammen, um dessen Interaktion mit Myosin zu verhindern. Sobald eine Zelle ausreichend stimuliert wird, setzt das sarkoplasmatische Retikulum der Zelle ionisches Kalzium (Ca2+) frei, das dann mit dem regulatorischen Protein Troponin interagiert. Das an Kalzium gebundene Troponin erfährt eine Konformationsänderung, die zur Bewegung von Tropomyosin führt, wodurch die Myosin-Bindungsstellen am Aktin freigelegt werden. Dies ermöglicht die ATP-abhängige Kreuzbrückenbewegung von Myosin und Aktin und die Verkürzung des Muskels. ⓘ
Erregung-Kontraktion-Kopplung
Die Erregungs-Kontraktions-Kopplung ist der Prozess, durch den ein muskuläres Aktionspotenzial in der Muskelfaser die Myofibrillen zur Kontraktion veranlasst. Dieser Prozess beruht auf einer direkten Kopplung zwischen dem Kalziumfreisetzungskanal RYR1 (Ryanodinrezeptor 1) des sarkoplasmatischen Retikulums und spannungsgesteuerten Kalziumkanälen des L-Typs (als Dihydropyridinrezeptoren, DHPRs, bezeichnet). Die DHPRs befinden sich auf dem Sarkolemm (das das Oberflächensarkolemm und die Quertubuli umfasst), während die RyRs auf der SR-Membran liegen. Die enge Aneinanderreihung eines Quertubulus und zweier SR-Regionen, die RyRs enthalten, wird als Triade bezeichnet und ist in erster Linie der Ort, an dem die Erregungs-Kontraktions-Kopplung stattfindet. Die Erregungs-Kontraktions-Kopplung tritt auf, wenn die Depolarisierung einer Skelettmuskelzelle zu einem Aktionspotenzial führt, das sich über die Zelloberfläche und in das T-Tubuli-Netzwerk der Muskelfaser ausbreitet und dadurch den inneren Teil der Muskelfaser depolarisiert. Durch die Depolarisierung der inneren Teile werden Dihydropyridinrezeptoren in den terminalen Zisternen aktiviert, die sich in unmittelbarer Nähe zu den Ryanodinrezeptoren im angrenzenden sarkoplasmatischen Retikulum befinden. Die aktivierten Dihydropyridinrezeptoren interagieren physisch mit den Ryanodinrezeptoren, um sie über Fußprozesse zu aktivieren (was Konformationsänderungen beinhaltet, die die Ryanodinrezeptoren allosterisch aktivieren). Wenn sich die Ryanodinrezeptoren öffnen, wird Ca2+
aus dem sarkoplasmatischen Retikulum in den lokalen Junktionsraum freigesetzt und diffundiert in das Gesamtzytoplasma, um einen Kalziumfunken auszulösen. Man beachte, dass das sarkoplasmatische Retikulum eine große Kalziumpufferkapazität hat, die zum Teil auf ein Kalzium-bindendes Protein namens Calsequestrin zurückzuführen ist. Die nahezu synchrone Aktivierung tausender Kalziumfunken durch das Aktionspotenzial verursacht einen zellweiten Kalziumanstieg, der den Aufwärtshub der Kalziumtransiente auslöst. Das Ca2+
das in das Zytosol freigesetzt wird, bindet sich an Troponin C an den Aktinfilamenten und ermöglicht so den Kreuzbrücken-Zyklus, der Kraft und in manchen Situationen auch Bewegung erzeugt. Die Kalzium-ATPase des sarko-endoplasmatischen Retikulums (SERCA) pumpt aktiv Ca2+
zurück in das sarkoplasmatische Retikulum. Wenn Ca2+
wieder auf den Ruhezustand zurückgeht, nimmt die Kraft ab und es kommt zur Entspannung. ⓘ
Muskelbewegung
Der efferente Schenkel des peripheren Nervensystems ist für die Übermittlung von Befehlen an die Muskeln und Drüsen und letztlich für die willentliche Bewegung verantwortlich. Die Nerven bewegen die Muskeln als Reaktion auf freiwillige und autonome (unwillkürliche) Signale des Gehirns. Tiefe Muskeln, oberflächliche Muskeln, Gesichtsmuskeln und innere Muskeln korrespondieren alle mit bestimmten Regionen im primären motorischen Kortex des Gehirns, direkt vor dem zentralen Sulcus, der die Frontal- und Parietallappen trennt. ⓘ
Darüber hinaus reagieren die Muskeln auf reflexive Nervenreize, die nicht immer Signale bis zum Gehirn senden. In diesem Fall erreicht das Signal der afferenten Faser nicht das Gehirn, sondern erzeugt die reflexive Bewegung durch direkte Verbindungen mit den efferenten Nerven in der Wirbelsäule. Der Großteil der Muskeltätigkeit ist jedoch willentlich und das Ergebnis komplexer Interaktionen zwischen verschiedenen Bereichen des Gehirns. ⓘ
Die Nerven, die bei Säugetieren die Skelettmuskeln steuern, korrespondieren mit Neuronengruppen entlang der primären motorischen Rinde der Großhirnrinde. Die Befehle werden über die Basalganglien geleitet und durch Eingaben aus dem Kleinhirn modifiziert, bevor sie über die Pyramidenbahn zum Rückenmark und von dort zur motorischen Endplatte an den Muskeln weitergeleitet werden. Auf dem Weg dorthin liefern Rückkopplungen, wie die des extrapyramidalen Systems, Signale, die den Muskeltonus und die Reaktion beeinflussen. ⓘ
Tiefer liegende Muskeln, wie die an der Körperhaltung beteiligten, werden häufig von Kernen im Hirnstamm und den Basalganglien gesteuert. ⓘ
Propriozeption
In den Skelettmuskeln leiten die Muskelspindeln Informationen über den Grad der Muskellänge und -dehnung an das zentrale Nervensystem weiter, um die Aufrechterhaltung der Körperhaltung und der Gelenkposition zu unterstützen. Das Gefühl dafür, wo sich unser Körper im Raum befindet, wird Propriozeption genannt, die Wahrnehmung des Körperbewusstseins, das "unbewusste" Bewusstsein, wo sich die verschiedenen Körperregionen zu einem bestimmten Zeitpunkt befinden. Mehrere Bereiche des Gehirns koordinieren Bewegung und Position mit den aus der Propriozeption gewonnenen Informationen. Insbesondere das Kleinhirn und der rote Kern prüfen ständig die Position im Vergleich zur Bewegung und nehmen kleinere Korrekturen vor, um einen reibungslosen Bewegungsablauf zu gewährleisten. ⓘ
Verbrauch von Energie
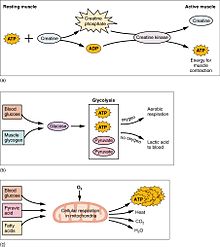
Die Muskeltätigkeit ist für einen Großteil des Energieverbrauchs des Körpers verantwortlich. Alle Muskelzellen produzieren Adenosintriphosphatmoleküle (ATP), die für die Bewegung der Myosinköpfe verwendet werden. Die Muskeln verfügen über einen kurzfristigen Energiespeicher in Form von Kreatinphosphat, das aus ATP erzeugt wird, und können ATP bei Bedarf mit Hilfe von Kreatinkinase regenerieren. Die Muskeln verfügen auch über einen Speicher für Glukose in Form von Glykogen. Glykogen kann schnell in Glukose umgewandelt werden, wenn Energie für anhaltende, kraftvolle Kontraktionen benötigt wird. In den willkürlichen Skelettmuskeln kann das Glukosemolekül anaerob in einem als Glykolyse bezeichneten Prozess verstoffwechselt werden, bei dem zwei ATP- und zwei Milchsäuremoleküle entstehen (unter aeroben Bedingungen wird kein Laktat gebildet; stattdessen wird Pyruvat gebildet und durch den Zitronensäurezyklus weitergeleitet). Die Muskelzellen enthalten auch Fettkügelchen, die bei aerobem Training zur Energiegewinnung genutzt werden. Die aeroben Energiesysteme brauchen länger, um ATP zu erzeugen und die maximale Effizienz zu erreichen, und erfordern viel mehr biochemische Schritte, erzeugen aber deutlich mehr ATP als die anaerobe Glykolyse. Der Herzmuskel hingegen kann jeden der drei Makronährstoffe (Eiweiß, Glukose und Fett) ohne Aufwärmphase aerob verbrauchen und holt immer die maximale ATP-Ausbeute aus jedem beteiligten Molekül heraus. Herz, Leber und rote Blutkörperchen verbrauchen auch die Milchsäure, die von den Skelettmuskeln während des Trainings produziert und ausgeschieden wird. ⓘ
Die Skelettmuskulatur verbraucht mehr Kalorien als andere Organe. Im Ruhezustand verbraucht er 54,4 kJ/kg (13,0 kcal/kg) pro Tag. Das ist mehr als das Fettgewebe mit 18,8 kJ/kg (4,5 kcal/kg) und die Knochen mit 9,6 kJ/kg (2,3 kcal/kg). ⓘ
Wirkungsgrad
Der Wirkungsgrad des menschlichen Muskels wurde (im Zusammenhang mit Rudern und Radfahren) mit 18 % bis 26 % gemessen. Der Wirkungsgrad ist definiert als das Verhältnis zwischen der mechanischen Arbeitsleistung und den gesamten Stoffwechselkosten, die sich aus dem Sauerstoffverbrauch errechnen lassen. Dieser niedrige Wirkungsgrad ergibt sich aus einem Wirkungsgrad von etwa 40 % bei der Erzeugung von ATP aus Nahrungsenergie, aus Verlusten bei der Umwandlung von Energie aus ATP in mechanische Arbeit im Muskel und aus mechanischen Verlusten im Körper. Die beiden letztgenannten Verluste hängen von der Art der Übung und der Art der verwendeten Muskelfasern (schnell zuckende oder langsam zuckende) ab. Bei einem Gesamtwirkungsgrad von 20 Prozent entspricht ein Watt mechanischer Leistung 4,3 kcal pro Stunde. Ein Hersteller von Rudergeräten beispielsweise kalibriert seine Ruderergometer so, dass die verbrannten Kalorien dem Vierfachen der tatsächlichen mechanischen Arbeit plus 300 kcal pro Stunde entsprechen, was bei 250 Watt mechanischer Leistung einem Wirkungsgrad von etwa 20 Prozent entspricht. Die mechanische Energieleistung einer zyklischen Kontraktion kann von vielen Faktoren abhängen, z. B. vom Zeitpunkt der Aktivierung, der Trajektorie der Muskelanspannung und der Geschwindigkeit des Kraftanstiegs und -abfalls. Diese Faktoren können experimentell mit Hilfe der Arbeitsschleifenanalyse ermittelt werden. ⓘ
Muskelkraft
Die Muskelkraft ist das Ergebnis von drei sich überschneidenden Faktoren: physiologische Kraft (Muskelgröße, Querschnittsfläche, verfügbare Querbrücken, Reaktion auf Training), neurologische Kraft (wie stark oder schwach ist das Signal, das dem Muskel sagt, dass er sich zusammenziehen soll) und mechanische Kraft (Kraftwinkel des Muskels am Hebel, Länge des Momentarmes, Gelenkfähigkeit). ⓘ
| Grad 0 | Keine Kontraktion |
| Grad 1 | Anzeichen einer Kontraktion, aber keine Bewegung im Gelenk |
| Grad 2 | Bewegung im Gelenk bei aufgehobener Schwerkraft |
| Grad 3 | Bewegung gegen die Schwerkraft, aber nicht gegen zusätzlichen Widerstand |
| Grad 4 | Bewegung gegen einen äußeren Widerstand, aber weniger als normal |
| Grad 5 | Normale Kraft |
Wirbeltiermuskeln erzeugen in der Regel eine Kraft von etwa 25-33 N (5,6-7,4 lbf) pro Quadratzentimeter Muskelquerschnittsfläche, wenn sie isometrisch und in optimaler Länge sind. Einige Muskeln von Wirbeltieren, wie z. B. die von Krabben, haben viel längere Sarkomere als die von Wirbeltieren, was zu viel mehr Bindungsstellen für Aktin und Myosin und damit zu einer viel größeren Kraft pro Quadratzentimeter führt, allerdings auf Kosten einer viel langsameren Geschwindigkeit. Die durch eine Kontraktion erzeugte Kraft kann nicht-invasiv mit Hilfe der Mechanomyographie oder der Phonomyographie gemessen werden, in vivo mit Hilfe der Sehnenbelastung (wenn eine ausgeprägte Sehne vorhanden ist) oder direkt mit invasiveren Methoden gemessen werden. ⓘ
Die Kraft eines bestimmten Muskels, d. h. die auf das Skelett ausgeübte Kraft, hängt von der Länge, der Verkürzungsgeschwindigkeit, der Querschnittsfläche, der Pennation, der Sarkomerlänge, den Myosin-Isoformen und der neuralen Aktivierung der motorischen Einheiten ab. Eine signifikante Verringerung der Muskelkraft kann auf eine zugrunde liegende Pathologie hinweisen, wobei die Tabelle rechts als Anhaltspunkt dient. ⓘ
Die maximale Haltezeit eines kontrahierten Muskels hängt von seinem Energievorrat ab und nimmt nach dem Rohmert'schen Gesetz vom Beginn der Belastung an exponentiell ab. ⓘ
Der "stärkste" menschliche Muskel
Da sich drei Faktoren gleichzeitig auf die Muskelkraft auswirken und die Muskeln nie einzeln arbeiten, ist es irreführend, die Kraft einzelner Muskeln zu vergleichen und zu behaupten, dass ein Muskel der "stärkste" ist. Es gibt jedoch mehrere Muskeln, deren Stärke aus unterschiedlichen Gründen bemerkenswert ist.
- Im allgemeinen Sprachgebrauch bezieht sich der Begriff "Muskelkraft" auf die Fähigkeit, eine Kraft auf ein äußeres Objekt auszuüben, z. B. ein Gewicht zu heben. Nach dieser Definition ist der Masseter oder Kiefermuskel der stärkste. Das Guinness-Buch der Rekorde von 1992 verzeichnet eine Bisskraft von 4.337 N (975 lbf) für 2 Sekunden. Was den Kaumuskel auszeichnet, ist nichts Besonderes am Muskel selbst, sondern sein Vorteil, dass er mit einem viel kürzeren Hebelarm arbeitet als andere Muskeln.
- Wenn sich "Kraft" auf die Kraft bezieht, die der Muskel selbst ausübt, z. B. an der Stelle, an der er in einen Knochen eingreift, dann sind die stärksten Muskeln diejenigen mit der größten Querschnittsfläche. Der Grund dafür ist, dass die Spannung, die eine einzelne Skelettmuskelfaser ausübt, nicht sehr unterschiedlich ist. Jede Faser kann eine Kraft in der Größenordnung von 0,3 Mikronewton ausüben. Nach dieser Definition ist der stärkste Muskel des Körpers in der Regel der Quadriceps femoris oder der Gluteus maximus.
- Da die Muskelkraft durch die Querschnittsfläche bestimmt wird, ist ein kürzerer Muskel "Pfund für Pfund" (d. h. nach Gewicht) stärker als ein längerer Muskel mit der gleichen Querschnittsfläche. Die Myometriumschicht der Gebärmutter ist möglicherweise der gewichtsmäßig stärkste Muskel im weiblichen menschlichen Körper. Zum Zeitpunkt der Geburt eines Kindes wiegt die gesamte menschliche Gebärmutter etwa 1,1 kg (40 oz). Während der Geburt übt die Gebärmutter bei jeder Kontraktion eine Kraft von 100 bis 400 N (25 bis 100 lbf) nach unten aus.
- Die äußeren Muskeln des Auges sind im Verhältnis zur geringen Größe und zum Gewicht des Augapfels auffallend groß und stark. Häufig heißt es, sie seien "die stärksten Muskeln für die Aufgabe, die sie zu erfüllen haben", und manchmal wird behauptet, sie seien "100 Mal stärker, als sie sein müssten". Augenbewegungen (insbesondere Sakkaden, die beim Scannen von Gesichtern und beim Lesen verwendet werden) erfordern jedoch Bewegungen mit hoher Geschwindigkeit, und die Augenmuskeln werden nachts während des Schlafs mit schnellen Augenbewegungen trainiert.
- Die Aussage, dass "die Zunge der stärkste Muskel im Körper ist", taucht häufig in Listen mit überraschenden Fakten auf, aber es ist schwierig, eine Definition von "Stärke" zu finden, die diese Aussage wahr machen würde. Man beachte, dass die Zunge aus acht Muskeln besteht, nicht nur aus einem. ⓘ
Krafterzeugung
Die Muskelkraft ist proportional zur physiologischen Querschnittsfläche (PCSA), und die Muskelgeschwindigkeit ist proportional zur Muskelfaserlänge. Das Drehmoment an einem Gelenk wird jedoch durch eine Reihe biomechanischer Parameter bestimmt, darunter der Abstand zwischen den Muskelansätzen und den Drehpunkten, die Muskelgröße und das architektonische Übersetzungsverhältnis. Normalerweise sind die Muskeln gegenläufig angeordnet, d. h. wenn sich eine Muskelgruppe zusammenzieht, entspannt oder verlängert sich eine andere Gruppe. Der Antagonismus bei der Übertragung von Nervenimpulsen auf die Muskeln bedeutet, dass es unmöglich ist, die Kontraktion von zwei antagonistischen Muskeln gleichzeitig vollständig zu stimulieren. Bei ballistischen Bewegungen wie dem Wurf bremsen die antagonistischen Muskeln die agonistischen Muskeln während der gesamten Kontraktion, insbesondere am Ende der Bewegung. Im Beispiel des Wurfs ziehen sich der Brustkorb und der vordere Teil der Schulter (vorderer Deltamuskel) zusammen, um den Arm nach vorne zu ziehen, während sich die Muskeln im hinteren und hinteren Teil der Schulter (hinterer Deltamuskel) ebenfalls zusammenziehen und exzentrisch kontrahieren, um die Bewegung abzubremsen und Verletzungen zu vermeiden. Ein Teil des Trainingsprozesses besteht darin, zu lernen, die antagonistischen Muskeln zu entspannen, um den Krafteinsatz der Brust und der vorderen Schulter zu erhöhen. ⓘ
Kontrahierende Muskeln erzeugen Vibrationen und Geräusche. Langsam zuckende Fasern erzeugen 10 bis 30 Kontraktionen pro Sekunde (10 bis 30 Hz). Schnell zuckende Fasern erzeugen 30 bis 70 Kontraktionen pro Sekunde (30 bis 70 Hz). Die Vibration kann durch starkes Anspannen der Muskeln beobachtet und gefühlt werden, z. B. wenn man eine feste Faust macht. Das Geräusch kann gehört werden, wenn man einen stark angespannten Muskel gegen das Ohr drückt, auch hier ist eine feste Faust ein gutes Beispiel. Das Geräusch wird in der Regel als ein polterndes Geräusch beschrieben. Manche Menschen können diesen rumpelnden Ton freiwillig erzeugen, indem sie den Musculus tensor tympani des Mittelohrs anspannen. Das Rumpeln kann auch bei starker Anspannung der Nacken- oder Kiefermuskulatur zu hören sein. ⓘ
Wege der Signaltransduktion
Der Phänotyp der Skelettmuskelfasern bei erwachsenen Tieren wird durch mehrere unabhängige Signalwege gesteuert. Dazu gehören Wege, die mit dem Ras/Mitogen-aktivierten Proteinkinase (MAPK)-Signalweg, Calcineurin, der Calcium/Calmodulin-abhängigen Proteinkinase IV und dem Peroxisom-Proliferator-γ-Coaktivator 1 (PGC-1) zusammenhängen. Der Ras/MAPK-Signalweg verbindet die Motoneuronen und die Signalsysteme, indem er Erregung und Transkriptionsregulierung miteinander verbindet, um die nervenabhängige Induktion des langsamen Programms im sich regenerierenden Muskel zu fördern. Calcineurin, eine Ca2+/Calmodulin-aktivierte Phosphatase, die an der von der Nervenaktivität abhängigen Fasertyp-Spezifizierung im Skelettmuskel beteiligt ist, kontrolliert direkt den Phosphorylierungszustand des Transkriptionsfaktors NFAT, was seine Verlagerung in den Zellkern ermöglicht und in Zusammenarbeit mit Proteinen des Myocyte Enhancer Factor 2 (MEF2) und anderen regulatorischen Proteinen zur Aktivierung von Muskelproteinen des langsamen Typs führt. Die Aktivität der Ca2+/Calmodulin-abhängigen Proteinkinase wird ebenfalls durch die Aktivität der langsamen Motoneuronen hochreguliert, möglicherweise weil sie die durch Calcineurin ausgelösten Reaktionen des langsamen Typs verstärkt, indem sie die Funktionen des MEF2-Transaktivators fördert und die oxidative Kapazität durch Stimulation der mitochondrialen Biogenese erhöht. ⓘ
Kontraktionsbedingte Veränderungen des intrazellulären Kalziums oder reaktiver Sauerstoffspezies liefern Signale an verschiedene Signalwege, zu denen die MAPKs, Calcineurin und die Kalzium/Calmodulin-abhängige Proteinkinase IV gehören, um Transkriptionsfaktoren zu aktivieren, die die Genexpression und Enzymaktivität im Skelettmuskel regulieren. ⓘ

PGC1-α (PPARGC1A), ein transkriptioneller Koaktivator nuklearer Rezeptoren, der für die Regulierung einer Reihe mitochondrialer Gene, die am oxidativen Stoffwechsel beteiligt sind, wichtig ist, interagiert direkt mit MEF2, um selektive Gene für langsame Muskelzuckungen (ST) synergistisch zu aktivieren, und dient auch als Ziel für Calcineurin-Signale. Ein vom Peroxisom-Proliferator-aktivierten Rezeptor δ (PPARδ) vermittelter Transkriptionsweg ist an der Regulierung des Skelettmuskelfaser-Phänotyps beteiligt. Mäuse, die eine aktivierte Form von PPARδ in sich tragen, zeigen einen "Ausdauer"-Phänotyp mit einem koordinierten Anstieg der oxidativen Enzyme und der mitochondrialen Biogenese sowie einem erhöhten Anteil an ST-Fasern. Somit bilden - durch funktionelle Genomik - Calcineurin, Calmodulin-abhängige Kinase, PGC-1α und aktiviertes PPARδ die Grundlage eines Signalnetzwerks, das die Umwandlung des Fasertyps der Skelettmuskulatur und metabolische Profile steuert, die vor Insulinresistenz und Fettleibigkeit schützen. ⓘ
Der Übergang vom aeroben zum anaeroben Stoffwechsel während intensiver Arbeit erfordert die rasche Aktivierung mehrerer Systeme, um eine konstante Versorgung der arbeitenden Muskeln mit ATP zu gewährleisten. Dazu gehören die Umstellung von fettbasierten auf kohlenhydratbasierte Brennstoffe, eine Umverteilung des Blutflusses von den nicht arbeitenden zu den trainierenden Muskeln und die Beseitigung mehrerer Nebenprodukte des anaeroben Stoffwechsels, wie Kohlendioxid und Milchsäure. Einige dieser Reaktionen werden durch die transkriptionelle Kontrolle des glykolytischen Phänotyps der schnell zuckenden Muskeln (FT) gesteuert. So ist beispielsweise an der Umprogrammierung der Skelettmuskulatur von einem glykolytischen ST-Phänotyp zu einem glykolytischen FT-Phänotyp der Six1/Eya1-Komplex beteiligt, der aus Mitgliedern der Six-Proteinfamilie besteht. Darüber hinaus wurde der Hypoxie-induzierbare Faktor 1-α (HIF1A) als Hauptregulator für die Expression von Genen identifiziert, die an wesentlichen hypoxischen Reaktionen beteiligt sind, die den ATP-Spiegel in den Zellen aufrechterhalten. Die Ablation von HIF-1α in der Skelettmuskulatur war mit einem Anstieg der Aktivität der ratenbegrenzenden Enzyme der Mitochondrien verbunden, was darauf hindeutet, dass der Zitronensäurezyklus und die verstärkte Fettsäureoxidation den verminderten Fluss durch den glykolytischen Weg in diesen Tieren kompensieren können. Hypoxie-vermittelte HIF-1α-Reaktionen sind jedoch auch mit der Regulierung der mitochondrialen Dysfunktion durch die Bildung übermäßiger reaktiver Sauerstoffspezies in den Mitochondrien verbunden. ⓘ
Auch andere Pfade beeinflussen den Charakter des erwachsenen Muskels. So kann beispielsweise physische Kraft innerhalb einer Muskelfaser den Transkriptionsfaktor Serum Response Factor aus dem Strukturprotein Titin freisetzen, was zu einem veränderten Muskelwachstum führt. ⓘ
Bewegung

Körperliche Bewegung wird häufig als Mittel zur Verbesserung der motorischen Fähigkeiten, der Fitness, der Muskel- und Knochenstärke sowie der Gelenkfunktion empfohlen. Bewegung hat verschiedene Auswirkungen auf Muskeln, Bindegewebe, Knochen und die Nerven, die die Muskeln stimulieren. Eine dieser Wirkungen ist die Muskelhypertrophie, eine Vergrößerung des Muskels aufgrund einer Zunahme der Anzahl der Muskelfasern oder der Querschnittsfläche der Myofibrillen. Die Veränderungen der Muskeln hängen von der Art der Übung ab. ⓘ
Im Allgemeinen gibt es zwei Arten von Trainingsprogrammen: aerobes und anaerobes Training. Aerobes Training (z. B. Marathonlauf) umfasst Aktivitäten von geringer Intensität, aber langer Dauer, bei denen die beanspruchten Muskeln unterhalb ihrer maximalen Kontraktionskraft liegen. Aerobe Aktivitäten beruhen auf der aeroben Atmung (d. h. dem Zitronensäurezyklus und der Elektronentransportkette) zur Gewinnung von Stoffwechselenergie durch den Verbrauch von Fett, Eiweiß, Kohlenhydraten und Sauerstoff. Muskeln, die an aeroben Übungen beteiligt sind, enthalten einen höheren Prozentsatz an Muskelfasern vom Typ I (oder langsam zuckende Muskelfasern), die in erster Linie Mitochondrien- und Oxidationsenzyme enthalten, die mit der aeroben Atmung verbunden sind. Im Gegensatz dazu werden anaerobe Übungen mit kurzer Dauer, aber hoher Intensität assoziiert (z. B. Sprinten und Gewichtheben). Bei anaeroben Aktivitäten werden vorwiegend schnell zuckende Muskelfasern vom Typ II eingesetzt. Typ-II-Muskelfasern sind bei anaeroben Aktivitäten auf die Glukogenese zur Energiegewinnung angewiesen. Bei anaerobem Training verbrauchen die Typ-II-Fasern wenig Sauerstoff, Eiweiß und Fett, produzieren große Mengen an Milchsäure und sind ermüdbar. Viele Übungen sind teilweise aerob und anaerob, z. B. Fußball und Klettern. ⓘ
Das Vorhandensein von Milchsäure hat eine hemmende Wirkung auf die ATP-Produktion im Muskel. Sie kann sogar die ATP-Produktion stoppen, wenn die intrazelluläre Konzentration zu hoch wird. Ausdauertraining mildert jedoch den Aufbau von Milchsäure durch erhöhte Kapillarisierung und Myoglobin. Dadurch wird die Fähigkeit erhöht, Abfallprodukte wie Milchsäure aus den Muskeln zu entfernen, um die Muskelfunktion nicht zu beeinträchtigen. Sobald die Milchsäure aus den Muskeln entfernt wurde, kann sie von anderen Muskeln oder Körpergeweben als Energiequelle genutzt oder zur Leber transportiert werden, wo sie wieder in Pyruvat umgewandelt wird. Neben der Erhöhung des Milchsäuregehalts führt anstrengende körperliche Betätigung zu einem Verlust von Kaliumionen im Muskel. Dies kann die Wiederherstellung der Muskelfunktion durch Schutz vor Ermüdung erleichtern. ⓘ
Ein verzögert auftretender Muskelkater ist ein Schmerz oder ein Unwohlsein, das ein bis drei Tage nach dem Training auftritt und im Allgemeinen nach zwei bis drei Tagen abklingt. Früher ging man davon aus, dass er durch die Ansammlung von Milchsäure verursacht wird. Eine neuere Theorie besagt, dass er durch winzige Risse in den Muskelfasern verursacht wird, die durch eine exzentrische Kontraktion oder ein ungewohntes Trainingsniveau entstehen. Da sich die Milchsäure relativ schnell auflöst, kann sie die Schmerzen, die noch Tage nach dem Training auftreten, nicht erklären. ⓘ
Klinische Bedeutung
Erkrankungen der Muskeln
Erkrankungen der Skelettmuskulatur werden als Myopathien bezeichnet, während Erkrankungen der Nerven als Neuropathien bezeichnet werden. Beide können die Muskelfunktion beeinträchtigen oder Muskelschmerzen verursachen und fallen unter den Oberbegriff der neuromuskulären Erkrankungen. Die Ursache vieler Myopathien wird auf Mutationen in den verschiedenen assoziierten Muskelproteinen zurückgeführt. Zu den entzündlichen Myopathien gehören Polymyositis und Einschlusskörpermyositis. ⓘ

Neuromuskuläre Erkrankungen betreffen die Muskeln und ihre nervliche Steuerung. Im Allgemeinen können Probleme mit der Nervensteuerung je nach Ort und Art des Problems zu Spastizität oder Lähmungen führen. Eine Reihe von Bewegungsstörungen wird durch neurologische Erkrankungen wie die Parkinson-Krankheit und die Huntington-Krankheit verursacht, bei denen es zu einer Funktionsstörung des zentralen Nervensystems kommt. ⓘ
Zu den Symptomen von Muskelerkrankungen können Schwäche, Spastizität, Myoklonus und Myalgie gehören. Zu den diagnostischen Verfahren, die Muskelerkrankungen aufdecken können, gehören die Bestimmung des Kreatinkinase-Spiegels im Blut und die Elektromyografie (Messung der elektrischen Aktivität in den Muskeln). In einigen Fällen kann eine Muskelbiopsie durchgeführt werden, um eine Myopathie zu identifizieren, sowie ein Gentest, um DNA-Anomalien zu ermitteln, die mit bestimmten Myopathien und Dystrophien in Verbindung stehen. ⓘ
Eine nicht-invasive Elastographietechnik, die das Muskelgeräusch misst, wird derzeit erprobt, um eine Möglichkeit zur Überwachung neuromuskulärer Erkrankungen zu schaffen. Das Geräusch, das ein Muskel erzeugt, entsteht durch die Verkürzung der Aktomyosin-Filamente entlang der Achse des Muskels. Während der Kontraktion verkürzt sich der Muskel in seiner Länge und dehnt sich in seiner Breite aus, wodurch an der Oberfläche Vibrationen entstehen. ⓘ
Hypertrophie
Unabhängig von Kraft- und Leistungsmessungen können Muskeln durch eine Reihe von Faktoren wie Hormonsignale, Entwicklungsfaktoren, Krafttraining und Krankheiten zu einer Vergrößerung angeregt werden. Entgegen der landläufigen Meinung kann die Anzahl der Muskelfasern nicht durch Training erhöht werden. Stattdessen wachsen die Muskeln durch eine Kombination aus Muskelzellwachstum, da neue Proteinfilamente hinzugefügt werden, und zusätzlicher Masse, die von undifferenzierten Satellitenzellen neben den bestehenden Muskelzellen bereitgestellt wird. ⓘ
Biologische Faktoren wie das Alter und der Hormonspiegel können die Muskelhypertrophie beeinflussen. Während der Pubertät kommt es bei Männern zu einer beschleunigten Hypertrophie, da die Menge der vom Körper produzierten wachstumsfördernden Hormone ansteigt. Die natürliche Hypertrophie endet normalerweise mit dem vollen Wachstum im späten Teenageralter. Da Testosteron eines der wichtigsten Wachstumshormone des Körpers ist, ist Hypertrophie für Männer im Durchschnitt viel leichter zu erreichen als für Frauen. Die Einnahme von zusätzlichem Testosteron oder anderen anabolen Steroiden verstärkt die Muskelhypertrophie. ⓘ
Muskuläre, spinale und neurale Faktoren wirken sich alle auf den Muskelaufbau aus. Manchmal kann eine Person einen Kraftzuwachs in einem bestimmten Muskel feststellen, obwohl nur dessen Gegenspieler trainiert wurde, z. B. wenn eine Bodybuilderin feststellt, dass ihr linker Bizeps stärker ist, nachdem sie ein Trainingsprogramm absolviert hat, das sich nur auf den rechten Bizeps konzentriert. Dieses Phänomen wird als Cross-Training bezeichnet. ⓘ
Atrophie

Jeden Tag werden ein bis zwei Prozent der Muskeln abgebaut und neu aufgebaut. Inaktivität, Unterernährung, Krankheiten und Alterung können den Abbau verstärken und zu Muskelschwund oder Sarkopenie führen. Sarkopenie ist in der Regel ein altersbedingter Prozess, der zu Gebrechlichkeit und deren Folgen führen kann. Eine Abnahme der Muskelmasse kann mit einer geringeren Anzahl und Größe der Muskelzellen sowie einem geringeren Proteingehalt einhergehen. ⓘ
Es ist bekannt, dass die Raumfahrt beim Menschen, die mit längeren Perioden der Immobilisierung und Schwerelosigkeit verbunden ist, zu Muskelschwächung und -schwund führt, was bei einigen Muskeln zu einem Verlust von bis zu 30 % der Masse führt. Solche Folgen sind auch bei einigen Säugetieren nach dem Winterschlaf zu beobachten. ⓘ
Viele Krankheiten und Zustände, darunter Krebs, AIDS und Herzversagen, können zu Muskelschwund führen, der als Kachexie bekannt ist. ⓘ
Forschung
Myopathien wurden mit Zellkultursystemen von Muskeln aus gesunden oder kranken Gewebebiopsien modelliert. Eine weitere Quelle für Skelettmuskeln und Vorläuferzellen ist die gezielte Differenzierung von pluripotenten Stammzellen. Bei der Erforschung der Eigenschaften der Skelettmuskulatur kommen zahlreiche Techniken zum Einsatz. Die elektrische Muskelstimulation wird zur Bestimmung von Kraft und Kontraktionsgeschwindigkeit bei verschiedenen Frequenzen eingesetzt, die mit der Zusammensetzung der Fasertypen und der Mischung innerhalb einer einzelnen Muskelgruppe zusammenhängen. In-vitro-Muskeltests werden für eine umfassendere Charakterisierung der Muskeleigenschaften eingesetzt. ⓘ
Die mit der Muskelkontraktion verbundene elektrische Aktivität wird mittels Elektromyographie (EMG) gemessen. Der Skelettmuskel zeigt zwei physiologische Reaktionen: Entspannung und Kontraktion. Die Mechanismen, durch die diese Reaktionen ausgelöst werden, führen zu einer elektrischen Aktivität, die durch EMG gemessen wird. Insbesondere kann mit EMG das Aktionspotenzial eines Skelettmuskels gemessen werden, das durch die Hyperpolarisierung der motorischen Axone aufgrund der an den Muskel gesendeten Nervenimpulse entsteht. EMG wird in der Forschung eingesetzt, um festzustellen, ob der betreffende Skelettmuskel aktiviert wird, wie viel Kraft erzeugt wird, und als Indikator für die Muskelermüdung. Es gibt zwei Arten von EMG: das intra-muskuläre EMG und das am häufigsten verwendete, das Oberflächen-EMG. Die EMG-Signale sind viel größer, wenn ein Skelettmuskel kontrahiert, als wenn er sich entspannt. Bei kleineren und tiefer liegenden Skelettmuskeln sind die EMG-Signale jedoch geringer und werden daher als weniger wertvolles Verfahren zur Messung der Aktivierung angesehen. In der EMG-Forschung wird in der Regel eine maximale freiwillige Kontraktion (MVC) des betreffenden Skelettmuskels durchgeführt, um Referenzdaten für die übrigen EMG-Aufzeichnungen während der Hauptversuche für denselben Skelettmuskel zu erhalten. ⓘ
In der Forschung zur Entwicklung künstlicher Muskeln werden auch elektroaktive Polymere verwendet. ⓘ
Einfluss auf das körperliche Wohlbefinden
Die Skelettmuskulatur kann über Botenstoffe das Immunsystem, den Fettstoffwechsel und die Entstehung von Diabetes mellitus beeinflussen. ⓘ
 Reizantwort der Skelettmuskulatur ⓘ |