Alanin
 Skelettformel von L-Alanin
| |||
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Alanin
| |||
| Bevorzugter IUPAC-Name
2-Aminopropansäure | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
| ||
| 3DMet |
| ||
Beilstein-Referenz
|
1720248 | ||
| ChEBI |
| ||
| ChEMBL |
| ||
| ChemSpider | |||
| Arzneimittelbank |
| ||
| EC-Nummer |
| ||
Gmelin-Referenz
|
49628 | ||
IUPHAR/BPS
|
| ||
| KEGG |
| ||
PubChem CID
|
|||
| UNII |
| ||
CompTox Dashboard (EPA)
|
|||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C3H7NO2 | ||
| Molekulare Masse | 89,094 g-mol-1 | ||
| Erscheinungsbild | weißes Pulver | ||
| Dichte | 1,424 g/cm3 | ||
| Schmelzpunkt | 258 °C (496 °F; 531 K) (sublimiert) | ||
Löslichkeit in Wasser
|
167,2 g/L (25 °C) | ||
| log P | -0.68 | ||
| Acidität (pKa) |
| ||
Magnetische Suszeptibilität (χ)
|
-50,5-10-6 cm3/mol | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox-Referenzen
| |||
Alanin (Symbol Ala oder A) ist eine α-Aminosäure, die in der Biosynthese von Proteinen verwendet wird. Sie enthält eine Aminogruppe und eine Carbonsäuregruppe, die beide an das zentrale Kohlenstoffatom gebunden sind, das auch eine Methylgruppe als Seitenkette trägt. Ihr systematischer IUPAC-Name lautet daher 2-Aminopropansäure, und sie wird als unpolare, aliphatische α-Aminosäure eingestuft. Unter biologischen Bedingungen liegt sie in ihrer zwitterionischen Form vor, bei der die Aminogruppe protoniert (als -NH3+) und die Carboxylgruppe deprotoniert (als -CO2-) ist. Es ist für den Menschen nicht essentiell, da es im Stoffwechsel synthetisiert werden kann und nicht in der Nahrung vorhanden sein muss. Es wird durch alle Codons kodiert, die mit GC beginnen (GCU, GCC, GCA und GCG). ⓘ
Das L-Isomer von Alanin (linksdrehend) ist dasjenige, das in die Proteine eingebaut wird. L-Alanin ist nach Leucin das am zweithäufigsten vorkommende Protein und macht in einer Stichprobe von 1 150 Proteinen 7,8 % der Primärstruktur aus. Die rechtsdrehende Form, D-Alanin, kommt in Polypeptiden in einigen bakteriellen Zellwänden und in einigen Peptidantibiotika vor und ist in den Geweben vieler Krebstiere und Weichtiere als Osmolyt enthalten. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
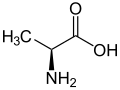
| |||||||||||||||||||
| Strukturformel von L-Alanin, dem natürlich vorkommenden Enantiomer | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Alanin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H7NO2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
V06DD | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 89,10 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,40 g·cm−3 | ||||||||||||||||||
| Schmelzpunkt |
297 °C (Zersetzung) | ||||||||||||||||||
| pKS-Wert |
| ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Die industrielle Herstellung von L-Alanin erfolgt ausgehend von der L-Asparaginsäure durch Abspaltung der β-Carboxygruppe in einem biotechnologischen Verfahren. Durch Strecker-Synthese gewonnenes racemisches Alanin kann an der Aminogruppe acetyliert werden und wird dann einer Racematspaltung unterworfen. Dabei wird unter Verwendung von L-Aminoacylase enantioselektiv die Acetylgruppe von L-N-Acetylalanin abgespalten und es entsteht L-Alanin, während D-N-Acetylalanin nicht hydrolysiert wird. Die Trennung von L-Alanin und D-N-Acetylalanin ist einfach. Benötigt man D-Alanin, so wird D-N-Acetylalanin unter sauren Bedingungen hydrolysiert, d. h., die Acetylgruppe wird abgespalten. Wenn kein Bedarf für D-Alanin besteht, wird das bei der kinetischen Racematspaltung anfallende D-N-Acetylalanin durch Einwirkung von Essigsäureanhydrid racemisiert und recycliert. ⓘ
DL-Alanin kann auch aus 2-Brompropansäure synthetisiert werden, dieses Verfahren besitzt jedoch keine industrielle Bedeutung. ⓘ
Im Stoffwechsel wird L-Alanin durch Transaminierung aus dem Endprodukt der Glykolyse, dem Pyruvat, synthetisiert. Bakterien erhalten benötigtes D-Alanin aus L-Alanin mittels des Enzyms Alaninracemase (EC 5.1.1.1). ⓘ

Aufbau
Alanin ist eine aliphatische Aminosäure, da die mit dem α-Kohlenstoffatom verbundene Seitenkette eine Methylgruppe (-CH3) ist; Alanin ist nach Glycin die einfachste α-Aminosäure. Die Methyl-Seitenkette von Alanin ist nicht reaktiv und ist daher kaum direkt an der Proteinfunktion beteiligt. Alanin ist eine nicht-essentielle Aminosäure, d. h. sie kann vom menschlichen Körper selbst hergestellt werden und muss nicht über die Nahrung zugeführt werden. Alanin kommt in einer Vielzahl von Lebensmitteln vor, ist aber besonders reichlich in Fleisch enthalten. ⓘ
Quellen
Biosynthese
Alanin kann aus Pyruvat und verzweigtkettigen Aminosäuren wie Valin, Leucin und Isoleucin synthetisiert werden. ⓘ
Alanin wird durch reduktive Aminierung von Pyruvat in einem zweistufigen Prozess hergestellt. Im ersten Schritt werden α-Ketoglutarat, Ammoniak und NADH durch Glutamatdehydrogenase in Glutamat, NAD+ und Wasser umgewandelt. Im zweiten Schritt wird die Aminogruppe des neu gebildeten Glutamats durch ein Aminotransferase-Enzym auf Pyruvat übertragen, wodurch das α-Ketoglutarat regeneriert und das Pyruvat in Alanin umgewandelt wird. Das Endergebnis ist, dass Pyruvat und Ammoniak zu Alanin umgewandelt werden, wobei ein reduzierendes Äquivalent verbraucht wird. Da Transaminationsreaktionen leicht umkehrbar sind und Pyruvat in allen Zellen vorhanden ist, kann Alanin leicht gebildet werden und ist daher eng mit Stoffwechselwegen wie der Glykolyse, der Glukoneogenese und dem Zitronensäurezyklus verbunden. ⓘ
Chemische Synthese
L-Alanin wird industriell durch Decarboxylierung von L-Aspartat mit Hilfe von Aspartat-4-Decarboxylase hergestellt. Die Fermentationswege zu L-Alanin werden durch Alanin-Racemase erschwert. ⓘ
Racemisches Alanin kann durch die Kondensation von Acetaldehyd mit Ammoniumchlorid in Gegenwart von Natriumcyanid durch die Strecker-Reaktion oder durch die Ammonolyse von 2-Brompropansäure hergestellt werden.
Abbaubarkeit
Alanin wird durch oxidative Desaminierung abgebaut, der Umkehrreaktion der oben beschriebenen reduktiven Aminierung, die von denselben Enzymen katalysiert wird. Die Richtung des Prozesses wird weitgehend durch die relative Konzentration der Substrate und Produkte der beteiligten Reaktionen gesteuert. ⓘ
Alanin-Welt-Hypothese
Alanin ist eine der zwanzig kanonischen α-Aminosäuren, die als Bausteine (Monomere) für die Ribosomen-vermittelte Biosynthese von Proteinen verwendet werden. Man geht davon aus, dass Alanin eine der frühesten Aminosäuren ist, die in das Standardrepertoire des genetischen Codes aufgenommen wurde. Auf der Grundlage dieser Tatsache wurde die Hypothese der "Alaninwelt" aufgestellt. Diese Hypothese erklärt die evolutionäre Auswahl von Aminosäuren im Repertoire des genetischen Codes vom chemischen Standpunkt aus. In diesem Modell beschränkt sich die Auswahl der Monomere (d.h. der Aminosäuren) für die ribosomale Proteinsynthese auf diejenigen Alanin-Derivate, die für den Aufbau von α-Helix- oder β-Faltblatt-Sekundärstrukturelementen geeignet sind. Die vorherrschenden Sekundärstrukturen im Leben, wie wir es kennen, sind α-Helices und β-Faltblätter, und die meisten kanonischen Aminosäuren können als chemische Derivate von Alanin betrachtet werden. Daher können die meisten kanonischen Aminosäuren in Proteinen durch Punktmutationen gegen Ala ausgetauscht werden, während die Sekundärstruktur intakt bleibt. Die Tatsache, dass Ala die Sekundärstrukturpräferenzen der meisten kodierten Aminosäuren nachahmt, wird bei der Alanin-Scanning-Mutagenese praktisch ausgenutzt. Darüber hinaus wird in der klassischen Röntgenkristallographie häufig das Polyalanin-Backbone-Modell verwendet, um dreidimensionale Strukturen von Proteinen durch molekulare Ersetzung zu bestimmen - eine modellbasierte Phasenmethode. ⓘ
Physiologische Funktion
Glukose-Alanin-Zyklus
Bei Säugetieren spielt Alanin eine Schlüsselrolle im Glukose-Alanin-Zyklus zwischen den Geweben und der Leber. In Muskeln und anderen Geweben, die Aminosäuren als Brennstoff abbauen, werden Aminogruppen durch Transaminierung in Form von Glutamat gesammelt. Glutamat kann dann seine Aminogruppe durch die Wirkung der Alanin-Aminotransferase auf Pyruvat, ein Produkt der Muskelglykolyse, übertragen, wobei Alanin und α-Ketoglutarat entstehen. Das Alanin gelangt in den Blutkreislauf und wird zur Leber transportiert. Die Alanin-Aminotransferase-Reaktion findet in der Leber in umgekehrter Weise statt, wo das regenerierte Pyruvat in der Gluconeogenese verwendet wird und Glucose bildet, die über den Blutkreislauf in die Muskeln zurückkehrt. Glutamat gelangt in der Leber in die Mitochondrien und wird von der Glutamat-Dehydrogenase zu α-Ketoglutarat und Ammonium abgebaut, das wiederum am Harnstoffzyklus teilnimmt und Harnstoff bildet, der über die Nieren ausgeschieden wird. ⓘ
Der Glucose-Alanin-Zyklus ermöglicht es, Pyruvat und Glutamat aus dem Muskel zu entfernen und sicher zur Leber zu transportieren. Dort wird Pyruvat zur Regenerierung von Glukose verwendet, woraufhin die Glukose in den Muskel zurückkehrt, um dort zur Energiegewinnung verstoffwechselt zu werden: Auf diese Weise wird die energetische Last der Glukoneogenese in die Leber statt in den Muskel verlagert, und das gesamte im Muskel verfügbare ATP kann für die Muskelkontraktion verwendet werden. Es handelt sich um einen katabolen Weg, der auf dem Proteinabbau im Muskelgewebe beruht. Ob und in welchem Umfang er bei Nicht-Säugetieren auftritt, ist unklar. ⓘ
Zusammenhang mit Diabetes
Veränderungen im Alanin-Zyklus, die zu einem Anstieg der Alanin-Aminotransferase (ALT) im Serum führen, werden mit der Entwicklung von Diabetes Typ II in Verbindung gebracht. ⓘ
Chemische Eigenschaften

Alanin ist nützlich bei Experimenten zum Funktionsverlust in Bezug auf die Phosphorylierung. Bei einigen Techniken wird eine Bibliothek von Genen erstellt, von denen jedes eine Punktmutation an einer anderen Stelle im interessierenden Bereich aufweist, manchmal sogar an jeder Stelle des gesamten Gens: Dies wird als "Scanning-Mutagenese" bezeichnet. Die einfachste Methode, die als erste angewandt wurde, ist das so genannte Alanin-Scanning, bei dem jede Position der Reihe nach zu Alanin mutiert wird. ⓘ
Die Hydrierung von Alanin ergibt den Aminoalkohol Alaninol, der ein nützlicher chiraler Baustein ist. ⓘ
Freies Radikal
Bei der Desaminierung eines Alaninmoleküls entsteht das freie Radikal CH3C-HCO2-. Die Desaminierung kann in festem oder wässrigem Alanin durch Strahlung ausgelöst werden, die eine homolytische Spaltung der Kohlenstoff-Stickstoff-Bindung bewirkt. ⓘ
Diese Eigenschaft von Alanin wird bei dosimetrischen Messungen in der Strahlentherapie genutzt. Wenn normales Alanin bestrahlt wird, bewirkt die Strahlung, dass bestimmte Alaninmoleküle zu freien Radikalen werden. Da diese Radikale stabil sind, kann der Gehalt an freien Radikalen später mit Hilfe der paramagnetischen Elektronenresonanz gemessen werden, um festzustellen, wie viel Strahlung das Alanin ausgesetzt war. Dies gilt als biologisch relevantes Maß für das Ausmaß der Strahlenschäden, die lebendes Gewebe bei gleicher Strahlenbelastung erleiden würde. Strahlentherapie-Behandlungspläne können im Testmodus an Alanin-Kügelchen abgegeben werden, die dann gemessen werden können, um zu überprüfen, ob das Behandlungssystem das beabsichtigte Muster der Strahlendosis korrekt abgibt. ⓘ
Enantiomere
Alanin ist chiral, tritt also in zwei spiegelbildlichen Formen auf, wobei das L-Alanin eine proteinogene Aminosäure ist, die nach IUPAC auch als (S)-2-Aminopropansäure oder als (S)-Alanin bezeichnet wird. D-Alanin [Synonym: (R)-Alanin] findet man als Baustein des Mureins, der Grundsubstanz von Bakterienzellwänden. Daneben gibt es noch das nichtproteinogene β-Alanin. ⓘ
Wenn in diesem Text oder in der wissenschaftlichen Literatur „Alanin“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist L-Alanin gemeint. ⓘ
| Enantiomere von Alanin ⓘ | ||
| Name | L-Alanin | D-Alanin |
| Andere Namen | (S)-Alanin | (R)-Alanin |
| Strukturformel |  |
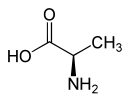
|
| CAS-Nummer | 56-41-7 | 338-69-2 |
| 302-72-7 (Racemat) | ||
| EG-Nummer | 200-273-8 | 206-418-1 |
| 206-126-4 (Racemat) | ||
| ECHA-Infocard | 100.000.249 | 100.005.835 |
| 100.005.571 (Racemat) | ||
| PubChem | 5950 | 71080 |
| 602 (Racemat) | ||
| DrugBank | DB00160 | DB01786 |
| − (Racemat) | ||
| FL-Nummer | 17.002 | - |
| 17.024 (Racemat) | ||
| Wikidata | Q218642 | Q27076975 |
| Q27101911 (Racemat) | ||
Eigenschaften

Alanin liegt meist als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das freie Elektronenpaar des Stickstoffatoms der Aminogruppe wandert: Beim physiologischen pH-Wert von 7,4 liegt ein großer Teil der Alanin-Moleküle als Zwitterion vor. Der isoelektrische Punkt von Alanin liegt bei pH 6,1 und Alanin erreicht seine geringste Löslichkeit in Wasser, da fast alle Alanin-Moleküle als Zwitterionen vorliegen. Die Lösung hat an diesem Punkt die geringste elektrische Leitfähigkeit, da Zwitterionen als Ganzes ungeladen sind. ⓘ
Verwendung
L-Alanin ist Bestandteil von Infusionslösungen zur parenteralen Ernährung und von Diätetika. ⓘ
Die beiden Enantiomeren des Alanins werden, mit einer Schutzgruppe versehen, häufig für die Synthese von Peptiden und Proteinen eingesetzt. Weiterhin werden L- oder D-Alanin auch in der stereoselektiven Synthese als Edukt eingesetzt. ⓘ
Verwandte Verbindungen
- β-Alanin
- Dehydroalanin ⓘ