Gram-Färbung
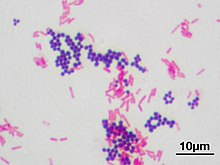
Die Gram-Färbung oder Gram-Färbung, auch Gram-Methode genannt, ist eine Färbemethode zur Einteilung von Bakterienarten in zwei große Gruppen: grampositive und gramnegative Bakterien. Der Name geht auf den dänischen Bakteriologen Hans Christian Gram zurück, der diese Technik 1884 entwickelte. ⓘ
Bei der Gram-Färbung werden die Bakterien anhand der chemischen und physikalischen Eigenschaften ihrer Zellwände unterschieden. Gram-positive Zellen haben eine dicke Peptidoglykanschicht in der Zellwand, die den primären Farbstoff, Kristallviolett, zurückhält. Gram-negative Zellen haben eine dünnere Peptidoglykanschicht, die das Kristallviolett bei Zugabe von Ethanol auswaschen kann. Sie werden durch die Gegenfärbung, in der Regel Safranin oder Fuchsin, rosa oder rot gefärbt. Nach der Zugabe von Kristallviolett wird immer Lugolsche Jodlösung zugegeben, um die Verbindung des Farbstoffs mit der Zellmembran zu verstärken. ⓘ
Die Gram-Färbung ist fast immer der erste Schritt bei der vorläufigen Identifizierung eines bakteriellen Organismus. Obwohl die Gram-Färbung sowohl in der Klinik als auch in der Forschung ein wertvolles Diagnoseinstrument ist, können nicht alle Bakterien mit dieser Technik eindeutig klassifiziert werden. Daher gibt es Gram-variable und Gram-indeterminierte Gruppen. ⓘ


Geschichte
Der dänische Mediziner Hans Christian Gram entwickelte die Färbemethode als Mitarbeiter bei Carl Friedländer in Berlin. Er suchte nach einer Färbemethode, mit der Bakterien in tierischen Geweben dargestellt werden können, also kontrastierend zu den Gewebezellen gefärbt wurden. Die gefundene Färbemethode, veröffentlicht 1884, hatte jedoch nur bei einigen Bakterien, den grampositiven, Erfolg. Émile Roux wendete die Methode zur färberischen Differenzierung von grampositiven und gramnegativen Bakterien an, insbesondere zur Bestimmung von Gonokokken (gramnegativ im Gegensatz zu vielen anderen Kokken) (Veröffentlichung 1886). ⓘ
Verwendet

Die Gram-Färbung ist ein bakteriologisches Laborverfahren zur Unterscheidung von Bakterienarten in zwei große Gruppen (gram-positiv und gram-negativ) auf der Grundlage der physikalischen Eigenschaften ihrer Zellwände. Die Gram-Färbung wird nicht zur Klassifizierung von Archaeen (früher Archaeabakterien) verwendet, da diese Mikroorganismen sehr unterschiedliche Reaktionen zeigen, die nicht ihren phylogenetischen Gruppen entsprechen. ⓘ
Einige Organismen sind gramvariabel (d. h. sie können sich sowohl negativ als auch positiv färben); andere werden mit keinem der bei der Gram-Technik verwendeten Farbstoffe angefärbt und sind nicht zu erkennen. In einem modernen Labor für Umwelt- oder Molekularmikrobiologie erfolgt die Identifizierung meist anhand von Gensequenzen und anderen molekularen Techniken, die weitaus spezifischer und informativer sind als die Differenzialfärbung. ⓘ
Medizinische
Gram-Färbungen werden bei Verdacht auf eine Infektion an Körperflüssigkeiten oder Biopsien durchgeführt. Gram-Färbungen liefern sehr viel schneller Ergebnisse als Kulturen und sind besonders wichtig, wenn eine Infektion für die Behandlung und die Prognose des Patienten von entscheidender Bedeutung ist; Beispiele sind Liquor bei Meningitis und Synovialflüssigkeit bei septischer Arthritis. ⓘ
Färbemechanismus

Gram-positive Bakterien haben eine dicke, netzartige Zellwand aus Peptidoglykan (50-90 % der Zellhülle) und werden daher mit Kristallviolett violett angefärbt, während gram-negative Bakterien eine dünnere Schicht (10 % der Zellhülle) haben, so dass sie die violette Färbung nicht behalten und mit Safranin rosa angefärbt werden. Die Gram-Färbung besteht aus vier grundlegenden Schritten:
- Auf einen hitzefixierten Ausstrich einer Bakterienkultur wird eine Primärfärbung (Kristallviolett) aufgetragen. Die Hitzefixierung tötet einige Bakterien ab, dient aber hauptsächlich dazu, die Bakterien auf dem Objektträger zu fixieren, damit sie während des Färbevorgangs nicht ausgespült werden.
- Die Zugabe von Jod, das an Kristallviolett bindet und es in der Zelle festhält
- Schnelle Entfärbung mit Ethanol oder Aceton
- Gegenfärbung mit Safranin. Carbolfuchsin wird manchmal durch Safranin ersetzt, da es anaerobe Bakterien intensiver färbt, wird aber seltener als Gegenfärbung verwendet. ⓘ
| Anwendung von | Reagenz | Zellfarbe ⓘ | |||
|---|---|---|---|---|---|
| Gram-positiv | Gram-negativ | ||||
| Primärer Farbstoff | Kristallviolett | violett | violett | ||
| Beizmittel | Jod | violett | violett | ||
| Entfärber | Alkohol/Aceton | violett | farblos | ||
| Gegenbeize | Safranin/Kohlensäurefuchsin | violett | rosa oder rot | ||
Kristallviolett (CV) dissoziiert in wässrigen Lösungen in CV+
und Chlorid (Cl-
) Ionen. Diese Ionen durchdringen die Zellwand sowohl von grampositiven als auch von gramnegativen Zellen. Das CV+
Ionen interagieren mit negativ geladenen Komponenten der Bakterienzellen und färben die Zellen violett. ⓘ
Iodid (I-
oder I-
3) interagiert mit CV+
und bildet große Komplexe aus Kristallviolett und Jod (CV-I) in den inneren und äußeren Schichten der Zelle. Jod wird oft als Beizmittel bezeichnet, ist aber ein Fänger, der die Entfernung des CV-I-Komplexes verhindert und somit die Zelle färbt. ⓘ
Wenn ein Entfärbungsmittel wie Alkohol oder Aceton hinzugefügt wird, interagiert es mit den Lipiden der Zellmembran. Eine gramnegative Zelle verliert ihre äußere Lipopolysaccharidmembran, und die innere Peptidoglykanschicht bleibt frei. Die CV-I-Komplexe werden zusammen mit der äußeren Membran aus der gramnegativen Zelle ausgewaschen. Im Gegensatz dazu wird eine gram-positive Zelle durch eine Ethanolbehandlung dehydriert. Die großen CV-I-Komplexe werden aufgrund der mehrschichtigen Beschaffenheit des Peptidoglycans in der gram-positiven Zelle eingeschlossen. Der Entfärbungsschritt ist von entscheidender Bedeutung und muss zeitlich korrekt durchgeführt werden; die Kristallviolettfärbung wird sowohl von gram-positiven als auch von negativen Zellen entfernt, wenn das Entfärbungsmittel zu lange einwirkt (einige Sekunden). ⓘ
Nach der Entfärbung bleibt die gram-positive Zelle violett und die gram-negative Zelle verliert ihre violette Farbe. Die Gegenfärbung, bei der es sich in der Regel um positiv geladenes Safranin oder basisches Fuchsin handelt, wird zuletzt aufgetragen, damit die entfärbten gramnegativen Bakterien eine rosa oder rote Farbe erhalten. Sowohl gram-positive als auch gram-negative Bakterien nehmen die Gegenfärbung auf. Bei grampositiven Bakterien ist die Gegenfärbung jedoch aufgrund der dunkleren Kristallviolettfärbung nicht zu sehen. ⓘ
Die Behandlungen mit Lugolscher Lösung und mit Alkohol sind die entscheidenden Schritte bei der Gramfärbung. ⓘ
Beispiele
Gram-positive Bakterien
Gram-positive Bakterien haben im Allgemeinen eine einzige Membran (Monoderm), die von einem dicken Peptidoglykan umgeben ist. Diese Regel wird von zwei Phyla befolgt: Bacillota (mit Ausnahme der Klassen Mollicutes und Negativicutes) und die Actinomycetota. Im Gegensatz dazu sind Mitglieder der Chloroflexota (grüne Nicht-Schwefelbakterien) Monoderme, die jedoch ein dünnes oder fehlendes Peptidoglykan (Klasse Dehalococcoidetes) besitzen und sich negativ, positiv oder unbestimmt färben können; Mitglieder der Deinococcota färben sich positiv, sind jedoch Diderme mit einem dicken Peptidoglykan. ⓘ
Historisch gesehen bildeten die gram-positiven Formen das Phylum Firmicutes, eine Bezeichnung, die heute für die größte Gruppe verwendet wird. Dazu gehören viele bekannte Gattungen wie Lactobacillus, Bacillus, Listeria, Staphylococcus, Streptococcus, Enterococcus und Clostridium. Sie wurde auch um die Mollicutes erweitert, also um Bakterien wie Mycoplasma und Thermoplasma, die keine Zellwände haben und daher nicht gramgefärbt werden können, aber von solchen Formen abstammen. ⓘ
Einige Bakterien haben Zellwände, die besonders gut in der Lage sind, Farbstoffe zurückzuhalten. Diese erscheinen in der Gram-Färbung positiv, obwohl sie nicht eng mit anderen gram-positiven Bakterien verwandt sind. Diese werden als säurefeste Bakterien bezeichnet und können nur durch spezielle Färbeverfahren von anderen grampositiven Bakterien unterschieden werden. ⓘ
Gramnegative Bakterien
Gramnegative Bakterien besitzen im Allgemeinen eine dünne Peptidoglykanschicht zwischen zwei Membranen (Diderm). Lipopolysaccharid (LPS) ist das am häufigsten vorkommende Antigen auf der Zelloberfläche der meisten gramnegativen Bakterien und macht bis zu 80 % der äußeren Membran von E. coli und Salmonella aus. Die meisten bakteriellen Phyla sind gramnegativ, einschließlich der Cyanobakterien, grünen Schwefelbakterien und der meisten Pseudomonadota (Ausnahmen sind einige Mitglieder der Rickettsiales und die Insekten-Endosymbionten der Enterobacteriales). ⓘ
Gram-variable und Gram-indeterminierte Bakterien
Einige Bakterien zeigen nach der Färbung mit der Gram-Färbung ein gramvariables Muster: Man sieht eine Mischung aus rosa und violetten Zellen. Bei Kulturen von Bacillus, Butyrivibrio und Clostridium geht eine Abnahme der Peptidoglykandicke während des Wachstums mit einer Zunahme der Anzahl der gramnegativ gefärbten Zellen einher. Darüber hinaus kann bei allen Bakterien, die mit der Gram-Färbung angefärbt werden, das Alter der Kultur die Ergebnisse der Färbung beeinflussen. ⓘ
Gram-indeterminierte Bakterien reagieren nicht vorhersehbar auf die Gram-Färbung und können daher nicht als gram-positiv oder gram-negativ eingestuft werden. Beispiele sind viele Mycobacterium-Arten, darunter Mycobacterium bovis, Mycobacterium leprae und Mycobacterium tuberculosis, die beiden letzteren Erreger von Lepra bzw. Tuberkulose. Den Bakterien der Gattung Mycoplasma fehlt eine Zellwand um ihre Zellmembranen, so dass sie sich mit der Gram-Methode nicht färben lassen und gegen Antibiotika, die auf die Zellwandsynthese abzielen, resistent sind. ⓘ
Orthografische Anmerkung
Der Begriff Gram-Färbung leitet sich vom Nachnamen von Hans Christian Gram ab; der Namensgeber (Gram) wird daher großgeschrieben, nicht aber das Hauptwort (Färbung), wie es bei wissenschaftlichen Begriffen üblich ist. Die Anfangsbuchstaben von gram-positiv und gram-negativ, die gleichnamige Adjektive sind, können entweder mit einem großen G oder einem kleinen g geschrieben werden, je nachdem, welche Stilrichtlinien (falls vorhanden) für das zu schreibende Dokument gelten. Die Kleinschreibung wird von den US Centers for Disease Control and Prevention und anderen Stilrichtlinien wie der AMA-Stilrichtlinie verwendet. In Wörterbüchern können Kleinbuchstaben, Großbuchstaben oder beides verwendet werden. Die Großschreibung von Gram-positiv oder Gram-negativ ist auch in vielen wissenschaftlichen Zeitschriftenartikeln und Veröffentlichungen üblich. Wenn Artikel bei Fachzeitschriften eingereicht werden, kann jede Zeitschrift den Hausstil auf die Postprint-Version anwenden, muss es aber nicht. Preprint-Versionen enthalten die vom Autor gewählte Schriftart. Selbst in Stilrichtlinien, in denen die Adjektive gram-positiv und gram-negativ kleingeschrieben werden, wird Gram-Färbung in der Regel noch groß geschrieben. ⓘ
Bedeutung
Die Gram-Färbung ist ein wertvolles Diagnostik-Werkzeug in der naturwissenschaftlichen und der medizinischen Mikrobiologie: Mit ihrer Hilfe können auf einfache Weise Bakterien nach dem Aufbau ihrer Zellwand unterschieden werden, da die unterschiedliche Färbbarkeit der Bakterien auf deren chemischen und physikalischen Eigenschaften basiert. Der Unterschied des Aufbaus der Zellwand ist bei Bakterien ein wichtiges systematisches Unterscheidungsmerkmal, somit dient die Differenzierbarkeit mittels Gram-Färbung als taxonomisches Merkmal. ⓘ
Wichtig ist die Gram-Färbung bei der Diagnostik von Infektionskrankheiten. Grampositive und gramnegative Bakterien können oft nur mit unterschiedlichen Antibiotika bekämpft werden. Nach Trocknung (je nach Materialart etwa 5–15 Minuten) und Fixierung (in der Regel Hitzefixierung durch dreimaliges kurzes Ziehen über eine starke Flamme (Bunsenbrenner)) des Bakterienausstrichs wird in etwa fünf Minuten das „Gramverhalten“ bestimmt. Damit kann der Arzt sofort mit der antibiotischen Therapie beginnen, bevor das Ergebnis der mindestens 24 Stunden dauernden kulturellen Erregeranzucht mit nachfolgender Bestimmung vorliegt. ⓘ
Alternativen zur Gram-Färbung
Mit folgenden Kurztests können Bakterien anhand derselben Zellwandmerkmale unterschieden werden wie bei der Gram-Färbung: ⓘ
KOH-Test
Eine kleine Menge Bakterienmasse (von einer Agar-Kultur) wird in einem Tropfen 3%iger Kaliumhydroxid-Lösung suspendiert. Bei grampositiven ist diese Lauge zu schwach, um die Zellwand zu lysieren. Zieht man eine Nadel oder einen Zahnstocher durch das Gemisch, verhält es sich wie eine Flüssigkeit mit einer Viskosität wie Wasser (keine Fadenbildung zu erkennen). Die Zellwand von gramnegativen Bakterien dagegen ist wesentlich dünner und wird durch die Kalilauge lysiert. Die Zellen brechen auf und die DNA wird freigesetzt. Wird die Nadel durch diese Lösung gezogen, kann aufgrund der erhöhten Viskosität durch die freigesetzte DNA eine Fadenbildung beobachtet werden. Es sei betont, dass es sich hier um einen Schnelltest handelt, der nur bedingt zuverlässig ist. Für Anfänger ist es oft schwer, eine Fadenbildung zu erkennen. Eine Fehlerquelle hierbei kann des Weiteren auch die Verwendung einer falschen Laugenkonzentration darstellen. Ist diese zu stark, kommt es auch zur Lyse von grampositiven Bakterien. Ist sie hingegen zu schwach, werden auch gramnegative Bakterien nicht lysiert. ⓘ
Aminopeptidasetest

Der Aminopeptidasetest beruht darauf, dass das Enzym L-Alanin-Aminopeptidase, von wenigen Ausnahmen abgesehen, nur bei gramnegativen Bakterien nachgewiesen werden kann. Eine kleine Menge der zu untersuchenden Bakterien wird in einem Reagenzglas oder Mikroreaktionsgefäß in etwas sterilem, destilliertem Wasser suspendiert. Zum Nachweis wird L-Alanin-4-nitroanilid verwendet, welches durch das Enzym unter Spaltung einer Amidbindung in L-Alanin und das gelb gefärbte 4-Nitroanilin gespalten wird. Somit zeigt eine Gelbfärbung der Suspension das Vorliegen eines gramnegativen Bakteriums an. Für diese Reaktion sind industriell hergestellte Teststreifen erhältlich. Es ist ratsam hierbei, immer eine Negativkontrolle mit anzusetzen, um einen Vergleich zu haben. Außerdem ist der Test nur bei Bakterienkolonien ohne starke Eigenfärbung anwendbar. ⓘ
Weiterentwicklung
Wissenschaftler an der Harvard University in Boston (USA) haben die Gram-Färbung zu einem magnetischen Detektionsverfahren weiterentwickelt. Nach der Färbung mit modifiziertem Kristallviolett werden magnetische Nanopartikel an den Farbstoff angehängt. Die Bakterien können anschließend über NMR-Geräte detektiert und magnetisch getrennt werden. Vorteil der magnetischen Detektion ist ihre hohe Empfindlichkeit. Mithilfe miniaturisierter Mikro-NMR-Geräte ist eine rasche und empfindliche Vor-Ort-Diagnose denkbar. ⓘ