Sichelzellkrankheit
| Sichelzellenanämie ⓘ | |
|---|---|
| Andere Namen | Sichelzellenanämie |
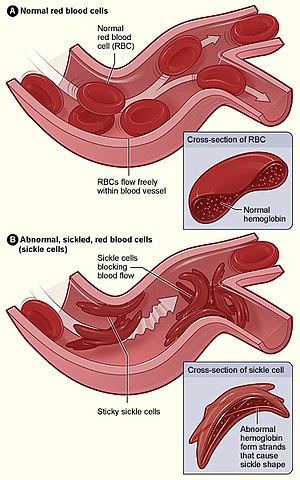 | |
| Abbildung (A) zeigt normale rote Blutkörperchen, die frei durch ein Blutgefäß fließen. Der Einsatz zeigt einen Querschnitt durch ein normales rotes Blutkörperchen mit normalem Hämoglobin. Abbildung (B) zeigt abnorme, sichelförmige rote Blutkörperchen, die an der Verzweigungsstelle eines Blutgefäßes hängen bleiben. Die Abbildung zeigt einen Querschnitt durch eine Sichelzelle mit langen polymerisierten Sichelhämoglobinsträngen (HbS), die sich dehnen und die Zellform so verzerren, dass sie wie eine Mondsichel aussieht. | |
| Fachgebiet | Hämatologie, medizinische Genetik |
| Symptome | Schmerzanfälle, Anämie, Schwellungen an Händen und Füßen, bakterielle Infektionen, Schlaganfall |
| Komplikationen | Chronische Schmerzen, Schlaganfall, aseptische Knochennekrosen, Gallensteine, Beingeschwüre, Priapismus, pulmonale Hypertonie, Sehstörungen, Nierenprobleme |
| Übliches Auftreten | 5-6 Monate im Alter |
| Ursachen | Genetisch bedingt |
| Diagnostische Methode | Bluttest |
| Behandlung | Impfung, Antibiotika, hohe Flüssigkeitszufuhr, Folsäureergänzung, Schmerzmittel, Bluttransfusionen |
| Prognose | Lebenserwartung 40-60 Jahre (entwickelte Welt) |
| Häufigkeit | 4,4 Millionen (2015) |
| Todesfälle | 114,800 (2015) |
Die Sichelzellkrankheit (SCD) ist eine Gruppe von Blutkrankheiten, die in der Regel von den Eltern vererbt werden. Die häufigste Form ist als Sichelzellenanämie bekannt. Sie führt zu einer Anomalie des sauerstofftransportierenden Proteins Hämoglobin in den roten Blutkörperchen. Dies führt unter bestimmten Umständen zu einer starren, sichelartigen Form. Die Probleme bei der Sichelzellkrankheit beginnen in der Regel im Alter von 5 bis 6 Monaten. Es kann zu einer Reihe von Gesundheitsproblemen kommen, z. B. zu Schmerzanfällen (einer so genannten Sichelzellenkrise), Anämie, Schwellungen an Händen und Füßen, bakteriellen Infektionen und Schlaganfällen. Mit zunehmendem Alter können langfristige Schmerzen auftreten. Die durchschnittliche Lebenserwartung in den Industrieländern liegt bei 40 bis 60 Jahren. ⓘ
Die Sichelzellkrankheit tritt auf, wenn eine Person zwei abnorme Kopien des β-Globin-Gens (HBB) erbt, das Hämoglobin herstellt, eine von jedem Elternteil. Dieses Gen befindet sich auf Chromosom 11. Es gibt mehrere Subtypen, die von der genauen Mutation in jedem Hämoglobin-Gen abhängen. Ein Anfall kann durch Temperaturschwankungen, Stress, Dehydrierung und große Höhe ausgelöst werden. Personen mit einer einzigen abnormen Kopie haben in der Regel keine Symptome und werden als Sichelzellenanämie bezeichnet. Solche Menschen werden auch als Träger bezeichnet. Die Diagnose wird durch einen Bluttest gestellt, und in einigen Ländern werden alle Babys bei der Geburt auf die Krankheit getestet. Eine Diagnose ist auch während der Schwangerschaft möglich. ⓘ
Die Behandlung von Menschen mit Sichelzellenanämie kann die Vorbeugung von Infektionen durch Impfungen und Antibiotika, eine hohe Flüssigkeitszufuhr, Folsäureergänzung und Schmerzmittel umfassen. Weitere Maßnahmen können Bluttransfusionen und das Medikament Hydroxycarbamid (Hydroxyharnstoff) sein. Ein kleiner Prozentsatz der Betroffenen kann durch eine Transplantation von Knochenmarkzellen geheilt werden. ⓘ
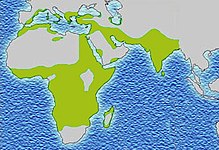
Im Jahr 2015 waren etwa 4,4 Millionen Menschen an der Sichelzellkrankheit erkrankt, während weitere 43 Millionen Menschen ein Sichelzellmerkmal haben. Man geht davon aus, dass etwa 80 % der Fälle von Sichelzellenanämie in Afrika südlich der Sahara auftreten. Auch in Teilen Indiens, auf der Arabischen Halbinsel und bei Menschen afrikanischer Herkunft, die in anderen Teilen der Welt leben, tritt sie relativ häufig auf. Im Jahr 2015 führte sie zu etwa 114 800 Todesfällen. Die Krankheit wurde erstmals 1910 von dem amerikanischen Arzt James B. Herrick in der medizinischen Fachliteratur beschrieben. Im Jahr 1949 wurde die genetische Übertragung von E. A. Beet und J. V. Neel festgestellt. Im Jahr 1954 wurde die schützende Wirkung der Sichelzellenanämie gegen Malaria beschrieben. ⓘ
| Klassifikation nach ICD-10 | |
|---|---|
| D57.0 | Sichelzellenanämie mit Krisen
Hb-SS-Krankheit mit Krisen |
| D57.1 | Sichelzellenanämie ohne Krisen |
| D57.2 | Doppelt heterozygote Sichelzellenkrankheit |
| D57.3 | Sichelzellen-Erbanlage
Heterozygotes Hämoglobin S |
| D57.8 | Sonstige Sichelzellenkrankheiten |
| ICD-10 online (WHO-Version 2019) | |
Die Sichelzellkrankheit (auch Sichelzell(en)anämie) oder Drepanozytose ist eine erbliche Erkrankung der roten Blutkörperchen (Erythrozyten). Sie gehört zur Gruppe der Hämoglobinopathien (Störungen des Hämoglobins) und führt zu einer korpuskulären hämolytischen Anämie. Bei den Betroffenen liegt eine Mutation der β-Kette des Hämoglobins vor. Es können entweder alle β-Ketten betroffen sein (schwere, homozygote Form) oder nur ein Teil (mildere, heterozygote Form). ⓘ
Die Krankheit tritt vor allem bei Personen aus Subsahara-Afrika und deren Nachfahren, aber auch in Teilen des Mittelmeerraums und des Nahen Ostens bis Indien auf und wurde durch Migration global verbreitet. Sie ist nach wie vor in den Entwicklungsländern mit einer hohen Mortalität verbunden. Die Krankheit wurde 1910 von James Herrick und Ernest E. Irons bei einem Patienten aus der Karibik beschrieben und die Bezeichnung Sichelzellenanämie wurde zuerst von Vernon Mason 1922 benutzt. ⓘ
Anzeichen und Symptome
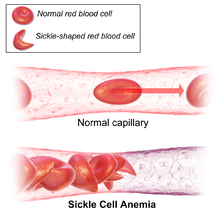
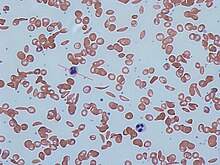

Die Anzeichen der Sichelzellenanämie beginnen in der Regel in der frühen Kindheit. Der Schweregrad der Symptome kann von Person zu Person variieren. Die Sichelzellkrankheit kann zu verschiedenen akuten und chronischen Komplikationen führen, von denen einige eine hohe Sterblichkeitsrate haben. ⓘ
Sichelzellenkrise
Die Begriffe "Sichelzellkrise" oder "Sichelkrise" können verwendet werden, um mehrere unabhängige akute Zustände zu beschreiben, die bei Patienten mit Sichelzellkrankheit auftreten und zu Anämie und Krisen führen, die unterschiedlicher Art sein können, wie z. B. die vasookklusive Krise, die aplastische Krise, die Milzsequestrierungskrise, die hämolytische Krise und andere. Die meisten Sichelzellenkrisen dauern zwischen fünf und sieben Tagen. "Obwohl Infektionen, Dehydrierung und Azidose (die alle die Sichelzellenkrise begünstigen) als Auslöser fungieren können, wird in den meisten Fällen keine prädisponierende Ursache festgestellt. ⓘ
Vaso-okklusive Krise
Die vasookklusive Krise wird durch sichelförmige rote Blutkörperchen verursacht, die die Kapillaren verstopfen und den Blutfluss zu einem Organ einschränken, was zu Ischämie, Schmerzen, Nekrose und häufig zu Organschäden führt. Häufigkeit, Schwere und Dauer dieser Krisen sind sehr unterschiedlich. Schmerzhafte Krisen werden mit Flüssigkeitszufuhr, Analgetika und Bluttransfusionen behandelt; die Schmerzbehandlung erfordert die regelmäßige Verabreichung von Opioiden, bis sich die Krise gelegt hat. Bei leichteren Krisen kommt eine Untergruppe von Patienten mit nichtsteroidalen Entzündungshemmern wie Diclofenac oder Naproxen aus. Bei schwereren Krisen benötigen die meisten Patienten eine stationäre Behandlung mit intravenösen Opioiden; in diesem Zusammenhang werden häufig patientengesteuerte Analgetika eingesetzt. Eine vasookklusive Krise, bei der Organe wie der Penis oder die Lunge betroffen sind, gilt als Notfall und wird mit Erythrozytentransfusionen behandelt. Empfohlen wird die Inzentivspirometrie, eine Technik zur Förderung der Tiefenatmung, um die Entwicklung einer Atelektase zu minimieren. ⓘ
Krise der Milzsequestration
Die Milz ist bei der Sichelzellkrankheit häufig betroffen, da die sichelförmigen roten Blutkörperchen eine Verengung der Blutgefäße und eine eingeschränkte Funktion bei der Beseitigung der defekten Zellen verursachen. Bei Menschen mit Sichelzellenanämie kommt es in der Regel vor dem Ende der Kindheit zu einem Infarkt der Milz. Diese Schädigung der Milz erhöht das Risiko einer Infektion durch eingekapselte Organismen; für Personen mit unzureichender Milzfunktion werden vorbeugende Antibiotika und Impfungen empfohlen. ⓘ
Milzsequestrierungskrisen sind akute, schmerzhafte Vergrößerungen der Milz, die durch intrasplenische Ablagerungen von Erythrozyten verursacht werden und zu einem rapiden Abfall des Hämoglobinspiegels mit der Gefahr eines hypovolämischen Schocks führen. Sequestrationskrisen gelten als Notfälle. Wenn sie nicht behandelt werden, können die Patienten innerhalb von 1-2 Stunden an Kreislaufversagen sterben. Die Behandlung erfolgt unterstützend, manchmal mit Bluttransfusionen. Diese Krisen sind vorübergehend; sie dauern 3 bis 4 Stunden und können bis zu einem Tag andauern. ⓘ
Akutes Thoraxsyndrom
Das akute Thoraxsyndrom ist durch mindestens zwei der folgenden Anzeichen oder Symptome definiert: Schmerzen in der Brust, Fieber, Lungeninfiltrate oder fokale Anomalien, Atembeschwerden oder Hypoxämie. Es handelt sich um die zweithäufigste Komplikation und ist für etwa 25 % der Todesfälle bei Patienten mit SCD verantwortlich. Die meisten Fälle beginnen mit vasookklusiven Krisen und entwickeln dann ein akutes Thoraxsyndrom. Dennoch kommt es bei etwa 80 % der Menschen während des akuten Thoraxsyndroms zu vasookklusiven Krisen. ⓘ
Aplastische Krise
Aplastische Krisen sind Fälle einer akuten Verschlechterung der Grundanämie des Patienten, die sich in Blässe, schneller Herzfrequenz und Müdigkeit äußert. Diese Krise wird in der Regel durch das Parvovirus B19 ausgelöst, das die Produktion roter Blutkörperchen direkt beeinträchtigt, indem es in die Vorstufen der roten Blutkörperchen eindringt, sich dort vermehrt und sie zerstört. Die Infektion mit dem Parvovirus führt dazu, dass die Produktion roter Blutkörperchen für zwei bis drei Tage fast vollständig eingestellt wird. Bei normalen Menschen hat dies kaum Auswirkungen, aber die verkürzte Lebensdauer der roten Blutkörperchen bei SCD-Patienten führt zu einer abrupten, lebensbedrohlichen Situation. Die Anzahl der Retikulozyten sinkt während der Krankheit dramatisch (was zu einer Retikulozytopenie führt), und der rasche Umsatz der Erythrozyten führt zu einem Abfall des Hämoglobins. Es dauert 4 bis 7 Tage, bis diese Krise verschwindet. Die meisten Patienten können unterstützend behandelt werden; einige benötigen eine Bluttransfusion. ⓘ
Hämolytische Krise
Hämolytische Krisen sind akute, beschleunigte Abfälle des Hämoglobinspiegels. Die roten Blutkörperchen werden schneller abgebaut. Dies ist besonders häufig bei Menschen mit gleichzeitigem G6PD-Mangel der Fall. Die Behandlung erfolgt unterstützend, manchmal mit Bluttransfusionen. ⓘ
Andere
Eine der frühesten klinischen Manifestationen ist die Daktylitis, die bereits im Alter von sechs Monaten auftritt und bei Kindern mit Sichelzellanämie vorkommen kann. Die Krise kann bis zu einem Monat andauern. Da sowohl Lungenentzündung als auch Lungensichelentzündung Symptome eines akuten Thoraxsyndroms hervorrufen können, wird der Patient gegen beide Erkrankungen behandelt. Es kann durch eine schmerzhafte Krise, eine Atemwegsinfektion, eine Knochenmarkembolisation oder möglicherweise durch Atelektase, Opiatverabreichung oder eine Operation ausgelöst werden. Auch hämatopoetische Ulzera können auftreten. ⓘ
Komplikationen
Die Sichelzellenanämie kann zu verschiedenen Komplikationen führen, darunter:
- Ein erhöhtes Risiko für schwere bakterielle Infektionen ist auf den Verlust von funktionierendem Milzgewebe zurückzuführen (und vergleichbar mit dem Risiko von Infektionen nach einer chirurgischen Entfernung der Milz). Diese Infektionen werden in der Regel durch abgekapselte Organismen wie Streptococcus pneumoniae und Haemophilus influenzae verursacht. Die tägliche Penicillinprophylaxe ist die am häufigsten angewandte Behandlung im Kindesalter, wobei einige Hämatologen die Behandlung auf unbestimmte Zeit fortsetzen. Die Patienten profitieren heute von einer Routineimpfung gegen S. pneumoniae.
- Ein Schlaganfall, der durch eine fortschreitende Verengung der Blutgefäße entstehen kann, verhindert, dass das Gehirn mit Sauerstoff versorgt wird. Ein Hirninfarkt tritt bei Kindern auf, eine Hirnblutung bei Erwachsenen.
- Der stille Schlaganfall verursacht keine unmittelbaren Symptome, ist aber mit einer Schädigung des Gehirns verbunden. Der stille Schlaganfall ist wahrscheinlich fünfmal so häufig wie der symptomatische Schlaganfall. Etwa 10-15 % der Kinder mit SCD erleiden einen Schlaganfall, wobei stumme Schlaganfälle bei jüngeren Patienten überwiegen.
- Cholelithiasis (Gallensteine) und Cholezystitis können durch eine übermäßige Bilirubinproduktion und Ausfällung aufgrund einer anhaltenden Hämolyse entstehen.
- Avaskuläre Nekrosen (aseptische Knochennekrosen) der Hüfte und anderer großer Gelenke können als Folge der Ischämie auftreten.
- Verminderte Immunreaktionen aufgrund von Hyposplenismus (Funktionsstörung der Milz)
- Priapismus und Infarkt des Penis
- Osteomyelitis (bakterielle Knocheninfektion), die häufigste Ursache für Osteomyelitis bei SCD sind Salmonellen (insbesondere die atypischen Serotypen Salmonella typhimurium, Salmonella enteritidis, Salmonella choleraesuis und Salmonella paratyphi B), gefolgt von Staphylococcus aureus und gramnegativen Darmbazillen, möglicherweise weil intravaskuläre Sichelungen des Darms zu lückenhaften ischämischen Infarkten führen.
- Akute papilläre Nekrosen in den Nieren
- Beingeschwüre
- Bei den Augen können Hintergrundretinopathie, proliferative Retinopathie, Glaskörperblutungen und Netzhautablösungen zur Erblindung führen. Regelmäßige jährliche Augenuntersuchungen werden empfohlen.
- Während der Schwangerschaft: intrauterine Wachstumsrestriktion, Spontanabort und Präeklampsie
- Chronische Schmerzen: Auch wenn keine akuten vaso-okklusiven Schmerzen vorliegen, haben viele Patienten unerklärte chronische Schmerzen.
- Pulmonale Hypertonie (erhöhter Druck auf die Lungenarterie) kann zu einer Belastung der rechten Herzkammer und einem Risiko für Herzversagen führen; typische Symptome sind Kurzatmigkeit, verminderte Belastbarkeit und Synkopen. 21 % der Kinder und 30 % der Erwachsenen weisen bei Tests eine pulmonale Hypertonie auf, die mit einer verringerten Gehstrecke und einer erhöhten Sterblichkeit einhergeht.
- Kardiomyopathie und linksventrikuläre diastolische Dysfunktion, verursacht durch Fibrose oder Vernarbung des Herzgewebes. Dies trägt ebenfalls zu pulmonaler Hypertonie, verminderter körperlicher Leistungsfähigkeit und Herzrhythmusstörungen bei.
- Chronisches Nierenversagen aufgrund einer Sichelzellnephropathie äußert sich durch Bluthochdruck, Eiweißverlust im Urin, Verlust von roten Blutkörperchen im Urin und eine Verschlechterung der Anämie. Wenn die Krankheit zu einem Nierenversagen im Endstadium fortschreitet, hat sie eine schlechte Prognose. ⓘ
Genetik




Normalerweise haben Menschen Hämoglobin A, das aus zwei Alpha- und zwei Beta-Ketten besteht, Hämoglobin A2, das aus zwei Alpha- und zwei Delta-Ketten besteht, und Hämoglobin F (HbF), das aus zwei Alpha- und zwei Gamma-Ketten besteht, in ihrem Körper. Von diesen drei Typen dominiert Hämoglobin F bis zum Alter von etwa 6 Wochen. Danach dominiert das Hämoglobin A während des gesamten Lebens. Bei Menschen, bei denen die Sichelzellkrankheit diagnostiziert wird, ist mindestens eine der β-Globin-Untereinheiten im Hämoglobin A durch das so genannte Hämoglobin S ersetzt. Bei der Sichelzellanämie, einer häufigen Form der Sichelzellkrankheit, ersetzt das Hämoglobin S beide β-Globin-Untereinheiten im Hämoglobin. ⓘ
Die Sichelzellenanämie wird autosomal-rezessiv von den Eltern vererbt. Welche Arten von Hämoglobin eine Person in ihren roten Blutkörperchen bildet, hängt davon ab, welche Hämoglobin-Gene sie von ihren Eltern geerbt hat. Wenn ein Elternteil an Sichelzellenanämie und der andere an Sichelzellanämie leidet, hat das Kind eine 50 %ige Chance, an Sichelzellanämie zu erkranken, und eine 50 %ige Chance, an Sichelzellanämie zu leiden. Wenn beide Elternteile Sichelzellenanämie haben, hat das Kind eine 25 %ige Chance, an Sichelzellenanämie zu erkranken; 25 % tragen keine Sichelzellenallele, und 50 % sind heterozygot. ⓘ
Wie die Restriktionsendonuklease-Analyse zeigt, ist die Sichelzellen-Genmutation wahrscheinlich spontan in verschiedenen geografischen Gebieten entstanden. Diese Varianten sind als Kamerun, Senegal, Benin, Bantu und Saudi-Asien bekannt. Ihre klinische Bedeutung liegt darin, dass einige von ihnen mit höheren HbF-Werten einhergehen, z. B. die senegalesischen und saudi-asiatischen Varianten, und tendenziell eine mildere Erkrankung aufweisen. ⓘ
Bei dem Gendefekt handelt es sich um eine Einzelnukleotid-Mutation (siehe Einzelnukleotid-Polymorphismus - SNP) des β-Globin-Gens (Änderung des GAG-Codons in GTG), die dazu führt, dass an Position 6 Glutamat (E/Glu) durch Valin (V/Val) ersetzt wird (E6V-Substitution). Hämoglobin S mit dieser Mutation wird als HbS bezeichnet, im Gegensatz zu dem normalen HbA des Erwachsenen. Normalerweise handelt es sich um eine gutartige Mutation, die bei normaler Sauerstoffkonzentration keine offensichtlichen Auswirkungen auf die sekundären, tertiären oder quaternären Strukturen des Hämoglobins hat. Bei niedriger Sauerstoffkonzentration polymerisiert HbS jedoch und bildet faserige Präzipitate, da die Desoxyform des Hämoglobins einen hydrophoben Fleck auf dem Protein zwischen den E- und F-Helices (Phe 85, Leu 88) freilegt. ⓘ
Bei Menschen, die heterozygot für HbS sind (Träger von Sichelhämoglobin), sind die Polymerisationsprobleme gering, da das normale Allel die Hälfte des Hämoglobins produzieren kann. Bei Menschen, die homozygot für HbS sind, verzerrt das Vorhandensein langkettiger HbS-Polymere die Form der roten Blutkörperchen von einer glatten, donutähnlichen Form zu einer zerklüfteten und zackigen Form, wodurch sie zerbrechlich werden und in den Kapillaren leicht zerbrechen können. Träger haben nur dann Symptome, wenn sie unter Sauerstoffmangel leiden (z. B. beim Bergsteigen) oder wenn sie stark dehydriert sind. ⓘ

Das für die Sichelzellenanämie verantwortliche Allel befindet sich auf dem kurzen Arm von Chromosom 11, genauer gesagt auf 11p15.5. Eine Person, die das defekte Gen sowohl von ihrem Vater als auch von ihrer Mutter erhält, erkrankt; eine Person, die ein defektes und ein gesundes Allel erhält, bleibt gesund, kann aber die Krankheit weitergeben und wird als Träger oder Heterozygote bezeichnet. Heterozygote können immer noch an Malaria erkranken, aber ihre Symptome sind im Allgemeinen weniger schwerwiegend. ⓘ
Aufgrund des adaptiven Vorteils der Heterozygoten ist die Krankheit immer noch weit verbreitet, vor allem bei Menschen, die erst seit kurzem in von Malaria betroffenen Gebieten wie Afrika, dem Mittelmeerraum, Indien und dem Nahen Osten leben. Malaria war früher in Südeuropa endemisch, wurde aber Mitte des 20. Jahrhunderts für ausgerottet erklärt, mit Ausnahme seltener sporadischer Fälle. ⓘ
Der Malariaparasit hat einen komplexen Lebenszyklus und verbringt einen Teil davon in den roten Blutkörperchen. Bei einem Träger führt die Anwesenheit des Malariaparasiten dazu, dass die roten Blutkörperchen mit defektem Hämoglobin vorzeitig zerplatzen, so dass sich der Plasmodium-Parasit nicht mehr vermehren kann. Außerdem beeinträchtigt die Polymerisation von Hb die Fähigkeit des Parasiten, Hb überhaupt zu verdauen. In Gebieten, in denen Malaria ein Problem darstellt, steigen daher die Überlebenschancen von Menschen, die Sichelzellenmerkmale tragen (Selektion auf das Heterozygot). ⓘ
In den Vereinigten Staaten, wo es keine endemische Malaria gibt, ist die Prävalenz der Sichelzellenanämie bei Menschen afrikanischer Abstammung niedriger (ca. 0,25 %) als bei Menschen in Westafrika (ca. 4,0 %), und sie ist rückläufig. Ohne endemische Malaria ist die Sichelzellenmutation rein nachteilig und geht in der betroffenen Bevölkerung durch natürliche Selektion und inzwischen auch künstlich durch pränatales genetisches Screening zurück. Die afroamerikanische Gemeinschaft stammt jedoch von einer bedeutenden Vermischung verschiedener afrikanischer und nichtafrikanischer ethnischer Gruppen ab und repräsentiert auch die Nachkommen von Überlebenden der Sklaverei und des Sklavenhandels. Ein gewisses Maß an genetischer Verwässerung durch Kreuzung mit nichtafrikanischen Völkern und ein hoher gesundheitlicher Selektionsdruck durch die Sklaverei (vor allem durch den Sklavenhandel und die häufig tödliche Mittlere Passage) dürften daher die plausibelsten Erklärungen für die geringere Prävalenz der Sichelzellenanämie (und möglicherweise anderer genetischer Krankheiten) unter Afroamerikanern im Vergleich zu Westafrikanern sein. Ein weiterer Faktor, der die Verbreitung von Sichelzellengenen in Nordamerika einschränkt, ist das relative Fehlen von Polygamie. In polygamen Gesellschaften können die betroffenen Männer viele Kinder mit mehreren Partnerinnen zeugen. ⓘ
Am Beispiel der Sichelzellenanämie wurde erstmals der Zusammenhang eines Defekts eines Moleküls mit einer Krankheit nachgewiesen, in einer berühmten Arbeit von Linus Pauling, Harvey Itano und Seymour Jonathan Singer von 1949. Der Unterschied des Hämoglobins beider roter Blutkörperchen zeigte sich in der Gel-Elektrophorese, die Itano durchführte. Die Autoren vermuteten schon, dass Unterschiede in den Aminosäuren vorlagen, was Vernon Ingram 1956 bestätigte, der auch zeigte, dass der Unterschied im Austausch genau einer Aminosäure bestand. Die Vererbungsmuster der Krankheit klärte ebenfalls 1949 James V. Neel (1915–2000). ⓘ
Pathophysiologie

Der Verlust der Elastizität der roten Blutkörperchen ist von zentraler Bedeutung für die Pathophysiologie der Sichelzellkrankheit. Normale rote Blutkörperchen sind recht elastisch und haben eine bikonkave Scheibenform, die es den Zellen ermöglicht, sich zu verformen, um durch die Kapillaren zu gelangen. Bei der Sichelzellkrankheit fördert eine niedrige Sauerstoffspannung die Sichelung der roten Blutkörperchen, und wiederholte Sichelungsepisoden schädigen die Zellmembran und verringern die Elastizität der Zellen. Diese Zellen kehren nicht in ihre normale Form zurück, wenn die normale Sauerstoffspannung wiederhergestellt ist. Infolgedessen können sich diese starren Blutzellen nicht verformen, wenn sie durch enge Kapillaren wandern, was zu Gefäßverschlüssen und Ischämie führt. ⓘ
Die eigentliche Anämie der Krankheit wird durch die Hämolyse, also die Zerstörung der roten Blutkörperchen aufgrund ihrer Form, verursacht. Obwohl das Knochenmark versucht, dies durch die Bildung neuer roter Blutkörperchen auszugleichen, kann es die Zerstörungsrate nicht auffangen. Gesunde rote Blutkörperchen funktionieren in der Regel 90-120 Tage lang, gesichelte Zellen jedoch nur 10-20 Tage lang. ⓘ
Diagnose
Bei HbS zeigt das vollständige Blutbild Hämoglobinwerte im Bereich von 6-8 g/dl mit einer hohen Retikulozytenzahl (da das Knochenmark die Zerstörung der sicheligen Zellen durch die Produktion neuer roter Blutkörperchen kompensiert). Bei anderen Formen der Sichelzellkrankheit sind die Hb-Werte tendenziell höher. Ein Blutbild kann Merkmale von Hyposplenismus (Zielzellen und Howell-Jolly-Körperchen) zeigen. ⓘ
Die Sichelung der roten Blutkörperchen auf einem Blutfilm kann durch die Zugabe von Natriummetabisulfit ausgelöst werden. Das Vorhandensein von Sichelhämoglobin kann auch mit dem "Sichel-Löslichkeitstest" (auch "Sicheldex" genannt) nachgewiesen werden. Eine Mischung von Hämoglobin S (HbS) in einer reduzierenden Lösung (z. B. Natriumdithionit) ergibt ein trübes Aussehen, während normales Hb eine klare Lösung ergibt. ⓘ
Abnormale Hämoglobinformen können in der Hämoglobinelektrophorese nachgewiesen werden, einer Form der Gelelektrophorese, bei der sich die verschiedenen Hämoglobinarten mit unterschiedlicher Geschwindigkeit bewegen. Auf diese Weise lassen sich das Sichelzellenhämoglobin (HgbS) und das Hämoglobin C mit Sichelzellbildung (HgbSC) - die beiden häufigsten Formen - identifizieren. Die Diagnose kann durch Hochleistungsflüssigkeitschromatographie bestätigt werden. Gentests werden nur selten durchgeführt, da andere Untersuchungen hochspezifisch für HbS und HbC sind. ⓘ
Eine akute Sichelzellkrise wird häufig durch eine Infektion ausgelöst. Daher sollten routinemäßig eine Urinanalyse zum Nachweis einer okkulten Harnwegsinfektion und eine Röntgenuntersuchung des Brustkorbs zum Nachweis einer okkulten Lungenentzündung durchgeführt werden. ⓘ
Personen, die bekanntermaßen Träger der Krankheit sind oder bei denen das Risiko besteht, dass sie ein Kind mit Sichelzellenanämie bekommen, können sich einer genetischen Beratung unterziehen. Genetische Berater arbeiten mit den Familien zusammen, um die Vorteile, die Grenzen und die Logistik der genetischen Testmöglichkeiten sowie die möglichen Auswirkungen der Tests und der Testergebnisse auf den Einzelnen zu besprechen. Während der Schwangerschaft können Gentests entweder mit einer Blutprobe des Fötus oder einer Fruchtwasserprobe durchgeführt werden. Da die Entnahme einer Blutprobe beim Fötus mit größeren Risiken verbunden ist, wird in der Regel der letztere Test durchgeführt. Das Neugeborenen-Screening, das auch als Neugeborenen-Screening bezeichnet wird, bietet nicht nur eine Methode zur Früherkennung der Sichelzellkrankheit, sondern ermöglicht auch die Identifizierung der Personengruppen, die Träger des Sichelzell-Merkmals sind. Genetische Berater können farbigen Menschen und ihren Familien helfen, die rassischen und ethnischen Ungleichheiten im Gesundheitswesen zu überwinden. ⓘ
Im Jahr 2010 gab es in den USA erhebliche Überlegungen und Debatten über ein umfassendes Screening von Sportlern auf SCD. Die American Society of Hematology (Amerikanische Gesellschaft für Hämatologie) kam 2012 in einer Erklärung zu dem Schluss, dass sie Tests oder die Offenlegung des Sichelzellenanämie-Status als Voraussetzung für die Teilnahme an sportlichen Aktivitäten nicht befürwortet, da es keine wissenschaftlichen Beweise gebe, dies nicht mit guter medizinischer Praxis und nicht mit der Ethik der öffentlichen Gesundheit vereinbar sei. Sie empfahlen universelle Maßnahmen zur Verringerung belastungsbedingter Verletzungen und Todesfälle, die für alle Sportler unabhängig von ihrem Sichelzellstatus gelten. ⓘ
Die Diagnose der Sichelzellanämie erfolgt zunächst anamnestisch, wobei die Herkunft und andere Fälle der Erkrankung in der Familie erfragt werden sollten; danach klinisch anhand der gebotenen Symptome und schließlich im Labor, wo in einem Blutbild eine hämolytische Anämie erscheinen kann und bei Untersuchung des Blutes unter dem Mikroskop die typisch geformten Drepanozyten erscheinen - insbesondere, wenn das Blut für 24 h unter Sauerstoffabschluss gelagert wurde (Sichelzelltest). Außerdem kann eine Elektrophorese des Hämoglobins die veränderten Moleküle beweisend identifizieren. Schließlich kann auch der Genabschnitt für das Hämoglobin in einer Restriktionsanalyse untersucht werden und die Punktmutation auf der Ebene der DNA aufzeigen. ⓘ
Stammbaumanalyse
Sind die Genotypen der Eltern bekannt, kann mit Hilfe des Hardy-Weinberg-Gesetzes die Wahrscheinlichkeit berechnet werden, mit der die Sichelzellenanämie bei einem Kind auftritt:
| Genotyp der Eltern | Genotypen der Kinder | Vererbungswahrscheinlichkeiten und Phänotyp der Kinder ⓘ | |
|---|---|---|---|
| AA x AA | AA | 100 % | gesunde Kinder |
| AA × AS | AA | 50 % | Wahrscheinlichkeit, dass ein Kind gesund ist |
| AS | 50 % | Wahrscheinlichkeit, dass ein Kind heterozygoter HbS-Träger wird | |
| AS × AS | AA | 25 % | Wahrscheinlichkeit, dass ein Kind gesund ist |
| AS | 50 % | Wahrscheinlichkeit, dass ein Kind heterozygoter HbS-Träger wird | |
| SS | 25 % | Wahrscheinlichkeit, dass ein Kind von der schwereren, homozygoten Form betroffen ist | |
| AA × SS | AS | 100 % | alle Kinder werden heterozygote HbS-Träger |
| AS × SS | AS | 50 % | Wahrscheinlichkeit, dass ein Kind heterozygoter HbS-Träger wird |
| SS | 50 % | Wahrscheinlichkeit, dass ein Kind von der schwereren, homozygoten Form betroffen ist | |
| SS × SS | SS | 100 % | Die Kinder haben mit Sicherheit die schwerere, homozygote Form |
Sichelzelltest
Das zu untersuchende Blut wird mit EDTA versetzt und über 24 Stunden unter Sauerstoffabschluss gelagert. Durch den eintretenden Sauerstoffmangel in den Erythrozyten entstehen die Sichelformen der Zellen, die im Mikroskop bei 40-facher Vergrößerung gut erkannt werden können. Zusätzlich kann durch Zugabe von Natriummetabisulfit der Effekt der Sichelzellbildung beschleunigt werden. ⓘ
Elektrophorese

Da erst unter extremem Sauerstoffmangel eine Veränderung der roten Blutkörperchen von Überträgern (Genotyp AS) auftritt, lässt sich durch Untersuchung der roten Blutkörperchen unter dem Mikroskop der Genotyp AA nicht vom Genotyp AS unterscheiden. Dagegen lässt sich mit Hilfe der Hämoglobin-Elektrophorese eindeutig der Genotyp bestimmen: Dazu wird den Probanden Blut entnommen und aufbereitet, bis reines Hämoglobin vorliegt. Im elektrischen Feld wandern die beiden Hämoglobinsorten unterschiedlich weit, da HbS aufgrund seiner geänderten Proteinstruktur ein anderes Wanderungsverhalten zeigt. Auch klinisch relevante Kombinationsformen, wie z. B. aus HbS und Hämoglobin C, die s.g. HbSC-Krankheit oder die Kombination aus HbS und Hämoglobin E (HbE) können mit der Hb-Elektrophorese unterschieden werden. ⓘ
Molekulargenetik
Die ursächliche Mutation im HBB-Gen (c.20A>T) kann mittels molekularbiologischer Untersuchungsverfahren nachgewiesen werden. Die Sequenzierung des HBB-Gens verdrängt hierbei zunehmend andere Verfahren wie bspw. die Restriktionsanalyse. ⓘ
Behandlung
Die Behandlung umfasst eine Reihe von Maßnahmen. Während in der Vergangenheit empfohlen wurde, dass Menschen mit Sichelzellenanämie Sport vermeiden sollten, kann regelmäßiger Sport für die Betroffenen von Vorteil sein. Dehydrierung sollte vermieden werden. Eine kalziumreiche Ernährung wird empfohlen, die Wirksamkeit einer Vitamin-D-Supplementierung ist jedoch noch ungewiss. Die Verwendung von L-Glutamin wurde von der FDA ab dem fünften Lebensjahr befürwortet, da es Komplikationen verringert. ⓘ
Folsäure und Penicillin
Von der Geburt bis zum fünften Lebensjahr wird aufgrund des unreifen Immunsystems, das sie anfälliger für frühkindliche Krankheiten macht, täglich Penicillin empfohlen. Eine Nahrungsergänzung mit Folsäure war zuvor von der WHO empfohlen worden. Ein Cochrane-Review aus dem Jahr 2016 kam zu dem Ergebnis, dass "die Wirkung einer Supplementierung auf Anämie und Anämiesymptome unklar bleibt", da es an medizinischen Belegen fehlt. ⓘ
Malaria-Prävention

Die schützende Wirkung der Sichelzellenanämie gilt nicht für Menschen mit Sichelzellenanämie; sie sind sogar anfälliger für Malaria, da die häufigste Ursache für schmerzhafte Krisen in Malarialändern die Infektion mit Malaria ist. Menschen mit Sichelzellenanämie, die in Malarialändern leben, sollten lebenslang Medikamente zur Vorbeugung erhalten. ⓘ
Vaso-okklusive Krise
Die meisten Menschen mit Sichelzellkrankheit leiden unter sehr schmerzhaften Episoden, die als vaso-okklusive Krisen bezeichnet werden. Häufigkeit, Schwere und Dauer dieser Krisen sind jedoch sehr unterschiedlich. Schmerzhafte Krisen werden symptomatisch mit Schmerzmedikamenten behandelt; die Schmerzbehandlung erfordert die regelmäßige Verabreichung von Opioiden, bis die Krise abgeklungen ist. Bei leichteren Krisen kommt eine Untergruppe von Patienten mit NSAIDs (wie Diclofenac oder Naproxen) aus. Bei schwereren Krisen benötigen die meisten Patienten eine stationäre Behandlung mit intravenösen Opioiden. ⓘ
Zusätzliche Flüssigkeit, die entweder oral oder intravenös verabreicht wird, ist ein Routinebestandteil der Behandlung vasookklusiver Krisen, aber die Erkenntnisse über die wirksamste Art, Menge und Art des Flüssigkeitsersatzes sind nach wie vor unsicher. ⓘ
Crizanlizumab, ein monoklonaler Antikörper gegen p-Selektin, wurde 2019 in den Vereinigten Staaten zugelassen, um die Häufigkeit von vasookklusiven Krisen bei Patienten ab 16 Jahren zu verringern. ⓘ
Schlaganfallprävention
Mit transkraniellem Doppler-Ultraschall (TCD) können Kinder mit Sichelzellenanämie, die ein hohes Schlaganfallrisiko haben, erkannt werden. Mit dem Ultraschalltest werden durch Sichelzellen teilweise verengte Blutgefäße aufgespürt, indem die Geschwindigkeit des Blutzuflusses ins Gehirn gemessen wird, da die Geschwindigkeit des Blutflusses in umgekehrtem Verhältnis zum Arteriendurchmesser steht, so dass eine hohe Blutflussgeschwindigkeit mit einer Verengung der Arterien korreliert. Im Jahr 2002 gab das National Institute of Health (NIH) eine Erklärung ab, in der es empfahl, bei Kindern mit Sichelzellenanämie jährlich eine transkranielle Doppler-Ultraschalluntersuchung durchzuführen, und im Jahr 2014 gab ein von den NIH einberufenes Expertengremium Leitlinien heraus, in denen diese Empfehlung bekräftigt wurde. Eine Überprüfung von Krankenakten durch die Hämatologin Dr. Julie Kanter von der University of Alabama in Birmingham ergab, dass im Durchschnitt nur 48,4 Prozent der Kinder mit Sichelzellen die empfohlene Ultraschalluntersuchung erhalten. ⓘ
Eine NIH-Studie aus dem Jahr 1994 zeigte, dass Kinder mit Schlaganfallrisiko, die Bluttransfusionen erhielten, eine jährliche Schlaganfallrate von weniger als 1 Prozent aufwiesen, während die Kinder, die keine Bluttransfusionen erhielten, eine Schlaganfallrate von 10 Prozent pro Jahr hatten. (Siehe auch die Studie von 1998 im New England Journal of Medicine.) Zusätzlich zu Ultraschalluntersuchungen und Bluttransfusionen kann das kostengünstige Generikum Hydroxyharnstoff das Risiko irreversibler Organ- und Hirnschäden verringern. In den 2014 veröffentlichten NIH-Leitlinien heißt es, dass alle Kinder und Jugendlichen Hydroxyharnstoff einnehmen sollten, ebenso wie Erwachsene mit schweren Komplikationen oder drei oder mehr Schmerzkrisen innerhalb eines Jahres. ⓘ
Akutes Thoraxsyndrom
Die Behandlung ähnelt der einer vasookklusiven Krise, wobei zusätzlich Antibiotika (in der Regel ein Chinolon oder Makrolid, da man davon ausgeht, dass zellwanddefiziente ["atypische"] Bakterien zu dem Syndrom beitragen), Sauerstoffergänzung bei Hypoxie und sorgfältige Beobachtung eingesetzt werden. Da es keine qualitativ hochwertigen Belege für die Wirksamkeit von Antibiotika bei akutem Brustsyndrom bei Menschen mit Sichelzellenanämie gibt, gibt es 2019 keine Standardantibiotikabehandlung. Es wird empfohlen, dass Menschen mit Verdacht auf ein akutes Thoraxsyndrom ins Krankenhaus eingeliefert werden sollten, wobei ein sich verschlechternder A-a-Gradient eine Indikation für die Aufnahme auf der Intensivstation darstellt. ⓘ
Sollte sich das Lungeninfiltrat verschlimmern oder der Sauerstoffbedarf steigen, ist eine einfache Bluttransfusion oder eine Austauschtransfusion angezeigt. Bei letzterer wird ein erheblicher Teil der Erythrozytenmasse des Betroffenen gegen normale Erythrozyten ausgetauscht, wodurch der Hämoglobin-S-Gehalt im Blut des Patienten sinkt. Derzeit gibt es jedoch keine gesicherten Erkenntnisse über den möglichen Nutzen oder Schaden einer Bluttransfusion bei akutem Brustsyndrom bei Menschen mit Sichelzellkrankheit. ⓘ
Hydroxyharnstoff
Hydroxyharnstoff, auch bekannt als Hydroxycarbamid, verringert wahrscheinlich die Häufigkeit der schmerzhaften Episoden und das Risiko einer lebensbedrohlichen Erkrankung oder des Todes, doch gibt es derzeit keine ausreichenden Beweise für das Risiko unerwünschter Wirkungen. Die Kombination von Hydroxyharnstoff und Aderlass könnte in Bezug auf Schmerzen, lebensbedrohliche Erkrankungen und Todesrisiko wirksamer sein als die Kombination von Transfusion und Chelattherapie. ⓘ
Hydroxyharnstoff war das erste zugelassene Medikament zur Behandlung der Sichelzellenanämie. 1995 wurde nachgewiesen, dass es die Zahl und den Schweregrad der Anfälle verringert, und in einer Studie aus dem Jahr 2003 wurde gezeigt, dass es möglicherweise die Überlebenszeit verlängert. Dies wird zum Teil dadurch erreicht, dass die Produktion von fetalem Hämoglobin anstelle des Hämoglobins S, das die Sichelzellenanämie verursacht, reaktiviert wird. Hydroxyharnstoff war zuvor als Chemotherapeutikum eingesetzt worden, und es bestehen gewisse Bedenken, dass eine langfristige Anwendung schädlich sein könnte, aber dieses Risiko ist entweder nicht vorhanden oder sehr gering, und die Vorteile überwiegen wahrscheinlich die Risiken. ⓘ
Voxelotor wurde 2019 in den Vereinigten Staaten zur Erhöhung des Hämoglobins bei Menschen mit SS-Erkrankungen zugelassen. ⓘ
Bluttransfusion
Bluttransfusionen werden häufig bei der Behandlung der Sichelzellkrankheit in akuten Fällen und zur Vorbeugung von Komplikationen eingesetzt, indem die Anzahl der roten Blutkörperchen (RB), die sich erniedrigen können, durch Zugabe normaler roter Blutkörperchen verringert wird. Bei Kindern hat sich gezeigt, dass eine präventive Erythrozytentransfusionstherapie das Risiko eines ersten Schlaganfalls oder eines stummen Schlaganfalls verringert, wenn bei der transkraniellen Doppler-Sonographie ein abnormaler zerebraler Blutfluss festgestellt wurde. Bei Personen, die bereits einen Schlaganfall erlitten haben, verringert sie auch das Risiko eines erneuten Schlaganfalls und weiterer stiller Schlaganfälle. ⓘ
Knochenmarktransplantation
Knochenmarktransplantationen haben sich bei Kindern als wirksam erwiesen; sie sind die einzige bekannte Heilmethode für SCD. Allerdings ist eine Knochenmarktransplantation aufgrund der erforderlichen spezifischen HLA-Typisierung schwierig zu erhalten. Im Idealfall würde ein naher Verwandter (allogen) das für die Transplantation erforderliche Knochenmark spenden. Derzeit werden einige Gentherapien entwickelt, bei denen die eigenen Knochenmarkstammzellen des Patienten ex vivo verändert werden, die dann dem Patienten zurücktransplantiert werden können, nachdem eine Chemotherapie die ursprünglichen unveränderten Zellen eliminiert hat. ⓘ
Avaskuläre Nekrose
Bei der Behandlung der avaskulären Nekrose des Knochens bei Menschen mit Sichelzellenanämie besteht das Ziel der Behandlung darin, die Schmerzen zu lindern oder zu stoppen und die Gelenkbeweglichkeit zu erhalten. Zu den derzeitigen Behandlungsmöglichkeiten gehören die Schonung des Gelenks, physikalische Therapie, schmerzlindernde Medikamente, Gelenkersatzoperationen oder Knochentransplantationen. Qualitativ hochwertige, randomisierte, kontrollierte Studien sind erforderlich, um die wirksamste Behandlungsoption zu ermitteln und festzustellen, ob eine Kombination aus Physiotherapie und Operation wirksamer ist als Physiotherapie allein. ⓘ
Psychologische Therapien
Psychologische Therapien wie Patientenschulung, kognitive Therapie, Verhaltenstherapie und psychodynamische Psychotherapie, die darauf abzielen, die derzeitigen medizinischen Behandlungen zu ergänzen, müssen weiter erforscht werden, um ihre Wirksamkeit zu bestimmen. ⓘ
Prognose
Etwa 90 % der Betroffenen überleben bis zum Alter von 20 Jahren, und fast 50 % überleben über das Alter von 50 Jahren hinaus. Im Jahr 2001 lag die geschätzte durchschnittliche Überlebenszeit von Menschen mit homozygoter SCD laut einer in Jamaika durchgeführten Studie bei 53 Jahren für Männer und 58 Jahren für Frauen. Die spezifische Lebenserwartung in einem Großteil der Entwicklungsländer ist unbekannt. Im Jahr 1975 starben etwa 7,3 % der Menschen mit SCD vor ihrem 23. Geburtstag, während 1989 2,6 % der Menschen mit SCD im Alter von 20 Jahren starben. ⓘ
Epidemiologie
Die höchste Häufigkeit der Sichelzellkrankheit findet sich in tropischen Regionen, insbesondere in Afrika südlich der Sahara, in Stammesgebieten Indiens und im Nahen Osten. Die Migration großer Bevölkerungsgruppen aus diesen Gebieten mit hoher Prävalenz in Länder mit niedriger Prävalenz in Europa hat in den letzten Jahrzehnten dramatisch zugenommen, und in einigen europäischen Ländern hat die Sichelzellkrankheit inzwischen bekanntere genetische Erkrankungen wie Hämophilie und Mukoviszidose überholt. Im Jahr 2015 führte sie zu etwa 114 800 Todesfällen. ⓘ
Die Sichelzellenkrankheit tritt häufiger bei Menschen auf, deren Vorfahren in tropischen und subtropischen Regionen südlich der Sahara lebten, wo Malaria verbreitet ist oder war. Dort, wo Malaria häufig vorkommt, hat das Tragen eines einzigen Sichelzellenallels (Trait) einen Heterozygotenvorteil; Menschen mit einem der beiden Allele der Sichelzellenkrankheit zeigen weniger schwere Symptome, wenn sie mit Malaria infiziert sind. ⓘ
Die Krankheit wird autosomal-rezessiv vererbt, d. h. beide Kopien des Gens in jeder Zelle sind mutiert. Die Eltern tragen jeweils eine Kopie des mutierten Gens, zeigen aber in der Regel keine Anzeichen und Symptome der Krankheit. ⓘ
Afrika
Drei Viertel der Sichelzellenanämie-Fälle treten in Afrika auf. In einem kürzlich erschienenen Bericht der WHO wird geschätzt, dass etwa 2 % der Neugeborenen in Nigeria von Sichelzellenanämie betroffen sind, was einer Gesamtzahl von 150.000 betroffenen Kindern entspricht, die jedes Jahr allein in Nigeria geboren werden. Die Häufigkeit der Sichelzellenanämie liegt in Äquatorialafrika zwischen 10 und 40 % und sinkt an der nordafrikanischen Küste auf 1-2 % und in Südafrika auf <1 %. Studien in Afrika zeigen, dass die Säuglingssterblichkeit im Alter von 2 bis 16 Monaten aufgrund der Sichelzellenanämie deutlich zurückgegangen ist. Dies geschah in Gebieten, in denen Malariafälle vorherrschten. ⓘ
Uganda hat die fünfthöchste Sichelzellkrankheitslast in Afrika. Einer Studie zufolge werden jährlich 20 000 Säuglinge mit Sichelzellanämie geboren, wobei der Anteil der Sichelzellanämie bei 13-3 % und der der Krankheit bei 0-7 % liegt. ⓘ
| Land | Bevölkerung (2020) | Unterregion | % der Prävalenz | Prävalenz | Inzidenz ⓘ |
| Angola | 32,866,272 | Mittleres Afrika | 0.09375 | 3,081,213 | 14,869 |
| Kamerun | 26,545,863 | Mittleres Afrika | 0.117 | 3,105,866 | 11,826 |
| DR Kongo | 89,561,403 | Mittleres Afrika | 0.1163333333 | 10,418,977 | 65,536 |
| Ghana | 31,072,940 | Westliches Afrika | 0.09375 | 2,913,088 | 9,588 |
| Guinea | 13,132,795 | Westliches Afrika | 0.139375 | 1,830,383 | 8,907 |
| Niger | 24,206,644 | Westliches Afrika | 0.07025 | 1,700,517 | 8,756 |
| Nigeria | 206,139,589 | Westliches Afrika | 0.1286666667 | 26,523,294 | 150,000 |
| Tansania | 59,734,218 | Ostafrika | 0.0545 | 3,255,515 | 19,585 |
| Uganda | 45,741,007 | Ostafrika | 0.07025 | 3,213,306 | 17,936 |
| Sambia | 18,383,955 | Ostafrika | 0.082 | 1,507,484 | 9,958 |
| Algerien | 43,851,044 | Nördliches Afrika | 0.029 | 1,271,680 | 6,624 |
| Benin | 12,123,200 | Westliches Afrika | 0.1286666667 | 1,559,852 | 8,125 |
| Botswana | 2,351,627 | Südliches Afrika | 0.029 | 68,197 | 355 |
| Burkina Faso | 20,903,273 | Westliches Afrika | 0.07025 | 1,468,455 | 7,649 |
| Burundi | 11,890,784 | Ostafrika | 0.023 | 273,488 | 1,425 |
| Cabo Verde | 555,987 | Westliches Afrika | 0.023 | 12,788 | 67 |
| Zentralafrikanische Republik | 4,829,767 | Mittleres Afrika | 0.082 | 396,041 | 2,063 |
| Tschad | 16,425,864 | Mittleres Afrika | 0.0585 | 960,913 | 5,005 |
| Komoren | 869,601 | Ostafrika | 0.023 | 20,001 | 104 |
| Kongo | 5,518,087 | Mittleres Afrika | 0.1615 | 891,171 | 4,642 |
| Côte d'Ivoire | 26,378,274 | Westliches Afrika | 0.07025 | 1,853,074 | 9,652 |
| Dschibuti | 988,000 | Ostafrika | 0.023 | 22,724 | 118 |
| Ägypten | 102,334,404 | Nördliches Afrika | 0.029 | 2,967,698 | 15,458 |
| Äquatorialguinea | 1,402,985 | Mittleres Afrika | 0.181 | 253,940 | 1,323 |
| Eritrea | 3,546,421 | Ostafrika | 0.023 | 81,568 | 425 |
| Eswatini | 1,160,164 | Südliches Afrika | 0.023 | 26,684 | 139 |
| Äthiopien | 114,963,588 | Ostafrika | 0.029 | 3,333,944 | 17,366 |
| Gabun | 2,225,734 | Mittleres Afrika | 0.181 | 402,858 | 2,098 |
| Gambia | 2,416,668 | Westliches Afrika | 0.082 | 198,167 | 1,032 |
| Guinea-Bissau | 1,968,001 | Westliches Afrika | 0.035 | 68,880 | 359 |
| Kenia | 53,771,296 | Ostafrika | 0.04675 | 2,513,808 | 13,094 |
| Lesotho | 2,142,249 | Südliches Afrika | 0.023 | 49,272 | 257 |
| Liberia | 5,057,681 | Westliches Afrika | 0.07025 | 355,302 | 1,851 |
| Libyen | 6,871,292 | Nördliches Afrika | 0.029 | 199,267 | 1,038 |
| Madagaskar | 27,691,018 | Ostafrika | 0.04675 | 1,294,555 | 6,743 |
| Malawi | 19,129,952 | Ostafrika | 0.035 | 669,548 | 3,488 |
| Mali | 20,250,833 | Westliches Afrika | 0.082 | 1,660,568 | 8,650 |
| Mauretanien | 4,649,658 | Westliches Afrika | 0.04675 | 217,372 | 1,132 |
| Mauretanien | 1,271,768 | Ostafrika | 0.023 | 29,251 | 152 |
| Marokko | 36,910,560 | Nördliches Afrika | 0.029 | 1,070,406 | 5,576 |
| Mosambik | 31,255,435 | Ostafrika | 0.035 | 1,093,940 | 5,698 |
| Namibia | 2,540,905 | Südliches Afrika | 0.03883333333 | 98,672 | 514 |
| Ruanda | 12,952,218 | Ostafrika | 0.035 | 453,328 | 2,361 |
| São Tomé und Príncipe | 219,159 | Mittleres Afrika | 0.181 | 39,668 | 207 |
| Senegal | 16,743,927 | Westliches Afrika | 0.07025 | 1,176,261 | 6,127 |
| Seychellen | 98,347 | Ostafrika | 0.023 | 2,262 | 12 |
| Sierra Leone | 7,976,983 | Westliches Afrika | 0.1615 | 1,288,283 | 6,711 |
| Somalia | 15,893,222 | Ostafrika | 0.029 | 460,903 | 2,401 |
| Süd-Afrika | 59,308,690 | Südliches Afrika | 0.029 | 1,719,952 | 8,959 |
| Südsudan | 11,193,725 | Ostafrika | 0.04675 | 523,307 | 2,726 |
| Sudan | 43,849,260 | Nördliches Afrika | 0.03883333333 | 1,702,813 | 8,870 |
| Togo | 8,278,724 | Westliches Afrika | 0.09375 | 776,130 | 4,043 |
| Tunesien | 11,818,619 | Nördliches Afrika | 0.023 | 271,828 | 1,416 |
| Simbabwe | 14,862,924 | Ostafrika | 0.035 | 520,202 | 2,710 |
| Insgesamt | 1,338,826,604 | Afrika | 91,868,664 | 495,726 |
Vereinigte Staaten
In den Vereinigten Staaten sind etwa 100.000 Menschen von dieser Krankheit betroffen (einer von 3.300), hauptsächlich Amerikaner afrikanischer Abstammung südlich der Sahara. In den Vereinigten Staaten hat etwa eines von 365 afroamerikanischen Kindern und eines von 16.300 hispanoamerikanischen Kindern Sichelzellenanämie. Die Lebenserwartung von Männern mit SCD liegt bei etwa 42 Jahren, während Frauen etwa sechs Jahre länger leben. Weitere 2 Millionen Menschen sind Träger der Sichelzellenanämie. Die meisten in den Vereinigten Staaten geborenen Säuglinge mit SCD werden durch ein routinemäßiges Neugeborenenscreening identifiziert. Seit 2016 ist in allen 50 Bundesstaaten das Screening auf Sichelzellkrankheit Teil der Neugeborenenuntersuchung. Dem Neugeborenen wird durch einen Fersenstich Blut abgenommen und zur Untersuchung an ein Labor geschickt. Das Baby muss mindestens 24 Stunden lang gegessen haben, bevor der Fersenblut-Test durchgeführt werden kann. In einigen Bundesländern muss außerdem ein zweiter Bluttest durchgeführt werden, wenn das Baby zwei Wochen alt ist, um die Ergebnisse zu sichern. Die Sichelzellenanämie ist die häufigste genetische Störung unter Afroamerikanern. Etwa 8 % sind Träger der Krankheit, und 1 von 375 wird mit dieser Krankheit geboren. Patientenvertreter haben sich darüber beschwert, dass die Sichelzellenanämie weniger staatliche und private Forschungsgelder erhält als ähnliche seltene Krankheiten wie z. B. Mukoviszidose. Der Forscher Elliott Vichinsky ist der Ansicht, dass dies ein Beweis für Rassendiskriminierung oder die Rolle des Wohlstands bei der Förderung des Gesundheitswesens ist. ⓘ
Frankreich
Infolge des Bevölkerungswachstums in den afrikanisch-karibischen Regionen im französischen Überseegebiet und der Einwanderung aus Nord- und Subsahara-Afrika auf das französische Festland ist die Sichelzellkrankheit in Frankreich zu einem großen Gesundheitsproblem geworden. Die Sichelzellenkrankheit ist inzwischen die häufigste genetische Erkrankung im Land, mit einer Gesamtprävalenz von einem von 2.415 Neugeborenen im französischen Mutterland, noch vor der Phenylketonurie (eines von 10.862), der kongenitalen Hypothyreose (eines von 3.132), der kongenitalen Nebennierenhyperplasie (eines von 19.008) und der Mukoviszidose (eines von 5.014) im gleichen Bezugszeitraum. ⓘ
Seit dem Jahr 2000 wird auf nationaler Ebene ein Neugeborenen-Screening auf SCD für alle Neugeborenen durchgeführt, die aufgrund ihrer ethnischen Herkunft als ³eRisiko³c für SCD gelten (d. h. Kinder von Eltern, die aus Afrika südlich der Sahara, Nordafrika, dem Mittelmeerraum (Süditalien, Griechenland und Türkei), der arabischen Halbinsel, den französischen Überseeinseln und dem indischen Subkontinent stammen). ⓘ
Vereinigtes Königreich
Im Vereinigten Königreich leiden schätzungsweise 12 000 bis 15 000 Menschen an der Sichelzellenanämie, wobei allein in England 250 000 Träger der Krankheit vermutet werden. Da die Zahl der Träger nur geschätzt wird, erhalten alle Neugeborenen im Vereinigten Königreich einen Routine-Bluttest, um auf die Krankheit zu testen. Da viele Erwachsene in Hochrisikogruppen nicht wissen, ob sie Träger der Krankheit sind, wird schwangeren Frauen und beiden Partnern eines Paares ein Screening angeboten, damit sie sich beraten lassen können, wenn sie die Sichelzellenanämie haben. Darüber hinaus werden auch Blutspender aus Hochrisikogruppen untersucht, um festzustellen, ob sie Träger sind und ob ihr Blut richtig gefiltert wird. Spender, bei denen sich herausstellt, dass sie Träger der Sichelzellenanämie sind, werden dann informiert, und ihr Blut wird zwar häufig für Angehörige derselben ethnischen Gruppe verwendet, aber nicht für Menschen mit Sichelzellenanämie, die eine Bluttransfusion benötigen. ⓘ
Naher Osten
In Saudi-Arabien tragen etwa 4,2 % der Bevölkerung das Sichelzellgen in sich und 0,26 % haben eine Sichelzellkrankheit. Die höchste Prävalenz ist in der Ostprovinz zu verzeichnen, wo etwa 17 % der Bevölkerung Träger des Gens sind und 1,2 % an der Sichelzellenkrankheit leiden. Im Jahr 2005 führte Saudi-Arabien einen obligatorischen vorehelichen Test mit HB-Elektrophorese ein, um die Häufigkeit von SCD und Thalassämie zu verringern. ⓘ
In Bahrain ergab eine 1998 veröffentlichte Studie, die rund 56 000 Personen in bahrainischen Krankenhäusern erfasste, dass 2 % der Neugeborenen an der Sichelzellkrankheit leiden, 18 % der befragten Personen das Sichelzellmerkmal haben und 24 % Träger der Genmutation sind, die die Krankheit verursacht. Das Land begann 1992 mit dem Screening aller schwangeren Frauen, und Neugeborene wurden getestet, wenn die Mutter Trägerin der Krankheit war. Im Jahr 2004 wurde ein Gesetz verabschiedet, das Paare, die heiraten wollen, zu einer kostenlosen vorehelichen Beratung verpflichtet. Diese Programme wurden von öffentlichen Aufklärungskampagnen begleitet. ⓘ
Indien und Nepal
Die Sichelzellenanämie ist in einigen ethnischen Gruppen Zentralindiens verbreitet, wo die Prävalenz zwischen 9,4 und 22,2 % in den endemischen Gebieten von Madhya Pradesh, Rajasthan und Chhattisgarh liegt. Auch bei den Tharu in Nepal und Indien ist die Krankheit endemisch; allerdings ist die Malariahäufigkeit bei ihnen um das Siebenfache niedriger, obwohl sie in einem von Malaria befallenen Gebiet leben. ⓘ
Karibische Inseln
In Jamaika tragen 10 % der Bevölkerung das Sichelzellen-Gen in sich, womit es die häufigste genetische Störung im Lande ist. ⓘ
Geschichte
Der erste moderne Bericht über die Sichelzellenkrankheit stammt möglicherweise aus dem Jahr 1846, als über die Autopsie eines hingerichteten entlaufenen Sklaven berichtet wurde; der wichtigste Befund war das Fehlen der Milz. Es wird berichtet, dass afrikanische Sklaven in den Vereinigten Staaten resistent gegen Malaria waren, aber anfällig für Beingeschwüre. Die abnormen Merkmale der roten Blutkörperchen, die der Krankheit später ihren Namen gaben, wurden erstmals 1910 von Ernest E. Irons (1877-1959), Assistenzarzt des Chicagoer Kardiologen und Medizinprofessors James B. Herrick (1861-1954), beschrieben. Irons entdeckte im Blut eines Mannes namens Walter Clement Noel, einem 20-jährigen Zahnmedizinstudenten aus Grenada, der im ersten Studienjahr war, "merkwürdig längliche und sichelförmige" Zellen. Noel war im Dezember 1904 mit Anämie in das Chicago Presbyterian Hospital eingeliefert worden. Noel wurde in den nächsten drei Jahren mehrmals wegen "Muskelrheumatismus" und "Gallenanfällen" wieder eingeliefert, schloss aber sein Studium ab und kehrte in die Hauptstadt von Grenada (St. George's) zurück, um als Zahnarzt zu praktizieren. Er starb 1916 an einer Lungenentzündung und ist auf dem katholischen Friedhof von Sauteurs im Norden Grenadas begraben. Kurz nach dem Bericht von Herrick erschien in der Virginia Medical Semi-Monthly ein weiterer Fall mit dem gleichen Titel: "Peculiar Elongated and Sickle-Shaped Red Blood Corpuscles in a Case of Severe Anemia". Dieser Artikel bezieht sich auf einen Patienten, der am 15. November 1910 in das University of Virginia Hospital eingeliefert wurde. In der späteren Beschreibung von Verne Mason aus dem Jahr 1922 wird zum ersten Mal die Bezeichnung "Sichelzellenanämie" verwendet. Über Probleme in der Kindheit, die mit der Sichelzellenanämie zusammenhängen, wurde erst in den 1930er Jahren berichtet, obwohl dies in der afroamerikanischen Bevölkerung keine Seltenheit war. ⓘ
Der Arzt Lemuel Diggs aus Memphis, ein bedeutender Forscher auf dem Gebiet der Sichelzellenanämie, führte 1933 erstmals die Unterscheidung zwischen Sichelzellenanämie und Trait ein, obwohl die genetischen Merkmale bis 1949 von James V. Neel und E.A. Beet nicht aufgeklärt worden waren. 1949 beschrieb Linus Pauling das ungewöhnliche chemische Verhalten von Hämoglobin S und führte dies auf eine Anomalie im Molekül selbst zurück. Die molekulare Veränderung von HbS wurde 1956 von Vernon Ingram beschrieben. In den späten 1940er und frühen 1950er Jahren wurde der Zusammenhang zwischen Malaria und Sichelzellkrankheit weiter erforscht. Die Einführung der Hämoglobin-Elektrophorese im Jahr 1954 ermöglichte die Entdeckung bestimmter Subtypen, wie der HbSC-Krankheit. ⓘ
In den 1970er und 1980er Jahren wurden groß angelegte Studien zum natürlichen Krankheitsverlauf und weitere Interventionsstudien durchgeführt, die unter anderem zu einer weit verbreiteten Prophylaxe gegen Pneumokokkeninfektionen führten. Bill Cosbys mit dem Emmy ausgezeichneter Fernsehfilm To All My Friends on Shore aus dem Jahr 1972 schilderte die Geschichte der Eltern eines Kindes mit Sichelzellkrankheit. In den 1990er Jahren wurde Hydroxycarbamid entwickelt, und 2007 erschienen Berichte über eine Heilung durch Knochenmarktransplantation. ⓘ
Einige alte Texte bezeichnen die Krankheit als Drepanozytose. ⓘ
Gesellschaft und Kultur
U.S. Social Security
Mit Wirkung vom 15. September 2017 hat die US-Sozialversicherungsbehörde eine Grundsatzentscheidung (Policy Interpretation Ruling) herausgegeben, die Hintergrundinformationen zur Sichelzellenkrankheit und eine Beschreibung der Bewertung der Krankheit durch die Sozialversicherung während des Verfahrens zur Beurteilung von Ansprüchen auf Invalidität enthält. ⓘ
Stigmatisierung in den USA
In den USA ist SCD mit einem Stigma behaftet, das Menschen mit SCD davon abhält, die notwendige Behandlung in Anspruch zu nehmen. Nach Angaben des National Heart, Lung, and Blood Institute betreffen diese Stigmata vor allem Menschen afroamerikanischer und lateinamerikanischer Abstammung. Menschen mit SCD erleben, wie sich die Stigmatisierung der Krankheit auf verschiedene Aspekte des Lebens auswirkt, einschließlich des sozialen und psychologischen Wohlbefindens. Studien haben gezeigt, dass Menschen mit SCD häufig das Gefühl haben, ihre Diagnose geheim halten zu müssen, um Diskriminierung am Arbeitsplatz und auch in Beziehungen unter Gleichaltrigen zu vermeiden. In den 1960er Jahren unterstützte die US-Regierung Initiativen zur Untersuchung von Arbeitsplätzen auf genetische Krankheiten, um Menschen mit SCD zu schützen. Mit diesem Screening sollte verhindert werden, dass Arbeitnehmer in Umgebungen eingesetzt werden, die möglicherweise schädlich sind und SCD auslösen können. ⓘ
Stigmatisierung in Uganda
Uganda ist das Land mit der fünfthöchsten Sichelzellkrankheit (SCD) in der Welt. In Uganda sind Menschen mit Sichelzellkrankheit aufgrund des mangelnden Allgemeinwissens über diese Krankheit sozial stigmatisiert. Die allgemeine Wissenslücke im Zusammenhang mit der Sichelzellkrankheit ist bei Jugendlichen und jungen Erwachsenen aufgrund der kulturell sanktionierten Geheimhaltung der Krankheit besonders ausgeprägt. Die meisten Menschen haben zwar schon von der Krankheit gehört, aber ein großer Teil der Bevölkerung ist relativ schlecht darüber informiert, wie die Sichelzellenkrankheit diagnostiziert oder vererbt wird. Diejenigen, die über die Krankheit informiert sind, haben von ihrer Familie oder ihren Freunden davon erfahren und nicht von medizinischen Fachkräften. Wenn die Öffentlichkeit nicht über die Sichelzellkrankheit informiert wird, hat dies zur Folge, dass die Bevölkerung nur unzureichend über die Ursachen der Krankheit, die Symptome und die Präventionsmaßnahmen informiert ist. Die körperlichen und sozialen Unterschiede, die bei Menschen mit Sichelzellkrankheit auftreten, wie Gelbsucht, verzögertes körperliches Wachstum und verzögerte Geschlechtsreife, können auch dazu führen, dass sie zur Zielscheibe von Mobbing, Ablehnung und Stigmatisierung werden. ⓘ
Anteil der Sichelzellenanämie in Uganda
Die Daten zur Sichelzellkrankheit in Uganda wurden seit den frühen 1970er Jahren nicht mehr aktualisiert. Der Mangel an Daten ist auf fehlende staatliche Forschungsmittel zurückzuführen, obwohl täglich Menschen in Uganda an der Sichelzellenkrankheit sterben. Die Daten zeigen, dass die Sichelzellkrankheit bei 20 % der ugandischen Bevölkerung vorkommt. Das bedeutet, dass für 66 Millionen Menschen das Risiko besteht, ein Kind mit Sichelzellkrankheit zu haben. Schätzungen zufolge werden jedes Jahr etwa 25 000 ugandische Kinder mit Sichelzellenanämie geboren, und 80 % dieser Menschen werden nicht älter als fünf Jahre. Die Sichelzellenanämie trägt auch zu 25 % zur Kindersterblichkeitsrate in Uganda bei. Das Bamba-Volk in Uganda, das im Südwesten des Landes lebt, trägt zu 45 % das Gen in sich, was die höchste weltweit festgestellte Häufigkeit des Merkmals darstellt. Die Sichelzellenklinik in Mulago ist die einzige Klinik für Sichelzellenanämie in Uganda und behandelt im Durchschnitt 200 Patienten pro Tag. ⓘ
Falsche Vorstellungen über die Sichelzellenkrankheit
Das Stigma, das die Krankheit umgibt, ist in Regionen des Landes, die nicht so stark betroffen sind, besonders schlimm. So wissen die Menschen im Osten Ugandas in der Regel besser über die Krankheit Bescheid als die Menschen im Westen des Landes, die eher glauben, dass die Sichelzellkrankheit eine Strafe Gottes oder Hexerei ist. Zu den weiteren Irrtümern über die Sichelzellkrankheit gehört der Glaube, dass sie durch Umweltfaktoren verursacht wird, während es sich in Wirklichkeit um eine genetische Krankheit handelt. In ganz Uganda wurden Anstrengungen unternommen, um die gesellschaftlichen Missverständnisse über die Krankheit zu beseitigen. Im Jahr 2013 wurde die Uganda Sickle Cell Rescue Foundation gegründet, um das Bewusstsein für die Sichelzellkrankheit zu schärfen und das mit der Krankheit verbundene soziale Stigma zu bekämpfen. Zusätzlich zu den Bemühungen dieser Organisation muss die Sichelzellkrankheit in bereits bestehende Programme zur Gesundheitsaufklärung in den Gemeinden aufgenommen werden, um die Stigmatisierung der Sichelzellkrankheit in Uganda zu verringern. ⓘ
Soziale Isolation von Menschen mit Sichelzellanämie
Die tief verwurzelte gesellschaftliche Stigmatisierung der Sichelzellkrankheit veranlasst die Familien oft, den Krankheitsstatus ihrer Familienmitglieder zu verheimlichen, aus Angst, abgestempelt, verflucht oder von gesellschaftlichen Ereignissen ausgeschlossen zu werden. Wenn in Uganda bestätigt wird, dass ein Familienmitglied an der Sichelzellkrankheit leidet, werden manchmal intime Beziehungen zu allen Familienmitgliedern vermieden. Die Stigmatisierung und soziale Isolation, die Menschen mit Sichelzellanämie erfahren, ist oft die Folge der weit verbreiteten falschen Vorstellung, dass Menschen mit Sichelzellanämie keinen Kontakt zu Menschen ohne diese Krankheit haben sollten. Diese Mentalität beraubt Menschen mit Sichelzellkrankheit des Rechts, wie alle anderen frei an Aktivitäten in der Gemeinschaft teilzunehmen. Die mit Sichelzellkrankheit verbundene Stigmatisierung und soziale Isolation in Schulen kann das Leben junger Menschen mit Sichelzellkrankheit extrem schwierig machen. Für Kinder im Schulalter, die mit SCD leben, kann das Stigma, mit dem sie konfrontiert sind, zur Ablehnung durch Gleichaltrige führen. Die Ablehnung durch Gleichaltrige beinhaltet den Ausschluss aus sozialen Gruppen oder Zusammenkünften. Dies führt bei den Ausgegrenzten häufig zu emotionalem Stress und kann zu schlechten schulischen Leistungen, Schulvermeidung und beruflichem Versagen im späteren Leben führen. Diese soziale Isolation hat wahrscheinlich auch negative Auswirkungen auf das Selbstwertgefühl und die allgemeine Lebensqualität von Menschen mit SCD. ⓘ
Frauen in Uganda und die Stigmatisierung von SCD
Mütter von Kindern mit Sichelzellkrankheit
Mütter von Kindern mit Sichelzellenanämie werden von Gleichaltrigen und Familienmitgliedern überproportional oft stigmatisiert. Diese Frauen werden oft für die Diagnose der Sichelzellkrankheit bei ihrem Kind verantwortlich gemacht, insbesondere wenn die Sichelzellkrankheit in früheren Generationen noch nicht aufgetreten ist, da der Verdacht besteht, dass der schlechte Gesundheitszustand des Kindes darauf zurückzuführen ist, dass die Mutter es versäumt hat, vorbeugende Gesundheitsmaßnahmen zu ergreifen oder ein gesundes Umfeld für das Gedeihen ihres Kindes zu fördern. Der Rückgriff auf Theorien, die sich auf Umweltfaktoren beziehen, um der Mutter die Schuld zuzuschieben, spiegelt das mangelnde Wissen vieler Ugander darüber wider, wie die Krankheit erworben wird, da sie durch die Genetik und nicht durch die Umwelt bestimmt wird. Mütter von Kindern mit Sichelzellenanämie verfügen zudem oft nur über sehr begrenzte Ressourcen, um ihre Zukunft vor dem Stigma der Krankheit zu schützen. Dieser mangelnde Zugang zu Ressourcen ergibt sich aus ihrer untergeordneten Rolle innerhalb der familiären Strukturen sowie aus den Klassenunterschieden, die viele Mütter daran hindern, die zusätzlichen Kinderbetreuungskosten und -pflichten zu erfüllen. ⓘ
Schwangere Frauen mit Sichelzellkrankheit
Frauen mit Sichelzellenanämie, die schwanger werden, sind in Uganda oft mit extremer Diskriminierung und Entmutigung konfrontiert. Diese Frauen werden von Gleichaltrigen häufig als unverantwortlich gebrandmarkt, weil sie ein Kind bekommen, während sie mit der Sichelzellkrankheit leben, oder sogar Sex haben, während sie mit der Sichelzellkrankheit leben. Die Kritik und das Urteil, das diese Frauen nicht nur von medizinischem Fachpersonal, sondern auch von ihren Familien zu hören bekommen, führt oft dazu, dass sie sich einsam, deprimiert, ängstlich und beschämt fühlen und nur wenig soziale Unterstützung finden. Die meisten schwangeren Frauen mit SCD werden auch alleinerziehende Mütter, da sie häufig von ihren männlichen Partnern verlassen werden, die behaupten, sie hätten nichts von dem SCD-Status ihrer Partnerin gewusst. Das Verlassenwerden dieser Frauen verursacht nicht nur emotionalen Stress für sie, sondern dieses geringe Maß an elterlicher Unterstützung kann auch mit depressiven Symptomen und einer insgesamt geringeren Lebensqualität für das Kind nach der Geburt in Verbindung gebracht werden. ⓘ
Forschung
Nabelschnurbluttransplantation
Eine Nabelschnurbluttransplantation kann die Krankheit zwar potenziell heilen, aber nur in 10 % der Fälle ist ein geeigneter Spender verfügbar. Etwa 7 % der Patienten sterben an den Folgen des Eingriffs, und es kann zu einer Transplantat-gegen-Wirt-Krankheit kommen. ⓘ
Gentherapie
Krankheiten wie die Sichelzellkrankheit, bei denen der normale Phänotyp oder die normale Zellfunktion einer Person in den Zellen, die an der Krankheit leiden, durch eine normale Kopie des mutierten Gens wiederhergestellt werden kann, können für eine gentherapeutische Behandlung in Frage kommen. Die Risiken und der Nutzen der Gentherapie bei Sichelzellkrankheit sind nicht bekannt. ⓘ
Im Jahr 2001 wurde die Sichelzellenkrankheit Berichten zufolge bei Mäusen erfolgreich mit Gentherapie behandelt. Die Forscher verwendeten einen viralen Vektor, um die Mäuse - die im Wesentlichen denselben Defekt aufweisen, der die Sichelzellenkrankheit beim Menschen verursacht - dazu zu bringen, die Produktion von fetalem Hämoglobin (HbF) zu erhöhen, das ein Mensch normalerweise kurz nach der Geburt nicht mehr produziert. Beim Menschen ist bekannt, dass die Verwendung von Hydroxyharnstoff zur Stimulierung der HbF-Produktion die Symptome der Sichelzellenkrankheit vorübergehend lindern kann. Die Forscher wiesen nach, dass diese gentherapeutische Methode ein dauerhafterer Weg zur Steigerung der therapeutischen HbF-Produktion ist. ⓘ
2014 wurden klinische Studien der Phase 1 zur Gentherapie der Sichelzellkrankheit beim Menschen begonnen. In den klinischen Studien soll die Sicherheit von mit lentiviralen Vektoren modifiziertem Knochenmark bei Erwachsenen mit schwerer Sichelzellkrankheit untersucht werden. Bis 2020 sind jedoch noch keine randomisierten kontrollierten Studien bekannt. Ein Fallbericht über die erste behandelte Person wurde im März 2017 veröffentlicht, und seitdem wurden einige weitere Personen behandelt. ⓘ
Gen-Editing-Plattformen wie CRISPR/Cas9 wurden eingesetzt, um die krankheitsverursachende Mutation in hämatopoetischen Stammzellen zu korrigieren, die einer betroffenen Person entnommen worden waren. Im Juli 2019 wurde das Gen-Editing-Tool CRISPR eingesetzt, um Knochenmarkzellen einer Person mit SCD so zu verändern, dass das Gen für fötales Hämoglobin "eingeschaltet" wurde. Eine Reihe von Forschern hat sich mit den ethischen Implikationen der SCD als eine der ersten potenziellen Anwendungen der CRISPR-Technologie befasst, angesichts des historischen Missbrauchs und der Vernachlässigung der afroamerikanischen Gemeinschaft durch die Medizin. ⓘ
Im Jahr 2017 konzentrierten sich zwölf klinische Studien auf die Gentherapie zur Behandlung der Sichelzellenanämie. Bei vier dieser 12 Studien wurde das mutierte HBB-Gen durch ein gesundes ersetzt. In drei Studien wurde Mozobil, ein Medikament zur Behandlung von Krebsarten, verwendet, um festzustellen, ob die Vermehrung von Stammzellen für die Gentherapie genutzt werden kann. Eine Studie konzentrierte sich auf die Analyse von Knochenmarksproben von Patienten mit Sichelzellenanämie. In einem anderen Versuch wurde Nabelschnurblut von Säuglingen mit und ohne Sichelzellenanämie für die Entwicklung einer Gentherapie verwendet. ⓘ
Hämatopoetische Stammzellentransplantation
Es gibt keine stichhaltigen medizinischen Beweise für die Risiken und den potenziellen Nutzen der Behandlung von Menschen mit Sichelzellenanämie mit hämatopoetischen Stammzelltransplantationen. ⓘ
Verbreitung

Auffallend ist, dass in Gebieten der Malaria das Sichelzellenallel relativ häufig ist. Daraus wurde geschlussfolgert, dass es gegen Malaria eine Resistenz verleiht, sodass die gesunden Überträger (AS) des Sichelzellenallels in diesen Gebieten einen Selektionsvorteil (den sogenannten Heterozygotenvorteil) gegenüber denen ohne Sichelzellenallel (Genotyp AA), die eher an Malaria sterben, und auch gegenüber den Sichelzellerkrankten (Genotyp SS) haben, die vorzeitig an Sichelzellenanämie sterben. In Afrika gibt es beispielsweise Gegenden, in denen fast ein Drittel der Bevölkerung heterozygot für dieses Merkmal ist. In den anderen Weltgegenden kommt das Sichelzellenallel praktisch nicht vor, da hier dieser Selektionsvorteil aufgrund der fehlenden Malaria nicht wirksam ist. In Deutschland werden jährlich zwischen 500 und 1100 Fälle von Malaria festgestellt. Etwa 85 % der homozygoten Träger stammen aus Afrika. ⓘ
Verlässliche Daten zur Häufigkeit in Deutschland liegen nicht vor. Die Gesamtzahl der in Deutschland lebenden Patienten mit Sichelzellkrankheit wurde für das Jahr 2017 auf mindestens 2000 geschätzt. ⓘ
Bedeutung der Sichelzellanämie für Malaria

Möglicherweise besteht ein Selektionsvorteil von heterozygoten Trägern bei Infektionen mit Malaria. Der Malaria-Erreger wird während eines Teiles seines Entwicklungszyklus an oder in den Erythrozyten transportiert. Das Hämoglobin von Menschen mit der heterozygoten Form des HbS führt durch Verminderung der Sauerstoffsättigung des Hämoglobins unter Extrembedingungen zur sichelartigen Verformung der roten Blutzellen, die dann in der Milz abgebaut werden oder verklumpen und danach zugrunde gehen. Eine Hypothese besagt, diejenigen Zellen, die von Plasmodien befallen sind, würden sich auch ohne diese Druckverminderung schon allein durch den Einfluss der Merozoiten beziehungsweise der Trophozoiten verformen, von der Milz als krank erkannt und abgebaut werden. ⓘ
Eine weitere Hypothese ist die direkte Tötung der Parasiten, denn die Sichelzellen bilden vermehrt Sauerstoffradikale. Es entstehen dabei Superoxidanionen und Wasserstoffperoxid, und beide Verbindungen sind für die Parasiten giftig. ⓘ
Eine andere Theorie besagt Folgendes: Befallen die Plasmodien, die die Malaria verursachen, Erythrozyten, so setzen die Mikroben nach einiger Zeit Säuren als Abfallprodukte ihres Stoffwechsels frei. Das Hämoglobin gibt nun, von H+-Ionen angeregt, den Sauerstoff ab (Rechtsverschiebung der Sauerstoffbindungskurve). Die Sichelform betrifft aber vor allem die Desoxyform der Erythrozyten. Also werden die befallenen Zellen schnell zu Sichelzellen, und diese werden dann in der Milz samt den Mikroben abgebaut. Daraus erklärt sich die Resistenz der Träger der Sichelzellenanämie gegenüber Malaria (siehe Abbildung). ⓘ
Die letzte Theorie besagt, dass dabei unter der Bildung von Hämoglobinpolymeren Hämin entsteht, das wiederum zur direkten Tötung der Parasiten führt. ⓘ
Therapie
Momentan werden Ansätze zur Verstärkung der Genexpression von HbF in Adoleszenten und Erwachsenen untersucht. ⓘ
Hydroxyurea kann die Bildung von HbF induzieren. Rote Blutkörperchen mit hohem Anteil von HbF bilden keine Sichelzellen, werden daher seltener abgebaut und verursachen seltener Verschlüsse kleiner Gefäße. Eine Behandlung mit Hydroxyurea kann die Häufigkeit von Gefäßverschlüssen vermindern, chronische Organschäden mildern und das Überleben verlängern. Dieses konnte kürzlich auch bei Kindern im Subsahara-Afrika gezeigt werden. ⓘ
Weiterhin wird ein adoptiver Zelltransfer untersucht. ⓘ
Am 12. Oktober 2016 wurde eine Therapiemöglichkeit basierend auf einer Veränderung der betroffenen Gene mit der CRISPR/Cas-Methode veröffentlicht. Mit Hilfe der Genschere ersetzten die Forscher die krankmachende Mutation durch die korrekten DNA-Basen. Es wurden zum ersten Mal ausreichend gesunde Blutzellen erzeugt, um Patienten künftig mit dieser Methode heilen zu können, wie die Forscher um Jacob Corn von der University of California, Berkeley berichteten. Es sei noch zu früh, um von einer praktikablen Lösung zu sprechen, jedoch sei der erste Schritt gemacht um die Ursachen zu bekämpfen, anstatt eine Symptombehandlung durchzuführen. ⓘ
Weitere Arzneimittel sind der Sauerstoffaffinitäts-Modulator Voxelotor und der monoklonale Antikörper Crizanlizumab. ⓘ