Hämophilie
| Hämophilie ⓘ | |
|---|---|
| Andere Namen | Hämophilie |
 | |
| Eine Zeichnung des Gerinnungsfaktors VIII | |
| Aussprache |
|
| Fachgebiet | Hämatologie |
| Symptome | Leichte und langanhaltende Blutungen |
| Übliches Auftreten | Bei der Geburt |
| Ursachen | Meist genetisch bedingt |
| Diagnostische Methode | Bluttest |
| Vorbeugung | Präimplantations-Screening |
| Behandlung | Ersetzen fehlender Blutgerinnungsfaktoren |
| Häufigkeit | 1 von 7.500 Männern (Hämophilie A), 1 von 40.000 Frauen (Hämophilie B) |
Hämophilie (von altgriechisch αἷμα (haîma) "Blut" und φιλία (philía) "Liebe zu") ist eine meist vererbte genetische Störung, die die Fähigkeit des Körpers zur Bildung von Blutgerinnseln beeinträchtigt, die zur Blutstillung erforderlich ist. Dies führt dazu, dass Menschen nach einer Verletzung länger bluten, leicht Blutergüsse bekommen und ein erhöhtes Risiko für Blutungen in Gelenken oder im Gehirn haben. Bei Menschen mit einer leichten Form der Krankheit treten die Symptome möglicherweise erst nach einem Unfall oder während einer Operation auf. Blutungen in ein Gelenk können zu dauerhaften Schäden führen, während Blutungen im Gehirn zu lang anhaltenden Kopfschmerzen, Krampfanfällen oder Bewusstseinsstörungen führen können. ⓘ
Es gibt zwei Haupttypen von Hämophilie: Hämophilie A, die aufgrund geringer Mengen des Gerinnungsfaktors VIII auftritt, und Hämophilie B, die aufgrund geringer Mengen des Gerinnungsfaktors IX auftritt. Sie werden in der Regel von den Eltern über ein X-Chromosom vererbt, das ein nicht funktionsfähiges Gen trägt. In seltenen Fällen kann während der frühen Entwicklung eine neue Mutation auftreten oder die Hämophilie kann sich später im Leben durch die Bildung von Antikörpern gegen einen Gerinnungsfaktor entwickeln. Zu den anderen Arten gehören die Hämophilie C, die durch einen niedrigen Spiegel des Faktors XI entsteht, die Von-Willebrand-Krankheit, die durch einen niedrigen Spiegel des so genannten Von-Willebrand-Faktors im Blut entsteht, und die Parahämophilie, die durch einen niedrigen Spiegel des Faktors V entsteht. Die Diagnose erfolgt durch Untersuchung des Blutes auf seine Gerinnungsfähigkeit und den Gehalt an Gerinnungsfaktoren. ⓘ
Zur Vorbeugung kann eine Eizelle entnommen, befruchtet und der Embryo getestet werden, bevor er in die Gebärmutter eingesetzt wird, was mit ethischen Problemen verbunden ist. Menschliche Embryonen in der Forschung können als technischer Gegenstand/Prozess betrachtet werden. Zur Behandlung der Hämophilie werden fehlende Blutgerinnungsfaktoren ersetzt. Dies kann in regelmäßigen Abständen oder bei Blutungsepisoden geschehen. Die Substitution kann zu Hause oder im Krankenhaus erfolgen. Die Gerinnungsfaktoren werden entweder aus menschlichem Blut oder durch rekombinante Methoden hergestellt. Bis zu 20 % der Menschen entwickeln Antikörper gegen die Gerinnungsfaktoren, was die Behandlung erschwert. Das Medikament Desmopressin kann bei leichter Hämophilie A eingesetzt werden. Studien zur Gentherapie befinden sich im Anfangsstadium. ⓘ
Von Hämophilie A ist etwa 1 von 5.000-10.000 betroffen, von Hämophilie B etwa 1 von 40.000, wobei die Männer bei der Geburt betroffen sind. Da es sich sowohl bei Hämophilie A als auch bei Hämophilie B um X-chromosomal rezessiv vererbte Krankheiten handelt, sind Frauen nur selten schwer betroffen. Einige Frauen mit einem nicht funktionsfähigen Gen auf einem der X-Chromosomen können leichte Symptome aufweisen. Hämophilie C tritt bei beiden Geschlechtern gleichermaßen auf und ist vor allem bei aschkenasischen Juden zu finden. In den 1800er Jahren war Hämophilie B in den königlichen Familien in Europa weit verbreitet. Der Unterschied zwischen Hämophilie A und B wurde 1952 festgestellt. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| D66 | Hereditärer Faktor-VIII-Mangel |
| D67 | Hereditärer Faktor-IX-Mangel |
| D68 | Sonstige Koagulopathien |
| ICD-10 online (WHO-Version 2019) | |
Hämophilie (von altgriechisch αἷμα haima „Blut“ und φιλία philia „Neigung“), auch Bluterkrankheit genannt, ist eine Erbkrankheit, bei der die Blutgerinnung gestört ist. Das Blut aus Wunden gerinnt nicht oder nur langsam. Häufig kommt es auch zu spontanen Blutungen, die ohne sichtbare Wunden auftreten. Hämophilie tritt hauptsächlich bei Männern auf. Betroffene Personen werden umgangssprachlich auch als Bluter bezeichnet. ⓘ
Anzeichen und Symptome

Die charakteristischen Symptome variieren je nach Schweregrad. Im Allgemeinen treten Symptome in Form von inneren oder äußeren Blutungen auf, die als "Blutungen" bezeichnet werden. Bei Menschen mit schwerer Hämophilie kommt es zu stärkeren und häufigeren Blutungen, während bei Menschen mit leichter Hämophilie in der Regel geringere Symptome auftreten, außer nach Operationen oder schweren Traumata. Bei mittelschwerer Hämophilie sind die Symptome variabel und bewegen sich in einem Spektrum zwischen schweren und leichten Formen. ⓘ
Sowohl bei der Hämophilie A als auch bei der Hämophilie B kommt es zu spontanen Blutungen, aber einer normalen Blutungszeit, einer normalen Prothrombinzeit, einer normalen Thrombinzeit, aber einer verlängerten partiellen Thromboplastinzeit. Innere Blutungen treten häufig bei Menschen mit schwerer Hämophilie und bei einigen Personen mit mäßiger Hämophilie auf. Die charakteristischste Form der inneren Blutung ist eine Gelenkblutung, bei der Blut in die Gelenkzwischenräume eindringt. Dies kommt am häufigsten bei schweren Hämophilen vor und kann spontan (ohne offensichtliches Trauma) auftreten. Wenn sie nicht umgehend behandelt werden, können Gelenkblutungen zu dauerhaften Gelenkschäden und Entstellungen führen. Blutungen in Weichteile wie Muskeln und Unterhautgewebe sind weniger schwerwiegend, können aber zu Schäden führen und müssen behandelt werden. ⓘ
Kinder mit leichter bis mittelschwerer Hämophilie zeigen bei der Geburt möglicherweise keine Anzeichen oder Symptome, insbesondere wenn sie nicht beschnitten werden. Ihre ersten Symptome sind oft häufige und große Blutergüsse und Hämatome durch häufige Stöße und Stürze, wenn sie laufen lernen. Auch Schwellungen und Blutergüsse durch Blutungen in den Gelenken, Weichteilen und Muskeln können auftreten. Kinder mit leichter Hämophilie haben möglicherweise viele Jahre lang keine erkennbaren Symptome. Bei sehr milden Hämophilen ist das erste Anzeichen oft eine starke Blutung nach einer Zahnbehandlung, einem Unfall oder einer Operation. Frauen, die Trägerinnen sind, haben in der Regel genug Gerinnungsfaktoren von ihrem einen normalen Gen, um ernsthafte Blutungsprobleme zu verhindern, obwohl einige von ihnen als leichte Hämophile auftreten können. ⓘ
Muskelblutungen treten seltener spontan auf als Gelenkblutungen und haben meistens Traumata als Ursache. Je nach Lage und Größe des Muskels können sie jedoch extrem langwierig werden und durch irreversible Muskelschädigung zu Verkrüppelungen führen. Muskelblutungen können auch nach intramuskulären Impfungen auftreten, die z. B. in den Gesäßmuskel, Oberarmmuskel gegeben werden. Bluterpatienten sollten daher Impfungen nur unter die Haut erhalten („subkutan“). Typische gefährliche Muskelblutungen finden sich z. B.:
- im Psoasmuskel (verläuft vom Bauch durch das Becken zum Bein, so dass ein „Stillhalten“ während des Heilungsprozesses fast nicht möglich ist und die Blutung oft nach scheinbarer Heilung wiederkehrt). Die dadurch entstehenden Schmerzen wurden besonders vor Einführung von Ultraschalluntersuchungen mit einer Blinddarmentzündung verwechselt (sog. „Pseudoappendizitis“).
- im Wadenmuskel (Wadenblutungen führen zu einer Verkürzung des Muskels und dadurch zum Spitzfuß, der wiederum zu einer erhöhten Belastung der Wade beim Gehen und zu weiteren Blutungen führen kann)
- in den Unterarmen (Blutungen der Unterarme können auf die Handnerven drücken und neben extremen Schmerzen auch Unbeweglichkeiten und Fehlstellungen der Hände auslösen) ⓘ
Hämophilie-Patienten bluten länger als gesunde Menschen. Je nach Schweregrad können Spontanblutungen auftreten, d. h. ohne entsprechende Verletzung. Bei Gesunden können solche Spontanblutungen ebenfalls auftreten, heilen aber rasch und unbemerkt wieder ab. Die Blutungen können überall auftreten, jedoch sind bestimmte Lokalisationen typisch bei Hämophilie-Patienten, z. B. Gelenkeinblutungen. ⓘ
Eine durch einen Unfall hervorgerufene oder schwere Blutung kann nur durch Gabe von Gerinnungsfaktoren in Grenzen gehalten werden. Ist diese Hilfe nicht rechtzeitig möglich, kann dies (auch bei weniger schweren Verletzungen) den Tod durch Verbluten bedeuten. ⓘ
Schnitt-, Riss- und Schürfwunden führen bei den häufigsten Unterformen der Hämophilie zunächst nicht zu stärkerem Blutverlust als bei gesunden Menschen, da die Krustenbildung dank der intakten Blutplättchen (Thrombozyten) zunächst funktioniert. Erst die verzögerte Blutgerinnung führt dazu, dass die Verkrustung immer wieder aufbrechen kann und die Blutung je nach Schweregrad der Hämophilie nur sehr langsam oder gar nicht gestillt wird. Auch ohne äußere Einwirkung kann es daher zu subkutanen oder intramuskulären Hämatomen kommen. ⓘ
Die Gefahr innerer Blutungen ist bei Hämophilie-Patienten ebenfalls erhöht (z. B. Nierenblutungen mit starker Kolik, Verschluss der Harnwege durch Thromben). ⓘ
Bei weiblichen Trägern des Gendefekts (sog. Konduktorinnen) kann eine verstärkte Blutungsneigung auftreten, die sich in verstärkten Regelblutungen, Neigung zu blauen Flecken (Hämatomen), bei Bagatelleingriffen wie Zahnextraktionen oder während bzw. nach Entbindung zeigen kann. In seltenen Fällen können auch Blutungen auftreten, die denen von männlichen Betroffenen gleichen (z. B. Gelenkblutungen). ⓘ
Komplikationen
Schwerwiegende Komplikationen sind bei schwerer und mittelschwerer Hämophilie wesentlich häufiger. Komplikationen können durch die Krankheit selbst oder durch ihre Behandlung entstehen:
- Tiefe innere Blutungen, z. B. tiefe Muskelblutungen, die zu Schwellungen, Taubheit oder Schmerzen einer Gliedmaße führen.
- Gelenkschäden durch Hämarthrose (hämophile Arthropathie), möglicherweise mit starken Schmerzen, Entstellung und sogar Zerstörung des Gelenks und Entwicklung einer schwächenden Arthritis.
- Durch Bluttransfusionen übertragene Infektionen, die als Behandlung verabreicht werden.
- Unerwünschte Reaktionen auf die Behandlung mit Gerinnungsfaktoren, einschließlich der Entwicklung eines Immuninhibitors, der die Wirksamkeit des Faktorersatzes beeinträchtigt.
- Eine intrakranielle Blutung ist ein ernster medizinischer Notfall, der durch einen Druckaufbau im Schädelinneren verursacht wird. Sie kann zu Orientierungslosigkeit, Übelkeit, Bewusstlosigkeit, Hirnschäden und zum Tod führen.
Die hämophile Arthropathie ist durch chronisch proliferative Synovitis und Knorpelzerstörung gekennzeichnet. Wenn eine intraartikuläre Blutung nicht frühzeitig abgeleitet wird, kann sie die Apoptose von Chondrozyten verursachen und die Synthese von Proteoglykanen beeinträchtigen. Die hypertrophierte und brüchige Synovialschleimhaut, die versucht, überschüssiges Blut zu beseitigen, kann leichter wieder einbluten, was zu einem Teufelskreis aus Hämarthrose-Synovitis-Hämarthrose führt. Darüber hinaus kann die Eisenablagerung in der Synovialis eine Entzündungsreaktion auslösen, die das Immunsystem aktiviert und die Angiogenese stimuliert, was zur Zerstörung von Knorpel und Knochen führt. ⓘ
Genetik

Frauen besitzen in der Regel zwei X-Chromosomen, Männer ein X- und ein Y-Chromosom. Da die Mutationen, die die Krankheit verursachen, X-chromosomal rezessiv vererbt werden, kann eine Frau, die den Defekt auf einem ihrer X-Chromosomen trägt, davon nicht betroffen sein, da das entsprechende dominante Allel auf ihrem anderen Chromosom aufgrund der X-Inaktivierung die notwendigen Gerinnungsfaktoren produzieren sollte. Heterozygote Frauen sind also nur Trägerinnen dieser genetischen Disposition. Das Y-Chromosom des Mannes hat jedoch kein Gen für die Faktoren VIII oder IX. Wenn die für die Produktion von Faktor VIII oder IX verantwortlichen Gene auf dem X-Chromosom eines Mannes defekt sind, gibt es kein Äquivalent auf dem Y-Chromosom, um dies auszugleichen, so dass das defekte Gen nicht maskiert wird und sich die Störung entwickelt. ⓘ
Da ein Mann sein einziges X-Chromosom von seiner Mutter erhält, hat der Sohn einer gesunden Frau, die das defekte Gen stillschweigend trägt, eine 50-prozentige Chance, dieses Gen und damit die Krankheit von ihr zu erben, und wenn seine Mutter an Hämophilie erkrankt ist, hat er eine 100-prozentige Chance, Bluter zu werden. Im Gegensatz dazu muss eine Frau, um die Krankheit zu erben, zwei defekte X-Chromosomen erhalten, eines von ihrer Mutter und das andere von ihrem Vater (der daher selbst Hämophilie haben muss). Daher ist die Hämophilie bei Männern weitaus häufiger anzutreffen als bei Frauen, während Frauen, die zwei defekte X-Chromosomen haben müssen, um Hämophilie zu erleiden, weitaus wahrscheinlicher stille Träger sind, die Kindheit überleben und jedes ihrer genetischen Kinder einem Risiko von mindestens 50 % aussetzen, das defekte Gen zu erhalten. Es ist jedoch möglich, dass weibliche Träger aufgrund einer Lyonisierung (Inaktivierung) der X-Chromosomen zu milden Hämophiliepatienten werden. Hämophile Töchter sind heute häufiger als früher, da dank der verbesserten Behandlung der Krankheit mehr hämophile Männer das Erwachsenenalter erreichen und Eltern werden können. Bei erwachsenen Frauen kann es aufgrund der Blutungsneigung zu Menorrhagie (starken Regelblutungen) kommen. Das Vererbungsmuster ist kreuz und quer. Dieses Muster findet sich auch bei der Farbenblindheit. ⓘ
Eine Mutter, die Trägerin ist, hat eine 50-prozentige Chance, das fehlerhafte X-Chromosom an ihre Tochter weiterzugeben, während ein betroffener Vater das betroffene Gen immer an seine Töchter weitergeben wird. Ein Sohn kann das defekte Gen nicht von seinem Vater erben. Es handelt sich um eine rezessive Veranlagung, die in schwereren Fällen an Träger weitergegeben werden kann. Genetische Tests und genetische Beratung werden für Familien mit Hämophilie empfohlen. Pränatale Tests, wie z. B. die Fruchtwasseruntersuchung, stehen schwangeren Frauen zur Verfügung, die möglicherweise Träger der Krankheit sind. ⓘ
Wie bei allen genetischen Störungen ist es auch bei der Hämophilie möglich, dass ein Mensch die Krankheit nicht erbt, sondern spontan durch eine neue Mutation in den Keimzellen eines Elternteils erwirbt. Spontanmutationen machen etwa 33 % aller Fälle von Hämophilie A aus. Etwa 30 % der Fälle von Hämophilie B sind das Ergebnis einer spontanen Genmutation. ⓘ
Wenn eine Frau einen hämophilen Sohn zur Welt bringt, ist entweder die Frau Trägerin der Blutkrankheit oder die Hämophilie ist auf eine spontane Mutation zurückzuführen. Bis zu den modernen direkten DNA-Tests war es jedoch unmöglich festzustellen, ob eine Frau, die nur gesunde Kinder zur Welt bringt, Trägerin ist oder nicht. ⓘ
Wenn ein Mann die Krankheit hat und Kinder mit einer Frau bekommt, die keine Trägerin ist, werden seine Töchter Trägerinnen der Hämophilie sein. Seine Söhne hingegen werden nicht von der Krankheit betroffen sein. Die Krankheit ist X-chromosomal gebunden, und der Vater kann die Hämophilie nicht über das Y-Chromosom vererben. Die Wahrscheinlichkeit, dass Männer mit der Krankheit das Gen an ihre Kinder weitergeben, ist daher nicht größer als bei weiblichen Trägern, obwohl alle Töchter, die sie zeugen, Träger sind und alle Söhne, die sie zeugen, keine Hämophilie haben (es sei denn, die Mutter ist Trägerin). ⓘ
Schweregrad
Es gibt zahlreiche verschiedene Mutationen, die jede Art von Hämophilie verursachen. Aufgrund der unterschiedlichen Veränderungen in den beteiligten Genen haben Menschen mit Hämophilie oft einen gewissen Grad an aktivem Gerinnungsfaktor. Menschen mit weniger als 1 % aktivem Faktor werden als schwere Hämophilie eingestuft, Menschen mit 1-5 % aktivem Faktor haben eine mittelschwere Hämophilie und Menschen mit leichter Hämophilie haben zwischen 5 % und 40 % der normalen Werte des aktiven Gerinnungsfaktors. ⓘ
Diagnose
Hämophilie kann vor, während oder nach der Geburt diagnostiziert werden, wenn es in der Familie eine Vorgeschichte für diese Krankheit gibt. Den Eltern stehen mehrere Möglichkeiten zur Verfügung. Gibt es keine familiäre Vorgeschichte der Hämophilie, wird sie in der Regel erst diagnostiziert, wenn das Kind zu laufen oder zu krabbeln beginnt. Es kann zu Gelenkblutungen oder leichten Blutergüssen kommen. ⓘ
Eine leichte Hämophilie kann erst später entdeckt werden, meist nach einer Verletzung oder einem zahnärztlichen oder chirurgischen Eingriff. ⓘ
Vor der Schwangerschaft
Es gibt genetische Tests und Beratung, um das Risiko der Vererbung der Krankheit an ein Kind zu ermitteln. Dabei kann eine Gewebe- oder Blutprobe untersucht werden, um nach Anzeichen für die Genmutation zu suchen, die die Hämophilie verursacht. ⓘ
Während der Schwangerschaft
Eine schwangere Frau, in deren Familie Hämophilie vorkommt, kann auf das Hämophilie-Gen getestet werden. Solche Tests umfassen:
- Chorionzottenbiopsie (CVS): eine kleine Probe der Plazenta wird aus der Gebärmutter entnommen und auf das Hämophilie-Gen untersucht, in der Regel in den Wochen 11-14 der Schwangerschaft
- Amniozentese: Entnahme einer Fruchtwasserprobe zur Untersuchung, in der Regel in den Wochen 15-20 der Schwangerschaft ⓘ
Bei diesen Verfahren besteht ein geringes Risiko, dass es zu Problemen wie Fehlgeburten oder vorzeitigen Wehen kommt; die Frau kann dies mit dem behandelnden Arzt besprechen. ⓘ
Nach der Geburt
Besteht der Verdacht auf Hämophilie nach der Geburt eines Kindes, kann die Diagnose in der Regel durch eine Blutuntersuchung bestätigt werden. Blut aus der Nabelschnur kann bei der Geburt untersucht werden, wenn es eine familiäre Vorbelastung mit Hämophilie gibt. Durch einen Bluttest kann auch festgestellt werden, ob ein Kind an Hämophilie A oder B leidet und wie schwer die Erkrankung ist. ⓘ
Einteilung
Es gibt im engeren Sinne zwei bekannte Formen der Hämophilie sowie weitere Krankheitsbilder, die gelegentlich unscharf unter diesem Begriff subsumiert werden:
- Hämophilie A (X-chromosomal-rezessiv erblicher Gerinnungsdefekt): Hiervon sind nahezu ausnahmslos Männer betroffen, da diese nur ein X-Geschlechtschromosom besitzen, während Frauen davon zwei besitzen. Hier kommt es zu einem Mangel an Faktor VIII (antihämophiles Globulin). ⓘ
- Hämophilie B (X-chromosomal-rezessive Vererbung): Mangel an Faktor IX (Christmas-Faktor) der Gerinnungskaskade mit verschiedenen Verläufen von Geburt an (schwer, mittelschwer, leicht). Durch diesen Mangel kann die Blutgerinnung nur sehr langsam verlaufen. ⓘ
- Der sehr seltene autosomal-rezessiv erbliche Gerinnungsdefekt (z. B. Stuart-Prower-Faktor-Mangel, Faktor X der Gerinnungskaskade) kann sich bei beiden Geschlechtern gleich stark ausprägen, da bei beiden Geschlechtern gleich viele Autosomen (nicht-geschlechtsgebundene Chromosomen) vorkommen. ⓘ
- Parahämophilie (Hypoproakzelerinämie, Owren-Syndrom): autosomal-rezessiv erbliche Krankheit durch Mangel des Gerinnungsfaktors V (Proaccelerin). ⓘ
- Angiohämophilie (Willebrand-Jürgens-Syndrom): Es ist die häufigste autosomal-dominant vererbte Gerinnungsstörung. Sie entsteht durch einen Strukturdefekt oder einen Mangel des Von-Willebrand-Faktors unterschiedlicher Ausprägung. Der Von-Willebrand-Faktor ist ein Trägerprotein des Blutgerinnungsfaktors VIII. ⓘ
- Hämophilie C (Rosenthal-Syndrom): Hier fehlt Faktor XI (PTA) der Gerinnungskaskade, so dass vor allem bei Kindern leicht Blutungen in Gelenken oder bei minimalen Verletzungen auftreten. Wie bei Hämophilie A und B ist der Quickwert typischerweise normal, während die PTT abhängig von der Ausprägung des Mangels verlängert ist. ⓘ
Es gibt verschiedene Arten von Hämophilie: Hämophilie A, Hämophilie B, Hämophilie C, Parahämophilie, erworbene Hämophilie A und erworbene Hämophilie B. ⓘ
Die als Parahämophilie bezeichnete Form der Hämophilie ist eine milde und seltene Form und beruht auf einem Mangel an Faktor V. Diese Form kann vererbt oder erworben werden. ⓘ
Eine nicht genetisch bedingte Form der Hämophilie wird durch Autoantikörper gegen den Faktor VIII verursacht und ist daher als erworbene Hämophilie A bekannt. Es handelt sich um eine seltene, aber potenziell lebensbedrohliche Blutungsstörung, die durch die Entwicklung von Autoantikörpern (Inhibitoren) gegen die Plasmagerinnungsfaktoren verursacht wird. Erworbene Hämophilie kann im Zusammenhang mit Krebserkrankungen, Autoimmunerkrankungen und nach einer Geburt auftreten. ⓘ
Behandlung
Es gibt keine langfristige Heilung. Die Behandlung und Vorbeugung von Blutungsepisoden erfolgt in erster Linie durch den Ersatz der fehlenden Blutgerinnungsfaktoren. ⓘ
Gerinnungsfaktoren
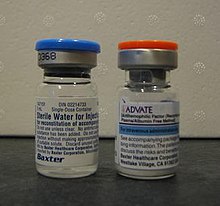
Bei leichter Hämophilie sind Gerinnungsfaktoren in der Regel nicht erforderlich. Bei mittelschwerer Hämophilie werden Gerinnungsfaktoren in der Regel nur benötigt, wenn Blutungen auftreten oder um Blutungen bei bestimmten Ereignissen zu verhindern. Bei schwerer Hämophilie wird die präventive Anwendung oft zwei- oder dreimal pro Woche empfohlen und kann lebenslang fortgesetzt werden. Eine rasche Behandlung von Blutungsepisoden verringert die Schädigung des Körpers. ⓘ
Faktor VIII wird bei Hämophilie A und Faktor IX bei Hämophilie B eingesetzt. Der Ersatzfaktor kann entweder aus menschlichem Blutserum isoliert, rekombinant oder eine Kombination aus beidem sein. Manche Menschen entwickeln Antikörper (Inhibitoren) gegen die ihnen verabreichten Ersatzfaktoren, so dass die Menge des Faktors erhöht werden muss oder nichtmenschliche Ersatzprodukte wie Faktor VIII vom Schwein verabreicht werden müssen. ⓘ
Wenn eine Person aufgrund hoher Konzentrationen zirkulierender Inhibitoren refraktär gegenüber dem Ersatzgerinnungsfaktor wird, kann dies teilweise mit rekombinantem humanem Faktor VIII überwunden werden. ⓘ
Anfang 2008 hat die US-amerikanische Arzneimittelbehörde FDA (Food and Drug Administration) ein Medikament gegen Hämophilie zugelassen, das völlig frei von Albumin ist und damit das erste Medikament gegen Hämophilie in den USA ist, das ein vollständig synthetisches Reinigungsverfahren verwendet. Seit 1993 sind rekombinante Faktorprodukte (die in der Regel in Gewebekulturzellen des chinesischen Hamster-Eies (CHO) gezüchtet werden und nur wenig oder gar keine menschlichen Plasmaprodukte enthalten) erhältlich und werden in den wohlhabenderen westlichen Ländern in großem Umfang verwendet. Rekombinante Gerinnungsfaktorprodukte bieten zwar eine höhere Reinheit und Sicherheit, sind aber wie Konzentrate extrem teuer und in den Entwicklungsländern im Allgemeinen nicht erhältlich. In vielen Fällen sind Gerinnungsfaktorprodukte jeglicher Art in Entwicklungsländern nur schwer zu bekommen. ⓘ
Gerinnungsfaktoren werden entweder präventiv oder bei Bedarf verabreicht. Bei der präventiven Anwendung wird der Gerinnungsfaktor regelmäßig infundiert, um die Gerinnungswerte ausreichend hoch zu halten und spontane Blutungen zu verhindern. Bei der On-Demand-Behandlung (oder episodischen Behandlung) werden Blutungsepisoden behandelt, sobald sie auftreten. Im Jahr 2007 wurde in einer Studie die On-Demand-Behandlung von Jungen (< 30 Monate) mit Hämophilie A mit einer prophylaktischen Behandlung (Infusionen von 25 IE/kg Körpergewicht Faktor VIII jeden zweiten Tag) hinsichtlich ihrer Wirkung auf die Prävention von Gelenkerkrankungen verglichen. Als die Jungen 6 Jahre alt waren, wiesen 93 % der Jungen in der Prophylaxe-Gruppe und 55 % der Jungen in der Episoden-Therapie-Gruppe eine normale Index-Gelenkstruktur im MRT auf. Die präventive Behandlung führte jedoch zu durchschnittlichen Kosten von 300.000 $ pro Jahr. Der Autor eines Leitartikels, der in der gleichen Ausgabe des NEJM veröffentlicht wurde, unterstützt die Idee, dass eine prophylaktische Behandlung nicht nur wirksamer ist als eine Behandlung nach Bedarf, sondern auch, dass ein Beginn nach der ersten schweren gelenkbedingten Blutung kosteneffizienter sein könnte als das Warten bis zum Erreichen eines bestimmten Alters. Die meisten Hämophilen in Ländern der Dritten Welt haben nur begrenzten oder gar keinen Zugang zu kommerziellen Blutgerinnungsfaktorprodukten. ⓘ
Japanischen Forschern ist es gelungen, einen sogenannten bispezifischen, monoklonalen Antikörper zu entwickeln, der die Rolle von Faktor VIII übernimmt. Zusätzlich wird er nicht durch gegen Faktor VIII gerichtete Antikörper (Hemmkörper, s. o. „Komplikation“) inaktiviert. Im November 2017 wurde Emicizumab seitens der US-amerikanischen Zulassungsbehörde FDA zugelassen. Die Zulassung für die EU erfolgte im Februar 2018. Emicizumab hat sich auch bei Patienten ohne inhibitorische Antikörper bewährt. Im März 2019 erfolgte eine EU Zulassungserweiterung für Patienten mit schwerer Hämophilie A ohne Hemmkörper für alle Altersstufen. ⓘ
Gegenüber der Substitution mit Faktor VIII hat der Antikörper den Vorteil, dass er nur subkutan entweder 1× pro Woche oder alle 2 bzw. 4 Wochen gespritzt werden muss und nicht intravenös zwei- bis dreimal wöchentlich. Nach über 3 Jahren sind über 80 % der Patienten ohne behandelte Blutungen, fast 92 % ohne behandelte Spontanblutung und 90 % ohne behandelte Gelenkblutung bzw. über 94 % ohne behandelte Zielgelenkblutung. Insgesamt fielen über 95 % der früheren Zielgelenke unter Therapie nicht mehr in die Zielgelenks-Definition, da in diesen Gelenken nach über 52 Wochen zwei oder weniger Blutungen (traumatisch oder spontan) aufgetreten waren. ⓘ
Andere
Desmopressin (DDAVP) kann bei Patienten mit leichter Hämophilie A eingesetzt werden. Tranexamsäure oder Epsilon-Aminocapronsäure können zusammen mit Gerinnungsfaktoren verabreicht werden, um den Abbau von Blutgerinnseln zu verhindern. ⓘ
Schmerzmittel, Steroide und Physiotherapie können eingesetzt werden, um Schmerzen und Schwellungen in einem betroffenen Gelenk zu lindern. Bei Patienten mit schwerer Hämophilie A, die bereits FVIII erhalten, kann Emicizumab einen gewissen Nutzen bringen. Bei Personen mit einer erworbenen Form der Hämophilie werden zusätzlich zu den normalen Gerinnungsfaktoren verschiedene Behandlungen eingesetzt. Die wirksamste Behandlung sind häufig Kortikosteroide, die bei der Hälfte der Betroffenen die Autoantikörper beseitigen. Als sekundärer Behandlungsweg werden Cyclophosphamid und Cyclosporin eingesetzt, die sich bei denjenigen als wirksam erwiesen haben, die auf die Steroidbehandlung nicht ansprachen. In seltenen Fällen wird ein dritter Weg oder eine dritte Behandlung angewandt, nämlich hohe Dosen intravenöser Immunglobuline oder Immunsorbentien, die zur Kontrolle der Blutung beitragen, anstatt die Autoantikörper zu bekämpfen. ⓘ
Kontraindikationen
Antikoagulanzien wie Heparin und Warfarin sind für Menschen mit Hämophilie kontraindiziert, da sie die Gerinnungsstörungen verschlimmern können. Ebenfalls kontraindiziert sind Medikamente, die "blutverdünnende" Nebenwirkungen haben. So sollten z. B. Medikamente, die Aspirin, Ibuprofen oder Naproxen-Natrium enthalten, nicht eingenommen werden, da sie bekanntermaßen die Nebenwirkung einer verlängerten Blutungszeit haben. ⓘ
Ebenfalls kontraindiziert sind Aktivitäten mit hoher Verletzungswahrscheinlichkeit wie Motorradfahren und Skateboardfahren. Beliebte Sportarten wie American Football, Hockey, Boxen, Ringen und Rugby, bei denen es häufig zu Körperkontakt und Verletzungen kommt, sollten von Menschen mit Hämophilie gemieden werden. Andere aktive Sportarten wie Fußball, Baseball und Basketball weisen ebenfalls eine hohe Verletzungsrate auf, haben aber insgesamt weniger Körperkontakt und sollten mit Vorsicht und nur in Absprache mit einem Arzt betrieben werden. ⓘ
Prognose
Wie bei den meisten Aspekten der Erkrankung hängt die Lebenserwartung vom Schweregrad und einer angemessenen Behandlung ab. Menschen mit schwerer Hämophilie, die keine angemessene, moderne Behandlung erhalten, haben eine stark verkürzte Lebenserwartung und erreichen oft nicht die Volljährigkeit. Vor den 1960er Jahren, als eine wirksame Behandlung verfügbar wurde, lag die durchschnittliche Lebenserwartung bei nur 11 Jahren. In den 1980er Jahren lag die durchschnittliche Lebenserwartung eines Hämophilen, der eine angemessene Behandlung erhielt, bei 50-60 Jahren. Heute haben Männer mit Hämophilie bei angemessener Behandlung in der Regel eine nahezu normale Lebensqualität, wobei die durchschnittliche Lebenserwartung etwa 10 Jahre unter der eines nicht betroffenen Mannes liegt. ⓘ
Seit den 1980er Jahren hat sich die Haupttodesursache bei Menschen mit schwerer Hämophilie von Blutungen auf HIV/AIDS verlagert, das durch die Behandlung mit kontaminierten Blutprodukten erworben wurde. Die zweithäufigste Todesursache im Zusammenhang mit schweren Hämophiliekomplikationen ist die intrakranielle Blutung, die heute ein Drittel aller Todesfälle bei Menschen mit Hämophilie ausmacht. Zwei weitere wichtige Todesursachen sind Hepatitis-Infektionen, die zu einer Zirrhose führen, und die Behinderung der Luftzufuhr oder des Blutflusses aufgrund von Weichteilblutungen. ⓘ
Epidemiologie
Hämophilie ist selten, mit nur etwa 1 Fall pro 10.000 Geburten (oder 1 von 5.000 männlichen Geburten) für Hämophilie A und 1 von 50.000 Geburten für Hämophilie B. Etwa 18.000 Menschen in den Vereinigten Staaten haben Hämophilie. Jedes Jahr werden in den USA etwa 400 Babys mit dieser Krankheit geboren. Hämophilie tritt in der Regel bei Männern und seltener bei Frauen auf. Schätzungsweise 2 500 Kanadier haben Hämophilie A, und etwa 500 Kanadier haben Hämophilie B. ⓘ
Geschichte
"Vor etwa siebzig oder achtzig Jahren ließ sich eine Frau namens Smith in der Nähe von Plymouth, New Hampshire, nieder und vererbte ihren Nachkommen die folgende Eigenart. Es handelt sich um eine Eigenart, von der ihre Familie leider betroffen ist und die nicht nur Anlass zu großer Sorge, sondern häufig auch die Ursache des Todes war. Wenn man einigen von ihnen den kleinsten Kratzer auf der Haut zufügt, kommt es schließlich zu einer ebenso tödlichen Blutung wie bei der größten Wunde. (...) Die Mitglieder dieser Familie sind sich der schrecklichen Folgen der kleinsten Wunde so sicher, dass sie es nicht dulden, aus irgendeinem Grund ausgeblutet zu werden, da sie einen Verwandten verloren haben, weil sie nicht in der Lage waren, den durch diesen Vorgang verursachten Ausfluss zu stoppen."
John C. Otto, 1803 ⓘ
Wissenschaftliche Entdeckung
Das übermäßige Bluten war schon den alten Menschen bekannt. Der Talmud schreibt vor, dass ein Junge nicht beschnitten werden darf, wenn er zwei Brüder hatte, die an Komplikationen infolge ihrer Beschneidung gestorben sind, und Maimonides sagt, dass dies väterliche Halbbrüder ausschloss. Dies könnte auf die Besorgnis über die Hämophilie zurückzuführen sein. Der erste Mediziner, der diese Krankheit beschrieb, war der arabische Chirurg Al-Zahrawi, auch bekannt als Abulcasis. Im zehnten Jahrhundert beschrieb er Familien, in denen die männlichen Kinder schon nach kleinen Verletzungen an Blutungen starben. Zwar finden sich in den historischen Schriften viele weitere beschreibende und praktische Hinweise auf die Krankheit, doch die wissenschaftliche Analyse begann erst zu Beginn des neunzehnten Jahrhunderts. ⓘ
Im Jahr 1803 schrieb John Conrad Otto, ein Arzt aus Philadelphia, einen Bericht über "eine in bestimmten Familien vorkommende hämorrhagische Veranlagung", in dem er die betroffenen Männer als "Bluter" bezeichnete. Er erkannte, dass es sich um eine Erbkrankheit handelte, die hauptsächlich Männer betraf und von gesunden Frauen vererbt wurde. Seine Arbeit war die zweite, in der wichtige Merkmale einer X-chromosomalen Erbkrankheit beschrieben wurden (die erste Arbeit war eine Beschreibung der Farbenblindheit von John Dalton, der seine eigene Familie untersuchte). Otto konnte die Krankheit bis zu einer Frau zurückverfolgen, die sich 1720 in der Nähe von Plymouth, New Hampshire, niederließ. Die Idee, dass betroffene Männer das Merkmal an ihre nicht betroffenen Töchter weitergeben könnten, wurde erst 1813 von John F. Hay in der Zeitschrift The New England Journal of Medicine beschrieben. ⓘ
Im Jahr 1924 entdeckte ein finnischer Arzt eine erbliche Bluterkrankheit, die der Hämophilie ähnelt und auf Åland, südwestlich von Finnland, vorkommt. Diese Blutungsstörung wird als "Von-Willebrand-Krankheit" bezeichnet. ⓘ
Der Begriff "Hämophilie" leitet sich von dem Begriff "Hämorrhaphilie" ab, den Friedrich Hopff 1828 als Student an der Universität Zürich in einer Beschreibung der Krankheit verwendete. 1937 entdeckten die beiden Harvard-Ärzte Patek und Taylor das Antihämophilieglobulin. 1947 stellte Pavlosky, ein Arzt aus Buenos Aires, durch einen Labortest fest, dass es sich bei Hämophilie A und Hämophilie B um unterschiedliche Krankheiten handelt. Bei diesem Test wurde das Blut eines Hämophilen auf einen anderen Hämophilen übertragen. Die Tatsache, dass dadurch das Gerinnungsproblem behoben wurde, zeigte, dass es mehr als eine Form der Hämophilie gibt. ⓘ
Europäische Königshäuser

Die Hämophilie ist in den europäischen Königshäusern weit verbreitet und wird daher manchmal auch als "königliche Krankheit" bezeichnet. Königin Victoria vererbte die Mutation für Hämophilie B an ihren Sohn Leopold und über zwei ihrer Töchter, Alice und Beatrice, an verschiedene königliche Familien auf dem ganzen Kontinent, darunter die Königshäuser von Spanien, Deutschland und Russland. In Russland war Zarewitsch Alexej, der Sohn und Erbe von Zar Nikolaus II., berühmt für seine Hämophilie, die er von seiner Mutter, Kaiserin Alexandra, einer Enkelin von Königin Victoria, geerbt hatte. Die Hämophilie von Alexej führte dazu, dass der russische Mystiker Grigori Rasputin am kaiserlichen Hof zu großer Berühmtheit gelangte. ⓘ
Es wurde behauptet, dass Rasputin die Hämophilie von Zarewitsch Alexej erfolgreich behandeln konnte. Die damals übliche Behandlung durch professionelle Ärzte bestand in der Einnahme von Aspirin, das das Problem eher verschlimmerte als linderte. Es wird angenommen, dass Rasputin den Zustand von Zarewitsch Alexej sichtbar und deutlich verbessern konnte, indem er einfach von der medizinischen Behandlung abriet. ⓘ
In Spanien hatte die jüngste Tochter von Königin Victoria, Prinzessin Beatrice, eine Tochter, Victoria Eugenie von Battenberg, die später Königin von Spanien wurde. Zwei ihrer Söhne waren hämophil und starben beide bei leichten Autounfällen. Ihr ältester Sohn, Prinz Alfonso von Spanien, Prinz von Asturien, starb im Alter von 31 Jahren an inneren Blutungen, nachdem sein Auto eine Telefonzelle gerammt hatte. Ihr jüngster Sohn, Infante Gonzalo, starb im Alter von 19 Jahren an inneren Blutungen nach einem kleinen Autounfall, bei dem er und seine Schwester beim Ausweichen vor einem Radfahrer gegen eine Mauer prallten. Keiner der beiden schien verletzt oder suchte sofort ärztliche Hilfe, und Gonzalo starb zwei Tage später an inneren Blutungen. ⓘ
Behandlung
Die Methode zur Herstellung eines Antihämophilie-Faktors wurde 1964 von Judith Graham Pool von der Stanford University entdeckt und 1971 in den USA unter dem Namen Cryopräzipitated AHF zur kommerziellen Verwendung zugelassen. Zusammen mit der Entwicklung eines Systems für den Transport und die Lagerung von menschlichem Plasma im Jahr 1965 war dies das erste Mal, dass eine effiziente Behandlung der Hämophilie zur Verfügung stand. ⓘ
Kontamination des Blutes

Bis Ende 1985 erhielten viele Menschen mit Hämophilie Gerinnungsfaktorprodukte, die ein Risiko für eine HIV- und Hepatitis-C-Infektion darstellten. Das für die Herstellung der Produkte verwendete Plasma wurde weder untersucht noch getestet, noch wurden die meisten Produkte in irgendeiner Form einer Virusinaktivierung unterzogen. ⓘ
Weltweit wurden Zehntausende durch verunreinigte Faktorprodukte infiziert, darunter mehr als 10.000 Menschen in den Vereinigten Staaten, 3.500 Briten, 1.400 Japaner, 700 Kanadier, 250 Iren und 115 Iraker. ⓘ
Die Ansteckung durch die verunreinigten Faktorprodukte war bis 1986 weitgehend zum Stillstand gekommen. Zu diesem Zeitpunkt waren die Methoden zur Inaktivierung des Virus weitgehend eingeführt worden, obwohl sich einige Produkte 1987 noch als gefährlich erwiesen. ⓘ
Forschung
Gentherapie
Bereits seit Jahrzehnten wird daran geforscht, Gentherapien zu entwickeln, die eine lebenslange Hämophilietherapie durch eine einzige Behandlung ersetzen könnte. Im Dezember 2017 wurde eine erfolgversprechende Phase-I/II-Studie im New England Journal of Medicine (NEJM) publiziert, in der sich erstmals eine Gentherapie der Hämophilie B über einen längeren Zeitraum als wirksam erwies. Im Januar 2020 wurde im NEJM eine Studie zur Gentherapie bei 15 Erwachsenen mit schwerer Hämophilie A veröffentlicht. In der Zusammenfassung heißt es: Die Behandlung mit AAV5-hFVIII-SQ führte zu einem nachhaltigen, klinisch relevanten Nutzen, gemessen an einer deutlichen Reduktion der jährlichen Blutungsraten und dem vollständigen Verzicht auf den prophylaktischen Faktor VIII bei allen Teilnehmern. ⓘ
Gelenkblutungen und ihre Folgen
Eine häufige Lokalisation für Blutungen sind die Gelenke (Hämarthros). Die erste Blutung in einem Gelenk (auch als Initialblutung bezeichnet) wird häufig durch einen Unfall/Trauma verursacht. Besonders betroffen sind die großen Gelenke. Durch die Gelenkinnenhaut (Membrana synovialis) werden Enzyme freigesetzt, die das im Gelenk befindliche Blut abbauen. Bei großvolumigen Ergüssen vergrößert sich die Synovia („Gelenkschmiere“) dafür und wird stärker mit Blutgefäßen durchzogen. Daraus folgt eine höhere Wahrscheinlichkeit nachfolgender Blutungen oder Entzündungen. Ein Kreislauf von Entzündungen und Blutungen wird in Gang gesetzt und es entsteht eine so genannte Hämarthrose; insbesondere ungeführte Bewegungen sowie Torsionen und Überstreckungen (auch in der Nacht), „umknicken“, stolpern etc. können weitere Gelenkblutungen (meist Sprunggelenk-, Knie-, Ellenbogen-, Schulter- oder selten Hüftblutungen) zur Folge haben, was meistens mit starken Schmerzen verbunden ist. Da wirksame prophylaktische Therapien erst seit etwa 30 Jahren verfügbar sind, haben die häufigen Blutungsereignisse bei älteren Patienten meist Gelenkversteifungen z. T. schwerster Art, frühzeitige Arthrose – die evtl. operative Eingriffe (wie z. B. Knie-Arthroskopie, Synovektomie bis hin zur Endoprothese (Gelenkersatz)), aber auch orthopädische Hilfsmittel (orthopädische Schuhe), Gehhilfen u. a. erforderlich machen – sowie Fehlbildungen der Muskulatur und des Knochenaufbaus zur Folge. Durch ständige Physiotherapie kann jedoch die Mobilität der Gelenke auf einem gewissen Belastungsgrad gehalten bzw. verbessert werden. ⓘ
Knochenblutungen und Pseudotumor
Selten kann es durch wiederholte Einblutungen in den Knochen zu einer zunehmenden Osteolyse kommen, mit Auftreibung und Verbreiterung des Knochens und seifenblasenartigem Aussehen im Röntgenbild, wodurch der Verdacht auf einen Knochentumor entstehen kann und weshalb vom „hämophilen Pseudotumor“ gesprochen wird. Durch den Stabilitätsverlust kommt es zu pathologischen Knochenbrüchen und Sinterungen, die erneute Blutungen induzieren und auch zu einer Verkürzung besonders an den unteren Extremitäten beitragen können. Zur Therapie ist nur ein kompletter allogener Knochenersatz mit eventuellem Gelenkersatz (Endoprothese) benachbarter Gelenke möglich. ⓘ