Anilin
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugte IUPAC-Bezeichnung
Anilin | |||
| Systematische IUPAC-Bezeichnung
Benzolamin | |||
| Andere Namen
Phenylamin
Aminobenzol Benzamin | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| 3DMet | |||
Beilstein-Referenz
|
605631 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
| EC-Nummer |
| ||
Gmelin Referenz
|
2796 | ||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII |
| ||
| UN-Nummer | 1547 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C6H7N | ||
| Molekulare Masse | 93,129 g-mol-1 | ||
| Erscheinungsbild | Farblose Flüssigkeit | ||
| Dichte | 1,0297 g/ml | ||
| Schmelzpunkt | -6,30 °C (20,66 °F; 266,85 K) | ||
| Siedepunkt | 184,13 °C (363,43 °F; 457,28 K) | ||
Löslichkeit in Wasser
|
3,6 g/100 mL bei 20 °C | ||
| Dampfdruck | 0,6 mmHg (20° C) | ||
| Acidität (pKa) |
| ||
Magnetische Suszeptibilität (χ)
|
-62,95-10-6 cm3/mol | ||
Brechungsindex (nD)
|
1.58364 | ||
| Viskosität | 3,71 cP (3,71 mPa-s bei 25 °C) | ||
| Thermochemie | |||
Standard-Verbrennungsenthalpie
Verbrennungsenthalpie (ΔcH⦵298) |
-3394 kJ/mol | ||
| Gefahren | |||
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |||
Hauptgefahren
|
potenziell krebserregend am Arbeitsplatz | ||
| GHS-Kennzeichnung: | |||
Piktogramme
|
    
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H301, H311, H317, H318, H331, H341, H351, H372, H400 | ||
Sicherheitshinweise
|
P201, P202, P260, P261, P264, P270, P271, P272, P273, P280, P281, P301+P310, P302+P352, P304+P340, P305+P351+P338, P308+P313, P310, P311, P312, P314, P321, P322, P330, P333+P313, P361, P363, P391, P403+P233, P405, P501 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | 70 °C (158 °F; 343 K) | ||
Selbstentzündung
temperatur |
770 °C (1.420 °F; 1.040 K) | ||
| Explosionsgrenzen | 1.3–11% | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LDLo (niedrigste veröffentlichte)
|
195 mg/kg (Hund, oral) 250 mg/kg (Ratte, oral) 464 mg/kg (Maus, oral) 440 mg/kg (Ratte, oral) 400 mg/kg (Meerschweinchen, oral) | ||
LC50 (mittlere Konzentration)
|
175 ppm (Maus, 7 h) | ||
LCLo (niedrigste veröffentlichte)
|
250 ppm (Ratte, 4 h) 180 ppm (Katze, 8 h) | ||
| NIOSH (US-Grenzwerte für die Gesundheit): | |||
PEL (Zulässig)
|
TWA 5 ppm (19 mg/m3) [Haut] | ||
REL (Empfohlen)
|
Ca [potenziell berufsbedingtes Karzinogen] | ||
IDLH (Unmittelbare Gefahr)
|
100 ppm | ||
| Verwandte Verbindungen | |||
Verwandte aromatische Amine
|
1-Naphthylamin 2-Naphthylamin | ||
Verwandte Verbindungen
|
Phenylhydrazin Nitrosobenzol Nitrobenzol | ||
Sofern nicht anders angegeben, beziehen sich die Daten auf Stoffe in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Anilin ist eine organische Verbindung mit der Formel C6H5NH2. Anilin besteht aus einer Phenylgruppe, die an eine Aminogruppe gebunden ist, und ist das einfachste aromatische Amin. Es ist ein industriell bedeutsamer chemischer Grundstoff und ein vielseitiges Ausgangsmaterial für die Feinchemikaliensynthese. Es wird hauptsächlich für die Herstellung von Vorprodukten für Polyurethan, Farbstoffe und andere Industriechemikalien verwendet. Wie die meisten flüchtigen Amine hat es den Geruch von verfaultem Fisch. Es entzündet sich leicht und brennt mit einer für aromatische Verbindungen charakteristischen rauchigen Flamme. Es ist für den Menschen giftig. ⓘ
Im Vergleich zu Benzol ist es reich an Elektronen. Es nimmt daher schneller an elektrophilen aromatischen Substitutionsreaktionen teil. Außerdem ist es anfällig für Oxidation: Während frisch gereinigtes Anilin ein fast farbloses Öl ist, färbt es sich an der Luft allmählich gelb oder rot, da sich stark gefärbte, oxidierte Verunreinigungen bilden. Anilin kann diazotiert werden, um ein Diazoniumsalz zu erhalten, das dann verschiedene nukleophile Substitutionsreaktionen eingehen kann. ⓘ
Der Begriff "Anilin" stammt aus dem Portugiesischen und bedeutet "Indigostrauch", wobei die Endung -ine auf "abgeleitete Substanz" hinweist. ⓘ
Wie andere Amine ist Anilin sowohl eine Base (pKaH = 4,6) als auch ein Nukleophil, wenn auch in geringerem Maße als die strukturell ähnlichen aliphatischen Amine. ⓘ
Da eine frühe Quelle des Benzols, von dem sie abgeleitet sind, Steinkohlenteer war, werden Anilinfarbstoffe auch Steinkohlenteerfarbstoffe genannt. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Anilin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H7N | ||||||||||||||||||
| Kurzbeschreibung |
ölige, farblose bis braune Flüssigkeit | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 93,13 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,02 g·cm−3 | ||||||||||||||||||
| Schmelzpunkt |
−6 °C | ||||||||||||||||||
| Siedepunkt |
184 °C | ||||||||||||||||||
| Dampfdruck |
0,681 hPa (20 °C) | ||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (36 g·l−1 bei 20 °C) | ||||||||||||||||||
| Brechungsindex |
1,5863 (20 °C) | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
| ||||||||||||||||||
| Toxikologische Daten |
| ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Anilin (nach spanisch oder auch arabisch: an-nil = blau = Indigo-Farbe) oder Benzenamin ist eine klare, farblose bis schwach gelbliche, ölige Flüssigkeit mit eigenartigem Geruch, die an der Luft schnell rötlich-braun wird. Es ist ein Benzolring mit einer Aminogruppe (–NH2) und damit ein aromatisches Amin. Mit Säuren versetzt bildet es Anilinsalze. Die basische Wirkung von Anilin wird durch den mesomeren Effekt abgeschwächt, da dieser die Elektronendichte der Aminogruppe verringert. ⓘ
Struktur

Aryl-N-Abstände
In Anilin beträgt die C-N-Bindungslänge 1,41 Å, verglichen mit 1,47 Å für Cyclohexylamin, was auf eine partielle π-Bindung zwischen N und C hinweist. Der C(Aryl)-NH2-Abstand in Anilinen ist sehr empfindlich gegenüber Substituenteneffekten. Dieser Abstand beträgt 1,34 Å in 2,4,6-Trinitroanilin gegenüber 1,44 Å in 3-Methylanilin. ⓘ
Pyramidalisierung
Das Amin in Anilinen ist ein leicht pyramidalisiertes Molekül, wobei die Hybridisierung des Stickstoffs zwischen sp3 und sp2 liegt. Der Stickstoff wird als ein Molekül mit hohem p-Charakter beschrieben. Die Aminogruppe in Anilin ist flacher (d. h. es handelt sich um eine "flachere Pyramide") als die in einem aliphatischen Amin, was auf die Konjugation des einsamen Paares mit dem Arylsubstituenten zurückzuführen ist. Die beobachtete Geometrie spiegelt einen Kompromiss zwischen zwei konkurrierenden Faktoren wider: 1) Die Stabilisierung des N-einsamen Paares in einem Orbital mit signifikantem s-Charakter begünstigt die Pyramidalisierung (Orbitale mit s-Charakter haben eine niedrigere Energie), während 2) die Delokalisierung des N-einsamen Paares in den Arylring die Planarität begünstigt (ein einsames Paar in einem reinen p-Orbital ergibt die beste Überlappung mit den Orbitalen des π-Systems des Benzolrings). ⓘ
In Übereinstimmung mit diesen Faktoren sind substituierte Aniline mit elektronenabgebenden Gruppen stärker pyramidalisiert, während solche mit elektronenabziehenden Gruppen eher planar sind. Im Ausgangsanilin hat das einsame Paar etwa 12 % s-Charakter, was einer sp7.3-Hybridisierung entspricht. (Zum Vergleich: Alkylamine haben im Allgemeinen einsame Paare in Orbitalen, die nahe an sp3 liegen). ⓘ
Der Pyramidalisierungswinkel zwischen der C-N-Bindung und der Winkelhalbierenden des H-N-H-Winkels beträgt 142,5°. Zum Vergleich: Beim stärker pyramidalisierten Methylamin liegt dieser Wert bei ~125°, während der Winkel bei Formamid 180° beträgt. ⓘ
Herstellung
Die industrielle Herstellung von Anilin erfolgt in zwei Schritten. Zunächst wird Benzol mit einer konzentrierten Mischung aus Salpetersäure und Schwefelsäure bei 50 bis 60 °C nitriert, wobei Nitrobenzol entsteht. Das Nitrobenzol wird dann in Gegenwart von Metallkatalysatoren hydriert (normalerweise bei 200-300 °C):
Die Reduktion von Nitrobenzol zu Anilin wurde erstmals 1842 von Nikolay Zinin durchgeführt, wobei anorganisches Sulfid als Reduktionsmittel verwendet wurde (Zinin-Reaktion). Die Reduktion von Nitrobenzol zu Anilin wurde auch von Antoine Béchamp im Jahr 1854 im Rahmen von Reduktionen durchgeführt, wobei Eisen als Reduktionsmittel verwendet wurde (Bechamp-Reduktion). ⓘ
Anilin kann alternativ auch aus Ammoniak und Phenol aus dem Cumolverfahren hergestellt werden. ⓘ
Im Handel werden drei Marken von Anilin unterschieden: Anilinöl für Blau, das reines Anilin ist; Anilinöl für Rot, ein Gemisch aus äquimolekularen Mengen von Anilin und ortho- und para-Toluidinen; und Anilinöl für Safranin, das Anilin und ortho-Toluidin enthält und aus dem Destillat (échappés) der Fuchsinfusion gewonnen wird. ⓘ
Großtechnisch wird Anilin durch Hydrierung von Nitrobenzol in der Gasphase bei 270 °C und 1,25 bar an einem Kupfer-Katalysator auf Siliciumdioxid hergestellt. Hierfür wird ein Wirbelschichtreaktor verwendet. ⓘ
Daneben ist die Hydrierung an einem Nickelsulfidkatalysator auf Aluminiumoxid im Festbettreaktor möglich. ⓘ
Anschließend wird mit Branntkalk (CaO) neutralisiert, und das Anilin zusammen mit dem Wasser abdestilliert. Das als Nebenprodukt entstehende Eisen(II,III)-oxid kann als Pigment eingesetzt werden. ⓘ
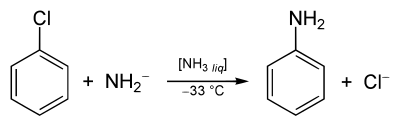
Es gibt noch andere Verfahren, zum Beispiel die Ammonolyse von Chlorbenzol oder Phenol:
Verwandte Anilin-Derivate
Es sind zahlreiche Analoga von Anilin bekannt, bei denen die Phenylgruppe weiter substituiert ist. Dazu gehören Toluidine, Xylidine, Chloraniline, Aminobenzoesäuren, Nitroaniline und viele andere. Sie werden häufig durch Nitrierung der substituierten aromatischen Verbindungen und anschließende Reduktion hergestellt. Auf diese Weise werden zum Beispiel Toluol in Toluidine und Chlorbenzol in 4-Chloranilin umgewandelt. Alternativ können Arylhalogenide über die Buchwald-Hartwig-Kupplung oder die Ullmann-Reaktion mit wässrigem oder gasförmigem Ammoniak aminiert werden. ⓘ
Reaktionen
Die Chemie des Anilins ist reichhaltig, da die Verbindung seit vielen Jahren billig erhältlich ist. Nachstehend sind einige Klassen von Reaktionen aufgeführt. ⓘ
Oxidation

Die Oxidation von Anilin wurde eingehend untersucht und kann zu Reaktionen führen, die sich auf den Stickstoff beschränken, oder, was häufiger der Fall ist, zur Bildung neuer C-N-Bindungen. In alkalischer Lösung entsteht Azobenzol, während Arsensäure den violettfarbenen Stoff Violanilin erzeugt. Chromsäure wandelt es in Chinon um, während Chlorate in Gegenwart bestimmter Metallsalze (insbesondere von Vanadium) Anilinschwarz ergeben. Salzsäure und Kaliumchlorat ergeben Chloranil. Kaliumpermanganat oxidiert es in neutraler Lösung zu Nitrobenzol, in alkalischer Lösung zu Azobenzol, Ammoniak und Oxalsäure, in saurer Lösung zu Anilinschwarz. Hypochlorige Säure ergibt 4-Aminophenol und para-Amino-Diphenylamin. Die Oxidation mit Persulfat führt zu einer Vielzahl von Polyanilinen. Diese Polymere weisen umfangreiche Redox- und Säure-Base-Eigenschaften auf. ⓘ

Elektrophile Reaktionen in ortho- und para-Stellung
Wie die Phenole sind auch die Anilinderivate sehr anfällig für elektrophile Substitutionsreaktionen. Seine hohe Reaktivität ist darauf zurückzuführen, dass es sich um ein Enamin handelt, was die Fähigkeit des Rings zur Elektronenabgabe erhöht. So entsteht beispielsweise bei der Reaktion von Anilin mit Schwefelsäure bei 180 °C Sulfanilsäure, H2NC6H4SO3H. ⓘ
Gibt man Bromwasser zu Anilin, so entfärbt sich das Bromwasser und es entsteht ein weißer Niederschlag von 2,4,6-Tribromanilin. Um das monosubstituierte Produkt zu erhalten, ist ein Schutz mit Acetylchlorid erforderlich:
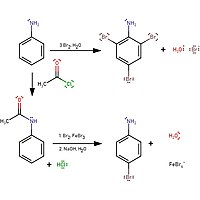
Die Reaktion zur Bildung von 4-Bromanilin besteht darin, das Amin mit Acetylchlorid zu schützen und dann durch Hydrolyse wieder zu Anilin zu machen. ⓘ
Die großtechnische Reaktion von Anilin ist die Alkylierung mit Formaldehyd. Eine idealisierte Gleichung ist dargestellt:
- 2 C6H5NH2 + CH2O → CH2(C6H4NH2)2 + H2O
Das entstehende Diamin ist der Vorläufer von 4,4'-MDI und verwandten Diisocyanaten. ⓘ
Reaktionen am Stickstoff
Basizität
Anilin ist eine schwache Base. Aromatische Amine wie Anilin sind im Allgemeinen viel schwächere Basen als aliphatische Amine. Anilin reagiert mit starken Säuren unter Bildung des Anilinium- (oder Phenylammonium-) Ions (C6H5-NH3+). ⓘ
Traditionell wird die schwache Basizität von Anilin auf eine Kombination aus induktiver Wirkung des elektronegativeren sp2-Kohlenstoffs und Resonanzeffekten zurückgeführt, da das einsame Paar am Stickstoff teilweise in das pi-System des Benzolrings delokalisiert ist. (siehe die Abbildung unten):

In einer solchen Analyse fehlt die Berücksichtigung der Solvatation. Anilin ist zum Beispiel in der Gasphase basischer als Ammoniak, in wässriger Lösung jedoch zehntausendmal weniger basisch. ⓘ
Acylierung
Anilin reagiert mit Acylchloriden wie Acetylchlorid unter Bildung von Amiden. Die aus Anilin gebildeten Amide werden manchmal als Anilide bezeichnet, z. B. CH3-CO-NH-C6H5 als Acetanilid. Bei hohen Temperaturen reagieren Anilin und Carbonsäuren unter Bildung von Aniliden. ⓘ
N-Alkylierung
Die N-Methylierung von Anilin mit Methanol bei hohen Temperaturen über sauren Katalysatoren ergibt N-Methylanilin und Dimethylanilin:
- C6H5NH2 + 2 CH3OH → C6H5N(CH3)2 + 2H2O
N-Methylanilin und Dimethylanilin sind farblose Flüssigkeiten mit Siedepunkten von 193-195 °C bzw. 192 °C. Diese Derivate sind in der Farbindustrie von Bedeutung. Anilin verbindet sich direkt mit Alkyljodiden zu sekundären und tertiären Aminen. ⓘ
Schwefelkohlenstoff-Derivate
Mit Schwefelkohlenstoff gekocht, ergibt es Sulfocarbanilid (Diphenylthioharnstoff) (CS(NHC6H5)2), das in Phenylisothiocyanat (C6H5CNS) und Triphenylguanidin (C6H5N=C(NHC6H5)2) zerlegt werden kann. ⓘ
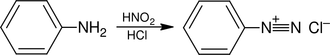
Diazotierung
Anilin und seine ring-substituierten Derivate reagieren mit salpetriger Säure unter Bildung von Diazoniumsalzen. Durch diese Zwischenprodukte kann die Amingruppe über Sandmeyer-Reaktionen in -OH, -CN oder ein Halogenid umgewandelt werden. Dieses Diazoniumsalz kann auch mit NaNO2 und Phenol umgesetzt werden, um einen Farbstoff zu erzeugen, der als Benzolazophenol bekannt ist, in einem Prozess, der als Kopplung bezeichnet wird. Die Reaktion, bei der ein primäres aromatisches Amin in ein Diazoniumsalz umgewandelt wird, nennt man Diazotierung. Bei dieser Reaktion reagiert primäres aromatisches Amin mit Natriumnitril und 2 Molen HCl, was als eiskalte Mischung bezeichnet wird, da die Temperatur 0,5 °C beträgt, und es entstehen Benzoldiazoniumsalz als Hauptprodukt sowie Wasser und Natriumchlorid. ⓘ
Andere Reaktionen
Es reagiert mit Nitrobenzol zur Bildung von Phenazin in der Wohl-Aue-Reaktion. Durch Hydrierung entsteht Cyclohexylamin. ⓘ
Als Standardreagenz in Labors wird Anilin für viele Nischenreaktionen verwendet. Sein Acetat wird im Anilin-Acetat-Test für Kohlenhydrate verwendet, wobei Pentosen durch Umwandlung in Furfural identifiziert werden. Es wird verwendet, um neurale RNA in der Nissl-Färbung blau zu färben. ⓘ
Verwendungen
Anilin wird vor allem zur Herstellung von Methylendianilin und verwandten Verbindungen durch Kondensation mit Formaldehyd verwendet. Die Diamine werden mit Phosgen zu Methylendiphenyldiisocyanat kondensiert, einem Vorprodukt für Urethanpolymere.
 Der größte Teil des Anilins wird bei der Herstellung von Methylendianilin verbraucht, einem Vorprodukt für Polyurethane. ⓘ
Der größte Teil des Anilins wird bei der Herstellung von Methylendianilin verbraucht, einem Vorprodukt für Polyurethane. ⓘ
Weitere Verwendungszwecke sind Chemikalien für die Gummiverarbeitung (9%), Herbizide (2%) sowie Farbstoffe und Pigmente (2%). Als Zusatzstoffe für Kautschuk sind Anilinderivate wie Phenylendiamine und Diphenylamin Antioxidantien. Ein Beispiel für ein aus Anilin hergestelltes Arzneimittel ist Paracetamol (Acetaminophen, Tylenol). Die Hauptverwendung von Anilin in der Farbstoffindustrie ist die Herstellung von Indigo, dem Blau der Blue Jeans. ⓘ

Geschichte
Anilin wurde erstmals 1826 von Otto Unverdorben durch destruktive Destillation von Indigo isoliert. Er nannte es Crystallin. 1834 isolierte Friedlieb Runge eine Substanz aus Steinkohlenteer, die bei der Behandlung mit Kalkchlorid eine schöne blaue Farbe annahm. Er nannte sie Kyanol oder Cyanol. 1840 behandelte Carl Julius Fritzsche (1808-1871) Indigo mit Kalilauge und gewann ein Öl, das er Anilin nannte, nach der Indigopflanze Anil (Indigofera suffruticosa), die Indigo liefert. 1842 reduzierte Nikolay Nikolaevich Zinin Nitrobenzol und gewann eine Base, die er Benzidam nannte. 1843 wies August Wilhelm von Hofmann nach, dass es sich um ein und dieselbe Substanz handelte, die fortan als Phenylamin oder Anilin bezeichnet wurde. ⓘ
Synthetische Farbstoffindustrie
1856 entdeckte von Hofmanns Schüler William Henry Perkin bei dem Versuch, Chinin zu synthetisieren, Mauvein und ging in die Industrie, um den ersten kommerziellen synthetischen Farbstoff herzustellen. Es folgten weitere Anilinfarbstoffe wie Fuchsin, Safranin und Indulin. Zum Zeitpunkt der Entdeckung des Malvenfarbstoffs war Anilin sehr teuer. Bald darauf konnte es nach einer 1854 von Antoine Béchamp beschriebenen Methode "tonnenweise" hergestellt werden. Die Béchamp-Reduktion ermöglichte die Entwicklung einer großen Farbstoffindustrie in Deutschland. Heute erinnert der Name der BASF, ursprünglich Badische Anilin- und Soda-Fabrik, heute der größte Chemielieferant, an das Erbe der synthetischen Farbstoffindustrie, die durch Anilinfarbstoffe aufgebaut und durch die verwandten Azofarbstoffe erweitert wurde. Der erste Azofarbstoff war Anilingelb. ⓘ
Entwicklungen in der Medizin
Im späten 19. Jahrhundert kamen Anilinderivate wie Acetanilid und Phenacetin als Schmerzmittel auf, deren herzunterdrückende Nebenwirkungen oft mit Koffein bekämpft wurden. Im ersten Jahrzehnt des 20. Jahrhunderts versuchte Paul Ehrlich, synthetische Farbstoffe für die Behandlung der afrikanischen Schlafkrankheit zu modifizieren, scheiterte jedoch an der Chemotherapie, die er für seinen "magic bullet"-Ansatz in der Medizin prägte, und ging dazu über, das Atoxyl von Béchamp, das erste organische Arsenpräparat, zu modifizieren, wobei er durch einen glücklichen Zufall ein Mittel gegen Syphilis - Salvarsan - erhielt, das erste erfolgreiche Chemotherapeutikum. Der Mikroorganismus, auf den Salvarsan abzielte, wurde noch nicht als Bakterium erkannt, sondern als Parasit angesehen, und die medizinischen Bakteriologen, die glaubten, dass Bakterien für eine Chemotherapie nicht empfänglich seien, übersahen Alexander Flemings Bericht von 1928 über die Wirkung von Penicillin. ⓘ
Im Jahr 1932 suchte Bayer nach medizinischen Anwendungen für seine Farbstoffe. Gerhard Domagk identifizierte einen roten Azofarbstoff als antibakteriell, der 1935 als erstes antibakterielles Medikament, Prontosil, eingeführt wurde. Im Pasteur-Institut stellte sich bald heraus, dass es sich dabei um ein Prodrug handelte, das in vivo zu Sulfanilamid abgebaut wurde - ein farbloses Zwischenprodukt für viele sehr farbechte Azofarbstoffe -, dessen Patent bereits abgelaufen war und das 1908 in Wien von dem Forscher Paul Gelmo für seine Doktorarbeit synthetisiert worden war. Bis in die 1940er Jahre wurden über 500 verwandte Sulfamittel hergestellt. Diese während des Zweiten Weltkriegs (1939-45) stark nachgefragten Medikamente, die erste Wunderdroge, die Chemotherapie mit breiter Wirksamkeit, trieben die amerikanische Pharmaindustrie an. Auf der Suche nach einer Alternative zu den Sulfamitteln entwickelte Howard Florey 1939 an der Universität Oxford das von Fleming entwickelte Penicillin zum ersten systemischen Antibiotikum, Penicillin G. (Das von René Dubos am Rockefeller Institute 1939 entwickelte Gramicidin war das erste Antibiotikum, das jedoch aufgrund seiner Toxizität nur äußerlich angewendet werden konnte). Nach dem Zweiten Weltkrieg führte Cornelius P. Rhoads den chemotherapeutischen Ansatz in der Krebsbehandlung ein. ⓘ
Raketentreibstoff
Einige frühe amerikanische Raketen, wie die Aerobee und die WAC Corporal, verwendeten eine Mischung aus Anilin und Furfurylalkohol als Treibstoff und Salpetersäure als Oxidationsmittel. Die Kombination ist hypergolisch und entzündet sich bei Kontakt zwischen Treibstoff und Oxidationsmittel. Außerdem ist es dicht und kann über längere Zeiträume gelagert werden. Anilin wurde später durch Hydrazin ersetzt. ⓘ
Toxikologie und Tests
Anilin ist giftig beim Einatmen der Dämpfe, beim Verschlucken oder bei perkutaner Absorption. Die IARC listet es aufgrund der begrenzten und widersprüchlichen Daten in Gruppe 3 (nicht klassifizierbar hinsichtlich seiner Karzinogenität für den Menschen). Die frühe Herstellung von Anilin führte zu einem erhöhten Auftreten von Blasenkrebs, aber diese Auswirkungen werden heute den Naphthylaminen und nicht den Anilinen zugeschrieben. ⓘ
Anilin wurde als eine mögliche Ursache für das Waldsterben genannt. ⓘ
Es gibt zahlreiche Methoden zum Nachweis von Anilin. ⓘ
Oxidative DNA-Schäden
Die Exposition von Ratten gegenüber Anilin kann eine für die Milz toxische Reaktion, einschließlich einer tumorigenen Reaktion, hervorrufen. Ratten, die Analin im Trinkwasser ausgesetzt waren, wiesen einen signifikanten Anstieg der oxidativen DNA-Schäden in der Milz auf, der sich in einem 2,8-fachen Anstieg von 8-Hydroxy-2'-desoxyguanosin (8-OHdG) in ihrer DNA zeigte. Obwohl der Basen-Exzisions-Reparaturweg ebenfalls aktiviert war, reichte seine Aktivität nicht aus, um die Anhäufung von 8-OHdG zu verhindern. Die Anhäufung von oxidativen DNA-Schäden in der Milz nach einer Anilin-Exposition könnte die mutagenen Vorgänge, die der Tumorentstehung zugrunde liegen, verstärken. ⓘ
Nomenklatur
Der systematische IUPAC-Name lautet Benzenamin. Die inzwischen bevorzugte IUPAC-Bezeichnung ist jedoch Anilin. Derivate des Anilins werden historisch unter der Benutzung der Silbe "Anil" bezeichnet; bspw. Anilazin, Acetanilid. ⓘ
Verwendung
Es dient in der chemischen Industrie in erster Linie als Ausgangsstoff für die Synthese von Farben und Kunstfasern, aber auch zur Herstellung von Synthesekautschuk und Medikamenten und als Komponente hypergoler Treibstoffe in der Raumfahrt. ⓘ
An der Aminogruppe
Anilin ist das einfachste aromatische Amin und nur wenig wasserlöslich. Um die Wasserlöslichkeit zu begünstigen bzw. diese zu erhöhen, wird Anilin mit einer Säure (beispielsweise Salzsäure) versetzt; dies führt zur sofortigen Salzbildung. Mit Salzsäure entsteht das Hydrochlorid Aniliniumchlorid:
Lässt man Anilin mit seinem Salz (beispielsweise Anilinhydrochlorid) in der Hitze reagieren, so entsteht das Diphenylamin:
Bei der Reaktion von Anilin mit Essigsäureanhydrid entsteht N-Phenylacetamid (Acetanilid):
Die Darstellung von Nitrobenzol aus Anilin ist ebenfalls möglich. Dabei wird das Anilin mit einem Oxidationsmittel (wie zum Beispiel Wasserstoffperoxid, mCPBA, Kaliumpermanganat, Chrom(VI)-oxid oder Blei(IV)-oxid) über die Zwischenstufe Nitrosobenzol zum Nitrobenzol umgesetzt.
Die Reaktion von Nitrosobenzol und Anilin führt durch Wasserabspaltung zum Azobenzol:
Eine direkte Nitrierung mit Nitriersäure führt zu Oxidationen der Aminogruppe. Die gewünschten Nitroaniline erhält man erst nach vorherigem Schützen der Aminogruppe als Acetanilid. ⓘ
Wenn man die nun erhaltenen Nitroaniline mithilfe eines Reduktionsmittels (wie zum Beispiel Zink in Salzsäure, Natriumborhydrid, Lithiumaluminiumhydrid oder Natriumsulfit) reduziert, erhält man die Phenylendiamine:
Ebenso ist auch die Reaktion mit dem Namen Diazotierung bekannt. Dabei reagiert das Anilin mit Natriumnitrit in Gegenwart von zum Beispiel Salzsäure oder mit Salpetriger Säure zum Benzoldiazoniumchlorid:
Das Benzoldiazoniumchlorid ist ein starkes, instabiles Elektrophil, das in der Farbstoffchemie eine große Anwendung findet. Das Benzoldiazoniumchlorid kann dabei zum Beispiel mit Wasser zu Phenol unter Stickstoffverlust reagieren. Ebenso ist eine Sandmeyer-Reaktion in Gegenwart von Kupfer(I)-chlorid und Salzsäure unter Wärmezufuhr möglich – dabei entsteht das Chlorbenzol ebenfalls unter Stickstoffverlust. Unter Beibehaltung der beiden Stickstoffatome lässt sich das Benzoldiazoniumion zum Beispiel mit Natriumsulfit in wässriger Lösung zum Phenylhydrazin reduzieren:
Lässt man das Benzoldiazoniumchlorid zum Beispiel mit einer alkalischen 2-Naphthol-Lösung () reagieren, so erhält man das sog. Sudan I. Diese Reaktion wird auch als Kupplungsreaktion, genauer als Azokupplung bezeichnet:
Abgesehen von den Naphtholen können auch andere Kupplungsreagenzien wie zum Beispiel 1-Naphthylamin eingesetzt werden. Aufgrund der Vielzahl an möglichen Kupplungsreagenzien existieren viele wichtige Azofarbstoffe, deshalb bilden sie zahlenmäßig auch die stärkste Farbstoffklasse. ⓘ
Lässt man Anilin mit Formaldehyd (37%ig) nach dem Mechanismus der Imin-Bildung reagieren erhält man das N-Methylidenanilin:
Zuerst greift der Stickstoff der Aminogruppe des Anilins an der Aldehydgruppe (Carbonylgruppe) des Formaldehyd an. Aus dem doppelt gebundenen Sauerstoff der Aldehydgruppe wird ein einfach gebundener mit einer negativen Ladung. Der Stickstoff ist vorerst positiv geladen, bis er sein Proton an den negativ geladenen Sauerstoff der Aldehydgruppe abgibt. Spontan oder durch Zugabe eines wasserentziehenden Mittels wird aus dem Molekül Wasser abgespalten (Hydroxygruppe des ehemaligen Formaldehyds + Proton des Stickstoffs). Zustande kommt eine Verbindung der allgemeinen Struktur R′–N=CH–R′′. N-Methylidenanilin gehört zu der Verbindungsklasse der Azomethine (Schiffschen Basen) und besitzt aufgrund der Methylidengruppe einen sehr reaktiven Angriffspunkt für Nucleophile. ⓘ
Die Reaktion von Anilin mit Benzaldehyd führt zum Benzalanilin (Benzylidenanilin):
Am Ring
Die Sulfonierung ist eine elektrophile aromatische Substitution SE. Als elektrophiles Teilchen wird Schwefeltrioxid (SO3) eingeführt, welches durch Reaktion von Schwefelsäure mit sich selbst gebildet wird: Bildung des Elektrophils (Schwefeltrioxid):
Nach dem Prinzip der elektrophilen Substitution (Sulfonierung) ist die Sulfanilsäure synthetisierbar.
Auch weitere elektrophile Substitutionen sind möglich. Beispielsweise die Halogenierung, die Friedel-Crafts-Alkylierung und die Friedel-Crafts-Acylierung. ⓘ
Eine katalytische Hydrierung von Anilin in Gegenwart eines Katalysators führt zum Cyclohexylamin (CHA). Als Katalysator für katalytische Hydrierungen benutzt man üblicherweise (Edel)-Metalle wie zum Beispiel Palladium:
Sicherheitshinweise
Anilin ist ein starkes Blutgift. Es oxidiert den roten Blutfarbstoff Hämoglobin zu Methämoglobin und verhindert damit den Sauerstofftransport im Blut. Das Gift kann durch Schlucken, Einatmen und durch die Haut aufgenommen werden. Bei leichten Vergiftungen kommt es zur Blaufärbung der Haut und der Fingernägel (Zyanose), zu Schwindelanfällen und Erregungszuständen. Bei höherer Konzentration treten Kopfschmerzen, Schwindel, Bewusstseinsstörungen und Atemnot auf. Letzteres kann den Tod verursachen. Langfristige Vergiftungserscheinungen zeigen sich in Schwächegefühl, Appetitlosigkeit und Blasenkrebs. ⓘ
Anilin war 1981 auch eine der Ursachen für die in Spanien durch verunreinigtes Rapsöl aufgetretene Massenvergiftung (Spanisches Ölsyndrom): Mit Anilin vergälltes Rapsöl für industrielle Zwecke wurde dabei redestilliert und anschließend über Straßenhändler als „Olivenöl“ verkauft. 20.000 Personen erkrankten, mehr als 300 starben. Die genauen Hintergründe der Vergiftung sind bis heute allerdings ungeklärt. ⓘ