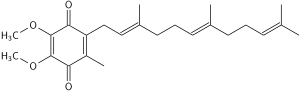
Ubichinon-10
| |
| Bezeichnungen | |
|---|---|
| Bevorzugte IUPAC-Bezeichnung
2-[(2E,6E,10E,14E,18E,22E,26E,30E,34E)-3,7,11,15,19,23,27,31,35,39-Decamethyltetraconta-2,6,10,14,18,22,26,30,34,38-decaen-1-yl]-5,6-dimethoxy-3-methylcyclohexa-2,5-diene-1,4-dione | |
| Andere Namen
Ubichinon, Ubidecarenon, Coenzym Q, CoQ10, /ˌkoʊˌkjuːˈtɛn/, CoQ, Q10, Vitamin Q
| |
| Bezeichner | |
3D-Modell (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
PubChem CID
|
|
| UNII | |
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
C59H90O4 |
| Molare Masse | 863,365 g-mol-1 |
| Erscheinungsbild | gelber oder orangefarbener Feststoff |
| Schmelzpunkt | 48-52 °C (118-126 °F; 321-325 K) |
Löslichkeit in Wasser
|
unlöslich |
| Pharmakologie | |
ATC-Code
|
C01EB09 (WHO) |
| Verwandte Verbindungen | |
Verwandte Chinone
|
1,4-Benzochinon Plastochinon Ubichinol |
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
Coenzym Q, auch bekannt als Ubichinon, ist eine Coenzymfamilie, die in Tieren und den meisten Bakterien allgegenwärtig ist (daher der Name Ubichinon). Beim Menschen ist die häufigste Form das Coenzym Q10 oder Ubichinon-10. CoQ10 ist von der US-amerikanischen Food and Drug Administration (FDA) nicht für die Behandlung von Krankheiten zugelassen; es wird jedoch als Nahrungsergänzungsmittel verkauft und ist ein Bestandteil einiger Kosmetika. ⓘ
Es handelt sich um ein 1,4-Benzochinon, wobei sich Q auf die chemische Gruppe der Chinone und 10 auf die Anzahl der chemischen Isoprenyl-Untereinheiten in seinem Schwanz bezieht. Bei den natürlichen Ubichinonen kann die Zahl zwischen 6 und 10 liegen. Diese Familie fettlöslicher Substanzen, die Vitaminen ähneln, ist in allen atmenden eukaryontischen Zellen vorhanden, vor allem in den Mitochondrien. Es ist ein Bestandteil der Elektronentransportkette und nimmt an der aeroben Zellatmung teil, bei der Energie in Form von ATP erzeugt wird. Fünfundneunzig Prozent der Energie des menschlichen Körpers wird auf diese Weise erzeugt. Organe mit dem höchsten Energiebedarf - wie Herz, Leber und Niere - weisen die höchsten CoQ10-Konzentrationen auf. ⓘ
Es gibt drei Redoxzustände von CoQ: vollständig oxidiert (Ubichinon), Halbchinon (Ubisemichinon) und vollständig reduziert (Ubichinol). Die Fähigkeit dieses Moleküls, als Zwei-Elektronen-Träger (der zwischen der Chinon- und der Chinolform wechselt) und als Ein-Elektronen-Träger (der zwischen dem Semichinon und einer dieser anderen Formen wechselt) zu fungieren, ist von zentraler Bedeutung für seine Rolle in der Elektronentransportkette aufgrund der Eisen-Schwefel-Cluster, die jeweils nur ein Elektron aufnehmen können, sowie als Antioxidans, das freie Radikale auffängt. ⓘ
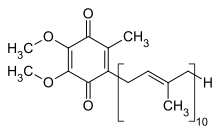
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ubichinon-10 | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C59H90O4 | ||||||||||||||||||
| Kurzbeschreibung |
geruchloser Feststoff | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
C01EB09 | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 863,34 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
48–52 °C | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Ubichinon-10 (auch UQ von englisch Ubiquinon, oder Q-10 oder Coenzym Q10) ist ein Chinon-Derivat mit lipophiler Isoprenoid-Seitenkette, strukturell verwandt mit Vitamin K und Vitamin E. Die reduzierte, phenolische Form wird Ubihydrochinon oder Ubichinol (kurz QH2) genannt. Ubichinon-10 gehört zu den Ubichinonen. ⓘ
Q-10 ist ein Elektronen- und Protonen-Überträger zwischen dem Komplex I bzw. Komplex II und dem Komplex III der Atmungskette. ⓘ
Q-10 wird als Bestandteil von kosmetischen Cremes sowie auch als Nahrungsergänzungsmittel zum Verkauf angeboten. ⓘ
Mangel und Toxizität
Es gibt zwei Hauptwege für einen Mangel an CoQ10 beim Menschen: eine verminderte Biosynthese und eine erhöhte Nutzung durch den Körper. Die Biosynthese ist die Hauptquelle von CoQ10. Für die Biosynthese sind mindestens 12 Gene erforderlich, und Mutationen in vielen von ihnen führen zu CoQ-Mangel. Der CoQ10-Spiegel kann auch durch andere genetische Defekte beeinträchtigt werden (z. B. Mutationen der mitochondrialen DNA, ETFDH, APTX, FXN und BRAF, Gene, die nicht direkt mit dem CoQ10-Biosyntheseprozess zusammenhängen). Einige davon, wie z. B. Mutationen in COQ6, können zu schwerwiegenden Krankheiten wie dem steroidresistenten nephrotischen Syndrom mit sensorineuraler Taubheit führen. ⓘ
Einige unerwünschte Wirkungen, vor allem gastrointestinaler Art, werden bei sehr hohen Aufnahmemengen berichtet. Die Methode zur Risikobewertung des beobachteten sicheren Niveaus (OSL) ergab, dass die Sicherheit bei einer Aufnahme von bis zu 1200 mg/Tag gut belegt ist, und dieses Niveau wird als OSL bezeichnet. ⓘ
Bewertung
Obwohl CoQ10 im Blutplasma gemessen werden kann, spiegeln diese Messungen eher die Nahrungszufuhr als den Gewebestatus wider. Derzeit messen die meisten klinischen Zentren den CoQ10-Spiegel in kultivierten Hautfibroblasten, Muskelbiopsien und mononukleären Blutzellen. Kulturfibroblasten können auch zur Bewertung der Rate der endogenen CoQ10-Biosynthese verwendet werden, indem die Aufnahme von 14C-markiertem p-Hydroxybenzoat gemessen wird. ⓘ
Statine
Es wurde vermutet, dass die Myotoxizität von Statinen auf eine Beeinträchtigung der CoQ-Biosynthese zurückzuführen ist, aber die Beweise, die dies belegen, wurden 2011 als umstritten eingestuft. ⓘ
Während Statine das Coenzym Q10 im Blut verringern können, ist unklar, ob sie das Coenzym Q10 im Muskel verringern. Es gibt keine Belege dafür, dass eine Supplementierung die Nebenwirkungen von Statinen verbessert. Eine neuere Metaanalyse kam jedoch zu dem Schluss, dass eine CoQ10-Supplementierung die SAMS verbessert, was darauf hindeutet, dass eine CoQ10-Supplementierung ein ergänzender Ansatz sein könnte, um die durch Statine ausgelöste Myopathie zu verbessern. ⓘ
Nahrungsergänzungsmittel
Regulierung und Zusammensetzung
CoQ10 wird in vielen Ländern als Nahrungsergänzungsmittel unter der Bezeichnung UbiQ 300 und UbiQ 100 verkauft, das nicht denselben Vorschriften unterliegt wie Arzneimittel, aber nicht für die Behandlung von Krankheiten zugelassen ist. Die Herstellung von CoQ10 ist nicht reguliert, und verschiedene Chargen und Marken können erheblich voneinander abweichen: Eine 2004 von ConsumerLab.com durchgeführte Laboranalyse von in den USA verkauften CoQ10-Ergänzungsmitteln ergab, dass einige nicht die auf dem Produktetikett angegebene Menge enthielten. Die Mengen reichten von "kein nachweisbares CoQ10" über 75 % der angegebenen Dosis bis hin zu einem Überschuss von 75 %. ⓘ
Im Allgemeinen ist CoQ10 gut verträglich. Die häufigsten Nebenwirkungen sind gastrointestinale Symptome (Übelkeit, Erbrechen, Appetitlosigkeit und Bauchschmerzen), Hautausschläge und Kopfschmerzen. ⓘ
Es gibt zwar keine festgelegte ideale Dosierung von CoQ10, aber eine typische Tagesdosis beträgt 100-200 Milligramm. Die verschiedenen Formulierungen weisen unterschiedliche Mengen an CoQ10 und anderen Inhaltsstoffen auf. ⓘ
Herzkrankheiten
Ein Cochrane-Review aus dem Jahr 2014 fand "keine überzeugenden Beweise zur Unterstützung oder Widerlegung" der Verwendung von CoQ10 zur Behandlung von Herzinsuffizienz. Eine weitere Cochrane-Überprüfung aus dem Jahr 2014 ergab unzureichende Belege für die Verwendung von CoQ10 zur Prävention von Herzkrankheiten. Ein Cochrane-Review von 2016 kam zu dem Schluss, dass CoQ10 keinen Einfluss auf den Blutdruck hat. In einer Metaanalyse von 2017 mit Menschen mit Herzinsuffizienz führte die Einnahme von 30 bis 100 mg CoQ10 pro Tag zu einer um 31 % niedrigeren Sterblichkeit. Auch die körperliche Leistungsfähigkeit wurde gesteigert. Bei den Endpunkten Linksherz-Ejektionsfraktion und New York Heart Association (NYHA)-Klassifizierung wurde kein signifikanter Unterschied festgestellt. ⓘ
Migräne-Kopfschmerzen
Die Leitlinie der Kanadischen Kopfschmerzgesellschaft zur Migräneprophylaxe empfiehlt auf der Grundlage von Belegen geringer Qualität, dass 300 mg CoQ10 als Prophylaxe angeboten werden sollten. ⓘ
Statin-Myopathie
CoQ10 wird routinemäßig zur Behandlung von Muskelabbau eingesetzt, der als Nebenwirkung der Einnahme von Statin-Medikamenten auftritt. Eine Meta-Analyse randomisierter kontrollierter Studien aus dem Jahr 2015 ergab, dass CoQ10 keinen Einfluss auf die Statin-Myopathie hat. Eine Metaanalyse aus dem Jahr 2018 kam zu dem Schluss, dass es vorläufige Belege dafür gibt, dass oral eingenommenes CoQ10 Statin-assoziierte Muskelsymptome wie Muskelschmerzen, Muskelschwäche, Muskelkrämpfe und Muskelmüdigkeit verringert. ⓘ
Krebs
Bis 2014 wurden noch keine großen klinischen Studien mit CoQ10 in der Krebsbehandlung durchgeführt. Das US-amerikanische National Cancer Institute wies auf Probleme mit den wenigen, kleinen Studien hin, die durchgeführt worden waren, und stellte fest, dass "die Art und Weise, wie die Studien durchgeführt wurden, und die Menge der berichteten Informationen es unklar machten, ob die Vorteile durch das CoQ10 oder durch etwas anderes verursacht wurden". Die Amerikanische Krebsgesellschaft kam zu dem Schluss, dass CoQ10 die Wirksamkeit von Chemo- und Strahlentherapien vermindern kann, weshalb die meisten Onkologen empfehlen, es während einer Krebsbehandlung zu vermeiden. ⓘ
Zahnkrankheiten
Eine 1995 durchgeführte Übersichtsstudie ergab, dass die Verwendung von CoQ10 bei der Behandlung von Parodontalerkrankungen keinen klinischen Nutzen hat. Die meisten der Studien, die das Gegenteil behaupteten, waren veraltet, konzentrierten sich auf In-vitro-Tests, hatten zu wenige Probanden und/oder eine fehlerhafte statistische Methodik und Versuchsanordnung oder wurden von einem Hersteller des Produkts gesponsert. ⓘ
Chronische Nierenerkrankung
Eine Überprüfung der Auswirkungen einer CoQ10-Supplementierung bei Menschen mit CKD wurde für 2019 vorgeschlagen. ⓘ
Weitere Verwendungen
Coenzym Q10 wurde auch zur Behandlung der Alzheimer-Krankheit, eines hohen Cholesterinspiegels oder der amyotrophen Lateralsklerose (Lou-Gehrig-Krankheit) eingesetzt. Die Forschung hat jedoch gezeigt, dass dies bei der Behandlung dieser Krankheiten möglicherweise nicht wirksam ist. ⓘ
Coenzym Q10 wurde auch als aktiver Bestandteil in kosmetischen Mitteln und als inaktiver Bestandteil in Sonnenschutzmitteln verwendet. Bei topischer Anwendung in Hautpflegeprodukten zeigt es eine gewisse Fähigkeit, oxidativen Stress in der Haut zu reduzieren, Anzeichen intrinsischer Hautalterung zu verzögern, Anzeichen extrinsischer Hautalterung umzukehren, das Verblassen von Dyspigmentierung zu unterstützen, die Stabilität bestimmter Sonnenschutzmittel zu erhöhen, den Lichtschutzfaktor von Sonnenschutzmitteln zu erhöhen und Sonnenschutzmitteln einen gewissen Infrarotschutz zu verleihen. Ein Großteil der Forschung über die Vorteile von Ubichinon für die Haut zeigt, dass es synergetisch mit anderen topischen Antioxidantien wirkt, um die Haut und kosmetische Formulierungen zu verbessern. ⓘ
Wechselwirkungen
Coenzym Q10 kann die Wirkung von Theophyllin sowie des Gerinnungshemmers Warfarin hemmen. Coenzym Q10 kann die Wirkung von Warfarin beeinträchtigen, indem es mit Cytochrom-p450-Enzymen interagiert und dadurch den INR-Wert, ein Maß für die Blutgerinnung, verringert. Die Struktur von Coenzym Q10 ist der von Vitamin K sehr ähnlich, das mit der gerinnungshemmenden Wirkung von Warfarin konkurriert und dieser entgegenwirkt. Coenzym Q10 sollte bei Patienten, die derzeit Warfarin einnehmen, wegen des erhöhten Gerinnungsrisikos vermieden werden. ⓘ
Chemische Eigenschaften
Die oxidierte Struktur von CoQ10 ist oben dargestellt. Die verschiedenen Arten von Coenzym Q lassen sich anhand der Anzahl der Isoprenoid-Untereinheiten in ihren Seitenketten unterscheiden. Das in den menschlichen Mitochondrien am häufigsten vorkommende Coenzym Q ist CoQ10. Q bezieht sich auf den Chinonkopf und 10 bezieht sich auf die Anzahl der Isopren-Wiederholungen im Schwanz. Das folgende Molekül hat drei Isoprenoid-Einheiten und wird als Q3 bezeichnet.
In seinem reinen Zustand ist es ein orangefarbenes, lipophiles Pulver und hat weder Geschmack noch Geruch. ⓘ
Q-10 ist ein gelb-oranges, kristallines Pulver ohne Geruch und Geschmack. Die hydrophobe Isoprenoid-Seitenkette ermöglicht die Verankerung des Moleküls im ebenfalls hydrophoben Bereich der Biomembranen, die die Mitochondrien aufbauen. ⓘ
Biosynthese
Die Biosynthese findet in den meisten menschlichen Geweben statt. Es gibt drei Hauptschritte:
- Aufbau der Benzochinonstruktur (unter Verwendung von Phenylalanin oder Tyrosin, über 4-Hydroxybenzoat)
- Bildung der Isopren-Seitenkette (unter Verwendung von Acetyl-CoA)
- Die Verbindung oder Kondensation der beiden oben genannten Strukturen ⓘ
Die ersten beiden Reaktionen finden in Mitochondrien, im endoplasmatischen Retikulum und in Peroxisomen statt, was auf mehrere Syntheseorte in tierischen Zellen hinweist. ⓘ
Ein wichtiges Enzym in diesem Stoffwechselweg ist die HMG-CoA-Reduktase, die in der Regel ein Ziel für Eingriffe bei kardiovaskulären Komplikationen ist. Die "Statin"-Familie von cholesterinsenkenden Medikamenten hemmt die HMG-CoA-Reduktase. Eine mögliche Nebenwirkung von Statinen ist die verminderte Produktion von CoQ10, was mit der Entwicklung von Myopathie und Rhabdomyolyse in Verbindung gebracht werden kann. Die Rolle, die Statine beim CoQ-Mangel spielen, ist jedoch umstritten. Obwohl diese Medikamente den CoQ-Spiegel im Blut senken, stehen Studien über die Auswirkungen auf den CoQ-Spiegel in den Muskeln noch aus. Eine CoQ-Supplementierung verringert auch nicht die Nebenwirkungen von Statin-Medikamenten. ⓘ
Zu den beteiligten Genen gehören PDSS1, PDSS2, COQ2 und ADCK3 (COQ8, CABC1). ⓘ
Andere Organismen als der Mensch verwenden etwas andere Ausgangschemikalien, um die Benzochinon-Struktur und die Isopren-Struktur herzustellen. Das Bakterium E. coli beispielsweise produziert die Benzochinon-Struktur aus Chorismat und die Isopren-Struktur aus einer Nicht-Mevalonat-Quelle. Die gewöhnliche Hefe S. cerevisiae hingegen gewinnt das erstere entweder aus Chorismat oder Tyrosin und das letztere aus Mevalonat. Die meisten Organismen verwenden das gemeinsame 4-Hydroxybenzoat-Zwischenprodukt, aber auch hier werden unterschiedliche Schritte verwendet, um die Q-Struktur zu erreichen. ⓘ
Absorption und Metabolismus
Absorption
CoQ10 ist ein kristallines, in Wasser unlösliches Pulver. Die Absorption erfolgt nach dem gleichen Verfahren wie bei den Lipiden; der Aufnahmemechanismus scheint dem von Vitamin E, einem anderen lipidlöslichen Nährstoff, zu ähneln. Dieser Prozess im menschlichen Körper beinhaltet die Sekretion von Pankreasenzymen und Galle in den Dünndarm, was die Emulgierung und Mizellenbildung erleichtert, die für die Aufnahme lipophiler Substanzen erforderlich sind. Die Nahrungsaufnahme (und das Vorhandensein von Fetten) stimuliert die körpereigene biliäre Ausscheidung von Gallensäuren und verbessert die Absorption von CoQ10 erheblich. Exogenes CoQ10 wird über den Dünndarm aufgenommen und am besten mit einer Mahlzeit absorbiert. Die Serumkonzentration von CoQ10 ist im ernährten Zustand höher als im nüchternen Zustand. ⓘ
Stoffwechsel
Es liegen nur wenige Daten über den Stoffwechsel von CoQ10 bei Tieren und Menschen vor. In einer Studie mit 14C-markiertem CoQ10 an Ratten wurde der größte Teil der Radioaktivität zwei Stunden nach der oralen Verabreichung in der Leber nachgewiesen, als die maximale Plasma-Radioaktivität beobachtet wurde, aber CoQ9 (mit nur 9 Isoprenyleinheiten) ist die vorherrschende Form des Coenzyms Q bei Ratten. Offenbar wird CoQ10 in allen Geweben verstoffwechselt, während es hauptsächlich über die Galle und den Stuhl ausgeschieden wird. Nach Absetzen der CoQ10-Supplementierung normalisieren sich die Werte innerhalb weniger Tage, unabhängig von der Art der verwendeten Formulierung. ⓘ
Pharmakokinetik
Es wurden einige Berichte über die Pharmakokinetik von CoQ10 veröffentlicht. Der Plasmaspitzenwert kann 2 bis 6 Stunden nach der oralen Verabreichung beobachtet werden, was hauptsächlich vom Design der Studie abhängt. In einigen Studien wurde auch ein zweiter Plasmaspitzenwert etwa 24 Stunden nach der Verabreichung beobachtet, der wahrscheinlich sowohl auf das enterohepatische Recycling als auch auf die Umverteilung von der Leber in den Blutkreislauf zurückzuführen ist. Tomono et al. verwendeten deuteriummarkiertes kristallines CoQ10 zur Untersuchung der Pharmakokinetik beim Menschen und ermittelten eine Eliminationshalbwertszeit von 33 Stunden. ⓘ
Verbesserung der Bioverfügbarkeit von CoQ10
Die Bedeutung der Formulierung von Arzneimitteln für deren Bioverfügbarkeit ist allgemein bekannt. Um ein Prinzip zur Steigerung der Bioverfügbarkeit von CoQ10 nach oraler Verabreichung zu finden, wurden mehrere neue Ansätze verfolgt; verschiedene Formulierungen und Formen wurden entwickelt und an Tieren und Menschen getestet. ⓘ
Verkleinerung der Partikelgröße
Nanopartikel wurden als Verabreichungssystem für verschiedene Arzneimittel erforscht, um beispielsweise die orale Bioverfügbarkeit von Arzneimitteln mit schlechten Absorptionseigenschaften zu verbessern. Bei CoQ10 hat sich dies jedoch nicht bewährt, obwohl die Berichte darüber sehr unterschiedlich sind. Auch die Verwendung einer wässrigen Suspension von fein pulverisiertem CoQ10 in reinem Wasser zeigt nur eine geringe Wirkung. ⓘ
Weichgelkapseln mit CoQ10 in Ölsuspension
Ein erfolgreicher Ansatz ist die Verwendung eines Emulsionssystems, um die Aufnahme aus dem Magen-Darm-Trakt zu erleichtern und die Bioverfügbarkeit zu verbessern. Emulsionen von Sojabohnenöl (Lipid-Mikrokugeln) konnten sehr wirksam durch Lecithin stabilisiert werden und wurden zur Herstellung von Weichgelkapseln verwendet. In einem der ersten Versuche dieser Art führten Ozawa et al. eine pharmakokinetische Studie an Beagles durch, in der die Emulsion von CoQ10 in Sojabohnenöl untersucht wurde; bei der Verabreichung einer Lipidmikrokugel wurde ein etwa doppelt so hoher CoQ10-Plasmaspiegel wie bei der Kontrolltablettenzubereitung festgestellt. Obwohl Kommuru et al. in einer späteren Studie an Hunden eine fast vernachlässigbare Verbesserung der Bioverfügbarkeit mit Weichkapseln auf Ölbasis feststellten, wurde die signifikant erhöhte Bioverfügbarkeit von CoQ10 für verschiedene Formulierungen auf Ölbasis in den meisten anderen Studien bestätigt. ⓘ
Neuartige Formen von CoQ10 mit erhöhter Wasserlöslichkeit
Die Erleichterung der Absorption von Arzneimitteln durch Erhöhung ihrer Wasserlöslichkeit ist eine gängige pharmazeutische Strategie und hat sich auch für CoQ10 als erfolgreich erwiesen. Um dieses Ziel zu erreichen, wurden verschiedene Ansätze entwickelt, von denen viele trotz zahlreicher Versuche, ihre Zusammensetzung zu optimieren, deutlich bessere Ergebnisse erzielen als Weichkapseln auf Ölbasis. Beispiele für solche Ansätze sind die Verwendung der wässrigen Dispersion von festem CoQ10 mit dem Polymer Tyloxapol, Formulierungen auf der Grundlage verschiedener Solubilisierungsmittel wie hydriertem Lecithin und die Komplexierung mit Cyclodextrinen; unter den letzteren hat sich der Komplex mit β-Cyclodextrin als sehr bioverfügbar erwiesen und wird auch in der Pharma- und Lebensmittelindustrie zur Anreicherung von CoQ10 verwendet. ⓘ
Geschichte
1950 isolierte G. N. Festenstein in Liverpool, England, als Erster eine kleine Menge CoQ10 aus der Darmschleimhaut eines Pferdes. In späteren Studien wurde die Verbindung kurz als Substanz SA bezeichnet, sie wurde für ein Chinon gehalten, und es wurde festgestellt, dass sie in vielen Geweben einer Reihe von Tieren gefunden werden konnte. ⓘ
1957 isolierten Frederick L. Crane und Kollegen vom Enzyminstitut der Universität von Wisconsin-Madison dieselbe Verbindung aus mitochondrialen Membranen von Rinderherzen und stellten fest, dass sie Elektronen innerhalb der Mitochondrien transportiert. Sie nannten es kurz Q-275, da es ein Chinon war. Bald stellten sie fest, dass es sich bei Q-275 und der in England untersuchten Substanz SA um dieselbe Verbindung handeln könnte. Dies wurde später im selben Jahr bestätigt, und Q-275/Substanz SA wurde in Ubichinon umbenannt, da es ein allgegenwärtiges Chinon war, das in allen tierischen Geweben gefunden werden konnte. ⓘ
Im Jahr 1958 wurde seine vollständige chemische Struktur von D. E. Wolf und Kollegen, die unter Karl Folkers bei Merck in Rahway arbeiteten, veröffentlicht. Später im selben Jahr schlugen D. E. Green und Kollegen aus der Forschungsgruppe in Wisconsin vor, Ubichinon wegen seiner Beteiligung an der mitochondrialen Elektronentransportkette entweder Mitochinon oder Coenzym Q zu nennen. ⓘ
1966 wiesen A. Mellors und A. L. Tappel an der Universität von Kalifornien als Erste nach, dass reduziertes CoQ6 ein wirksames Antioxidans in Zellen ist. ⓘ
In den 1960er Jahren erweiterte Peter D. Mitchell das Verständnis der mitochondrialen Funktion durch seine Theorie des elektrochemischen Gradienten, an dem CoQ10 beteiligt ist, und in den späten 1970er Jahren untermauerten Studien von Lars Ernster die Bedeutung von CoQ10 als Antioxidans. In den 1980er Jahren stieg die Zahl der klinischen Studien mit CoQ10 stark an. ⓘ
Ubichinon-10 wurde 1957 entdeckt und erstmals von Fred L. Crane aus Rinder-Herzen isoliert. Die chemische Struktur konnte 1958 von Karl August Folkers aufgeklärt werden. Für die Erkenntnisse über die Rolle von Q-10 im Q-Zyklus des Komplex III der Atmungskette erhielt der britische Wissenschaftler Peter D. Mitchell 1978 den Nobelpreis für Chemie. ⓘ
Ernährungstechnische Konzentrationen
Ausführliche Übersichten über das Vorkommen von CoQ10 und die Aufnahme über die Nahrung wurden 2010 veröffentlicht. Neben der endogenen Synthese im Organismus wird CoQ10 dem Organismus auch über verschiedene Lebensmittel zugeführt. Trotz des großen Interesses der wissenschaftlichen Gemeinschaft an dieser Verbindung wurde jedoch nur eine sehr begrenzte Anzahl von Studien durchgeführt, um den Gehalt von CoQ10 in Nahrungsbestandteilen zu bestimmen. Die ersten Berichte zu diesem Aspekt wurden 1959 veröffentlicht, aber die Empfindlichkeit und Selektivität der damaligen Analysemethoden erlaubten keine zuverlässigen Analysen, insbesondere bei Produkten mit niedrigen Konzentrationen. Seitdem haben die Entwicklungen in der analytischen Chemie eine zuverlässigere Bestimmung der CoQ10-Konzentrationen in verschiedenen Lebensmitteln ermöglicht:
| Lebensmittel | CoQ10-Konzentration (mg/kg) ⓘ | |
|---|---|---|
| Rindfleisch | Herz | 113 |
| Leber | 39–50 | |
| Muskel | 26–40 | |
| Schweinefleisch | Herz | 12–128 |
| Leber | 23–54 | |
| Muskel | 14–45 | |
| Huhn | Brust | 8–17 |
| Schenkel | 24–25 | |
| Flügel | 11 | |
| Fisch | Sardine | 5–64 |
| Makrele: | ||
| - rotes Fleisch | 43–67 | |
| - weißes Fleisch | 11–16 | |
| Lachs | 4–8 | |
| Thunfisch | 5 | |
| Öle | Sojabohnen | 54–280 |
| Olive | 4–160 | |
| Traubenkern | 64–73 | |
| Sonnenblume | 4–15 | |
| Raps | 64–73 | |
| Nüsse | Erdnuss | 27 |
| Walnuss | 19 | |
| Sesamsamen | 18–23 | |
| Pistazie | 20 | |
| Haselnuss | 17 | |
| Mandel | 5–14 | |
| Gemüse | Petersilie | 8–26 |
| Brokkoli | 6–9 | |
| Blumenkohl | 2–7 | |
| Spinat | bis zu 10 | |
| Chinakohl | 2–5 | |
| Obst | Avocado | 10 |
| Schwarze Johannisbeere | 3 | |
| Weintraube | 6–7 | |
| Erdbeere | 1 | |
| Orange | 1–2 | |
| Grapefruit | 1 | |
| Apfel | 1 | |
| Banane | 1 | |
Fleisch und Fisch sind die reichhaltigsten Quellen für CoQ10 in der Nahrung; Gehalte von über 50 mg/kg finden sich in Rind-, Schweine- und Hühnerherz und -leber. Milchprodukte sind eine wesentlich schlechtere Quelle für CoQ10 als tierisches Gewebe. Pflanzliche Öle sind ebenfalls recht reich an CoQ10. Bei den Gemüsesorten sind Petersilie und Perilla die reichsten CoQ10-Quellen, doch finden sich in der Literatur erhebliche Unterschiede im CoQ10-Gehalt. Brokkoli, Weintrauben und Blumenkohl sind bescheidene CoQ10-Quellen. Die meisten Früchte und Beeren sind eine schlechte bis sehr schlechte CoQ10-Quelle, mit Ausnahme von Avocados, die einen relativ hohen CoQ10-Gehalt aufweisen. ⓘ
Nahrungsergänzung
Über die Nahrung nimmt ein Mensch täglich etwa fünf bis zehn Milligramm des Coenzyms auf. Zudem ist der Körper in der Lage, Q-10 aus Phenylalanin und Tyrosin bzw. aus der in Pflanzen vorkommenden Mevalonsäure selbst herzustellen (siehe Biosynthese). Damit ist eine zusätzliche Aufnahme für Gesunde über Nahrungsergänzungsmittel überflüssig. ⓘ
Das Bundesamt für Verbraucherschutz und Lebensmittelsicherheit sieht eine tägliche Aufnahmemenge von 10 bis 30 mg Q-10 als bedenkenlos an. In einer Allgemeinverfügung stellt es fest, dass auch höhere Dosierungen von 100 mg pro Tag verkauft werden können. Voraussetzung hierfür ist, dass die Verzehrempfehlung von einer Kapsel pro Tag nicht überschritten wird sowie eine Kennzeichnung, die vor dem Verzehr durch Schwangere, Stillende, Kinder und Jugendliche unter 18 Jahren warnt. ⓘ
Überschreitet man die Verzehrmenge von 100 mg Q-10 täglich, können Nebenwirkungen wie Schlaflosigkeit, Durchfall, Übelkeit, Appetitverlust und Unwohlsein, Reizbarkeit und Hautausschlag auftreten. Für mögliche chronische Auswirkungen liegen keine Daten vor. ⓘ
Angeboten wird Q-10 entweder in Form von Ubichinon oder Ubichinol. Alle von Herstellern behaupteten Wirkungen bezüglich Q-10 (z. B. Nutzen hinsichtlich der Energiegewinnung, des Blutdrucks, des Schutzes vor oxidativen Schäden, Migräne, kognitiver Funktionen, des Cholesterinspiegels, einer Leistungssteigerung, Verbesserungen des Hautbildes) sind wissenschaftlich nicht belegt und dürfen als Werbeaussage nicht verwendet werden (siehe Health Claims). ⓘ
Auswirkung von Hitze und Verarbeitung
Das Kochen durch Braten verringert den CoQ10-Gehalt um 14-32 %. ⓘ
Biologische Funktion
Q-10 ist eine körpereigene Substanz. Es wird zum Teil über die Nahrung aufgenommen, aber auch im Körper selbst produziert. In jeder menschlichen Zelle wird die Energie aus der Nahrung in körpereigene Energie (ATP) umgewandelt. Q-10 ist als Coenzym an der oxidativen Phosphorylierung beteiligt, über die 95 % der gesamten Körperenergie (ATP) erzeugt wird. Die Organe mit dem höchsten Energiebedarf – wie Herz, Lunge und Leber – weisen deshalb auch die höchste Q-10-Konzentration auf. ⓘ
Biochemie
Die Atmungskette in den Mitochondrien der Zelle ermöglicht den stufenweise ablaufenden Transfer von Elektronen und Protonen auf Sauerstoff bei gleichzeitiger Gewinnung von ATP als biochemisches Energieäquivalent. Diese Reaktion findet an lokalisierten Membranproteinen, den Komplexen I bis V, und mobilen Komponenten, Ubichinon und Cytochrom c, statt. Letztere dienen als Shuttlesysteme zwischen den Komplexen: Ubichinon vermittelt zwischen den Komplexen I/II und III, Cytochrom c zwischen den Komplexen III und IV. ⓘ
Die Elektronen zur Reduktion des Ubichinons entstammen der Oxidation des NADH am Komplex I der Atmungskette, der NADH-Dehydrogenase, bzw. von der Oxidation von Succinat am Komplex II, welcher mit der Succinat-Dehydrogenase des Citratzyklus identisch ist. Ein Ubichinon-Molekül kann dabei schrittweise zwei Elektronen aufnehmen. Im ersten Schritt bildet sich QH•, ein recht stabiles Semichinon-Radikal. Die Aufnahme des zweiten Elektrons lässt nach der Protonierung das Hydrochinon Ubichinol entstehen, also die reduzierte Form. Dies ermöglicht neben dem Elektronentransport auch die Bindung zweier Protonen – Ubichinon kann somit auch als Protonencarrier dienen. Diese Vorgänge sind innerhalb der Atmungskette im Q-Zyklus am Komplex III von Bedeutung. ⓘ
Prooxidante und antioxidante Eigenschaften
Ubichinon ist auch involviert bei der Bildung von reaktiven Sauerstoffspezies (ROS) durch die Entstehung von Superoxid durch Ubisemichinon-Radikale, die oxidative Beschädigungen verursachen, die vielen degenerativen Krankheiten zugrunde liegen. Paradoxerweise ist der Ubichinon-Pool auch ein wichtiges mitochondriales Antioxidans. ⓘ
Mangel
Ein permanenter Q-10-Mangel kommt selten vor, Mangelerscheinungen sind nicht bekannt. Man findet ihn gehäuft bei Patienten mit Myopathien. Da die an der Biosynthese von Q-10 beteiligten Enzyme noch nicht alle bekannt sind, ist es ohne weiteres möglich, dass Mutationen in einem der betroffenen Gene noch nicht identifiziert sind. ⓘ
Eine Möglichkeit für temporären Q-10-Mangel stellt die Medikation mit Statinen dar, wo durch die Hemmung der HMG-CoA-Reduktase die Ausgangsstoffe für die Biosynthese von Q-10 verringert werden, was zu einem Rückgang der Plasmawerte führt. Über die Verfügbarkeit von Q-10 im Muskel ist dagegen nichts bekannt, ebenso wenig wie über eine Wirksamkeit von erhöhter Zufuhr. ⓘ
Hochdosierte, Q-10-haltige Therapien können unter ärztlicher Kontrolle in der Behandlung von Herzerkrankungen eingesetzt werden. ⓘ
Biosynthese
Die Biosynthese von Q-10 in Eukaryoten geht einerseits von 4-Hydroxybenzoesäure aus, die aus der Aminosäure Tyrosin in fünf Schritten, unter anderem über Hydroxyphenylbernsteinsäure und 4-Cumarinsäure, erhalten wird und den Chinon-Teil bildet; auf der anderen Seite wird für die Seitenkette all-trans-Decaprenylphosphat benötigt, das aus Geranylgeranylphosphat (GGP, aus dem Mevalonatweg) in sechs Schritten aufgebaut wird. Beide Ausgangsstoffe werden mithilfe der p-Hydroxybenzoat-Polyprenyltransferase (EC 2.5.1.39) zu 3-Decaprenyl-4-hydroxybenzoat zusammengefügt. In sieben weiteren Schritten entsteht Ubichinol-10, das durch Elektronenübertragung zum Ubichinon-10 wird. ⓘ
Vorkommen
Q-10 findet sich reichhaltig im Fleisch von Organen (Leber), öligem Fisch (Sardinen, Makrelen usw.), Leber, Ei und Butter, ferner in Nüssen (z. B. Pistazien), Hülsenfrüchten, Sesamsamen, Sonnenblumenkernen, Pflanzenölen. Kochen kann das Coenzym jedoch zerstören. ⓘ
Kosmetik
Q-10 ist auch propagierter Wirkstoff von vielfach angebotenen Hautcremes. Sie sollen den angeblich im Alter zunehmenden Mangel an Q-10 ausgleichen und z. B. den Abbau von schädlichen Radikalen sicherstellen. Ein wissenschaftlicher Nachweis hierfür existiert nicht. ⓘ
Herstellung
Für die Herstellung von Q-10 werden drei Verfahren eingesetzt: Fermentation von Hefen, Fermentation von Bakterien und chemische Synthese. ⓘ
Beim Hefefermentationsverfahren entsteht Q-10 in der so genannten trans-Konfiguration, was bedeutet, dass es identisch ist mit dem natürlich auftretenden CoQ10, wie man es in Fleisch, Fisch oder anderen Lebensmitteln findet. ⓘ
Die Sicherheit von Hefefermentation wurde durch mehrere Sicherheitsstudien bestätigt, die von einem der weltweit führenden Versuchslaboratorien (Covance Laboratories Inc.) durchgeführt wurden. Darüber hinaus wurde in einer doppelblinden, randomisierten, placebokontrollierten Studie nachgewiesen, dass CoQ10 von Hefefermentation in Dosierungen bis 900 Milligramm pro Tag absolut sicher und gut verträglich ist. ⓘ
Das durch chemische Synthese hergestellte Q-10 enthält das cis-Isomer (eine im natürlich auftretenden Q-10 nicht vorhandene Molekularstruktur), über dessen Sicherheit bisher keine intensiven Studien durchgeführt worden sind. ⓘ