Milchsäure
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugte IUPAC-Bezeichnung
2-Hydroxypropansäure | |||
| Andere Bezeichnungen
Milchsäure
Milchsäure | |||
| Bezeichner | |||
| |||
3D-Modell (JSmol)
|
|||
| 3DMet | |||
Beilstein-Referenz
|
1720251 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC-Nummer |
| ||
Gmelin Referenz
|
362717 | ||
IUPHAR/BPS
|
|||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII |
| ||
| UN-Nummer | 3265 | ||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C3H6O3 | ||
| Molekulare Masse | 90,078 g-mol-1 | ||
| Schmelzpunkt | 18 °C (64 °F; 291 K) | ||
| Siedepunkt | 122 °C (252 °F; 395 K) bei 15 mmHg | ||
Löslichkeit in Wasser
|
mischbar | ||
| Acidität (pKa) | 3.86, 15.1 | ||
| Thermochemie | |||
Standard-Verbrennungsenthalpie
Verbrennungsenthalpie (ΔcH⦵298) |
1361,9 kJ/mol, 325,5 kcal/mol, 15,1 kJ/g, 3,61 kcal/g | ||
| Pharmakologie | |||
ATC-Code
|
G01AD01 (WER) QP53AG02 (WER) | ||
| Gefahren | |||
| GHS-Kennzeichnung: | |||
Piktogramme
|

| ||
Gefahrensätze
|
H315, H318 | ||
Sicherheitshinweise
|
P280, P305+P351+P338 | ||
| Verwandte Verbindungen | |||
Andere Anionen
|
Laktat | ||
Verwandte Carbonsäuren
|
Essigsäure Glykolsäure Propionsäure 3-Hydroxypropansäure Malonsäure Buttersäure Hydroxybuttersäure | ||
Verwandte Verbindungen
|
1-Propanol 2-Propanol Propionaldehyd Acrolein Natriumlactat Ethyllactat | ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Stoffe in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Milchsäure ist eine organische Säure. Sie hat die Summenformel CH3CH(OH)COOH. Im festen Zustand ist sie weiß und mit Wasser mischbar. Im gelösten Zustand bildet sie eine farblose Lösung. Die Herstellung erfolgt sowohl durch künstliche Synthese als auch aus natürlichen Quellen. Milchsäure ist eine Alpha-Hydroxysäure (AHA), da sie eine Hydroxylgruppe neben der Carboxylgruppe aufweist. Sie wird als synthetisches Zwischenprodukt in vielen Bereichen der organischen Synthese und in verschiedenen biochemischen Industrien verwendet. Die konjugierte Base der Milchsäure wird Laktat genannt. Der Name der abgeleiteten Acylgruppe ist Lactoyl. ⓘ
In Lösung kann sie durch den Verlust eines Protons ionisieren, wobei das Laktat-Ion CH
3CH(OH)CO-
2. Im Vergleich zur Essigsäure ist ihr pKa-Wert um 1 Einheit niedriger, d. h. Milchsäure ist zehnmal saurer als Essigsäure. Diese höhere Acidität ist die Folge der intramolekularen Wasserstoffbrückenbindungen zwischen der α-Hydroxyl- und der Carboxylatgruppe. ⓘ
Milchsäure ist chiral und besteht aus zwei Enantiomeren. Das eine ist als L-Milchsäure, (S)-Milchsäure oder (+)-Milchsäure bekannt, das andere, sein Spiegelbild, ist D-Milchsäure, (R)-Milchsäure oder (-)-Milchsäure. Eine Mischung aus beiden in gleichen Mengen wird als DL-Milchsäure oder racemische Milchsäure bezeichnet. Milchsäure ist hygroskopisch. DL-Milchsäure ist mit Wasser und mit Ethanol oberhalb ihres Schmelzpunktes, der bei etwa 16 bis 18 °C liegt, mischbar. D-Milchsäure und L-Milchsäure haben einen höheren Schmelzpunkt. Die durch Fermentation von Milch erzeugte Milchsäure ist häufig racemisch, obwohl bestimmte Bakterienarten ausschließlich D-Milchsäure erzeugen. Die durch anaerobe Atmung in tierischen Muskeln produzierte Milchsäure hingegen hat das (L)-Enantiomer und wird manchmal als "sarkolaktische" Säure bezeichnet, abgeleitet vom griechischen Wort "sarx" für Fleisch. ⓘ
Bei Tieren wird L-Laktat während des normalen Stoffwechsels und bei körperlicher Betätigung ständig durch das Enzym Laktatdehydrogenase (LDH) in einem Gärungsprozess aus Pyruvat gebildet. Die Laktatkonzentration steigt erst an, wenn die Laktatproduktionsrate die Laktatabbaugeschwindigkeit übersteigt, die von einer Reihe von Faktoren wie den Monocarboxylattransportern, der Konzentration und Isoform der LDH und der Oxidationskapazität der Gewebe bestimmt wird. Die Laktatkonzentration im Blut liegt in Ruhe normalerweise bei 1-2 mM, kann aber bei intensiver Anstrengung auf über 20 mM und danach auf bis zu 25 mM ansteigen. Neben anderen biologischen Funktionen ist L-Milchsäure der primäre endogene Agonist des Hydroxycarbonsäurerezeptors 1 (HCA1), eines Gi/O-gekoppelten G-Protein-Rezeptors (GPCR). ⓘ
In der Industrie wird die Milchsäuregärung von Milchsäurebakterien durchgeführt, die einfache Kohlenhydrate wie Glukose, Saccharose oder Galaktose in Milchsäure umwandeln. Diese Bakterien können sich auch im Mund ansiedeln; die von ihnen produzierte Säure ist für die als Karies bekannte Zahnfäule verantwortlich. In der Medizin ist Laktat einer der Hauptbestandteile von Ringer-Laktat-Lösung und Hartmann-Lösung. Diese intravenösen Flüssigkeiten bestehen aus Natrium- und Kaliumkationen sowie Laktat- und Chloridanionen in Lösung mit destilliertem Wasser, im Allgemeinen in isotonischen Konzentrationen mit menschlichem Blut. Sie werden am häufigsten zur Flüssigkeitsreanimation nach Blutverlusten aufgrund von Traumata, Operationen oder Verbrennungen verwendet. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Strukturformel ohne Angabe der Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Milchsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H6O3 | ||||||||||||||||||
| Kurzbeschreibung |
farblose, fast geruchlose, ölige Flüssigkeit (Racemat) | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
G01AD01 | ||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 90,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig (Racemat) | ||||||||||||||||||
| Dichte |
1,21 g·cm−3 (Racemat) | ||||||||||||||||||
| Schmelzpunkt |
| ||||||||||||||||||
| Siedepunkt |
122 °C (20 hPa) (Racemat) | ||||||||||||||||||
| Dampfdruck |
10 Pa (25 °C) | ||||||||||||||||||
| pKS-Wert |
3,90 (25 °C, Racemat) | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Brechungsindex |
1,4392 (20 °C; Racemat) | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten |
3.543 mg·kg−1 (LD50, Ratte, oral) | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Milchsäure (lat. acidum lacticum) ist eine Hydroxycarbonsäure, enthält somit sowohl eine Carboxygruppe als auch eine Hydroxygruppe. Sie wird deswegen auch als 2-Hydroxypropionsäure bezeichnet, nach den Nomenklaturempfehlungen der IUPAC ist jedoch die Bezeichnung 2-Hydroxypropansäure zu verwenden. Die Salze und Ester der Milchsäure heißen Lactate. ⓘ
Geschichte
Milchsäure wurde historisch sowohl in Europa wie auch in Asien zur Säuerung und Konservierung von Lebensmitteln, insbesondere für Milch (Sauermilch), Gemüse (z. B. Sauerkraut) und auch zur Herstellung von Silagen als Futtermittel bereits seit Jahrhunderten oder Jahrtausenden genutzt. ⓘ
Die erste Entdeckung und Isolierung der Milchsäure geht auf den deutsch-schwedischen Chemiker Carl Wilhelm Scheele im Jahr 1780 zurück, der sie aus saurer Milch in Form eines braunen Sirups isolierte. Die Fleischmilchsäure [L-(+)-Milchsäure] wurde von Jöns Jakob Berzelius im Jahr 1808 entdeckt und ihre Struktur 1873 von Johannes Wislicenus aufgeklärt. Henri Braconnot, ein französischer Chemiker, fand im Jahre 1813 heraus, dass Milchsäure in einem Fermentationsprozess hergestellt werden kann. 1856 entdeckte Louis Pasteur die Milchsäurebakterien und entwickelte das Grundverständnis für die Milchsäuregärung. Die großtechnische Produktion von Milchsäure begann 1881 in den USA, und 1895 machte auch Boehringer Ingelheim die Entdeckung, wie Milchsäure mit Hilfe von Bakterien in großen Mengen hergestellt werden konnte. ⓘ
Im Jahr 2006 erreichte die weltweite Milchsäureproduktion 275.000 Tonnen mit einem durchschnittlichen jährlichen Wachstum von 10 %. ⓘ
Herstellung
Milchsäure wird industriell durch bakterielle Fermentation von Kohlenhydraten oder durch chemische Synthese aus Acetaldehyd hergestellt. Im Jahr 2009 wurde Milchsäure überwiegend (70-90 %) durch Fermentation hergestellt. Die Herstellung von racemischer Milchsäure, die aus einer 1:1-Mischung von D- und L-Stereoisomeren besteht, oder von Mischungen mit bis zu 99,9 % L-Milchsäure ist durch mikrobielle Fermentation möglich. Die fermentative Herstellung von D-Milchsäure im industriellen Maßstab ist möglich, aber sehr viel schwieriger. ⓘ
Fermentative Herstellung
Etwa 70 bis 90 % der Weltproduktion an Milchsäure wird derzeit fermentativ hergestellt, wobei beide reinen Enantiomere kommerziell durch Fermentationsverfahren mit Milchsäurebakterien in signifikanten Mengen produziert werden. In der Regel wird stammspezifisch nur eines der Stereoisomere gebildet, allerdings kann es durch das Enzym Lactat-Racemase auch zu anderen Mischungsverhältnissen kommen. ⓘ
Industriell erfolgt die Herstellung von Sauermilchprodukten durch Vergärung von Milch oder Molke vor allem durch die Lactobacillus-Arten Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus delbrueckii subsp. bulgaricus (Lactobacillus bulgaricus) und Lactobacillus helveticus, weiterhin durch Streptococcus salivarius subsp. thermophilus (Streptococcus thermophilus) und Lactococcus lactis. Für industriell genutzte Milchsäure werden Zuckerdicksaft oder Stärkehydrolysate und Lactobacillus delbrueckii sowie Pentose-haltige Sulfitablaugen und Lactobacillus pentosus verwendet. Die Bakterienstämme werden nach ihrer Eigenart eingeteilt, Glucose nur zu Lactat oder auch zu anderen Produkten zu vergären: homofermentative Arten, wie Lactobacillus casei und Lactococcus lactis, bilden pro Mol Glucose zwei Mol Lactat, während heterofermentative Arten, wie Leuconostoc mesenteroides und Lactobacillus brevis, neben einem Mol Lactat pro Mol Glucose auch Essigsäure, Kohlenstoffdioxid und Ethanol produzieren. ⓘ
Ein Vorteil der fermentativen Herstellung ist, dass sie – anders als die synthetische Herstellung – stereospezifisch ist. So kann mit bestimmten Stämmen gezielt das L-Isomer hergestellt werden, welches für moderne Anwendungen gefragter ist. ⓘ
Chemische Produktion
Racemische Milchsäure wird industriell durch Reaktion von Acetaldehyd mit Cyanwasserstoff und Hydrolyse des entstehenden Lactonitrils hergestellt. Bei der Hydrolyse mit Salzsäure entsteht als Nebenprodukt Ammoniumchlorid; das japanische Unternehmen Musashino ist einer der letzten großen Hersteller von Milchsäure auf diesem Weg. Die Synthese von sowohl racemischer als auch enantioreiner Milchsäure ist auch aus anderen Ausgangsstoffen (Vinylacetat, Glycerin usw.) durch Anwendung katalytischer Verfahren möglich. ⓘ
Biologie
Molekularbiologie
L-Milchsäure ist der primäre endogene Agonist des Hydroxycarbonsäurerezeptors 1 (HCA1), eines Gi/ogekoppelten G-Protein-gekoppelten Rezeptors (GPCR). ⓘ
Bewegung und Laktat
Bei Kraftübungen wie dem Sprint, bei denen ein hoher Energiebedarf besteht, wird Glukose aufgespalten und zu Pyruvat oxidiert, aus dem dann schneller Laktat gebildet wird, als der Körper es verarbeiten kann, wodurch die Laktatkonzentration ansteigt. Die Laktatproduktion ist für die Regeneration von NAD+ von Vorteil (Pyruvat wird zu Laktat reduziert, während NADH zu NAD+ oxidiert wird), das bei der Oxidation von Glyceraldehyd-3-Phosphat während der Pyruvatproduktion aus Glukose verbraucht wird, wodurch die Energieproduktion aufrechterhalten und das Training fortgesetzt werden kann. Bei intensiver körperlicher Betätigung kann die Atmungskette nicht mit der Menge an Wasserstoffionen Schritt halten, die sich zu NADH verbinden, und NAD+ nicht schnell genug regenerieren. ⓘ
Das entstehende Laktat kann auf zwei Arten verwendet werden:
- Oxidation zurück zu Pyruvat durch gut mit Sauerstoff versorgte Muskelzellen, Herzzellen und Gehirnzellen
- Pyruvat wird dann direkt als Brennstoff für den Krebszyklus verwendet
- Umwandlung in Glukose durch Glukoneogenese in der Leber und Rückführung in den Kreislauf; siehe Cori-Zyklus
- Bei hohen Blutzuckerkonzentrationen kann die Glukose zum Aufbau von Glykogenspeichern in der Leber verwendet werden. ⓘ
Allerdings wird in Ruhe und bei allen Belastungsintensitäten kontinuierlich Laktat gebildet. George Brooks und Kollegen von der University of California, Berkeley, haben mit Hilfe von stabilen Isotopen-Tracern beobachtet, dass Laktat als metabolischer Brennstoff dient, der im ruhenden und trainierenden Muskel produziert und oxidativ entsorgt wird. Einige Ursachen hierfür sind der Stoffwechsel in roten Blutkörperchen, denen Mitochondrien fehlen, und Einschränkungen aufgrund der Enzymaktivität, die in Muskelfasern mit hoher glykolytischer Kapazität auftreten. ⓘ
Im Jahr 2004 behaupteten Robergs et al., dass die Laktatazidose während des Trainings ein "Konstrukt" oder ein Mythos sei, und wiesen darauf hin, dass ein Teil des H+ aus der ATP-Hydrolyse stammt (ATP4- + H2O → ADP3- + HPO2-
4 + H+), und dass die Reduktion von Pyruvat zu Laktat (Pyruvat- + NADH + H+ → Laktat- + NAD+) tatsächlich H+ verbraucht. Lindinger et al. entgegneten, dass sie die ursächlichen Faktoren für den Anstieg von [H+] außer Acht gelassen hätten. Schließlich muss die Produktion von Laktat aus einem neutralen Molekül den [H+]-Wert erhöhen, um die Elektroneutralität zu erhalten. In der Arbeit von Robergs ging es jedoch darum, dass Laktat aus Pyruvat hergestellt wird, das die gleiche Ladung hat. Bei der Herstellung von Pyruvat aus neutraler Glukose entsteht H+:
| C6H12O6 + 2 NAD+ + 2 ADP3- + 2 HPO2- 4 |
→ | 2 CH 3COCO- 2 + 2 H+ + 2 NADH + 2 ATP4- + 2 H2O ⓘ | |
| Die anschließende Laktatproduktion absorbiert diese Protonen: | |||
| 2 CH 3COCO- 2 + 2 H+ + 2 NADH |
→ | 2 CH 3CH(OH)CO- 2 + 2 NAD+ | |
| Insgesamt: | |||
| C6H12O6 + 2 NAD+ + 2 ADP3- + 2 HPO2- 4 |
→ | 2 CH 3COCO- 2 + 2 H+ + 2 NADH + 2 ATP4- + 2 H2O | |
| → | 2 CH 3CH(OH)CO- 2 + 2 NAD+ + 2 ATP4- + 2 H2O | ||
Bei der Reaktion Glukose → 2 Laktat- + 2 H+ werden zwar allein betrachtet zwei H+ freigesetzt, die H+ werden jedoch bei der ATP-Produktion absorbiert. Andererseits wird die absorbierte Säure bei der anschließenden Hydrolyse von ATP freigesetzt: ATP4- + H2O → ADP3- + HPO2-
4 + H+. Wenn man also die Verwendung von ATP mit einbezieht, lautet die Gesamtreaktion
- C6H12O6 → 2 CH
3COCO-
2 + 2 H+ ⓘ
Die Erzeugung von CO2 während der Atmung führt auch zu einem Anstieg von [H+]. ⓘ
Energiequelle des Nervengewebes
Obwohl man normalerweise davon ausgeht, dass Glukose die Hauptenergiequelle für lebendes Gewebe ist, gibt es einige Berichte, die darauf hindeuten, dass Laktat und nicht Glukose bevorzugt von den Neuronen im Gehirn mehrerer Säugetierarten (vor allem von Mäusen, Ratten und Menschen) verstoffwechselt wird. Nach der Laktat-Shuttle-Hypothese sind die Gliazellen für die Umwandlung von Glukose in Laktat und für die Versorgung der Neuronen mit Laktat verantwortlich. Aufgrund dieser lokalen Stoffwechselaktivität der Gliazellen unterscheidet sich die extrazelluläre Flüssigkeit, die die Neuronen unmittelbar umgibt, in ihrer Zusammensetzung stark von der des Blutes oder der Liquorflüssigkeit und ist viel reicher an Laktat, wie in Mikrodialysestudien festgestellt wurde. ⓘ
Stoffwechsel in der Gehirnentwicklung
Einiges deutet darauf hin, dass Laktat in frühen Entwicklungsstadien für den Stoffwechsel des Gehirns bei pränatalen und frühen postnatalen Probanden wichtig ist, wobei Laktat in diesen Stadien höhere Konzentrationen in den Körperflüssigkeiten aufweist und vom Gehirn vorzugsweise gegenüber Glukose verwertet wird. Es wurde auch die Hypothese aufgestellt, dass Laktat eine starke Wirkung auf die GABA-ergen Netzwerke im sich entwickelnden Gehirn ausübt und diese hemmender macht als bisher angenommen, entweder durch eine bessere Unterstützung der Metaboliten oder durch Veränderungen des intrazellulären pH-Wertes oder durch beides. ⓘ
Studien an Hirnschnitten von Mäusen zeigen, dass β-Hydroxybutyrat, Laktat und Pyruvat als oxidative Energiesubstrate wirken und eine Erhöhung der NAD(P)H-Oxidationsphase bewirken, dass Glukose als Energieträger während intensiver synaptischer Aktivität unzureichend war und schließlich, dass Laktat ein effizientes Energiesubstrat sein kann, das in der Lage ist, den aeroben Energiestoffwechsel des Gehirns in vitro aufrechtzuerhalten und zu verbessern. Die Studie "liefert neue Daten über biphasische NAD(P)H-Fluoreszenz-Transienten, eine wichtige physiologische Reaktion auf neuronale Aktivierung, die in vielen Studien reproduziert wurde und von der man annimmt, dass sie hauptsächlich von aktivitätsbedingten Konzentrationsänderungen der zellulären NADH-Pools herrührt." ⓘ
Laktat kann auch als wichtige Energiequelle für andere Organe, einschließlich Herz und Leber, dienen. Bei körperlicher Betätigung stammen bis zu 60 % des Energieumsatzes des Herzmuskels aus der Laktatoxidation. ⓘ
Blutuntersuchungen

Blutuntersuchungen auf Laktat werden durchgeführt, um den Zustand der Säure-Basen-Homöostase im Körper zu bestimmen. Die Blutentnahme zu diesem Zweck erfolgt häufig arteriell (auch wenn dies schwieriger ist als eine Venenpunktion), da sich die Laktatwerte zwischen arteriellen und venösen Werten erheblich unterscheiden und der arterielle Wert für diesen Zweck repräsentativer ist. ⓘ
| Untere Grenze | Oberer Grenzwert | Einheit | |
|---|---|---|---|
| Venös | 4.5 | 19.8 | mg/dL |
| 0.5 | 2.2 | mmol/L | |
| Arteriell | 4.5 | 14.4 | mg/dL |
| 0.5 | 1.6 | mmol/L |
Während der Geburt kann der Laktatspiegel des Fötus durch eine fetale Kopfhautblutuntersuchung quantifiziert werden. ⓘ
Polymer-Vorläufer
Zwei Milchsäuremoleküle können zu dem Lacton Lactid dehydriert werden. In Anwesenheit von Katalysatoren polymerisiert Lactid entweder zu ataktischem oder syndiotaktischem Polylactid (PLA), das zu den biologisch abbaubaren Polyestern gehört. PLA ist ein Beispiel für einen Kunststoff, der nicht aus Petrochemikalien gewonnen wird. ⓘ
Pharmazeutische und kosmetische Anwendungen
Milchsäure wird auch in der pharmazeutischen Technologie eingesetzt, um aus ansonsten unlöslichen Wirkstoffen wasserlösliche Laktate herzustellen. Darüber hinaus wird sie in topischen Präparaten und Kosmetika zur Regulierung des Säuregehalts sowie aufgrund ihrer desinfizierenden und keratolytischen Eigenschaften verwendet. ⓘ
Lebensmittel
Milchsäure ist vor allem in Sauermilchprodukten wie Kumis, Laban, Joghurt, Kefir und einigen Hüttenkäsesorten enthalten. Das Kasein in fermentierter Milch wird durch Milchsäure zum Gerinnen gebracht (geronnen). Milchsäure ist auch für den sauren Geschmack von Sauerteigbrot verantwortlich. ⓘ
In Listen mit Nährwertangaben kann Milchsäure unter dem Begriff "Kohlenhydrate" (oder "Kohlenhydrate nach Unterschieden") aufgeführt werden, da dies oft alles andere als Wasser, Eiweiß, Fett, Asche und Ethanol umfasst. Wenn dies der Fall ist, kann die berechnete Nahrungsenergie die standardmäßigen 4 Kilokalorien (17 kJ) pro Gramm verwenden, die häufig für alle Kohlenhydrate verwendet werden. In einigen Fällen wird die Milchsäure bei der Berechnung jedoch nicht berücksichtigt. Die Energiedichte von Milchsäure beträgt 362 Kilokalorien (1.510 kJ) pro 100 g. ⓘ
Einige Biere (Sauerbiere) enthalten absichtlich Milchsäure, z. B. belgische Lambics. Meistens wird diese auf natürliche Weise von verschiedenen Bakterienstämmen produziert. Diese Bakterien vergären Zucker zu Säuren, im Gegensatz zu den Hefen, die Zucker zu Ethanol vergären. Nach dem Abkühlen der Würze können Hefe und Bakterien in die offenen Gärbehälter "fallen". Die Brauer gängigerer Bierstile stellen sicher, dass keine derartigen Bakterien in den Gärbehälter gelangen können. Andere saure Biersorten sind Berliner Weiße, Flanders Red und American Wild Ale. ⓘ
Bei der Weinherstellung wird häufig ein natürlicher oder kontrollierter bakterieller Prozess eingesetzt, um die natürlich vorhandene Apfelsäure in Milchsäure umzuwandeln, um die Schärfe zu verringern und aus anderen geschmacklichen Gründen. Diese malolaktische Gärung wird von Milchsäurebakterien durchgeführt. ⓘ
Obwohl sie normalerweise nicht in nennenswerten Mengen in Obst vorkommt, ist Milchsäure die wichtigste organische Säure in Akebia-Früchten und macht 2,12 % des Saftes aus. ⓘ
Als Lebensmittelzusatzstoff ist sie in der EU, den USA sowie in Australien und Neuseeland zugelassen; sie ist unter der INS-Nummer 270 oder als E-Nummer E270 aufgeführt. Milchsäure wird als Lebensmittelkonservierungsmittel, Pökelmittel und Aromastoff verwendet. Sie ist eine Zutat in verarbeiteten Lebensmitteln und wird als Dekontaminationsmittel bei der Fleischverarbeitung verwendet. Milchsäure wird kommerziell durch Fermentation von Kohlenhydraten wie Glukose, Saccharose oder Laktose oder durch chemische Synthese hergestellt. Zu den Kohlenhydratquellen gehören Mais, Rüben und Rohrzucker. ⓘ
Fälschung
Milchsäure wurde in der Vergangenheit verwendet, um die Tinte von amtlichen Papieren zu entfernen, die durch Fälschung verändert werden sollten. ⓘ
Reinigungsmittel
Milchsäure wird in einigen Flüssigreinigern als Entkalkungsmittel verwendet, um harte Wasserablagerungen wie Kalziumkarbonat zu entfernen, wobei das Laktat Calciumlaktat entsteht. Aufgrund ihres hohen Säuregehalts werden solche Ablagerungen sehr schnell beseitigt, vor allem wenn kochendes Wasser verwendet wird, wie in Wasserkochern. Auch in antibakteriellen Geschirrspülmitteln und Handseifen, die Triclosan ersetzen, wird es immer beliebter. ⓘ
Eigenschaften
Milchsäure ist in Form von Lactat ein wichtiges Zwischenprodukt im Stoffwechsel, zum Beispiel als Produkt beim Abbau von Zuckern durch die Milchsäuregärung. Weltweit werden jährlich etwa 250.000 Tonnen (Stand 2010) Milchsäure industriell produziert, die vor allem in der Lebensmittelindustrie sowie zur Herstellung von Polylactiden (PLA; auch: Polymilchsäuren) genutzt werden. ⓘ
Der spezifische Drehwinkel beträgt für D-Milchsäure bei 20 °C [α]D20 = −2,6 (H2O) und für L-Milchsäure [α]D20 = +2,6 (H2O). Bei 15 °C wird für L-Milchsäure ein Drehwinkel [α]D15 = +3,82 (H2O) gemessen. ⓘ
Milchsäure bildet intermolekular Ester. Unter Abspaltung von Wasser entsteht als Dimer Lactoylmilchsäure, die beim längeren Stehen oder beim Erhitzen zu Polymilchsäure weiterverestert. Diese Makromoleküle erreichen jedoch keine relevanten Kettenlängen, um das Produkt technisch verwerten zu können. ⓘ
In wässriger Milchsäurelösung liegt ein chemisches Gleichgewicht zwischen Milchsäure und ihren durch intermolekulare Wasserabspaltung entstehenden Polyester (Estoliden) vor. In 90%iger Milchsäurelösung findet man etwa 70 % als freie Säure und 20 % als ihre Estolide vor. Aus zwei Milchsäuremolekülen entstehen unter Ringschluss und Abspaltung von zwei Wassermolekülen Dilactid mit einem sechsgliedrigen Ring (Dilacton). Diese Verbindung wird in wässriger Milchsäurelösung jedoch nicht beobachtet. Aus Dilactiden lassen sich mittels Ringöffnungspolymerisation hochwertige Polyester erzeugen. Der entstehende Kunststoff ist biologisch abbaubar und zudem immunologisch neutral. ⓘ
Isomerie
Aufgrund ihrer unterschiedlichen optischen Aktivität wird die D-(−)-Milchsäure (Syn.: (R)-Milchsäure) auch als linksdrehende Milchsäure und die L-(+)-Milchsäure (Syn.: (S)-Milchsäure) auch als rechtsdrehende Milchsäure bezeichnet. Racemische Milchsäure ist ein 1:1-Gemisch aus (R)- und (S)-Milchsäure. ‚L‘ steht für lateinisch laevus = „links liegend“, ‚D‘ für lateinisch dexter = „rechts“. ⓘ
| Isomere von Milchsäure ⓘ | ||
| Name | L-Milchsäure | D-Milchsäure |
| Andere Namen | (S)-Milchsäure (+)-Milchsäure Fleischmilchsäure |
(R)-Milchsäure (−)-Milchsäure |
| Strukturformel |  |
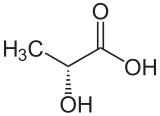
|
| CAS-Nummer | 79-33-4 | 10326-41-7 |
| 50-21-5 (unspez.) | ||
| EG-Nummer | 201-196-2 | 233-713-2 |
| 200-018-0 (unspez.) | ||
| ECHA-Infocard | 100.001.088 | 100.030.636 |
| 100.000.017 (unspez.) | ||
| PubChem | 107689 | 61503 |
| 612 (unspez.) | ||
| Wikidata | Q27080955 | Q27077083 |
| Q161249 (unspez.) | ||
Vorkommen

L-(+)-Milchsäure kommt in Schweiß, Blut, Speichel sowie im Muskelserum, in der Niere und Galle vor. Das Racemat, eine 1:1-Mischung aus D- und L-Milchsäure, findet sich z. B. in Sauermilch- und Molkeprodukten, Tomatensaft und Bier. Bei allen Produkten, die per Milchsäuregärung haltbar gemacht werden, ist der Anteil der beiden Enantiomeren abhängig vom verwendeten Bakterienstamm und den Reaktionsbedingungen. ⓘ
Auch Pilze erzeugen Milchsäure, z. B. Vertreter der Gattungen Rhizopodus, Allomyces und Blastocladiella. ⓘ
Verwendung
Ernährung, Futter- und Genussmittel

Eine Reihe von Lebensmitteln werden direkt durch Milchsäuregärung hergestellt. Darunter fallen vor allem die Sauermilchprodukte wie Sauermilch, Joghurt, Kefir und Buttermilch. Diese werden durch Infektion von pasteurisierter Milch mit Starterkulturen der Milchsäurebakterien hergestellt. Weitere Produkte sind lactofermentierte Gemüse wie Sauerkraut, rote Bete in einigen Borschtsch-Varianten oder Kimchi sowie Sauerteig und entsprechend Sauerteigprodukte. Auch Silagen, durch Vergärung haltbar gemachte Frischfuttermittel, basieren auf der Milchsäuregärung. ⓘ
Als Lebensmittelzusatzstoff trägt Milchsäure die Bezeichnung E 270. Sie wird in der Lebens- und Genussmittelindustrie vielfältig als Säuerungsmittel eingesetzt, so etwa in Backwaren, Süßwaren und vereinzelt auch in Limonaden. Durch die Änderung des pH-Wertes in den Lebensmitteln auf einen pH von etwa 4 kommt es zu einer Konservierung der Lebensmittel, da eine Besiedlung mit anderen Mikroorganismen weitgehend ausgeschlossen wird. ⓘ
Bierbrauer schätzen Milchsäure beim Brauwasser als pH-senkend. Dies ist besonders der Fall bei hellen Bieren, bei denen das Malz weniger säuernde Eigenschaften hat. Hier wird oft mit Milchsäurebakterien behandeltes Sauermalz eingesetzt, um dem Reinheitsgebot zu entsprechen. Auch darf die Maische und die Bierwürze mit Milchsäurebakterien direkt angereichert werden. Biologisch hergestellte Milchsäure ist also zulässig, technisch erzeugte dagegen nicht. Die Einhaltung des deutschen Reinheitsgebotes erfordert deshalb zusätzlichen Herstellungsaufwand zur Fermentation. ⓘ
In Form der Salze Calciumlactat oder Calciumlactatgluconat kann sie zudem zur Calciumanreicherung zugesetzt werden. ⓘ
Stoffliche Nutzung
Milchsäure ist das Monomer der Polylactide bzw. Polymilchsäuren (PLA), die als biologisch abbaubare und bio-basierte Kunststoffe vielfältige Verwendung finden. ⓘ
Milchsäure wirkt antibakteriell und wird deshalb Flüssigseifen, Reinigern und Geschirrspülmitteln zugegeben. Die Desinfektionswirkung entfaltet sie optimal bei einem pH-Wert von 3 bis 4. Sie wurde und wird auch als Mittel zur Schwangerschaftsverhütung eingesetzt. ⓘ
Milchsäure wird als Kalklöser in der Gerberei zum Entkalken von Häuten verwendet. Auch in der Textilindustrie und der Druckerei wird sie hierzu eingesetzt. Manche Reinigungstabs für Kaffeemaschinen, Trinkwassersprudler und ähnliche Geräte enthalten Milchsäure als Kalklöser. ⓘ
Imker nutzen Milchsäure zur Behandlung von Bienen gegen die Varroamilbe, wobei darauf zu achten ist, dass die behandelten Bienenstöcke bzw. Waben brutfrei sind. Arachnologen verwenden Milchsäure, um die präparierte Epigyne von Spinnenweibchen oder andere Chitinstrukturen aufzuhellen und um Gewebereste aufzulösen. ⓘ
Die Pharmazeutische Technologie nutzt Milchsäure, um wasserunlösliche Arzneistoffe in Salze der Milchsäure (Lactate) umzuwandeln; diese sind besser wasserlöslich (Beispiel: Ciprofloxacin). ⓘ
In der Kosmetik wird Milchsäure in Hautcremes und anderen Produkten zur Behandlung von Akne genutzt. ⓘ
Physiologie
Bei starker Betätigung der Skelettmuskulatur kann es zum Anstieg des Blut-Lactatgehaltes von 5 mg/dl auf 100 mg/dl kommen. Die Ursache ist, dass bei anaeroben Bedingungen, wie beispielsweise bei schneller Betätigung der Skelettmuskulatur, Energie in Form von NAD+ aus der Reduktion von Pyruvat mittels der Lactatdehydrogenase für die Fortführung der Glykolyse gewonnen werden muss. Die dabei anfallende Milchsäure (Lactat und H+) wird über den Monocarboxylat-Transporter 1 aus den Zellen geschwemmt. Dieser Vorgang wurde früher als Ursache des Muskelkaters verstanden, jedoch wird diese Theorie heute größtenteils als falsch betrachtet. ⓘ
Für den Menschen ist die rechtsdrehende L-(+)-Milchsäure die physiologische. Oral eingenommen wird sie im Organismus schneller abgebaut als die linksdrehende D-(−)-Milchsäure. ⓘ



