Blasenkrebs
| Harnblasenkrebs ⓘ | |
|---|---|
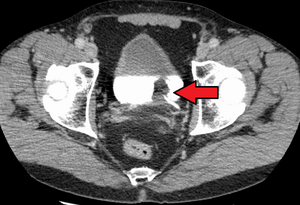 | |
| Übergangszellkarzinom der Harnblase. Das Weiße in der Blase ist der Kontrast. | |
| Fachgebiet | Onkologie, Urologie |
| Symptome | Blut im Urin, Schmerzen beim Wasserlassen |
| Übliches Auftreten | 65 bis 84 Jahre alt |
| Arten | Übergangszellkarzinom, Plattenepithelkarzinom, Adenokarzinom |
| Risikofaktoren | Rauchen, familiäre Vorbelastung, vorherige Strahlentherapie, häufige Blaseninfektionen, bestimmte Chemikalien |
| Diagnostische Methode | Zystoskopie mit Gewebeentnahme |
| Behandlung | Operation, Strahlentherapie, Chemotherapie, Immuntherapie |
| Prognose | Fünf-Jahres-Überlebensrate ~77% (US) |
| Häufigkeit | 549.000 neue Fälle (2018) |
| Todesfälle | 200,000 (2018) |
Blasenkrebs ist eine von mehreren Krebsarten, die von den Geweben der Harnblase ausgehen. Zu den Symptomen gehören Blut im Urin, Schmerzen beim Wasserlassen und Schmerzen im unteren Rückenbereich. Er entsteht, wenn Epithelzellen, die die Harnblase auskleiden, bösartig werden. ⓘ
Zu den Risikofaktoren für Blasenkrebs gehören Rauchen, familiäre Vorbelastung, frühere Strahlentherapie, häufige Blaseninfektionen und der Kontakt mit bestimmten Chemikalien. Die häufigste Form ist das Übergangszellkarzinom. Andere Arten sind Plattenepithelkarzinome und Adenokarzinome. Die Diagnose wird in der Regel durch eine Blasenspiegelung mit Gewebebiopsien gestellt. Die Stadieneinteilung des Krebses wird durch transurethrale Resektion und medizinische Bildgebung bestimmt. ⓘ
Die Behandlung richtet sich nach dem Stadium des Krebses. Sie kann eine Kombination aus Operation, Strahlentherapie, Chemotherapie oder Immuntherapie umfassen. Zu den chirurgischen Optionen gehören die transurethrale Resektion, die teilweise oder vollständige Entfernung der Blase oder eine Harnableitung. Die typische Fünf-Jahres-Überlebensrate liegt in den Vereinigten Staaten bei 77 %, in Kanada bei 75 % und in Europa bei 68 %. ⓘ
Im Jahr 2018 waren weltweit etwa 1,6 Millionen Menschen von Blasenkrebs betroffen, mit 549.000 Neuerkrankungen und 200.000 Todesfällen. Das Erkrankungsalter liegt in den meisten Fällen zwischen 65 und 84 Jahren. Männer sind häufiger betroffen als Frauen. Im Jahr 2018 trat die höchste Rate an Blasenkrebs in Süd- und Westeuropa auf, gefolgt von Nordamerika mit Raten von 15, 13 und 12 Fällen pro 100.000 Menschen. Die höchsten Raten an Todesfällen durch Blasenkrebs wurden in Nordafrika und Westasien beobachtet, gefolgt von Südeuropa. ⓘ
| Klassifikation nach ICD-10 | |
|---|---|
| C67 | Bösartige Neubildung der Harnblase |
| D09.0 | Carcinoma in situ der Harnblase |
| ICD-10 online (WHO-Version 2019) | |
Als Blasenkrebs (Blasenkarzinom) werden allgemein von der Harnblase ausgehende bösartige Geschwülste (bösartige Tumoren) bezeichnet. Als ursächlich für die Entstehung von Blasenkrebs gelten chronische Entzündungen (einschließlich Parasiteninfektionen), Tabakkonsum, die Aufnahme bestimmter chemischer Substanzen (beispielsweise aromatische Amine wie 2-Naphthylamin), Strahlenexposition und abwehrunterdrückende Medikamente. Behandelt wird der Harnblasenkrebs je nach Ausdehnung mit einer transurethralen Resektion der Harnblase (TUR-B), der kompletten Entfernung der Blase, einer lokalen Chemotherapie oder auch einer Strahlentherapie in Kombination mit einer systemischen Chemotherapie. Die Heilungsaussichten sind bei früh entdecktem Krebsleiden gut, bei bereits ausgedehnter Erkrankung mit Metastasen jedoch gering. ⓘ
Anzeichen und Symptome
Charakteristisch für Blasenkrebs ist Blut im Urin, das sichtbar oder nur unter dem Mikroskop nachweisbar sein kann. Blut im Urin ist das häufigste Symptom bei Blasenkrebs und ist schmerzlos. Sichtbares Blut im Urin kann nur von kurzer Dauer sein, und zur Bestätigung von nicht sichtbarem Blut kann ein Urintest erforderlich sein. Zwischen 80 und 90 % der Menschen mit Blasenkrebs weisen anfangs sichtbares Blut auf. Blut im Urin kann auch durch andere Erkrankungen verursacht werden, z. B. durch Blasen- oder Harnleitersteine, Infektionen, Nierenerkrankungen, Nierenkrebs oder Gefäßfehlbildungen, obwohl diese Erkrankungen (außer Nierenkrebs) in der Regel schmerzhaft sind. ⓘ
Weitere mögliche Symptome sind Schmerzen beim Wasserlassen, häufiges Wasserlassen oder das Gefühl, urinieren zu müssen, ohne es tun zu können. Diese Anzeichen und Symptome sind nicht spezifisch für Blasenkrebs und können auch durch andere Erkrankungen als Krebs verursacht werden, z. B. Prostata-Infektionen, überaktive Blase oder Zystitis. Einige seltene Formen von Blasenkrebs wie das Adenokarzinom der Harnblase produzieren Muzin, das dann mit dem Urin ausgeschieden wird und diesen dickflüssig macht. ⓘ
Menschen mit fortgeschrittener Erkrankung können Schmerzen im Becken oder in den Knochen, Schwellungen in den unteren Gliedmaßen oder Flankenschmerzen haben. In seltenen Fällen kann bei der körperlichen Untersuchung eine tastbare Masse festgestellt werden. ⓘ
Ursachen
In den meisten Bevölkerungsgruppen wird das Rauchen mit mehr als der Hälfte der Blasenkrebsfälle bei Männern und einem Drittel der Fälle bei Frauen in Verbindung gebracht. Diese Anteile sind jedoch in den letzten Jahren zurückgegangen, da es in Europa und Nordamerika weniger Raucher gibt. Es besteht ein nahezu linearer Zusammenhang zwischen der Dauer des Rauchens (in Jahren), der Anzahl der Packungen und dem Blasenkrebsrisiko. Ein Risikoplateau ist bei etwa 15 Zigaretten pro Tag zu beobachten (d. h., wer 15 Zigaretten pro Tag raucht, hat ungefähr das gleiche Risiko wie jemand, der 30 Zigaretten pro Tag raucht). Rauchen (Zigarre, Pfeife, ägyptische Wasserpfeife und rauchloser Tabak) in jeder Form erhöht das Risiko für Blasenkrebs. Der Verzicht auf das Rauchen verringert das Risiko. Das Risiko, an Blasenkrebs zu erkranken, sinkt innerhalb von 1-4 Jahren um 30 % und nimmt auch 25 Jahre nach dem Rauchstopp noch um 60 % ab. Ehemalige Raucher werden jedoch höchstwahrscheinlich immer ein höheres Risiko für Blasenkrebs haben als Menschen, die nie geraucht haben. Auch Passivrauchen scheint ein Risiko darzustellen. ⓘ
Opiumkonsum erhöht das Risiko für Blasenkrebs um das Dreifache, und der gleichzeitige Konsum von Opium und Rauchen erhöht das Risiko für Blasenkrebs im Vergleich zur Allgemeinbevölkerung um das Fünffache. ⓘ
Dreißig Prozent der Blasentumore sind wahrscheinlich auf eine berufsbedingte Exposition am Arbeitsplatz gegenüber Karzinogenen zurückzuführen. Die berufliche oder indirekte Exposition gegenüber den folgenden Stoffen wurde als Ursache für Blasenkrebs in Betracht gezogen; Benzidin (Farbstoffherstellung), 4-Aminobiphenyl (Gummiindustrie), 2-Naphtylamin (Azofarbstoffherstellung, Gießereidämpfe, Gummiindustrie, Zigarettenrauch und Krebsforschung), Phenacetin (Analgetikum), Arsen und chlorierte aliphatische Kohlenwasserstoffe im Trinkwasser, Auramin (Farbstoffherstellung), Magenta (Farbstoffherstellung), Ortho-Toluidin (Farbstoffherstellung), Epoxid- und Polyurethanharzhärter (Kunststoffindustrie), Chlornaphazin, Steinkohlenteerpech. Zu den gefährdeten Berufen gehören Busfahrer, Gummiarbeiter, Maler, Kfz-Mechaniker, Lederarbeiter (einschließlich Schuhhersteller), Schmiede, Maschineneinrichter und Mechaniker. Auch Friseure gelten als gefährdet, da sie häufig mit permanenten Haarfärbemitteln arbeiten. ⓘ
Eine Infektion mit Schistosoma haematobium (Bilharziose oder Schistosomiasis) kann Blasenkrebs verursachen, insbesondere Plattenepithelkarzinome. Die Schistosoma-Eier lösen einen chronischen Entzündungszustand in der Blasenwand aus, der zu einer Gewebefibrose führt. In Urinproben von Menschen mit Schistosomiasis wurde ein erhöhter Gehalt an N-Nitroso-Verbindungen nachgewiesen. N-Nitroso-Verbindungen werden mit der Entstehung von durch Bilharziose verursachtem Blasenkrebs in Verbindung gebracht. Sie verursachen Alkylierungs-DNA-Schäden, insbesondere Guanin-Adenin-Übergangsmutationen im HRAS- und p53-Tumorsuppressor-Gen. Mutationen von p53 werden in 73 % der Tumoren nachgewiesen, BCL-2-Mutationen in 32 % und eine Kombination aus beiden in 13 %. Weitere Ursachen für Plattenepithelkarzinome der Blase sind chronische Katheterisierungen bei Menschen mit einer Rückenmarksverletzung und eine Behandlung mit Cyclophosphamid in der Vergangenheit. ⓘ
Die Einnahme von Aristolochiasäure, die in vielen chinesischen Kräutermitteln enthalten ist, kann nachweislich Urothelkarzinome und Nierenversagen verursachen. Aristolochiasäure aktiviert die Peroxidase im Urothel und verursacht eine Transversionsmutation im Tumorsuppressorgen TP53. ⓘ
Personen, die sich wegen Prostatakrebs einer externen Strahlentherapie (EBRT) unterziehen, haben ein höheres Risiko, an invasivem Blasenkrebs zu erkranken. ⓘ
Neben diesen Hauptrisikofaktoren gibt es noch zahlreiche andere veränderbare Faktoren, die weniger stark (d. h. 10-20 % Risikoerhöhung) mit Blasenkrebs assoziiert sind, z. B. Fettleibigkeit. Auch wenn diese als geringfügige Auswirkungen betrachtet werden könnten, ließe sich das Risiko in der Allgemeinbevölkerung dennoch senken, indem man die Prävalenz einer Reihe kleinerer Risikofaktoren zusammen reduziert. ⓘ
Tabakrauchen ist der wichtigste Risikofaktor für Blasenkrebs, was in der Öffentlichkeit nicht allgemein bekannt ist. In einer Befragung urologischer Patienten gaben zwar fast alle einen Zusammenhang zwischen Rauchen und Lungenkrebs an, aber nur 34 % wussten, dass Blasenkrebs durch Rauchen verursacht werden kann. Die Menge der insgesamt konsumierten Tabakprodukte korreliert dabei linear mit dem Risiko, an einem Harnblasenkarzinom zu erkranken. Es erhöht sich je nach Konsumverhalten und -dauer um das Zwei- bis Sechsfache. Als Ursache wird das Vorkommen aromatischer Amine wie des 2-Naphthylamin im Rauch angesehen. Ob das Beenden eines Nikotinmissbrauchs nach dem Auftreten des Krebses die Prognose der Erkrankung verbessern oder ein Wiederauftreten verhindern kann, ist bisher (2002) noch nicht abschließend geklärt. ⓘ
Laut einer Studie aus dem Jahr 2011 ist Tabakrauchen bei Männern für 50 Prozent und bei Frauen für 52 Prozent aller Blasenkrebserkrankungen verantwortlich. Für aktive Raucher wurde ein 4-fach erhöhtes, für ehemalige Raucher ein 2,2-fach erhöhtes Risiko einer Erkrankung errechnet. ⓘ
Aromatische Amine
Der Kontakt zu aromatischen Aminen (2-Naphthylamin, Benzidin) ist der am längsten bekannte Risikofaktor. In zahlreichen Berufen ist der Kontakt zu solchen krebsverursachenden Stoffen möglich und Blasenkrebs als Berufskrankheit anerkannt. Dazu zählen Arbeiter in der Chemie-, Stahl- und Lederindustrie, Automechaniker sowie Zahntechniker und Friseure. Die aromatischen Amine werden in der Leber durch Kopplung mit Hydroxygruppen und Glucuronsäure wasserlöslich gemacht, damit der Körper sie im Urin ausscheiden kann. Dabei entwickeln sie allerdings eine krebserregende Potenz. Aromatische Amine können durch das Enzym N-Acetyltransferase inaktiviert werden. Dabei haben einige Menschen, bei denen aufgrund eines genetischen Polymorphismus eine höhere Aktivität des Enzyms entsteht, ein geringeres Risiko, an Harnblasenkrebs zu erkranken. Laut einer spanischen Studie sind diese Polymorphismen so weit verbreitet, dass sie bei rund 31 % der Blasenkrebserkrankungen eine Rolle spielen könnten. ⓘ
Chronische Entzündungen
Chronische Entzündungen im Bereich der Blase erhöhen ebenso das Risiko für eine bösartige Neubildung. Dazu zählen langjährige Blasensteinleiden und chronische Harnwegsinfekte. In Afrika und Teilen der arabischen Welt ist die durch Parasiten ausgelöste Schistosomiasis ein wichtiger Risikofaktor für das Entstehen von Blasenkrebs. Durch Entzündungen ausgelöste Karzinome sind in der Regel Plattenepithelkarzinome. Als Ursache wird eine Bildung von Nitrosaminen im Rahmen der Entzündungsreaktion angenommen. ⓘ
Bestrahlung
Ebenso ist eine Strahlentherapie im Beckenbereich ein Risikofaktor für ein Blasenkarzinom. ⓘ
Medikamente
Weitere iatrogene Risikofaktoren stellen einige Medikamente dar. Chlornaphazin, ein Mittel zur Behandlung der Polycythaemia vera, und Phenacetin, ein Schmerzmedikament, fördern die Bildung von Harnblasenkrebs. Der erstgenannte Wirkstoff ist seit 1963 nicht mehr im Handel, der zweitgenannte wurde 1983 vom Markt genommen. Als weiteres Medikament kann das Immunsuppressivum Cyclophosphamid eine hämorrhagische Zystitis auslösen und dadurch Blasenkrebs begünstigen. Bei korrekter Anwendung zusammen mit dem Wirkstoff Mesna ist das Krebsrisiko allerdings vernachlässigbar gering. Das Zytostatikum Chlornaphazin, welches bis 1963 bei der Behandlung der Polycythaemia vera eingesetzt wurde, löste bei rund einem Drittel der behandelten Patienten Harnblasenkarzinome aus. ⓘ
Auch das orale Antidiabetikum Pioglitazon steht im Verdacht, Blasenkrebs auslösen zu können. Die US-amerikanische Food and Drug Administration veröffentlichte 2011 und 2016 aktualisierte Sicherheitsinformationen, die auf das potentielle Risiko hinweisen. ⓘ
Süßungsmittel
Künstliche Süßungsmittel wie Saccharin und Cyclamat haben in Tierversuchen nachweislich das Auftreten von Harnblasenkrebs erhöht. Die Wirkung beim Menschen ist umstritten, da die Mehrheit der Studien am Menschen diesen Effekt nicht nachgewiesen hat. Zudem sind die Studien im Tierversuch insoweit nicht relevant, als die Substanzen mit einer Kanüle direkt in die Blase injiziert wurden. Die beobachteten Tumoren sind eher mit der Penetration der Nadeln zu assoziieren als mit dem Süßungsmittel. Auch zum Konsum von Kaffee ist die Forschungslage bisher nicht eindeutig. ⓘ
Wasser
Eine spanische Fallkontrollstudie kam zu dem Ergebnis, dass chloriertes Wasser das Risiko für Blasenkrebs erhöhe. Demnach haben Menschen, die chloriertes Wasser tranken, ein um 35 Prozent erhöhtes Risiko auf Blasenkrebs. Schwimmen im Chlorwasser steigere die Gefahr sogar um 57 Prozent. Studien mit großer Fallzahl aus der Volksrepublik China und der Republik China (Taiwan) kamen zu dem Ergebnis, dass Arsenkontaminationen im Trinkwasser das Risiko für Blasenkrebs steigerten. ⓘ
Ernährung
Statistisch hat ein hoher Gesamtverzehr von Obst einen leicht schützenden Effekt gegen Blasenkrebs. Der genaue Mechanismus, über den diese Schutzwirkung erfolgt, ist bisher aber noch nicht aufgeklärt. Ein schützender Effekt von Vitamin E wird in der Literatur debattiert, ist allerdings nicht belegt. ⓘ
Genetik
Mutationen in den Genen FGFR3, TP53, PIK3CA, KDM6A, ARID1A, KMT2D, HRAS, TERT, KRAS, CREBBP, RB1 und TSC1 können mit einigen Fällen von Blasenkrebs in Verbindung gebracht werden. Deletionen von Teilen oder des gesamten Chromosoms 9 sind bei Blasenkrebs häufig. Es ist bekannt, dass bei niedriggradigem Krebs Mutationen im RAS-Signalweg und im Fibroblasten-Wachstumsfaktor-Rezeptor 3 (FGFR3)-Gen auftreten, die beide eine Rolle im MAPK/ERK-Signalweg spielen. p53- und RB-Genmutationen werden bei hochgradigen muskelinvasiven Tumoren vermutet. Neunundachtzig Prozent der invasiven Muskeltumoren weisen Mutationen in Genen auf, die das Chromatin umbauen und den Histon modifizieren. Die Deletion beider Kopien des GSTM1-Gens erhöht das Risiko für Blasenkrebs nur geringfügig. Das GSTM1-Genprodukt, die Glutathion-S-Transferase M1 (GSTM1), ist am Entgiftungsprozess von Karzinogenen wie den im Zigarettenrauch enthaltenen polyzyklischen aromatischen Kohlenwasserstoffen beteiligt. In ähnlicher Weise werden Mutationen in NAT2 (N-Acetyltransferase) mit einem erhöhten Risiko für Blasenkrebs in Verbindung gebracht. N-Acetyltransferase hilft bei der Entgiftung von Karzinogenen wie aromatischen Aminen (die auch im Zigarettenrauch enthalten sind). Verschiedene Einzelnukleotid-Polymorphismen im PSCA-Gen auf Chromosom 8 haben nachweislich das Risiko für Blasenkrebs erhöht. Die Promotorregion des PSCA-Gens weist eine Androgenreaktionsregion auf. Der Verlust der Reaktivität dieser Region auf Androgene wird als Ursache für eine größere Anzahl aggressiver Tumore bei Frauen vermutet (im Gegensatz zu Männern, die eine höhere Androgenmenge haben). ⓘ
Muskelinvasiver Blasenkrebs ist von Natur aus heterogen. Im Allgemeinen lassen sie sich genetisch in basale und luminale Subtypen einteilen. Der basale Subtyp weist Veränderungen in den Genen RB und NFE2L2 auf, während der luminale Typ Veränderungen in den Genen FGFR3 und KDM6A aufweist. Der basale Subtyp wird in die basale und die Claudin-arme Gruppe unterteilt und ist aggressiv und zeigt bei der Präsentation Metastasen, spricht aber auf eine platinbasierte Chemotherapie an. Der luminale Subtyp kann in p53-ähnliche und luminale Tumoren unterteilt werden. p53-ähnliche Tumoren des luminalen Subtyps sind zwar nicht so aggressiv wie der basale Typ, sprechen aber auf Chemotherapie an. ⓘ
Diagnose
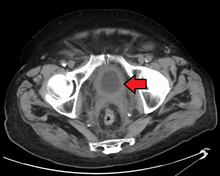
Die beste Diagnose des Zustands der Blase ist derzeit die Zystoskopie, ein Verfahren, bei dem ein flexibler oder starrer Schlauch (ein so genanntes Zystoskop) mit einer Kamera und verschiedenen Instrumenten durch die Harnröhre in die Blase eingeführt wird. Das flexible Verfahren ermöglicht eine visuelle Inspektion der Blase, die Durchführung kleinerer Eingriffe und die Entnahme von Proben verdächtiger Läsionen für eine Biopsie. Ein starres Zystoskop wird unter Vollnarkose im Operationssaal verwendet und kann sowohl für Abhilfemaßnahmen und Biopsien als auch für die Entfernung größerer Tumore eingesetzt werden. Im Gegensatz zu papillären Läsionen, die in die Blasenhöhle hineinwachsen und gut sichtbar sind, sind Karzinom-in-situ-Läsionen flach und unauffällig. Der Nachweis von Carcinoma-in-situ-Läsionen erfordert mehrere Biopsien aus verschiedenen Bereichen der inneren Blasenwand. Die photodynamische Detektion (Blaulicht-Zystoskopie) kann bei der Erkennung von Carcinoma in situ helfen. Bei der photodynamischen Detektion wird mit Hilfe eines Katheters ein Farbstoff in die Blase eingebracht. Die Krebszellen nehmen diesen Farbstoff auf und werden unter blauem Licht sichtbar, was visuelle Anhaltspunkte für Bereiche liefert, die biopsiert oder reseziert werden müssen. ⓘ
Der visuelle Nachweis in jeder der oben genannten Formen reicht jedoch nicht aus, um die pathologische Klassifizierung, den Zelltyp oder das Stadium des vorliegenden Tumors zu bestimmen. Eine so genannte kalte Becherbiopsie während einer gewöhnlichen Zystoskopie (starr oder flexibel) reicht ebenfalls nicht für ein pathologisches Staging aus. Daher muss nach einer visuellen Entdeckung eine transurethrale Operation durchgeführt werden. Dieser Eingriff wird als transurethrale Resektion des Blasentumors (TURBT) bezeichnet. Außerdem sollte vor und nach der TURBT eine rektale und vaginale bimanuelle Untersuchung durchgeführt werden, um festzustellen, ob eine tastbare Masse vorhanden ist oder ob der Tumor an der Beckenwand festgewachsen ist ("tethered"). Die durch das TURBT-Verfahren gewonnenen Informationen über die pathologische Klassifizierung und das Staging sind von grundlegender Bedeutung für die Wahl der anschließenden Behandlungs- und/oder Nachsorgemaßnahmen. ⓘ
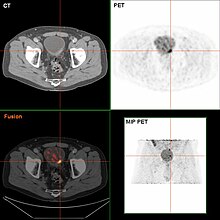
Wird bei der TURBT ein invasiver oder hochgradiger Krebs (einschließlich Carcinoma in situ) festgestellt, sollte eine MRT- und/oder CT-Untersuchung des Abdomens und des Beckens oder ein Urogramm und eine CT-Thorax-Untersuchung zur Stadieneinteilung und zur Suche nach Krebsausbreitung (Metastasen) durchgeführt werden. Erhöhte Werte der alkalischen Phosphatase ohne Anzeichen einer Lebererkrankung sollten durch eine Knochenszintigraphie auf Knochenmetastasen untersucht werden. Obwohl die 18F-Fluordesoxyglukose (FDG)-Positronenemissionstomographie (PET)/CT als praktikable Methode für das Staging erforscht wurde, gibt es keinen Konsens, der ihre Rolle in der klinischen Routinebewertung unterstützt. ⓘ
Die Urinzytologie kann im entleerten Urin oder zum Zeitpunkt der Zystoskopie ("Blasenspülung") durchgeführt werden. Die Zytologie ist nicht sehr empfindlich für niedriggradige oder Grad-1-Tumore (ein negatives Ergebnis kann Blasenkrebs nicht zuverlässig ausschließen), hat aber eine hohe Spezifität (ein positives Ergebnis weist Blasenkrebs zuverlässig nach). Es gibt neuere, nicht-invasive, an den Urin gebundene Marker, die bei der Diagnose von Blasenkrebs hilfreich sein können, darunter das humane Komplementfaktor-H-verwandte Protein, das hochmolekulare karzinoembryonale Antigen und das Kernmatrixprotein 22 (NMP22). In den Vereinigten Staaten hat die FDA die Tests NMP22, NMP22 BladderChek und UroVysion für den Nachweis und die Überwachung von Blasenkrebs zugelassen, während die Tests ImmunoCyt, BTA-TRAK und BTA-STAT nur für die Überwachung zugelassen wurden. BTA-STAT und BladderChek können in der Klinik durchgeführt werden, die anderen Tests werden im Labor durchgeführt. Zu den anderen nicht-invasiven Urintests gehören der CertNDx Bladder Cancer Assay, der FGFR3-Mutationen nachweist, und der Urine Bladder Cancer Test (UBC), ein Sandwich-ELISA für das Fragment Cytokeratin 8/18. Ebenso ist NMP22 ein Sandwich-ELISA und NMP22 BladderChek ein Dipstick-Immunoassay, die beide den Tumormarker NuMA (Nuclear Mitotic Apparat Protein) (eine Art Kernmatrixprotein) nachweisen. UroVysion ist eine Fluoreszenz-in-situ-Hybridisierung, die Aneuploidie in den Chromosomen 3, 7, 17 und den Verlust des 9p21-Lokus nachweist. ImmunoCyt ist ein Immunfluoreszenztest zum Nachweis von glykosyliertem CEA und MUCIN-ähnlichen Antigenen (M344, LDQ10, 19A11). BTA-STAT ist ein Dipstick-Immunoassay zum Nachweis des humanen Komplementfaktor-H-verwandten Proteins. BTA-TRAK ist ein Sandwich-ELISA, mit dem auch humanes Komplementfaktor-H-verwandtes Protein nachgewiesen werden kann. Die Sensitivitäten der Biomarker reichten von 0,57 bis 0,82 und die Spezifitäten von 0,74 bis 0,88. Die Biomarker schnitten besser ab, wenn sie in Kombination mit der Urinzytologie verwendet wurden, als wenn sie allein eingesetzt wurden. Allerdings ist die Erkennungsgenauigkeit bei niedriggradigen Karzinomen gering, und 10 % der Karzinome werden immer noch übersehen. In den aktuellen Leitlinien wird die Verwendung von Urin-Biomarkern zur Erkennung und Überwachung nicht empfohlen. ⓘ
Erster Schritt in der Diagnostik ist ein Urinstatus. Hier kann auch eine mit dem bloßen Auge nicht sichtbare Blutbeimengung im Urin nachgewiesen werden. Die zytologische Untersuchung des Urins kann einen weiteren Hinweis auf Blasenkrebs liefern, insofern sich unter dem Mikroskop sichtbare entartete Zellen zeigen. Die Urinzytologie liefert vor allem bei fortgeschrittenen und schwer entarteten Tumoren einen positiven Befund. Bei gut differenzierten Tumoren ist oft eine Unterscheidung zu entzündlichen Veränderungen schwierig. Eine negative Zytologie schließt einen Blasenkrebs nicht aus. Es befinden sich verschiedene Markersysteme in Entwicklung, welche über den Nachweis von tumorspezifischen Molekülen im Urin eine Diagnose ermöglichen sollen. Aufgrund der Unsicherheit dieser Tests sollten diese weder in der Früherkennung noch in der Erfolgskontrolle der Behandlung eingesetzt werden. ⓘ
Eine Ultraschalluntersuchung kann Raumforderungen der Harnblase nachweisen und somit einen Hinweis auf Blasenkrebs liefern. Ebenso können dadurch von einem eventuellen Tumor ausgelöste Veränderungen der Nieren oder der ableitenden Harnwege sichtbar gemacht werden. Die Ultraschalluntersuchung kann jedoch keine endgültige Diagnose liefern. ⓘ
Der Goldstandard zur Diagnostik des Blasenkrebses ist die Blasenspiegelung. Dabei wird über die Harnröhre die Blase mittels eines Endoskops untersucht. Auffällige Bereiche können biopsiert werden. Die feingewebliche Untersuchung liefert die endgültige Diagnose. Bei auffälligen Befunden kann auch direkt eine Behandlung im Sinne einer Entfernung durch die Harnröhre durchgeführt werden. Konventionell erfolgt die Untersuchung mit Weißlicht. Durch die photodynamische Diagnostik können auffällige Gewebsareale besser dargestellt werden. Dabei wird Aminolävulinsäure oder Hypericin in die Blase instilliert und die Schleimhaut mit Blaulicht untersucht. Diese Stoffe färben die Schleimhaut und machen zusätzlich auffällige Areal sichtbar. Dabei werden aber auch oft entzündliche Areale als auffällig angefärbt. Die photodynamische Diagnostik sollte bei positiver Urinzytologie aber fehlendem Nachweis eines Tumors in der konventionellen Untersuchung durchgeführt werden. ⓘ
Bei Vorhandensein eines Tumors können eine Computertomographie oder eine Magnetresonanztomographie über die Ausdehnung des Tumors in Nachbarorgane oder das der Blase anliegende Fettgewebe sowie Aussagen über Lungen-, Lymphknoten- und Knochenmetastasen liefern. In speziellen Fragestellungen kann die Bildgebung auch durch den Nachweis von Stoffwechselaktivität mittels Positronen-Emissions-Tomographie ergänzt werden. ⓘ
Klassifizierung

| Typ | Relative Häufigkeit | Subtypen ⓘ |
|---|---|---|
| Transitionales Zellkarzinom | 95% | Papillär (70%) |
| Nicht-papillär (30%) | ||
| Nicht-Übergangszellkarzinom | 5% | Plattenepithelkarzinome, Adenokarzinome, Sarkome, kleinzellige Karzinome und sekundäre Ablagerungen von Krebserkrankungen an anderen Stellen des Körpers. |
Zum nicht-papillären Karzinom gehören das Carcinoma in situ (CIS), das mikroinvasive Karzinom und das offen invasive Karzinom. Das Carcinoma in situ (CIS) besteht ausnahmslos aus zytologisch hochwertigen Tumorzellen. ⓘ
Das Übergangszellkarzinom kann eine Differenzierung (25 %) in seine Varianten erfahren. Unter dem Mikroskop kann das papilläre Übergangszellkarzinom in seiner typischen Form oder als eine seiner Varianten (Plattenepithelkarzinom, drüsige Differenzierung oder mikropapilläre Variante) auftreten. Die verschiedenen Varianten des nicht-papillären Übergangszellkarzinoms sind im Folgenden aufgeführt. ⓘ
| Variante | Histologie | Prozentualer Anteil der nicht-papillären Fälle | Bedeutung ⓘ |
|---|---|---|---|
| Plattenepitheliale Differenzierung | Vorhandensein von interzellulären Brücken oder Keratinisierung | 60% | Ähnliche Ergebnisse wie beim herkömmlichen Übergangszellkarzinom |
| Drüsige Differenzierung | Vorhandensein von echten Drüsenräumen | 10% | |
| Sarkomatoide Herde | Vorhandensein von sowohl epithelialer als auch mesenchymaler Differenzierung | 7% | Klinisch aggressiv |
| Mikropapilläre Variante | Ähnelt dem papillären serösen Karzinom des Eierstocks oder dem mikropapillären Karzinom der Brust oder der Lunge | 3.7% | Klinisch aggressiv, frühe Zystektomie empfohlen |
| Urothelkarzinom mit kleinen Tubuli und mikrozystischer Form | Vorhandensein von Zysten mit einem Größenbereich von mikroskopisch klein bis 1-2 mm | Selten | |
| Lymphoepitheliom-ähnliches Karzinom | Ähnelt dem Lymphoepitheliom des Nasopharynx | ||
| Lymphomähnliche und plasmazytoide Varianten | Bösartige Zellen ähneln Zellen eines malignen Lymphoms oder Plasmozytoms | ||
| Verschachtelte Variante | Histologisch sehen sie ähnlich aus wie von Brunn'sche Nester | Kann fälschlicherweise als gutartige von Brunn'sche Nester oder nicht-invasives, niedriggradiges papilläres Urothelkarzinom diagnostiziert werden | |
| Urothelkarzinom mit Riesenzellen | Vorhandensein von epithelialen Tumorriesenzellen und ähnliches Aussehen wie bei einem Riesenzellkarzinom der Lunge | ||
| Trophoblastische Differenzierung | Vorhandensein von synzytiotrophoblastischen Riesenzellen oder choriokarzinomatöse Differenzierung, kann HCG exprimieren | ||
| Klarzellige Variante | Klarzelliges Muster mit glykogenreichem Zytoplasma | ||
| Plasmozytoid | Zellen mit hohem Lipidgehalt, die das Siegelringzell-Adenokarzinom des Magens/den lobulären Brustkrebs imitieren | Klinisch aggressiv, Neigung zur Ausbreitung im Bauchfell | |
| Ungewöhnliche stromale Reaktionen | Vorhandensein folgender Merkmale: pseudosarkomatöses Stroma, stromale knöcherne oder knorpelige Metaplasie, osteoklastische Riesenzellen, lymphoides Infiltrat |
Stadieneinteilung




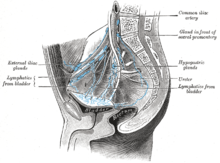
Blasenkrebs wird in Stadien eingeteilt (nach dem Ausmaß der Ausbreitung des Krebses) und eingestuft (wie abnormal und aggressiv die Zellen unter dem Mikroskop erscheinen), um die Behandlung festzulegen und die Ergebnisse vorherzusagen. Die Stadieneinteilung erfolgt in der Regel durch eine transurethrale Resektion des Blasentumors (TURBT) und radiologische Bildgebung (CT und MRT). Papilläre Tumoren, die auf die Schleimhaut begrenzt sind oder in die Lamina propria eindringen, werden als Ta oder T1 eingestuft. Flache Läsionen, die nicht in die Basalmembran der Blasenschleimhaut eindringen, werden als Tis (in situ) bezeichnet. Alle drei Kategorien (Tis, Ta und T1) werden zu therapeutischen Zwecken als nicht-muskelinvasive Erkrankung zusammengefasst und in den meisten Fällen wird ihnen eine zystoskopische Resektion mit TURBT angeboten, ohne dass eine radikale Resektion der gesamten Harnblase erforderlich ist. Tumoren der übrigen Kategorien (T2, T3 und T4) werden als muskelinvasive Erkrankungen bezeichnet und sind mit einer ungünstigeren Prognose verbunden. ⓘ
Im TNM-Staging-System (8th Edn. 2017) für Blasenkrebs T (Primärtumor)
- TX Primärtumor nicht beurteilbar
- T0 Kein Nachweis eines Primärtumors
- Ta Nicht-invasives papilläres Karzinom
- Tis Karzinom in situ ("flacher Tumor")
- T1 Tumor dringt in subepitheliales Bindegewebe ein
- T2a Tumor dringt in den oberflächlichen Muskel ein (innere Hälfte des Detrusormuskels)
- T2b Tumor dringt in den tiefen Muskel ein (äußere Hälfte des Detrusormuskels)
- T3 Der Tumor dringt in das perivikale Gewebe ein:
- T3a Mikroskopisch
- T3b Makroskopisch (extravesikale Masse)
- T4a Tumor dringt in Prostata, Gebärmutter oder Vagina ein
- T4b Tumor dringt in Beckenwand oder Bauchdecke ein ⓘ
N (Lymphknoten)
- NX Regionale Lymphknoten können nicht beurteilt werden
- N0 Keine regionalen Lymphknotenmetastasen
- N1 Metastasierung in einem einzelnen Lymphknoten im echten Becken (hypogastrischer, obturatorischer, externer iliakaler oder präsakraler Knoten)
- N2 Metastasierung in mehreren Lymphknoten im echten Becken (hypogastrischer, obturatorischer, externer iliakaler oder präsakraler Knoten)
- N3 Metastasierung in gemeinsamen iliakalen Lymphknoten ⓘ
M (Fernmetastasierung)
- MX Fernmetastasierung kann nicht beurteilt werden
- M0 Keine Fernmetastasierung
- M1 Fernmetastasierung.
- M1a: Der Krebs hat sich nur in Lymphknoten außerhalb des Beckens ausgebreitet.
- M1b: Der Krebs hat in andere Körperteile gestreut. ⓘ
Die häufigsten Orte für Blasenkrebsmetastasen sind die Lymphknoten, Knochen, Lunge, Leber und das Bauchfell. Die häufigsten Sentinel-Lymphknoten, die Blasenkrebs entwässern, sind die Lymphknoten des Obturators und des inneren Darms. Der Ort der lymphatischen Ausbreitung hängt von der Lage des Tumors ab. Tumore an der superolateralen Blasenwand streuen in die Lymphknoten des äußeren Darms. Tumore am Hals, an der Vorderwand und am Fundus breiten sich häufig in die Lymphknoten des inneren Darms aus. Von den regionalen Lymphknoten (d. h. Obturator, innere und äußere Lymphknoten) breitet sich der Krebs auf entfernte Stellen wie die gemeinsamen iliakalen Lymphknoten und die paraaortalen Lymphknoten aus. Beim Blasenkrebs werden keine Lymphknotenläsionen übersprungen. ⓘ
Numerisch
Die oben genannten Stadien können wie folgt in eine numerische Stadieneinteilung (mit römischen Ziffern) integriert werden:
| Stadium | Tumor | Knoten | Metastasierung | 5-Jahres-Überlebensrate in den USA ⓘ |
|---|---|---|---|---|
| Stadium 0a | Ta | N0 | M0 | 98% |
| Stadium 0is | Tis | N0 | M0 | 95% |
| Stufe I | T1 | N0 | M0 | 63% |
| Stadium II | T2a | N0 | M0 | |
| T2b | ||||
| Stadium IIIA | T3a | N0 | M0 | 35% |
| T3b | ||||
| T4a | ||||
| T1-4a | N1 | |||
| Stadium IIIB | T1-4a | N2 | M0 | |
| N3 | ||||
| Stadium IVA | T4b | Beliebiges N | M0 | |
| Beliebig T | M1a | |||
| Stadium IVB | Beliebig T | Beliebiges N | M1b | 5% |

Die Einordnung von Schleimhauttumoren folgt nach der TNM-Klassifikation. Das Blasenkarzinom stellt hierbei keine Ausnahme dar. Die Klassifikation ist in der folgenden Tabelle grob umrissen:
| T | Ta | Nicht invasives papilläres Carcinoma in situ des Urothels ⓘ |
| Tcis | Nicht invasives Carcinoma in situ | |
| T1 | Einwachsen unter die Schleimhaut in das submuköse Bindegewebe (Unterformen: T1a: oberhalb der Schleimhautmuskelschicht; T1b: unterhalb der Schleimhautmuskelschicht) | |
| T2 | Einwachsen in die Muskelschicht der Harnblase (Unterformen: T2a: innere Hälfte, T2b: bis in die äußere Hälfte) | |
| T3 | Hinauswachsen über die Muskelschicht der Harnblase (Unterformen: T3a: nur mikroskopisch erkennbar, T3b: mit dem bloßen Auge sichtbar) | |
| T4 | Einwachsen in Nachbarorgane (Unterformen: T4a: Prostata, Gebärmutter, Scheide, T4b: Becken- oder Bauchwand) | |
| N | N0 | Keine lokalen Lymphknoten befallen |
| N1 | Einzelner befallener Lymphknoten kleiner als 2 cm | |
| N2 | einzelner Lymphknoten von 2 bis 5 cm Durchmesser oder mehrere befallene Lymphknoten < 5 cm | |
| N3 | Lymphknoten über 5 cm | |
| M | M0 | Keine Fernmetastasen nachgewiesen |
| M1 | Fernmetastasen nachgewiesen (Unterformen: M1a: Metastasen in nichtregionalen Lymphknoten; M1b: sonstige Fernmetastasen) |
Neben der Klassifikation der Ausdehnung des Tumors wird im Rahmen einer feingeweblichen Untersuchung auch ein Grading durchgeführt. Seit 2004 umfasst das Grading laut den Kriterien der WHO nur noch zwei Möglichkeiten, entweder High- oder Low-grade. Low-grade-Karzinome sind dabei besser differenziert und haben eine bessere Prognose als High-grade Karzinome mit vielen Atypien. Es zählt beim Grading jeweils der am schlechtesten differenzierte Anteil des Tumors unabhängig von seinem Anteil am Gesamttumor. Daneben ist im deutschsprachigen Raum eine Einteilung verbreitet, welche die Tumoren von G1 bis G3 nach dem Differenzierungsgrad einteilt. Dabei stellt G1 einen relativ wenig atypischen Tumor und G3 einen sehr schlecht differenzierten Tumor dar. G2 liegt zwischen diesen beiden Extremen. ⓘ
Einstufung
Nach der WHO-Klassifikation (1973) wird Blasenkrebs histologisch wie folgt eingeteilt:
- G1 - Gut differenziert,
- G2 - Mäßig differenziert
- G3 - Schlecht differenziert ⓘ
WHO-Klassifikation (2004/2016)
- Papilläre Läsionen
- Urotheliales Papillom
- Papilläres urotheliales Neoplasma mit geringem malignen Potenzial (PUNLMP)
- Niedriger Grad
- Hochgradig
- Flache Läsionen
- Urotheliale Proliferation mit ungewissem malignen Potenzial
- Reaktive Atypie
- Atypie von unbekannter Bedeutung
- Urotheliale Dysplasie
- Urotheliales CIS (immer hochgradig)
- Primär
- Sekundär
- Gleichzeitige ⓘ
Risikostratifizierung
Menschen mit nicht-muskelinvasivem Blasenkrebs (NMIBC) werden auf der Grundlage klinischer und pathologischer Faktoren einer Risikostratifizierung unterzogen, damit sie je nach Wahrscheinlichkeit eines Fortschreitens und/oder Wiederauftretens angemessen behandelt werden. Menschen mit nicht-muskelinvasiven Tumoren werden in die Kategorien geringes Risiko, mittleres Risiko und hohes Risiko eingeteilt oder mit einem numerischen Risikoscore versehen. Der Rahmen für die Risikostratifizierung wird von der American Urology Association/Society of Urological Oncology (AUA/SUO-Stratifizierung), den Leitlinien der European Association of Urology (EAU), den Risikotabellen der European Organization for Research and Treatment of Cancer (EORTC) und dem Scoring-Modell des Club Urológico Español de Tratamiento Oncológico (CUETO) vorgegeben. ⓘ
| Geringes Risiko | Mittleres Risiko | Hohes Risiko |
|---|---|---|
| Niedriggradiger solitärer Ta-Tumor, kleiner als 3 cm | Rezidiv innerhalb von 1 Jahr, niedriggradiger Ta-Tumor | Hochgradiger T1 |
| Papilläres urotheliales Neoplasma mit geringem malignen Potenzial | Solitärer niedriggradiger Ta-Tumor, größer als 3 cm | Jeder rezidivierende Tumor oder jeder hochgradige Ta |
| Niedriggradige Ta, multifokale Tumore | Hochgradige Ta, größer als 3 cm (oder multifokal) | |
| Hochgradiges Ta, kleiner als 3 cm | Jedes Karzinom in situ | |
| Geringgradiges T1 | Jedes BCG-Versagen bei hochgradigen Tumoren | |
| Jede Variante der Histologie | ||
| Jede lymphovaskuläre Invasion | ||
| Jede hochgradige Beteiligung der Prostata-Harnröhre |
Das EORTC- und das CUETO-Modell verwenden einen kumulativen Score, der sich aus den einzelnen prognostischen Faktoren ergibt, die dann in ein Progressions- und Rezidivrisiko umgerechnet werden. Die sechs Prognosefaktoren des EORTC-Modells sind die Anzahl der Tumore, die Rezidivrate, das T-Stadium, das Vorhandensein eines Carcinoma-in-situ und der Grad des Tumors. Die Bewertung der Rezidivrate im CUETO-Modell umfasst sechs Variablen: Alter, Geschlecht, Grad, Tumorstatus, Anzahl der Tumoren und Vorhandensein von Tis. Für die Bewertung der Progression werden die vorherigen 6 Variablen plus T-Stadium verwendet. ⓘ
| Modell | Kumulativer Score für Wiederauftreten | Wiederauftreten nach 1 Jahr (%) | Wiederauftreten nach 5 Jahren (%) ⓘ |
|---|---|---|---|
| EORTC | 0 | 15 | 31 |
| 1-4 | 24 | 46 | |
| 5-9 | 38 | 62 | |
| 10-17 | 61 | 78 | |
| CUETO | 0-4 | 8.2 | 21 |
| 5-6 | 12 | 36 | |
| 7-9 | 25 | 48 | |
| 10-16 | 42 | 68 |
| Modell | Kumulativer Score für Progression | Fortschreiten nach 1 Jahr (%) | Fortschreiten nach 5 Jahren (%) ⓘ |
|---|---|---|---|
| EORTC | 0 | 0.2 | 0.8 |
| 2-6 | 1 | 6 | |
| 7-13 | 5 | 17 | |
| 12-23 | 17 | 45 | |
| CUETO | 0-4 | 1.2 | 3.7 |
| 5-6 | 3 | 12 | |
| 7-9 | 5.5 | 21 | |
| 10-16 | 14 | 34 |
Prävention
Im Jahr 2019 gibt es nur begrenzte Belege dafür, dass der Verzehr von Obst und Gemüse das Risiko für Blasenkrebs senkt. Eine Studie aus dem Jahr 2008 kam zu dem Schluss, dass "bestimmte Obst- und Gemüsesorten das Risiko für Blasenkrebs verringern können." Obst und gelb-orangefarbenes Gemüse, insbesondere Karotten und selenhaltige Gemüsesorten, werden wahrscheinlich mit einem mäßig reduzierten Blasenkrebsrisiko in Verbindung gebracht. Auch Zitrusfrüchte und Kreuzblütlergemüse wurden mit einer möglichen Schutzwirkung in Verbindung gebracht. Eine Analyse von 47 909 Männern in der Health Professionals Follow-Up Study ergab jedoch nur einen geringen Zusammenhang zwischen der Verringerung des Krebsrisikos und einem hohen Verzehr von Obst und Gemüse im Allgemeinen oder von gelbem oder grünem Blattgemüse im Besonderen, verglichen mit der Verringerung, die bei den Männern beobachtet wurde, die große Mengen an Kreuzblütlergemüse konsumierten. Es wurde auch ein umgekehrter Zusammenhang zwischen der Aufnahme von Flavonolen und Lignanen (diphenolische Verbindungen, die in Vollkornprodukten, Hülsenfrüchten, Obst und Gemüse enthalten sind) und aggressivem Blasenkrebs beschrieben. ⓘ
Es wird zwar vermutet, dass die Polyphenolverbindungen im Tee eine hemmende Wirkung auf die Bildung und das Wachstum von Blasentumoren haben, doch gibt es nur wenige Hinweise darauf, dass Teetrinken das Blasenkrebsrisiko verringert. ⓘ
In einer 10-Jahres-Studie, an der fast 49 000 Männer teilnahmen, fanden Forscher heraus, dass Männer, die täglich mindestens 1,44 l Wasser (etwa 6 Tassen) tranken, ein geringeres Risiko für Blasenkrebs hatten als Männer, die weniger tranken. Es wurde auch festgestellt, dass: "Das Risiko für Blasenkrebs verringerte sich um 7 % pro 240 ml zusätzlicher Flüssigkeit". Die Autoren schlugen vor, dass Blasenkrebs zum Teil dadurch verursacht werden könnte, dass die Blase direkt mit Karzinogenen in Berührung kommt, die mit dem Urin ausgeschieden werden, obwohl dies in anderen Studien noch nicht bestätigt wurde. ⓘ
Screening
Ab 2019 gibt es keine ausreichenden Beweise dafür, ob ein Screening auf Blasenkrebs bei Menschen ohne Symptome wirksam ist oder nicht. ⓘ
Behandlung
Die Behandlung von Blasenkrebs hängt davon ab, wie tief der Tumor in die Blasenwand eingedrungen ist. ⓘ
Zu den Behandlungsstrategien für Blasenkrebs gehören:
- Nicht-muskelinvasiv: transurethrale Resektion des Blasentumors (TURBT) mit oder ohne intravesikale Chemotherapie oder Immuntherapie
- Muskelinvasiv
- Stadium II/Stadium IIIA: radikale Zystektomie plus neoadjuvante Chemotherapie (multimodale Therapie, bevorzugt) oder transurethrale Resektion mit Chemobestrahlung (trimodale Therapie, bei sehr ausgewählten Patienten) oder partielle Zystektomie plus neoadjuvante Chemotherapie (bei sehr ausgewählten Patienten)
- Stadium IIIB/IVA: Chemotherapie auf Cisplatinbasis, gefolgt von radikaler Zystektomie oder Chemobestrahlung oder Beobachtung je nach Ansprechen auf die Behandlung
- Stadium IVB (lokal fortgeschrittene, nicht resektable Tumore): palliative Strahlentherapie
- Metastasierte Erkrankung: Chemotherapie auf Cisplatinbasis
- Metastasierte Erkrankung, aber ungeeignet für eine Chemotherapie auf Cisplatinbasis: Chemotherapie auf Carboplatinbasis
- Metastasierte Erkrankung mit Kontraindikation für eine Chemotherapie: Checkpoint-Inhibitoren, wenn der programmierte Todesligand 1 (PD L1) positiv ist
- Plattenepithelkarzinom oder Adenokarzinom der Harnblase: radikale Zystektomie ⓘ
Nicht-muskelinvasiv
Transurethrale Resektion
Nicht-muskelinvasive Blasenkarzinome (d. h. solche, die nicht in die Muskelschicht der Blase eindringen) können mit Hilfe eines Elektrokauters, der an einem Zystoskop (in diesem Fall einem Resektoskop) befestigt ist, "abrasiert" werden. Dieses Verfahren wird als transurethrale Resektion von Blasentumoren (TURBT) bezeichnet und dient in erster Linie dem pathologischen Staging. Bei nicht-muskelinvasivem Blasenkrebs ist die TURBT an sich die Behandlung, aber bei muskelinvasivem Krebs ist das Verfahren für die endgültige Behandlung nicht ausreichend. Zusätzlich wird bei der ersten TURBT eine Blaulicht-Zystoskopie mit dem optischen Bildgebungsmittel Hexaminolevulinat (HAL) empfohlen, um die Erkennung von Läsionen (insbesondere von Carcinoma in situ) zu verbessern und die Qualität der Resektion zu erhöhen und damit die Rezidivrate zu senken. Es ist wichtig, die Qualität der Resektion zu beurteilen: Gibt es Anzeichen für eine unvollständige Resektion oder sind keine Muskeln in der Probe vorhanden (ohne die die Invasivität der Muskeln nicht bestimmt werden kann), wird eine zweite TURBT dringend empfohlen. Außerdem hat fast die Hälfte der Patienten mit hochgradiger nichtinvasiver Erkrankung nach der primären TURBT einen Resttumor; in diesen Fällen ist eine zweite TURBT wichtig, um ein Under-Staging zu vermeiden. Zu diesem Zeitpunkt wird empfohlen, die Patienten in Risikogruppen einzuteilen. Die Behandlung und Überwachung für die verschiedenen Risikogruppen ist in der nachstehenden Tabelle angegeben. ⓘ
Eine weitere Methode zur Verringerung des Wiederauftretens von Tumoren ist die medikamentöse Behandlung nach der TURBT-Operation. Die beiden am häufigsten verwendeten Medikamente sind Bacillus Calmette-Guérin (BCG) und Mitomycin. Bei Personen, die bereits eine TURBT-Operation hatten, kann BCG zu einem ähnlichen Sterberisiko führen und das Risiko eines Tumorrezidivs verringern. Allerdings kann dieses Medikament das Risiko schwerwiegender unerwünschter Nebeneffekte erhöhen. Weitere Untersuchungen sind erforderlich, um diese Ergebnisse zu bestätigen. ⓘ
Chemotherapie

Die einmalige Instillation einer Chemotherapie in die Blase nach einer primären TURBT hat sich als vorteilhaft erwiesen, da sie bei einer nicht-muskelinvasiven Erkrankung das Wiederauftreten um 35 % verringert. Zu diesem Zweck können die Medikamente Mitomycin C (MMC), Epirubicin, Pirarubicin und Gemcitabin eingesetzt werden. Die Instillation der postoperativen Chemotherapie sollte innerhalb der ersten Stunden nach der TURBT durchgeführt werden. Es ist bekannt, dass mit fortschreitender Zeit restliche Tumorzellen fest anhaften und von der extrazellulären Matrix bedeckt werden, was die Wirksamkeit der Instillation verringert. Die häufigste Nebenwirkung ist eine chemische Zystitis und Hautreizung. Besteht bei der TURBT der Verdacht auf eine Blasenperforation, sollte die Chemotherapie nicht in die Blase instilliert werden, da es bekanntermaßen zu schwerwiegenden unerwünschten Ereignissen aufgrund von Arzneimittelextravasation kommen kann. Studien haben gezeigt, dass die Wirksamkeit der Chemotherapie durch den Einsatz von gerätegestützter Chemotherapie erhöht wird. Diese Technologien nutzen verschiedene Mechanismen, um die Aufnahme und Wirkung eines direkt in die Blase verabreichten Chemotherapeutikums zu erleichtern. Bei einer anderen Technologie - der elektromotorischen Medikamentenverabreichung (EMDA) - wird ein elektrischer Strom verwendet, um die Medikamentenaufnahme nach der chirurgischen Entfernung des Tumors zu verbessern. Eine weitere Technologie, die Thermotherapie, nutzt Hochfrequenzenergie zur direkten Erwärmung der Blasenwand, die zusammen mit der Chemotherapie (Chemohyperthermie) einen synergistischen Effekt zeigt, indem sie die Fähigkeit des jeweils anderen, Tumorzellen abzutöten, verstärkt. ⓘ
Immuntherapie

Die Immuntherapie durch Verabreichung von [[Bacillus Calmette-Guérin|Bacillus Calmette-Guérin]] (BCG) in die Blase wird ebenfalls zur Behandlung und Vorbeugung des Wiederauftretens von NMIBC eingesetzt. BCG ist ein Impfstoff gegen Tuberkulose, der aus einem abgeschwächten lebenden Rindertuberkulosebazillus, Mycobacterium bovis, hergestellt wird, der seine Virulenz beim Menschen verloren hat. Die BCG-Immuntherapie ist in diesem Stadium in bis zu 2/3 der Fälle wirksam und hat sich in randomisierten Studien als besser erwiesen als die Standard-Chemotherapie. Der genaue Mechanismus, durch den BCG ein Wiederauftreten der Krankheit verhindert, ist unbekannt. Es hat sich jedoch gezeigt, dass die Bakterien von den Krebszellen aufgenommen werden. Die Infektion dieser Zellen in der Blase kann eine örtlich begrenzte Immunreaktion auslösen, die die restlichen Krebszellen beseitigt. ⓘ
BCG wird als Induktions- und als Erhaltungsimpfung verabreicht. Die Einleitungskur besteht aus einer 6-wöchigen intravesikalen und perkutanen BCG-Behandlung. Daran schließt sich eine Erhaltungsbehandlung an. Über das Erhaltungsschema gibt es keinen Konsens, am häufigsten wird jedoch das Schema der Southwestern Oncology Group (SWOG) befolgt. Das SWOG-Erhaltungsschema besteht aus wöchentlicher intravesikaler und perkutaner BCG-Injektion über drei Wochen nach 3, 6, 12, 18, 24, 30 und 36 Monaten. Das dreiwöchige Erhaltungsschema mit Induktion hat eine vollständige Ansprechrate von 84 % gezeigt, verglichen mit 69 % bei Patienten, die nur 6-wöchige BCG-Induktion nach 6 Monaten erhielten. In vielen Studien wurden alternative Behandlungsschemata und -regime von BCG untersucht, die jedoch keine klinische Bedeutung hatten. Die Wirksamkeit der verschiedenen BCG-Stämme (Connaught, TICE, Pasteur, Tokio-172) unterscheidet sich nachweislich nicht, es gibt jedoch keine eindeutigen Beweise. ⓘ
Zu den Nebenwirkungen der BCG-Therapie gehören Zystitis, Prostatitis, Epididymo-Orchitis, Balanitis, Harnleiterobstruktion, Blasenverengung, mykobakterielle Osteomyelitis, reaktive Arthritis, mykobakterielle Pneumonie, granulomatöse Hepatitis, granulomatöse Nephritis, interstitielle Nephritis, infektiöse Vaskulitis und disseminierte Infektionen. ⓘ
Lokale Infektionen (z. B. Prostatitis, Epididymo-Orchitis, Balanitis), die auf BCG zurückzuführen sind, sollten mit einer tuberkulösen Dreifachtherapie behandelt werden, wobei eines der Medikamente ein Fluorchinolon für 3 bis 6 Monate ist. Bei Personen mit systemischen Infektionen sollte die BCG-Therapie abgebrochen und eine antituberkuläre Multimedikamentenbehandlung für mindestens 6 Monate begonnen werden. Für diese Behandlung kommen INH, Rifampicin, Ethambutol, Fluorchinolone, Clarithromycin, Aminoglykoside und Doxycyclin in Frage. BCG-Stämme sind nicht empfindlich gegenüber Pyrazinamid, daher sollte es nicht Teil der antituberkulären Behandlung sein. ⓘ
Versagen der BCG-Behandlung
Das Versagen der BCG-Behandlung kann in 3 Gruppen eingeteilt werden: BCG-Rezidiv, BCG-refraktär und BCG-intolerant. Bei einem BCG-Rezidiv tritt der Tumor nach einer krankheitsfreien Zeit erneut auf. BCG-refraktäre Tumoren sind solche, die auf Induktions- und Erhaltungsdosen von BCG nicht ansprechen oder die während der Therapie fortschreiten. Bei BCG-intoleranten Tumoren tritt der Tumor aufgrund einer unvollständigen Behandlung wieder auf, da die betroffene Person eine Induktionsbehandlung mit BCG nicht verträgt. Bei etwa 50 % der Betroffenen versagt die BCG-Behandlung und sie benötigen eine weitere Behandlung. ⓘ
Schwieriger zu behandeln sind Menschen, deren Tumor nach der BCG-Behandlung wieder aufgetreten ist oder die auf die Behandlung nicht ansprachen. Bei diesen Patienten wird eine radikale Zystektomie empfohlen. Bei Patienten, die nicht auf die BCG-Therapie ansprechen und nicht in der Lage oder nicht bereit sind, sich einer radikalen Zystektomie zu unterziehen, können Salvage-Therapien in Betracht gezogen werden. Zu den Salvage-Therapien gehören die intravesikale Chemotherapie mit Wirkstoffen wie Valrubicin, Gemcitabin oder Docetaxel, Chemoradiation oder Chemohyperthermie. ⓘ
| Risiko | Sonstige Überlegungen | Chemotherapie | Immuntherapie (BCG) | Zystoskopie (Überwachung) | Bildgebung (Überwachung) |
|---|---|---|---|---|---|
| Niedrig | nach 3 Monaten, gefolgt von einer Zystoskopie nach 12 Monaten, dann jährlich über 5 Jahre | CT/MR-Urographie und CT/MRT des Abdomens und des Beckens bei Studienbeginn | |||
| Mittelwertig | Primärtumor mit Chemotherapie in der Vorgeschichte | Intravesikale Chemotherapie für 1 Jahr ODER Intravesikales BCG für 1 Jahr (bevorzugt) | alle 3 Monate mit Zytologie, danach alle 3-6 Monate für 5 Jahre und dann jährlich | CT/MR-Urographie und CT/MRT des Abdomens und des Beckens bei Studienbeginn | |
| Rezidivierende Tumore mit vorheriger Chemotherapie in der Vorgeschichte | Intravesikales BCG für 1 Jahr | ||||
| Hoch | Intravesikales BCG für 3 Jahre (je nach Verträglichkeit) | alle 3 Monate mit Zytologie, danach alle 3 Monate für 2 Jahre, 6 Monate für 5 Jahre und dann jährlich | CT/MR-Urographie und CT/MRT des Abdomens und des Beckens bei Studienbeginn, CT/MR-Urographie 1-2 jährlich über 10 Jahre | ||
| T1G3/Hochgrad, Lymphgefäßinvasion, Vorliegen einer abweichenden Histologie | Radikale Zystektomie erwägen | ||||
Muskelinvasiv

Multimodale Therapie (Standardbehandlung)
Unbehandelte, nicht-muskelinvasive Tumoren können allmählich beginnen, die Muskelwand der Blase zu infiltrieren (muskelinvasiver Blasenkrebs). Tumoren, die die Blasenwand infiltrieren, erfordern eine radikalere Operation, bei der ein Teil (partielle Zystektomie) oder die gesamte Blase (radikale Zystektomie) entfernt und der Harnstrahl in eine isolierte Darmschlinge (ein so genanntes Ilealkanälchen oder Urostomie) umgeleitet wird. In einigen Fällen können erfahrene Chirurgen eine Ersatzblase (eine Neoblase) aus einem Segment des Darmgewebes herstellen, aber dies hängt weitgehend von den Präferenzen des Patienten, seinem Alter, seiner Nierenfunktion und dem Ort der Erkrankung ab. ⓘ
Die radikale Zystektomie sollte mit einer bilateralen Lymphadenektomie des Beckens einhergehen. Zumindest sollte ein Standardschema für die Lymphadenektomie befolgt werden, bei dem die Lymphknoten des äußeren und inneren Darmbeins sowie des Obturators entfernt werden. Bei der Lymphadenektomie kann der Chirurg entweder Lymphknoten aus einem kleineren (Standard) oder aus einem größeren (erweiterten) Gebiet entfernen. Im Vergleich zu einer Standard-Lymphknotendissektion kann eine erweiterte Lymphknotendissektion die Wahrscheinlichkeit verringern, aus irgendeinem Grund zu sterben, einschließlich des Todes durch Blasenkrebs. Das erweiterte Verfahren kann zu schwerwiegenderen unerwünschten Wirkungen führen und die Wahrscheinlichkeit des Wiederauftretens des Krebses im Laufe der Zeit beeinflussen oder auch nicht. Die Rate der weniger schwerwiegenden Nebenwirkungen kann bei beiden Eingriffen ähnlich sein. ⓘ
Die radikale Zystektomie ist mit einer erheblichen Morbidität verbunden. Bei etwa 50-65 % der Patienten treten innerhalb von 90 Tagen nach dem Eingriff Komplikationen auf. Die Sterblichkeitsrate betrug 7 % innerhalb von 90 Tagen nach der Operation. Zentren mit hohem Operationsvolumen haben bessere Ergebnisse als Zentren mit geringem Volumen. Einige Zentren setzen die Empfehlungen der ERAS-Gesellschaft (Enhanced Recovery After Surgery) um, um die Morbidität nach radikaler Zystektomie zu verringern. Aufgrund fehlender spezifischer Nachweise in der urologischen Chirurgie wurde das ERAS-Protokoll jedoch nicht in großem Umfang in die urologische klinische Versorgung aufgenommen. ⓘ
Selbst nach der chirurgischen Entfernung der Blase entwickeln 50 % der Patienten mit muskelinvasiver Erkrankung (T2-T4) innerhalb von zwei Jahren aufgrund von Mikrometastasen eine metastatische Erkrankung. In diesem Fall hat sich gezeigt, dass eine neoadjuvante Chemotherapie (Chemotherapie vor der Hauptbehandlung, d. h. der Operation) die Gesamtüberlebenszeit nach 5 Jahren von 45 % auf 50 % erhöht, mit einem absoluten Überlebensvorteil von 5 %. Die beiden derzeit am häufigsten verwendeten Chemotherapieschemata für die neoadjuvante Chemotherapie sind platinbasiert: Methotrexat, Vinblastin, Doxorubicin, Cisplatin (MVAC) und Gemcitabin mit Cisplatin (GC). Andere Schemata umfassen dosisdichtes MVAC (DDMVC) und Cisplatin, Methotrexat und Vinblastin (CMV). Obwohl das optimale Schema noch nicht feststeht, ist MVAC das bevorzugte Schema für die neoadjuvante Therapie. ⓘ
Eine adjuvante Chemotherapie (Chemotherapie nach der Hauptbehandlung) kommt nur bei Patienten mit hochgradigen Tumoren (pT3/T4 und/oder N+) in Frage, die nicht mit einer neoadjuvanten Therapie behandelt worden sind. Eine adjuvante Strahlentherapie hat keine Vorteile bei der Behandlung von Blasenkrebs gezeigt. ⓘ
| MVAC | DDMVAC | Gemcitabin + Cisplatin |
|---|---|---|
| Methotrexat (30 mg/m2 IV) - Tag 1,15,22
Vinblastin (3 mg/m2 IV) - Tag 2, 15, 22 Doxorubicin (30 mg/m2 IV) - Tag 2 Cisplatin (70 mg/m2 IV) - Tag 2 Wiederholung alle 4 Wochen für 3 Zyklen |
Methotrexat (30 mg/m2 IV) - Tag 1 Vinblastin (3 mg/m2 IV) - Tag 2 Doxorubicin (30 mg/m2 IV) - Tag 2 Cisplatin (70 mg/m2 IV) - Tag 2 Granulozyten-Kolonie-stimulierender Faktor (G-CSF) (240μg/m2 SC) - Tag 4-10 Wiederholung alle 2 Wochen für 3-4 Zyklen |
Gemcitabin (1.000 mg/m2 IV) - Tag 1,8,15 Cisplatin (70 mg/m2) - Tag 2 Wiederholung alle 4 Wochen für 4 Zyklen |
Trimodale Therapie (alternative Behandlung)
Eine Kombination aus Strahlen- und Chemotherapie (Chemoradiation) in Verbindung mit einer transurethralen (endoskopischen) Blasentumorresektion kann bei bestimmten Patienten als Alternative eingesetzt werden. Eine Überprüfung der verfügbaren großen Datenreihen zu dieser so genannten trimodalen Therapie hat ergeben, dass die langfristigen krebsspezifischen Überlebensraten ähnlich hoch sind und die Lebensqualität insgesamt besser ist als bei Patienten, die sich einer radikalen Zystektomie mit Urinrekonstruktion unterziehen. Allerdings gibt es derzeit keine randomisierten Kontrollstudien, die die trimodale Therapie mit der radikalen Zystektomie verglichen haben. Patienten, die sich einer trimodalen Therapie unterziehen, sind in der Regel hochselektiert und haben in der Regel eine T2-Erkrankung ohne Hydronephrose und/oder Karzinom in situ. Die fünfjährige krebsspezifische Überlebensrate und die Gesamtüberlebensrate nach trimodaler Therapie liegen zwischen 50 % und 82 % bzw. 36 % und 74 %. ⓘ
Bei der trimodalen Therapie wird eine maximale TURBT durchgeführt, gefolgt von einer Chemo- und Strahlentherapie. Es werden strahlensensibilisierende Chemotherapieschemata bestehend aus Cisplatin oder 5-Flurouracil und Mitomycin C eingesetzt. Die Strahlentherapie erfolgt mittels externer Strahlentherapie (EBRT) mit einer kurativen Zieldosis von 64-66 Gy. Die Überwachung auf Fortschreiten oder Wiederauftreten des Tumors sollte mit Hilfe von CT-Scans, Zystoskopien und Urinzytologie erfolgen. Zu den Nebenwirkungen der Chemostrahlung gehören Übelkeit, Erbrechen, Appetitlosigkeit, Haarausfall, wunde Stellen im Mund, Durchfall, Verstopfung, erhöhtes Infektions- und Blutungsrisiko und Müdigkeit. ⓘ
Bei Versagen der trimodalen Therapie wird eine radikale Zystektomie in Betracht gezogen, wenn muskelinvasive oder rezidivierende Tumoren vorliegen. Etwa 25-30 % der Patienten, bei denen die Behandlung versagt, müssen sich einer radikalen Zystektomie unterziehen. Die TURBT mit intravesikaler Therapie ist nach Versagen der Behandlung bei nicht-muskelinvasiven Erkrankungen angezeigt. ⓘ
Partielle Zystektomie
Bei Patienten mit einem solitären Tumor ohne gleichzeitiges Carcinoma in situ in einem Bereich, in dem saubere chirurgische Ränder erzielt werden können, kann eine partielle Zystektomie mit Lymphadenektomie in Betracht gezogen werden. Ein Behandlungsplan, der eine partielle Zystektomie vorsieht, sollte mit einer neoadjuvanten Chemotherapie einhergehen. Bei Patienten mit einem Adenokarzinom der Harnblase kann eine partielle Zystektomie mit En-bloc-Resektion des Ligamentum urachale und des Umbilicus in Betracht gezogen werden. ⓘ
Metastasierte Erkrankung
Erstlinienbehandlung
Eine Cisplatin-haltige Kombinationschemotherapie ist die Standardtherapie für die Behandlung der metastasierten Harnblase. Die Eignung für eine Cisplatin-basierte Chemotherapie wird vor der Behandlung geprüft. Eine Person gilt als untauglich, wenn einer der folgenden Punkte zutrifft.
- Leistungsstatus der Eastern Cooperative Oncology Group von 2
- Kreatinin-Clearance < 60 mL/min
- Grad ≥ 2 der Schwerhörigkeit
- Neuropathie Grad ≥ 2
- Herzinsuffizienz der Klasse III der New York Heart Association ⓘ
Personen, die als tauglich gelten, erhalten platinhaltige Therapien: Methotrexat, Vinblastin, Doxorubicin mit Cisplatin (MVAC) oder Gemcitabin mit Cisplatin (GC). Zu den alternativen Therapien gehören Paclitaxel mit Gemcitabin und Cisplatin (PCG, Dreifachtherapie) und Cisplatin, Methotrexat und Vinblastin (CMV). Die Ansprechrate für die Kombination auf Cisplatinbasis liegt zwischen 39 und 65 %, ein vollständiges Ansprechen wird bei 12-35 % der Patienten beobachtet. MVAC wird besser vertragen, wenn es mit Granulozyten-Kolonie-stimulierendem Faktor kombiniert wird, und das Regime ist als dosisdichtes MVAC-Regime (DDMVAC) bekannt. Diese Kombination senkt nachweislich die Sterblichkeit aller Ursachen. Die MVAC-Behandlung ist aggressiv. Eine febrile Neutropenie (Fieber aufgrund eines Rückgangs der weißen Blutkörperchen) tritt bei 10 bis 14 % auf und der Tod aufgrund von Toxizität bei etwa 3 bis 4 %. Zu den häufigen Nebenwirkungen von MVAC gehören die Suppression des Knochenmarks, Fieber aufgrund der Abnahme der weißen Blutkörperchen, Sepsis, Mukositis sowie Übelkeit und Erbrechen. Im Gegensatz dazu hat sich gezeigt, dass das GC-Schema im Vergleich zu MVAC eine geringere Rate an neutropenischer Sepsis und Mukositis Grad 3/4 aufweist. Es wurden Anstrengungen unternommen, um die Verträglichkeit einer Cisplatin-basierten Therapie zu erhöhen, indem sie durch eine Carboplatin-basierte Chemotherapie ersetzt wurde. Allerdings ist die Cisplatin-basierte Therapie der Carboplatin-basierten Chemotherapie in Bezug auf das Erreichen des Gesamtansprechens und des vollständigen Ansprechens überlegen. Dennoch ist fast die Hälfte der Patienten mit metastasierter Erkrankung für eine Cisplatin-basierte Therapie "ungeeignet". Bei diesen Patienten kann eine Kombination aus Carboplatin und Gemcitabin (GemCarbo) als Erstlinien-Chemotherapie eingesetzt werden. Bei Patienten, die für eine platinbasierte Chemotherapie nicht in Frage kommen und eine PD-L1-Expression aufweisen, können Atezolizumab und Pembrolizumab eingesetzt werden. ⓘ
Personen mit Knochenmetastasen sollten Bisphosphonate oder Denosumab erhalten, um skelettbezogene Ereignisse (z. B. Knochenbrüche, Rückenmarkskompression, Knochenschmerzen) zu verhindern. ⓘ
| DDMVAC | Gemcitabin + Cisplatin |
|---|---|
| Methotrexat (30 mg/m2 IV) - Tag 1
Vinblastin (3 mg/m2 IV) - Tag 2 Doxorubicin (30 mg/m2 IV) - Tag 2 Cisplatin (70 mg/m2 IV) - Tag 2 Granulozyten-Kolonie-stimulierender Faktor (G-CSF) (240μg/m2 SC) - Tag 4-10 Wiederholung alle 2 Wochen für 3-4 Zyklen |
Gemcitabin (1.000 mg/m2 IV) - Tag 1,8,15 Cisplatin (70 mg/m2) - Tag 2 Wiederholung alle 4 Wochen für 4 Zyklen |
| Atezolizumab (bei PD-L1+) | Gemcitabin + Carboplatin | Pembrolizumab (bei Patienten mit PD-L1+) |
|---|---|---|
| Atezolizumab (Atezolizumab 1200 mg IV)
alle 3 Wochen |
Gemcitabin (1.000 mg/m2 IV) - Tag 1,8 Carboplatin (4,5 × [glomeruläre Filtrationsrate + 25]) - Tag 1 und alle 3 Wochen |
Pembrolizumab 200 mg alle 3 Wochen |
Zweitlinienbehandlung
Blasenkrebs, der nach einer platinbasierten Chemotherapie refraktär ist oder ein Fortschreiten zeigt, kann mit einer Zweitlinien-Chemotherapie oder einer Immuntherapie behandelt werden. ⓘ
Die am häufigsten eingesetzte Zweitlinien-Chemotherapie ist eine Monotherapie mit Taxanen (Paclitaxel, nab-Paclitaxel und Docetaxel). Andere Monotherapien umfassen Vinflunin, ein Vincaalkaloid der dritten Generation (in Europa zugelassen), Gemcitabin, Pemetrexed, Oxaliplatin und Ifosfamid. Zu den Nebenwirkungen von Vinflunin gehören Neutropenie, Verstopfung, Müdigkeit und Anämie, was seine Verwendung als Zweitlinientherapeutikum einschränkt. Ein Ansprechen auf eine Zweitlinien-Chemotherapie tritt bei 5-20 % der Patienten auf. Das mediane progressionsfreie Überleben mit einer Zweitlinien-Chemotherapie beträgt 3-4 Monate. ⓘ
Bei Patienten mit Fibroblasten-Wachstumsfaktor-Rezeptor (FGFR)-Mutationen, die auf eine platinbasierte Standardchemotherapie nicht ansprechen, kann Erdafitinib eingesetzt werden. Erdafitinib hat bei diesen Patienten eine Ansprechrate von 40 % gezeigt. ⓘ
In den USA sind fünf Immuntherapeutika für die Behandlung von metastasierendem Blasenkrebs zugelassen worden. Sie wirken durch Hemmung des programmierten Zelltod-Proteins 1 (PD-1) oder des programmierten Zelltod-Liganden 1 (PD-L1). Pembrolizumab und Nivolumab sind Inhibitoren des programmierten Zelltod-Liganden 1 (PD-1). Avelumab, Atezolizumab und Durvalumab sind Inhibitoren von PD-L1. ⓘ
Pembrolizumab verbessert wahrscheinlich das Gesamtüberleben ein wenig und kann die Lebensqualität von Patienten mit Urothelkarzinom, das sich nach der Erstbehandlung verschlimmert hat, im Vergleich zu einer fortgesetzten Chemotherapie leicht verbessern. Allerdings hat Pembrolizumab möglicherweise nur minimale Auswirkungen auf die behandlungsbedingte Sterblichkeitsrate oder das Fortschreiten des Krebses. Pembrolizumab kann weniger schwerwiegende Nebenwirkungen verursachen als eine Chemotherapie. ⓘ
| Atezolizumab | Nivolumab | Pembrolizumab | Durvalumab | Avelumab |
|---|---|---|---|---|
| Atezolizumab 1200 mg IV
alle 3 Wochen |
Nivolumab 3 mg/kg IV alle 2 Wochen |
Pembrolizumab 200 mg alle 3 Wochen |
Durvalumab 10 mg/kg alle 2 Wochen für 12 Monate |
Avelumab 10 mg/kg IV alle 2 Wochen |
Überwachung und Ansprechen
Eine kontrastmittelverstärkte CT wird zur Überwachung von Lungen-, Leber- und Lymphknotenmetastasen eingesetzt. Ein Knochenscan wird zur Erkennung und Überwachung von Knochenmetastasen eingesetzt. Das Ansprechen auf die Behandlung wird anhand der Kriterien für die Beurteilung des Ansprechens bei soliden Tumoren (RECIST) gemessen und in eine der folgenden Gruppen eingeteilt: Ansprechen (vollständig oder teilweise), stabiler Krankheitsverlauf und Fortschreiten der Erkrankung. ⓘ
Prognose
Menschen mit nicht-muskelinvasiven Tumoren haben ein günstiges Ergebnis (die 5-Jahres-Überlebensrate beträgt 95 % gegenüber 69 % bei muskelinvasivem Blasenkrebs). Bei 70 % von ihnen kommt es jedoch nach der Erstbehandlung zu einem Rezidiv, wobei 30 % von ihnen eine muskelinvasive Erkrankung aufweisen. Ein Rezidiv und das Fortschreiten der Erkrankung in ein höheres Stadium haben ein weniger günstiges Ergebnis. ⓘ
Die Überlebensrate nach radikaler Zystektomie und Entfernung der Beckenlymphknoten hängt vom pathologischen Stadium ab. Wenn die Krankheit nicht auf die Lymphknoten übergegriffen hat und auf die Blase begrenzt ist (T1 oder T2, N0), beträgt die 5-Jahres-Überlebensrate 78 %. Wenn sich die Krankheit lokal um die Blase herum ausgebreitet hat, ohne dass ein Lymphknoten betroffen ist (T3, N0), sinkt die 5-Jahres-Überlebensrate auf 47 %. Bei einer Erkrankung mit Lymphknotenbefall (N+, unabhängig vom T-Stadium) beträgt die 5-Jahres-Überlebensrate 31 %. Bei lokal fortgeschrittener und metastasierter Erkrankung sinkt die Überlebensrate drastisch, wobei die mediane Überlebenszeit ohne Chemotherapie 3-6 Monate beträgt. Eine Chemotherapie mit Cisplatin hat die mediane Überlebenszeit auf 15 Monate erhöht. Die 5-Jahres-Überlebensrate liegt jedoch immer noch bei 15 %. ⓘ
Es gibt mehrere prognostische Faktoren, die das krebsspezifische Überleben nach radikaler Zystektomie bestimmen. Faktoren, die sich nachteilig auf das krebsspezifische Überleben auswirken, sind hohes Alter, höherer Tumorgrad und pathologisches Stadium, Lymphknotenmetastasen, Vorhandensein einer lymphatischen Invasion und ein positiver Weichteilrand. Die Lymphknotendichte (positive Lymphknoten/Gesamtlymphknoten im Operationspräparat) ist ein Prädiktor für das Überleben bei lymphknotenpositiver Erkrankung. Je höher die Dichte, desto geringer ist die Überlebensrate. ⓘ
Qualität des Lebens
Nach einer radikalen Zystektomie sind die Harn- und Sexualfunktionen weiterhin schlechter als in der Allgemeinbevölkerung. Menschen mit einer Neoblase haben eine bessere emotionale Funktion und ein besseres Körperbild als Menschen mit einer kutanen Umleitung (die einen Beutel zum Auffangen des Urins über dem Bauch tragen müssen). Soziale Faktoren wie Familie, Beziehungen, Gesundheit und Finanzen tragen wesentlich dazu bei, die Lebensqualität von Menschen zu bestimmen, bei denen Blasenkrebs diagnostiziert wurde. ⓘ
Ein hoher Prozentsatz der Menschen mit Blasenkrebs leidet unter Angstzuständen und Depressionen. Menschen, die jung, alleinstehend und im fortgeschrittenen Krankheitsstadium sind, haben ein hohes Risiko, dass bei ihnen nach der Behandlung eine psychiatrische Erkrankung diagnostiziert wird. Menschen mit psychiatrischen Erkrankungen nach der Behandlung scheinen ein schlechteres krebsspezifisches und Gesamtüberleben zu haben. ⓘ
Epidemiologie
| Rang | Land | Insgesamt | Männer | Frauen ⓘ |
|---|---|---|---|---|
| 1 | Libanon | 25 | 40 | 9 |
| 2 | Griechenland | 21 | 40 | 4 |
| 3 | Dänemark | 18 | 29 | 8 |
| 4 | Ungarn | 17 | 27 | 9 |
| 5 | Albanien | 16 | 27 | 6 |
| 5 | Niederlande | 16 | 26 | 8 |
| 7 | Belgien | 16 | 27 | 6 |
| 8 | Italien | 15 | 27 | 6 |
| 9 | Deutschland | 15 | 26 | 6 |
| 10 | Spanien | 15 | 27 | 6 |

Weltweit führte Blasenkrebs im Jahr 2017 zu 196.000 Todesfällen, was einem Rückgang von 5,4 % (altersbereinigt) gegenüber 2007 entspricht. Im Jahr 2018 lag die altersbereinigte Rate der Neuerkrankungen an Blasenkrebs bei 6 Fällen pro 100.000 Menschen und die altersbereinigte Todesrate bei 2 Todesfällen pro 100.000 Menschen. Libanon und Griechenland weisen die höchste Rate an Neuerkrankungen auf. Im Libanon wird dieses hohe Risiko auf die hohe Zahl der Raucher und die petrochemische Luftverschmutzung zurückgeführt. ⓘ
Das Risiko, an Blasenkrebs zu erkranken, ist bei Männern viermal so hoch wie bei Frauen. Das Rauchen kann diese höhere Rate bei Männern in der westlichen Hemisphäre nur teilweise erklären. Ein weiterer Grund ist, dass der Androgenrezeptor, der bei Männern viel aktiver ist als bei Frauen, eine Rolle bei der Entstehung des Krebses spielen könnte. Diese Hypothese wird auch durch die Tatsache gestützt, dass Männer, die sich aus anderen Gründen einer Androgensuppressionstherapie unterziehen, offenbar ein geringeres Risiko haben, an Blasenkrebs zu erkranken. In Afrika arbeiten Männer häufiger auf dem Feld und sind einer Infektion mit Schistosoma ausgesetzt, was bis zu einem gewissen Grad den Unterschied in der Inzidenz von Plattenepithelkarzinomen in Gebieten erklären könnte, in denen Blasenkrebs endemisch ist. Frauen haben jedoch einen aggressiveren Krankheitsverlauf und schlechtere Ergebnisse als Männer. Diese unterschiedlichen Ergebnisse werden auf zahlreiche Faktoren zurückgeführt, wie z. B. die unterschiedliche Exposition gegenüber Karzinogenen, die Genetik, die soziale Situation und die Qualität der Versorgung. Eines der häufigsten Anzeichen für Blasenkrebs ist Hämaturie, die bei Frauen häufig als Harnwegsinfektion fehldiagnostiziert wird, was zu einer Verzögerung der Diagnose führt. Außerdem kann, wie bereits erwähnt, das PSCA-Gen bei aggressiven Tumoren bei Frauen eine Rolle spielen. ⓘ
Kanada
Blasenkrebs ist die sechsthäufigste Krebsart und macht 3,7 % der neuen Krebsfälle aus. 2018 lebten 30 700 Kanadier mit Blasenkrebs, 9160 neue Fälle wurden diagnostiziert und 2467 starben daran. Im Jahr 2019 werden schätzungsweise 11.800 neue Fälle diagnostiziert werden und 2500 daran sterben. Von den 11 800 neuen Fällen werden 9100 bei Männern und 2700 bei Frauen auftreten. Von den 2500 Todesfällen werden 1800 Männer und 700 Frauen sein. ⓘ
China
Blasenkrebs ist die 14. häufigste Krebsart und die 16. häufigste Krebstodesursache. Im Jahr 2018 gab es 82.300 Neuerkrankungen und 38.200 Todesfälle. Die Zahl der Neuerkrankungen ist im Vergleich zu den westlichen Ländern vergleichsweise gering. Bei der Mehrheit der Menschen wird eine nicht-muskelinvasive Erkrankung diagnostiziert (75 %), der Rest hat eine muskelinvasive Erkrankung (25 %). Ein Carcinoma in situ lag nur in 2,4 % der Fälle vor. ⓘ
Europa
Im Jahr 2015 wurden in der Europäischen Union 131.000 neue Fälle diagnostiziert, 40.000 Menschen starben daran. Es ist die fünfthäufigste Krebserkrankung und die neunthäufigste Ursache für Krebstodesfälle. Die relative 5-Jahres-Überlebensrate für Blasenkrebs, der zwischen 2000 und 2007 diagnostiziert wurde, beträgt 69 %. Die geografischen Unterschiede bei den Überlebensraten liegen zwischen 75 % in Nordeuropa und 65 % in Osteuropa. ⓘ
Vereinigtes Königreich
Blasenkrebs ist die neunthäufigste Krebsart im Vereinigten Königreich und macht 2,7 % aller neuen Krebsfälle aus. Im Jahr 2018 gab es 12.200 neue Fälle und 6100 Menschen starben daran. ⓘ
Vereinigte Staaten
In den Vereinigten Staaten werden für 2019 80.470 Fälle und 17.670 Todesfälle erwartet, womit es sich um die sechsthäufigste Krebsart in der Region handelt. Blasenkrebs ist die vierthäufigste Krebsart bei Männern und die zwölthäufigste Krebsart bei Frauen. Im Jahr 2019 wird bei etwa 62 000 Männern und 19 000 Frauen Blasenkrebs diagnostiziert. Zwischen 2012 und 2016 ist die jährliche Rate der Neuerkrankungen an Blasenkrebs um ein Prozent pro Jahr gesunken. ⓘ
Pathologie

Der häufigste in der Harnblase vorkommende bösartige Tumor ist das vom Urothel der Harnblase ausgehende urotheliale Karzinom. Es können auch Plattenepithelkarzinome vorkommen. Diese entstehen auf der Basis einer Metaplasie des normalen Urothels zu Plattenepithel. Dieser Prozess wird durch die chronische Entzündung durch eine Schistosomiasis ausgelöst, die in Teilen Afrikas und der arabischen Welt endemisch ist. Sehr selten sind drüsige Adenokarzinome und neuroendokrine Karzinome. Ebenso sehr selten können sich auch von der Muskelschicht der Harnblase ausgehend Sarkome bilden. ⓘ
Makroskopie
Mit bloßem Auge lassen sich Harnblasentumoren makroskopisch in zwei Arten einteilen. Einerseits gibt es Tumoren, die sich flach über die Oberfläche des Organs (solide Tumoren) ausdehnen, andererseits solche, die warzenartig (papillär) in das Lumen der Harnblase einwachsen. Der Augenschein gibt dabei keinen Hinweis auf die Invasivität des Tumors. ⓘ
Histologie
Histologisch zeigt der häufigste Typ ein Urothelgewebe mit „krebstypischen“ Atypien. Die Zellkerne sind verändert, verstärkt angefärbt, sehen nicht gleich aus und sind in ihrer Polarität voneinander verschieden. In seiner Gesamtheit zeigt das Epithel eine Aufhebung der Schichtung und ein Fehlen der am Gesunden zu beobachteten Ausreifung von der unteren zur oberflächennahen Schicht. Die restlichen Typen zeichnen sich durch beim Gesunden nicht vorhandene Typen von Oberflächengewebe in der Harnblase aus, welches auch atypisch verändert ist. ⓘ
Das Eindringen des Tumors in tiefere Schichten der Harnblase findet meist in kleinen Zellgruppen statt. Diese sind häufig von einer Entzündungsreaktion aus Lymphozyten und Plasmazellen umgeben. ⓘ
Eine Sonderform des Urothelkarzinoms ist die „Nested-Variante“. Diese zeigt nur geringe Zellatypien und auch immunhistologisch keine besonderen Auffälligkeiten, wächst aber oft bösartig in das umgebende Gewebe ein. Erkennbar ist sie an der nestartigen Anordnung von Tumorzellen. Durch das vergleichsweise harmlose morphologische Erscheinungsbild kann die Diagnose erschwert werden, wenn die Invasion in tiefere Schichten nicht durch das Biopsatmaterial erfasst wird. ⓘ
Immunhistochemie
Die Deckzellen des Urothels bilden auch beim Gesunden Zytokeratin aus. Wie bei anderen Karzinomen ist auch bei Harnblasentumoren immunhistochemisch eine Expression von Zytokeratin nachweisbar. Mit einem gegen das Protein Uroplakin gerichteten Antikörper kann der urotheliale Charakter des Tumors belegt werden. Der Differenzierungsgrad und die eventuelle Malignität der Tumorzellen kann unter anderem durch eine Färbung mit dem Proliferationsmarker Ki-67 abgeschätzt werden, der in Teilung befindliche Zellen markiert. Je mehr Zellen sich in Teilung befinden, desto aggressiver verhält sich im Allgemeinen der Tumor. Auch eine vermehrte Ansammlung von p53-Protein im Zellkern hat eine ungünstige prognostische Bedeutung. ⓘ
Molekularpathologie
Die bereits mit bloßem Auge getroffene Einteilung zwischen soliden und papillären Tumoren spiegelt sich auf genetischer Ebene wider. Die papillären Tumoren zeigen Veränderungen auf beiden Armen des Chromosoms 9. Die soliden Tumoren zeigen als genetische Hauptveränderung eine Mutation des Tumorsuppressorgens p53 auf Chromosom 17. ⓘ
Therapie
Harnableitung nach Entfernung der Blase
Bei Patienten, deren Harnblase entfernt wurde (Zystektomie), gibt es mehrere Möglichkeiten, den Harn abzuleiten. Man unterscheidet kontinente und sogenannte nasse Ableitungen. ⓘ
Eine Möglichkeit ist die Anlage einer Neoblase als Harnblasenersatz. Dazu wird ein ausgeschaltetes Dünndarmsegment (Ileum) zu einer Kugel vernäht und an die Harnleiter sowie an die Harnröhre angeschlossen. Da der Blasenschließmuskel bei der Blasenentfernung erhalten bleibt, sind die Patienten zu einem hohen Prozentsatz kontinent und scheiden den Urin wie gewohnt über die Harnröhre aus. ⓘ
Eine weitere Methode ist das Einpflanzen der Harnleiter in den unteren Abschnitt des Dickdarms (Colon sigmoideum) nach Coffey. Der Urin wird dann zusammen mit dem Stuhl über die Darmaustrittsöffnung (Kloake) ausgeschieden. Diese Methode ist weitgehend verlassen worden zugunsten der Mainz-Pouches. An der Verbindungsstelle zwischen Harnleiter und Darm kann nach rund einem Jahrzehnt eine Bildung von Karzinomen beobachtet werden. ⓘ
Der Urin kann auch über einen künstlich geschaffenen Ausgang (Urostoma) in der Bauchwand abgeleitet werden. Dazu wird etwa ein sogenannter Ileum-Conduit angelegt: aus dem Dünndarm (Ileum) wird ein Segment entnommen, an die Harnleiter angeschlossen und mit dem Stoma verbunden. Auch eine Ersatzblase aus Darmanteilen kann über ein Stoma abgeleitet werden, sie wird dann als Pouch bezeichnet. Diese Methoden stellen eine Option für Patienten dar, denen im Rahmen der Operation auch die Harnröhre entfernt werden musste. ⓘ
Bei allen Ableitungen mit Darmsegmenten ist die Kontrolle des Säure-Base-Haushalts erforderlich, da durch Rückresorption von Urin eine Übersäuerung (Azidose) entstehen kann; gegebenenfalls ist eine Therapie der Azidose mit Bikarbonat angezeigt. ⓘ
Die einfachste Form der Harnableitung ist die Harnleiter-Hautfistel. Hierbei werden die Harnleiter direkt in die Haut eingenäht. Der Vorteil besteht in einer geringeren Belastung durch die Blasenentfernung, da das Bauchfell nicht grundsätzlich eröffnet werden muss. Nachteilig ist die dauerhafte Schienung der Harnleiter mit regelmäßigen Schienenwechseln. ⓘ
Berufskrankheit
1895 stellte der deutsche Chirurg Ludwig Rehn den Zusammenhang zwischen Tätigkeiten in der anilinverarbeitenden Industrie und der Entstehung von Blasenkrebs fest. Blasenkrebs gehört bei entsprechender Konstellation zu den anerkannten Berufskrankheiten. Das Hessische Landessozialgericht Darmstadt hat 2019 entschieden, dass bei einem Kfz-Mechaniker – als er 38 Jahre alt war, wurde bei ihm ein Blasentumor nach BK Nr. 1301 festgestellt – eine Berufskrankheit vorliegt, die die Berufsgenossenschaft finanziell zu entschädigen hat. Grundlegend für seine Erkrankung war der langjährige Kontakt mit giftigen Bleiverbindungen in Ottokraftstoffen. Zudem war der Mann Nichtraucher; üblicherweise hat Tabakkonsum bei Blasentumoren eine schädigende Wirkung. (Az. L 3 U 48/13) Eine Revision ließ das Gericht nicht zu. ⓘ
Medizingeschichte
Zunächst wurde als kurative Operation die einfache Blasenentfernung durchgeführt, bei der die Nachbarorgane und die Beckenlymphknoten belassen wurden. Ab den 1950er Jahren etablierte sich die radikale Blasenentfernung, da sie eine deutliche Steigerung des Überlebens der Patienten mit sich brachte. In den 1980er-Jahren entwickelte der US-amerikanische Chirurg D.G. Skinner diese durch eine noch genauere Technik der Lymphknotenentfernung weiter. ⓘ
In den 1950er Jahren entwickelten US-amerikanische Chirurgen die Ableitung des Urins über den Darm und erarbeiteten die Methode der Bildung einer Neoblase aus Darmanteilen. ⓘ