Schistosomiasis
| Schistosomiasis ⓘ | |
|---|---|
| Andere Namen | Bilharziose, Schneckenfieber, Katayama-Fieber |
 | |
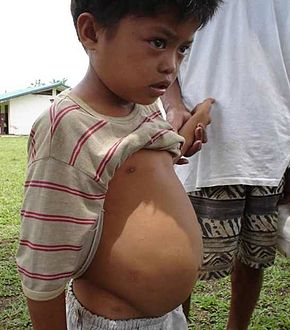
| 11-jähriger Junge mit abdominaler Flüssigkeit und portaler Hypertension aufgrund von Schistosomiasis (Agusan del Sur, Philippinen) | |
| Aussprache |
|
| Fachgebiet | Infektionskrankheit |
| Symptome | Unterleibsschmerzen, Durchfall, blutiger Stuhl, Blut im Urin |
| Komplikationen | Leberschäden, Nierenversagen, Unfruchtbarkeit, Blasenkrebs |
| Auslöser | Schistosomen aus Süßwasserschnecken |
| Diagnostische Methode | Nachweis von Eiern des Parasiten im Urin oder Stuhl, Antikörper im Blut |
| Vorbeugung | Zugang zu sauberem Wasser |
| Medikation | Praziquantel |
| Häufigkeit | 252 Millionen (2015) |
| Todesfälle | 4,400–200,000 |
Schistosomiasis, auch bekannt als Schneckenfieber, Bilharziose und Katayama-Fieber, ist eine Krankheit, die von parasitären Plattwürmern, den Schistosomen, verursacht wird. Die Harnwege oder der Darm können infiziert sein. Zu den Symptomen gehören Bauchschmerzen, Durchfall, blutiger Stuhl oder Blut im Urin. Bei Personen, die über einen längeren Zeitraum infiziert sind, kann es zu Leberschäden, Nierenversagen, Unfruchtbarkeit oder Blasenkrebs kommen. Bei Kindern kann die Krankheit zu Wachstumsstörungen und Lernschwierigkeiten führen. ⓘ
Die Krankheit wird durch Kontakt mit Süßwasser verbreitet, das mit den Parasiten kontaminiert ist. Diese Parasiten werden von infizierten Süßwasserschnecken freigesetzt. Besonders häufig tritt die Krankheit bei Kindern in Entwicklungsländern auf, da sie häufiger in kontaminiertem Wasser spielen. Weitere Risikogruppen sind Landwirte, Fischer und Menschen, die im Alltag unsauberes Wasser benutzen. Sie gehört zur Gruppe der Helmintheninfektionen. Die Diagnose wird durch den Nachweis von Eiern des Parasiten im Urin oder Stuhl einer Person gestellt. Sie kann auch durch den Nachweis von Antikörpern gegen die Krankheit im Blut bestätigt werden. ⓘ
Zu den Methoden zur Vorbeugung der Krankheit gehören die Verbesserung des Zugangs zu sauberem Wasser und die Verringerung der Anzahl von Schnecken. In Gebieten, in denen die Krankheit weit verbreitet ist, kann das Medikament Praziquantel einmal im Jahr an die gesamte Gruppe verabreicht werden. Dadurch soll die Zahl der Infizierten und damit die Ausbreitung der Krankheit verringert werden. Praziquantel ist auch die von der Weltgesundheitsorganisation empfohlene Behandlung für diejenigen, die bekanntermaßen infiziert sind. ⓘ
Im Jahr 2019 waren weltweit etwa 236,6 Millionen Menschen von Schistosomiasis betroffen. Schätzungsweise 4.400 bis 200.000 Menschen sterben jedes Jahr daran. Die Krankheit kommt vor allem in Afrika, Asien und Südamerika vor. Rund 700 Millionen Menschen in mehr als 70 Ländern leben in Gebieten, in denen die Krankheit weit verbreitet ist. In tropischen Ländern ist die Bilharziose nach der Malaria die parasitäre Krankheit mit den größten wirtschaftlichen Auswirkungen. Die Schistosomiasis wird als vernachlässigte Tropenkrankheit eingestuft. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| B65 | Schistosomiasis (Bilharziose) |
| ICD-10 online (WHO-Version 2019) | |
Schistosomiasis, auch Bilharziose, ist eine durch die Larven von Saugwürmern der Gattung Pärchenegel (Schistosoma) verursachte Wurmerkrankung. Sie wird in warmen Binnengewässern durch Schnecken als Zwischenwirte verbreitet. ⓘ
Anzeichen und Symptome


Bei vielen Menschen treten keine Symptome auf. Wenn doch Symptome auftreten, dauert es in der Regel 4-6 Wochen ab dem Zeitpunkt der Infektion. Das erste Symptom der Krankheit kann ein allgemeines Krankheitsgefühl sein. Innerhalb von 12 Stunden nach der Infektion kann der Betroffene über ein Kribbeln oder einen leichten Ausschlag klagen, der aufgrund der Reizung an der Eintrittsstelle allgemein als "Schwimmerjucken" bezeichnet wird. Der Ausschlag, der sich entwickeln kann, kann Krätze und andere Arten von Hautausschlägen imitieren. Weitere Symptome können 2-10 Wochen später auftreten und Fieber, Schmerzen, Husten, Durchfall, Schüttelfrost oder Drüsenvergrößerung umfassen. Diese Symptome können auch mit der Schistosomiasis der Vögel in Verbindung gebracht werden, die beim Menschen keine weiteren Symptome hervorruft. ⓘ
Die Symptome einer Schistosomiasis-Infektion variieren im Laufe der Zeit, wenn die Zerkarien und später die erwachsenen Würmer und ihre Eier durch den Körper wandern. Wenn die Eier in das Gehirn oder Rückenmark wandern, sind Krampfanfälle, Lähmungen oder Rückenmarksentzündungen möglich. ⓘ
Akute Infektion
Zu den Erscheinungsformen einer akuten Infektion mit Schistosoma gehören die Zerkariendermatitis (Stunden bis Tage) und die akute Schistosomiasis (2-8 Wochen). ⓘ
Zerkariendermatitis
Die erste mögliche Reaktion ist ein juckender, makulopapulöser Ausschlag, der durch das Eindringen der Zerkarien in die Haut innerhalb der ersten 12 Stunden bis Tage nach dem Eindringen der Zerkarien in die Haut entsteht. Wenn eine nicht sensibilisierte Person zum ersten Mal mit den Zerkarien in Berührung kommt, sind die Ausschläge in der Regel mild und mit einem Kribbeln verbunden, das schnell von selbst verschwindet, da es sich um eine Überempfindlichkeitsreaktion handelt. Bei sensibilisierten Personen, die zuvor infiziert waren, kann sich der Ausschlag zu juckenden, roten, erhabenen Läsionen (Papeln) entwickeln, von denen sich einige in flüssigkeitsgefüllte Läsionen (Bläschen) verwandeln. Frühere Infektionen mit Zerkarien führen aufgrund der stärkeren Immunreaktion zu einer schnelleren Entwicklung und einem schlimmeren Erscheinungsbild der Dermatitis. Die runden Beulen sind in der Regel ein bis drei Zentimeter groß. Da Menschen, die in den betroffenen Gebieten leben, oft wiederholt mit der Krankheit in Kontakt gekommen sind, treten akute Reaktionen häufiger bei Touristen und Migranten auf. Der Ausschlag kann zwischen den ersten Stunden und einer Woche nach der Exposition auftreten und verschwindet normalerweise innerhalb von 7-10 Tagen von selbst. Eine ähnliche Form der Dermatitis, das so genannte "Schwimmerekzem", kann auch durch Zerkarien von tierischen Trematoden verursacht werden, die häufig Vögel befallen. Die Zerkariendermatitis ist nicht ansteckend und kann nicht von Mensch zu Mensch übertragen werden. ⓘ
Zu den Symptomen können gehören:
- Flacher, roter Ausschlag
- Kleine rote, erhabene Pickel
- Kleine rote Bläschen
- Kribbeln oder Prickeln, Brennen, Juckreiz auf der Haut ⓘ
Das Kratzen am Ausschlag kann zu einer sekundären bakteriellen Infektion der Haut führen, daher ist es wichtig, das Kratzen zu unterlassen. Zu den üblichen Behandlungen gegen Juckreiz gehören Kortikosteroid-Creme, Anti-Juckreiz-Lotion, kühle Umschläge auf den Ausschlag, Bäder in Bittersalz oder Backpulver und in Fällen von starkem Juckreiz verschreibungspflichtige Cremes und Lotionen. Auch orale Antihistaminika können helfen, den Juckreiz zu lindern. ⓘ
Akute Schistosomiasis (Katayama-Fieber)
Die akute Schistosomiasis (Katayama-Fieber) kann Wochen oder Monate (ca. 2-8 Wochen) nach der Erstinfektion als systemische Reaktion gegen wandernde Bilharzioseerreger auf ihrem Weg durch die Blutbahn über die Lunge zur Leber sowie gegen die Antigene der Eier auftreten. Ähnlich wie das Schwimmerekzem tritt das Katayama-Fieber häufiger bei Menschen auf, die sich zum ersten Mal infiziert haben, z. B. bei Migranten und Touristen, und ist mit einer schweren Infektion verbunden. Es wird jedoch auch bei Einheimischen in China beobachtet, die mit S. japonicum infiziert sind. S. japonicum kann bei chronisch infizierten Menschen eine akute Bilharziose verursachen, die zu einer schwereren Form der akuten Bilharziose führen kann. ⓘ
Zu den Symptomen können gehören:
- Trockener Husten mit Veränderungen im Röntgenbild der Brust
- Fieber
- Müdigkeit
- Schmerzen in den Muskeln
- Kopfschmerzen
- Unwohlsein
- Unterleibsschmerzen
- Durchfall
- Vergrößerung von Leber und Milz
- Nesselsucht
Die akute Bilharziose heilt in den meisten Fällen innerhalb von 2-8 Wochen von selbst ab, aber ein kleiner Teil der Betroffenen leidet unter anhaltendem Gewichtsverlust, Durchfall, diffusen Bauchschmerzen und Hautausschlag. ⓘ
Zu den Komplikationen können gehören:
- Eine Entzündung des Rückenmarks (transverse Myelitis) kann auftreten, wenn die Würmer oder Eier während der akuten Phase der Infektion ins Rückenmark gelangen. ⓘ
Die Behandlung kann Folgendes umfassen:
- Kortikosteroide wie Prednison werden eingesetzt, um die Überempfindlichkeitsreaktion zu lindern und die Entzündung zu reduzieren.
- Praziquantel kann zusätzlich zur Kortikosteroidtherapie verabreicht werden, um die erwachsenen Schistosomen abzutöten und eine chronische Infektion zu verhindern. Praziquantel ist bei einer frischen Infektion nicht wirksam, da es nur die erwachsenen Würmer abtötet, nicht aber die vorzeitigen Schistosomen. Daher kann eine erneute Behandlung mit Praziquantel einige Wochen nach der Erstinfektion gerechtfertigt sein. Es wird empfohlen, 4-6 Wochen nach der Erstinfektion mit Praziquantel zu behandeln, da es auf die erwachsenen Würmer wirkt. ⓘ
Chronische Infektion
Bei einer lang anhaltenden Erkrankung legen die erwachsenen Würmer Eier ab, die Entzündungsreaktionen hervorrufen können. Die Eier scheiden proteolytische Enzyme aus, mit deren Hilfe sie in die Blase und den Darm wandern, um dort ausgeschieden zu werden. Die Enzyme verursachen auch eine eosinophile Entzündungsreaktion, wenn sich die Eier im Gewebe verfangen oder in Leber, Milz, Lunge oder Gehirn embolisieren. Die Langzeitmanifestationen hängen von der Schistosomenart ab, da die erwachsenen Würmer der verschiedenen Arten in unterschiedliche Gebiete wandern. Viele Infektionen verlaufen symptomarm, wobei Anämie und Unterernährung in endemischen Gebieten häufig sind. ⓘ
Intestinale Schistosomiasis
Die Würmer von S. mansoni und S. japonicum wandern in die Venen des Magen-Darm-Trakts und der Leber. Die Eier in der Darmwand können zu Schmerzen, Blut im Stuhl und Durchfall (insbesondere bei Kindern) führen. Eine schwere Erkrankung kann zu einer Verengung des Dickdarms oder des Enddarms führen. ⓘ
Bei der intestinalen Schistosomiasis setzen sich die Eier während ihrer Wanderung von den Mesenterialvenolen zum Darmlumen in der Darmwand fest, und die eingeschlossenen Eier verursachen eine Reaktion des Immunsystems, die als granulomatöse Reaktion bezeichnet wird. Sie befallen vor allem den Dickdarm und das Rektum, der Dünndarm ist seltener betroffen. Diese Immunreaktion kann zu einer Obstruktion des Dickdarms und Blutverlust führen. Die infizierte Person kann einen scheinbaren Hängebauch haben. Es besteht eine starke Korrelation zwischen der Morbidität der intestinalen Bilharziose und der Intensität der Infektion. Bei leichten Infektionen können die Symptome mild sein und unerkannt bleiben. Die häufigsten Arten, die eine intestinale Schistosomiasis verursachen, sind S. mansoni und S. japonicum, aber auch S. mekongi und S. intercalatum können diese Krankheit auslösen. ⓘ
Zu den Symptomen können gehören:
- Unterleibsschmerzen und Unwohlsein
- Appetitlosigkeit
- Schleimiger Durchfall mit oder ohne grobes Blut
- Blut im Stuhl, das nicht sichtbar ist (okkultes Blut im Stuhl)
- Abdominales Völlegefühl ⓘ
Zu den Komplikationen können gehören:
- Polypen im Darm
- Darmgeschwüre
- Anämie mit Eisenmangel
- Fistel
- Darmstrikturen (Verengungen des Dickdarms oder Enddarms)
- Eiweißverlierende Enteropathie
- Partielle oder vollständige Darmobstruktion
- Blinddarmentzündung (selten)
Etwa 10-50 % der Menschen, die in endemischen Regionen von S. mansoni und S. japonicum leben, entwickeln eine intestinale Schistosomiasis. Die Infektion mit S. mansoni überschneidet sich epidemiologisch mit der hohen HIV-Prävalenz in Afrika südlich der Sahara, wo die gastrointestinale Schistosomiasis mit einer erhöhten HIV-Übertragung in Verbindung gebracht wurde. ⓘ
Hepatosplenische Schistosomiasis
Die Eier wandern auch in die Leber und führen bei 4 bis 8 % der chronisch infizierten Personen zu Fibrose, vor allem bei Langzeitinfektionen mit hohem Befall. ⓘ
Die Eier können sich in der Leber festsetzen, was zu portaler Hypertension, Splenomegalie, Flüssigkeitsansammlung im Bauchraum und potenziell lebensbedrohlichen Erweiterungen oder geschwollenen Bereichen in der Speiseröhre oder im Magen-Darm-Trakt führt, die reißen und stark bluten können (Ösophagusvarizen). Diese Erkrankung kann in zwei Phasen unterteilt werden: die entzündliche hepatische Schistosomiasis (frühe Entzündungsreaktion) und die chronische hepatische Schistosomiasis. Die häufigsten Arten, die diese Erkrankung verursachen, sind S. mansoni, S. japonicum und S. mekongi. ⓘ
Entzündliche hepatische Schistosomiasis
- Diese Erkrankung tritt vor allem bei Kindern und Jugendlichen auf, und zwar aufgrund einer frühen Immunreaktion auf die Eier, die in den periportalen und präsinusoidalen Räumen der Leber eingeschlossen sind und zahlreiche Granulome bilden. Die Leberfunktion ist nicht beeinträchtigt, und der Schweregrad der Leber- und Milzvergrößerung korreliert mit der Intensität der Infektion. Charakteristisch sind ein vergrößerter linker Leberlappen mit scharfem Rand und eine vergrößerte Milz mit Knötchen. Die Vergrößerung von Leber und Milz ist in der Regel leicht, in schweren Fällen können sie sich jedoch bis auf Höhe des Bauchnabels und sogar bis ins Becken ausdehnen. ⓘ

Chronische (fibrotische) hepatische Schistosomiasis
- Hierbei handelt es sich um eine Lebererkrankung im Spätstadium, die vor allem bei jungen Erwachsenen und Erwachsenen mittleren Alters auftritt, die chronisch mit einer schweren Infektion infiziert waren und deren Immunregulation der Fibrose nicht richtig funktioniert. Sie betrifft nur einen kleinen Teil der infizierten Personen. Die Leberfunktion und die Leberarchitektur sind im Gegensatz zur Zirrhose nicht beeinträchtigt. Die Pathogenese dieser Krankheit wird durch die Ablagerung von Kollagen und extrazellulären Matrixproteinen im periportalen Raum verursacht, was zu einer Leberpfortaderfibrose und vergrößerten fibrotischen Pfortaderwegen (Symmersche Rohrstammfibrose) führt. Die periportale Fibrose drückt die Pfortader physisch zusammen, was zu portaler Hypertension (erhöhtem Pfortaderdruck), erhöhtem Druck in der Milzvene und anschließender Vergrößerung der Milz führt. Die portale Hypertension kann auch den Druck in den portosystemischen Anastomosen (Gefäßverbindungen zwischen dem portalen und dem systemischen Kreislauf) erhöhen, was zu Ösophagusvarizen und Caput medusae führt. Diese portosystemischen Anastomosen bieten den Eiern auch die Möglichkeit, in die Lunge, das Rückenmark oder das Gehirn vorzudringen. In Regionen, in denen die Bilharziose endemisch ist, kommt es häufig zu einer Koinfektion mit Hepatitis B oder Hepatitis C, und eine Koinfektion mit Hepatitis C geht mit einer schnelleren Verschlechterung der Leberfunktion und einem schlechteren Verlauf einher. Eine durch S. mansoni verursachte fibrotische hepatische Schistosomiasis entwickelt sich in der Regel in etwa 5-15 Jahren, während es bei S. japonicum weniger lange dauern kann.
- Zu den Symptomen können gehören:
- Ösophagusvarizen (können lebensbedrohliche Ösophagusvarizenblutungen verursachen)
- Aszites (Endstadium)
- Caput medusae
- Vergrößerte Milz und Leber
- Zu den Komplikationen können gehören:
- Neuroschistosomiasis aufgrund portosystemischer Anastomosen bei portaler Hypertension
- Pulmonale Schistosomiasis aufgrund portosystemischer Anastomosen bei portaler Hypertension ⓘ
Pulmonale Schistosomiasis
Eine portale Hypertension als Folge einer hepatosplenischen Schistosomiasis kann dazu führen, dass sich Gefäßverbindungen zwischen dem portalen Kreislauf (Leber und Darm) und dem systemischen Kreislauf entwickeln, wodurch ein Weg für die Eier und Würmer in die Lunge geschaffen wird. Die Eier können sich um die Alveolarkapillarbetten ablagern und eine granulomatöse Entzündung der Lungenarteriolen mit anschließender Fibrose verursachen. Dies führt zu einem hohen Blutdruck im Lungenkreislauf (pulmonale Hypertonie), einem erhöhten Druck im rechten Herzen, einer Vergrößerung der Lungenarterie und des rechten Vorhofs sowie einer Verdickung der rechten Ventrikelwand. ⓘ
Zu den Symptomen der pulmonalen Hypertonie können gehören
- Kurzatmigkeit
- Schmerzen in der Brust
- Gefühl der Müdigkeit
- Ohnmacht bei körperlicher Anstrengung ⓘ
Urogenitale Schistosomiasis

Die Würmer von S. haematobium wandern in die Venen um Blase und Harnleiter, wo sie sich vermehren. S. haematobium kann bis zu 3000 Eier pro Tag produzieren. Diese Eier wandern von den Venen zu den Blasen- und Harnleiterlumen, aber bis zu 50 Prozent von ihnen können sich im umliegenden Gewebe festsetzen und eine granulomatöse Entzündung, Polypenbildung und Ulzeration von Blasen-, Harnleiter- und Genitaltraktgewebe verursachen. Dies kann 10 bis 12 Wochen nach der Infektion zu Blut im Urin führen. Mit der Zeit kann die Fibrose zu einer Obstruktion der Harnwege, Hydronephrose und Nierenversagen führen. Die Diagnose von Blasenkrebs und die Sterblichkeitsrate sind in den betroffenen Gebieten generell erhöht; die Bemühungen zur Bekämpfung der Bilharziose in Ägypten haben zu einem Rückgang der Blasenkrebsrate geführt. Das Risiko, an Blasenkrebs zu erkranken, scheint bei männlichen Rauchern besonders hoch zu sein, was möglicherweise auf eine chronische Reizung der Blasenschleimhaut zurückzuführen ist, durch die sie den Karzinogenen des Rauchens ausgesetzt wird. ⓘ
Bei Frauen können zu den Urogenitalerkrankungen auch genitale Läsionen gehören, die zu einer erhöhten HIV-Übertragungsrate führen können. Wenn Läsionen die Eileiter oder Eierstöcke betreffen, kann dies zu Unfruchtbarkeit führen. Wenn die männlichen Fortpflanzungsorgane betroffen sind, kann es zu Blut im Sperma kommen. ⓘ
Zu den Symptomen im Urin können gehören:
- Blut im Urin - Blut ist meist am Ende des Urinstrahls zu sehen (häufigstes Symptom)
- Schmerzhaftes Wasserlassen
- Erhöhte Häufigkeit des Wasserlassens
- Eiweiß im Urin
- Sekundäre Harnwegsinfektion
- Sekundäre Niereninfektion
Genitale Symptome können sein:
- Entzündung und Geschwürbildung des Gebärmutterhalses, der Vagina oder der Vulva
- Blut im Sperma
- Unfruchtbarkeit bei der Frau ⓘ
Die Nierenfunktion ist in vielen Fällen nicht beeinträchtigt, und die Läsionen sind bei angemessener Behandlung zur Beseitigung der Würmer reversibel. ⓘ
Neuroschistosomiasis
Läsionen des zentralen Nervensystems treten gelegentlich aufgrund von Entzündungen und Granulombildung um Eier oder Würmer auf, die über den Blutkreislauf in das Gehirn oder das Rückenmark gelangen. Die zerebrale granulomatöse Erkrankung kann durch S. japonicum-Eier im Gehirn sowohl in der akuten als auch in der chronischen Phase der Krankheit verursacht werden. In Gemeinden in China, die von S. japonicum betroffen sind, ist die Rate der Anfälle achtmal höher als im Ausgangszustand. Eine zerebrale granulomatöse Infektion kann auch durch S. mansoni verursacht werden. Die In-situ-Eiablage nach der anomalen Wanderung des adulten Wurms scheint der einzige Mechanismus zu sein, durch den Schistosoma bei Menschen mit Schistosomiasis das zentrale Nervensystem erreichen kann. Die zerstörerische Wirkung auf das Nervengewebe und der Masseneffekt, der durch eine große Anzahl von Eiern hervorgerufen wird, die von multiplen, großen Granulomen in umschriebenen Bereichen des Gehirns umgeben sind, charakterisieren die pseudotumorale Form der Neuroschistosomiasis und sind für das Auftreten klinischer Manifestationen verantwortlich: Kopfschmerzen, Hemiparese, veränderter Geisteszustand, Schwindel, Sehstörungen, Krampfanfälle und Ataxie. Ebenso können granulomatöse Läsionen von S. mansoni und S. haematobium-Eiern im Rückenmark zu einer transversalen Myelitis (Entzündung des Rückenmarks) mit schlaffer Querschnittslähmung führen. Bei fortgeschrittener hepatosplenischer und urinärer Schistosomiasis führt die kontinuierliche Embolisation von Eiern aus dem portalen Mesenterialsystem (S. mansoni) oder dem portalen Mesenterial-Becken-System (S. haematobium) in das Gehirn zu einer spärlichen Verteilung der Eier in Verbindung mit einer geringen periovulären Entzündungsreaktion, die in der Regel keine oder nur eine geringe klinische Bedeutung hat. ⓘ
Zu den Symptomen einer Rückenmarksentzündung (transverse Myelitis) können gehören:
- Lähmung der unteren Extremitäten
- Verlust der Kontrolle über den Darm oder den Urin
- Gefühlsverlust unterhalb der Läsion
- Schmerzen unterhalb der Läsion ⓘ
Zu den Symptomen einer zerebralen granulomatösen Infektion können gehören:
- Krampfanfälle
- Kopfschmerzen
- Motorische Beeinträchtigung
- Beeinträchtigung der Sinnesorgane
- Kleinhirnspezifische Symptome
- Unsicherer Gang
- Unfähigkeit, ohne Unterstützung zu stehen oder zu sitzen
- Unkoordinierte Bewegungen
- Scannende Sprache
- Unregelmäßige Augenbewegungen
Kortikosteroide werden eingesetzt, um bleibende neurologische Schäden durch die Entzündungsreaktion auf die Eier zu verhindern, und manchmal ist ein Antikonvulsivum erforderlich, um die Anfälle zu stoppen. Das Kortikosteroid wird vor der Verabreichung von Praziquantel verabreicht. ⓘ
Übertragung und Lebenszyklus
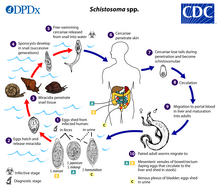
Infizierte Personen geben Schistosoma-Eier über ihre Fäkalien oder ihren Urin ins Wasser ab. Nachdem die Larven aus diesen Eiern geschlüpft sind, infizieren sie eine ganz bestimmte Art von Süßwasserschnecken. Bei S. haematobium und S. intercalatum sind es zum Beispiel Schnecken der Gattung Bulinus, bei S. mansoni ist es Biomphalaria und bei S. japonicum Oncomelania. In diesen Schnecken durchlaufen die Schistosoma-Larven die nächste Phase ihres Lebenszyklus und verbringen ihre Zeit mit der Vermehrung und Entwicklung. Sobald dieser Schritt abgeschlossen ist, verlässt der Parasit die Schnecke und gelangt in die Wassersäule. Ohne einen Säugetierwirt kann der Parasit nur 48 Stunden lang im Wasser leben. Sobald er einen Wirt gefunden hat, dringt der Wurm in dessen Blutgefäße ein. Mehrere Wochen lang bleibt der Wurm in den Blutgefäßen und entwickelt sich bis zum Erwachsenenstadium weiter. Wenn die Reife erreicht ist, kommt es zur Paarung, und es werden Eier produziert. Die Eier gelangen in die Blase/den Darm und werden mit dem Urin und den Fäkalien ausgeschieden, und der Vorgang wiederholt sich. Wenn die Eier nicht ausgeschieden werden, können sie sich im Körpergewebe festsetzen und eine Reihe von Problemen wie Immunreaktionen und Organschäden verursachen. Während die Übertragung normalerweise nur in Ländern erfolgt, in denen Süßwasserschnecken endemisch sind, wurde aus Deutschland ein Fall gemeldet, bei dem sich ein Mann durch eine infizierte Schnecke in seinem Aquarium mit Schistosoma infiziert hatte. ⓘ
Der Mensch kommt mit den Larven des Schistosoma-Parasiten in Berührung, wenn er beim Baden, Spielen, Schwimmen, Waschen, Angeln oder Spazierengehen in kontaminiertes Wasser gelangt. ⓘ

Lebenszyklus
- Die Ausscheidung von Schistosomen-Eiern im Urin oder im Kot, je nach Art
- Das Ausschlüpfen der Eier führt zur Freisetzung der freischwimmenden, flimmernden Larven, den Miracidien
- Die Miracidien finden die Schnecken, die als Zwischenwirte dienen, und dringen in sie ein (die Art der Schnecken hängt von der Art der Schistosomen ab)
- In den Schnecken bilden sich zwei aufeinander folgende Generationen von Sporozysten
- Aus den Sporozysten entwickeln sich die infektiösen freischwimmenden Larven mit gegabelten Schwänzen, die Zerkarien genannt werden, und die Schnecken verlassen, um ins Wasser zu gelangen
- Die Zerkarien finden die menschlichen Wirte und dringen in deren Haut ein
- Nach dem Eindringen in den menschlichen Wirt verlieren die Zerkarien ihre Schwänze und werden zu Schistosomulae
- Die Schistosomulae wandern über den venösen Kreislauf in die Lunge und das Herz
- Sie wandern in das Pfortadersystem der Leber, wo sie zur erwachsenen Form mit zwei getrennten Geschlechtern heranreifen
- Das erwachsene Männchen und das erwachsene Weibchen paaren sich, verlassen die Leber über das Pfortadersystem und wandern in die Venensysteme des Darms oder der Blase (je nach Art), wo sie Eier produzieren
- S. japonicum - obere Mesenterialvenen (kann aber auch untere Mesenterialvenen besiedeln)
- S. mansoni - untere Mesenterialvenen (kann aber auch obere Mesenterialvenen besiedeln)
- S. haematobium - Blasen- und Beckenvenenplexus der Blase (gelegentlich Rektalvenen)
- S. intercalatum und S. guineensis - Plexus mesentericus inferior (unterer Teil des Darms im Vergleich zu S. mansoni)
Schistosomen können durchschnittlich 3 bis 5 Jahre leben, und die Eier können nach der Infektion mehr als 30 Jahre überleben. ⓘ
Andere Wirte
Schistosomiasis ist auch ein Problem in der Rinderhaltung und bei Mäusen. O-Methyl-Threonin ist bei der Schistosomiasis der Maus nur schwach wirksam, wird aber nicht eingesetzt. ⓘ
Pathogenese
Das infektiöse Stadium beginnt, wenn die freischwimmende Larvenform des Schistosoms, die Zerkarien, mit ihren Saugnäpfen, proteolytischen Enzymen und Schwanzbewegungen in die menschliche Haut eindringt; die Zerkarien verwandeln sich in Schistosomulae, indem sie ihren Schwanz verlieren, und wandern anschließend über das Venensystem zum Herzen und zur Lunge, bis sie schließlich die Leber erreichen, wo sie zur erwachsenen Form heranreifen. Die durch Bilharziose verursachten Krankheiten werden in akute und chronische Bilharziose unterteilt und können je nach Art der Bilharziose variieren. ⓘ
Akute Infektion
- Minuten bis Tage nach der Erstinfektion:
- Zerkariendermatitis (Schwimmerekzem) - das Schwimmerekzem wird durch eine örtlich begrenzte allergische Reaktion an den Stellen verursacht, an denen die Zerkarien in die Haut eingedrungen sind, was zu einer Entzündungsreaktion führt, die durch juckende rote Pickel und Bläschen gekennzeichnet ist.
- Einige Wochen bis Monate nach der Erstinfektion:
- Akute Schistosomiasis (Katayama-Fieber) - die genaue Pathophysiologie dieser Krankheit ist noch unbekannt. Man nimmt an, dass sie durch eine systemische Immunreaktion verursacht wird, die auf die Bildung von Immunkomplexen (Typ-III-Hypersensibilität) mit den fremden Antigenen auf den wandernden Schistosomula und den Eiern und die anschließende Ablagerung dieser Komplexe in verschiedenen Geweben zurückzuführen ist und zur Aktivierung einer Autoimmunreaktion führt. Die akute Schistosomiasis, die durch S. mansoni und S. haematobium verursacht wird, betrifft in der Regel Personen, die sich zum ersten Mal infiziert haben, wie z. B. Touristen, die endemische Regionen besuchen. Im Gegensatz dazu können Fälle von akuter Schistosomiasis, die durch S. japonicum verursacht werden, bei der Reinfektion von Menschen auftreten, die sich in endemischen Regionen aufhalten, und sie treten in größerer Häufigkeit auf und können eine schlechtere Prognose haben. Es wurde vorgeschlagen, dass die große Menge der von S. japonicum freigesetzten Ei-Antigene mit Antikörpern interagiert, was zur Bildung einer großen Menge von Immunkomplexen führt, die eine Vergrößerung des Lymphgewebes verursachen. Diese Abfolge von Ereignissen kann zu klinischen Manifestationen wie Fieber, Vergrößerung von Milz und Leber aufgrund von Fibrose, portaler Hypertension und Tod führen. ⓘ
Chronische Infektion ⓘ
Die klinischen Symptome einer chronischen Infektion werden hauptsächlich durch eine Immunreaktion auf die in den Geweben eingeschlossenen Eier verursacht, die zur Bildung von Granulomen und chronischen Entzündungen führt. Die erwachsenen Würmer leben paarweise zusammen (ein Männchen und ein Weibchen), pflanzen sich sexuell fort und legen je nach Art Eier in den Venen um den Darm und die Blase ab, die die Venenwand durchbrechen können, um in das umliegende Gewebe zu gelangen. Mit Hilfe proteolytischer Enzyme bahnen sich die Eier ihren Weg durch das Gewebe bis zum Darm- oder Blasenlumen. Ein großer Teil der Eier ist jedoch nicht in der Lage, ihre Reise zu beenden und bleibt im Gewebe stecken, wo sie eine Immunreaktion auslösen können. Die Miracidien in diesen Eiern können dann Antigene freisetzen, die eine entzündliche Immunreaktion hervorrufen. Die Miracidien in den Eiern leben etwa 6-8 Wochen, bevor sie absterben und keine Antigene mehr freisetzen. Die granulomatöse Reaktion ist eine zelluläre Immunreaktion, die von CD4+ T-Zellen, Neutrophilen, Eosinophilen, Lymphozyten, Makrophagen und Monozyten vermittelt wird, und diese von den Eiern ausgelöste chronische Entzündungsreaktion kann zu Fibrose, Gewebszerstörung und Granulomknötchen führen, die die Funktionen der betroffenen Organe beeinträchtigen. In den frühen Phasen der Infektion ist die Th1-Helferzellreaktion vorherrschend, die Zytokine wie IFN-γ freisetzt. Mit fortschreitender Eierproduktion geht sie in eine Th2-Reaktion über, die zu einem Anstieg von IgE, IL-4 und Eosinophilen führt. Bei chronischen Infektionen geht die Th2-Antwort in einen Anstieg von IL-10, IL-13 und IgG4 über, was das Fortschreiten der Granulome umkehrt und zu Kollagenablagerungen an den Stellen der Granulome führt. Die spezifischen klinischen Symptome und der Schweregrad der dadurch verursachten Erkrankung hängen von der Art der Schistosomeninfektion, der Dauer der Infektion, der Anzahl der Eier und dem Organ ab, an dem die Eier abgelagert werden. Die Menge der im Gewebe eingeschlossenen Eier nimmt weiter zu, wenn die Schistosomen nicht beseitigt werden. ⓘ
Diagnose


Identifizierung von Eiern im Stuhl
Die Diagnose einer Infektion wird durch den Nachweis von Eiern im Stuhl bestätigt. Die Eier von S. mansoni sind etwa 140 x 60 µm groß und haben einen Seitenstachel. Die Diagnose wird durch den Einsatz der Kato-Katz-Technik, einer semiquantitativen Stuhluntersuchungstechnik, verbessert. Weitere Methoden sind der Enzymimmunoassay, der Zirkumoval-Präzipitationstest und der Alkalische Phosphatase-Immunoassay. ⓘ
Der mikroskopische Nachweis von Eiern im Stuhl oder Urin ist die praktischste Methode zur Diagnose. Eine Stuhluntersuchung sollte bei Verdacht auf eine Infektion mit S. mansoni oder S. japonicum durchgeführt werden, eine Urinuntersuchung bei Verdacht auf S. haematobium. Bei Infektionen mit allen Schistosoma-Arten können Eier im Stuhl vorhanden sein. Die Untersuchung kann anhand eines einfachen Abstrichs (1 bis 2 mg Stuhlmaterial) durchgeführt werden. Da die Eier intermittierend oder in geringer Zahl ausgeschieden werden können, wird ihr Nachweis durch wiederholte Untersuchungen oder Konzentrationsverfahren oder beides verbessert. Darüber hinaus kann bei Felduntersuchungen und zu Untersuchungszwecken die Eiausscheidung mit der Kato-Katz-Technik (20 bis 50 mg Kotmaterial) oder der Ritchie-Technik quantifiziert werden. Bei Infektionen mit S. haematobium (empfohlene Sammelzeit: zwischen 12 und 15 Uhr) und mit S. japonicum können Eier im Urin gefunden werden. Eine Quantifizierung ist möglich, indem ein Standardvolumen Urin durch eine Nukleoporen-Filtermembran filtriert und anschließend die Eier auf der Membran gezählt werden. Eine Gewebebiopsie (Rektalbiopsie für alle Arten und Blasenbiopsie für S. haematobium) kann Eier nachweisen, wenn Stuhl- oder Urinuntersuchungen negativ sind. ⓘ
Der Nachweis einer Mikrohämaturie im Urin mit Hilfe von Urinreagenzstreifen ist bei der Identifizierung einer aktiven Bilharziose in endemischen Gebieten genauer als Tests mit zirkulierenden Antigenen. ⓘ
Nachweis von Antikörpern
Der Antikörpernachweis kann nützlich sein, um eine Bilharziose-Infektion bei Personen nachzuweisen, die in Gebiete gereist sind, in denen Bilharziose häufig vorkommt, und bei denen in Stuhl- oder Urinproben keine Eier nachgewiesen werden können. Sensitivität und Spezifität der Tests variieren stark zwischen den zahlreichen Tests, die für die serologische Diagnose von Bilharziose eingesetzt werden, und hängen sowohl von der Art der verwendeten Antigenpräparate (roh, gereinigt, erwachsener Wurm, Ei, Zerkarien) als auch vom Testverfahren ab. ⓘ
In den U.S. Centers for Disease Control and Prevention wird für den Antikörpernachweis eine Kombination von Tests mit gereinigten Antigenen des adulten Wurms verwendet. Alle Serumproben werden mittels FAST-ELISA unter Verwendung des mikrosomalen Antigens von S. mansoni getestet. Eine positive Reaktion (mehr als 9 Einheiten/µl Serum) weist auf eine Infektion mit Schistosoma-Arten hin. Die Sensitivität für eine Infektion mit S. mansoni beträgt 99 %, 95 % für eine Infektion mit S. haematobium und weniger als 50 % für eine Infektion mit S. japonicum. Die Spezifität dieses Tests zum Nachweis einer Schistosomeninfektion beträgt 99 %. Da die Testempfindlichkeit des FAST-ELISA für andere Spezies als S. mansoni herabgesetzt ist, werden Immunoblots der Spezies, die der Reisegeschichte der Person entspricht, ebenfalls getestet, um den Nachweis von S. haematobium- und S. japonicum-Infektionen sicherzustellen. Immunoblots mit mikrosomalen Antigenen von adulten Würmern sind artspezifisch, so dass eine positive Reaktion auf die infizierende Spezies hinweist. Das Vorhandensein von Antikörpern ist nur ein Hinweis auf eine Schistosomeninfektion zu einem bestimmten Zeitpunkt und kann nicht mit dem klinischen Status, der Wurmlast, der Eiproduktion oder der Prognose korreliert werden. Der Aufenthaltsort einer Person kann bei der Bestimmung der Schistosoma-Spezies helfen, auf die mittels Immunoblot getestet werden soll. ⓘ
Im Jahr 2005 wurde in Uganda ein neuartiges Handmikroskop zur Diagnose der intestinalen Bilharziose von einem Team unter der Leitung von Russell Stothard vom Natural History Museum of London in Zusammenarbeit mit der Schistosomiasis Control Initiative, London, vor Ort getestet. ⓘ
Molekulare Diagnostik
Auf der Polymerase-Kettenreaktion (PCR) basierende Tests sind genau und schnell. Sie wird jedoch in Ländern, in denen die Krankheit weit verbreitet ist, aufgrund der Kosten für die Ausrüstung und der für die Durchführung der Tests erforderlichen Fachkenntnisse nicht häufig eingesetzt. Die Verwendung eines Mikroskops zum Nachweis von Eiern kostet etwa 0,40 US-Dollar pro Test, während die PCR etwa 7 US-Dollar pro Test kostet (Stand 2019). Die schleifenvermittelte isotherme Amplifikation wird derzeit untersucht, da sie kostengünstiger ist. LAMP-Tests sind 2019 noch nicht im Handel erhältlich. ⓘ
Labortests
Das S. haematobium-Screening in der Gemeinde kann mit einem Urintest auf Hämaturie und mit dem Guajak-Stuhltest auf Blut im Stuhl auf eine mögliche Infektion mit S. mansoni und S. japonicum überprüft werden. Bei Reisenden oder Migranten in endemischen Regionen kann ein komplettes Blutbild mit Differenzialdiagnose durchgeführt werden, um einen hohen Eosinophilenspiegel im Blut festzustellen, der auf eine akute Infektion hindeuten könnte. Bei Verdacht auf hepatosplenische Schistosomiasis kann ein Leberfunktionstest angeordnet werden, und bei abnormalem Leberfunktionstest kann ein Hepatitis-Testpanel angeordnet werden. ⓘ
Gewebebiopsie
Wenn andere Diagnosemethoden der Bilharziose nicht zum Nachweis der Infektion geführt haben, aber immer noch ein hoher Verdacht auf Bilharziose besteht, kann eine Gewebebiopsie aus dem Rektum, der Blase und der Leber entnommen werden, um in den Gewebeproben nach Bilharziose-Eiern zu suchen. ⓘ
Bildgebung
Bildgebende Verfahren wie Röntgen, Ultraschall, Computertomographie (CT) und Magnetresonanztomographie (MRT) können eingesetzt werden, um den Schweregrad der Bilharziose und Schäden an den infizierten Organen festzustellen. Mit Röntgen- und CT-Aufnahmen des Brustkorbs lassen sich beispielsweise Läsionen in der Lunge bei pulmonaler Bilharziose erkennen, und Röntgenaufnahmen des Beckens können Verkalkungen der Blase bei chronischer Bilharziose aufdecken. Mit Ultraschall kann bei hepatosplenischer Schistosomiasis nach Anomalien in Leber und Milz gesucht werden, und eine CT-Untersuchung der Leber ist ein gutes Mittel, um Verkalkungen in der Leber im Zusammenhang mit einer S. japonicum-Infektion zu erkennen. Eine CT-Untersuchung der Leber ist ein gutes Mittel, um Verkalkungen in der Leber im Zusammenhang mit einer Infektion mit S. japonicum festzustellen. Die MRT wird zur Beurteilung der Bilharziose des zentralen Nervensystems, der Leber und der Genitalien eingesetzt. ⓘ
PET/CT-Scans, mit denen Gewebe mit erhöhter Stoffwechselaktivität identifiziert werden können, wurden in seltenen Fällen zur Diagnose von Bilharziose eingesetzt. Dies ist auf die starke Entzündung zurückzuführen, die durch die Schistosomeneier verursacht wird und die Stoffwechselrate des umliegenden Gewebes erhöht. ⓘ
Vorbeugung

Viele Länder arbeiten daran, die Krankheit auszurotten. Die Weltgesundheitsorganisation fördert diese Bemühungen. In einigen Fällen haben die Verstädterung, die Umweltverschmutzung und die daraus resultierende Zerstörung des Lebensraums der Schnecken zu einer geringeren Exposition und damit zu einem Rückgang der Neuinfektionen geführt. In der Vergangenheit wurde versucht, die Schneckenpopulationen mit Hilfe von Molluskiziden zu eliminieren, um Bilharziose vorzubeugen, doch war dies ein teures Verfahren, das die Schneckenpopulationen oft nur reduzierte, aber nicht eliminierte. Das Medikament Praziquantel wird zur Vorbeugung in Hochrisikopopulationen eingesetzt, die in Gebieten leben, in denen die Krankheit weit verbreitet ist. Die Centers for Disease Control and Prevention raten, in Gebieten, in denen Bilharziose häufig vorkommt, nicht zu trinken oder mit kontaminiertem Wasser in Kontakt zu kommen. ⓘ
Eine Untersuchung aus dem Jahr 2014 ergab, dass ein verbesserter Zugang zu sauberem Wasser und sanitären Einrichtungen die Zahl der Bilharziose-Infektionen verringert. ⓘ
Weitere wichtige Präventivmaßnahmen sind Hygieneerziehung, die zu Verhaltensänderungen führt, und sanitäre Anlagen, die eine sichere Wasserversorgung gewährleisten. ⓘ
Vorbeugende Chemotherapie
Zur Bekämpfung der Bilharziose empfiehlt die Weltgesundheitsorganisation (WHO) eine präventive Chemotherapie, d. h. die Behandlung der gesamten betroffenen Bevölkerung und die regelmäßige Behandlung aller Gruppen mit hohem Risiko, sich mit Bilharziose zu infizieren, mit Praziquantel. Im Jahr 2019 wurden weltweit 44,5 % der Menschen mit Bilharziose behandelt, und 67,2 % der Kinder im Schulalter, die eine präventive Chemotherapie benötigten, wurden behandelt. ⓘ
Schnecken, Dämme und Garnelen
Ab den 1950er Jahren wurden über viele Jahre hinweg riesige Staudämme und Bewässerungsanlagen gebaut, was zu einem massiven Anstieg der durch Wasser übertragenen Bilharziose-Infektionen führte. Die detaillierten Spezifikationen, die seit den 1950er Jahren in verschiedenen Dokumenten der Vereinten Nationen festgelegt wurden, hätten dieses Problem minimieren können. Bewässerungssysteme können so angelegt werden, dass sie die Besiedlung des Wassers durch Schnecken erschweren und den Kontakt mit der lokalen Bevölkerung verringern. Obwohl bereits vor Jahren Leitlinien für die Gestaltung dieser Systeme zur Minimierung der Ausbreitung der Krankheit veröffentlicht worden waren, kannten die Planer diese nicht. Die Dämme scheinen die Population der großen wandernden Garnele Macrobrachium, die die Schnecken frisst, reduziert zu haben. Nach dem Bau von vierzehn großen Staudämmen kam es in den historischen Lebensräumen der einheimischen Garnelen zu einer stärkeren Zunahme der Bilharziose als in anderen Gebieten. Am Diama-Damm am Senegal-Fluss von 1986 verringerte die Wiederansiedlung von Garnelen flussaufwärts des Damms sowohl die Schneckendichte als auch die Neuinfektionsrate der Bilharziose beim Menschen. ⓘ
Integrierte Strategie in China
In China hat sich die nationale Strategie zur Bekämpfung der Bilharziose seit ihren Anfängen dreimal geändert: die Strategie zur Kontrolle der Übertragung (von Mitte der 1950er bis Anfang der 1980er Jahre), die Strategie zur Bekämpfung der Morbidität (von Mitte der 1980er bis 2003) und die "neue integrierte Strategie" (2004 bis heute). Die Morbiditätskontrollstrategie konzentrierte sich auf die synchrone Chemotherapie von Menschen und Rindern, während die 2004 entwickelte neue Strategie in den Übertragungsweg der Bilharziose eingreift und vor allem den Ersatz von Rindern durch Maschinen, das Verbot der Weidehaltung von Rindern im Grasland, die Verbesserung der sanitären Verhältnisse, die Installation von Fäkalienbehältern auf Booten, die medikamentöse Behandlung mit Praziquantel, die Schneckenbekämpfung und die Gesundheitserziehung umfasst. Eine Überprüfung im Jahr 2018 ergab, dass die "neue integrierte Strategie" die Infektionsrate mit S. japonicum sowohl beim Menschen als auch beim Zwischenwirt Schnecke hochwirksam reduzierte und das Infektionsrisiko im Vergleich zur herkömmlichen Strategie um das Drei- bis Vierfache verringerte. ⓘ
Behandlung

Für die Behandlung von Schistosomiasis stehen zwei Medikamente zur Verfügung: Praziquantel und Oxamniquin. Sie werden in Bezug auf ihre Wirksamkeit gegen S. mansoni und ihre Sicherheit als gleichwertig angesehen. Aufgrund der niedrigeren Kosten von Praziquantel pro Behandlung und der mangelnden Wirksamkeit von Oxamniquin gegen die urogenitale Form der durch S. haematobium verursachten Krankheit wird Praziquantel im Allgemeinen als erste Behandlungsoption angesehen. Praziquantel kann unbedenklich bei schwangeren Frauen und Kleinkindern eingesetzt werden. Ziel der Behandlung ist es, die Krankheit zu heilen und den Übergang von der akuten zur chronischen Form der Krankheit zu verhindern. Alle Fälle von Verdacht auf Schistosomiasis sollten unabhängig vom Krankheitsbild behandelt werden, da der erwachsene Parasit jahrelang im Wirt leben kann. ⓘ
Schistosomiasis kann durch die jährliche Einnahme einer Einzeldosis des Medikaments Praziquantel behandelt werden. ⓘ
Praziquantel tötet nur die erwachsenen Schistosomen, nicht aber die Eier und unreifen Würmer. Lebende Eier können von den infizierten Personen noch wochenlang nach der Behandlung mit Praziquantel ausgeschieden werden. Die unreifen Würmer können überleben und nach der Praziquantel-Therapie zu erwachsenen Schistosomen heranwachsen. Daher ist es wichtig, etwa 4-6 Wochen nach der Praziquantel-Therapie wiederholte Bilharziose-Untersuchungen des Stuhls und/oder Urins durchzuführen. Die Behandlung mit Praziquantel kann wiederholt werden, um eine vollständige Beseitigung des Parasiten zu gewährleisten. ⓘ
Die WHO hat auf der Grundlage der Auswirkungen der Krankheit auf Kinder in Dörfern, in denen sie häufig vorkommt, Leitlinien für die Behandlung in der Gemeinde entwickelt:
- Wenn ein Dorf meldet, dass mehr als 50 Prozent der Kinder Blut im Urin haben, erhalten alle Kinder des Dorfes eine Behandlung.
- Wenn 20 bis 50 Prozent der Kinder blutigen Urin haben, werden nur Kinder im schulpflichtigen Alter behandelt.
- Wenn weniger als 20 Prozent der Kinder Symptome aufweisen, wird keine Massenbehandlung durchgeführt. ⓘ
Andere mögliche Behandlungen umfassen eine Kombination von Praziquantel mit Metrifonat, Artesunat oder Mefloquin. Eine Cochrane-Überprüfung ergab vorläufige Hinweise darauf, dass Metrifonat bei alleiniger Anwendung ebenso wirksam ist wie Praziquantel. Mefloquin, das früher zur Behandlung und Vorbeugung von Malaria eingesetzt wurde, wurde 2008-2009 als wirksam gegen Schistosoma anerkannt. ⓘ
In der Vergangenheit war Antimonkaliumtartrat bis zur Entwicklung von Praziquantel in den 1980er Jahren das Mittel der Wahl zur Behandlung von Bilharziose. ⓘ
Überwachung nach der Behandlung Osteopontin (OPN) ist ein vielversprechendes Instrument zur Überwachung der Wirksamkeit von Praziquantel und der Rückbildung der Fibrose nach der Behandlung, da die (OPN)-Expression durch die Ei-Antigene von Schistosoma mansoni moduliert wird und seine Werte mit dem Schweregrad der Schistosomiasis-Fibrose und der portalen Hypertension bei Mäusen und Menschen korrelieren. Die Pharmakotherapie mit Praziquantel (PZQ) reduziert den systemischen OPN-Spiegel und den Kollagengehalt der Leber bei Mäusen. ⓘ
Epidemiologie


Die Krankheit ist in tropischen Ländern in Afrika, der Karibik, dem östlichen Südamerika, Südostasien und dem Nahen Osten verbreitet. S. mansoni kommt in Teilen Südamerikas und der Karibik, in Afrika und im Nahen Osten vor; S. haematobium in Afrika und im Nahen Osten; und S. japonicum im Fernen Osten. S. mekongi und S. intercalatum kommen lokal in Südostasien bzw. im zentralen Westafrika vor. ⓘ
Die Krankheit ist in etwa 75 Entwicklungsländern endemisch und betrifft hauptsächlich Menschen, die in ländlichen, landwirtschaftlichen und stadtnahen Gebieten leben. ⓘ
| Art der Infektion | Spezies | Ort ⓘ |
|---|---|---|
| Darm | Schistosoma mansoni | Afrika, Naher Osten, Karibik, Brasilien, Venezuela, Surinam |
| Darm | Schistosoma japonicum | China, Indonesien, Philippinen |
| Darm | Schistosoma mekongi | Kambodscha, Laos |
| Darm | Schistosoma guineensis | Zentralafrika, Regenwald |
| Darm | Schistosoma intercalatum | Zentralafrika, Regenwald |
| Urogenital | Schistosoma haematobium | Afrika, Naher Osten, Korsika |
Schätzungen zur Infektion
Im Jahr 2010 waren etwa 238 Millionen Menschen mit Bilharziose infiziert, 85 Prozent davon leben in Afrika. Eine frühere Schätzung aus dem Jahr 2006 hatte die Zahl der Infizierten auf 200 Millionen geschätzt. Nach den jüngsten Angaben der WHO waren im Jahr 2019 236,6 Millionen Menschen infiziert. In vielen der betroffenen Gebiete ist ein großer Teil der Kinder unter 14 Jahren mit Bilharziose infiziert. Weltweit sind schätzungsweise 600 bis 700 Millionen Menschen von der Krankheit bedroht, weil sie in Ländern leben, in denen der Erreger weit verbreitet ist. Im Jahr 2012 waren 249 Millionen Menschen auf eine Behandlung angewiesen, um die Krankheit zu verhindern. Damit ist S. haematobium wahrscheinlich die häufigste parasitäre Infektion, gefolgt von Malaria, die im Jahr 2013 etwa 207 Millionen Fälle verursachte. ⓘ
S. haematobium, der Erreger der urogenitalen Bilharziose, infiziert allein in Afrika südlich der Sahara jährlich über 112 Millionen Menschen. Er ist für 32 Millionen Fälle von Dysurie, 10 Millionen Fälle von Hydronephrose und 150.000 Todesfälle durch Nierenversagen pro Jahr verantwortlich, was S. haematobium zum tödlichsten Schistosom der Welt macht. ⓘ
Todesfälle
Die Schätzungen über die Zahl der Todesfälle schwanken. Die Global Burden of Disease Study aus dem Jahr 2010 schätzt die Zahl der direkten Todesfälle auf 12.000, während die WHO im Jahr 2014 von mehr als 200.000 jährlichen Todesfällen im Zusammenhang mit Bilharziose ausging. Weitere 20 Millionen Menschen leiden unter den schweren Folgen der Krankheit. Sie ist die tödlichste der vernachlässigten tropischen Krankheiten. ⓘ
Geschichte
Die ältesten Hinweise auf Bilharziose stammen aus der Zeit vor mehr als 6000 Jahren. In Studien an menschlichen Skelettresten, die in Nordsyrien (5800-4000 v. Chr.) gefunden wurden, konnte ein endständiges, stacheliges Schistosom im Beckensediment der Skelettreste nachgewiesen werden. Auch wenn diese Nachweise aus Syrien stammen, wird vermutet, dass die "Wiege" der Schistosomen in der Region der großen afrikanischen Seen liegt, einem Gebiet, in dem sich sowohl die Parasiten als auch ihre Zwischenwirte in einem aktiven Entwicklungsstadium befinden. Es wird angenommen, dass sich die Bilharziose durch die Einfuhr von Affen und Sklaven während der fünften Pharaonendynastie (~ 2494-2345 v. Chr.) nach Ägypten verbreitet hat. ⓘ
Die Schistosomiasis ist in vielen Ländern als Bilharziose oder Bilharziose bekannt, nach dem deutschen Arzt Theodor Bilharz, der 1851 erstmals die Ursache der Schistosomiasis im Urin beschrieb. ⓘ
Der erste Arzt, der den gesamten Krankheitszyklus beschrieb, war der brasilianische Parasitologe Pirajá da Silva im Jahr 1908. Der älteste bekannte Fall einer Infektion wurde 2014 bei einem Kind entdeckt, das vor 6.200 Jahren lebte. ⓘ
In der griechisch-römischen Zeit war sie eine häufige Todesursache bei den Ägyptern. ⓘ
Im Jahr 2016 waren mehr als 200 Millionen Menschen behandlungsbedürftig, aber nur 88 Millionen Menschen wurden tatsächlich wegen Bilharziose behandelt. ⓘ
Etymologie
Die Blasenbilharziose taucht möglicherweise bereits im altägyptischen Papyrus Ebers als Aaa-Krankheit auf. Der Name der Krankheit geht auf den deutschen Tropenarzt Theodor Bilharz zurück, der den Erreger bei Obduktionen in einer Kairoer Klinik 1851 entdeckte. Zunächst wurde der Parasit nach seinem Entdecker Bilharzia genannt. ⓘ
Schistosomiasis ist nach der Gattung des parasitären Plattwurms Schistosoma benannt, dessen Name "gespaltener Körper" bedeutet. Der Name Bilharziose stammt von Theodor Bilharz, einem deutschen Pathologen, der 1851 in Ägypten arbeitete und diese Würmer erstmals entdeckte. ⓘ
Gesellschaft und Kultur
Bilharziose ist in Ägypten endemisch und wurde durch die Staudamm- und Bewässerungsprojekte entlang des Nils noch verschlimmert. Von den späten 1950er bis in die frühen 1980er Jahre wurden infizierte Dorfbewohner mit wiederholten Injektionen von Weinstein-Emetikum behandelt. Epidemiologische Erkenntnisse deuten darauf hin, dass diese Kampagne ungewollt zur Verbreitung von Hepatitis C über unsaubere Nadeln beigetragen hat. Ägypten hat die weltweit höchste Hepatitis-C-Infektionsrate, und die Infektionsraten in verschiedenen Regionen des Landes hängen eng mit dem Zeitpunkt und der Intensität der Anti-Bistosomiasis-Kampagne zusammen. Von der Antike bis ins frühe 20. Jahrhundert galt das Symptom der Bilharziose, Blut im Urin, in Ägypten als männliche Version der Menstruation und wurde daher als Übergangsritus für Jungen angesehen. ⓘ
Unter den parasitären Krankheiten des Menschen steht die Bilharziose nach der Malaria an zweiter Stelle, was die sozioökonomische und gesundheitliche Bedeutung in tropischen und subtropischen Gebieten angeht. ⓘ
Forschung
1989 erhielten Aklilu Lemma (1935–1997) und Legesse Wolde-Yohannes den Right Livelihood Award zugesprochen; sie hatten herausgefunden, dass die sogenannte „Endod-Pflanze“ Phytolacca dodecandra (eine Art aus der Gattung der Kermesbeeren) als preiswertes Mittel zur Vorbeugung gegen Bilharziose genutzt werden kann. 2008 wurde die Wirksamkeit von Oxadiazol-Derivaten gegen den Pärchenegel entdeckt, zudem wird an der Entwicklung von Schistosomiasisimpfstoffen geforscht. ⓘ
Ein vorgeschlagener Impfstoff gegen die Infektion mit S. haematobium namens "Bilhvax" wurde in einer klinischen Phase-3-Studie an Kindern im Senegal getestet: Die 2018 veröffentlichten Ergebnisse zeigten, dass der Impfstoff nicht wirksam war, obwohl er eine gewisse Immunreaktion hervorrief. Mithilfe der CRISPR-Gen-Editierungstechnologie konnten Forscher die durch Bilharziose verursachten Symptome in einem Tiermodell verringern. ⓘ
