Eisen(III)-oxid
 Fe O
| |

| |

| |
| Bezeichnungen | |
|---|---|
| IUPAC-Bezeichnung
Eisen(III)-oxid
| |
| Andere Bezeichnungen
Eisenoxid, Hämatit, Eisen(III)-oxid, rotes Eisenoxid, Rouge, Maghemit, Colcothar, Eisensesquioxid, Rost, Ocker
| |
| Bezeichnungen | |
3D-Modell (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| EC-Nummer |
|
Gmelin-Referenz
|
11092 |
| KEGG | |
PubChem CID
|
|
| RTECS-Nummer |
|
| UNII | |
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
Fe2O3 |
| Molare Masse | 159,687 g-mol-1 |
| Erscheinungsbild | Rot-brauner Feststoff |
| Geruch | Geruchlos |
| Dichte | 5,25 g/cm3 |
| Schmelzpunkt | 1.539 °C (2.802 °F; 1.812 K) zersetzt sich 105 °C (221 °F; 378 K) β-Dihydrat, zersetzt sich 150 °C (302 °F; 423 K) β-Monohydrat, zersetzt sich 50 °C (122 °F; 323 K) α-Dihydrat, zersetzt sich 92 °C (198 °F; 365 K) α-Monohydrat, zersetzt sich |
Löslichkeit in Wasser
|
Unlöslich |
| Löslichkeit | Löslich in verdünnten Säuren, kaum löslich in Zuckerlösung Trihydrat schwach löslich in wässriger Weinsäure, Zitronensäure, CH3COOH |
Magnetische Suszeptibilität (χ)
|
+3586,0-10-6 cm3/mol |
Brechungsindex (nD)
|
n1 = 2,91, n2 = 3,19 (α, Hämatit) |
| Struktur | |
Kristallstruktur
|
Rhomboedrisch, hR30 (α-Form) Kubischer Bixbyit, cI80 (β-Form) Kubischer Spinell (γ-Form) Orthorhombisch (ε-Form) |
Raumgruppe
|
R3c, Nr. 161 (α-Form) Ia3, Nr. 206 (β-Form) Pna21, Nr. 33 (ε-Form) |
Punktgruppe
|
3m (α-Form) 2/m 3 (β-Form) mm2 (ε-Form) |
Koordinationsgeometrie
|
Oktaedrisch (Fe3+, α-Form, β-Form) |
| Thermochemie | |
Wärmekapazität (C)
|
103,9 J/mol-K |
Std. molare
Entropie (S |
87,4 J/mol-K |
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-824.2 kJ/mol |
Gibbssche freie Energie (ΔfG˚)
|
-742,2 kJ/mol |
| Gefahren | |
| GHS-Kennzeichnung: | |
Piktogramme
|

|
Signalwort
|
Warnhinweis |
Gefahrenhinweise
|
H315, H319, H335 |
Sicherheitshinweise
|
P261, P305+P351+P338 |
| NFPA 704 (Feuerdiamant) | |
Schwellengrenzwert (TLV)
|
5 mg/m3 (TWA) |
| Tödliche Dosis oder Konzentration (LD, LC): | |
LD50 (Mittlere Dosis)
|
10 g/kg (Ratten, oral) |
| NIOSH (US-Grenzwerte für die Gesundheit): | |
PEL (Zulässig)
|
TWA 10 mg/m3 |
REL (Empfohlen)
|
TWA 5 mg/m3 |
IDLH (Unmittelbare Gefahr)
|
2500 mg/m3 |
| Verwandte Verbindungen | |
Andere Anionen
|
Eisen(III)-fluorid |
Andere Kationen
|
Mangan(III)-oxid Kobalt(III)-oxid |
Verwandte Eisenoxide
|
Eisen(II)-oxid Eisen(II,III)-oxid |
Wenn nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
Eisen(III)-oxid oder Eisen(III)-oxid ist eine anorganische Verbindung mit der Formel Fe2O3. Es ist eines der drei wichtigsten Eisenoxide, die anderen beiden sind Eisen(II)-oxid (FeO), das selten vorkommt, und Eisen(II,III)-oxid (Fe3O4), das in der Natur auch als Mineral Magnetit vorkommt. Das als Hämatit bekannte Mineral Fe2O3 ist die Hauptquelle für Eisen in der Stahlindustrie. Fe2O3 wird leicht von Säuren angegriffen. Eisen(III)-oxid wird oft als Rost bezeichnet, und in gewissem Maße ist diese Bezeichnung auch sinnvoll, da Rost mehrere Eigenschaften und eine ähnliche Zusammensetzung aufweist; in der Chemie gilt Rost jedoch als undefiniertes Material, das als wasserhaltiges Eisenoxid bezeichnet wird. ⓘ
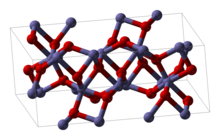
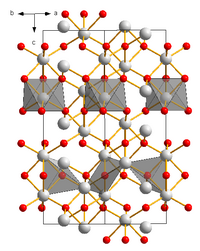
| Kristallstruktur ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| _ Fe3+ _ O2− | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Eisen(III)-oxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Verhältnisformel | Fe2O3 | ||||||||||||||||||
| Kurzbeschreibung |
rote bis schwarze Kristalle | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 159,70 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
5,25 g·cm−3 | ||||||||||||||||||
| Schmelzpunkt |
1539 °C | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Struktur
Fe2O3 kann in verschiedenen Polymorphen auftreten. In der Hauptform, α, nimmt Eisen eine oktaedrische Koordinationsgeometrie an. Das heißt, jedes Fe-Zentrum ist an sechs Sauerstoffliganden gebunden. Im γ-Polymorph sitzt ein Teil des Fe auf tetraedrischen Plätzen mit vier Sauerstoffliganden. ⓘ
Alpha-Phase
α-Fe2O3 hat die rhomboedrische Korundstruktur (α-Al2O3) und ist die häufigste Form. Es kommt in der Natur in Form des Minerals Hämatit vor, das als Haupteisenerz abgebaut wird. Es ist unterhalb von ~260 K (Morin-Übergangstemperatur) antiferromagnetisch und weist zwischen 260 K und der Néel-Temperatur, 950 K, einen schwachen Ferromagnetismus auf. Seine magnetischen Eigenschaften sind von vielen Faktoren abhängig, z. B. von Druck, Partikelgröße und Magnetfeldstärke. ⓘ
Gamma-Phase
γ-Fe2O3 hat eine kubische Struktur. Sie ist metastabil und wandelt sich bei hohen Temperaturen aus der Alpha-Phase um. Es kommt in der Natur in Form des Minerals Maghemit vor. Es ist ferromagnetisch und wird in Aufzeichnungsbändern verwendet, obwohl ultrafeine Partikel unter 10 Nanometern superparamagnetisch sind. Es kann durch thermische Dehydratisierung von Gamma-Eisen(III)-Oxid-Hydroxid hergestellt werden. Eine andere Methode besteht in der sorgfältigen Oxidation von Eisen(II,III)-oxid (Fe3O4). Die ultrafeinen Partikel können durch thermische Zersetzung von Eisen(III)-Oxalat hergestellt werden. ⓘ
Andere feste Phasen
Es wurden mehrere andere Phasen identifiziert oder behauptet. Die β-Phase ist kubisch-raumzentriert (Raumgruppe Ia3), metastabil und wandelt sich bei Temperaturen über 500 °C (930 °F) in die Alpha-Phase um. Sie kann durch Reduktion von Hämatit mit Kohlenstoff, durch Pyrolyse einer Eisen(III)-chloridlösung oder durch thermische Zersetzung von Eisen(III)-sulfat hergestellt werden. ⓘ
Die Epsilon-Phase (ε) ist rhombisch und weist Eigenschaften auf, die zwischen denen der Alpha- und der Gamma-Phase liegen, und kann nützliche magnetische Eigenschaften aufweisen, die beispielsweise für Aufzeichnungsmedien mit hoher Dichte zur Speicherung großer Datenmengen verwendet werden können. Die Herstellung der reinen Epsilon-Phase hat sich als sehr schwierig erwiesen. Materialien mit einem hohen Anteil an Epsilon-Phase können durch thermische Umwandlung der Gamma-Phase hergestellt werden. Die Epsilon-Phase ist ebenfalls metastabil und wandelt sich bei Temperaturen zwischen 500 und 750 °C in die Alpha-Phase um. Sie kann auch durch Oxidation von Eisen in einem elektrischen Lichtbogen oder durch Sol-Gel-Fällung aus Eisen(III)-Nitrat hergestellt werden. Bei Forschungsarbeiten wurde epsilon-Eisen(III)-Oxid in alten chinesischen Jian-Keramikglasuren gefunden, was Aufschluss darüber geben könnte, wie sich diese Form im Labor herstellen lässt. ⓘ
Außerdem wird behauptet, dass bei hohem Druck eine amorphe Form entsteht. ⓘ
Flüssige Phase
Man geht davon aus, dass geschmolzenes Fe2O3 eine Koordinationszahl von annähernd 5 Sauerstoffatomen um jedes Eisenatom aufweist. Dies geht aus Messungen an leicht sauerstoffarmen, unterkühlten flüssigen Eisenoxidtröpfchen hervor, bei denen durch die Unterkühlung die hohen Sauerstoffdrücke umgangen werden, die oberhalb des Schmelzpunktes zur Aufrechterhaltung der Stöchiometrie erforderlich sind. ⓘ
Hydratisierte Eisen(III)-Oxide
Es gibt mehrere Hydrate von Eisen(III)-oxid. Bei Zugabe von Alkali zu Lösungen von löslichen Fe(III)-Salzen bildet sich ein rotbrauner, gallertartiger Niederschlag. Dabei handelt es sich nicht um Fe(OH)3, sondern um Fe2O3-H2O (auch als Fe(O)OH geschrieben). Es gibt auch mehrere Formen des hydratisierten Fe(III)-Oxids. Der rote Lepidokrokit (γ-Fe(O)OH) kommt an der Außenseite der Rustikula vor, und der orangefarbene Goethit (α-Fe(O)OH) kommt im Inneren der Rustikula vor. Wenn Fe2O3-H2O erhitzt wird, verliert es sein Hydratationswasser. Bei weiterer Erhitzung auf 1670 K wandelt sich Fe2O3 in schwarzes Fe3O4 (FeIIFeIII2O4) um, das als Mineral Magnetit bekannt ist. Fe(O)OH ist in Säuren löslich und ergibt [Fe(H2O)6]3+. In konzentriertem wässrigem Alkali bildet Fe2O3 [Fe(OH)6]3-. ⓘ
Reaktionen
Die wichtigste Reaktion ist die karbothermische Reduktion, bei der das in der Stahlerzeugung verwendete Eisen entsteht:
- Fe2O3 + 3 CO → 2 Fe + 3 CO2 ⓘ
Eine weitere Redoxreaktion ist die extrem exotherme Thermitreaktion mit Aluminium.
- 2 Al + Fe2O3 → 2 Fe + Al2O3 ⓘ
Dieses Verfahren wird zum Schweißen von dicken Metallen wie z. B. Eisenbahnschienen verwendet, indem das geschmolzene Eisen in einem Keramikbehälter zwischen zwei Schienenabschnitte geleitet wird. Thermit wird auch für Waffen und die Herstellung kleinerer gusseiserner Skulpturen und Werkzeuge verwendet. ⓘ
Durch partielle Reduktion mit Wasserstoff bei etwa 400 °C entsteht Magnetit, ein schwarzes magnetisches Material, das sowohl Fe(III) als auch Fe(II) enthält:
- 3 Fe2O3 + H2 → 2 Fe3O4 + H2O ⓘ
Eisen(III)-oxid ist unlöslich in Wasser, löst sich aber leicht in starken Säuren, z. B. Salz- und Schwefelsäure. Es löst sich auch gut in Lösungen von Chelatbildnern wie EDTA und Oxalsäure. ⓘ
Durch Erhitzen von Eisen(III)-Oxiden mit anderen Metalloxiden oder Karbonaten erhält man so genannte Ferrate (Ferrat(III)):
- ZnO + Fe2O3 → Zn(FeO2)2 ⓘ
Herstellung
Eisen(III)-oxid ist ein Produkt der Oxidation von Eisen. Es kann im Labor durch Elektrolyse einer Lösung von Natriumbicarbonat, einem inerten Elektrolyten, mit einer Eisenanode hergestellt werden:
- 4 Fe + 3 O2 + 2 H2O → 4 FeO(OH) ⓘ
Das entstehende hydratisierte Eisen(III)-oxid, hier als FeO(OH) bezeichnet, dehydriert bei etwa 200 °C.
- 2 FeO(OH) → Fe2O3 + H2O ⓘ
Es ist möglich, rotes Eisenoxid unter anderem durch Brennen von Eisen(III)-oxidhydroxid zu gewinnen. Dabei wird gelbes Eisenoxid auf über 200 °C erhitzt, wobei sich Wasserdampf bildet.
Verwendungen
Eisenindustrie
Die überwiegende Anwendung von Eisen(III)-oxid ist die Verwendung als Ausgangsstoff in der Stahl- und Eisenindustrie, z. B. bei der Herstellung von Eisen, Stahl und vielen Legierungen. ⓘ
Polieren
Ein sehr feines Pulver aus Eisen(III)-oxid ist als "Juwelier-Rouge", "Rot-Rouge" oder einfach als Rouge bekannt. Es wird verwendet, um Metallschmuck und Brillengläser zu polieren, und diente früher als Kosmetikum. Rouge schneidet langsamer als einige moderne Poliermittel, wie z. B. Cerium(IV)-oxid, wird aber immer noch in der Optikherstellung und von Juwelieren verwendet, da es ein hervorragendes Finish erzeugt. Beim Polieren von Gold färbt das Rouge das Gold leicht ein, was zum Aussehen des fertigen Stücks beiträgt. Rouge wird als Pulver, Paste, auf Poliertüchern oder als fester Stab (mit einem Wachs- oder Fettbindemittel) verkauft. Auch andere Poliermittel werden häufig als "Rouge" bezeichnet, selbst wenn sie kein Eisenoxid enthalten. Juweliere entfernen die Reste von Rouge auf Schmuckstücken mit Hilfe von Ultraschallreinigung. Produkte, die als "Abziehpaste" verkauft werden, werden häufig auf einen Lederriemen aufgetragen, um die Schärfe von Messern, Rasiermessern oder anderen scharfkantigen Werkzeugen zu erhöhen. ⓘ
Pigment
Eisen(III)-oxid wird auch als Pigment verwendet, unter den Namen "Pigment Brown 6", "Pigment Brown 7" und "Pigment Red 101". Einige von ihnen, z. B. Pigment Red 101 und Pigment Brown 6, sind von der US Food and Drug Administration (FDA) zur Verwendung in Kosmetika zugelassen. Eisenoxide werden neben Titanoxiden als Pigmente in Dentalkompositen verwendet. ⓘ
Hämatit ist der charakteristische Bestandteil der schwedischen Lackfarbe Falu-Rot. ⓘ
Magnetische Aufzeichnung
Eisen(III)-oxid war das am häufigsten verwendete magnetische Teilchen in allen Arten von magnetischen Speicher- und Aufzeichnungsmedien, einschließlich Magnetplatten (für die Datenspeicherung) und Magnetbändern (für die Audio- und Videoaufzeichnung sowie die Datenspeicherung). Seine Verwendung in Computerfestplatten wurde durch eine Kobaltlegierung ersetzt, die dünnere Magnetfilme mit höherer Speicherdichte ermöglicht. ⓘ
Photokatalyse
α-Fe2O3 wurde als Photoanode für die solare Wasseroxidation untersucht. Seine Wirksamkeit ist jedoch durch die kurze Diffusionslänge (2-4 nm) der durch das Licht angeregten Ladungsträger und die anschließende schnelle Rekombination begrenzt, so dass ein großes Überpotential erforderlich ist, um die Reaktion in Gang zu setzen. Die Forschung konzentriert sich auf die Verbesserung der Wasseroxidationsleistung von Fe2O3 durch Nanostrukturierung, Oberflächenfunktionalisierung oder durch Verwendung alternativer Kristallphasen wie β-Fe2O3. ⓘ
Medizin
Galmei-Lotion, die zur Behandlung von leichtem Juckreiz verwendet wird, besteht hauptsächlich aus einer Kombination von Zinkoxid, das adstringierend wirkt, und etwa 0,5 % Eisen(III)-oxid, dem Wirkstoff des Produkts, der juckreizstillend wirkt. Die rote Farbe von Eisen(III)-oxid ist auch hauptsächlich für die rosa Farbe der Lotion verantwortlich. ⓘ




