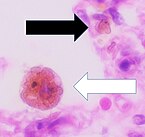
Makrophage
| Makrophagen ⓘ | |
|---|---|
 Ein Makrophage streckt seine "Arme" (Filopodien) aus, um zwei Partikel, möglicherweise Krankheitserreger, in einer Maus zu verschlingen (Trypanblau-Ausschlussfärbung) | |
| Einzelheiten | |
| Aussprache | /ˈmakrə(ʊ)feɪdʒ/ |
| System | Immunsystem |
| Funktion | Phagozytose |
| Bezeichnungen | |
| Lateinisch | Makrophagocytus |
| Akronym(e) | Mφ, MΦ |
| Anatomische Begriffe der Mikroanatomie [Bearbeiten auf Wikidata] | |
Makrophagen (abgekürzt Mφ, MΦ oder MP) (griechisch: große Fresser, von griechisch μακρός (makrós) = groß, φαγεῖν (phagein) = fressen) sind eine Art weißer Blutkörperchen des Immunsystems, die Krankheitserreger wie Krebszellen, Mikroben, Zelltrümmer und Fremdstoffe, die keine für gesunde Körperzellen spezifischen Proteine auf ihrer Oberfläche haben, verschlingen und verdauen. Dieser Vorgang wird als Phagozytose bezeichnet und dient der Abwehr von Infektionen und Verletzungen des Wirtes. ⓘ
Diese großen Phagozyten sind in praktisch allen Geweben zu finden, wo sie durch amöboide Bewegungen nach potenziellen Krankheitserregern Ausschau halten. Sie nehmen im ganzen Körper verschiedene Formen (mit verschiedenen Namen) an (z. B. Histiozyten, Kupffer-Zellen, Alveolarmakrophagen, Mikroglia und andere), aber alle sind Teil des mononukleären Phagozytensystems. Neben der Phagozytose spielen sie eine entscheidende Rolle bei der unspezifischen Abwehr (angeborene Immunität) und tragen auch zur Einleitung spezifischer Abwehrmechanismen (adaptive Immunität) bei, indem sie andere Immunzellen wie Lymphozyten rekrutieren. So sind sie beispielsweise als Antigenpräsenter für T-Zellen wichtig. Beim Menschen verursachen funktionsgestörte Makrophagen schwere Krankheiten wie die chronische granulomatöse Erkrankung, die zu häufigen Infektionen führt. ⓘ
Makrophagen sind nicht nur entzündungsfördernd und stimulieren das Immunsystem, sondern spielen auch eine wichtige entzündungshemmende Rolle und können Immunreaktionen durch die Freisetzung von Zytokinen verringern. Makrophagen, die Entzündungen fördern, werden als M1-Makrophagen bezeichnet, während diejenigen, die Entzündungen verringern und die Gewebereparatur fördern, als M2-Makrophagen bezeichnet werden. Dieser Unterschied spiegelt sich in ihrem Stoffwechsel wider: M1-Makrophagen haben die einzigartige Fähigkeit, Arginin in das "Killer"-Molekül Stickstoffmonoxid umzuwandeln, während M2-Makrophagen die einzigartige Fähigkeit haben, Arginin in das "Reparatur"-Molekül Ornithin umzuwandeln. Diese Dichotomie wurde jedoch kürzlich in Frage gestellt, da weitere komplexe Zusammenhänge entdeckt wurden. ⓘ
Menschliche Makrophagen haben einen Durchmesser von etwa 21 Mikrometern und entstehen durch die Differenzierung von Monozyten in Geweben. Sie können mittels Durchflusszytometrie oder immunhistochemischer Färbung durch ihre spezifische Expression von Proteinen wie CD14, CD40, CD11b, CD64, F4/80 (Mäuse)/EMR1 (Mensch), Lysozym M, MAC-1/MAC-3 und CD68 identifiziert werden. ⓘ
Makrophagen wurden erstmals 1884 von Élie Metchnikoff, einem russischen Zoologen, entdeckt und benannt. ⓘ
Makrophagen (Abk. ΜΦ; von altgriechisch μακρός makrós, deutsch ‚groß‘ und altgriechisch φαγεῖν phagein, deutsch ‚essen‘, „Riesenfresszelle“) zählen zu den Fresszellen (Phagozyten) und sind Leukozyten (weiße Blutkörperchen), gehören also zu den Zellen des Immunsystems. Sie dienen der Beseitigung von Mikroorganismen durch Phagozytose und stellen stammesgeschichtlich (phylogenetisch) die vermutlich ältesten Teile der angeborenen Immunabwehr dar. So sind makrophagenartige Zellen in der Taufliege Drosophila und sogar in Pflanzen identifiziert worden. ⓘ
Aufbau
Arten
Die meisten Makrophagen befinden sich an strategischen Punkten, an denen eine mikrobielle Invasion oder eine Ansammlung von Fremdpartikeln wahrscheinlich ist. Diese Zellen werden als Gruppe als mononukleäres Phagozytensystem bezeichnet und waren früher als retikuloendotheliales System bekannt. Jede Art von Makrophagen, die sich nach ihrem Standort richtet, hat einen spezifischen Namen:
| Name der Zelle | Anatomischer Ort ⓘ |
| Fettgewebe-Makrophagen | Fettgewebe (Fett) |
| Monozyten | Knochenmark / Blut |
| Kupffer-Zellen | Leber |
| Sinus-Histiozyten | Lymphknoten |
| Alveolarmakrophagen (Staubzellen) | Pulmonale Alveolen |
| Gewebemakrophagen (Histiozyten), die zu Riesenzellen führen | Bindegewebe |
| Mikroglia | Zentrales Nervensystem |
| Hofbauer-Zellen | Mutterkuchen |
| Intraglomeruläre mesangiale Zellen | Niere |
| Osteoklasten | Knochen |
| Langerhans-Zellen | Haut |
| Epithelioide Zellen | Granulome |
| Makrophagen der roten Pulpa (Zellen der Sinusoidalauskleidung) | Rote Pulpa der Milz |
| Peritoneale Makrophagen | Peritonealhöhle |
| LysoMac | Peyerscher Fleck |
Untersuchungen zu Kupffer-Zellen werden dadurch erschwert, dass Kupffer-Zellen beim Menschen nur für immunhistochemische Analysen aus Biopsien oder Autopsien zugänglich sind. Aus Ratten und Mäusen lassen sie sich nur schwer isolieren, und nach der Aufreinigung können nur etwa 5 Millionen Zellen aus einer Maus gewonnen werden. ⓘ
Makrophagen können in Organen parakrine Funktionen ausüben, die für die Funktion des jeweiligen Organs spezifisch sind. In den Hoden zum Beispiel können Makrophagen nachweislich mit Leydig-Zellen interagieren, indem sie 25-Hydroxycholesterin absondern, ein Oxysterol, das von benachbarten Leydig-Zellen in Testosteron umgewandelt werden kann. Außerdem können Hodenmakrophagen an der Schaffung eines immunprivilegierten Umfelds im Hoden und an der Vermittlung von Unfruchtbarkeit bei Hodenentzündungen beteiligt sein. ⓘ
Im Herzen ansässige Makrophagen sind über die Gap-Junction-Kommunikation mit den Herzmuskelzellen an der elektrischen Erregungsleitung beteiligt. ⓘ
Makrophagen können auf der Grundlage ihrer grundlegenden Funktion und Aktivierung klassifiziert werden. Nach dieser Einteilung gibt es klassisch aktivierte (M1) Makrophagen, wundheilende Makrophagen (auch als alternativ aktivierte (M2) Makrophagen bekannt) und regulatorische Makrophagen (Mregs). ⓘ
Entwicklung
Makrophagen, die sich in erwachsenen gesunden Geweben befinden, stammen entweder von zirkulierenden Monozyten ab oder werden vor der Geburt gebildet und dann während des Erwachsenenlebens unabhängig von Monozyten erhalten. Im Gegensatz dazu stammen die meisten Makrophagen, die sich an erkrankten Stellen ansammeln, in der Regel von zirkulierenden Monozyten ab. Wenn ein Monozyt durch das Endothel eines Blutgefäßes in geschädigtes Gewebe eindringt, ein Prozess, der als Leukozytenextravasation bekannt ist, durchläuft er eine Reihe von Veränderungen, um zu einem Makrophagen zu werden. Monozyten werden durch chemische Substanzen mittels Chemotaxis zu einer geschädigten Stelle gelockt, ausgelöst durch eine Reihe von Stimuli, darunter geschädigte Zellen, Krankheitserreger und Zytokine, die von bereits vor Ort befindlichen Makrophagen freigesetzt werden. An einigen Stellen, wie z. B. den Hoden, bevölkern die Makrophagen das Organ nachweislich durch Proliferation. Im Gegensatz zu den kurzlebigen Neutrophilen überleben Makrophagen länger im Körper, bis zu mehreren Monaten. ⓘ
Funktion

a. Aufnahme durch Phagozytose, ein Phagosom wird gebildet.
b. Die Vereinigung von Phagosom und Lysosom bildet ein Phagolysosom. Der Krankheitserreger wird dann durch Enzyme aufgelöst.
c. Aufgelöstes Material wird ausgeschieden oder assimiliert.
Zeichenerklärung:
1. Krankheitserreger
2. Phagosom
3. Lysosom
4. Reststoffe
5. Zytoplasma
6. Zellmembran ⓘ
Körperfremde Proteine oder Glycoproteine, wie etwa auf Oberflächen von Viren und Bakterien, werden im Gewebe von Makrophagen erkannt. In einem Phagocytose genannten Prozess werden die Mikroorganismen aufgenommen oder aktiv „umflossen“ und teilweise intrazellulär zerkleinert. Gleichzeitig werden durch auf diese Art „aktivierte“ Makrophagen und neutrophile Granulozyten chemische Lockstoffe (Chemokine) freigesetzt, die weitere Zellen ihrer Art aus dem Blutstrom rekrutieren. Freigesetzte Cytokine sorgen zugleich für eine lokale Entzündung. Die Bestandteile des zuvor aufgenommenen Erregers werden anschließend an die Zelloberfläche des Makrophagen transportiert und mit ihr durch ein MHC-II-Molekül verbunden. ⓘ
Die Antigenpräsentation erlaubt die Aktivierung von Zellen der erworbenen Immunabwehr (T-Helfer-Zellen). Diese wiederum geben nun an die Makrophagen ein Signal zur Zerstörung der zuvor aufgenommenen Erreger zurück. Im Gegensatz zu den dendritischen Zellen sind aktivierte Makrophagen nur begrenzt fähig, naive (also noch nicht mit einem Antigen in Kontakt gekommene) T-Zellen zu aktivieren. Makrophagen (besonders solche in sekundären lymphatischen Organen) tragen aber dazu bei, dass sich T-Zellen stark vermehren und in „handelnde“ Effektor-T-Zellen und Gedächtnis-T-Zellen differenzieren. Neben dieser Aktivierung der erworbenen Immunabwehr beseitigen Makrophagen auch gealterte, zerstörte sowie apoptotische körpereigene Zellen. Nach einer erfolgreich bekämpften Infektion sind Makrophagen an Heilungsprozessen beteiligt, indem sie die Narbenbildung (Granulationsgewebe) und die Neubildung von Blutgefäßen (Angiogenese) fördern. ⓘ
Makrophagen können auch direkt an der Funktion eines Organs beteiligt sein. Im Bindegewebe des Hodens beispielsweise sezernieren sie 25-Hydroxy-Cholesterin, eine Substanz, die von benachbarten Leydig-Zellen aufgenommen wird und dort der Synthese von Testosteron dient. Im Falle einer Entzündung des Hodens nehmen die Makrophagen ihre immunologische Aufgabe wahr und stehen nicht mehr für die Unterstützung der Testosteron-Bildung zur Verfügung. Dies führt zur Unfruchtbarkeit. ⓘ
Phagozytose
Makrophagen sind professionelle Fresszellen und hochspezialisiert auf die Beseitigung von absterbenden oder toten Zellen und Zelltrümmern. Diese Rolle ist bei chronischen Entzündungen wichtig, da die frühen Stadien der Entzündung von Neutrophilen dominiert werden, die von den Makrophagen aufgenommen werden, wenn sie erwachsen sind (siehe CD31 für eine Beschreibung dieses Prozesses). ⓘ
Die Neutrophilen werden zunächst an eine Stelle gelockt, wo sie ihre Funktion erfüllen und absterben, bevor sie oder ihre neutrophilen extrazellulären Fallen von den Makrophagen phagozytiert werden. Am Ort des Geschehens stimuliert die erste Welle von Neutrophilen nach dem Alterungsprozess und nach den ersten 48 Stunden das Auftreten der Makrophagen, die dann die gealterten Neutrophilen aufnehmen. ⓘ
Die Beseitigung absterbender Zellen wird in größerem Umfang von festsitzenden Makrophagen übernommen, die sich an strategischen Orten wie Lunge, Leber, Nervengewebe, Knochen, Milz und Bindegewebe aufhalten, Fremdmaterial wie Krankheitserreger aufnehmen und bei Bedarf weitere Makrophagen rekrutieren. ⓘ
Wenn ein Makrophage einen Krankheitserreger aufnimmt, wird dieser in einem Phagosom gefangen, das dann mit einem Lysosom verschmilzt. Innerhalb des Phagolysosoms verdauen Enzyme und toxische Peroxide den Erreger. Einige Bakterien, wie z. B. Mycobacterium tuberculosis, sind jedoch gegen diese Verdauungsmethoden resistent geworden. Typhoide Salmonellen induzieren ihre eigene Phagozytose durch Wirtsmakrophagen in vivo und hemmen die Verdauung durch lysosomale Wirkung, wodurch sie Makrophagen für ihre eigene Replikation nutzen und Makrophagenapoptose verursachen. Makrophagen können mehr als 100 Bakterien verdauen, bevor sie schließlich durch ihre eigenen Verdauungsstoffe sterben. ⓘ
Rolle bei der adaptiven Immunität
Makrophagen sind vielseitige Zellen, die zahlreiche Aufgaben erfüllen. Als Aasfresser befreien sie den Körper von abgenutzten Zellen und anderen Ablagerungen. Zusammen mit den dendritischen Zellen gehören sie zu den Zellen, die Antigene präsentieren, was eine entscheidende Rolle bei der Auslösung einer Immunreaktion spielt. Als sekretorische Zellen sind Monozyten und Makrophagen von entscheidender Bedeutung für die Regulierung von Immunreaktionen und die Entwicklung von Entzündungen; sie produzieren eine breite Palette starker chemischer Substanzen (Monokine), darunter Enzyme, Komplementproteine und Regulationsfaktoren wie Interleukin-1. Gleichzeitig tragen sie Rezeptoren für Lymphokine, die es ihnen ermöglichen, zur zielstrebigen Verfolgung von Mikroben und Tumorzellen "aktiviert" zu werden. ⓘ
Nachdem ein Makrophage einen Erreger verdaut hat, präsentiert er das Antigen (ein Molekül, meist ein Protein, das sich auf der Oberfläche des Erregers befindet und vom Immunsystem zur Identifizierung verwendet wird) des Erregers der entsprechenden T-Helferzelle. Die Präsentation erfolgt, indem das Antigen in die Zellmembran integriert und an ein MHC-Klasse-II-Molekül (MHCII) angeheftet wird, um anderen weißen Blutkörperchen zu signalisieren, dass der Makrophage kein Krankheitserreger ist, obwohl er Antigene auf seiner Oberfläche trägt. ⓘ
Schließlich führt die Antigenpräsentation zur Produktion von Antikörpern, die sich an die Antigene von Krankheitserregern anlagern und es den Makrophagen erleichtern, mit ihrer Zellmembran daran zu haften und sie zu phagozytieren. In einigen Fällen sind die Erreger sehr resistent gegen die Adhäsion durch die Makrophagen. ⓘ
Die Antigenpräsentation auf der Oberfläche infizierter Makrophagen (im Zusammenhang mit MHC-Klasse II) in einem Lymphknoten regt die TH1 (Typ-1-Helfer-T-Zellen) zur Vermehrung an (hauptsächlich aufgrund der IL-12-Sekretion des Makrophagen). Wenn eine B-Zelle im Lymphknoten das gleiche unbearbeitete Oberflächenantigen auf dem Bakterium mit ihrem oberflächengebundenen Antikörper erkennt, wird das Antigen endozytiert und bearbeitet. Das verarbeitete Antigen wird dann in MHCII auf der Oberfläche der B-Zelle präsentiert. T-Zellen, die den T-Zell-Rezeptor exprimieren, der den Antigen-MHCII-Komplex erkennt (mit ko-stimulatorischen Faktoren - CD40 und CD40L), veranlassen die B-Zelle zur Produktion von Antikörpern, die zur Opsonisierung des Antigens beitragen, so dass die Bakterien besser von Phagozyten beseitigt werden können. ⓘ
Makrophagen bilden eine weitere Verteidigungslinie gegen Tumorzellen und somatische Zellen, die mit Pilzen oder Parasiten infiziert sind. Sobald eine T-Zelle ihr spezielles Antigen auf der Oberfläche einer abnormen Zelle erkannt hat, wird die T-Zelle zu einer aktivierten Effektorzelle, die chemische Botenstoffe, so genannte Lymphokine, produziert, die die Makrophagen zu einer aggressiveren Form anregen. ⓘ
Makrophagen-Subtypen
Es gibt mehrere aktivierte Formen von Makrophagen. Trotz des breiten Spektrums an Möglichkeiten, Makrophagen zu aktivieren, gibt es zwei Hauptgruppen, die als M1 und M2 bezeichnet werden. M1-Makrophagen: Wie bereits erwähnt (früher als klassisch aktivierte Makrophagen bezeichnet), werden M1-"Killer"-Makrophagen durch LPS und IFN-gamma aktiviert und sezernieren hohe Mengen an IL-12 und geringe Mengen an IL-10. M1-Makrophagen haben pro-inflammatorische, bakterientötende und phagozytische Funktionen. Im Gegensatz dazu bezieht sich die Bezeichnung M2 "Reparatur"-Makrophagen (auch alternativ aktivierte Makrophagen genannt) auf Makrophagen, die an konstruktiven Prozessen wie Wundheilung und Gewebereparatur beteiligt sind, und auf solche, die eine schädliche Aktivierung des Immunsystems ausschalten, indem sie entzündungshemmende Zytokine wie IL-10 produzieren. M2 ist der Phänotyp der residenten Gewebemakrophagen und kann durch IL-4 weiter erhöht werden. M2-Makrophagen produzieren hohe Mengen von IL-10, TGF-beta und geringe Mengen von IL-12. Tumor-assoziierte Makrophagen sind hauptsächlich vom Phänotyp M2 und scheinen das Tumorwachstum aktiv zu fördern. ⓘ
Makrophagen existieren in einer Vielzahl von Phänotypen, die durch die Rolle bestimmt werden, die sie bei der Wundreifung spielen. Die Phänotypen lassen sich hauptsächlich in zwei Hauptkategorien einteilen: M1 und M2. M1-Makrophagen sind der vorherrschende Phänotyp, der in den frühen Stadien der Entzündung beobachtet wird, und werden durch vier Schlüsselmediatoren aktiviert: Interferon-γ (IFN-γ), Tumornekrosefaktor (TNF) und schadensassoziierte molekulare Muster (DAMPs). Diese Mediatormoleküle lösen eine entzündungsfördernde Reaktion aus, die ihrerseits entzündungsfördernde Zytokine wie Interleukin-6 und TNF produziert. Im Gegensatz zu M1-Makrophagen sezernieren M2-Makrophagen eine entzündungshemmende Antwort durch die Zugabe von Interleukin-4 oder Interleukin-13. Sie spielen auch eine Rolle bei der Wundheilung und werden für die Revaskularisierung und Reepithelisierung benötigt. M2-Makrophagen werden je nach ihrer Rolle in vier Haupttypen unterteilt: M2a, M2b, M2c und M2d. Wie die M2-Phänotypen bestimmt werden, ist noch umstritten, aber Studien haben gezeigt, dass ihre Umgebung es ihnen ermöglicht, sich an den Phänotyp anzupassen, der für eine effiziente Wundheilung am besten geeignet ist. ⓘ
M2-Makrophagen werden für die Stabilität der Gefäße benötigt. Sie produzieren den vaskulären endothelialen Wachstumsfaktor-A und TGF-β1. Bei akuten Wunden findet eine Verschiebung des Phänotyps von M1- zu M2-Makrophagen statt, bei chronischen Wunden ist diese Verschiebung jedoch gestört. Diese Dysregulation führt zu einem Mangel an M2-Makrophagen und den entsprechenden Wachstumsfaktoren, die bei der Wundheilung helfen. Bei einem Mangel an diesen Wachstumsfaktoren/entzündungshemmenden Zytokinen und einem Übermaß an entzündungsfördernden Zytokinen aus M1-Makrophagen können chronische Wunden nicht rechtzeitig heilen. Normalerweise führen Neutrophile, nachdem sie Trümmer/Pathogene gefressen haben, Apoptose durch und werden entfernt. Zu diesem Zeitpunkt ist eine Entzündung nicht erforderlich, und M1 schaltet auf M2 (entzündungshemmend) um. Es kommt jedoch zu einer Dysregulation, da die M1-Makrophagen nicht in der Lage sind, Neutrophile zu phagozytieren, die die Apoptose durchlaufen haben, was zu einer verstärkten Makrophagenwanderung und Entzündung führt. ⓘ
Sowohl M1- als auch M2-Makrophagen spielen eine Rolle bei der Förderung der Atherosklerose. M1-Makrophagen fördern die Atherosklerose durch Entzündungen. M2-Makrophagen können Cholesterin aus den Blutgefäßen entfernen, aber wenn das Cholesterin oxidiert wird, werden die M2-Makrophagen zu apoptotischen Schaumzellen, die zu den atheromatösen Plaques der Atherosklerose beitragen. ⓘ
Rolle bei der Muskelregeneration
Der erste Schritt zum Verständnis der Bedeutung von Makrophagen bei der Reparatur, dem Wachstum und der Regeneration von Muskeln besteht darin, dass es zwei "Wellen" von Makrophagen gibt, die mit dem Beginn einer Schädigung des Muskels einhergehen - Subpopulationen, die einen direkten Einfluss auf die Reparatur des Muskels haben und solche, die dies nicht tun. Bei der ersten Welle handelt es sich um eine phagozytische Population, die in Zeiten erhöhter Muskelbelastung auftritt, die ausreichen, um eine Lyse der Muskelmembran und eine Membranentzündung zu verursachen, die in die verletzten Muskelfasern eindringen und deren Inhalt abbauen kann. Diese früh eindringenden, phagozytierenden Makrophagen erreichen ihre höchste Konzentration etwa 24 Stunden nach dem Beginn einer Muskelzellverletzung oder einer Wiederbelastung. Ihre Konzentration nimmt nach 48 Stunden rasch ab. Die zweite Gruppe sind die nicht-phagozytischen Makrophagen, die in der Nähe der sich regenerierenden Fasern verteilt sind. Sie erreichen ihren Höhepunkt zwischen zwei und vier Tagen und bleiben mehrere Tage lang erhöht, während sich das Muskelgewebe wieder aufbaut. Die erste Subpopulation hat keinen direkten Nutzen für die Wiederherstellung des Muskels, die zweite nicht-phagozytäre Gruppe hingegen schon. ⓘ
Man nimmt an, dass Makrophagen lösliche Substanzen freisetzen, die die Proliferation, die Differenzierung, das Wachstum, die Reparatur und die Regeneration des Muskels beeinflussen, aber derzeit ist der Faktor, der produziert wird, um diese Effekte zu vermitteln, unbekannt. Es ist bekannt, dass die Beteiligung von Makrophagen an der Förderung der Gewebereparatur nicht muskelspezifisch ist; sie sammeln sich während der Heilungsphase nach einer Verletzung in zahlreichen Geweben an. ⓘ
Rolle bei der Wundheilung
Makrophagen sind für die Wundheilung unerlässlich. Sie ersetzen am zweiten Tag nach der Verletzung die polymorphkernigen Neutrophilen als die vorherrschenden Zellen in der Wunde. Durch Wachstumsfaktoren, die von Blutplättchen und anderen Zellen freigesetzt werden, werden Monozyten aus dem Blutkreislauf durch die Blutgefäßwände in die Wunde gelockt. Die Zahl der Monozyten in der Wunde erreicht einen bis eineinhalb Tage nach der Verletzung ihren Höhepunkt. Sobald sie sich im Wundgebiet befinden, reifen die Monozyten zu Makrophagen heran. In der Milz befindet sich die Hälfte der Monozyten des Körpers in Reserve, die bereit sind, zum verletzten Gewebe gebracht zu werden. ⓘ
Die Hauptaufgabe der Makrophagen besteht darin, Bakterien und geschädigtes Gewebe zu phagozytieren, und sie bauen geschädigtes Gewebe ab, indem sie Proteasen freisetzen. Makrophagen sezernieren auch eine Reihe von Faktoren wie Wachstumsfaktoren und andere Zytokine, insbesondere am dritten und vierten Tag nach der Wunde. Diese Faktoren locken Zellen, die an der Proliferationsphase der Heilung beteiligt sind, in das Gebiet. Makrophagen können auch die Kontraktionsphase hemmen. Makrophagen werden durch den niedrigen Sauerstoffgehalt ihrer Umgebung zur Produktion von Faktoren angeregt, die die Angiogenese induzieren und beschleunigen, und sie stimulieren auch Zellen, die die Wunde reepithelisieren, Granulationsgewebe bilden und eine neue extrazelluläre Matrix anlegen. Indem sie diese Faktoren absondern, tragen Makrophagen dazu bei, den Wundheilungsprozess in die nächste Phase zu treiben. ⓘ
Rolle bei der Regeneration von Gliedmaßen
Wissenschaftler haben herausgefunden, dass Makrophagen nicht nur Materialreste auffressen, sondern auch an der typischen Gliedmaßenregeneration beim Salamander beteiligt sind. Sie fanden heraus, dass die Entfernung der Makrophagen aus einem Salamander zu einem Scheitern der Gliedmaßenregeneration und zu einer Vernarbung führte. ⓘ
Rolle bei der Eisenhomöostase
Wie oben beschrieben, spielen Makrophagen eine Schlüsselrolle bei der Beseitigung sterbender oder toter Zellen und Zelltrümmer. Erythrozyten haben eine durchschnittliche Lebensdauer von 120 Tagen und werden daher ständig von Makrophagen in Milz und Leber zerstört. Makrophagen verschlingen auch Makromoleküle und spielen daher eine Schlüsselrolle in der Pharmakokinetik von parenteralem Eisen. ⓘ
Das aus dem Hämoglobin freigesetzte Eisen wird entweder intern in Ferritin gespeichert oder über Ferroportin in den Blutkreislauf abgegeben. In Fällen, in denen der systemische Eisenspiegel erhöht ist oder eine Entzündung vorliegt, wirken erhöhte Hepcidinspiegel auf die Ferroportin-Kanäle der Makrophagen, was dazu führt, dass Eisen in den Makrophagen verbleibt. ⓘ
Rolle bei der Pigmenteinlagerung

Melanophagen sind eine Untergruppe der gewebebewohnenden Makrophagen, die in der Lage sind, Pigmente aus dem extrazellulären Raum zu absorbieren, die entweder aus dem Organismus stammen oder exogen sind (z. B. Tattoos). Im Gegensatz zu den dendritischen juncionalen Melanozyten, die Melanosomen synthetisieren und verschiedene Stadien ihrer Entwicklung enthalten, akkumulieren die Melanophagen nur phagozytiertes Melanin in lysosomenartigen Phagosomen. Dies geschieht wiederholt, da das Pigment von abgestorbenen dermalen Makrophagen von ihren Nachfolgern phagozytiert wird, wodurch die Tätowierung an der gleichen Stelle erhalten bleibt. ⓘ
Rolle in der Gewebehomöostase
Jedes Gewebe beherbergt seine eigene spezialisierte Population ansässiger Makrophagen, die wechselseitige Verbindungen mit dem Stroma und dem Funktionsgewebe unterhalten. Diese ansässigen Makrophagen sind sessil (nicht wandernd), liefern wichtige Wachstumsfaktoren zur Unterstützung der physiologischen Funktion des Gewebes (z. B. Makrophagen-Neuronen-Crosstalk im Darm) und können das Gewebe aktiv vor Entzündungsschäden schützen. ⓘ
Nervenassoziierte Makrophagen
Nervenassoziierte Makrophagen oder NAMs sind die im Gewebe ansässigen Makrophagen, von denen bekannt ist, dass sie mit Nerven assoziiert sind. Einige von ihnen sind dafür bekannt, dass sie eine längliche Morphologie von bis zu 200 um aufweisen. ⓘ
Klinische Bedeutung
Aufgrund ihrer Rolle bei der Phagozytose sind Makrophagen an vielen Erkrankungen des Immunsystems beteiligt. So sind sie beispielsweise an der Bildung von Granulomen beteiligt, entzündlichen Läsionen, die durch eine Vielzahl von Krankheiten verursacht werden können. So sind einige, meist seltene Störungen der Phagozytose und der Makrophagenfunktion beschrieben worden, die unwirksam sind. ⓘ
Als Wirt für intrazelluläre Krankheitserreger
In ihrer Rolle als phagozytierende Immunzellen sind Makrophagen dafür verantwortlich, Krankheitserreger zu verschlingen, um sie zu zerstören. Einige Krankheitserreger unterlaufen diesen Prozess und leben stattdessen im Inneren des Makrophagen. Dadurch entsteht eine Umgebung, in der der Erreger vor dem Immunsystem verborgen ist und sich vermehren kann. ⓘ
Zu den Krankheiten mit diesem Verhalten gehören Tuberkulose (verursacht durch Mycobacterium tuberculosis) und Leishmaniose (verursacht durch Leishmania-Arten). ⓘ
Um die Möglichkeit, Wirt eines intrazellulären Bakteriums zu werden, zu minimieren, haben Makrophagen Abwehrmechanismen entwickelt, wie z. B. die Induktion von Stickstoffmonoxid und reaktiven Sauerstoffzwischenprodukten, die für Mikroben toxisch sind. Makrophagen haben auch die Fähigkeit entwickelt, die Nährstoffzufuhr der Mikrobe einzuschränken und Autophagie zu induzieren. ⓘ
Tuberkulose
Sobald der Erreger der Tuberkulose, Mycobacterium tuberculosis, von einem Makrophagen aufgenommen wurde, umgeht er die zellulären Abwehrmechanismen und nutzt die Zelle zur Vermehrung. Jüngste Erkenntnisse deuten darauf hin, dass als Reaktion auf eine Lungeninfektion mit Mycobacterium tuberculosis die peripheren Makrophagen zum M1-Phänotyp heranreifen. Der M1-Phänotyp der Makrophagen ist durch eine erhöhte Sekretion von pro-inflammatorischen Zytokinen (IL-1β, TNF-α und IL-6) und erhöhte glykolytische Aktivitäten gekennzeichnet, die für die Beseitigung der Infektion wichtig sind. ⓘ
Leishmaniose
Nach der Phagozytose durch einen Makrophagen befindet sich der Leishmania-Parasit in einer phagozytischen Vakuole. Unter normalen Umständen würde sich diese phagozytische Vakuole zu einem Lysosom entwickeln und ihr Inhalt würde verdaut werden. Leishmanien verändern diesen Prozess und vermeiden es, zerstört zu werden; stattdessen siedeln sie sich innerhalb der Vakuole an. ⓘ
Chikungunya
Die Infektion von Makrophagen in den Gelenken steht im Zusammenhang mit lokalen Entzündungen während und nach der akuten Phase von Chikungunya (verursacht durch CHIKV oder Chikungunya-Virus). ⓘ
Andere
Adenoviren (häufigste Ursache von Rosa Auge) können latent in Makrophagen des Wirts verbleiben, wobei die Viren 6-18 Monate nach der Erstinfektion weiter ausgeschieden werden. ⓘ
Brucella spp. kann durch Hemmung der Phagosomen-Lysosomen-Fusion latent in einem Makrophagen verbleiben; verursacht Brucellose (undulantes Fieber). ⓘ
Legionella pneumophila, der Erreger der Legionärskrankheit, siedelt sich ebenfalls in Makrophagen an. ⓘ
Herzkrankheit
Makrophagen sind die wichtigsten Zellen, die an der Entstehung der fortschreitenden Plaqueläsionen der Atherosklerose beteiligt sind. ⓘ
Nach einem akuten Herzinfarkt kommt es zu einer fokalen Rekrutierung von Makrophagen. Diese Makrophagen haben die Aufgabe, Trümmer und apoptotische Zellen zu entfernen und die Regeneration des Gewebes vorzubereiten. Makrophagen schützen vor ischämiebedingter Kammertachykardie bei hypokaliämischen Mäusen. ⓘ
HIV-Infektion
Makrophagen spielen auch bei der Infektion mit dem Humanen Immundefizienz-Virus (HIV) eine Rolle. Wie T-Zellen können auch Makrophagen mit HIV infiziert werden und sogar zu einem Reservoir für die laufende Virusreplikation im Körper werden. HIV kann durch die Bindung von gp120 an CD4 und den zweiten Membranrezeptor, CCR5 (ein Chemokinrezeptor), in den Makrophagen gelangen. Sowohl zirkulierende Monozyten als auch Makrophagen dienen als Reservoir für das Virus. Makrophagen sind besser in der Lage, einer Infektion durch HIV-1 zu widerstehen als CD4+ T-Zellen, obwohl die Anfälligkeit für eine HIV-Infektion bei den verschiedenen Makrophagen-Subtypen unterschiedlich ist. ⓘ
Krebs
Makrophagen können zum Wachstum und Fortschreiten von Tumoren beitragen, indem sie die Proliferation und Invasion von Tumorzellen fördern, die Tumorangiogenese begünstigen und Antitumor-Immunzellen unterdrücken. Sie werden von sauerstoffarmen (hypoxischen) und nekrotischen Tumorzellen angezogen und fördern chronische Entzündungen. Von den Makrophagen freigesetzte Entzündungsstoffe wie der Tumor-Nekrose-Faktor (TNF)-alpha aktivieren den Genschalter Nuklearfaktor-Kappa B. NF-κB dringt dann in den Kern einer Tumorzelle ein und schaltet die Produktion von Proteinen ein, die die Apoptose stoppen und die Zellproliferation und Entzündung fördern. Darüber hinaus dienen Makrophagen als Quelle für viele pro-angiogene Faktoren wie vaskulärer Endothelfaktor (VEGF), Tumornekrosefaktor-alpha (TNF-alpha), Makrophagenkolonie-stimulierender Faktor (M-CSF/CSF1) sowie IL-1 und IL-6, die das Tumorwachstum weiter fördern. Es hat sich gezeigt, dass Makrophagen eine Reihe von Tumoren infiltrieren. Ihre Anzahl korreliert mit einer schlechten Prognose bei bestimmten Krebsarten wie Brust-, Gebärmutterhals-, Blasen-, Gehirn- und Prostatakrebs. Man geht davon aus, dass tumorassoziierte Makrophagen (TAMs) einen M2-Phänotyp annehmen, der zum Wachstum und Fortschreiten des Tumors beiträgt. Einige Tumore können auch Faktoren wie M-CSF/CSF1, MCP-1/CCL2 und Angiotensin II produzieren, die die Vermehrung und Mobilisierung von Makrophagen in Tumoren auslösen. Untersuchungen in verschiedenen Studienmodellen legen nahe, dass Makrophagen manchmal Anti-Tumorfunktionen übernehmen können. Zum Beispiel können Makrophagen eine zytotoxische Aktivität haben, um Tumorzellen direkt abzutöten; auch die Zusammenarbeit von T-Zellen und Makrophagen ist wichtig, um Tumore zu unterdrücken. Diese Zusammenarbeit umfasst nicht nur den direkten Kontakt zwischen T-Zellen und Makrophagen bei der Antigenpräsentation, sondern auch die Sekretion geeigneter Kombinationen von Zytokinen, die die Antitumoraktivität der T-Zellen verstärken. Jüngste Studienergebnisse deuten darauf hin, dass es möglich ist, durch Forcierung der IFN-α-Expression in tumorinfiltrierenden Makrophagen deren angeborene protumorale Aktivität abzuschwächen und die Mikroumgebung des Tumors in Richtung einer effektiveren Aktivierung dendritischer Zellen und der Zytotoxizität von Immuneffektorzellen umzuprogrammieren. Darüber hinaus können subkapsuläre Sinusmakrophagen in tumordrainierenden Lymphknoten die Krebsprogression unterdrücken, indem sie die Ausbreitung von Tumormaterialien eindämmen. ⓘ
Krebstherapie
Experimentelle Studien deuten darauf hin, dass Makrophagen alle therapeutischen Modalitäten beeinflussen können, einschließlich Chirurgie, Chemotherapie, Strahlentherapie, Immuntherapie und gezielte Therapie. Makrophagen können die Behandlungsergebnisse sowohl positiv als auch negativ beeinflussen. Makrophagen können auf verschiedene Weise schützend wirken: Sie können abgestorbene Tumorzellen entfernen (in einem Prozess, der Phagozytose genannt wird), nachdem diese Zellen durch eine Behandlung abgetötet wurden; sie können als Medikamentendepots für einige Krebsmedikamente dienen; sie können auch durch einige Therapien aktiviert werden, um die Antitumorimmunität zu fördern. Makrophagen können auch auf verschiedene Weise schädlich sein: So können sie beispielsweise verschiedene Chemo-, Strahlen- und Immuntherapien unterdrücken. Da Makrophagen das Fortschreiten des Tumors regulieren können, werden derzeit therapeutische Strategien zur Verringerung der Anzahl dieser Zellen oder zur Manipulation ihres Phänotyps bei Krebspatienten getestet. Makrophagen sind jedoch auch an der antikörpervermittelten Zytotoxizität (ADCC) beteiligt, und dieser Mechanismus soll für bestimmte Krebsimmuntherapie-Antikörper von Bedeutung sein. ⓘ
Fettleibigkeit
Es wurde beobachtet, dass eine erhöhte Anzahl von entzündungsfördernden Makrophagen im Fettgewebe von Fettleibigen zu den Komplikationen der Fettleibigkeit, einschließlich Insulinresistenz und Diabetes Typ 2, beiträgt. ⓘ
Die Modulation des entzündlichen Zustands der Makrophagen im Fettgewebe wird daher als mögliches therapeutisches Ziel für die Behandlung von Krankheiten im Zusammenhang mit Fettleibigkeit angesehen. Obwohl die Makrophagen des Fettgewebes einer entzündungshemmenden homöostatischen Kontrolle durch die sympathische Innervation unterliegen, deuten Experimente mit ADRB2-Gen-Knockout-Mäusen darauf hin, dass diese Wirkung indirekt durch die Modulation der Fettzellenfunktion und nicht durch die direkte Aktivierung des adrenergen Beta-2-Rezeptors erfolgt, was darauf hindeutet, dass die adrenerge Stimulation der Makrophagen möglicherweise nicht ausreicht, um die Entzündung oder Funktion des Fettgewebes bei Adipositas zu beeinflussen. ⓘ
Im Fettgewebe von CCR2-defizienten Mäusen findet sich eine erhöhte Anzahl von Eosinophilen, eine stärkere alternative Makrophagenaktivierung und eine Neigung zur Expression von Zytokinen des Typs 2. Darüber hinaus wurde dieser Effekt noch verstärkt, wenn die Mäuse durch eine fettreiche Ernährung fettleibig wurden. Dies ist teilweise auf einen Phänotypwechsel der Makrophagen zurückzuführen, der durch die Nekrose von Fettzellen (Adipozyten) ausgelöst wird. Bei einer fettleibigen Person platzen einige Fettzellen und sterben nekrotisch ab, was dazu führt, dass die ansässigen M2-Makrophagen zum M1-Phänotyp wechseln. Dies ist eine der Ursachen für eine geringgradige systemische chronische Entzündung, die mit Fettleibigkeit einhergeht. ⓘ
Intestinale Makrophagen
Obwohl sie in ihrer Struktur den Gewebemakrophagen sehr ähnlich sind, haben Darmmakrophagen angesichts ihrer natürlichen Umgebung, dem Verdauungstrakt, spezifische Eigenschaften und Funktionen entwickelt. Makrophagen und Darmmakrophagen haben eine hohe Plastizität, so dass ihr Phänotyp durch ihre Umgebung verändert werden kann. Wie Makrophagen sind auch Darmmakrophagen differenzierte Monozyten, allerdings müssen Darmmakrophagen mit dem Mikrobiom im Darm koexistieren. Dies ist eine Herausforderung, da die im Darm vorkommenden Bakterien nicht als "selbst" erkannt werden und potenzielle Ziele für die Phagozytose durch die Makrophagen sein könnten. ⓘ
Um die Zerstörung der Darmbakterien zu verhindern, haben Darmmakrophagen im Vergleich zu anderen Makrophagen wichtige Unterschiede entwickelt. In erster Linie lösen Darmmakrophagen keine Entzündungsreaktionen aus. Während Gewebemakrophagen verschiedene entzündliche Zytokine wie IL-1, IL-6 und TNF-α freisetzen, produzieren oder sezernieren Darmmakrophagen keine entzündlichen Zytokine. Diese Veränderung ist direkt auf die Umgebung der Darmmakrophagen zurückzuführen. Die umgebenden Darmepithelzellen setzen TGF-β frei, das den Wechsel von proinflammatorischen Makrophagen zu nichtinflammatorischen Makrophagen einleitet. ⓘ
Obwohl die Entzündungsreaktion in den Darmmakrophagen herunterreguliert wird, findet weiterhin eine Phagozytose statt. Die Effizienz der Phagozytose nimmt nicht ab, da die Darmmakrophagen in der Lage sind, die Bakterien S. typhimurium und E. coli effektiv zu phagozytieren, aber die Darmmakrophagen setzen auch nach der Phagozytose keine Zytokine frei. Außerdem exprimieren die Darmmakrophagen weder Lipopolysaccharid- (LPS) noch IgA- oder IgG-Rezeptoren. Das Fehlen von LPS-Rezeptoren ist für den Darm von Bedeutung, da die Darmmakrophagen die mit Mikroben assoziierten molekularen Muster (MAMPS/PAMPS) des Darmmikrobioms nicht erkennen. Auch exprimieren sie keine IL-2- und IL-3-Rezeptoren für Wachstumsfaktoren. ⓘ
Rolle bei Krankheiten
Darmmakrophagen spielen nachweislich eine Rolle bei entzündlichen Darmerkrankungen (IBD) wie Morbus Crohn (CD) und Colitis ulcerosa (UC). In einem gesunden Darm begrenzen intestinale Makrophagen die Entzündungsreaktion im Darm, aber in einem Krankheitszustand sind Anzahl und Vielfalt der intestinalen Makrophagen verändert. Dies führt zu einer Entzündung des Darms und den Krankheitssymptomen von CED. Darmmakrophagen sind entscheidend für die Aufrechterhaltung der Darmhomöostase. Das Vorhandensein einer Entzündung oder eines Krankheitserregers stört diese Homöostase und verändert gleichzeitig die Darmmakrophagen. Der Mechanismus für die Veränderung der Darmmakrophagen durch die Rekrutierung neuer Monozyten oder die Veränderung der bereits vorhandenen Darmmakrophagen ist noch nicht geklärt. ⓘ
Medien
Man sieht einen aktiven J774-Makrophagen, der vier Konidien kooperativ aufnimmt. Die J774-Zellen wurden eine Nacht vor dem Filmen mit Konidien mit 5 ng/ml Interferon-γ behandelt. Die Beobachtungen wurden alle 30 Sekunden über einen Zeitraum von 2,5 Stunden durchgeführt.
Zu sehen sind zwei hochaktive Alveolarmakrophagen, die Konidien aufnehmen. Der Zeitraffer beträgt 30 Sekunden pro Bild über 2,5 Stunden. ⓘ
Geschichte
Makrophagen wurden erstmals Ende des 19. Jahrhunderts von Élie Metchnikoff entdeckt. ⓘ
Entwicklung und Vorkommen
Es wird zwischen zwei Arten von Makrophagen aufgrund ihrer entwicklungsbiologischen Herkunft unterschieden. Im Knochenmark entwickeln sich Monozyten und wandern in die Blutgefäße, in denen sie im Blutstrom durch den Körper zirkulieren. Kommen sie währenddessen in Kontakt mit Infektionen, sind sie wie neutrophile Granulozyten in der Lage, verstärkt in das betroffene Gewebe einzuwandern. Dort differenzieren sie unter Einfluss von Cytokinen und Erreger-Substanzen in Makrophagen. Diese Makrophagen sind jedoch nur kurzlebig und müssen ständig durch neue Knochenmarkszellen ersetzt werden. Je nach Stimulierung können sie verschiedene Formen annehmen: Einige verkleinern stark ihr Cytoplasma und werden dann Epitheloidzellen genannt, wegen ihrer Ähnlichkeit zu epithelialen Zellen. Aktivierte Makrophagen können auch fusionieren und mehrkernige Riesenzellen bilden, um größere Fremdkörper durch Phagozytose zu umschließen und zu verdauen. Des Weiteren finden sich Makrophagen in der Muttermilch, in der sie der Sekretion des Enzyms Lysozym und immunstimulatorischer Substanzen dienen. ⓘ
Unter Normalbedingungen werden keine Monozyten ins Gewebe rekrutiert, um in Makrophagen zu differenzieren. Es gibt aber in allen Organen residente Makrophagen. Um ihre Lokalisierung in verschiedenen Geweben zu beschreiben, wurden ihnen spezielle Bezeichnungen gegeben. So heißen sie im Gehirn Mikroglia, in der Leber Kupffer-Sternzellen, in der Lunge Alveolarmakrophagen, mehrkernig und im Knochen vorkommend Osteoklasten, im Knorpelgewebe Chondroklasten, im Bindegewebe Histiozyten, im Glaskörper des Auges Hyalozyten und in der Plazenta Hofbauerzellen. Die meisten dieser residenten Makrophagen entwickeln sich jedoch nicht im Knochenmark, sondern entstehen in der pränatalen Phase im Dottersack des Embryos, sind langlebig und werden unabhängig von Stammzellen aus dem Knochenmark erhalten. ⓘ
Die Bezeichnung kann auch nach dem investierten Material erfolgen, dann nennt man sie z. B. Lipophagen (fetthaltig, z. B. „Schaumzellen“ in atherosklerotischen Plaques oder bei Fettgewebsnekrosen), Muziphagen (schleimhaltig, z. B. in Speicheldrüsenzysten) oder Siderophagen (eisen- bzw. hämosiderinhaltig, z. B. nach Blutungen oder als „Herzfehlerzellen“ in der Lunge). ⓘ
Beteiligung an Krankheitssymptomen
Im Falle einer Tuberkulose nehmen Makrophagen gemäß ihrer Funktion den Erreger (meist Mycobacterium tuberculosis) auf. Im Gegensatz zu anderen Bakterien vermögen die Tuberkuloseerreger jedoch aufgrund der wachsartigen Beschaffenheit ihrer Zellwand innerhalb der Makrophagen zu überleben. Trotzdem werden aus dem Blut weitere Monozyten rekrutiert, die sich in Epitheloidzellen umwandeln und zusammenlagern. Diese durch ihren katzenzungenartigen Zellkern auffallenden Makrophagen-Abkömmlinge bilden einen Schutzwall, in dessen Zentrum die befallenen Zellen absterben. Das von Epitheloidzellen umschlossene Gebilde von bis zu 1 mm Durchmesser wird als Granulom bezeichnet. Die Epitheloidzellen können außerdem zu mehrkernigen Langhans-Riesenzellen fusionieren, die jedoch nicht mit den Langerhans-Zellen der Epidermis zu verwechseln sind. ⓘ
Bei Fettstoffwechselstörungen, Fettsucht und Krankheiten wie dem Niemann-Pick-Syndrom oder dem Alport-Syndrom können Makrophagen ein Übermaß an Lipiden aufnehmen und werden dann „Schaumzellen“ genannt. Im Blutstrom spielt diese Form eine Rolle bei der Entstehung der Arteriosklerose. ⓘ
Bei herzkranken Patienten kann es zu einem Blutstau in den Lungen kommen, was dort eine Akkumulation von Hämosiderin zur Folge hat. Die örtlichen Alveolarmakrophagen nehmen diesen Eisen-Protein-Komplex auf. Diese Zellen und ihre „Fracht“ sind bei entsprechenden Patienten in ausgehusteten Absonderungen der Atemwegsschleimhäute nachweisbar. Sie können so auch als diagnostische Hilfsmittel dienen, was diesen Makrophagen die Bezeichnung „Herzfehlerzellen“ eintrug. ⓘ
Eine weitere Sonderform der Bindegewebs-Makrophagen sind die „Anitschkow-Zellen“, die bei der Bildung des Rheumatischen Granuloms beteiligt sind. Dieses Gebilde wird auch als Aschoff-Knötchen bezeichnet. ⓘ
Entdeckungsgeschichte
Auf Rudolf Virchows Vorschlag basierend beschrieb Kranid Slavjanski 1863 erstmals, dass er in Lungenbläschen von Kaninchen, in deren Luftröhre er zuvor eine Zinnober-Lösung träufelte, Zellen fand, „welche den Character weisser Blutkörperchen hatten und stellenweise auch Zinnober enthielten“. Entgegen vorheriger Theorien schloss er aus seinen Experimenten, dass diese Zellen nicht als „metamorphosierte Alveolarepithelien“, also der Lungen-Schleimhaut entstammend, zu sehen seien. Es liege „auf der Hand, sie als weiße Blutzellen anzunehmen, welche aus den Gefäßen herauswandern“. Nach heutigen Kenntnissen beschrieb er somit nicht nur die ersten „verzehrenden“ Alveolar-Makrophagen, sondern auch ihre Fähigkeit, aus dem Blutgefäßsystem in Organe einzuwandern. ⓘ
Erst Ilja Metschnikow beschrieb 1880 das Prinzip der Phagozytose. Basierend auf seiner Untersuchung phagozytierender Zellen in Seesternen prägte er den Begriff „Makrophage“ und erkannte deren Bedeutung für das Immunsystem. Für diese und weitere Leistungen bei der Beschreibung der zellulären Immunabwehr erhielt Metschnikow zusammen mit Paul Ehrlich im Jahr 1908 den Nobelpreis für Physiologie und Medizin. ⓘ
In der ersten Hälfte des 20. Jahrhunderts wurde vermehrt die Funktion der „festen“ Gewebe-Makrophagen (Histiozyten) beschrieben. Darauf aufbauend definierten Ludwig Aschoff und andere Wissenschaftler das Prinzip des Retikuloendothelialen Systems (RES), welches in den späten 1960er Jahren unter dem Namen Mononukleär-phagozytierendes System erweitert wurde. ⓘ
Verglichen mit anderen Zellen erwies sich in den Folgejahren die Untersuchung der Zellbiologie von Makrophagen als schwierig. Erst ab Mitte der 1980er Jahre wurden neue Erkenntnisse über die Bedeutung von Makrophagen gewonnen: So wurde durch Makrophagen nach LPS-Kontakt ein von ihnen produziertes und bis dahin unbekanntes Zytokin entdeckt, der Tumornekrosefaktor. Auch durch die Entdeckung Makrophagen-spezifischer Wachstumsfaktoren wie M-CSF zu dieser Zeit wurden neue Einblicke in die Zell-Differenzierung von Monozyten zu Makrophagen gewonnen. ⓘ
In den 1990er Jahren wurden vermehrt Oberflächenmarker verwendet, um Subpopulationen von Makrophagen in verschiedenen Geweben zu lokalisieren. Auf diese Weise konnten bisherige Definitionen von Gewebe-spezifischen Makrophagen gefestigt werden. ⓘ
Immunophänotyp
Identifikation
Eine Unterscheidung zwischen diesen beiden Subpopulationen ist anhand ihrer Oberflächenmoleküle möglich. M1-Makrophagen besitzen an ihrer Oberfläche folgende Marker: CD80, CD86, CD16/32. Demgegenüber besitzen M2-Makrophagen an ihrer Oberfläche Arginase-1, CD206 (Mannose-Rezeptor). ⓘ