Blutbild
| Vollständiges Blutbild ⓘ | |
|---|---|
 Eine CBC-Probe vor einem Ausdruck, der CBC- und Differenzialergebnisse anzeigt
| |
| Synonyme | Komplettes Blutbild, vollständiges Blutbild (FBC), vollständiges Blutzellenbild, vollständige Blutuntersuchung (FBE), Hämogramm |
| MeSH | D001772 |
| MedlinePlus | 003642 |
| LOINC | Codes für CBC, z. B. 57021-8 |
| HCPCS-L2 | G0306 |
Ein vollständiges Blutbild (CBC), auch bekannt als Vollblutbild (FBC), ist eine Reihe von medizinischen Labortests, die Informationen über die Zellen im Blut einer Person liefern. Das Blutbild gibt Aufschluss über die Anzahl der weißen Blutkörperchen, der roten Blutkörperchen und der Blutplättchen, die Hämoglobinkonzentration und den Hämatokrit (den Volumenanteil der roten Blutkörperchen). Die Erythrozyten-Indizes, die die durchschnittliche Größe und den Hämoglobingehalt der Erythrozyten angeben, werden ebenfalls angegeben, und ein Differentialblutbild der weißen Blutkörperchen, das die verschiedenen Arten von weißen Blutkörperchen zählt, kann ebenfalls enthalten sein. ⓘ
Das Blutbild wird häufig im Rahmen einer medizinischen Untersuchung durchgeführt und kann zur Überwachung des Gesundheitszustands oder zur Diagnose von Krankheiten verwendet werden. Die Ergebnisse werden durch den Vergleich mit Referenzwerten interpretiert, die je nach Geschlecht und Alter variieren. Zustände wie Anämie und Thrombozytopenie werden durch abnorme Ergebnisse des vollständigen Blutbildes definiert. Die Indizes der roten Blutkörperchen können Aufschluss über die Ursache der Anämie einer Person geben, z. B. Eisenmangel und Vitamin-B12-Mangel, und die Ergebnisse der Differenzialdiagnose der weißen Blutkörperchen können helfen, virale, bakterielle und parasitäre Infektionen sowie Blutkrankheiten wie Leukämie zu diagnostizieren. Nicht alle Ergebnisse, die außerhalb des Referenzbereichs liegen, erfordern ein medizinisches Eingreifen. ⓘ
Das große Blutbild wird in der Regel mit einem automatischen Hämatologie-Analysegerät durchgeführt, das die Zellen zählt und Informationen über ihre Größe und Struktur sammelt. Die Hämoglobinkonzentration wird gemessen, und die Erythrozytenindizes werden aus den Messungen der roten Blutkörperchen und des Hämoglobins berechnet. Manuelle Tests können verwendet werden, um abnormale Ergebnisse unabhängig zu bestätigen. Bei etwa 10-25 % der Proben ist eine manuelle Überprüfung des Blutausstrichs erforderlich, bei der das Blut gefärbt und unter dem Mikroskop betrachtet wird, um zu überprüfen, ob die Ergebnisse des Analysegeräts mit dem Aussehen der Zellen übereinstimmen, und um nach Anomalien zu suchen. Der Hämatokrit kann manuell durch Zentrifugieren der Probe und Messen des Anteils der roten Blutkörperchen bestimmt werden. In Labors, die keinen Zugang zu automatisierten Geräten haben, werden die Blutzellen unter dem Mikroskop mit einem Hämozytometer gezählt. ⓘ
1852 veröffentlichte Karl Vierordt das erste Verfahren zur Durchführung eines Blutbildes, bei dem eine bekannte Menge Blut auf einen Objektträger aufgetragen und jede Zelle gezählt wurde. Die Erfindung des Hämozytometers im Jahr 1874 durch Louis-Charles Malassez vereinfachte die mikroskopische Analyse von Blutzellen, und im späten 19. Jahrhundert entwickelten Paul Ehrlich und Dmitri Leonidowitsch Romanowsky Techniken zur Färbung weißer und roter Blutkörperchen, die auch heute noch zur Untersuchung von Blutausstrichen verwendet werden. In den 1920er Jahren wurden automatisierte Verfahren zur Messung des Hämoglobins entwickelt, und Maxwell Wintrobe führte 1929 die Wintrobe-Hämatokrit-Methode ein, die es ihm wiederum ermöglichte, die Indizes der roten Blutkörperchen zu definieren. Ein Meilenstein in der Automatisierung der Blutzellenzählung war das Coulter-Prinzip, das 1953 von Wallace H. Coulter patentiert wurde. Das Coulter-Prinzip nutzt elektrische Impedanzmessungen, um Blutzellen zu zählen und ihre Größe zu bestimmen; diese Technologie wird auch heute noch in vielen automatisierten Analysegeräten eingesetzt. Weitere Forschungen in den 1970er Jahren befassten sich mit der Verwendung optischer Messungen zur Zählung und Identifizierung von Zellen, was die Automatisierung der Differenzialdiagnose der weißen Blutkörperchen ermöglichte. ⓘ

Das Blutbild (Hämogramm, Hämatogramm) ist in der Medizin eine standardisierte Zusammenstellung wichtiger Befunde aus einer Blutprobe. Es gibt einen Überblick über die im Blut enthaltenen zellulären Bestandteile. Es enthält Daten sowohl zur Quantität zellulärer Blutbestandteile als auch zu deren Morphologie (äußeren Form). ⓘ
Es wird zwischen dem kleinen und dem großen Blutbild unterschieden. ⓘ
Blutbild-Untersuchungen erfolgen im Allgemeinen aus EDTA-Blut. ⓘ
Zweck

Das Blut besteht aus einem flüssigen Teil, dem Plasma, und einem zellulären Teil, der rote Blutkörperchen, weiße Blutkörperchen und Blutplättchen enthält. Bei einem vollständigen Blutbild werden die drei zellulären Bestandteile des Blutes untersucht. Einige Erkrankungen, wie Anämie oder Thrombozytopenie, zeichnen sich durch einen deutlichen Anstieg oder Abfall der Blutzellzahl aus. Da sich Veränderungen in vielen Organsystemen auf das Blut auswirken können, sind die Ergebnisse des Blutbildes für die Untersuchung eines breiten Spektrums von Erkrankungen nützlich. Aufgrund der Fülle an Informationen, die es liefert, ist das vollständige Blutbild eine der am häufigsten durchgeführten medizinischen Laboruntersuchungen. ⓘ
Das CBC wird häufig zur Erkennung von Krankheiten im Rahmen einer medizinischen Untersuchung eingesetzt. Es wird auch angefordert, wenn ein Arzt den Verdacht hat, dass eine Person an einer Krankheit leidet, die die Blutzellen angreift, wie z. B. eine Infektion, eine Blutungsstörung oder einige Krebsarten. Bei Personen, bei denen Erkrankungen diagnostiziert wurden, die abnormale CBC-Ergebnisse verursachen können, oder die Behandlungen erhalten, die sich auf die Anzahl der Blutzellen auswirken können, kann ein regelmäßiges CBC durchgeführt werden, um ihren Gesundheitszustand zu überwachen, und der Test wird oft täglich bei Personen durchgeführt, die im Krankenhaus liegen. Die Ergebnisse können auf die Notwendigkeit einer Blut- oder Thrombozytentransfusion hinweisen. ⓘ
Das vollständige Blutbild findet in vielen medizinischen Fachbereichen spezifische Anwendung. Es wird häufig vor einer Operation durchgeführt, um Anämie festzustellen, sicherzustellen, dass die Thrombozytenzahl ausreichend ist, und um Infektionen zu erkennen. In der Notfallmedizin wird das Blutbild zur Untersuchung zahlreicher Symptome wie Fieber, Bauchschmerzen und Kurzatmigkeit sowie zur Beurteilung von Blutungen und Traumata eingesetzt. Bei Menschen, die sich einer Chemo- oder Strahlentherapie zur Behandlung von Krebs unterziehen, wird das Blutbild engmaschig überwacht, da diese Behandlungen die Produktion von Blutzellen im Knochenmark unterdrücken und zu einem starken Rückgang von weißen Blutkörperchen, Blutplättchen und Hämoglobin führen können. Regelmäßige Blutbilduntersuchungen sind bei der Einnahme bestimmter Psychopharmaka wie Clozapin und Carbamazepin erforderlich, die in seltenen Fällen einen lebensbedrohlichen Abfall der weißen Blutkörperchen (Agranulozytose) verursachen können. Da eine Anämie während der Schwangerschaft zu schlechteren Ergebnissen für die Mutter und ihr Baby führen kann, ist das vollständige Blutbild ein Routinebestandteil der Schwangerenvorsorge; bei Neugeborenen kann ein großes Blutbild erforderlich sein, um Gelbsucht zu untersuchen oder die Anzahl der unreifen Zellen im Leukozyten-Differentialblutbild zu zählen, was ein Hinweis auf eine Sepsis sein kann. ⓘ
Das vollständige Blutbild ist ein wesentliches Instrument der Hämatologie, also der Erforschung von Ursache, Prognose, Behandlung und Vorbeugung von Krankheiten im Zusammenhang mit Blut. Die Ergebnisse des großen Blutbildes und des Abstrichs geben Aufschluss über die Funktion des blutbildenden Systems, d. h. der Organe und Gewebe, die an der Produktion und Entwicklung von Blutzellen beteiligt sind, insbesondere des Knochenmarks. Eine niedrige Anzahl aller drei Zelltypen (Panzytopenie) kann beispielsweise darauf hinweisen, dass die Produktion von Blutzellen durch eine Störung des Knochenmarks beeinträchtigt ist. Eine Knochenmarkuntersuchung kann die Ursache weiter ergründen. Abnormale Zellen im Blutausstrich können auf eine akute Leukämie oder ein Lymphom hinweisen, während eine abnorm hohe Anzahl von Neutrophilen oder Lymphozyten in Kombination mit indikativen Symptomen und Blutausstrichbefunden den Verdacht auf eine myeloproliferative Störung oder eine lymphoproliferative Störung wecken kann. Die Untersuchung der Ergebnisse des großen Blutbildes und des Blutausstrichs kann helfen, zwischen den Ursachen der Anämie zu unterscheiden, wie z. B. Ernährungsmängeln, Knochenmarksstörungen, erworbenen hämolytischen Anämien und vererbten Erkrankungen wie Sichelzellenanämie und Thalassämie. ⓘ
Die Referenzbereiche für das vollständige Blutbild stellen die Bandbreite der Ergebnisse dar, die bei 95 % der scheinbar gesunden Menschen gefunden werden. Definitionsgemäß werden immer 5 % der Ergebnisse außerhalb dieses Bereichs liegen, so dass einige abnormale Ergebnisse eher auf natürliche Schwankungen als auf ein medizinisches Problem hindeuten können. Dies ist besonders wahrscheinlich, wenn die Ergebnisse nur geringfügig außerhalb des Referenzbereichs liegen, wenn sie mit früheren Ergebnissen übereinstimmen oder wenn das Blutbild keine anderen damit zusammenhängenden Anomalien aufweist. Wird der Test bei einer relativ gesunden Bevölkerung durchgeführt, kann die Zahl der klinisch unbedeutenden Anomalien die Zahl der Ergebnisse, die auf eine Krankheit hinweisen, übersteigen. Aus diesem Grund empfehlen Berufsverbände in den Vereinigten Staaten, im Vereinigten Königreich und in Kanada, bei Operationen mit geringem Risiko und bei Personen ohne relevante Erkrankungen keine präoperativen CBC-Tests durchzuführen. Wiederholte Blutentnahmen für hämatologische Untersuchungen bei hospitalisierten Patienten können zu einer im Krankenhaus erworbenen Anämie beitragen und zu unnötigen Transfusionen führen. ⓘ
Verfahren
Die Probe wird entnommen, indem das Blut in ein Röhrchen gefüllt wird, das ein Antikoagulans - in der Regel EDTA - enthält, um die natürliche Gerinnung des Blutes zu verhindern. Das Blut wird in der Regel aus einer Vene entnommen, aber wenn dies schwierig ist, kann es auch aus den Kapillaren mit einem Fingerstich oder bei Säuglingen mit einem Fersenstich entnommen werden. Die Tests werden in der Regel mit einem automatischen Analysegerät durchgeführt, aber auch manuelle Verfahren wie eine Blutabstrichuntersuchung oder ein manueller Hämatokrit-Test können zur Untersuchung abnormaler Ergebnisse eingesetzt werden. Zellzählungen und Hämoglobinmessungen werden in Labors, die keinen Zugang zu automatischen Geräten haben, manuell durchgeführt. ⓘ
Automatisiert
Im Analysegerät wird die Probe geschüttelt, um die Zellen gleichmäßig zu verteilen, dann verdünnt und auf mindestens zwei Kanäle aufgeteilt, von denen einer für die Zählung der roten Blutkörperchen und der Blutplättchen und der andere für die Zählung der weißen Blutkörperchen und die Bestimmung der Hämoglobinkonzentration verwendet wird. Einige Geräte messen Hämoglobin in einem separaten Kanal, und zusätzliche Kanäle können für die differenzierte Zählung der weißen Blutkörperchen, die Retikulozytenzählung und spezielle Messungen der Blutplättchen verwendet werden. Die Zellen werden in einem Flüssigkeitsstrom suspendiert, und ihre Eigenschaften werden gemessen, während sie an Sensoren vorbeifließen (Durchflusszytometrie). Die hydrodynamische Fokussierung kann verwendet werden, um einzelne Zellen zu isolieren, so dass genauere Ergebnisse erzielt werden können: Die verdünnte Probe wird in einen Flüssigkeitsstrom mit niedrigem Druck injiziert, der die Zellen in der Probe dazu veranlasst, sich durch die laminare Strömung in einer Reihe aufzustellen. ⓘ


Zur Messung der Hämoglobinkonzentration wird der Probe ein chemisches Reagenz zugesetzt, um die roten Blutkörperchen in einem anderen Kanal als dem für die Erythrozytenzählung verwendeten zu zerstören (zu lysieren). Bei Analysegeräten, die die weißen Blutkörperchen in demselben Kanal wie die Hämoglobinmessung messen, können die weißen Blutkörperchen auf diese Weise leichter gezählt werden. Hämatologie-Analysegeräte messen Hämoglobin mit Hilfe der Spektralphotometrie und beruhen auf der linearen Beziehung zwischen der Absorption von Licht und der Menge des vorhandenen Hämoglobins. Es werden Chemikalien verwendet, um verschiedene Formen von Hämoglobin, wie Oxyhämoglobin und Carboxyhämoglobin, in eine stabile Form, in der Regel Cyanhämoglobin, umzuwandeln und eine dauerhafte Farbänderung zu erzeugen. Die Absorption der resultierenden Farbe, gemessen bei einer bestimmten Wellenlänge - in der Regel 540 Nanometer -, entspricht der Hämoglobinkonzentration. ⓘ
Sensoren zählen und identifizieren die Zellen in der Probe nach zwei Hauptprinzipien: elektrische Impedanz und Lichtstreuung. Die impedanzbasierte Zellzählung funktioniert nach dem Coulter-Prinzip: Die Zellen werden in einer stromdurchflossenen Flüssigkeit suspendiert und verursachen beim Passieren einer kleinen Öffnung (einer Apertur) aufgrund ihrer schlechten elektrischen Leitfähigkeit einen Stromabfall. Die Amplitude des Spannungsimpulses, der erzeugt wird, wenn eine Zelle die Öffnung durchquert, korreliert mit der von der Zelle verdrängten Flüssigkeitsmenge und somit mit dem Zellvolumen, während die Gesamtzahl der Impulse mit der Anzahl der Zellen in der Probe korreliert. Die Verteilung der Zellvolumina wird in einem Histogramm dargestellt, und durch die Festlegung von Schwellenwerten für das Volumen, die auf den typischen Größen der einzelnen Zelltypen basieren, können die verschiedenen Zellpopulationen identifiziert und gezählt werden. ⓘ
Bei der Lichtstreuung wird das Licht eines Lasers oder einer Wolfram-Halogen-Lampe auf den Strom von Zellen gerichtet, um Informationen über deren Größe und Struktur zu sammeln. Die Zellen streuen das Licht beim Durchgang durch den Strahl in unterschiedlichen Winkeln, was mit Photometern erfasst wird. Die Vorwärtsstreuung, die sich auf die Menge des entlang der Strahlachse gestreuten Lichts bezieht, wird hauptsächlich durch Lichtbeugung verursacht und korreliert mit der Zellgröße, während die Seitenstreuung (Licht, das in einem 90-Grad-Winkel gestreut wird) durch Reflexion und Brechung verursacht wird und Informationen über die Komplexität der Zellen liefert. ⓘ
Hochfrequenzbasierte Methoden können in Kombination mit Impedanz verwendet werden. Da der Hochfrequenzstrom jedoch in die Zellen eindringt, hängt die Amplitude des resultierenden Impulses von Faktoren wie der relativen Größe des Zellkerns, der Struktur des Zellkerns und der Menge der Granula im Zytoplasma ab. Kleine Erythrozyten und Zelltrümmer, die eine ähnliche Größe wie Thrombozyten haben, können die Thrombozytenzählung stören, und große Thrombozyten werden möglicherweise nicht genau gezählt. Daher verwenden einige Analysegeräte zusätzliche Techniken zur Messung von Thrombozyten, wie z. B. Fluoreszenzfärbung, Mehrwinkel-Lichtstreuung und Markierung mit monoklonalen Antikörpern. ⓘ
Die meisten Analysegeräte messen direkt die durchschnittliche Größe der roten Blutkörperchen, die als mittleres Zellvolumen (MCV) bezeichnet wird, und berechnen den Hämatokrit durch Multiplikation der Anzahl der roten Blutkörperchen mit dem MCV. Andere messen den Hämatokrit, indem sie das Gesamtvolumen der roten Blutkörperchen mit dem Volumen der Blutprobe vergleichen, und leiten den MCV aus dem Hämatokrit und der Anzahl der roten Blutkörperchen ab. Die Hämoglobinkonzentration, die Anzahl der roten Blutkörperchen und der Hämatokrit werden zur Berechnung der durchschnittlichen Hämoglobinmenge in jedem roten Blutkörperchen, dem mittleren korpuskularen Hämoglobin (MCH), und seiner Konzentration, der mittleren korpuskularen Hämoglobinkonzentration (MCHC), verwendet. Eine weitere Berechnung, die Verteilungsbreite der Erythrozyten (RDW), wird von der Standardabweichung des mittleren Zellvolumens abgeleitet und spiegelt die Variation der Zellgröße wider. ⓘ

Nach der Behandlung mit Reagenzien bilden die Leukozyten drei deutliche Peaks, wenn ihr Volumen in einem Histogramm aufgetragen wird. Diese Peaks entsprechen in etwa den Populationen von Granulozyten, Lymphozyten und anderen mononukleären Zellen, so dass eine dreiteilige Differentialdiagnose allein anhand des Zellvolumens durchgeführt werden kann. Fortschrittlichere Analysegeräte verwenden zusätzliche Techniken, um eine fünf- bis siebenteilige Differenzierung vorzunehmen, wie z. B. Lichtstreuung oder Hochfrequenzanalyse oder die Verwendung von Farbstoffen zur Anfärbung spezifischer Chemikalien in den Zellen - z. B. Nukleinsäuren, die in unreifen Zellen in höheren Konzentrationen vorkommen, oder Myeloperoxidase, ein Enzym, das in Zellen der myeloischen Linie vorkommt. Basophile können in einem separaten Kanal gezählt werden, in dem ein Reagenz andere weiße Zellen zerstört und Basophile intakt lässt. Die aus diesen Messungen gewonnenen Daten werden analysiert und in einem Streudiagramm dargestellt, wo sie Cluster bilden, die mit den einzelnen Typen weißer Blutkörperchen korrelieren. Ein weiterer Ansatz zur Automatisierung der Differenzialzählung ist der Einsatz digitaler Mikroskopie-Software, die mit Hilfe künstlicher Intelligenz die weißen Blutkörperchen anhand von Mikrofotografien des Blutausstrichs klassifiziert. Die Zellbilder werden einem menschlichen Bediener angezeigt, der die Zellen bei Bedarf manuell neu klassifizieren kann. ⓘ
Die meisten Analysegeräte benötigen weniger als eine Minute, um alle Tests des kompletten Blutbildes durchzuführen. Da die Analysegeräte viele einzelne Zellen entnehmen und zählen, sind die Ergebnisse sehr genau. Es kann jedoch vorkommen, dass einige abnorme Zellen nicht korrekt identifiziert werden, so dass eine manuelle Überprüfung der Ergebnisse des Geräts und eine Identifizierung abnormer Zellen, die das Gerät nicht einordnen konnte, auf andere Weise erforderlich ist. ⓘ
Point-of-Care-Tests
Point-of-Care-Tests beziehen sich auf Tests, die außerhalb des Labors durchgeführt werden, z. B. am Krankenbett einer Person oder in einer Klinik. Diese Testmethode ist schneller und verbraucht weniger Blut als herkömmliche Methoden und erfordert kein speziell geschultes Personal, so dass sie in Notfallsituationen und in Gebieten mit begrenztem Zugang zu Ressourcen nützlich ist. Zu den häufig verwendeten Geräten für hämatologische Tests vor Ort gehören der HemoCue, ein tragbares Analysegerät, das die Hämoglobinkonzentration der Probe spektralphotometrisch misst, und der i-STAT, der den Hämoglobinwert durch Schätzung der Konzentration der roten Blutkörperchen anhand der Leitfähigkeit des Blutes ermittelt. Hämoglobin und Hämatokrit können mit Point-of-Care-Geräten gemessen werden, die für die Blutgasanalyse entwickelt wurden, aber diese Messungen korrelieren manchmal schlecht mit denen, die mit Standardmethoden ermittelt wurden. Es gibt vereinfachte Versionen von Hämatologie-Analysegeräten für den Einsatz in Kliniken, die ein komplettes Blutbild und Differentialblutbild liefern können. ⓘ
Manuell

Die Tests können manuell durchgeführt werden, wenn keine automatischen Geräte zur Verfügung stehen oder wenn die Ergebnisse des Analysegeräts weitere Untersuchungen erforderlich machen. Automatisierte Ergebnisse werden in 10-25 % der Fälle für eine manuelle Überprüfung des Blutausstrichs markiert, was auf abnormale Zellpopulationen zurückzuführen sein kann, die das Analysegerät nicht richtig zählen kann, auf interne, vom Analysegerät generierte Markierungen, die darauf hindeuten, dass die Ergebnisse ungenau sein könnten, oder auf numerische Ergebnisse, die außerhalb der festgelegten Grenzwerte liegen. Um diese Probleme zu untersuchen, wird das Blut auf einen Objektträger gestrichen, mit einer Romanowsky-Färbung gefärbt und unter dem Mikroskop untersucht. Das Aussehen der roten und weißen Blutkörperchen sowie der Blutplättchen wird beurteilt, und falls vorhanden, werden qualitative Anomalien gemeldet. Veränderungen im Erscheinungsbild der roten Blutkörperchen können von erheblicher diagnostischer Bedeutung sein - so ist beispielsweise das Vorhandensein von Sichelzellen ein Hinweis auf eine Sichelzellkrankheit, und eine hohe Anzahl fragmentierter roter Blutkörperchen (Schistozyten) erfordert eine dringende Untersuchung, da sie auf eine mikroangiopathische hämolytische Anämie hindeuten kann. Bei einigen entzündlichen Erkrankungen und bei Paraproteinerkrankungen wie dem Multiplen Myelom kann ein hoher Eiweißgehalt im Blut dazu führen, dass die roten Blutkörperchen im Abstrich gestapelt erscheinen, was als Rouleaux bezeichnet wird. Einige parasitäre Erkrankungen wie Malaria und Babesiose können durch den Nachweis der verursachenden Organismen im Blutausstrich nachgewiesen werden, und die Thrombozytenzahl kann anhand des Blutausstrichs geschätzt werden, was nützlich ist, wenn die automatische Thrombozytenzahl ungenau ist. ⓘ
Bei der manuellen Differenzierung der weißen Blutkörperchen zählt der Mikroskopiker 100 Zellen im Blutausstrich und klassifiziert sie anhand ihres Aussehens; manchmal werden auch 200 Zellen gezählt. So erhält man den prozentualen Anteil jeder Art von weißen Blutkörperchen, und durch Multiplikation dieser Prozentsätze mit der Gesamtzahl der weißen Blutkörperchen erhält man die absolute Anzahl der einzelnen Arten von weißen Blutkörperchen. Die manuelle Zählung unterliegt Stichprobenfehlern, da im Vergleich zur automatischen Analyse so wenige Zellen gezählt werden, aber sie kann abnorme Zellen identifizieren, die Analysegeräte nicht erkennen können, wie z. B. die Blastenzellen bei akuter Leukämie. Klinisch bedeutsame Merkmale wie toxische Granulation und Vakuolisierung können auch durch die mikroskopische Untersuchung der weißen Blutkörperchen festgestellt werden. ⓘ
Der Hämatokrit kann manuell bestimmt werden, indem man ein Kapillarröhrchen mit Blut füllt, es zentrifugiert und dann den prozentualen Anteil der roten Blutkörperchen misst. Dies ist bei einigen Erkrankungen nützlich, die dazu führen können, dass die automatischen Hämatokritwerte falsch sind, z. B. bei Polyzythämie (stark erhöhte Anzahl roter Blutkörperchen) oder schwerer Leukozytose (stark erhöhte Anzahl weißer Blutkörperchen, die die Messung der roten Blutkörperchen stört, da weiße Blutkörperchen als rote Blutkörperchen gezählt werden).
Rote und weiße Blutkörperchen sowie Blutplättchen können mit einem Hämozytometer gezählt werden, einem Objektträger mit einer Kammer, die ein bestimmtes Volumen an verdünntem Blut enthält. Die Kammer des Hämozytometers ist mit einem kalibrierten Gitter versehen, das die Zellzählung erleichtert. Die im Gitter sichtbaren Zellen werden gezählt und durch das untersuchte Blutvolumen geteilt, das anhand der Anzahl der auf dem Gitter gezählten Quadrate bestimmt wird, um die Zellkonzentration in der Probe zu ermitteln. Die manuelle Zellzählung ist arbeitsintensiv und im Vergleich zu automatisierten Methoden ungenau, weshalb sie nur in Labors, die keinen Zugang zu automatisierten Analysegeräten haben, selten verwendet wird. Zur Zählung der weißen Blutkörperchen wird die Probe mit einer Flüssigkeit verdünnt, die eine Verbindung enthält, die die roten Blutkörperchen auflöst, z. B. Ammoniumoxalat, Essigsäure oder Salzsäure. Manchmal wird dem Verdünnungsmittel ein Farbstoff zugesetzt, der die Zellkerne der weißen Blutkörperchen hervorhebt, so dass sie leichter zu identifizieren sind. Manuelle Thrombozytenzählungen werden auf ähnliche Weise durchgeführt, wobei bei einigen Methoden die roten Blutkörperchen unversehrt bleiben. Die Verwendung eines Phasenkontrastmikroskops anstelle eines Lichtmikroskops kann die Identifizierung der Blutplättchen erleichtern. Die manuelle Erythrozytenzählung wird nur selten durchgeführt, da sie ungenau ist und andere Methoden wie die Hämoglobinometrie und der manuelle Hämatokrit für die Bewertung der Erythrozyten zur Verfügung stehen; wenn es jedoch notwendig ist, können die Erythrozyten in mit Kochsalzlösung verdünntem Blut gezählt werden. ⓘ
Hämoglobin kann manuell mit einem Spektrophotometer oder Kolorimeter gemessen werden. Zur manuellen Messung von Hämoglobin wird die Probe mit Reagenzien verdünnt, die rote Blutkörperchen zerstören, um das Hämoglobin freizusetzen. Andere Chemikalien werden verwendet, um verschiedene Arten von Hämoglobin in eine Form umzuwandeln, so dass es leicht gemessen werden kann. Die Lösung wird dann in eine Messküvette gegeben, und die Absorption wird bei einer bestimmten Wellenlänge gemessen, die von der Art des verwendeten Reagenzes abhängt. Ein Referenzstandard, der eine bekannte Menge Hämoglobin enthält, wird verwendet, um das Verhältnis zwischen der Absorption und der Hämoglobinkonzentration zu bestimmen, wodurch der Hämoglobingehalt der Probe gemessen werden kann. ⓘ
In ländlichen und wirtschaftlich benachteiligten Gebieten ist das Testangebot durch den Zugang zu Geräten und Personal begrenzt. In Einrichtungen der Primärversorgung in diesen Regionen können sich die Tests auf die Untersuchung der Erythrozytenmorphologie und die manuelle Messung des Hämoglobinwerts beschränken, während komplexere Verfahren wie die manuelle Zellzählung und Differenzialdiagnose und manchmal auch die automatisierte Zellzählung in Bezirkslabors durchgeführt werden. Regionale und provinzielle Krankenhäuser und akademische Zentren haben in der Regel Zugang zu automatischen Analysegeräten. Wo keine Laboreinrichtungen zur Verfügung stehen, kann die Hämoglobinkonzentration geschätzt werden, indem ein Tropfen Blut auf ein standardisiertes saugfähiges Papier gegeben und mit einer Farbskala verglichen wird. ⓘ
Qualitätskontrolle
Automatisierte Analysegeräte müssen regelmäßig kalibriert werden. Die meisten Hersteller liefern Blutkonserven mit definierten Parametern, und die Analysegeräte werden justiert, wenn die Ergebnisse außerhalb der festgelegten Schwellenwerte liegen. Um sicherzustellen, dass die Ergebnisse weiterhin genau sind, werden mindestens einmal täglich Qualitätskontrollproben getestet, die in der Regel vom Gerätehersteller zur Verfügung gestellt werden. Die Proben werden so formuliert, dass sie bestimmte Ergebnisse liefern, und die Labors vergleichen ihre Ergebnisse mit den bekannten Werten, um sicherzustellen, dass das Gerät ordnungsgemäß funktioniert. Für Labors, die keinen Zugang zu kommerziellem Qualitätskontrollmaterial haben, empfiehlt eine indische Aufsichtsbehörde, Patientenproben in zweifacher Ausführung zu testen und die Ergebnisse zu vergleichen. Eine gleitende Durchschnittsmessung, bei der die durchschnittlichen Ergebnisse für Patientenproben in bestimmten Abständen gemessen werden, kann als zusätzliche Qualitätskontrolltechnik verwendet werden. Unter der Annahme, dass die Merkmale der Patientenpopulation im Laufe der Zeit in etwa gleich bleiben, sollte der Durchschnittswert konstant bleiben; große Verschiebungen des Durchschnittswerts können auf Geräteprobleme hinweisen. Die MCHC-Werte sind in dieser Hinsicht besonders nützlich. ⓘ
Neben der Analyse interner Qualitätskontrollproben mit bekannten Ergebnissen können Laboratorien auch externe Qualitätsbewertungsproben von Aufsichtsbehörden erhalten. Während der Zweck der internen Qualitätskontrolle darin besteht, sicherzustellen, dass die Ergebnisse des Analysegeräts innerhalb eines bestimmten Labors reproduzierbar sind, wird bei der externen Qualitätsbewertung überprüft, ob die Ergebnisse verschiedener Laboratorien untereinander und mit den Zielwerten übereinstimmen. Die erwarteten Ergebnisse der Proben für die externe Qualitätsbewertung werden dem Laboratorium nicht mitgeteilt. Externe Qualitätsbewertungsprogramme sind in Nordamerika und Westeuropa weit verbreitet, und die Laboratorien sind häufig verpflichtet, an diesen Programmen teilzunehmen, um ihre Akkreditierung aufrechtzuerhalten. Logistische Probleme können es Laboratorien in unterversorgten Gebieten erschweren, externe Qualitätsbewertungsprogramme durchzuführen. ⓘ
Enthaltene Tests
Das große Blutbild misst die Menge an Blutplättchen, roten und weißen Blutkörperchen sowie die Hämoglobin- und Hämatokritwerte. Die Indizes der roten Blutkörperchen - MCV, MCH und MCHC -, die die Größe der roten Blutkörperchen und ihren Hämoglobingehalt beschreiben, werden zusammen mit der Verteilungsbreite der roten Blutkörperchen (RDW) angegeben, die die Größenunterschiede der roten Blutkörperchen misst. Eine Differenzialdiagnose der weißen Blutkörperchen, die die verschiedenen Arten von weißen Blutkörperchen aufzählt, kann durchgeführt werden, und manchmal wird auch eine Zählung der unreifen roten Blutkörperchen (Retikulozyten) durchgeführt. ⓘ
Rote Blutkörperchen, Hämoglobin und Hämatokrit
| Analyte | Ergebnis | Normaler Bereich |
|---|---|---|
| Erythrozytenzahl | 5,5 x 1012/L | 4.5–5.7 |
| Anzahl der weißen Blutkörperchen | 9,8 x 109/L | 4.0–10.0 |
| Hämoglobin | 123 g/L | 133–167 |
| Hämatokrit | 0.42 | 0.35–0.53 |
| MCV | 76 fL | 77–98 |
| MCH | 22,4 pg | 26–33 |
| MCHC | 293 g/L | 330–370 |
| RDW | 14.5% | 10.3–15.3 |
Die roten Blutkörperchen transportieren den Sauerstoff von der Lunge zu den Geweben und befördern auf ihrem Rückweg das Kohlendioxid zurück in die Lunge, wo es ausgeatmet wird. Diese Funktionen werden durch das Hämoglobin der Zellen vermittelt. Das Analysegerät zählt die roten Blutkörperchen und gibt das Ergebnis in Einheiten von 106 Zellen pro Mikroliter Blut (× 106/μL) oder 1012 Zellen pro Liter (× 1012/L) an; außerdem misst es ihre durchschnittliche Größe, die als mittleres Zellvolumen bezeichnet und in Femtolitern oder Kubikmikrometern angegeben wird. Durch Multiplikation des mittleren Zellvolumens mit der Anzahl der roten Blutkörperchen lässt sich der Hämatokrit (HCT) oder das gepackte Zellvolumen (PCV), ein Maß für den prozentualen Anteil der roten Blutkörperchen im Blut, ableiten; wird der Hämatokrit direkt bestimmt, kann das mittlere Zellvolumen aus dem Hämatokrit und der Anzahl der roten Blutkörperchen berechnet werden. Das Hämoglobin, das nach der Lyse der roten Blutkörperchen gemessen wird, wird in der Regel in Gramm pro Liter (g/L) oder Gramm pro Deziliter (g/dL) angegeben. Unter der Annahme, dass die roten Blutkörperchen normal sind, besteht ein konstantes Verhältnis zwischen Hämoglobin und Hämatokrit: Der prozentuale Hämatokritwert ist etwa dreimal so hoch wie der Hämoglobinwert in g/dL, plus oder minus drei. Anhand dieses Verhältnisses, der so genannten Dreierregel, lässt sich bestätigen, dass die Ergebnisse des CBC korrekt sind. ⓘ
Aus der Anzahl der roten Blutkörperchen, der Hämoglobinkonzentration und dem Hämatokrit werden zwei weitere Messwerte berechnet: das mittlere korpuskuläre Hämoglobin und die mittlere korpuskuläre Hämoglobinkonzentration. Diese Parameter beschreiben den Hämoglobingehalt der einzelnen roten Blutkörperchen. MCH und MCHC können verwirrend sein; im Wesentlichen ist der MCH ein Maß für die durchschnittliche Menge an Hämoglobin pro rotem Blutkörperchen. Der MCHC gibt den durchschnittlichen Hämoglobinanteil der Zelle an. Bei der MCH wird die Größe der roten Blutkörperchen nicht berücksichtigt, bei der MCHC hingegen schon. MCV, MCH und MCHC werden zusammen als Erythrozytenindizes bezeichnet. Veränderungen dieser Indizes sind auf dem Blutausstrich sichtbar: Ungewöhnlich große oder kleine rote Blutkörperchen sind im Vergleich zur Größe der weißen Blutkörperchen erkennbar, und Zellen mit einer niedrigen Hämoglobinkonzentration erscheinen blass. Aus den ersten Messungen der roten Blutkörperchen wird ein weiterer Parameter errechnet: die Verteilungsbreite der roten Blutkörperchen (RDW), die den Grad der Größenunterschiede der Zellen widerspiegelt. ⓘ

Ein abnorm niedriger Hämoglobin-, Hämatokrit- oder Erythrozytenwert weist auf eine Anämie hin. Anämie ist keine eigenständige Diagnose, sondern deutet auf eine Grunderkrankung hin, die die roten Blutkörperchen der Person beeinträchtigt. Zu den allgemeinen Ursachen einer Anämie gehören Blutverlust, die Produktion fehlerhafter roter Blutkörperchen (ineffektive Erythropoese), eine verminderte Produktion roter Blutkörperchen (unzureichende Erythropoese) und eine verstärkte Zerstörung roter Blutkörperchen (hämolytische Anämie). Eine Anämie verringert die Fähigkeit des Blutes, Sauerstoff zu transportieren, und verursacht Symptome wie Müdigkeit und Kurzatmigkeit. Fällt der Hämoglobinwert unter die vom klinischen Zustand der Person abhängigen Grenzwerte, kann eine Bluttransfusion erforderlich sein. ⓘ
Eine erhöhte Anzahl roter Blutkörperchen, die in der Regel zu einem Anstieg von Hämoglobin und Hämatokrit führt, wird als Polyzythämie bezeichnet. Eine Dehydratation oder die Einnahme von Diuretika kann eine "relative" Polyzythämie verursachen, da die Plasmamenge im Vergleich zu den roten Blutkörperchen abnimmt. Ein echter Anstieg der Zahl der roten Blutkörperchen, die so genannte absolute Polyzythämie, kann auftreten, wenn der Körper mehr rote Blutkörperchen produziert, um chronisch niedrige Sauerstoffwerte bei Erkrankungen wie Lungen- oder Herzkrankheiten auszugleichen, oder wenn eine Person abnorm hohe Werte von Erythropoietin (EPO) aufweist, einem Hormon, das die Produktion roter Blutkörperchen anregt. Bei der Polyzythämie vera produziert das Knochenmark rote und andere Blutzellen in einem übermäßig hohen Maße. ⓘ
Die Bestimmung der Erythrozyten-Indizes ist hilfreich, um die Ursache der Anämie zu ermitteln. Ist der MCV-Wert niedrig, spricht man von einer mikrozytären Anämie, während eine Anämie mit einem hohen MCV-Wert als makrozytäre Anämie bezeichnet wird. Eine Anämie mit einem niedrigen MCHC-Wert wird als hypochrome Anämie bezeichnet. Liegt eine Anämie vor, aber die Erythrozytenindizes sind normal, wird die Anämie als normochrom und normozytisch bezeichnet. Der Begriff Hyperchromie, der sich auf einen hohen MCHC-Wert bezieht, wird im Allgemeinen nicht verwendet. Eine Erhöhung des MCHC-Wertes über den oberen Referenzwert hinaus ist selten und tritt hauptsächlich bei Erkrankungen wie Sphärozytose, Sichelzellkrankheit und Hämoglobin-C-Krankheit auf. Ein erhöhter MCHC-Wert kann auch ein falsches Ergebnis sein, z. B. aufgrund einer Erythrozytenagglutination (die zu einer falschen Abnahme der Erythrozytenzahl und damit zu einer Erhöhung des MCHC-Wertes führt) oder aufgrund stark erhöhter Lipidmengen im Blut (die zu einem falschen Anstieg des Hämoglobinwertes führen). ⓘ
Eine mikrozytäre Anämie wird typischerweise mit Eisenmangel, Thalassämie und Anämie bei chronischen Krankheiten in Verbindung gebracht, während eine makrozytäre Anämie mit Alkoholismus, Folsäure- und B12-Mangel, der Einnahme bestimmter Medikamente und einigen Knochenmarkserkrankungen einhergeht. Akuter Blutverlust, hämolytische Anämie, Knochenmarksstörungen und verschiedene chronische Krankheiten können zu einer Anämie mit einem normozytären Blutbild führen. Der MCV-Wert erfüllt einen weiteren Zweck bei der Qualitätskontrolle im Labor. Im Vergleich zu anderen CBC-Parametern ist er im Laufe der Zeit relativ stabil, so dass eine starke Veränderung des MCV darauf hinweisen kann, dass die Probe vom falschen Patienten entnommen wurde. ⓘ
Ein niedriger RDW-Wert hat keine klinische Bedeutung, ein erhöhter RDW-Wert weist jedoch auf eine erhöhte Variation der Größe der roten Blutkörperchen hin, die als Anisozytose bezeichnet wird. Anisozytose tritt häufig bei ernährungsbedingten Anämien wie Eisenmangelanämie und Anämie aufgrund von Vitamin B12- oder Folsäuremangel auf, während Menschen mit Thalassämie einen normalen RDW haben können. Auf der Grundlage der CBC-Ergebnisse können weitere Schritte zur Untersuchung der Anämie unternommen werden, z. B. ein Ferritintest zur Bestätigung eines Eisenmangels oder eine Hämoglobinelektrophorese zur Diagnose einer Hämoglobinopathie wie Thalassämie oder Sichelzellenanämie. ⓘ
Weiße Blutkörperchen
|
|
Weiße Blutkörperchen dienen der Abwehr von Infektionen und sind an der Entzündungsreaktion beteiligt. Eine hohe Anzahl weißer Blutkörperchen, die als Leukozytose bezeichnet wird, tritt häufig bei Infektionen, Entzündungen und physiologischen Stresszuständen auf. Sie kann auch durch Krankheiten verursacht werden, die mit einer abnormen Produktion von Blutzellen einhergehen, wie z. B. myeloproliferative und lymphoproliferative Erkrankungen. Eine verringerte Anzahl weißer Blutkörperchen, die so genannte Leukopenie, kann zu einem erhöhten Infektionsrisiko führen und tritt bei Behandlungen wie Chemo- und Strahlentherapie sowie bei vielen Erkrankungen auf, die die Produktion von Blutzellen hemmen. Eine Sepsis geht sowohl mit Leukozytose als auch mit Leukopenie einher. Die Gesamtzahl der weißen Blutkörperchen wird normalerweise in Zellen pro Mikroliter Blut (/μL) oder 109 Zellen pro Liter (× 109/L) angegeben. ⓘ
Bei der Differenzierung der weißen Blutkörperchen werden die verschiedenen Arten von weißen Blutkörperchen identifiziert und gezählt. Die Ergebnisse werden als Prozentsatz und als absolute Zahl pro Volumeneinheit angegeben. In der Regel werden fünf Arten von Leukozyten - Nutrophile, Lymphozyten, Monozyten, Eosinophile und Basophile - gemessen. Einige Geräte geben die Anzahl der unreifen Granulozyten an, eine Klassifizierung, die aus Vorläufern der Neutrophilen besteht, insbesondere Promyelozyten, Myelozyten und Metamyelozyten. Andere Zelltypen werden angegeben, wenn sie bei der manuellen Differenzierung identifiziert werden. ⓘ
Differenzialergebnisse sind bei der Diagnose und Überwachung vieler medizinischer Erkrankungen nützlich. Eine erhöhte Neutrophilenzahl (Neutrophilie) wird beispielsweise mit bakteriellen Infektionen, Entzündungen und myeloproliferativen Störungen in Verbindung gebracht, während eine verminderte Zahl (Neutropenie) bei Personen auftreten kann, die sich einer Chemotherapie unterziehen, bestimmte Medikamente einnehmen oder an Krankheiten leiden, die das Knochenmark beeinträchtigen. Eine Neutropenie kann auch durch einige angeborene Störungen verursacht werden und vorübergehend nach viralen oder bakteriellen Infektionen bei Kindern auftreten. Menschen mit schwerer Neutropenie und klinischen Anzeichen einer Infektion werden mit Antibiotika behandelt, um eine potenziell lebensbedrohliche Erkrankung zu verhindern. ⓘ

Eine erhöhte Anzahl von Bandneutrophilen - jungen Neutrophilen, denen ein segmentierter Zellkern fehlt - oder unreifen Granulozyten wird als Linksverschiebung bezeichnet und tritt bei Sepsis und einigen Blutkrankheiten auf, ist aber in der Schwangerschaft normal. Eine erhöhte Lymphozytenzahl (Lymphozytose) wird mit Virusinfektionen und lymphoproliferativen Erkrankungen wie der chronischen lymphatischen Leukämie in Verbindung gebracht; eine erhöhte Monozytenzahl (Monozytose) wird mit chronischen Entzündungszuständen in Verbindung gebracht; und die Eosinophilenzahl ist häufig bei parasitären Infektionen und allergischen Erkrankungen erhöht (Eosinophilie). Eine erhöhte Anzahl von Basophilen, die so genannte Basophilie, kann bei myeloproliferativen Erkrankungen wie chronischer myeloischer Leukämie und Polycythemia vera auftreten. Das Vorhandensein einiger Arten abnormaler Zellen, wie Blastenzellen oder Lymphozyten mit neoplastischen Merkmalen, ist ein Hinweis auf eine hämatologische Malignität. ⓘ
Blutplättchen
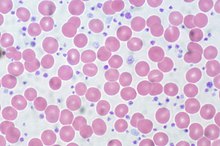
Thrombozyten spielen eine wichtige Rolle bei der Blutgerinnung. Wenn die Wand eines Blutgefäßes beschädigt wird, heften sich die Blutplättchen an die freiliegende Oberfläche an der Verletzungsstelle und schließen den Spalt. Die gleichzeitige Aktivierung der Gerinnungskaskade führt zur Bildung von Fibrin, das den Thrombozytenpfropfen verstärkt und ein stabiles Gerinnsel bildet. Eine niedrige Thrombozytenzahl, die so genannte Thrombozytopenie, kann in schweren Fällen zu Blutungen führen. Sie kann bei Personen auftreten, die sich Behandlungen unterziehen, die das Knochenmark unterdrücken, wie z. B. Chemo- oder Strahlentherapie, oder die bestimmte Medikamente wie Heparin einnehmen, die das Immunsystem veranlassen können, Blutplättchen zu zerstören. Thrombozytopenie ist ein Merkmal vieler Blutkrankheiten, wie akuter Leukämie und aplastischer Anämie, sowie einiger Autoimmunerkrankungen. Wenn die Zahl der Blutplättchen extrem niedrig ist, kann eine Thrombozytentransfusion durchgeführt werden. Thrombozytose, d. h. eine hohe Thrombozytenzahl, kann bei Entzündungen oder Traumata sowie bei Eisenmangel auftreten, und die Thrombozytenzahl kann bei Menschen mit essenzieller Thrombozythämie, einer seltenen Blutkrankheit, außergewöhnlich hohe Werte erreichen. Die Thrombozytenzahl kann in Einheiten von Zellen pro Mikroliter Blut (/μL), 103 Zellen pro Mikroliter (× 103/μL) oder 109 Zellen pro Liter (× 109/L) angegeben werden. ⓘ
Das mittlere Thrombozytenvolumen (MPV) misst die durchschnittliche Größe der Thrombozyten in Femtolitern. Ein erhöhtes MPV kann auftreten, wenn junge Thrombozyten in den Blutkreislauf abgegeben werden, um die verstärkte Zerstörung von Thrombozyten zu kompensieren, während eine verminderte Produktion von Thrombozyten aufgrund einer Funktionsstörung des Knochenmarks zu einem niedrigen MPV führen kann. Der MPV ist auch nützlich für die Unterscheidung zwischen angeborenen Krankheiten, die eine Thrombozytopenie verursachen. Die Fraktion der unreifen Blutplättchen (IPF) oder die Anzahl der retikulierten Blutplättchen wird von einigen Analysegeräten angegeben und gibt Aufschluss über die Geschwindigkeit der Blutplättchenproduktion, indem die Anzahl der unreifen Blutplättchen im Blut gemessen wird. ⓘ
- Thrombozytopenie oder Thrombopenie: zu wenige Thrombozyten
- Thrombozytose: zu viele Thrombozyten ⓘ
Andere Tests
Retikulozytenzahl

Retikulozyten sind unreife rote Blutkörperchen, die im Gegensatz zu den reifen Zellen RNA enthalten. Ein Retikulozytenzählung wird manchmal im Rahmen eines vollständigen Blutbildes durchgeführt, in der Regel um die Ursache der Anämie einer Person zu untersuchen oder ihr Ansprechen auf eine Behandlung zu bewerten. Eine Anämie mit einer hohen Retikulozytenzahl kann darauf hindeuten, dass das Knochenmark vermehrt rote Blutkörperchen produziert, um den Blutverlust oder die Hämolyse auszugleichen, während eine Anämie mit einer niedrigen Retikulozytenzahl darauf hindeuten kann, dass der Betroffene an einer Erkrankung leidet, die die Fähigkeit des Körpers zur Produktion roter Blutkörperchen verringert. Wenn Menschen mit ernährungsbedingter Anämie eine Nährstoffergänzung erhalten, deutet ein Anstieg der Retikulozytenzahl darauf hin, dass ihr Körper auf die Behandlung mit der Produktion von mehr roten Blutkörperchen reagiert. Hämatologische Analysegeräte führen Retikulozytenzählungen durch, indem sie die roten Blutkörperchen mit einem Farbstoff färben, der an RNA bindet, und die Anzahl der Retikulozyten durch Lichtstreuung oder Fluoreszenzanalyse messen. Der Test kann manuell durchgeführt werden, indem das Blut mit neuem Methylenblau angefärbt und der Prozentsatz der roten Blutkörperchen, die RNA enthalten, unter dem Mikroskop gezählt wird. Die Retikulozytenzahl wird als absolute Zahl oder als Prozentsatz der roten Blutkörperchen angegeben. ⓘ
Einige Geräte messen die durchschnittliche Menge an Hämoglobin in jedem Retikulozyten; ein Parameter, der als Indikator für Eisenmangel bei Menschen untersucht wurde, die an Erkrankungen leiden, die die Standardtests stören. Die Fraktion der unreifen Retikulozyten (IRF) ist eine weitere Messung, die von einigen Analysegeräten vorgenommen wird und die Reife der Retikulozyten quantifiziert: Zellen, die weniger reif sind, enthalten mehr RNA und erzeugen daher ein stärkeres Fluoreszenzsignal. Diese Information kann bei der Diagnose von Anämien und der Bewertung der Produktion roter Blutkörperchen nach einer Anämiebehandlung oder Knochenmarktransplantation nützlich sein. ⓘ
Kernhaltige rote Blutkörperchen

Während ihrer Bildung im Knochenmark sowie in der Leber und der Milz bei Föten enthalten die roten Blutkörperchen einen Zellkern, der bei den reifen Zellen, die im Blutkreislauf zirkulieren, normalerweise fehlt. Kernhaltige rote Blutkörperchen sind bei Neugeborenen normal, werden sie jedoch bei Kindern und Erwachsenen entdeckt, weisen sie auf einen erhöhten Bedarf an roten Blutkörperchen hin, der durch Blutungen, einige Krebsarten und Anämie verursacht werden kann. Die meisten Analysegeräte können diese Zellen als Teil des Differentialblutbildes nachweisen. Eine hohe Anzahl kernhaltiger Erythrozyten kann zu einem falsch hohen Wert der weißen Blutkörperchen führen, der dann korrigiert werden muss. ⓘ
Andere Parameter
Moderne Hämatologie-Analysegeräte ermöglichen neuartige Messungen von Blutzellen, die sich in Forschungsstudien als diagnostisch bedeutsam erwiesen haben, aber noch keine breite klinische Anwendung gefunden haben. Einige Analysegeräte erzeugen beispielsweise Koordinatenwerte, die die Größe und Position jedes einzelnen weißen Blutkörperchen-Clusters angeben. Diese Parameter (die so genannten Zellpopulationsdaten) wurden als potenzielle Marker für Blutkrankheiten, bakterielle Infektionen und Malaria untersucht. Analysegeräte, die Myeloperoxidase-Färbung zur Erstellung von Differenzialzählungen verwenden, können die Expression des Enzyms in den weißen Blutkörperchen messen, die bei verschiedenen Erkrankungen verändert ist. Einige Geräte können neben dem MCHC-Durchschnittswert auch den Prozentsatz der hypochromen roten Blutkörperchen angeben oder die Anzahl der fragmentierten roten Blutkörperchen (Schistozyten) ermitteln, die bei einigen Arten von hämolytischer Anämie auftreten. Da diese Parameter oft für bestimmte Marken von Analysegeräten spezifisch sind, ist es für die Labors schwierig, die Ergebnisse zu interpretieren und zu vergleichen. ⓘ
Referenzbereiche
| Test | Einheiten | Erwachsene | Pädiatrisch
(4-7 Jahre alt) |
Neugeborene
(0-1 Tage alt) ⓘ |
|---|---|---|---|---|
| WBC | × 109/L | 3.6–10.6 | 5.0–17.0 | 9.0–37.0 |
| ERYTHROZYTEN | × 1012/L |
|
4.00–5.20 | 4.10–6.10 |
| HGB | g/L |
|
102–152 | 165–215 |
| HCT | L/L |
|
0.36–0.46 | 0.48–0.68 |
| MCV | fL | 80–100 | 78–94 | 95–125 |
| MCH | pg | 26–34 | 23–31 | 30–42 |
| MCHC | g/L | 320–360 | 320–360 | 300–340 |
| RDW | % | 11.5–14.5 | 11.5–14.5 | Erhöht |
| PLT | × 109/L | 150–450 | 150–450 | 150–450 |
| Neutrophile | × 109/L | 1.7–7.5 | 1.5–11.0 | 3.7–30.0 |
| Lymphozyten | × 109/L | 1.0–3.2 | 1.5–11.1 | 1.6–14.1 |
| Monozyten | × 109/L | 0.1–1.3 | 0.1–1.9 | 0.1–4.4 |
| Eosinophile | × 109/L | 0.0–0.3 | 0.0–0.7 | 0.0–1.5 |
| Basophile | × 109/L | 0.0–0.2 | 0.0–0.3 | 0.0–0.7 |
Das vollständige Blutbild wird interpretiert, indem die Ergebnisse mit Referenzbereichen verglichen werden, die die Ergebnisse von 95 % der scheinbar gesunden Menschen repräsentieren. Auf der Grundlage einer statistischen Normalverteilung variieren die Bereiche der untersuchten Proben je nach Geschlecht und Alter. ⓘ
Im Durchschnitt haben erwachsene Frauen niedrigere Hämoglobin-, Hämatokrit- und Erythrozytenwerte als Männer; nach der Menopause nimmt der Unterschied ab, ist aber immer noch vorhanden. Die CBC-Ergebnisse für Kinder und Neugeborene unterscheiden sich von denen der Erwachsenen. Die Hämoglobin-, Hämatokrit- und Erythrozytenwerte von Neugeborenen sind extrem hoch, um den niedrigen Sauerstoffgehalt im Mutterleib und den hohen Anteil an fetalem Hämoglobin in den roten Blutkörperchen auszugleichen, das weniger effektiv Sauerstoff an das Gewebe abgibt als reife Formen von Hämoglobin. Der MCV-Wert ist ebenfalls erhöht, und die Anzahl der weißen Blutkörperchen ist mit einem Übergewicht an Neutrophilen erhöht. Die Anzahl der roten Blutkörperchen und die entsprechenden Werte beginnen kurz nach der Geburt zu sinken, erreichen ihren Tiefpunkt im Alter von etwa zwei Monaten und steigen danach wieder an. Die roten Blutkörperchen älterer Säuglinge und Kinder sind kleiner und haben einen niedrigeren MCH-Wert als die von Erwachsenen. Bei der Differenzierung der weißen Blutkörperchen in der Pädiatrie überwiegen die Lymphozyten häufig die Neutrophilen, während bei Erwachsenen die Neutrophilen überwiegen. ⓘ
Andere Unterschiede zwischen den Bevölkerungsgruppen können sich auf die Referenzbereiche auswirken: So haben Menschen, die in höheren Lagen leben, höhere Hämoglobin-, Hämatokrit- und Erythrozytenwerte, und Menschen afrikanischer Herkunft haben im Durchschnitt niedrigere Leukozytenwerte. Auch die Art des Analysegeräts, mit dem das Blutbild durchgeführt wird, wirkt sich auf die Referenzbereiche aus. Die Referenzbereiche werden daher von den einzelnen Labors auf der Grundlage ihrer eigenen Patientenpopulation und Ausrüstung festgelegt. ⓘ
Beschränkungen
Bestimmte medizinische Bedingungen oder Probleme mit der Blutprobe können zu ungenauen Ergebnissen führen. Wenn die Probe sichtbar verklumpt ist, was durch eine schlechte Phlebotomietechnik verursacht werden kann, ist sie für den Test ungeeignet, da die Thrombozytenzahl fälschlicherweise verringert wird und andere Ergebnisse abnormal sein können. Proben, die mehrere Stunden bei Raumtemperatur gelagert werden, können falsch hohe Werte für den MCV-Wert ergeben, da die roten Blutkörperchen bei der Aufnahme von Wasser aus dem Plasma anschwellen; und die Differenzialergebnisse für Thrombozyten und weiße Blutkörperchen können bei gealterten Proben ungenau sein, da sich die Zellen mit der Zeit abbauen. ⓘ

Proben von Personen mit sehr hohem Bilirubin- oder Lipidgehalt im Plasma (so genannte ikterische Proben bzw. lipämische Proben) können falsch hohe Hämoglobinwerte anzeigen, da diese Substanzen die Farbe und Trübung der Probe verändern, was die Hämoglobinmessung beeinträchtigt. Dieser Effekt kann durch Ersetzen des Plasmas durch Kochsalzlösung abgeschwächt werden. ⓘ
Manche Menschen produzieren einen Antikörper, der dazu führt, dass ihre Blutplättchen verklumpen, wenn ihr Blut in Röhrchen mit EDTA, dem üblicherweise zur Entnahme von CBC-Proben verwendeten Antikoagulans, abgefüllt wird. Thrombozytenklumpen können von automatischen Analysegeräten als einzelne Thrombozyten gezählt werden, was zu einer fälschlicherweise verminderten Thrombozytenzahl führt. Dies kann durch die Verwendung eines alternativen Antikoagulans wie Natriumzitrat oder Heparin vermieden werden. ⓘ
Eine weitere antikörpervermittelte Erkrankung, die die Ergebnisse des vollständigen Blutbildes beeinflussen kann, ist die Agglutination der roten Blutkörperchen. Bei diesem Phänomen verklumpen die roten Blutkörperchen aufgrund von Antikörpern, die an der Zelloberfläche gebunden sind. Erythrozytenaggregate werden vom Analysegerät als einzelne Zellen gezählt, was zu einem deutlich verringerten Erythrozytenzahl- und Hämatokritwert und einem deutlich erhöhten MCV und MCHC-Wert führt. Häufig sind diese Antikörper nur bei Raumtemperatur aktiv (in diesem Fall werden sie als Kälteagglutinine bezeichnet), und die Agglutination kann durch Erhitzen der Probe auf 37 °C rückgängig gemacht werden. Proben von Menschen mit warmer autoimmuner hämolytischer Anämie können eine Erythrozytenagglutination aufweisen, die sich bei Erwärmung nicht auflöst. ⓘ
Während Blasten- und Lymphomzellen bei der manuellen Differentialdiagnose identifiziert werden können, lässt sich bei der mikroskopischen Untersuchung die hämatopoetische Abstammung der Zellen nicht zuverlässig bestimmen. Diese Information ist häufig für die Diagnose von Blutkrebs erforderlich. Nach der Identifizierung abnormaler Zellen können zusätzliche Techniken wie die Immunphänotypisierung mittels Durchflusszytometrie eingesetzt werden, um Marker zu identifizieren, die zusätzliche Informationen über die Zellen liefern. ⓘ
Geschichte

Vor der Einführung automatischer Zellzähler wurden vollständige Blutbilduntersuchungen manuell durchgeführt: Die weißen und roten Blutkörperchen sowie die Blutplättchen wurden mit Hilfe von Mikroskopen gezählt. Die erste Person, die mikroskopische Beobachtungen von Blutzellen veröffentlichte, war Antonie van Leeuwenhoek, der 1674 in einem Brief an die Proceedings of the Royal Society of London über das Aussehen der roten Blutkörperchen berichtete. Jan Swammerdam hatte bereits einige Jahre zuvor rote Blutkörperchen beschrieben, seine Erkenntnisse aber damals nicht veröffentlicht. Im Laufe des 18. und 19. Jahrhunderts ermöglichten Verbesserungen in der Mikroskoptechnik, wie z. B. achromatische Linsen, die Zählung von weißen Blutkörperchen und Blutplättchen in ungefärbten Proben. ⓘ
Dem Physiologen Karl Vierordt wird die Durchführung des ersten Blutbildes zugeschrieben. Bei seiner 1852 veröffentlichten Technik wurde eine sorgfältig abgemessene Menge Blut in ein Kapillarröhrchen gesaugt und auf einen mit Eiweiß bestrichenen Objektträger aufgetragen. Nachdem das Blut getrocknet war, zählte er jede Zelle auf dem Objektträger; dieser Vorgang konnte mehr als drei Stunden in Anspruch nehmen. Das 1874 von Louis-Charles Malassez eingeführte Hämozytometer vereinfachte die mikroskopische Zählung der Blutzellen. Das Hämozytometer von Malassez bestand aus einem Objektträger, der ein abgeflachtes Kapillarrohr enthielt. Verdünntes Blut wurde mit Hilfe eines an einem Ende angebrachten Gummischlauchs in die Kapillarkammer eingeführt, und am Mikroskop wurde ein Okular mit einem skalierten Gitter angebracht, mit dem der Mikroskopiker die Anzahl der Zellen pro Blutvolumen zählen konnte. 1877 erfand William Gowers ein Hämozytometer mit einem eingebauten Zählgitter, wodurch die Notwendigkeit entfiel, für jedes Mikroskop speziell kalibrierte Okulare herzustellen. ⓘ

In den 1870er Jahren entwickelte Paul Ehrlich eine Färbetechnik mit einer Kombination aus einem sauren und einem basischen Farbstoff, mit der verschiedene Arten von weißen Blutkörperchen unterschieden und die Morphologie der roten Blutkörperchen untersucht werden konnten. Dmitri Leonidowitsch Romanowsky verbesserte diese Technik in den 1890er Jahren, indem er eine Mischung aus Eosin und gealtertem Methylenblau verwendete, um eine breite Palette von Farbtönen zu erzeugen, die bei der alleinigen Verwendung eines der beiden Farbstoffe nicht vorhanden waren. Dies wurde die Grundlage für die Romanowsky-Färbung, die auch heute noch zum Färben von Blutausstrichen für die manuelle Überprüfung verwendet wird. ⓘ
Die ersten Verfahren zur Messung von Hämoglobin wurden im späten 19. Jahrhundert entwickelt und umfassten visuelle Vergleiche der Farbe von verdünntem Blut mit einem bekannten Standard. Versuche, diesen Prozess mit Hilfe der Spektralphotometrie und der Kolorimetrie zu automatisieren, scheiterten an der Tatsache, dass Hämoglobin im Blut in vielen verschiedenen Formen vorkommt, so dass es nicht bei einer einzigen Wellenlänge gemessen werden konnte. 1920 wurde eine Methode zur Umwandlung der verschiedenen Hämoglobinformen in eine stabile Form (Cyanmethämoglobin oder Hämiglobincyanid) eingeführt, mit der der Hämoglobingehalt automatisch gemessen werden konnte. Die Cyanmethämoglobin-Methode ist nach wie vor die Referenzmethode für die Hämoglobinmessung und wird noch immer in vielen automatischen Hämatologie-Analysegeräten verwendet. ⓘ
Maxwell Wintrobe wird die Erfindung des Hämatokrit-Tests zugeschrieben. Im Jahr 1929 führte er an der Universität Tulane ein Promotionsprojekt durch, um die Normalbereiche für die Parameter der roten Blutkörperchen zu bestimmen, und erfand eine Methode, die als Wintrobe-Hämatokrit bekannt wurde. Die Messung des Hämatokrits war bereits in der Literatur beschrieben worden, aber Wintrobes Methode unterschied sich dadurch, dass er ein großes Röhrchen verwendete, das nach genauen Spezifikationen in Massenproduktion hergestellt werden konnte und über eine eingebaute Skala verfügte. Der Anteil der roten Blutkörperchen im Röhrchen wurde nach der Zentrifugation gemessen, um den Hämatokrit zu bestimmen. Die Erfindung einer reproduzierbaren Methode zur Bestimmung des Hämatokritwertes ermöglichte es Wintrobe, die Erythrozytenindizes zu definieren. ⓘ

Die Forschung im Bereich der automatischen Zellzählung begann Anfang des 20. Eine 1928 entwickelte Methode nutzte die Lichtmenge, die durch eine verdünnte Blutprobe durchgelassen wurde, um die Anzahl der Erythrozyten zu bestimmen, was sich jedoch bei Proben mit abnormalen Erythrozyten als ungenau erwies. Andere erfolglose Versuche in den 1930er und 1940er Jahren beinhalteten fotoelektrische Detektoren, die an Mikroskopen angebracht waren und die Zellen zählten, während sie gescannt wurden. In den späten 1940er Jahren versuchte Wallace H. Coulter, der nach den Bombenangriffen auf Hiroshima und Nagasaki bessere Methoden zur Zählung der roten Blutkörperchen benötigte, die fotoelektrische Zellzählung zu verbessern. Bei seinen Forschungen wurde er von seinem Bruder Joseph R. Coulter unterstützt, der in einem Kellerlabor in Chicago arbeitete. Die Ergebnisse der fotoelektrischen Methoden waren enttäuschend, und 1948, nachdem er eine Abhandlung gelesen hatte, in der die Leitfähigkeit von Blut mit der Konzentration roter Blutkörperchen in Verbindung gebracht wurde, entwickelte Wallace das Coulter-Prinzip - die Theorie, dass eine Zelle, die in einem leitfähigen Medium schwebt, einen Stromabfall proportional zu ihrer Größe erzeugt, wenn sie durch eine Öffnung tritt. ⓘ
Im Oktober dieses Jahres baute Wallace einen Zähler, um dieses Prinzip zu demonstrieren. Aus finanziellen Gründen wurde die Öffnung durch das Durchbrennen eines Zellophanstücks aus einer Zigarettenpackung hergestellt. Wallace meldete 1949 ein Patent für diese Technik an und beantragte 1951 beim Office of Naval Research die Finanzierung der Entwicklung des Coulter-Zählers. Wallace' Patentanmeldung wurde 1953 bewilligt, und nach Verbesserungen an der Öffnung und der Einführung eines Quecksilbermanometers zur präzisen Kontrolle der Probengröße gründeten die Brüder 1958 die Coulter Electronics Inc. zur Vermarktung ihrer Instrumente. Der Coulter-Zähler wurde ursprünglich für die Zählung roter Blutkörperchen entwickelt, erwies sich aber mit späteren Modifikationen auch für die Zählung weißer Blutkörperchen als effektiv. Coulter-Zähler wurden von medizinischen Labors in großem Umfang übernommen. ⓘ
Das erste Analysegerät, das in der Lage war, mehrere Zellen gleichzeitig zu zählen, war das Technicon SMA 4A-7A, das 1965 auf den Markt kam. Es erreichte dies, indem es die Blutproben in zwei Kanäle aufteilte: einen für die Zählung der roten und weißen Blutkörperchen und einen für die Hämoglobinmessung. Das Gerät war jedoch unzuverlässig und schwer zu warten. Im Jahr 1968 wurde das Coulter-Analysegerät Modell S auf den Markt gebracht und fand breite Anwendung. Ähnlich wie das Technicon-Gerät verfügte es über zwei verschiedene Reaktionskammern, von denen eine für die Erythrozytenzahl und eine für die Zahl der weißen Blutkörperchen und die Hämoglobinbestimmung verwendet wurde. Das Modell S bestimmte auch das mittlere Zellvolumen durch Impedanzmessungen, woraus sich die Erythrozytenindizes und der Hämatokrit ableiten ließen. Die automatisierte Thrombozytenzählung wurde 1970 mit dem Gerät Hemalog-8 von Technicon eingeführt und 1980 von den Analysegeräten der Serie S Plus von Coulter übernommen. ⓘ
Nachdem die Basiszellzählung automatisiert worden war, blieb die Differenzierung der weißen Blutkörperchen eine Herausforderung. In den 1970er Jahren erforschten Forscher zwei Methoden zur Automatisierung der Differenzialzählung: digitale Bildverarbeitung und Durchflusszytometrie. Unter Verwendung von Technologien, die in den 1950er und 60er Jahren zur Automatisierung des Ablesens von PAP-Abstrichen entwickelt worden waren, wurden mehrere Modelle von Bildverarbeitungsanalysatoren hergestellt. Diese Geräte scannten einen gefärbten Blutausstrich, um Zellkerne zu finden, und machten dann einen Schnappschuss der Zelle mit höherer Auflösung, um sie mittels Densitometrie zu analysieren. Sie waren teuer, langsam und trugen kaum zur Verringerung der Arbeitsbelastung im Labor bei, da sie immer noch die Vorbereitung und Anfärbung von Blutausstrichen erforderten. Daher wurden Systeme auf der Grundlage der Durchflusszytometrie immer beliebter, und bis 1990 waren in den Vereinigten Staaten oder Westeuropa keine digitalen Bildanalysegeräte im Handel erhältlich. Diese Techniken erlebten in den 2000er Jahren mit der Einführung fortschrittlicherer Bildanalyseplattformen, die künstliche neuronale Netze verwenden, einen erneuten Aufschwung. ⓘ
Frühe Geräte der Durchflusszytometrie beschossen die Zellen mit Lichtstrahlen in bestimmten Wellenlängen und maßen die daraus resultierende Absorption, Fluoreszenz oder Lichtstreuung, wobei sie Informationen über die Eigenschaften der Zellen sammelten und die Quantifizierung zellulärer Inhalte wie der DNA ermöglichten. Ein solches Gerät - das Rapid Cell Spectrophotometer, das 1965 von Louis Kamentsky zur Automatisierung der Gebärmutterhalszytologie entwickelt wurde - konnte mit Hilfe zytochemischer Färbetechniken Streudiagramme von Blutzellen erstellen. Leonard Ornstein, der an der Entwicklung des Färbesystems für das Rapid Cell Spectrophotometer mitgewirkt hatte, und seine Kollegen entwickelten später den ersten kommerziellen durchflusszytometrischen Differenzialanalysator für weiße Blutkörperchen, den Hemalog D. Dieser 1974 eingeführte Analysator nutzte Lichtstreuung, Absorption und Zellfärbung, um die fünf normalen weißen Blutkörperchen zu identifizieren, zusätzlich zu den "großen nicht identifizierten Zellen", einer Klassifizierung, die in der Regel aus atypischen Lymphozyten oder Blastzellen bestand. Das Hemalog D konnte 10.000 Zellen in einem Durchgang zählen, was eine deutliche Verbesserung gegenüber der manuellen Differenzierung darstellte. 1981 kombinierte Technicon das Hemalog D mit dem Hemalog-8-Analysegerät zum Technicon H6000, dem ersten kombinierten Blutbild- und Differenzialanalysegerät. Dieses Analysegerät war bei den Hämatologielabors unbeliebt, weil es arbeitsintensiv zu bedienen war, aber in den späten 1980er bis frühen 1990er Jahren wurden ähnliche Systeme von anderen Herstellern wie Sysmex, Abbott, Roche und Beckman Coulter in großem Umfang produziert. ⓘ
Grundlagen
Die zellulären Blutbestandteile sind rote Blutzellen (Erythrozyten), weiße Blutzellen (Leukozyten) und Thrombozyten (Blutplättchen ältere Bezeichnung nach Schilling). Normalerweise besteht das menschliche Blut etwa zu 43 bis 50 % (Männer) bzw. zu 37 bis 45 % (Frauen) aus Blutzellen. Der Anteil der zellulären Bestandteile am Gesamtvolumen der Probe wird als Hämatokrit bezeichnet. Die nach Abtrennung zellulärer Bestandteile (z. B. durch Zentrifugation) übrigbleibende Blutflüssigkeit ist das Blutplasma, das Elektrolyte, Gerinnungsfaktoren und andere Plasmaproteine enthält. Lässt man Blut eine Weile stehen, dann setzt eine Gerinnungsreaktion ein, die Gerinnungsfaktoren werden aktiviert und bilden zusammen mit den zellulären Bestandteilen (insbesondere den Thrombozyten) ein Gerinnsel (Thrombus). Der Überstand besteht aus Plasma ohne Gerinnungsfaktoren und heißt dann Blutserum. ⓘ
„Großes“ Blutbild
Das große Blutbild umfasst zusätzlich zum kleinen Blutbild, das lediglich die Gesamtleukozytenzahl enthält, das Differentialblutbild. Das ist eine genaue Aufschlüsselung, aus welchen Untergruppen sich die Leukozyten (weiße Blutzellen) zusammensetzen. Dieses Differentialblutbild kann maschinell oder manuell, d. h. mikroskopisch erstellt werden. Durch mikroskopische Auszählung eines Blutausstrichs oder mit Hilfe automatisierter Zählgeräte wie dem Coulter-Zähler werden die prozentualen Anteile der einzelnen Blutzelltypen bestimmt. Die mikroskopische Auszählung ist aufwändiger und quantitativ weniger präzise, aber häufig zur abschließenden qualitativen Bewertung unerlässlich. So können pathogene Zellformen wie etwa atypische Lymphozyten (Virozyten) maschinell oft nicht richtig zugeordnet werden und diagnostisch relevante Informationen gehen so verloren. Die Form der roten Blutkörperchen (Erythrozyten) wird mit einem Blutausstrich beurteilt. ⓘ
Störungen des Blutbildes
Die verschiedensten gesundheitlichen Umstände können zu einem auffälligen Blutbild führen. ⓘ
Quantitative Veränderungen
Abweichungen der Retikulozytenanzahl
Auch wenn der Anteil der Retikulozyten in der Routine normalerweise nicht mitbestimmt wird, ist er ein wichtiges Maß für die Erythrozytenneubildung im Knochenmark. Der hier gemessene Wert lässt unterscheiden, ob es sich um eine Umsatzstörung, bei der der Retikulozytenanteil erhöht ist, oder um eine Bildungsstörung, bei der der Retikulozytenanteil normal bzw. erniedrigt ist, handelt. ⓘ
Störungen der Erythrozyten
Erscheinungsbild im Blutausstrich und dessen Bedeutung bzw. Vorkommen:
- Makrozyt: Durchmesser > 10 μm, erhöhtes Volumen, aber normale Form; bei Alkoholismus
- Megalozyt: vergrößerter, hyperchromer (stärker gefärbter), ovaler Erythrozyt; bei Vitamin-B12-Mangel, Folsäuremangel, Eisenmangel, Thalassämie
- Mikrozyt: Durchmesser < 7 μm, erniedrigtes Volumen, aber normale Form; bei Eisenmangel, Thalassämie
- Poikilozyt: abnorm geformter Erythrozyt (mantel-, keulen-, birnenförmig); bei schweren Anämien
- Retikulozyt: junger kernloser Erythrozyt mit retikulären Kernresten; bis 1,5 % normal, erhöht bei gesteigerter Erythrozytenneubildung (z. B. Hämolyse)
- Schistozyt (auch Fragmentozyt): zerrissener Erythrozyt; bei HUS (hämolytisch-urämischen Syndrom, mechanischer Hämolyse (z. B. künstliche Herzklappe))
- Sichelzelle: kurzlebiger Erythrozyt (< 42 Tage), der unter Sauerstoffentzug Sichelform annimmt; Sichelzellenanämie
- Sphärozyt: Kugelzelle; bei Kugelzellanämie
- Echinozyt (Stechapfelzelle): deformierte, runde Erythrozyten mit dornartigen Zellausläufern
- Targetzelle (Schießscheibenzelle): Erythrozyt mit abnormer Farbverteilung (Hämoglobin im Zentrum und ringförmig am Rand); bei Thalassämie, hämolytischer Anämie, schwerer Eisenmangelanämie
- Anisozytose: ungleiche Größenverteilung von normalerweise gleich großen Zellen; bei Anämien
- Anulozyt: ringförmige Erythrozyten mit niedrigem Hämoglobingehalt und der dadurch entstehenden Abblassung; bei Eisenmangelanämie
- Basophile Tüpfelung: punktartig verteilte basophile Substanz (dunkle Tüpflung) in den Erythrozyten und eine gesteigerte Erythropoese; bei Bleivergiftung und Thalassämie
- Dakrozyt: Tränentropfenform; bei Osteomyelosklerose
- Elliptozyt: ovaler Erythrozyt; bei seltener angeborener Elliptozytose
- Heinz-Innenkörperchen: degeneriertes, intrazelluläres Hämoglobin, welches nur nach Sonderfärbung sichtbar wird; bei toxischer, hämolytischer Anämie, Methämoglobinämie, G6P-DH-Mangel
- Howell-Jolly-Körperchen: Kernreste im Erythrozyten; nach Milzentfernung.
- Cabot-Ring: Reste des Spindelapparats
- Anämie (Blutarmut) – Verminderung der Hämoglobinkonzentration im Blut durch zu wenig Erythrozyten und/oder Verringerung der MCHC
- Polyglobulie (Blutfülle) – zu viele Erythrozyten
- Polycythaemia vera (übernormale Zellvermehrung im Blut) – zu viele Erythrozyten
- Pyknozyt: geschrumpfter Erythrozyt, vor allem infolge oxydativen Stresses ⓘ
Störungen der Leukozyten
- Leukopenie: Mangel an Leukozyten
- Leukozytose: zu viele Leukozyten
- Linksverschiebung: vermehrtes Auftreten unreifer Granulozyten
- Rechtsverschiebung: vermehrtes Auftreten übersegmentierter (alter) Granulozyten ⓘ
Qualitative Veränderungen
Störungen der Erythrozyten
- Anisozytose: verschieden große rote Blutkörperchen
- Lagerung: abnorme Lagerung, wie „Geldrollenbildung“
- Mikrozytose: zu kleine Erythrozyten
- Makrozytose: zu große Erythrozyten
- Poikilozytose: unterschiedlich geformte rote Blutkörperchen
- Polychromasie: Anfärbbarkeit krankhaft veränderter oder nicht ausgereifter Erythrozyten mit sauren und basischen Farbstoffen (übliche Färbung nach Pappenheim = May-Grünwald- + Giemsa-Färbung)
- Thalassämie und andere die Erythrozyten betreffende genetische Defekte: führen zu deformierten/kleineren/größeren Erythrozyten.
- Zelleinschlüsse: Einschlüsse, wie Cabot-Ringe oder basophile Tüpfelung ⓘ
Störungen der Thrombozyten
- Thrombanisozytose – verschieden große Thrombozyten (= erhöhte Verteilungsbreite des Thrombozytenvolumens) ⓘ

