Toxoplasmose
| Toxoplasmose ⓘ | |
|---|---|
 | |
| T. gondii Tachyzoiten | |
| Spezialgebiet | Ansteckende Krankheit |
| Symptome | Oft keine, während der Schwangerschaft (Geburtsfehler) |
| Verursacht | Toxoplasma gondii |
| Risikofaktoren | Verzehr schlecht gekochter Lebensmittel, Kontakt mit infiziertem Katzenkot |
| Diagnostische Methode | Bluttest, Fruchtwasseruntersuchung |
| Behandlung | Während der Schwangerschaft Spiramycin oder Pyrimethamin/Sulfadiazin und Folinsäure |
| Häufigkeit | Bis zu 50 % der Menschen, 200.000 Fälle von angeborener Toxoplasmose pro Jahr |
Toxoplasmose ist eine parasitäre Erkrankung, die durch Toxoplasma gondii, einen Apicomplexus, verursacht wird. Infektionen mit Toxoplasmose werden mit einer Vielzahl von neuropsychiatrischen und Verhaltensstörungen in Verbindung gebracht. Gelegentlich kommt es für einige Wochen oder Monate zu leichten, grippeähnlichen Erkrankungen wie Muskelschmerzen und schmerzenden Lymphknoten. Bei einer kleinen Anzahl von Menschen können Augenprobleme auftreten. Bei Menschen mit einem schwachen Immunsystem können schwere Symptome wie Krampfanfälle und Koordinationsstörungen auftreten. Wenn sich eine Frau während der Schwangerschaft infiziert, kann das Kind von einer so genannten kongenitalen Toxoplasmose betroffen sein. ⓘ
Toxoplasmose wird in der Regel durch den Verzehr von schlecht gekochten Lebensmitteln, die Zysten enthalten, durch den Kontakt mit infiziertem Katzenkot und durch die Übertragung von einer infizierten Frau auf ihr Kind während der Schwangerschaft übertragen. In seltenen Fällen kann die Krankheit auch durch Bluttransfusionen übertragen werden. Ansonsten wird sie nicht von Mensch zu Mensch übertragen. Es ist bekannt, dass sich der Parasit nur in der Katzenfamilie sexuell fortpflanzt. Er kann jedoch die meisten warmblütigen Tiere infizieren, auch den Menschen. Die Diagnose erfolgt in der Regel durch den Nachweis von Antikörpern im Blut oder durch die Untersuchung des Fruchtwassers schwangerer Frauen auf die DNA des Parasiten. ⓘ
Zur Vorbeugung müssen Lebensmittel richtig zubereitet und gekocht werden. Schwangeren Frauen wird außerdem empfohlen, keine Katzenklos zu reinigen oder, falls sie es doch tun müssen, Handschuhe zu tragen und sich anschließend die Hände zu waschen. Eine Behandlung von ansonsten gesunden Menschen ist in der Regel nicht erforderlich. Während der Schwangerschaft kann die Behandlung mit Spiramycin oder Pyrimethamin/Sulfadiazin und Folinsäure erfolgen. ⓘ
Bis zur Hälfte der Weltbevölkerung ist mit Toxoplasmose infiziert, hat aber keine Symptome. In den Vereinigten Staaten sind etwa 11 % der Menschen infiziert, in einigen Gebieten der Welt sind es mehr als 60 %. Jährlich treten etwa 200.000 Fälle von kongenitaler Toxoplasmose auf. Charles Nicolle und Louis Manceaux beschrieben den Organismus erstmals 1908. Im Jahr 1941 wurde die Übertragung während der Schwangerschaft von einer Mutter auf ihr Kind bestätigt. Es gibt erste Hinweise darauf, dass die Infektion das Verhalten von Menschen beeinflussen kann. ⓘ
| Klassifikation nach ICD-10 | |
|---|---|
| B58 | Toxoplasmose |
| B58.0+ | Augenerkrankung durch Toxoplasmen |
| B58.1+ | Hepatitis durch Toxoplasmen |
| B58.2+ | Meningoenzephalitis durch Toxoplasmen |
| B58.3+ | Toxoplasmose der Lunge |
| B58.8 | Toxoplasmosen mit Beteiligung sonstiger Organe |
| B58.9 | Toxoplasmose, nicht näher bezeichnet |
| K77.0* | Leberkrankheiten bei anderenorts klassifizierten infektiösen und parasitären Krankheiten Hepatitis durch Toxoplasma gondii |
| H32.0* | Chorioretinitis bei anderenorts klassifizierten infektiösen und parasitären Krankheiten |
| G05.2* | Enzephalitis, Myelitis und Enzephalomyelitis bei sonstigen anderenorts klassifizierten infektiösen und parasitären Krankheiten |
| J17.3 | Pneumonie bei parasitären Krankheiten |
| ICD-10 online (WHO-Version 2019) | |
Die Toxoplasmose ist eine häufig auftretende Infektionskrankheit, die primär Katzen befällt. Der Erreger ist der protozooische Parasit und einzige Vertreter seiner Gattung Toxoplasma gondii, für den alle Arten von Katzen als Hauptwirte dienen. Nur selten ruft die Erkrankung bei Katzen klinische Erscheinungen wie Durchfall hervor. Lediglich bei der Erstinfektion scheiden Katzen große Mengen von Eiern (Oozysten) des Erregers aus, anschließend entwickeln sie eine zumeist lebenslange Immunität. ⓘ
Als fakultativer Zwischenwirt für den Erreger dienen alle anderen Säugetiere, der Mensch wird dabei als Fehlwirt betrachtet. Auch beim Menschen können Krankheitserscheinungen auftreten, die Toxoplasmose ist also eine Zoonose. Zwischenwirte können sich entweder durch Aufnahme der versporten Oozysten von Katzen (z. B. bei der Gartenarbeit durch kontaminiertes Erdreich) oder über Entwicklungsstadien des Erregers in anderen Zwischenwirten (der Mensch vor allem über rohes Schweine- und Schaffleisch) anstecken. Auch die Infektion der Zwischenwirte ist zumeist ohne klinische Erscheinungen. Problematisch ist vor allem die Erstinfektion von Schwangeren, da der Erreger auf das Ungeborene übergehen und schwere Fruchtschäden verursachen kann, sowie die Infektion von Individuen mit einem gestörten Immunsystem. ⓘ
Erstmals als Krankheit erkannt wurde die Toxoplasmose 1939. Die Übertragbarkeit des 1908 von Charles Nicolle und Louis Manceaux beim Nagetier Gundi entdeckten Krankheitserregers von Katzen auf Menschen wurde Mitte der 1960er Jahre von William M. Hutchison aufgeklärt, der dafür 1970 mit Jørgen C. Siim den Robert-Koch-Preis erhielt. ⓘ
Die Toxoplasmose bei Haustieren unterliegt in Deutschland der Meldepflicht nach dem Tiergesundheitsgesetz. ⓘ
Anzeichen und Symptome
Die Infektion verläuft in drei Phasen: ⓘ
Akut
Die akute Toxoplasmose verläuft bei gesunden Erwachsenen häufig ohne Symptome. Es können jedoch Symptome auftreten, die häufig grippeähnlich sind: geschwollene Lymphknoten, Kopfschmerzen, Fieber und Müdigkeit oder Muskelschmerzen, die einen Monat oder länger anhalten. Es ist selten, dass ein Mensch mit einem voll funktionierenden Immunsystem nach einer Infektion schwere Symptome entwickelt. Bei Menschen mit geschwächtem Immunsystem kann es zu Kopfschmerzen, Verwirrung, Koordinationsstörungen, Krampfanfällen, Lungenproblemen, die einer Tuberkulose oder Pneumocystis jiroveci-Pneumonie ähneln (eine häufige opportunistische Infektion, die bei AIDS-Patienten auftritt), oder zu einer Chorioretinitis kommen, die durch eine schwere Entzündung der Netzhaut verursacht wird (okuläre Toxoplasmose). Bei Kleinkindern und immungeschwächten Menschen wie HIV/AIDS-Patienten, Menschen, die bestimmte Arten von Chemotherapie erhalten, oder Menschen, die vor kurzem eine Organtransplantation erhalten haben, kann es zu einer schweren Toxoplasmose kommen. Dies kann zu Schäden am Gehirn (Enzephalitis) oder an den Augen (nekrotisierende Retinochoroiditis) führen. Säuglinge, die über die Plazenta infiziert wurden, können mit einem dieser beiden Probleme oder mit Nasenfehlbildungen geboren werden, obwohl diese Komplikationen bei Neugeborenen selten sind. Die Toxoplasma-Trophozoiten, die die akute Toxoplasmose verursachen, werden als Tachyzoiten bezeichnet und sind typischerweise in verschiedenen Geweben und Körperflüssigkeiten zu finden, selten jedoch in Blut oder Liquor. ⓘ
Geschwollene Lymphknoten finden sich häufig im Nacken oder unter dem Kinn, gefolgt von den Achselhöhlen und der Leiste. Die Schwellungen können zu verschiedenen Zeitpunkten nach der Erstinfektion auftreten, anhalten und unabhängig von einer antiparasitären Behandlung immer wiederkehren. Bei Erwachsenen treten sie in der Regel an einzelnen Stellen auf, bei Kindern dagegen häufiger an mehreren Stellen. Vergrößerte Lymphknoten bilden sich in 60 % der Fälle innerhalb von 1-2 Monaten zurück. Bei einem Viertel der Betroffenen dauert es jedoch 2 bis 4 Monate, bis sie sich wieder normalisieren, und bei 8 % dauert es 4 bis 6 Monate. Eine beträchtliche Anzahl (6 %) kehrt erst viel später in den Normalzustand zurück. ⓘ
Latent
Da es keine offensichtlichen Symptome gibt, infizieren sich Wirte leicht mit T. gondii und entwickeln Toxoplasmose, ohne es zu wissen. Obwohl in den ersten Wochen nach der Exposition gelegentlich leichte, grippeähnliche Symptome auftreten, verursacht eine Infektion mit T. gondii bei gesunden erwachsenen Menschen keine leicht erkennbaren Symptome. Bei den meisten immunkompetenten Menschen tritt die Infektion in eine latente Phase ein, in der nur Bradyzoiten (in Gewebezysten) vorhanden sind; diese Gewebezysten und sogar Läsionen können in der Netzhaut, der alveolären Auskleidung der Lunge (wo eine akute Infektion eine Pneumocystis jirovecii-Infektion imitieren kann), dem Herzen, der Skelettmuskulatur und dem zentralen Nervensystem (ZNS), einschließlich des Gehirns, auftreten. Bei einer Infektion mit T. gondii bilden sich im ZNS (Hirngewebe) Zysten, die ein Leben lang bestehen bleiben. Die meisten Säuglinge, die im Mutterleib infiziert werden, haben bei der Geburt keine Symptome, können aber später im Leben Symptome entwickeln. ⓘ
Aus serologischen Studien geht hervor, dass 30-50 % der Weltbevölkerung einer latenten Toxoplasmose ausgesetzt waren und möglicherweise chronisch damit infiziert sind, wobei die Infektionsraten von Land zu Land sehr unterschiedlich sind. Dieser latente Infektionszustand wurde in letzter Zeit mit zahlreichen Krankheiten, neuronalen Veränderungen und subtilen geschlechtsabhängigen Verhaltensänderungen bei immunkompetenten Menschen sowie einem erhöhten Risiko von Zusammenstößen mit Kraftfahrzeugen in Verbindung gebracht. ⓘ
Haut
Obwohl selten, können bei der erworbenen Form der Krankheit Hautläsionen auftreten, darunter Roseola- und Erythema-multiforme-ähnliche Eruptionen, prurigo-ähnliche Knötchen, Urtikaria und makulopapulöse Läsionen. Bei Neugeborenen können punktförmige Flecken, Ekchymosen oder "Blaubeermuffin"-Läsionen auftreten. Die Diagnose der kutanen Toxoplasmose basiert auf dem Nachweis der Tachyzoitenform von T. gondii in der Epidermis. Er kommt in allen Schichten der Epidermis vor, ist etwa 6 x 2 μm groß und bogenförmig, wobei der Zellkern ein Drittel seiner Größe ausmacht. Er kann durch Elektronenmikroskopie oder durch Giemsa-Färbung des Gewebes identifiziert werden, wobei sich das Zytoplasma blau und der Zellkern rot zeigt. ⓘ
Ursache
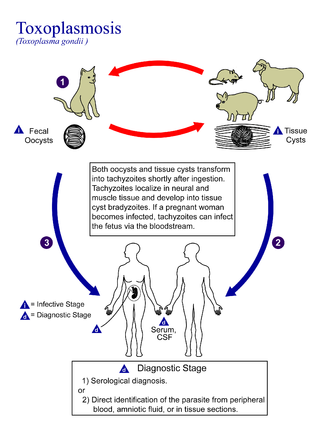
Parasitologie
In seinem Lebenszyklus nimmt T. gondii mehrere Formen an. Tachyzoiten sind für die akute Infektion verantwortlich; sie teilen sich schnell und verbreiten sich in den Geweben des Körpers. Tachyzoiten werden auch als "tachyzoische Merozoiten" bezeichnet, ein beschreibender Begriff, der die parasitologische Natur dieses Stadiums genauer wiedergibt. Nach der Vermehrung wandeln sich die Tachyzoiten in Bradyzoiten um, die sich in latenten intrazellulären Gewebezysten befinden, die sich vor allem in den Muskeln und im Gehirn bilden. Die Bildung von Zysten wird zum Teil durch den Druck des Immunsystems des Wirts ausgelöst. Die Bradyzoiten (auch "bradyzoische Merozoiten" genannt) sind unempfindlich gegenüber Antibiotika. Einmal gebildete Bradyzoiten können während der gesamten Lebensdauer des Wirts im Gewebe verbleiben. Wenn sich bei einem gesunden Wirt einige Bradyzoiten wieder in aktive Tachyzoiten umwandeln, werden sie vom Immunsystem schnell vernichtet. Bei Personen mit geschwächtem Immunsystem oder bei Föten, die kein entwickeltes Immunsystem haben, können die Tachyzoiten jedoch überhand nehmen und erhebliche neurologische Schäden verursachen. ⓘ
Das Überleben des Parasiten hängt von einem Gleichgewicht zwischen dem Überleben des Wirts und der Vermehrung des Parasiten ab. T. gondii erreicht dieses Gleichgewicht, indem er die Immunreaktion des Wirts manipuliert, die Immunreaktion des Wirts reduziert und den Fortpflanzungsvorteil des Parasiten erhöht. Sobald er eine normale Wirtszelle infiziert hat, widersteht er den vom Immunsystem des Wirts verursachten Schäden und verändert die Immunprozesse des Wirts. ⓘ
Wenn der Parasit in die Wirtszelle eindringt, bildet er aus der Membran der Wirtszelle eine parasitophoren Vakuole (PV). Die PV kapselt den Parasiten ein und ist sowohl resistent gegen die Aktivität des endolysosomalen Systems als auch in der Lage, die Kontrolle über die Mitochondrien und das endoplasmatische Retikulum des Wirts zu übernehmen. ⓘ
Beim ersten Eindringen in die Zelle setzt der Parasit ROP-Proteine aus dem Bulbus der Rhoptry-Organelle frei. Diese Proteine wandern in den Zellkern und an die Oberfläche der PV-Membran, wo sie STAT-Signalwege aktivieren können, um die Expression von Zytokinen auf der Transkriptionsebene zu modulieren, und neben anderen möglichen Effekten die PV-Membran zerstörende IRG-Proteine binden und inaktivieren. Darüber hinaus können bestimmte Stämme von T. gondii ein als GRA15 bekanntes Protein sezernieren, das den NF-κB-Signalweg aktiviert, der das proinflammatorische Zytokin IL-12 in der frühen Immunantwort hochreguliert, was möglicherweise zur latenten Phase des Parasiten führt. Die Fähigkeit des Parasiten, diese Proteine abzusondern, hängt von seinem Genotyp ab und beeinflusst seine Virulenz. ⓘ
Der Parasit beeinflusst auch einen anti-apoptotischen Mechanismus, der es den infizierten Wirtszellen ermöglicht, zu überleben und sich zu vermehren. Eine Methode der Apoptose-Resistenz besteht in der Unterbrechung von Pro-Apoptose-Effektorproteinen, wie BAX und BAK. Um diese Proteine zu stören, verursacht T. gondii Konformationsänderungen an den Proteinen, die verhindern, dass die Proteine zu verschiedenen zellulären Kompartimenten transportiert werden, wo sie die Apoptose auslösen. T. gondii bewirkt jedoch keine Herunterregulierung der Pro-Apoptose-Effektorproteine. ⓘ
T. gondii hat auch die Fähigkeit, die Autophagie der Wirtszellen zu initiieren. Dies führt zu einer Abnahme gesunder, nicht infizierter Zellen und folglich zu weniger Wirtszellen, die die infizierten Zellen angreifen können. Forschungen von Wang et al. zeigen, dass infizierte Zellen zu einer höheren Anzahl von Autophagosomen in normalen und infizierten Zellen führen. Ihre Untersuchungen zeigen, dass T. gondii die Autophagie der Wirtszellen über einen kalziumabhängigen Weg auslöst. Eine andere Studie legt nahe, dass der Parasit die Freisetzung von Kalzium aus den Kalziumspeichern, die für die Signalprozesse der Zellen wichtig sind, direkt beeinflussen kann. ⓘ
Die oben genannten Mechanismen ermöglichen es T. gondii, in einem Wirt zu überleben. Einige einschränkende Faktoren für die Toxoplasmen sind, dass ihr Einfluss auf die Wirtszellen bei einem schwachen Immunsystem stärker und mengenabhängig ist, so dass eine große Anzahl von T. gondii pro Wirtszelle eine stärkere Wirkung hat. Die Wirkung auf den Wirt hängt auch von der Stärke des Immunsystems des Wirts ab. Immunkompetente Personen zeigen normalerweise keine oder keine schweren Symptome, während bei immungeschwächten Personen Todesfälle oder schwere Komplikationen auftreten können. ⓘ
Da der Parasit die Immunreaktion des Wirts verändern kann, kann er sich auch positiv oder negativ auf die Immunreaktion auf andere pathogene Bedrohungen auswirken. Dies gilt unter anderem für die Reaktion auf Infektionen durch Helicobacter felis, Leishmania major oder andere Parasiten wie Nippostrongylus brasiliensis. ⓘ
Übertragung
Die Toxoplasmose wird im Allgemeinen durch den Mund übertragen, wenn Oozysten oder Gewebezysten von Toxoplasma gondii versehentlich verzehrt werden. Eine angeborene Übertragung von der Mutter auf den Fötus kann ebenfalls vorkommen. Eine Übertragung kann auch bei der Transplantation fester Organe oder bei hämatogenen Stammzelltransplantationen erfolgen. ⓘ
Eine orale Übertragung kann erfolgen durch:
- Verzehr von rohem oder teilweise gekochtem Fleisch, insbesondere von Schweine-, Lamm- oder Wildfleisch, das Toxoplasma-Zysten enthält: Die Infektionsprävalenz in Ländern, in denen traditionell rohes Fleisch verzehrt wird, wurde mit dieser Übertragungsmethode in Verbindung gebracht. Gewebezysten können auch durch Hand-zu-Mund-Kontakt nach dem Umgang mit rohem Fleisch oder durch die Verwendung von Messern, Utensilien oder Schneidebrettern, die mit rohem Fleisch kontaminiert sind, aufgenommen werden.
- Verschlucken von ungewaschenem Obst oder Gemüse, das mit kontaminierter Erde, die infizierten Katzenkot enthält, in Berührung gekommen ist.
- Verschlucken von Katzenkot, der Oozysten enthält: Dies kann durch Hand-zu-Mund-Kontakt bei der Gartenarbeit, beim Reinigen der Katzentoilette oder beim Kontakt mit Sandkästen von Kindern geschehen; der Parasit kann monatelang in der Umwelt überleben.
- Aufnahme von unbehandeltem, ungefiltertem Wasser durch direkten Verzehr oder Verwendung von Wasser für die Lebensmittelzubereitung.
- Verzehr von nicht pasteurisierter Milch und Milchprodukten, insbesondere Ziegenmilch.
- Verschlucken von rohen Meeresfrüchten.
Katzen scheiden den Erreger einige Wochen nach der Ansteckung mit der Krankheit mit dem Kot aus, in der Regel durch den Verzehr eines infizierten Zwischenwirts, zu dem Säugetiere (wie Nagetiere) oder Vögel gehören können. Die Ausscheidung von Oozysten beginnt in der Regel am dritten Tag nach dem Verzehr von infizierten Zwischenwirten und kann wochenlang anhalten. Die Oozysten sind nicht infektiös, wenn sie ausgeschieden werden. Nach etwa einem Tag durchlaufen die Oozysten einen Prozess, der Sporulation genannt wird, und werden potenziell pathogen. Neben Katzen sind auch Vögel und Säugetiere, einschließlich des Menschen, Zwischenwirte des Parasiten und am Übertragungsprozess beteiligt. Die Pathogenität variiert jedoch mit dem Alter und der Spezies, die an der Infektion beteiligt sind, sowie mit der Art der Übertragung von T. gondii. ⓘ
Die Toxoplasmose kann auch durch Transplantationen fester Organe übertragen werden. Toxoplasma-seronegative Empfänger, die Organe von kürzlich infizierten Toxoplasma-seropositiven Spendern erhalten, sind gefährdet. Bei Organempfängern, die an einer latenten Toxoplasmose erkrankt sind, besteht die Gefahr, dass die Krankheit aufgrund der Immunsuppression bei der Transplantation fester Organe reaktiviert wird. Bei Empfängern einer hämatogenen Stammzelltransplantation kann das Infektionsrisiko aufgrund der längeren Immunsuppression höher sein. ⓘ
Bei Herz- und Lungentransplantationen ist das Risiko einer Toxoplasmose-Infektion am höchsten, da das Herz aus quergestreiften Muskeln besteht, die Zysten enthalten können; das Risiko für andere Organe und Gewebe ist sehr unterschiedlich. Das Risiko einer Übertragung kann durch ein Screening von Spendern und Empfängern vor dem Transplantationsverfahren und durch eine entsprechende Behandlung verringert werden. ⓘ
Beim Endwirt-Zwischenwirt-Zyklus sind ein oder mehrere Zwischenwirte beteiligt. Katzen stecken sich dabei zumeist durch das Fressen von Fleisch des Zwischenwirts an, welches Tachy- oder Bradyzoiten enthält. Werden Tachyzoiten – die intrazellulären Entwicklungsstadien vor der Zystenbildung – aufgenommen, verläuft die Entwicklung in der Katze wie beim Endwirt-Endwirt-Zyklus mit einer Präpatenz von 4 bis 8 Tagen. Nimmt die Katze Bradyzoiten auf, so entfällt die Entwicklungsphase außerhalb des Darms und im Darmepithel finden sofort die Schizo- und Gametogonie mit Bildung der Oozysten statt. Die Präpatenzzeit beträgt dann nur 3 bis 6 Tage. ⓘ
Die Infektion des Zwischenwirts erfolgt bei diesem Zyklus über die Aufnahme von mit sporulierten Oozysten von Katzen verschmutzter Nahrung oder Wasser. Dabei werden im Darm die Sporozoiten freigesetzt. Diese durchbohren die Darmwand und siedeln sich in verschiedenen Organen an, vor allem dem Zentralnervensystem, den Augen und weiblichen Geschlechtsorganen. Hier entstehen durch ungeschlechtliche Vermehrung (Endodyogenie) Tachyzoiten und nach etwa 10 Tagen Zysten, vor allem in der Muskulatur, dem Herz und im Gehirn. In den Zysten, die bis zu 300 µm groß werden, finden sich dann Tausende von Bradyzoiten. ⓘ
Vorsichtsmaßnahmen während der Schwangerschaft
Bei der kongenitalen Toxoplasmose handelt es sich um eine besondere Form der Toxoplasmose, bei der ein ungeborener Fötus über die Plazenta infiziert wird. Kongenitale Toxoplasmose geht mit fötalem Tod und Fehlgeburten einher, und bei Säuglingen führt sie zu Hydrozephalus, zerebralen Verkalkungen und Chorioretinitis, was zu Enzephalopathie und möglicherweise Blindheit führt. Ein positiver Antikörpertiter weist auf eine frühere Exposition und Immunität hin und gewährleistet weitgehend die Sicherheit des ungeborenen Fötus. Durch eine einfache Blutabnahme beim ersten pränatalen Arztbesuch kann festgestellt werden, ob eine Frau bereits früher mit dem Virus in Kontakt gekommen ist und somit ein Risiko besteht oder nicht. Wenn eine Frau während der Schwangerschaft zum ersten Mal mit T. gondii in Kontakt kommt, ist der Fötus besonders gefährdet. ⓘ
Es gibt nicht viele Belege dafür, dass eine Aufklärung vor der Schwangerschaft eine kongenitale Toxoplasmose verhindern kann. Es wird jedoch vermutet, dass die Aufklärung der Eltern vor der Geburt des Kindes wirksam ist, da sie die Hygiene in Bezug auf Lebensmittel, Körper und Haustiere verbessern kann. Weitere Untersuchungen sind erforderlich, um herauszufinden, ob vorgeburtliche Aufklärung die kongenitale Toxoplasmose verringern kann. ⓘ
Bei schwangeren Frauen mit negativen Antikörpertitern, die auf keine frühere Exposition gegenüber T. gondii hindeuten, ist es ratsam, so häufig wie möglich serologische Tests durchzuführen, da eine Behandlung während der Schwangerschaft bei Frauen, die zum ersten Mal mit T. gondii in Kontakt kommen, das Risiko einer Übertragung des Parasiten auf den Fötus drastisch verringert. Da sich das Immunsystem eines Babys im ersten Lebensjahr noch nicht vollständig entwickelt hat und die widerstandsfähigen Zysten, die sich im ganzen Körper bilden, mit Antiprotozoika nur sehr schwer zu beseitigen sind, kann eine Infektion bei Kindern sehr schwerwiegend sein. ⓘ
Trotz dieser Risiken werden schwangere Frauen in den meisten Ländern aus Gründen der Kosteneffizienz und der hohen Zahl falsch positiver Ergebnisse nicht routinemäßig auf Toxoplasmose untersucht; Portugal, Frankreich, Österreich, Uruguay und Italien sind bemerkenswerte Ausnahmen, und in Deutschland, der Schweiz und Belgien werden einige regionale Screening-Programme durchgeführt. Da invasive pränatale Tests mit einem gewissen Risiko für den Fötus verbunden sind (18,5 Schwangerschaftsverluste pro verhindertem Toxoplasmosefall), wird das postnatale oder neonatale Screening bevorzugt. Ausnahmen sind Fälle, in denen fetale Anomalien festgestellt werden, so dass das Screening gezielt eingesetzt werden kann. ⓘ
Schwangere Frauen sollten den Umgang mit rohem Fleisch und den Genuss von Rohmilch (insbesondere Ziegenmilch) vermeiden und darauf hingewiesen werden, dass sie kein rohes oder unzureichend gegartes Fleisch, gleich welcher Art, essen sollten. Aufgrund des offensichtlichen Zusammenhangs zwischen Toxoplasma und Katzen wird auch häufig empfohlen, den Kontakt mit Katzenkot zu vermeiden und keine Gartenarbeit zu verrichten (Katzenkot findet sich häufig in der Gartenerde) oder zumindest Handschuhe zu tragen, wenn man damit zu tun hat. Die meisten Katzen scheiden nicht aktiv Oozysten aus, da sie sich in den ersten sechs Monaten ihres Lebens infizieren, wenn sie für einen kurzen Zeitraum (1-2 Wochen) Oozysten ausscheiden. Diese Oozysten werden jedoch im Boden vergraben, sporulieren und bleiben für mehrere Monate bis zu mehr als einem Jahr infektiös. Zahlreiche Studien haben gezeigt, dass das Zusammenleben mit einer Katze kein signifikanter Risikofaktor für eine T.-gondii-Infektion ist, obwohl das Zusammenleben mit mehreren Kätzchen eine gewisse Bedeutung hat. ⓘ
Im Jahr 2006 entdeckte ein tschechisches Forscherteam, dass Frauen mit hohen Toxoplasmose-Antikörperspiegeln mit deutlich höherer Wahrscheinlichkeit Jungen als Mädchen zur Welt bringen. In den meisten Populationen liegt die Geburtenrate bei etwa 51 % Jungen, aber bei Menschen, die mit T. gondii infiziert sind, besteht eine bis zu 72 %ige Chance auf einen Jungen. ⓘ
Diagnose
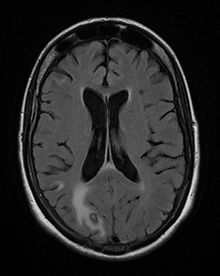
Die Diagnose der Toxoplasmose beim Menschen wird durch biologische, serologische, histologische oder molekulare Methoden oder durch eine Kombination der oben genannten Methoden gestellt. Die Toxoplasmose kann schwer von einem primären Lymphom des zentralen Nervensystems zu unterscheiden sein. Sie ahmt mehrere andere Infektionskrankheiten nach, so dass die klinischen Anzeichen unspezifisch und für eine eindeutige Diagnose nicht ausreichend charakteristisch sind. Daher wird die Möglichkeit einer alternativen Diagnose durch einen fehlgeschlagenen Versuch einer antimikrobiellen Therapie (Pyrimethamin, Sulfadiazin und Folinsäure (USAN: Leucovorin)) gestützt, d. h. wenn die Medikamente klinisch keine Wirkung zeigen und keine Verbesserung bei einer erneuten Bildgebung. ⓘ
T. gondii kann auch mit Hilfe der Polymerase-Kettenreaktion in Blut, Fruchtwasser oder Liquor nachgewiesen werden. T. gondii kann in einem Wirt als inaktive Zyste existieren, die sich wahrscheinlich dem Nachweis entziehen würde. ⓘ
Mit serologischen Tests können T.-gondii-Antikörper im Blutserum nachgewiesen werden, u. a. mit dem Sabin-Feldman-Farbstofftest (DT), dem indirekten Hämagglutinationstest, dem indirekten Fluoreszenz-Antikörper-Assay (IFA), dem direkten Agglutinationstest, dem Latex-Agglutinationstest (LAT), dem Enzyme-Linked Immunosorbent Assay (ELISA) und dem Immunosorbent Agglutination Assay Test (IAAT). ⓘ
Die am häufigsten verwendeten Tests zur Messung von IgG-Antikörpern sind der DT, der ELISA, der IFA und der modifizierte direkte Agglutinationstest. IgG-Antikörper treten in der Regel innerhalb von ein bis zwei Wochen nach der Infektion auf, erreichen ihren Höhepunkt innerhalb von ein bis zwei Monaten und nehmen dann unterschiedlich schnell ab. Toxoplasma-IgG-Antikörper bleiben in der Regel ein Leben lang bestehen und können daher als Folge einer aktuellen oder früheren Infektion in der Blutbahn vorhanden sein. ⓘ
Bis zu einem gewissen Grad können akute Toxoplasmose-Infektionen von chronischen Infektionen mit Hilfe eines IgG-Aviditätstests unterschieden werden, der eine Variante des ELISA ist. In der ersten Reaktion auf die Infektion hat toxoplasmaspezifisches IgG eine geringe Affinität für das Toxoplasma-Antigen; in den folgenden Wochen und Monaten nimmt die IgG-Affinität für das Antigen zu. Wenn das IgG der infizierten Person eine hohe Affinität aufweist, bedeutet dies, dass die Infektion drei bis fünf Monate vor dem Test begonnen hat, wie der IgG-Aviditätstest zeigt. Dies ist besonders nützlich bei angeborenen Infektionen, bei denen der Schwangerschaftsstatus und das Gestationsalter zum Zeitpunkt der Infektion die Behandlung bestimmen. ⓘ
Im Gegensatz zu IgG können IgM-Antikörper zum Nachweis einer akuten Infektion verwendet werden, aber im Allgemeinen nicht zum Nachweis einer chronischen Infektion. Die IgM-Antikörper treten früher nach der Infektion auf als die IgG-Antikörper und verschwinden nach der Genesung schneller als die IgG-Antikörper. In den meisten Fällen können T. gondii-spezifische IgM-Antikörper erstmals etwa eine Woche nach Erwerb der Primärinfektion nachgewiesen werden und nehmen innerhalb von einem bis sechs Monaten ab; 25 % der Infizierten sind innerhalb von sieben Monaten negativ für T. gondii-spezifische IgM. IgM kann jedoch auch noch Monate oder Jahre nach der Infektion, während der chronischen Phase, nachweisbar sein, und falsch positive Ergebnisse für eine akute Infektion sind möglich. Die am häufigsten verwendeten Tests für die Messung von IgM-Antikörpern sind der Doppel-Sandwich-IgM-ELISA, der IFA-Test und der Immunosorbent-Agglutinationstest (IgM-ISAGA). Kommerzielle Testkits haben oft eine geringe Spezifität, und die gemeldeten Ergebnisse werden häufig falsch interpretiert. ⓘ
Im Jahr 2021 wurden zwanzig kommerzielle Anti-Toxoplasma-IgG-Tests im Rahmen einer systematischen Überprüfung im Vergleich zu einer anerkannten Referenzmethode bewertet. Bei den meisten handelte es sich um Enzym-Immunoassays, gefolgt von Agglutinationstests, immunchromatografischen Tests und einem Western-Blot-Assay. Die mittlere Empfindlichkeit der IgG-Tests reichte von 89,7 % bis 100 % für Standardtiter und von 13,4 % bis 99,2 % für niedrige IgG-Titer. Einige Studien wiesen darauf hin, dass einige Methoden, insbesondere der WB, in der Lage sind, IgG frühzeitig nach der Primärinfektion nachzuweisen. Die Spezifität der IgG-Assays war im Allgemeinen hoch und reichte von 91,3 % bis 100 %; bei den meisten EIA-Assays lag sie bei über 99 %. Der positive prädiktive Wert (PPV) war kein diskriminierender Indikator zwischen den Methoden, während beim negativen prädiktiven Wert (NPV), einem Schlüsselparameter zur Beurteilung der Fähigkeit, eine Toxoplasma-Infektion bei Patienten, die ein Risiko für opportunistische Infektionen haben, definitiv auszuschließen, erhebliche Unterschiede (87,5 %-100 %) festgestellt wurden. ⓘ
Kongenitale
Die Empfehlungen für die Diagnose der kongenitalen Toxoplasmose umfassen: Pränataldiagnose auf der Grundlage von Fruchtwasseruntersuchungen und Ultraschalluntersuchungen; Neugeborenendiagnose auf der Grundlage von molekularen Tests der Plazenta und des Nabelschnurblutes sowie vergleichenden serologischen Tests von Mutter und Kind und einer klinischen Untersuchung bei der Geburt; und Diagnose im frühen Kindesalter auf der Grundlage von neurologischen und ophthalmologischen Untersuchungen und einer serologischen Untersuchung im ersten Lebensjahr. Während der Schwangerschaft wird eine serologische Untersuchung im Abstand von drei Wochen empfohlen. ⓘ
Obwohl die Diagnose der Toxoplasmose in hohem Maße vom serologischen Nachweis spezifischer Anti-Toxoplasma-Immunglobuline abhängt, haben serologische Tests ihre Grenzen. So kann es beispielsweise vorkommen, dass die aktive Phase der T. gondii-Infektion nicht erkannt wird, weil das spezifische Anti-Toxoplasma-IgG oder -IgM möglicherweise erst nach mehreren Wochen der Infektion gebildet wird. Infolgedessen könnte eine schwangere Frau während der aktiven Phase der T. gondii-Infektion negativ getestet werden, was zu einer unerkannten und daher unbehandelten kongenitalen Toxoplasmose führt. Außerdem kann der Test T. gondii-Infektionen bei immungeschwächten Patienten nicht nachweisen, da die Titer von spezifischem Anti-Toxoplasma-IgG oder -IgM bei dieser Art von Patienten nicht ansteigen können. ⓘ
Es wurden zahlreiche PCR-basierte Verfahren zur Diagnose von Toxoplasmose anhand klinischer Proben wie Fruchtwasser, Blut, Liquor und Gewebebiopsie entwickelt. Die empfindlichste PCR-Technik ist die nested PCR, gefolgt von der Hybridisierung der PCR-Produkte. Der größte Nachteil dieser Techniken ist, dass sie zeitaufwändig sind und keine quantitativen Daten liefern. ⓘ
Die Echtzeit-PCR ist nützlich für den Nachweis von Krankheitserregern, die Genexpression und -regulation sowie die Unterscheidung von Allelen. Bei dieser PCR-Technik wird die 5'-Nukleaseaktivität der Taq-DNA-Polymerase genutzt, um eine nicht verlängerbare, fluoreszenzmarkierte Hybridisierungssonde während der Verlängerungsphase der PCR zu spalten. Ein zweiter Fluoreszenzfarbstoff, z. B. 6-Carboxy-Tetramethyl-Rhodamin, löscht die Fluoreszenz der intakten Sonde. Die Nuklease-Spaltung der Hybridisierungssonde während der PCR hebt den Effekt der Löschung auf, was zu einem Anstieg der Fluoreszenz proportional zur Menge des PCR-Produkts führt, das mit einem Sequenzdetektor überwacht werden kann. ⓘ
Toxoplasmose kann nicht durch Immunfärbung nachgewiesen werden. Von Toxoplasma befallene Lymphknoten weisen charakteristische Veränderungen auf, darunter schlecht abgegrenzte reaktive Keimzentren, Cluster von monozytoiden B-Zellen und verstreute epithelioide Histiozyten. ⓘ
Die klassische Trias der kongenitalen Toxoplasmose umfasst: Chorioretinitis, Hydrozephalus und intrakranielle Arteriosklerose. Weitere Folgen sind sensorineurale Taubheit, Krampfanfälle und geistige Behinderung. ⓘ
Angeborene Toxoplasmose kann auch das Gehör eines Kindes beeinträchtigen. Bis zu 30 % der Neugeborenen haben einen gewissen Grad an Schallempfindungsschwerhörigkeit. Auch die Kommunikationsfähigkeit des Kindes kann beeinträchtigt sein. Eine 2010 veröffentlichte Studie untersuchte 106 Patienten, die alle vor dem Alter von 2,5 Monaten mit Toxoplasmose behandelt wurden. Von dieser Gruppe wiesen 26,4 % Sprachstörungen auf. ⓘ
Behandlung
Eine Behandlung wird für Menschen mit schwerwiegenden gesundheitlichen Problemen empfohlen, z. B. für HIV-Infizierte, deren CD4-Zahl unter 200 Zellen/mm3 liegt. Trimethoprim/Sulfamethoxazol ist das Mittel der Wahl zur Vorbeugung von Toxoplasmose, aber nicht zur Behandlung einer aktiven Erkrankung. Eine Studie aus dem Jahr 2012 zeigt einen vielversprechenden neuen Weg zur Behandlung der aktiven und latenten Form dieser Krankheit mit zwei endochinähnlichen Chinolonen. ⓘ
Akut
Zur Behandlung der akuten Toxoplasmose werden folgende Medikamente verschrieben:
- Pyrimethamin - ein Antimalariamittel
- Sulfadiazin - ein Antibiotikum, das in Kombination mit Pyrimethamin zur Behandlung der Toxoplasmose eingesetzt wird
- Die Kombinationstherapie wird in der Regel zusammen mit Folsäurepräparaten verabreicht, um das Auftreten von Thrombozytopenien zu verringern.
- Eine Kombinationstherapie ist vor allem bei einer HIV-Infektion sinnvoll.
- Clindamycin
- Spiramycin - ein Antibiotikum, das vor allem bei schwangeren Frauen eingesetzt wird, um die Ansteckung ihrer Kinder zu verhindern. ⓘ
(Andere Antibiotika, wie z. B. Minocyclin, wurden in gewissem Umfang als Rettungstherapie eingesetzt). ⓘ
Bei einer Infektion während der Schwangerschaft wird Spiramycin im ersten und frühen zweiten Trimenon empfohlen, während Pyrimethamin/Sulfadiazin und Leucovorin im späten zweiten und dritten Trimenon empfohlen werden. ⓘ
Latent
Bei Menschen mit latenter Toxoplasmose sind die Zysten gegen diese Behandlungen immun, da die Antibiotika die Bradyzoiten nicht in ausreichender Konzentration erreichen. ⓘ
Die für latente Toxoplasmose verschriebenen Medikamente sind:
- Atovaquon - ein Antibiotikum, das zur Abtötung von Toxoplasma-Zysten bei AIDS-Patienten eingesetzt wurde
- Clindamycin - ein Antibiotikum, das in Kombination mit Atovaquon die Zysten bei Mäusen optimal abzutöten schien ⓘ
Kongenitale
Wenn bei einer schwangeren Frau eine akute Toxoplasmose diagnostiziert wird, kann durch eine Fruchtwasseruntersuchung festgestellt werden, ob der Fötus infiziert ist oder nicht. Wenn eine schwangere Frau an akuter Toxoplasmose erkrankt, haben die Tachyzoiten eine etwa 30 %ige Chance, in das Plazentagewebe einzudringen und von dort aus den Fötus zu infizieren. Mit zunehmendem Schwangerschaftsalter zum Zeitpunkt der Infektion steigt auch die Wahrscheinlichkeit einer Infektion des Fötus. ⓘ
Wenn der Parasit den Fötus noch nicht erreicht hat, kann Spiramycin dazu beitragen, eine Plazentaübertragung zu verhindern. Wurde der Fötus infiziert, kann die Schwangere nach dem ersten Trimester mit Pyrimethamin und Sulfadiazin mit Folinsäure behandelt werden. Die Behandlung erfolgt nach dem ersten Trimester, da Pyrimethamin eine antifolathaltige Wirkung hat und ein Folsäuremangel die Gehirnbildung des Fötus beeinträchtigen und eine Thrombozytopenie verursachen kann. Eine Infektion in früheren Schwangerschaftsstadien korreliert mit schlechteren fötalen und neonatalen Ergebnissen, insbesondere wenn die Infektion unbehandelt ist. ⓘ
Neugeborene, die 12 Monate lang postnatal gegen Toxoplasmose behandelt werden, haben ein geringes Risiko für einen sensorineuralen Hörverlust. Für diese Gruppe wurden Informationen zu den Behandlungsmeilensteinen für Kinder mit kongenitaler Toxoplasmose erstellt. ⓘ
Epidemiologie
T. gondii-Infektionen treten weltweit auf, wobei die Infektionsraten je nach Land sehr unterschiedlich sind. Bei Frauen im gebärfähigen Alter ergab eine Untersuchung von 99 Studien in 44 Ländern, dass die höchste Prävalenz in Lateinamerika (ca. 50-80 %), in Teilen Ost- und Mitteleuropas (ca. 20-60 %), im Nahen Osten (ca. 30-50 %), in Teilen Südostasiens (ca. 20-60 %) und in Teilen Afrikas (ca. 20-55 %) zu verzeichnen ist. ⓘ
In den Vereinigten Staaten ergaben Daten der National Health and Nutrition Examination Survey (NHANES) aus den Jahren 1999 bis 2004, dass 9,0 % der in den USA geborenen Personen im Alter von 12 bis 49 Jahren seropositiv für IgG-Antikörper gegen T. gondii waren, gegenüber 14,1 % bei der NHANES-Erhebung 1988-1994. In der Erhebung 1999-2004 waren 7,7 % der in den USA geborenen und 28,1 % der im Ausland geborenen Frauen im Alter von 15-44 Jahren seropositiv für T. gondii. In zahlreichen Studien in den Vereinigten Staaten und vielen europäischen Ländern wurde ein Trend zu einer sinkenden Seroprävalenz beobachtet. Toxoplasma gondii gilt als die zweithäufigste Ursache für lebensmittelbedingte Todesfälle und die vierthäufigste Ursache für lebensmittelbedingte Krankenhausaufenthalte in den Vereinigten Staaten. ⓘ
Der für die Toxoplasmose verantwortliche Erreger ist T. gondii. Es gibt drei Haupttypen von T. gondii, die für die Muster der Toxoplasmose in der Welt verantwortlich sind. Es sind die Typen I, II und III. Diese drei Typen von T. gondii haben aufgrund ihrer unterschiedlichen Genotypen unterschiedliche Auswirkungen auf bestimmte Wirte, hauptsächlich Mäuse und Menschen.
- Typ I: virulent bei Mäusen und Menschen, kommt bei AIDS-Kranken vor.
- Typ II: nicht virulent bei Mäusen, virulent beim Menschen (vor allem in Europa und Nordamerika), kommt bei Menschen mit AIDS vor.
- Typ III: nicht-virulent bei Mäusen, virulent hauptsächlich bei Tieren, aber in geringerem Maße auch bei Menschen. ⓘ
Die derzeitigen Serotypisierungsverfahren können nur Parasiten des Typs I oder III von denen des Typs II unterscheiden. ⓘ
Da der Parasit eine besondere Gefahr für Föten darstellt, wenn er sich während der Schwangerschaft infiziert, stammt ein Großteil der weltweiten epidemiologischen Daten über T. gondii aus Seropositivitätstests bei Frauen im gebärfähigen Alter. Seropositivitätstests suchen nach dem Vorhandensein von Antikörpern gegen T. gondii im Blut, so dass eine Seropositivität zwar garantiert, dass man mit dem Parasiten in Kontakt gekommen ist, aber nicht unbedingt, dass man chronisch infiziert ist. ⓘ
Geschichte
Toxoplasma gondii wurde erstmals 1908 von Nicolle und Manceaux in Tunesien und unabhängig davon von Splendore in Brasilien beschrieben. Splendore berichtete über den Protozoen bei einem Kaninchen, während Nicolle und Manceaux ihn bei einem nordafrikanischen Nagetier, dem Gundi (Ctenodactylus gundi), identifizierten. Im Jahr 1909 unterschieden Nicolle und Manceaux den Protozoen von Leishmanien. Nicolle und Manceaux gaben ihm den Namen Toxoplasma gondii nach der gebogenen Form seines infektiösen Stadiums (griechische Wurzel 'toxon' = Bogen). ⓘ
Der erste dokumentierte Fall von kongenitaler Toxoplasmose trat 1923 auf, wurde jedoch nicht als durch T. gondii verursacht identifiziert. Janků (1923) beschrieb detailliert die Autopsieergebnisse eines 11 Monate alten Jungen, der mit Hydrocephalus ins Krankenhaus eingeliefert worden war. Der Junge wies klassische Anzeichen einer Toxoplasmose auf, einschließlich einer Chorioretinitis (Entzündung der Aderhaut und der Netzhaut des Auges). Die Histologie ergab eine Reihe von "Sporocyten", die Janků jedoch nicht als T. gondii identifizierte. ⓘ
Erst 1937 fand die erste detaillierte wissenschaftliche Analyse von T. gondii mit Hilfe von Techniken statt, die zuvor für die Analyse von Viren entwickelt worden waren. 1937 untersuchten Sabin und Olitsky T. gondii in Laboraffen und Mäusen. Sabin und Olitsky wiesen nach, dass T. gondii ein obligater intrazellulärer Parasit ist und dass Mäuse, die mit T. gondii-kontaminiertem Gewebe gefüttert wurden, ebenfalls an der Infektion erkrankten. Damit wiesen Sabin und Olitsky nach, dass T. gondii ein zwischen Tieren übertragbarer Erreger ist. ⓘ
T. gondii wurde 1939 im Babies Hospital in New York City erstmals als Krankheitserreger beim Menschen beschrieben. Wolf, Cowen und Paige wiesen eine T. gondii-Infektion bei einem Mädchen nach, das per Kaiserschnitt entbunden worden war. Der Säugling entwickelte Krampfanfälle und hatte nach drei Tagen eine Chorioretinitis in beiden Augen. Der Säugling entwickelte dann eine Enzephalomyelitis und starb im Alter von einem Monat. Wolf, Cowen und Paige isolierten T. gondii aus Hirngewebsläsionen. Die intrakranielle Injektion von Gehirn- und Rückenmarksproben in Mäuse, Kaninchen und Ratten führte bei den Tieren zu einer Enzephalitis. Wolf, Cowen und Page untersuchten weitere Fälle und kamen zu dem Schluss, dass T. gondii erkennbare Symptome hervorruft und von der Mutter auf das Kind übertragen werden kann. ⓘ
Der erste Fall von Toxoplasmose bei Erwachsenen wurde 1940 ohne neurologische Anzeichen gemeldet. Pinkerton und Weinman meldeten das Vorhandensein von Toxoplasma bei einem 22-jährigen Mann aus Peru, der an einer nachfolgenden bakteriellen Infektion und Fieber starb. ⓘ
1948 wurde von Sabin und Feldman ein serologischer Farbstofftest entwickelt, der auf der Fähigkeit der Antikörper des Patienten beruht, die Färbung von Toxoplasma zu verändern. Der Sabin-Feldman-Färbetest ist heute der Goldstandard für den Nachweis einer Toxoplasma-Infektion. ⓘ
Die Übertragung von Toxoplasma durch den Verzehr von rohem oder nicht ausreichend gegartem Fleisch wurde 1965 von Desmonts et al. in Paris nachgewiesen. Desmonts beobachtete, dass der therapeutische Verzehr von rohem Rind- oder Pferdefleisch in einem Tuberkulosekrankenhaus mit einem Anstieg der Toxoplasma-Antikörper um 50 % pro Jahr verbunden war. Dies bedeutet, dass durch das rohe Fleisch mehr T. gondii übertragen wurde. ⓘ
1974 zeigten Desmonts und Couvreur, dass eine Infektion während der ersten beiden Trimester dem Fötus am meisten schadet, dass die Übertragung davon abhängt, wann die Mütter während der Schwangerschaft infiziert wurden, dass Mütter mit Antikörpern vor der Schwangerschaft die Infektion nicht auf den Fötus übertragen und dass Spiramycin die Übertragung auf den Fötus verringert. ⓘ
Mit dem Aufkommen der immunsuppressiven Behandlung nach Organ- oder Knochenmarktransplantationen und der AIDS-Epidemie in den 1980er Jahren erlangte Toxoplasma in den 1970er Jahren größere Aufmerksamkeit. Patienten, deren Immunsystem geschwächt ist, sind wesentlich anfälliger für die Krankheit. ⓘ
Gesellschaft und Kultur
"Verrückte Katze"
"Crazy cat-lady syndrome" ist ein Begriff, der von Nachrichtenorganisationen geprägt wurde, um wissenschaftliche Erkenntnisse zu beschreiben, die den Parasiten Toxoplasma gondii mit verschiedenen psychischen Störungen und Verhaltensauffälligkeiten in Verbindung bringen. Der vermutete Zusammenhang zwischen Katzenbesitz in der Kindheit und der späteren Entwicklung von Schizophrenie legte nahe, dass weitere Studien erforderlich sind, um einen Risikofaktor für Kinder zu ermitteln; spätere Studien zeigten jedoch, dass T. gondii kein ursächlicher Faktor für spätere Psychosen ist. Die Forscher fanden auch heraus, dass der Besitz einer Katze das Risiko einer T. gondii-Infektion bei schwangeren Frauen nicht stark erhöht. ⓘ
Der Begriff "Crazy-Cat-Lady-Syndrom" beruht sowohl auf Stereotypen als auch auf einer populären kulturellen Referenz. Er entstand, als in der Bevölkerung Fälle der oben genannten Leiden festgestellt wurden. Eine Katzenlady ist ein kulturelles Stereotyp einer Frau, die zwanghaft Katzen hortet und anhimmelt. Der Biologe Jaroslav Flegr vertritt die Theorie, dass Toxoplasmose das menschliche Verhalten beeinflusst. ⓘ
Bemerkenswerte Fälle
- Der Tennisspieler Arthur Ashe entwickelte aufgrund von Toxoplasmose neurologische Probleme (und erwies sich später als HIV-positiv).
- Der Schauspieler Merritt Butrick war HIV-positiv und starb an Toxoplasmose als Folge seines bereits geschwächten Immunsystems.
- Bei Pedro Zamora, Reality-TV-Persönlichkeit und HIV/AIDS-Aktivist, wurde Toxoplasmose diagnostiziert, da sein Immunsystem durch HIV geschwächt war.
- Prinz François, Graf von Clermont, Anwärter auf den französischen Thron, litt an angeborener Toxoplasmose; seine Behinderung führte dazu, dass er in der Thronfolge übergangen wurde.
- Die Schauspielerin Leslie Ash erkrankte im zweiten Schwangerschaftsmonat an Toxoplasmose.
- Der britische Mittelstreckenläufer Sebastian Coe erkrankte 1983 an Toxoplasmose, die wahrscheinlich von einer Katze übertragen wurde, während er in Italien trainierte.
- Die Tennisspielerin Martina Navratilova erkrankte während der US Open 1982 an Toxoplasmose. ⓘ
Andere Tiere

Obwohl T. gondii praktisch alle warmblütigen Tiere infizieren kann, variieren Anfälligkeit und Infektionsraten zwischen den verschiedenen Gattungen und Arten erheblich. Die Infektionsraten in Populationen derselben Art können aufgrund von Unterschieden in Bezug auf Standort, Ernährung und andere Faktoren ebenfalls stark variieren. ⓘ
Obwohl eine Infektion mit T. gondii bei mehreren asiatischen Primatenarten festgestellt wurde, wurde die Seroprävalenz von T. gondii-Antikörpern zum ersten Mal bei Totenkopfmakaken (Macaca sinica) festgestellt, die auf der Insel Sri Lanka endemisch sind. ⓘ
Australische Beuteltiere sind besonders anfällig für Toxoplasmose. Wallabys, Koalas, Wombats, Pademelons und kleine Dasyuriden können daran sterben, wobei die östlichen Streifenhörnchen in der Regel innerhalb von etwa 3 Wochen nach der Infektion verenden. ⓘ
Man schätzt, dass weltweit 23 % der Wildschweine seropositiv für T. gondii sind. Die Seroprävalenz variiert weltweit, wobei die höchste Seroprävalenz in Nordamerika (32 %) und Europa (26 %) und die niedrigste in Asien (13 %) und Südamerika (5 %) zu verzeichnen ist. Geografische Regionen in höheren Breitengraden und Regionen mit wärmerem, feuchtem Klima werden mit einer erhöhten Seroprävalenz von T. gondii bei Wildschweinen in Verbindung gebracht. Mit T. gondii infizierte Wildschweine stellen ein potenzielles Gesundheitsrisiko für Menschen dar, die ihr Fleisch verzehren. ⓘ
Viehbestand
Unter den Nutztieren weisen Schweine, Schafe und Ziegen die höchsten Raten an chronischen T. gondii-Infektionen auf. Die Prävalenz von T. gondii bei Tieren, die der Fleischgewinnung dienen, ist sowohl innerhalb eines Landes als auch von Land zu Land sehr unterschiedlich, und es hat sich gezeigt, dass die Infektionsraten durch unterschiedliche Haltungs- und Managementpraktiken erheblich beeinflusst werden. So sind beispielsweise Tiere, die im Freien oder in Freilandhaltung gehalten werden, einem höheren Infektionsrisiko ausgesetzt als Tiere, die in Ställen oder in kommerziellen Haltungsbetrieben aufgezogen werden. ⓘ
Schweine
Weltweit wurde der Prozentsatz der Schweine, die lebensfähige Parasiten beherbergen, mit 3 - 71,43 % angegeben, in den Vereinigten Staaten (mittels Bioassay an Mäusen oder Katzen) mit 92,7 % bis 0 %, je nach Betrieb oder Herde. Erhebungen zur Seroprävalenz (T. gondii-Antikörper im Blut) sind häufiger, und solche Messungen sind ein Hinweis auf die hohe relative Seroprävalenz bei Schweinen in der ganzen Welt. Bei neugeborenen Ferkeln wurde die gesamte Bandbreite des Schweregrads festgestellt, einschließlich der Entwicklung bis hin zur Totgeburt. Dies wurde insbesondere in der grundlegenden Studie von Thiptara et al. 2006 deutlich, die über einen Wurf mit drei Totgeburten und sechs Lebendgeburten in Thailand berichtete. Diese Beobachtung ist nicht nur für dieses Land von Bedeutung, sondern auch für die Toxoplasmosebekämpfung in der Schweinehaltung auf der ganzen Welt. ⓘ
Schafe
Neben Schweinen gehören Schafe und Ziegen zu den am häufigsten infizierten Nutztieren, die für die Ansteckung des Menschen von epidemiologischer Bedeutung sind. Die Prävalenz von lebensfähigen T. gondii in Schafsgewebe wurde (mittels Bioassay) in den Vereinigten Staaten mit bis zu 78 % gemessen, und eine 2011 durchgeführte Untersuchung von zum Verzehr bestimmten Ziegen in den Vereinigten Staaten ergab eine Seroprävalenz von 53,4 %. ⓘ
Hühner
Aufgrund des fehlenden Kontakts mit der freien Natur sind Hühner, die in großen Ställen gehalten werden, nicht häufig mit T. gondii infiziert. Hühner in Freiland- oder Hinterhofhaltung sind viel häufiger infiziert. Eine Untersuchung von freilaufenden Hühnern in den Vereinigten Staaten ergab eine Prävalenz von 17-100 %, je nach Betrieb. Da Hühnerfleisch in der Regel vor dem Verzehr gründlich gekocht wird, gilt Geflügel im Allgemeinen nicht als signifikanter Risikofaktor für eine T. gondii-Infektion beim Menschen. ⓘ
Rinder
Obwohl Rinder und Büffel mit T. gondii infiziert werden können, wird der Parasit im Allgemeinen innerhalb weniger Wochen nach der Exposition eliminiert oder auf nicht nachweisbare Werte reduziert. Gewebezysten sind in Büffelfleisch oder Rindfleisch nur selten vorhanden, und Fleisch von diesen Tieren gilt als risikoarm, da es lebensfähige Parasiten enthält. ⓘ
Pferde
Pferde gelten als resistent gegen eine chronische T. gondii-Infektion. Es wurden jedoch lebensfähige Zellen von US-Pferden isoliert, die für den Export geschlachtet wurden, und in Frankreich wurde eine schwere Toxoplasmose beim Menschen epidemiologisch mit dem Verzehr von Pferdefleisch in Verbindung gebracht. ⓘ
Hauskatzen
1942 wurde der erste Fall von Katzentoxoplasmose bei einer Hauskatze in Middletown, New York, diagnostiziert und gemeldet. Die Forscher isolierten Oozysten aus Katzenkot und stellten fest, dass die Oozysten in der Umwelt bis zu 12 Monate lang infektiös sein konnten. ⓘ
Die Seroprävalenz von T. gondii bei Hauskatzen wird weltweit auf etwa 30-40 % geschätzt und weist erhebliche geografische Unterschiede auf. In den Vereinigten Staaten gibt es keine offizielle nationale Schätzung, aber lokale Erhebungen haben ergeben, dass die Werte zwischen 16 % und 80 % liegen. Eine 2012 durchgeführte Untersuchung von 445 reinrassigen Hauskatzen und 45 Katzen aus Tierheimen in Finnland ergab eine Gesamtprävalenz von 48,4 %, während eine 2010 durchgeführte Untersuchung von verwilderten Katzen in Giza, Ägypten, eine Seroprävalenz von 97,4 % ergab. Bei einer anderen Erhebung in Kolumbien wurde eine Seroprävalenz von 89,3 % festgestellt, während eine chinesische Studie (Guangdong) nur eine Prävalenz von 2,1 % ergab. ⓘ
Die T. gondii-Infektionsraten bei Hauskatzen variieren stark, je nach Ernährung und Lebensweise der Katzen. Bei verwilderten Katzen, die auf der Jagd nach Nahrung sind, ist die Wahrscheinlichkeit einer Infektion größer als bei Hauskatzen, und natürlich hängt sie auch von der Häufigkeit T. gondii-infizierter Beutetiere wie Vögel und kleine Säugetiere ab. ⓘ
Die meisten infizierten Katzen scheiden nur einmal in ihrem Leben Oozysten aus, und zwar für einen Zeitraum von etwa ein bis zwei Wochen. Bei dieser Ausscheidung können Millionen von Oozysten freigesetzt werden, von denen jede einzelne in der Lage ist, sich zu verbreiten und monatelang zu überleben. Schätzungsweise 1 % der Katzen scheidet zu einem bestimmten Zeitpunkt aktiv Oozysten aus. ⓘ
Da es keinen wirksamen Impfstoff gibt, ist es schwierig, die Katzenpopulation mit den infizierten Oozysten zu kontrollieren. Dies bleibt in den meisten Fällen eine Herausforderung, und die zur Verfügung stehenden Programme sind in ihrer Wirksamkeit fragwürdig. ⓘ
Nagetiere
Es wurde nachgewiesen, dass eine Infektion mit T. gondii das Verhalten von Mäusen und Ratten in einer Weise verändert, die die Chancen der Nagetiere erhöht, von Katzen erbeutet zu werden. Infizierte Nagetiere zeigen eine Verringerung ihrer angeborenen Abneigung gegen Katzengeruch; während nicht infizierte Mäuse und Ratten im Allgemeinen Bereiche meiden, die mit Katzenurin oder Katzenkörpergeruch markiert sind, ist diese Meidung bei infizierten Tieren verringert oder aufgehoben. Darüber hinaus deutet einiges darauf hin, dass dieser Verlust der Aversion spezifisch für Katzengerüche sein könnte: Wenn man die Wahl zwischen zwei Raubtiergerüchen (Katze oder Nerz) hat, zeigen infizierte Nager eine deutlich stärkere Präferenz für Katzengeruch als nicht infizierte Kontrolltiere. ⓘ
Bei Nagetieren treten T. gondi-induzierte Verhaltensänderungen durch epigenetischen Umbau in Neuronen auf, die mit beobachteten Verhaltensweisen in Verbindung stehen; so verändert es beispielsweise die epigenetische Methylierung, um eine Hypomethylierung von Arginin-Vasopressin-verwandten Genen in der medialen Amygdala zu induzieren, was die Raubtieraversion stark verringert. Ähnliche epigenetisch induzierte Verhaltensänderungen wurden auch in Mausmodellen der Sucht beobachtet, wo Veränderungen der Expression von Histon-modifizierenden Enzymen durch Gen-Knockout oder Enzymhemmung in spezifischen Neuronen zu Veränderungen im drogenbezogenen Verhalten führten. Die weit verbreitete Histon-Lysin-Acetylierung in kortikalen Astrozyten scheint ein weiterer epigenetischer Mechanismus von T. gondii zu sein. ⓘ
Mit T. gondii infizierte Nagetiere zeigen eine Reihe von Verhaltensänderungen, die über veränderte Reaktionen auf Katzengeruch hinausgehen. Mit dem Parasiten infizierte Ratten zeigen ein erhöhtes Maß an Aktivität und ein geringeres neophobisches Verhalten. In ähnlicher Weise zeigen infizierte Mäuse während experimenteller Tests veränderte Muster der Fortbewegung und des Erkundungsverhaltens. Sie legen größere Entfernungen zurück, bewegen sich mit höherer Geschwindigkeit, beschleunigen über längere Zeiträume und zeigen eine geringere Pausenzeit, wenn sie sich in neuen Umgebungen aufhalten. Bei infizierten Nagetieren hat sich auch gezeigt, dass sie weniger ängstlich sind, wenn sie traditionelle Modelle wie Labyrinthe in erhöhter Position, Arenen im offenen Feld und Tests zur sozialen Interaktion verwenden. ⓘ
Meeressäugetiere
Eine Studie der University of California, Davis, an toten Seeottern, die zwischen 1998 und 2004 gesammelt wurden, ergab, dass Toxoplasmose bei 13 % der Tiere die Todesursache war. Die Nähe zu Süßwasserausflüssen ins Meer war ein wichtiger Risikofaktor. Das Verschlucken von Oozysten aus Katzenkot gilt als die wahrscheinlichste letzte Quelle. Oberflächenabflüsse, die wilde Katzenkotpartikel enthalten, und Einstreu von Hauskatzen, die in Toiletten heruntergespült werden, sind mögliche Quellen für Oozysten. Dieselben Quellen könnten auch die Toxoplasmose-Infektion der gefährdeten Hawaii-Mönchsrobbe eingeschleppt haben. Die Infektion mit dem Parasiten hat zum Tod von mindestens vier Hawaiianischen Mönchsrobben beigetragen. Die Infektion einer hawaiianischen Mönchsrobbe mit T. gondii wurde erstmals im Jahr 2004 festgestellt. Die Ausbreitung des Parasiten bedroht die Erholung dieses stark bedrohten Tümmlers. Die Parasiten wurden auch bei Delfinen und Walen gefunden. Die Forscher Black und Massie glauben, dass Sardellen, die von Flussmündungen in den offenen Ozean wandern, zur Verbreitung der Krankheit beitragen könnten. ⓘ
Großer Panda
Toxoplasma gondii wurde als Todesursache eines in einem Zoo in China gehaltenen Großen Pandas gemeldet, der 2014 an akuter Gastroenteritis und Atemwegserkrankungen starb. Obwohl dieser Bericht eher anekdotisch erscheint, unterstreicht er, dass alle warmblütigen Tierarten mit T. gondii infiziert sein können, einschließlich gefährdeter Arten wie dem Großen Panda. ⓘ
Forschung
Eine chronische Infektion mit T. gondii wird bei Menschen mit normaler Immunfunktion traditionell als asymptomatisch angesehen. Einiges deutet darauf hin, dass eine latente Infektion eine Reihe menschlicher Verhaltensweisen und Neigungen auf subtile Weise beeinflussen kann, und dass eine Infektion die Anfälligkeit für oder die Intensität einer Reihe psychiatrischer oder neurologischer Störungen verändern kann. ⓘ
In den meisten aktuellen Studien, in denen positive Korrelationen zwischen T.-gondii-Antikörpertitern und bestimmten Verhaltensmerkmalen oder neurologischen Störungen festgestellt wurden, wurden T.-gondii-Seropositivitätstests nach dem Auftreten der untersuchten Krankheit oder des Verhaltensmerkmals durchgeführt; das heißt, es ist oft unklar, ob eine Infektion mit dem Parasiten die Wahrscheinlichkeit erhöht, ein bestimmtes Merkmal oder eine bestimmte Störung zu haben, oder ob ein bestimmtes Merkmal oder eine bestimmte Störung die Wahrscheinlichkeit erhöht, mit dem Parasiten infiziert zu werden. Gruppen von Personen mit bestimmten Verhaltensmerkmalen oder neurologischen Störungen können bestimmte Verhaltenstendenzen aufweisen, die die Wahrscheinlichkeit einer Exposition und Infektion mit T. gondii erhöhen; daher ist es schwierig, kausale Zusammenhänge zwischen T. gondii-Infektionen und damit verbundenen neurologischen Störungen oder Verhaltensmerkmalen zu bestätigen. ⓘ
Psychische Gesundheit
Es gibt Hinweise auf einen Zusammenhang zwischen T. gondii und Schizophrenie. Zwei Meta-Analysen aus dem Jahr 2012 ergaben, dass die Raten von Antikörpern gegen T. gondii bei Menschen mit Schizophrenie 2,7-mal höher waren als bei Kontrollpersonen. Die Positivität von T. gondii-Antikörpern wurde daher als intermediärer Risikofaktor im Verhältnis zu anderen bekannten Risikofaktoren betrachtet. Es wurde darauf hingewiesen, dass die Antikörpertests die Toxoplasmose nicht direkt nachweisen, dass die meisten Menschen mit Schizophrenie keine Antikörper gegen Toxoplasmose haben und dass es zu Verzerrungen bei der Veröffentlichung kommen kann. In den meisten dieser Studien wurden Menschen, bei denen bereits eine Schizophrenie diagnostiziert wurde, auf T. gondii-Antikörper getestet, doch wurden auch Zusammenhänge zwischen T. gondii und Schizophrenie vor dem Auftreten von Schizophreniesymptomen festgestellt. Geschlechtsspezifische Unterschiede im Alter des Ausbruchs der Schizophrenie lassen sich zum Teil durch einen zweiten Höhepunkt der T. gondii-Infektionshäufigkeit im Alter von 25 bis 30 Jahren nur bei Frauen erklären. Obwohl der Mechanismus, der den Zusammenhang zwischen Schizophrenie und T. gondii-Infektion unterstützt, unklar ist, haben Studien eine molekulare Grundlage für diesen Zusammenhang untersucht. Antipsychotika, die bei Schizophrenie eingesetzt werden, scheinen die Vermehrung von T. gondii-Tachyzoiten in Zellkulturen zu hemmen. Unter der Annahme, dass ein kausaler Zusammenhang zwischen T. gondii und Schizophrenie besteht, muss in Studien noch geklärt werden, warum nur einige Personen mit latenter Toxoplasmose eine Schizophrenie entwickeln; zu den plausiblen Erklärungen gehören eine unterschiedliche genetische Anfälligkeit, Unterschiede zwischen den Parasitenstämmen und Unterschiede beim Weg der erworbenen T. gondii-Infektion. ⓘ
Es wurden auch Zusammenhänge zwischen Antikörpertitern gegen T. gondii und Zwangsstörungen sowie Selbstmord bei Menschen mit Stimmungsstörungen, einschließlich bipolarer Störungen, festgestellt. Positive T. gondii-Antikörpertiter scheinen nicht mit schweren Depressionen oder Dysthymie korreliert zu sein. Obwohl es eine Korrelation zwischen T. gondii und vielen psychischen Störungen gibt, ist der zugrunde liegende Mechanismus unklar. Eine Studie aus dem Jahr 2016 an 236 Personen mit hohen Toxoplasmose-Antikörperspiegeln ergab, dass "es kaum Hinweise darauf gab, dass T. gondii mit einem erhöhten Risiko für psychiatrische Störungen, schlechte Impulskontrolle, Persönlichkeitsstörungen oder neurokognitive Beeinträchtigungen verbunden war". ⓘ
Neurologische Störungen
Eine latente Infektion wurde mit der Parkinson-Krankheit und der Alzheimer-Krankheit in Verbindung gebracht. ⓘ
Bei Personen mit Multipler Sklerose ist die Infektionsrate um etwa 15 % niedriger als in der Allgemeinbevölkerung. ⓘ
Verkehrsunfälle
Eine latente T.-gondii-Infektion beim Menschen wurde mit einem höheren Risiko für Autounfälle in Verbindung gebracht, was möglicherweise auf eine beeinträchtigte psychomotorische Leistungsfähigkeit oder ein verstärktes risikofreudiges Persönlichkeitsprofil zurückzuführen ist. ⓘ
Klimawandel
Es wurde berichtet, dass der Klimawandel das Auftreten, das Überleben, die Verbreitung und die Übertragung von T. gondii beeinflusst. T. gondii wurde in der kanadischen Arktis nachgewiesen, einem Ort, der früher zu kalt für sein Überleben war. Höhere Temperaturen verlängern die Überlebenszeit von T. gondii. Mehr Schneeschmelze und Niederschläge können die Menge der Oozysten von T. gondii erhöhen, die über die Flüsse transportiert werden. Veränderungen in den Populationen von Vögeln, Nagetieren und Insekten sowie in den Migrationsmustern können sich auf die Verbreitung von T. gondii auswirken, da sie als Reservoir und Überträger dienen. Auch die Verstädterung und die natürliche Umweltverschlechterung können die Übertragung von T. gondii beeinflussen und das Infektionsrisiko erhöhen. ⓘ
Infektionszyklus

Der Infektionszyklus bei T. gondii kann auf drei Wegen erfolgen:
- Endwirt-Endwirt-Zyklus
- Endwirt-Zwischenwirt-Zyklus
- Zwischenwirt-Zwischenwirt-Zyklus ⓘ
Toxoplasmose des Menschen

Die Grundzüge der Toxoplasmose beim Menschen gelten prinzipiell für alle Säugetiere, die als Zwischenwirt für Toxoplasma gondii in Frage kommen. ⓘ
Die Serokonversion, also die Veränderung von fehlenden Antikörpern gegen Toxoplasma zu positivem Antikörpernachweis, ist eine gute Methode, um die Infektionshäufigkeit einer Bevölkerung festzustellen. In Europa variiert die Quote der Serokonversion von 7 % (Norwegen) bis 50 % (Deutschland). In der BRD infizieren sich die meisten Menschen durch den Verzehr von mangelhaft erhitztem Schweinefleisch (Rohwurst, Mett). Vegetarier erkranken seltener an Toxoplasmose. Die Infektionen erfolgen in allen Lebensaltern. In Deutschland sind 20 % im Alter von 18–29 Jahre seropositiv und 77 % der 70–79-Jährigen. ⓘ
Die Inkubationszeit beim Menschen beträgt ein bis drei Wochen, die Infektion verläuft bei gesundem Immunsystem für etwa 90 % der Betroffenen beschwerdefrei und symptomlos. Bei schubweise verlaufender Erkrankung kann sich die Ausbreitung über Wochen und Jahre hinziehen. Hierbei bleiben die Erreger im Organismus in Zysten eingeschlossen. Sie platzen zu beliebiger Zeit und gelangen so in das Blutgefäßsystem und Lymphgefäße. Bei einer überstandenen Erkrankung ist eine Immunität anzunehmen. ⓘ
Eine Therapie mit Antibiotika ist für Menschen bei pränataler Toxoplasmose des Neugeborenen, okulärer Toxoplasmose und aktiver Toxoplasma-Infektion immunsupprimierter Patienten angezeigt. ⓘ
Allgemeine Krankheitsanzeichen
Die Infektion ist bei gesunden Personen mit intaktem Immunsystem zumeist symptomlos. Selten treten Beschwerden wie leichtes Fieber, Lymphknotenschwellungen im Halsbereich, Müdigkeit sowie Kopf- und Gliederschmerzen auf. Der Verlauf der Krankheit ist in der Regel günstig und der Infizierte muss nicht behandelt werden. Bei einer Infektion werden Antikörper gebildet, die eine spätere erneute Ansteckung verhindern. ⓘ
Komplikationen
Das Immunsystem von Embryonen und Feten im Mutterleib und bei Neugeborenen nach der Geburt ist noch nicht ausgebildet. Fötus und Säugling sind auf mütterliche Antikörper durch den Mutterkuchen und Muttermilch angewiesen. Bei Föten und Babys und auch bei Menschen mit geschwächtem Immunsystem (z. B. AIDS-Patienten) können sich in allen Organen, am häufigsten im Gehirn, Entzündungsherde bilden und zu zusätzlichen Symptomen wie Wesensveränderungen, Lähmungserscheinungen und Krampfanfällen führen. Zusätzliche Manifestationen durch Toxoplasmose können Lungenentzündung und die Hirnhautentzündung sein. Daher ist meist eine medikamentöse Behandlung notwendig. ⓘ
Therapie
Die antibiotische Therapie besteht in der Gabe von Pyrimethamin, auch in Kombination mit Sulfadiazin und Folinsäure. Auch Clindamycin und Atovaquon gehören zu den einsetzbaren antimikrobiellen Arzneimitteln. ⓘ
Therapie in der Schwangerschaft
Eine nachgewiesene Infektion in der Schwangerschaft sollte behandelt werden. Je früher die Behandlung begonnen wird, umso geringer ist die Wahrscheinlichkeit einer Schädigung des Kindes (Senkung der Schäden bis zu 60 %). ⓘ
- Bis zur 16. Schwangerschaftswoche: Gabe von Spiramycin
- Ab der 16. Schwangerschaftswoche wird bis zur Entbindung eine Kombination aus Sulfadiazin, Pyrimethamin und Folinsäure in Zyklen von jeweils vier Wochen Dauer mit darauf folgendem vierwöchigen freien Intervall gegeben. ⓘ
Toxoplasmose bei Immunsuppression und Neugeborenen
| Medikament | Tagesdosis ⓘ |
|---|---|
| Pyrimethamin Sulfadiazin Folinsäure |
2 × 50 mg 4 × 1 g 15 mg |
| Bei Sulfonamid-Unverträglichkeit: Pyrimethamin Clindamycin Folinsäure |
2 × 50 mg 3 × 600 mg 15 mg |
Die Toxoplasmose führt bei Immunsupprimierten (z. B. Neugeborenen, AIDS-Patienten oder Patienten nach allogener Stammzelltransplantation) zu Erkrankungsbildern, die bei Menschen mit intaktem Immunsystem nicht vorkommen. Besonders schwerwiegend ist die zerebrale Toxoplasmose, die sich in Form von großen raumfordernden Prozessen mit entsprechenden neurologischen Ausfällen äußern kann. Manchmal kann die Diagnosestellung schwierig sein, insbesondere die differenzialdiagnostische Abgrenzung zu ZNS-Lymphomen, die bei Immunsupprimierten ebenfalls um ein Vielfaches häufiger auftreten. Die Diagnose kann durch Nachweis der DNS des Erregers im Liquor mittels Polymerase-Kettenreaktion (PCR) oder direkte Hirnbiopsie gesichert werden. Nicht selten muss aber auf Verdacht hin behandelt werden. Medikamente der ersten Wahl sind die Kombination Pyrimethamin+Sulfadiazin (+Folinsäure zur Milderung von Nebenwirkungen des Sulfonamids), oder bei Sulfonamid-Unverträglichkeit die Kombination Clindamycin+Pyrimethamin (+ Folinsäure). Pyrimethamin ist auch in Kombination mit Makroliden wie Azithromycin oder Clarithromycin wirksam. Diese Kombinationen werden aber in den Behandlungsleitlinien nicht empfohlen. Die Therapiedauer beträgt mindestens 4 Wochen. Entscheidender Risikofaktor für das Auftreten einer Toxoplasmose ist die T-Helferzellzahl im Blut. Liegt die Helferzellzahl unter 200/µl, sollte eine medikamentöse Prophylaxe, z. B. mit 960 mg Cotrimoxazol 3 × wöchentlich betrieben werden („Primärprophylaxe“). Ist schon einmal eine Toxoplasmose aufgetreten, muss ebenfalls eine Prophylaxe zur Vermeidung des Wiederauftretens betrieben werden („Sekundärprophylaxe“). ⓘ
Meldepflicht
Nach dem Recht Sachsens besteht nach der Verordnung des Sächsischen Staatsministeriums für Soziales und Verbraucherschutz über die Erweiterung der Meldepflicht für übertragbare Krankheiten und Krankheitserreger nach dem Infektionsschutzgesetz eine namentliche Meldepflicht bezüglich Erkrankung und Tod an angeborener und sonstiger Toxoplasmose. ⓘ