Citronensäure
|
| |||
| Bezeichnungen | |||
|---|---|---|---|
| IUPAC-Bezeichnung
Zitronensäure
| |||
| Bevorzugte IUPAC-Bezeichnung
2-Hydroxypropan-1,2,3-tricarboxylsäure | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
| EC-Nummer |
| ||
IUPHAR/BPS
|
|||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C6H8O7 | ||
| Molare Masse | 192,123 g/mol (wasserfrei), 210,14 g/mol (Monohydrat) | ||
| Erscheinungsbild | weißer Feststoff | ||
| Geruch | Geruchlos | ||
| Dichte | 1,665 g/cm3 (wasserfrei) 1,542 g/cm3 (18 °C, Monohydrat) | ||
| Schmelzpunkt | 156 °C (313 °F; 429 K) | ||
| Siedepunkt | 310 °C (590 °F; 583 K) zersetzt sich ab 175 °C | ||
Löslichkeit in Wasser
|
54% w/w (10 °C) 59,2 % w/w (20 °C) 64,3 % w/w (30 °C) 68,6 % w/w (40 °C) 70,9 % w/w (50 °C) 73,5 % Gew./Gew. (60 °C) 76,2 % Gew./Gew. (70 °C) 78,8% w/w (80 °C) 81,4 % w/w (90 °C) 84% w/w (100 °C) | ||
| Löslichkeit | Löslich in Aceton, Alkohol, Ether, Ethylacetat, DMSO Unlöslich in C 6H 6, CHCl3, CS2, Toluol | ||
| Löslichkeit in Ethanol | 62 g/100 g (25 °C) | ||
| Löslichkeit in Amylacetat | 4,41 g/100 g (25 °C) | ||
| Löslichkeit in Diethylether | 1,05 g/100 g (25 °C) | ||
| Löslichkeit in 1,4-Dioxan | 35,9 g/100 g (25 °C) | ||
| log P | −1.64 | ||
| Acidität (pKa) | pKa1 = 3,13 pKa2 = 4,76 pKa3 = 6,39, 6,40 | ||
Brechungsindex (nD)
|
1.493-1.509 (20 °C) 1.46 (150 °C) | ||
| Viskosität | 6,5 cP (50%ige wässrige Lösung) | ||
| Struktur | |||
Kristallstruktur
|
Monoklin | ||
| Thermochemie | |||
Wärmekapazität (C)
|
226,51 J/(mol-K) (26,85 °C) | ||
Std. molare
Entropie (S |
252,1 J/(mol-K) | ||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-1543,8 kJ/mol | ||
Verbrennungswärme, höherer Wert (HHV)
|
1985,3 kJ/mol (474,5 kcal/mol, 2,47 kcal/g), 1960,6 kJ/mol 1972,34 kJ/mol (471,4 kcal/mol, 2,24 kcal/g) (Monohydrat) | ||
| Pharmakologie | |||
ATC-Code
|
A09AB04 (WHO) | ||
| Gefahren | |||
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |||
Hauptgefahren
|
Haut- und augenreizend | ||
| GHS-Kennzeichnung: | |||
Piktogramme
|
 
| ||
Signalwort
|
Warnhinweis | ||
Gefahrenhinweise
|
H290, H319, H315 | ||
Sicherheitshinweise
|
P305+P351+P338 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | 155 °C (311 °F; 428 K) | ||
Selbstentzündung
temperatur |
345 °C (653 °F; 618 K) | ||
| Explosionsgrenzen | 8% | ||
| Tödliche Dosis oder Konzentration (LD, LC): | |||
LD50 (mittlere Dosis)
|
3000 mg/kg (Ratten, oral) | ||
| Sicherheitsdatenblatt (SDS) | HMDB | ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Materialien in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
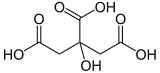
Zitronensäure ist eine organische Verbindung mit der chemischen Formel HOC(CO2H)(CH2CO2H)2. Sie ist eine farblose schwache organische Säure. Sie kommt natürlich in Zitrusfrüchten vor. In der Biochemie ist sie ein Zwischenprodukt im Zitronensäurezyklus, der im Stoffwechsel aller aeroben Organismen abläuft. ⓘ
Jährlich werden mehr als zwei Millionen Tonnen Zitronensäure hergestellt. Sie wird häufig als Säuerungsmittel, als Aromastoff und als Chelatbildner verwendet. ⓘ
Ein Citrat ist ein Derivat der Zitronensäure, d. h. der Salze, Ester und des mehratomigen Anions, das in Lösung vorliegt. Ein Beispiel für ein Salz ist Trinatriumcitrat, ein Ester ist Triethylcitrat. Als Teil eines Salzes wird die Formel des Citratanions als C
6H
5O3-
7 oder C
3H
5O(COO)3-
3. ⓘ
Citronensäure (alternative Schreibweise Zitronensäure) ist eine farblose, wasserlösliche Carbonsäure, die zu den Tricarbonsäuren und zu den Fruchtsäuren zählt. Neben der wasserfreien Variante existiert das Citronensäuremonohydrat (C6H8O7 · H2O), das pro Molekül Citronensäure ein Molekül Kristallwasser enthält. Die Salze und Ester der Citronensäure sind die Citrate. Ein Konstitutionsisomer der Citronensäure ist die Isocitronensäure. ⓘ
Natürliches Vorkommen und industrielle Produktion

Zitronensäure kommt in einer Vielzahl von Obst- und Gemüsesorten vor, vor allem in Zitrusfrüchten. Zitronen und Limetten weisen besonders hohe Konzentrationen dieser Säure auf; sie kann bis zu 8 % des Trockengewichts dieser Früchte ausmachen (etwa 47 g/L im Saft). Die Konzentrationen von Zitronensäure in Zitrusfrüchten reichen von 0,005 mol/l bei Orangen und Grapefruits bis zu 0,30 mol/l bei Zitronen und Limetten; diese Werte variieren innerhalb der Arten je nach Sorte und den Bedingungen, unter denen die Früchte gewachsen sind. ⓘ
Zitronensäure wurde erstmals 1784 von dem Chemiker Carl Wilhelm Scheele isoliert, der sie aus Zitronensaft kristallisierte. ⓘ
Die industrielle Herstellung von Zitronensäure begann 1890 nach dem Vorbild der italienischen Zitrusfruchtindustrie, wo der Saft mit Kalkhydrat (Calciumhydroxid) behandelt wurde, um Calciumcitrat auszufällen, das isoliert und mit verdünnter Schwefelsäure in die Säure zurückverwandelt wurde. Im Jahr 1893 entdeckte C. Wehmer, dass der Schimmelpilz Penicillium Zitronensäure aus Zucker herstellen kann. Die mikrobielle Produktion von Zitronensäure erlangte jedoch erst dann industrielle Bedeutung, als der Erste Weltkrieg die italienischen Zitrusexporte unterbrach. ⓘ
Im Jahr 1917 entdeckte der amerikanische Lebensmittelchemiker James Currie, dass bestimmte Stämme des Schimmelpilzes Aspergillus niger effiziente Zitronensäureproduzenten sein konnten, und das Pharmaunternehmen Pfizer begann zwei Jahre später mit der industriellen Produktion nach dieser Technik, gefolgt von Citrique Belge im Jahr 1929. Bei dieser Produktionstechnik, die auch heute noch der wichtigste industrielle Weg zur Herstellung von Zitronensäure ist, werden A. niger-Kulturen mit einem sucrose- oder glucosehaltigen Medium gefüttert, um Zitronensäure zu produzieren. Die Zuckerquelle ist Maisquellwasser, Melasse, hydrolysierte Maisstärke oder eine andere kostengünstige zuckerhaltige Lösung. Nachdem der Schimmelpilz aus der resultierenden Lösung herausgefiltert wurde, wird die Zitronensäure durch Ausfällen mit Calciumhydroxid isoliert, um das Calciumcitratsalz zu erhalten, aus dem die Zitronensäure durch Behandlung mit Schwefelsäure regeneriert wird, wie bei der direkten Extraktion aus Zitrusfruchtsaft. ⓘ
1977 wurde den Gebrüdern Lever ein Patent für die chemische Synthese von Zitronensäure ausgehend von Aconit- oder Isocitrat/Aloisocitrat-Calciumsalzen unter Hochdruckbedingungen erteilt; dabei wurde Zitronensäure in nahezu quantitativer Umwandlung durch eine offenbar umgekehrte, nicht enzymatische Krebszyklusreaktion hergestellt. ⓘ
Die weltweite Produktion lag im Jahr 2018 bei über 2.000.000 Tonnen. Mehr als 50 % dieser Menge wurde in China hergestellt. Mehr als 50 % wurden als Säureregulator in Getränken verwendet, etwa 20 % in anderen Lebensmittelanwendungen, 20 % für Waschmittelanwendungen und 10 % für andere Anwendungen als Lebensmittel, wie Kosmetika, Pharmazeutika und in der chemischen Industrie. ⓘ
Chemische Eigenschaften

Zitronensäure kann in wasserfreier Form oder als Monohydrat gewonnen werden. Die wasserfreie Form kristallisiert aus heißem Wasser, während sich das Monohydrat bildet, wenn Zitronensäure aus kaltem Wasser kristallisiert wird. Das Monohydrat kann bei etwa 78 °C in die wasserfreie Form überführt werden. Zitronensäure löst sich auch in absolutem (wasserfreiem) Ethanol (76 Teile Zitronensäure auf 100 Teile Ethanol) bei 15 °C. Oberhalb von etwa 175 °C zersetzt sie sich unter Verlust von Kohlendioxid. ⓘ
Zitronensäure ist eine dreibasische Säure mit pKa-Werten, extrapoliert auf die Ionenstärke Null, von 3,128, 4,761 und 6,396 bei 25 °C. Der pKa-Wert der Hydroxylgruppe wurde mit Hilfe der 13C-NMR-Spektroskopie auf 14,4 bestimmt. Das Speziationsdiagramm zeigt, dass Lösungen von Zitronensäure Pufferlösungen zwischen etwa pH 2 und pH 8 sind. In biologischen Systemen um pH 7 sind die beiden vorhandenen Spezies das Citrat-Ion und das Mono-Hydrogen-Citrat-Ion. Der SSC 20X-Hybridisierungspuffer ist ein häufig verwendetes Beispiel. Es sind Tabellen für biochemische Studien verfügbar. ⓘ
Andererseits liegt der pH-Wert einer 1 mM-Lösung von Zitronensäure bei etwa 3,2. Der pH-Wert von Fruchtsäften aus Zitrusfrüchten wie Orangen und Zitronen hängt von der Zitronensäurekonzentration ab, wobei eine höhere Konzentration von Zitronensäure zu einem niedrigeren pH-Wert führt. ⓘ
Saure Salze der Zitronensäure können durch sorgfältige Einstellung des pH-Wertes vor der Kristallisation der Verbindung hergestellt werden. Siehe z. B. Natriumcitrat. ⓘ
Das Citrat-Ion bildet Komplexe mit metallischen Kationen. Die Stabilitätskonstanten für die Bildung dieser Komplexe sind aufgrund des Chelat-Effekts recht groß. Daher bildet es auch mit Alkalimetallkationen Komplexe. Wenn jedoch ein Chelatkomplex mit allen drei Carboxylatgruppen gebildet wird, haben die Chelatringe 7 und 8 Glieder, die im Allgemeinen thermodynamisch weniger stabil sind als kleinere Chelatringe. Infolgedessen kann die Hydroxylgruppe deprotoniert werden und einen Teil eines stabileren 5-gliedrigen Rings bilden, wie in Ammoniumeisen(III)-citrat, (NH
4)
5Fe(C
6H
4O
7)
2-2H
2O. ⓘ
Zitronensäure kann an einer oder mehreren ihrer drei Carbonsäuregruppen verestert werden, wobei eine Vielzahl von Mono-, Di-, Tri- und Mischestern entsteht. ⓘ
Biochemie
Zitronensäure-Zyklus
Citrat ist ein Zwischenprodukt im Zitronensäurezyklus, auch bekannt als TCA-Zyklus (Tricarbonsäurezyklus) oder Krebszyklus, einem zentralen Stoffwechselweg für Tiere, Pflanzen und Bakterien. Die Citrat-Synthase katalysiert die Kondensation von Oxalacetat mit Acetyl-CoA unter Bildung von Citrat. Citrat dient dann als Substrat für Aconitase und wird in Aconitsäure umgewandelt. Der Zyklus endet mit der Regeneration von Oxalacetat. Diese Reihe chemischer Reaktionen ist die Quelle von zwei Dritteln der aus der Nahrung gewonnenen Energie in höheren Organismen. Hans Adolf Krebs erhielt für diese Entdeckung 1953 den Nobelpreis für Physiologie oder Medizin. ⓘ
Einige Bakterien (vor allem E. coli) können Citrat im Rahmen ihres TCA-Zyklus selbst herstellen und verbrauchen, sind aber nicht in der Lage, es als Nahrung zu verwenden, da ihnen die Enzyme fehlen, die für den Import in die Zelle erforderlich sind. Nach Zehntausenden von Evolutionen in einem minimalen Glukosemedium, das auch Citrat enthielt, entwickelte sich im Rahmen des Langzeitevolutionsexperiments von Richard Lenski eine Variante von E. coli, die in der Lage ist, aerob auf Citrat zu wachsen. Zachary Blount, ein Student von Lenski, und Kollegen untersuchten diese "Cit+"-E. coli als Modell dafür, wie sich neue Eigenschaften entwickeln. Sie fanden Hinweise darauf, dass die Innovation in diesem Fall durch eine seltene Duplikationsmutation aufgrund der Anhäufung mehrerer vorheriger "potenzierender" Mutationen verursacht wurde, deren Identität und Auswirkungen noch untersucht werden. Die Entwicklung des Cit+-Merkmals gilt als bemerkenswertes Beispiel für die Rolle historischer Zufälligkeiten in der Evolution. ⓘ
Andere biologische Funktionen
Citrat kann aus den Mitochondrien in das Zytoplasma transportiert und dort in Acetyl-CoA für die Fettsäuresynthese und in Oxalacetat aufgespalten werden. Citrat ist ein positiver Modulator dieser Umwandlung und reguliert allosterisch das Enzym Acetyl-CoA-Carboxylase, das das regulierende Enzym bei der Umwandlung von Acetyl-CoA in Malonyl-CoA ist (der entscheidende Schritt bei der Fettsäuresynthese). Kurz gesagt, Citrat wird ins Zytoplasma transportiert, in Acetyl-CoA umgewandelt, das dann von der Acetyl-CoA-Carboxylase, die durch Citrat allosterisch moduliert wird, in Malonyl-CoA umgewandelt wird. ⓘ
Hohe Konzentrationen von zytosolischem Citrat können die Phosphofructokinase, den Katalysator eines ratenbegrenzenden Schritts der Glykolyse, hemmen. Diese Wirkung ist vorteilhaft: Hohe Citratkonzentrationen deuten darauf hin, dass ein großer Vorrat an biosynthetischen Vorläufermolekülen vorhanden ist, so dass die Phosphofructokinase keine weiteren Moleküle ihres Substrats, Fructose-6-phosphat, in die Glykolyse schicken muss. Citrat verstärkt die hemmende Wirkung hoher ATP-Konzentrationen, ein weiteres Zeichen dafür, dass keine Glykolyse durchgeführt werden muss. ⓘ
Citrat ist ein wichtiger Bestandteil des Knochens und trägt zur Regulierung der Größe der Apatitkristalle bei. ⓘ
Anwendungen
Lebensmittel und Getränke

Da sie zu den stärkeren Speisesäuren gehört, wird Zitronensäure hauptsächlich als Geschmacks- und Konservierungsstoff in Lebensmitteln und Getränken verwendet, insbesondere in Erfrischungsgetränken und Süßigkeiten. In der Europäischen Union wird sie mit der E-Nummer E330 bezeichnet. Zitratsalze verschiedener Metalle werden in vielen Nahrungsergänzungsmitteln verwendet, um diese Mineralien in einer biologisch verfügbaren Form zu liefern. Zitronensäure hat 247 kcal pro 100 g. In den Vereinigten Staaten werden die Reinheitsanforderungen für Zitronensäure als Lebensmittelzusatzstoff durch den Food Chemicals Codex festgelegt, der von der United States Pharmacopoeia (USP) veröffentlicht wird. ⓘ
Zitronensäure kann Eiscreme als Emulgator zugesetzt werden, um die Trennung von Fetten zu verhindern, oder Karamell, um das Auskristallisieren von Saccharose zu verhindern, oder in Rezepten anstelle von frischem Zitronensaft. Zitronensäure wird zusammen mit Natriumbicarbonat in einer Vielzahl von Brauseprodukten verwendet, sowohl zum Einnehmen (z. B. Pulver und Tabletten) als auch für die Körperpflege (z. B. Badesalz, Badebomben und Fettentferner). Zitronensäure in trockener, pulverförmiger Form wird auf Märkten und in Lebensmittelläden häufig als "saures Salz" verkauft, da es physisch dem Kochsalz ähnelt. Sie wird in der Küche als Alternative zu Essig oder Zitronensaft verwendet, wenn eine reine Säure benötigt wird. Zitronensäure kann in Lebensmittelfarben verwendet werden, um den pH-Wert eines normalerweise basischen Farbstoffs auszugleichen. ⓘ
Reinigungs- und Chelatbildner

Zitronensäure ist ein ausgezeichneter Chelatbildner, der Metalle bindet, indem er sie löslich macht. Sie wird zur Entfernung und Verhinderung von Kalkablagerungen in Kesseln und Verdampfern eingesetzt. Es kann zur Wasseraufbereitung verwendet werden, wodurch es die Wirksamkeit von Seifen und Waschmitteln verbessert. Indem sie die Metalle in hartem Wasser chelatiert, sorgt sie dafür, dass diese Reiniger Schaum produzieren und besser funktionieren, ohne dass eine Wasserenthärtung erforderlich ist. Zitronensäure ist der Wirkstoff in einigen Reinigungslösungen für Bad und Küche. Eine Lösung mit einer sechsprozentigen Konzentration von Zitronensäure entfernt harte Wasserflecken von Glas ohne Schrubben. Zitronensäure kann in Shampoos verwendet werden, um Wachs und Farbstoffe aus dem Haar auszuwaschen. Aufgrund ihrer chelatbildenden Eigenschaften war Zitronensäure das erste erfolgreiche Elutionsmittel, das während des Manhattan-Projekts in den 1940er Jahren für die vollständige Ionenaustauschtrennung von Lanthaniden verwendet wurde. In den 1950er Jahren wurde sie durch das weitaus effizientere EDTA ersetzt. ⓘ
In der Industrie wird es zum Lösen von Rost aus Stahl und zur Passivierung von rostfreiem Stahl verwendet. ⓘ
Kosmetika, Pharmazeutika, Nahrungsergänzungsmittel und Lebensmittel
Zitronensäure wird als Säuerungsmittel in Cremes, Gelen und Flüssigkeiten verwendet. In Lebensmitteln und Nahrungsergänzungsmitteln kann sie als Verarbeitungshilfsstoff eingestuft werden, wenn sie aufgrund einer technischen oder funktionellen Wirkung zugesetzt wurde (z. B. als Säuerungsmittel, Chelatbildner, Viskositätsregler usw.). Wenn sie nur noch in unbedeutenden Mengen vorhanden ist und die technische oder funktionelle Wirkung nicht mehr gegeben ist, kann sie von der Kennzeichnungspflicht ausgenommen werden <21 CFR §101.100(c)>. ⓘ
Zitronensäure ist eine Alphahydroxysäure und ist ein aktiver Bestandteil von chemischen Hautpeelings. ⓘ
Zitronensäure wird im Allgemeinen als Puffer verwendet, um die Löslichkeit von braunem Heroin zu erhöhen. ⓘ
Zitronensäure wird als einer der Wirkstoffe bei der Herstellung von Gesichtstüchern mit antiviralen Eigenschaften verwendet. ⓘ
Andere Verwendungen
Die Puffereigenschaften von Zitraten werden zur Kontrolle des pH-Werts in Haushaltsreinigern und Arzneimitteln verwendet. ⓘ
Zitronensäure wird als geruchlose Alternative zu weißem Essig zum Färben von Stoffen mit sauren Farbstoffen verwendet. ⓘ
Natriumcitrat ist ein Bestandteil des Benedict-Reagenzes, das sowohl für die qualitative als auch die quantitative Bestimmung von reduzierenden Zuckern verwendet wird. ⓘ
Zitronensäure kann als Alternative zu Salpetersäure bei der Passivierung von rostfreiem Stahl verwendet werden. ⓘ
Zitronensäure kann als geruchsarmes Stoppbad bei der Entwicklung fotografischer Filme verwendet werden. Da fotografische Entwickler alkalisch sind, wird eine milde Säure verwendet, um ihre Wirkung schnell zu neutralisieren und zu stoppen, aber die üblicherweise verwendete Essigsäure hinterlässt in der Dunkelkammer einen starken Essiggeruch. ⓘ
Zitronensäure/Kalium-Natrium-Citrat kann als Blutsäureregulator verwendet werden. ⓘ
Zitronensäure ist ein ausgezeichnetes Flussmittel zum Löten, entweder trocken oder als konzentrierte Lösung in Wasser. Sie sollte nach dem Löten entfernt werden, insbesondere bei feinen Drähten, da sie leicht ätzend ist. Sie löst sich in heißem Wasser auf und lässt sich schnell abspülen. ⓘ
Synthese von anderen organischen Verbindungen
Zitronensäure ist ein vielseitiger Ausgangsstoff für viele andere organische Verbindungen. Durch Dehydratisierung erhält man Itaconsäure und ihr Anhydrid. Zitronensäure kann durch thermische Isomerisierung von Itaconsäureanhydrid hergestellt werden. Das benötigte Itaconsäureanhydrid wird durch trockene Destillation von Zitronensäure gewonnen. Aconitsäure kann durch Dehydratisierung von Zitronensäure mit Schwefelsäure synthetisiert werden:
- (HO2CCH2)2C(OH)CO2H → HO2CCH=C(CO2H)CH2CO2H + H2O ⓘ
Acetondicarbonsäure kann auch durch Decarbonylierung von Zitronensäure in rauchender Schwefelsäure hergestellt werden: ⓘ
Sicherheit
Obwohl es sich um eine schwache Säure handelt, kann der Kontakt mit reiner Zitronensäure schädliche Auswirkungen haben. Das Einatmen kann Husten, Kurzatmigkeit oder Halsschmerzen verursachen. Übermäßiger Verzehr kann zu Bauchschmerzen und Halsschmerzen führen. Der Kontakt von konzentrierten Lösungen mit Haut und Augen kann zu Rötungen und Schmerzen führen. Langfristiger oder wiederholter Konsum kann zu Erosion des Zahnschmelzes führen. ⓘ
Kompendienstatus
- Britische Pharmakopöe
- Japanisches Arzneibuch ⓘ
Geschichte
Carl Wilhelm Scheele isolierte 1784 erstmals Citronensäure aus Zitronensaft – daher der Name. Allerdings dürfte Citronensäure schon den ersten Alchemisten bekannt gewesen sein, wenn auch unter anderem Namen. Bereits im 9. Jahrhundert soll der arabische Alchemist Dschābir ibn Hayyān (Geber) Citronensäure entdeckt haben. ⓘ

Vorkommen
Citronensäure ist eine der im Pflanzenreich am weitesten verbreiteten Säuren und tritt als Stoffwechselprodukt in allen Organismen auf. Zitronensaft enthält beispielsweise 5–7 % Citronensäure. Sie kommt aber auch in Äpfeln, Birnen, Sauerkirschen, Himbeeren, Brombeeren, Johannisbeeren, in Nadelhölzern, Pilzen, Tabakblättern, im Wein und sogar in der Milch vor. ⓘ
Citronensäure ist weit verbreitet, weil sie (namengebend) als Zwischenprodukt im Citratzyklus (auch Tricarbonsäurezyklus, Krebszyklus) auftritt. Dieser Prozess nimmt eine Schlüsselrolle im Kohlenhydrat- und Fettsäure-Stoffwechsel aller sauerstoffverbrauchenden Lebewesen einschließlich des Menschen ein. Dieser Zyklus liefert auch die molekularen Grundstrukturen für den Aufbau der meisten Aminosäuren. ⓘ
Gewinnung und Darstellung
Herstellung aus Zitrusfrüchten
Nach dem ursprünglichen Verfahren wurde Citronensäure aus Zitrusfrüchten gewonnen. Zitronensaft wurde mit konzentrierter Ammoniaklösung versetzt, eingedickt und filtriert. Das leicht lösliche Ammoniumcitrat wurde durch Fällung mit Calciumchlorid in schwerer lösliches Calciumcitrat umgewandelt. Die Lösung wurde erneut filtriert und der Filterkuchen in 25%iger Schwefelsäure gelöst, wobei noch schlechter lösliches Calciumsulfat (Gips) ausfällt. Nach erneuter Filtration wird eine Citronensäurelösung gewonnen. Die reine Citronensäure erhält man durch Kristallisation. ⓘ
Biotechnische Herstellung
Industriell stellt man Citronensäure durch Fermentation zuckerhaltiger Rohstoffe wie Melasse und Mais her. Für die Fermentation werden Aspergillus-niger-Stämme verwendet. Vor allem in den USA und in China kommen oft transgene Varianten des Schimmelpilzes zum Einsatz, in Europa ist dies nicht gestattet. Bei der Citronensäure-Produktion müssen besonders drei Bedingungen erfüllt sein:
- Hoher Glucose- und Sauerstoffgehalt im Nährmedium
- Niedriger pH-Wert (pH < 3). Dieser hemmt zum einen das Folgeenzym der Citratsynthase im Citratzyklus, die Aconitase. Ein solch niedriger pH-Wert liegt fern des pH-Optimums des Enzyms und senkt dessen Aktivität stark ab. Dies führt dazu, dass die Pilze die Citronensäure nur in geringem Maße weiter verstoffwechseln. Zum anderen wird die Außenmembran der Pilzzellen instabil und die Citronensäure wird in das Außenmedium abgegeben. Hinzu kommt, dass die Kontaminationsgefahr durch unerwünschte Fremdorganismen bei derart niedrigem pH-Wert gering ist.
- Niedrige Fe2+-Konzentration (< 5 mg/l). Dadurch fehlt der Aconitase der Cofaktor. Die Fe2+-Ionen werden durch Zugabe von Kaliumhexacyanidoferrat(III) gebunden. Mn2+-Konzentrationen (< 2 µg/l) führen ebenfalls zu hohen Citrat-Ausbeuten.
Reinheit und Verträglichkeit der Citronensäure auf dem Markt zeigen große Unterschiede. Verschiedene Aspergillus-niger-Stämme produzieren unter bestimmten Wachstumsbedingungen Mykotoxine. Die Produktion dieser Stoffe findet unter kontrollierten Bedingungen nicht statt. In hoch aufgereinigter Citronensäure finden sich keine Rückstände von Schimmelpilzen. ⓘ
Eigenschaften

Physikalische Eigenschaften
Citronensäure bildet im wasserfreien Zustand rhombische Kristalle, die leicht sauer schmecken. Eine wässrige Lösung der Citronensäure leitet den elektrischen Strom, da die Carboxygruppen Protonen abspalten und somit bewegliche Ladungsträger (Ionen) in der Lösung vorliegen. Die Säuredissoziationskonstanten der Citronensäure sind pKs1 = 3,13, pKs2 = 4,76 und pKs3 = 6,4. Der teilweise beziehungsweise vollständig dissoziierte Säurerest der Citronensäure wird als Citrat bezeichnet. Für die Löslichkeit in Wasser werden in der Literatur stark abweichende Werte genannt. ⓘ
Chemische Eigenschaften

Citronensäure wird aufgrund ihrer drei Carboxygruppen (–COOH) zu den organischen Tricarbonsäuren gezählt. Zudem weist die Hydroxygruppe (–OH) an Position 3 des Kohlenstoffrückgrates sie als Hydroxycarbonsäure aus. Citronensäure ist ein Chelator für Metallionen. ⓘ
Citronensäure geht viele für Carbonsäuren typische Reaktionen ein:
- Deprotonierung/Salzbildung
- Substitutionsreaktionen am Carboxylkohlenstoff:
- Veresterung
- Halogenierung
- Anhydridbildung
- Amidierung ⓘ
Citronensäure kann mit verschiedenen Oxidationsmitteln (beispielsweise Peroxiden oder Hypochloriten) oxidiert werden. In Abhängigkeit von den Reaktionsbedingungen können dabei β-Ketoglutarsäure, Oxalsäure, Kohlendioxid und Wasser entstehen. ⓘ
In geringen Mengen eingenommen fördert Citronensäure indirekt das Knochenwachstum, weil sie die Aufnahme von Calcium begünstigt. In größeren Mengen wirkt sie jedoch toxisch (LD50 bei Ratten: 3 g/kg). ⓘ
Isomere
Bei der Isocitronensäure sitzt die Hydroxygruppe (–OH) an Position 2 des Kohlenstoffrückgrats. Sie unterscheidet sich von der Citronensäure durch die Stellung dieser Hydroxygruppe, die bei der Citronensäure an Position 3 ist. ⓘ
Isocitronensäure ⓘ
Verwendung

Citronensäure ist häufig in kalklösenden Reinigungsmitteln enthalten, da sie geruchlos ist. Durch die saure Wirkung löst sie Calciumcarbonat zum wasserlöslichen Calcium-dicitrato-Komplex, einen typischen Chelatkomplex [Ca(Cit)2]4−. Der Komplex zerfällt durch steigende Temperatur und steigenden pH-Wert, es fällt wasserunlösliches Calciumcitrat Ca3(Cit)2 aus. Bei einem Überschuss an Citronensäure löst sich Calciumcitrat wieder. Es wird aufgrund der Verstopfungsgefahr nicht empfohlen, Citronensäure-Lösung als Entkalker für erhitzte pumpenbetriebene Rohrleitungssysteme wie Kaffeemaschinen oder Wärmetauscher anzuwenden. ⓘ
Zum Lösen von Kalk- sowie Eisen- und Manganverbindungen, die sich bei der Verockerung von Brunnen bilden, wird Citronensäure gemeinsam mit einer geringen Zugabe von Ascorbinsäure als Reduktionsmittel (alternativ Natriumdithionit) eingesetzt. ⓘ
Citronensäure und ihre Salze werden zur Konservierung und auch zur Homogenisierung als Schmelzsalz sowie als Säuerungsmittel bzw. Säureregulator von Lebensmitteln verwendet, beispielsweise in Getränken. In Brausepulver und -stäbchen ist sie zusammen mit Natriumhydrogencarbonat enthalten. Als natürlicher Bestandteil der meisten Früchte ist sie in Fruchtsäften (Fruchtsäuren) enthalten. Citronensäure ist in der EU als Lebensmittelzusatzstoff unter der Nummer E 330 in den meisten Lebensmitteln unbegrenzt zugelassen. Eine Ausnahme bilden Schokoladenerzeugnisse und Fruchtsäfte, für die nur eine begrenzte Zulassung vorliegt, sowie einige Lebensmittel, wie zum Beispiel Honig, Milch und Butter, für die keine Zulassung vorliegt. Da sie als Peptisator wirkt, wird sie zur Herstellung stabiler Suspensionen eingesetzt. In Fischgerichten kann sie biogene Amine in nicht flüchtige Salze überführen und so den Fischgeruch mindern. ⓘ
Der vielfache Einsatz von Citronensäure in Lebensmitteln wird kritisiert, da sie als Komplexbildner Aluminium löst und dessen Resorption erhöht. Citronensäure löst Calcium sowie andere Mineralstoffe aus dem Zahnschmelz, dies begünstigt die Entstehung von Karies bzw. Zahnerosion. ⓘ
Citronensäure und Citrate verhindern die Blutgerinnung. Deshalb konserviert man Blutspenden in Beuteln, die eine Citratpufferlösung enthalten. Für Gerinnungsanalysen verwendet man Citratblut, bei dem Blut mit Citrat im Verhältnis 9:1 (9 Teile Blut + 1 Teil 0,11 mol/l Natriumcitrat) gemischt wird. Eine spezielle Verwendung ist der Einsatz in Zellseparatoren. Dabei wird aus einer Vene Blut entnommen, im Gerät werden die gewünschten Blutbestandteile (zum Beispiel Thrombozyten) abgetrennt, und das restliche Blut wird in die Vene zurückgeführt. Damit das Blut im Gerät keine gefährlichen Gerinnsel bildet, wird es mit Citratpuffer versetzt. ⓘ
Citronensäure wird wie auch EDTA als Spüllösung bei Wurzelkanalbehandlungen in der Zahnmedizin verwendet. ⓘ
Weitere Einsatzgebiete der Citronensäure:
- Citronensäure wird als Wasserenthärter und alternativer Weichspüler eingesetzt.
- Citronensäure wird zur Passivierung von rostfreiem Edelstahl verwendet. Bei diesem Verfahren werden die freien Eisenanteile aus der Oberfläche gelöst. Dadurch wird das Chrom-Eisen-Verhältnis beeinflusst, was zu einer Verbesserung der Passivschicht und damit zur Verbesserung des Korrosionsschutzes führt.
- Citronensäure wird zur pH-Wert-Einstellung von Kosmetika, z. B. Hautpflegelotion oder -creme, verwendet.
- In hoher Dosierung dient Citronensäure auch als Rostentferner.
- Citronensäure wird als Katalysator bei der Biokohleherstellung durch Hydrothermale Carbonisierung verwendet. ⓘ
Citronensäuretrimethylester, Citronensäuretriethylester und Citronensäuretri-n-butylester werden unter anderem als Weichmacher verwendet. ⓘ