Aktionspotential

In der Physiologie spricht man von einem Aktionspotenzial (AP), wenn das Membranpotenzial einer bestimmten Zelle schnell ansteigt und abfällt. Diese Depolarisierung führt dann dazu, dass benachbarte Stellen in ähnlicher Weise depolarisiert werden. Aktionspotenziale treten in verschiedenen Arten von tierischen Zellen auf, die als erregbare Zellen bezeichnet werden und zu denen Neuronen, Muskelzellen, endokrine Zellen und einige Pflanzenzellen gehören. ⓘ
In Neuronen spielen Aktionspotenziale eine zentrale Rolle bei der Kommunikation von Zelle zu Zelle, indem sie die Ausbreitung von Signalen entlang des Neuronenaxons in Richtung der synaptischen Boutons an den Enden des Axons ermöglichen oder - im Hinblick auf die saltatorische Leitung - unterstützen; diese Signale können dann mit anderen Neuronen an Synapsen oder mit motorischen Zellen oder Drüsen verbunden werden. Bei anderen Zelltypen besteht ihre Hauptfunktion darin, intrazelluläre Prozesse zu aktivieren. In Muskelzellen zum Beispiel ist ein Aktionspotenzial der erste Schritt in der Kette von Ereignissen, die zu einer Kontraktion führen. In den Betazellen der Bauchspeicheldrüse lösen sie die Freisetzung von Insulin aus. Aktionspotenziale in Neuronen werden auch als "Nervenimpulse" oder "Spikes" bezeichnet, und die zeitliche Abfolge der von einem Neuron erzeugten Aktionspotenziale wird als "Spike Train" bezeichnet. Ein Neuron, das ein Aktionspotenzial oder einen Nervenimpuls aussendet, wird oft als "feuernd" bezeichnet. ⓘ
Aktionspotenziale werden durch spezielle Arten von spannungsgesteuerten Ionenkanälen in der Plasmamembran einer Zelle erzeugt. Diese Kanäle sind geschlossen, wenn sich das Membranpotenzial in der Nähe des (negativen) Ruhepotenzials der Zelle befindet. Sie öffnen sich jedoch schnell, wenn das Membranpotenzial auf eine genau definierte Schwellenspannung ansteigt, wodurch das Transmembranpotenzial depolarisiert wird. Wenn sich die Kanäle öffnen, lassen sie einen Einstrom von Natriumionen zu, wodurch sich der elektrochemische Gradient ändert, was wiederum einen weiteren Anstieg des Membranpotenzials gegen Null bewirkt. Dies führt dazu, dass sich weitere Kanäle öffnen, wodurch ein größerer elektrischer Strom durch die Zellmembran fließt und so weiter. Der Prozess verläuft explosionsartig, bis alle verfügbaren Ionenkanäle geöffnet sind, was zu einem starken Anstieg des Membranpotenzials führt. Durch den raschen Einstrom von Natriumionen kehrt sich die Polarität der Plasmamembran um, und die Ionenkanäle werden rasch inaktiviert. Wenn sich die Natriumkanäle schließen, können die Natriumionen nicht mehr in das Neuron eindringen und werden dann aktiv aus der Plasmamembran zurücktransportiert. Daraufhin werden die Kaliumkanäle aktiviert, und es kommt zu einem Strom von Kaliumionen nach außen, wodurch der elektrochemische Gradient in den Ruhezustand zurückkehrt. Nach dem Auftreten eines Aktionspotenzials kommt es zu einer vorübergehenden negativen Verschiebung, der so genannten Nachhyperpolarisation. ⓘ
In tierischen Zellen gibt es zwei Haupttypen von Aktionspotenzialen. Die eine Art wird durch spannungsgesteuerte Natriumkanäle erzeugt, die andere durch spannungsgesteuerte Kalziumkanäle. Aktionspotenziale auf Natriumbasis dauern in der Regel weniger als eine Millisekunde, aber Aktionspotenziale auf Kalziumbasis können 100 Millisekunden oder länger dauern. In einigen Arten von Neuronen sind langsame Kalziumspitzen die treibende Kraft für einen langen Ausbruch von schnell ausgesandten Natriumspitzen. In Herzmuskelzellen hingegen dient eine anfängliche schnelle Natriumspitze als "Initialzündung", um das schnelle Einsetzen einer Kalziumspitze zu provozieren, die dann die Muskelkontraktion auslöst. ⓘ
Als Aktionspotential, abgekürzt AP, wird in der Physiologie eine vorübergehende charakteristische Abweichung des Membranpotentials einer Zelle vom Ruhepotential bezeichnet. Ein Aktionspotential bildet sich selbsttätig mit zelltypischem Verlauf bei einer Erregung (Exzitation) der Zelle und breitet sich als elektrisches Signal über die Zellmembran aus. Umgangssprachlich werden die Aktionspotentiale von Nervenzellen auch „Nervenimpuls“ genannt. ⓘ
Nur erregbare Zellen können auf Reize oder Signale hin Aktionspotentiale bilden, durch kurzfristige Änderungen der Membranleitfähigkeit infolge von Wechselwirkungen besonderer spannungsgesteuerter Ionenkanäle in ihrer Membran. Deren zeitabhängig unterschiedliche Aktivierung führt zu verschiedenen Ionenströmen mit entsprechend verschobenen Potentialdifferenzen. Daraus resultiert ein Aktionspotentialverlauf, bei dem auf die Phase der Depolarisation nach einem eventuellen Plateau die Phase der Repolarisation folgt, mit nachschwingender Hyperpolarisation. Dieser Vorgang läuft jeweils selbsttätig in typischer Form ab, wenn ein bestimmtes Schwellenpotential überschritten wird, und ist erst nach einer gewissen Refraktärzeit wieder auslösbar. ⓘ
Daneben kommen Aktionspotentiale auch in Einzellern vor – beispielsweise bei Pantoffeltierchen und Kieselalgen – sowie ebenfalls bei mehrzelligen Algen (Armleuchteralgen), Gefäßpflanzen (Mimose) und Pilzen. ⓘ
Übersicht

Nahezu alle Zellmembranen in Tieren, Pflanzen und Pilzen halten eine Spannungsdifferenz zwischen dem Äußeren und dem Inneren der Zelle aufrecht, das so genannte Membranpotenzial. Eine typische Spannung über einer tierischen Zellmembran beträgt -70 mV. Das bedeutet, dass das Innere der Zelle eine negative Spannung gegenüber dem Äußeren aufweist. Bei den meisten Zelltypen bleibt das Membranpotenzial in der Regel ziemlich konstant. Einige Zelltypen sind jedoch in dem Sinne elektrisch aktiv, dass ihre Spannungen im Laufe der Zeit schwanken. Bei einigen Arten von elektrisch aktiven Zellen, wie z. B. Neuronen und Muskelzellen, treten die Spannungsschwankungen häufig in Form einer schnellen (positiven) Spitze auf, gefolgt von einem schnellen Abfall. Diese Auf- und Abwärtszyklen werden als Aktionspotenziale bezeichnet. Bei einigen Arten von Neuronen findet der gesamte Auf- und Abwärtszyklus in wenigen Tausendstelsekunden statt. In Muskelzellen dauert ein typisches Aktionspotenzial etwa eine Fünftelsekunde. Bei einigen anderen Zelltypen und Pflanzen kann ein Aktionspotenzial drei Sekunden oder länger dauern. ⓘ
Die elektrischen Eigenschaften einer Zelle werden durch die Struktur der Membran bestimmt, die sie umgibt. Eine Zellmembran besteht aus einer Lipiddoppelschicht von Molekülen, in die größere Proteinmoleküle eingebettet sind. Die Lipiddoppelschicht ist sehr widerstandsfähig gegenüber der Bewegung elektrisch geladener Ionen, so dass sie wie ein Isolator wirkt. Die großen, in die Membran eingebetteten Proteine bilden dagegen Kanäle, durch die Ionen die Membran passieren können. Aktionspotenziale werden durch Kanalproteine gesteuert, deren Konfiguration in Abhängigkeit von der Spannungsdifferenz zwischen dem Inneren und dem Äußeren der Zelle zwischen geschlossenem und offenem Zustand wechselt. Diese spannungsempfindlichen Proteine werden als spannungsgesteuerte Ionenkanäle bezeichnet. ⓘ
Ablauf in einem typischen Neuron

Alle Zellen in tierischen Körpergeweben sind elektrisch polarisiert, d. h. sie halten eine Spannungsdifferenz über der Plasmamembran der Zelle aufrecht, die als Membranpotenzial bezeichnet wird. Diese elektrische Polarisierung ist das Ergebnis eines komplexen Zusammenspiels zwischen in die Membran eingebetteten Proteinstrukturen, den so genannten Ionenpumpen und Ionenkanälen. In Neuronen variieren die Arten von Ionenkanälen in der Membran in der Regel zwischen den verschiedenen Teilen der Zelle, wodurch die Dendriten, das Axon und der Zellkörper unterschiedliche elektrische Eigenschaften aufweisen. Infolgedessen können einige Teile der Membran eines Neurons erregbar sein (fähig, Aktionspotenziale zu erzeugen), während andere nicht erregbar sind. Jüngste Studien haben gezeigt, dass der erregbarste Teil eines Neurons der Teil nach dem Axonhügel (der Punkt, an dem das Axon den Zellkörper verlässt) ist, der als axonales Initialsegment bezeichnet wird, aber auch das Axon und der Zellkörper sind in den meisten Fällen erregbar. ⓘ
Jeder erregbare Membranabschnitt hat zwei wichtige Membranpotenziale: das Ruhepotenzial, d. h. den Wert, den das Membranpotenzial beibehält, solange die Zelle nicht gestört wird, und einen höheren Wert, das so genannte Schwellenpotenzial. Am Axonhügel eines typischen Neurons liegt das Ruhepotenzial bei etwa -70 Millivolt (mV) und das Schwellenpotenzial bei etwa -55 mV. Synaptische Eingänge in ein Neuron bewirken eine De- oder Hyperpolarisierung der Membran, d. h. sie bewirken einen Anstieg oder Abfall des Membranpotenzials. Aktionspotenziale werden ausgelöst, wenn sich genügend Depolarisationen ansammeln, um das Membranpotenzial auf den Schwellenwert zu bringen. Wenn ein Aktionspotenzial ausgelöst wird, schießt das Membranpotenzial abrupt nach oben und dann ebenso abrupt wieder nach unten, wobei es oft unter dem Ruhewert endet, wo es für eine gewisse Zeit verbleibt. Die Form des Aktionspotenzials ist stereotyp; das bedeutet, dass der Anstieg und der Abfall in der Regel für alle Aktionspotenziale in einer bestimmten Zelle ungefähr die gleiche Amplitude und den gleichen zeitlichen Verlauf haben. (Ausnahmen werden später in diesem Artikel behandelt). Bei den meisten Neuronen läuft der gesamte Prozess in etwa einer Tausendstelsekunde ab. Viele Arten von Neuronen senden ständig Aktionspotentiale mit einer Geschwindigkeit von bis zu 10-100 pro Sekunde aus. Es gibt jedoch auch Neuronen, die viel leiser sind und minutenlang oder länger keine Aktionspotenziale aussenden. ⓘ
Biophysikalische Grundlage
Aktionspotenziale entstehen durch das Vorhandensein spezieller Arten von spannungsgesteuerten Ionenkanälen in der Zellmembran. Ein spannungsgesteuerter Ionenkanal ist ein Transmembranprotein, das drei wesentliche Eigenschaften aufweist:
- Es ist in der Lage, mehr als eine Konformation anzunehmen.
- Mindestens eine der Konformationen schafft einen Kanal durch die Membran, der für bestimmte Ionenarten durchlässig ist.
- Der Übergang zwischen den Konformationen wird durch das Membranpotenzial beeinflusst. ⓘ
So ist ein spannungsgesteuerter Ionenkanal bei bestimmten Werten des Membranpotenzials tendenziell offen und bei anderen geschlossen. In den meisten Fällen ist die Beziehung zwischen Membranpotenzial und Kanalzustand jedoch probabilistisch und beinhaltet eine Zeitverzögerung. Ionenkanäle schalten zu unvorhersehbaren Zeiten zwischen verschiedenen Konformationen um: Das Membranpotenzial bestimmt die Geschwindigkeit der Übergänge und die Wahrscheinlichkeit pro Zeiteinheit für jede Art von Übergang. ⓘ

Spannungsgesteuerte Ionenkanäle sind in der Lage, Aktionspotenziale zu erzeugen, da sie positive Rückkopplungsschleifen auslösen können: Das Membranpotenzial steuert den Zustand der Ionenkanäle, aber der Zustand der Ionenkanäle steuert das Membranpotenzial. So kann in manchen Situationen ein Anstieg des Membranpotenzials dazu führen, dass sich Ionenkanäle öffnen, was einen weiteren Anstieg des Membranpotenzials zur Folge hat. Ein Aktionspotenzial entsteht, wenn dieser positive Rückkopplungszyklus (Hodgkin-Zyklus) explosionsartig abläuft. Der zeitliche Verlauf und die Amplitude des Aktionspotenzials werden durch die biophysikalischen Eigenschaften der spannungsgesteuerten Ionenkanäle bestimmt, die es erzeugen. Es gibt mehrere Arten von Kanälen, die in der Lage sind, die für die Erzeugung eines Aktionspotenzials erforderliche positive Rückkopplung zu erzeugen. Die spannungsabhängigen Natriumkanäle sind für die schnellen Aktionspotenziale verantwortlich, die bei der Nervenleitung auftreten. Langsamere Aktionspotenziale in Muskelzellen und einigen Arten von Neuronen werden von spannungsgesteuerten Kalziumkanälen erzeugt. Jeder dieser Typen kommt in mehreren Varianten mit unterschiedlicher Spannungsempfindlichkeit und unterschiedlicher zeitlicher Dynamik vor. ⓘ
Der am intensivsten untersuchte Typ von spannungsabhängigen Ionenkanälen sind die Natriumkanäle, die an der schnellen Nervenleitung beteiligt sind. Sie werden manchmal auch als Hodgkin-Huxley-Natriumkanäle bezeichnet, da sie zuerst von Alan Hodgkin und Andrew Huxley in ihren mit dem Nobelpreis ausgezeichneten Studien zur Biophysik des Aktionspotenzials charakterisiert wurden, können aber auch als NaV-Kanäle bezeichnet werden. (Das "V" steht für "Spannung".) Ein NaV-Kanal hat drei mögliche Zustände, die als deaktiviert, aktiviert und inaktiv bezeichnet werden. Der Kanal ist nur für Natriumionen durchlässig, wenn er sich im aktivierten Zustand befindet. Wenn das Membranpotenzial niedrig ist, verbringt der Kanal die meiste Zeit im deaktivierten (geschlossenen) Zustand. Wird das Membranpotenzial über ein bestimmtes Niveau angehoben, steigt die Wahrscheinlichkeit, dass der Kanal in den aktivierten (offenen) Zustand übergeht. Je höher das Membranpotenzial ist, desto größer ist die Wahrscheinlichkeit der Aktivierung. Sobald ein Kanal aktiviert ist, geht er schließlich in den inaktivierten (geschlossenen) Zustand über. Er neigt dann dazu, für einige Zeit inaktiv zu bleiben, aber wenn das Membranpotenzial wieder niedrig wird, geht der Kanal schließlich wieder in den deaktivierten Zustand über. Während eines Aktionspotenzials durchlaufen die meisten Kanäle dieses Typs den Zyklus deaktiviert→aktiviert→inaktiviert→deaktiviert. Dies ist jedoch nur das durchschnittliche Verhalten der Population - ein einzelner Kanal kann im Prinzip jeden Übergang zu jeder Zeit vollziehen. Die Wahrscheinlichkeit, dass ein Kanal vom inaktivierten Zustand direkt in den aktivierten Zustand übergeht, ist jedoch sehr gering: Ein Kanal im inaktivierten Zustand ist refraktär, bis er wieder in den deaktivierten Zustand übergegangen ist. ⓘ
All dies führt dazu, dass die Kinetik der NaV-Kanäle durch eine Übergangsmatrix bestimmt wird, deren Raten auf komplizierte Weise spannungsabhängig sind. Da diese Kanäle selbst eine wichtige Rolle bei der Bestimmung der Spannung spielen, kann die globale Dynamik des Systems recht schwierig zu berechnen sein. Hodgkin und Huxley gingen das Problem an, indem sie eine Reihe von Differentialgleichungen für die Parameter entwickelten, die den Zustand der Ionenkanäle bestimmen, die so genannten Hodgkin-Huxley-Gleichungen. Diese Gleichungen wurden durch spätere Forschungen erheblich modifiziert, bilden jedoch den Ausgangspunkt für die meisten theoretischen Studien zur Biophysik des Aktionspotenzials. ⓘ

Schlüssel: a) Natrium (Na+)-Ion. b) Kalium (K+)-Ion. c) Natriumkanal. d) Kaliumkanal. e) Natrium-Kalium-Pumpe.
In den Phasen eines Aktionspotenzials ändert sich die Durchlässigkeit der Membran des Neurons. Im Ruhezustand (1) können Natrium- und Kaliumionen die Membran nur in begrenztem Maße passieren, und das Neuron weist im Inneren eine negative Nettoladung auf. Sobald das Aktionspotenzial ausgelöst wird, aktiviert die Depolarisation (2) des Neurons Natriumkanäle, so dass Natriumionen durch die Zellmembran in die Zelle gelangen können, was zu einer positiven Nettoladung des Neurons im Verhältnis zur extrazellulären Flüssigkeit führt. Nach Erreichen des Spitzenwerts des Aktionspotenzials beginnt das Neuron mit der Repolarisation (3), bei der sich die Natriumkanäle schließen und die Kaliumkanäle öffnen, so dass Kaliumionen die Membran in die extrazelluläre Flüssigkeit passieren können und das Membranpotenzial wieder einen negativen Wert annimmt. Schließlich gibt es eine Refraktärzeit (4), in der die spannungsabhängigen Ionenkanäle inaktiviert werden, während die Na+- und K+-Ionen zu ihrer Ruheverteilung über die Membran zurückkehren (1), und das Neuron ist bereit, den Vorgang für das nächste Aktionspotenzial zu wiederholen. ⓘ
Wenn das Membranpotenzial ansteigt, öffnen sich die Natriumionenkanäle und ermöglichen den Eintritt von Natriumionen in die Zelle. Danach öffnen sich Kalium-Ionenkanäle, die den Austritt von Kalium-Ionen aus der Zelle ermöglichen. Der Einstrom von Natriumionen erhöht die Konzentration positiv geladener Kationen in der Zelle und bewirkt eine Depolarisation, bei der das Potenzial der Zelle höher ist als das Ruhepotenzial der Zelle. Die Natriumkanäle schließen sich auf dem Höhepunkt des Aktionspotenzials, während Kalium weiterhin die Zelle verlässt. Durch den Abfluss von Kaliumionen wird das Membranpotenzial gesenkt oder die Zelle hyperpolarisiert. Bei kleinen Spannungserhöhungen aus dem Ruhezustand übersteigt der Kaliumstrom den Natriumstrom, und die Spannung kehrt zu ihrem normalen Ruhewert zurück, typischerweise -70 mV. Steigt die Spannung jedoch über einen kritischen Schwellenwert, der in der Regel 15 mV über dem Ruhewert liegt, dominiert der Natriumstrom. Dies führt zu einem Runaway-Zustand, bei dem die positive Rückkopplung des Natriumstroms noch mehr Natriumkanäle aktiviert. Die Häufigkeit, mit der ein Neuron Aktionspotenziale auslöst, wird oft als Feuerungsrate oder neuronale Feuerungsrate bezeichnet. ⓘ
Die Ströme, die durch die Öffnung von spannungsgesteuerten Kanälen im Verlauf eines Aktionspotenzials erzeugt werden, sind in der Regel deutlich größer als der anfängliche Stimulationsstrom. Somit werden Amplitude, Dauer und Form des Aktionspotenzials weitgehend durch die Eigenschaften der erregbaren Membran und nicht durch die Amplitude oder Dauer des Stimulus bestimmt. Diese Alles-oder-Nichts-Eigenschaft des Aktionspotenzials unterscheidet es von abgestuften Potenzialen wie Rezeptorpotenzialen, elektrotonischen Potenzialen, unterschwelligen Membranpotenzialschwingungen und synaptischen Potenzialen, die mit der Stärke des Reizes skalieren. In vielen Zelltypen und Zellkompartimenten gibt es eine Vielzahl von Aktionspotenzialen, die durch die Arten von spannungsgesteuerten Kanälen, Leckkanälen, Kanalverteilungen, Ionenkonzentrationen, Membrankapazität, Temperatur und andere Faktoren bestimmt werden. ⓘ
Die wichtigsten an einem Aktionspotenzial beteiligten Ionen sind Natrium- und Kaliumkationen; Natriumionen treten in die Zelle ein und Kaliumionen verlassen sie, wodurch das Gleichgewicht wiederhergestellt wird. Es müssen relativ wenige Ionen die Membran passieren, damit sich die Membranspannung drastisch ändert. Die während eines Aktionspotenzials ausgetauschten Ionen bewirken daher eine vernachlässigbare Änderung der inneren und äußeren Ionenkonzentration. Die wenigen Ionen, die die Membran passieren, werden durch die kontinuierliche Tätigkeit der Natrium-Kalium-Pumpe wieder herausgepumpt, die zusammen mit anderen Ionentransportern das normale Verhältnis der Ionenkonzentrationen in der Membran aufrechterhält. Kalziumkationen und Chloridanionen sind an einigen Arten von Aktionspotenzialen beteiligt, wie z. B. am Aktionspotenzial des Herzens und am Aktionspotenzial der einzelligen Alge Acetabularia. ⓘ
Obwohl Aktionspotenziale lokal auf erregbaren Membranabschnitten erzeugt werden, können die daraus resultierenden Ströme Aktionspotenziale auf benachbarten Membranabschnitten auslösen, was zu einer dominoartigen Ausbreitung führt. Im Gegensatz zur passiven Ausbreitung elektrischer Potentiale (elektrotonisches Potential) werden Aktionspotentiale entlang erregbarer Membranabschnitte neu erzeugt und breiten sich ohne Abklingen aus. Myelinisierte Abschnitte von Axonen sind nicht erregbar und erzeugen keine Aktionspotenziale; das Signal wird passiv als elektrotonisches Potenzial weitergegeben. In regelmäßigen Abständen angeordnete nicht myelinisierte Abschnitte, die so genannten Ranvier-Knoten, erzeugen Aktionspotenziale, um das Signal zu verstärken. Diese Art der Signalausbreitung wird als saltatorische Leitung bezeichnet und bietet einen günstigen Kompromiss zwischen Signalgeschwindigkeit und Axondurchmesser. Die Depolarisierung von Axonendigungen löst im Allgemeinen die Freisetzung von Neurotransmittern in den synaptischen Spalt aus. Darüber hinaus wurden in den Dendriten von Pyramidenneuronen, die im Neokortex allgegenwärtig sind, rückwärts gerichtete Aktionspotentiale aufgezeichnet. Es wird angenommen, dass diese eine Rolle bei der spike-timing-abhängigen Plastizität spielen. ⓘ
Im Hodgkin-Huxley-Membrankapazitätsmodell war die Übertragungsgeschwindigkeit eines Aktionspotenzials nicht definiert, und es wurde angenommen, dass benachbarte Bereiche aufgrund der Interferenz freigesetzter Ionen mit benachbarten Kanälen depolarisiert wurden. Messungen der Ionendiffusion und der Ionenradien haben inzwischen gezeigt, dass dies nicht möglich ist. Darüber hinaus haben widersprüchliche Messungen der Entropieänderungen und des Zeitablaufs das Kapazitätsmodell als alleinige Ursache in Frage gestellt. Die Adsorptionshypothese von Gilbert Ling geht davon aus, dass das Membranpotenzial und das Aktionspotenzial einer lebenden Zelle auf die Adsorption mobiler Ionen an Adsorptionsstellen der Zellen zurückzuführen ist. ⓘ
In der Ausgangslage befindet sich die Zelle in Ruhe und weist ihr Ruhemembranpotential auf. Die Natriumkanäle sind nahezu alle geschlossen, nur bestimmte Kaliumkanäle sind geöffnet. Die Kaliumionen bestimmen so im Wesentlichen das Ruhemembranpotential. Bei allen Ionenbewegungen werden Richtung und Stärke durch die elektrochemischen Triebkräfte für die jeweiligen Ionen bestimmt. Vor allem Natriumionen strömen infolge des herrschenden Konzentrationsgefälles schnell in die Zelle, sobald sich die Kanäle dafür öffnen. ⓘ
Reifung der elektrischen Eigenschaften des Aktionspotenzials
Die Fähigkeit eines Neurons, ein Aktionspotenzial zu erzeugen und weiterzuleiten, ändert sich im Laufe der Entwicklung. Wie stark sich das Membranpotenzial eines Neurons infolge eines Stromimpulses ändert, ist eine Funktion des Membraneingangswiderstands. Wenn eine Zelle wächst, werden der Membran mehr Kanäle hinzugefügt, was zu einer Verringerung des Eingangswiderstands führt. Ein reifes Neuron erfährt auch kürzere Änderungen des Membranpotenzials als Reaktion auf synaptische Ströme. Neuronen aus dem Nucleus geniculatus lateralis eines Frettchens haben bei P0 eine längere Zeitkonstante und einen größeren Spannungsausschlag als bei P30. Eine Folge der abnehmenden Aktionspotenzialdauer ist, dass die Signaltreue als Reaktion auf hochfrequente Stimulation erhalten bleiben kann. Unreife Neuronen neigen nach hochfrequenter Stimulation eher zur synaptischen Depression als zur Potenzierung. ⓘ
In der frühen Entwicklungsphase vieler Organismen wird das Aktionspotenzial anfangs eher durch Kalzium- als durch Natriumströme übertragen. Die Öffnungs- und Schließkinetik der Kalziumkanäle während der Entwicklung ist langsamer als die der spannungsgesteuerten Natriumkanäle, die das Aktionspotenzial in den reifen Neuronen leiten werden. Die längere Öffnungszeit der Kalziumkanäle kann zu Aktionspotenzialen führen, die wesentlich langsamer sind als die von reifen Neuronen. Xenopus-Neuronen haben anfänglich Aktionspotenziale, die 60-90 ms dauern. Während der Entwicklung sinkt diese Zeit auf 1 ms. Für diesen drastischen Rückgang gibt es zwei Gründe. Erstens wird der Einwärtsstrom hauptsächlich von Natriumkanälen geleitet. Zweitens steigt der verzögerte Gleichrichterstrom, ein Kaliumkanalstrom, auf das 3,5-fache seiner ursprünglichen Stärke an. ⓘ
Damit der Übergang von einem kalziumabhängigen Aktionspotenzial zu einem natriumabhängigen Aktionspotenzial stattfinden kann, müssen der Membran neue Kanäle hinzugefügt werden. Wenn Xenopus-Neuronen in einer Umgebung mit RNA-Synthese- oder Proteinsynthese-Inhibitoren gezüchtet werden, wird dieser Übergang verhindert. Auch die elektrische Aktivität der Zelle selbst kann eine Rolle bei der Kanalexpression spielen. Wenn Aktionspotenziale in Xenopus-Myozyten blockiert werden, wird der typische Anstieg der Natrium- und Kaliumstromdichte verhindert oder verzögert. ⓘ
Diese Reifung der elektrischen Eigenschaften ist bei allen Arten zu beobachten. Bei Xenopus steigen die Natrium- und Kaliumströme drastisch an, nachdem ein Neuron die letzte Phase der Mitose durchlaufen hat. Die Natriumstromdichte von kortikalen Neuronen der Ratte steigt innerhalb der ersten beiden postnatalen Wochen um 600 %. ⓘ
Neurotransmission
Anatomie eines Neurons
| Neuron |
|---|
Es gibt mehrere Zelltypen, die ein Aktionspotenzial erzeugen, wie z. B. Pflanzenzellen, Muskelzellen und die spezialisierten Zellen des Herzens (in denen das Aktionspotenzial des Herzens entsteht). Die wichtigste erregbare Zelle ist jedoch das Neuron, das auch den einfachsten Mechanismus für das Aktionspotenzial besitzt. ⓘ
Neuronen sind elektrisch erregbare Zellen, die im Allgemeinen aus einem oder mehreren Dendriten, einem einzelnen Soma, einem einzelnen Axon und einem oder mehreren Axonenden bestehen. Dendriten sind zelluläre Fortsätze, deren Hauptfunktion darin besteht, synaptische Signale zu empfangen. Ihre Ausstülpungen, die so genannten dendritischen Stacheln, sind dazu bestimmt, die vom präsynaptischen Neuron freigesetzten Neurotransmitter einzufangen. Sie weisen eine hohe Konzentration von ligandengesteuerten Ionenkanälen auf. Diese Stacheln haben einen dünnen Hals, der eine knollige Ausstülpung mit dem Dendriten verbindet. Dadurch wird sichergestellt, dass sich Veränderungen im Inneren des Stachels weniger wahrscheinlich auf die benachbarten Stacheln auswirken. Der dendritische Stachel kann, mit seltenen Ausnahmen (siehe LTP), als unabhängige Einheit agieren. Die Dendriten gehen vom Soma aus, in dem sich der Zellkern und viele der "normalen" eukaryotischen Organellen befinden. Im Gegensatz zu den Stacheln ist die Oberfläche des Somas von spannungsaktivierten Ionenkanälen besiedelt. Diese Kanäle helfen bei der Übertragung der von den Dendriten erzeugten Signale. Aus dem Soma geht das Axonhügelchen hervor. Diese Region zeichnet sich durch eine sehr hohe Konzentration von spannungsaktivierten Natriumkanälen aus. Im Allgemeinen wird sie als die Spike-Initiationszone für Aktionspotenziale angesehen, d. h. als Triggerzone. Hier laufen mehrere Signale zusammen, die an den Stacheln erzeugt und vom Soma weitergeleitet werden. Unmittelbar nach dem Axonhügel befindet sich das Axon. Dabei handelt es sich um einen dünnen röhrenförmigen Vorsprung, der sich vom Soma wegbewegt. Das Axon ist durch eine Myelinscheide isoliert. Das Myelin besteht entweder aus Schwann-Zellen (im peripheren Nervensystem) oder aus Oligodendrozyten (im zentralen Nervensystem), die beide zu den Gliazellen gehören. Obwohl Gliazellen nicht an der Übertragung elektrischer Signale beteiligt sind, kommunizieren sie mit den Neuronen und leisten ihnen wichtige biochemische Unterstützung. Das Myelin wickelt sich mehrfach um das Axonsegment und bildet eine dicke Fettschicht, die verhindert, dass Ionen in das Axon eindringen oder es verlassen. Diese Isolierung verhindert einen signifikanten Signalabfall und sorgt für eine höhere Signalgeschwindigkeit. Diese Isolierung hat jedoch die Einschränkung, dass an der Oberfläche des Axons keine Kanäle vorhanden sein können. Daher gibt es in regelmäßigen Abständen Membranabschnitte, die keine Isolierung aufweisen. Diese Ranvier-Knoten können als "Mini-Axonhügel" betrachtet werden, da ihr Zweck darin besteht, das Signal zu verstärken, um einen signifikanten Signalabfall zu verhindern. Am äußersten Ende verliert das Axon seine Isolierung und beginnt, sich in mehrere Axonendigungen zu verzweigen. Diese präsynaptischen Terminals oder synaptischen Boutons sind ein spezialisierter Bereich innerhalb des Axons der präsynaptischen Zelle, der Neurotransmitter enthält, die in kleinen membrangebundenen Kugeln, den so genannten synaptischen Vesikeln, eingeschlossen sind. ⓘ
Einleitung
Bevor man sich mit der Ausbreitung von Aktionspotenzialen entlang der Axone und ihrer Beendigung an den synaptischen Knöpfen befasst, ist es hilfreich, die Methoden zu betrachten, mit denen Aktionspotenziale am Axonhügel ausgelöst werden können. Die Grundvoraussetzung ist, dass die Membranspannung am Hillock über den Schwellenwert für die Zündung angehoben wird. Es gibt mehrere Möglichkeiten, wie diese Depolarisation erfolgen kann. ⓘ

Dynamik
Aktionspotentiale werden in der Regel durch erregende postsynaptische Potentiale von einem präsynaptischen Neuron ausgelöst. In der Regel werden von der präsynaptischen Nervenzelle Neurotransmittermoleküle freigesetzt. Diese Neurotransmitter binden dann an Rezeptoren auf der postsynaptischen Zelle. Durch diese Bindung werden verschiedene Arten von Ionenkanälen geöffnet. Diese Öffnung hat den weiteren Effekt, dass sich die lokale Durchlässigkeit der Zellmembran und damit das Membranpotenzial ändert. Wenn die Bindung die Spannung erhöht (die Membran depolarisiert), ist die Synapse erregend. Wenn die Bindung jedoch die Spannung senkt (die Membran hyperpolarisiert), ist sie hemmend. Unabhängig davon, ob die Spannung erhöht oder gesenkt wird, breitet sich die Veränderung passiv in nahe gelegene Regionen der Membran aus (wie durch die Kabelgleichung und ihre Verfeinerungen beschrieben). Normalerweise nimmt der Spannungsreiz exponentiell mit der Entfernung von der Synapse und mit der Zeit nach der Bindung des Neurotransmitters ab. Ein Teil einer erregenden Spannung kann den Axonhügel erreichen und (in seltenen Fällen) die Membran so weit depolarisieren, dass ein neues Aktionspotenzial ausgelöst wird. In der Regel müssen die Erregungspotenziale von mehreren Synapsen fast gleichzeitig zusammenwirken, um ein neues Aktionspotenzial auszulösen. Ihre gemeinsamen Bemühungen können jedoch durch die entgegenwirkenden hemmenden postsynaptischen Potenziale vereitelt werden. ⓘ
Neurotransmission kann auch über elektrische Synapsen erfolgen. Aufgrund der direkten Verbindung zwischen erregbaren Zellen in Form von Gap Junctions kann ein Aktionspotenzial direkt von einer Zelle zur nächsten in beide Richtungen übertragen werden. Der freie Fluss von Ionen zwischen den Zellen ermöglicht eine schnelle, nicht chemisch vermittelte Übertragung. Gleichrichtende Kanäle sorgen dafür, dass sich Aktionspotenziale nur in eine Richtung durch eine elektrische Synapse bewegen. Elektrische Synapsen sind in allen Nervensystemen zu finden, auch im menschlichen Gehirn, obwohl sie eine deutliche Minderheit darstellen. ⓘ
"Alles-oder-nichts"-Prinzip
Die Amplitude eines Aktionspotenzials ist unabhängig von der Menge des Stroms, der es erzeugt hat. Mit anderen Worten: Größere Ströme erzeugen keine größeren Aktionspotenziale. Daher werden Aktionspotenziale als Alles-oder-nichts-Signale bezeichnet, da sie entweder vollständig oder gar nicht auftreten. Dies steht im Gegensatz zu den Rezeptorpotenzialen, deren Amplitude von der Intensität eines Reizes abhängt. In beiden Fällen ist die Häufigkeit von Aktionspotenzialen mit der Intensität eines Reizes korreliert. ⓘ
Sensorische Neuronen
In sensorischen Neuronen wird ein externes Signal wie Druck, Temperatur, Licht oder Schall mit dem Öffnen und Schließen von Ionenkanälen gekoppelt, die wiederum die Ionenpermeabilität der Membran und ihre Spannung verändern. Diese Spannungsänderungen können wiederum erregend (depolarisierend) oder hemmend (hyperpolarisierend) sein, und bei einigen sensorischen Neuronen können ihre kombinierten Effekte den Axonhügel so weit depolarisieren, dass Aktionspotenziale ausgelöst werden. Einige Beispiele beim Menschen sind das Geruchsrezeptorneuron und das Meissner-Körperchen, die für den Geruchs- bzw. Tastsinn entscheidend sind. Allerdings setzen nicht alle sensorischen Neuronen ihre externen Signale in Aktionspotenziale um; einige haben nicht einmal ein Axon. Einige haben nicht einmal ein Axon. Stattdessen können sie das Signal in die Freisetzung eines Neurotransmitters oder in kontinuierliche, abgestufte Potenziale umwandeln, die wiederum ein oder mehrere nachfolgende Neuronen zum Abfeuern eines Aktionspotenzials stimulieren können. Im menschlichen Ohr beispielsweise wandeln die Haarzellen den eintreffenden Schall in das Öffnen und Schließen mechanisch gesteuerter Ionenkanäle um, was zur Freisetzung von Neurotransmittermolekülen führen kann. In ähnlicher Weise erzeugen in der menschlichen Netzhaut die ersten Photorezeptorzellen und die nächste Zellschicht (bestehend aus Bipolarzellen und horizontalen Zellen) keine Aktionspotentiale; nur einige amakrine Zellen und die dritte Schicht, die Ganglienzellen, erzeugen Aktionspotentiale, die dann den Sehnerv hinaufwandern. ⓘ
Schrittmacher-Potenziale

Bei sensorischen Neuronen werden Aktionspotentiale durch einen äußeren Reiz ausgelöst. Einige erregbare Zellen benötigen jedoch keinen solchen Reiz, um zu feuern: Sie depolarisieren ihren Axonhügel spontan und feuern Aktionspotenziale in einem regelmäßigen Rhythmus ab, wie eine innere Uhr. Die Spannungsspuren solcher Zellen werden als Schrittmacherpotentiale bezeichnet. Ein gutes Beispiel dafür sind die Herzschrittmacherzellen des sinoatrialen Knotens im Herzen. Obwohl solche Schrittmacherpotenziale einen natürlichen Rhythmus haben, kann dieser durch äußere Reize verändert werden; beispielsweise kann die Herzfrequenz durch Medikamente sowie durch Signale der sympathischen und parasympathischen Nerven verändert werden. Die externen Stimuli bewirken nicht das wiederholte Feuern der Zelle, sondern verändern lediglich ihr Timing. In einigen Fällen kann die Regulierung der Frequenz komplexer sein und zu Mustern von Aktionspotenzialen führen, wie z. B. Bursting. ⓘ
Phasen
Der Verlauf des Aktionspotenzials lässt sich in fünf Teile unterteilen: die Anstiegsphase, die Hochphase, die Abstiegsphase, die Unterschwingungsphase und die Refraktärphase. Während der Anstiegsphase depolarisiert sich das Membranpotenzial (wird positiver). Der Punkt, an dem die Depolarisation aufhört, wird als Peak-Phase bezeichnet. In dieser Phase erreicht das Membranpotenzial ein Maximum. Daran schließt sich eine abfallende Phase an. Während dieser Phase wird das Membranpotenzial negativer und kehrt zum Ruhepotenzial zurück. Die Unterschwingungsphase oder Nachhyperpolarisationsphase ist der Zeitraum, in dem das Membranpotenzial vorübergehend negativer geladen ist als im Ruhezustand (Hyperpolarisation). Die Zeit, in der ein nachfolgendes Aktionspotenzial nicht oder nur schwer ausgelöst werden kann, wird als Refraktärphase bezeichnet, die sich mit den anderen Phasen überschneiden kann. ⓘ
Der Verlauf des Aktionspotenzials wird durch zwei gekoppelte Effekte bestimmt. Erstens öffnen und schließen sich spannungsempfindliche Ionenkanäle als Reaktion auf Änderungen der Membranspannung Vm. Dadurch ändert sich die Durchlässigkeit der Membran für diese Ionen. Zweitens ändert diese Permeabilitätsänderung nach der Goldman-Gleichung das Gleichgewichtspotenzial Em und damit die Membranspannung Vm. Das Membranpotenzial beeinflusst also die Permeabilität, die wiederum das Membranpotenzial beeinflusst. Dadurch wird die Möglichkeit einer positiven Rückkopplung geschaffen, die ein wichtiger Bestandteil der Anstiegsphase des Aktionspotenzials ist. Ein komplizierter Faktor ist, dass ein einzelner Ionenkanal mehrere interne "Tore" haben kann, die auf Änderungen von Vm auf entgegengesetzte Weise oder mit unterschiedlicher Geschwindigkeit reagieren. Zum Beispiel öffnet eine Erhöhung von Vm zwar die meisten Gates im spannungsempfindlichen Natriumkanal, schließt aber auch das "Inaktivierungs-Gate" des Kanals, wenn auch langsamer. Wenn also Vm plötzlich erhöht wird, öffnen sich die Natriumkanäle zunächst, schließen sich dann aber aufgrund der langsameren Inaktivierung. ⓘ
Die Spannungen und Ströme des Aktionspotenzials in all seinen Phasen wurden 1952 von Alan Lloyd Hodgkin und Andrew Huxley genau modelliert, wofür sie 1963 mit dem Nobelpreis für Physiologie oder Medizin ausgezeichnet wurden. Ihr Modell berücksichtigt jedoch nur zwei Typen spannungsempfindlicher Ionenkanäle und geht von mehreren Annahmen aus, z. B. dass sich ihre internen Gates unabhängig voneinander öffnen und schließen. In Wirklichkeit gibt es viele Arten von Ionenkanälen, und sie öffnen und schließen sich nicht immer unabhängig voneinander. ⓘ
Stimulation und Anstiegsphase
Ein typisches Aktionspotenzial beginnt am Axonhügel mit einer ausreichend starken Depolarisation, z. B. einem Reiz, der Vm erhöht. Diese Depolarisation wird häufig durch die Injektion zusätzlicher Natriumkationen in die Zelle verursacht; diese Kationen können aus einer Vielzahl von Quellen stammen, z. B. von chemischen Synapsen, sensorischen Neuronen oder Schrittmacherpotenzialen. ⓘ
Bei einem Neuron im Ruhezustand ist die Konzentration von Natrium- und Chloridionen in der extrazellulären Flüssigkeit höher als in der intrazellulären Flüssigkeit, während die Konzentration von Kaliumionen in der intrazellulären Flüssigkeit höher als in der extrazellulären Flüssigkeit ist. Der Konzentrationsunterschied, der dazu führt, dass Ionen von einer hohen zu einer niedrigen Konzentration wandern, und elektrostatische Effekte (Anziehung entgegengesetzter Ladungen) sind für die Bewegung von Ionen in und aus dem Neuron verantwortlich. Das Innere eines Neurons ist im Vergleich zur Außenseite der Zelle negativ geladen, was auf die Bewegung von K+ aus der Zelle zurückzuführen ist. Die Neuronenmembran ist für K+ durchlässiger als für andere Ionen, so dass dieses Ion selektiv aus der Zelle herauswandern kann, und zwar entlang des Konzentrationsgradienten. Dieser Konzentrationsgradient und die an der Neuronenmembran vorhandenen Kalium-Leckkanäle bewirken einen Abfluss von Kaliumionen, wodurch das Ruhepotenzial nahe EK ≈ -75 mV liegt. Da Na+-Ionen außerhalb der Zelle in höheren Konzentrationen vorliegen, werden sie durch die Konzentrations- und Spannungsunterschiede in die Zelle getrieben, wenn sich Na+-Kanäle öffnen. Durch die Depolarisation werden sowohl die Natrium- als auch die Kaliumkanäle in der Membran geöffnet, so dass die Ionen in das Axon hinein- bzw. aus ihm herausfließen können. Wenn die Depolarisation gering ist (z. B. Erhöhung von Vm von -70 mV auf -60 mV), überwältigt der Kaliumstrom nach außen den Natriumstrom nach innen, und die Membran repolarisiert zurück zu ihrem normalen Ruhepotenzial um -70 mV. Wenn die Depolarisation jedoch groß genug ist, steigt der Natriumeinstrom stärker an als der Kaliumausstrom, und es kommt zu einem "Runaway"-Zustand (positive Rückkopplung): Je mehr Einstrom vorhanden ist, desto mehr steigt Vm, was wiederum den Einstrom weiter erhöht. Eine ausreichend starke Depolarisation (Anstieg von Vm) bewirkt, dass sich die spannungsempfindlichen Natriumkanäle öffnen; die zunehmende Permeabilität für Natrium treibt Vm näher an die Natrium-Gleichgewichtsspannung ENa≈ +55 mV. Die steigende Spannung bewirkt wiederum, dass sich noch mehr Natriumkanäle öffnen, was Vm noch weiter in Richtung ENa drückt. Diese positive Rückkopplung setzt sich fort, bis die Natriumkanäle vollständig geöffnet sind und Vm nahe an ENa liegt. Der starke Anstieg von Vm und der Natriumpermeabilität entspricht der Anstiegsphase des Aktionspotenzials. ⓘ
Die kritische Schwellenspannung für diesen "Runaway"-Zustand liegt in der Regel bei etwa -45 mV, hängt aber von der jüngsten Aktivität des Axons ab. Eine Zelle, die gerade ein Aktionspotenzial ausgelöst hat, kann nicht sofort ein weiteres auslösen, da sich die Na+-Kanäle noch nicht vom inaktivierten Zustand erholt haben. Der Zeitraum, in dem kein neues Aktionspotenzial ausgelöst werden kann, wird als absolute Refraktärzeit bezeichnet. Nach längerer Zeit, wenn sich zwar einige, aber nicht alle Ionenkanäle erholt haben, kann das Axon stimuliert werden, um ein weiteres Aktionspotenzial auszulösen, allerdings mit einem höheren Schwellenwert, der eine viel stärkere Depolarisation erfordert, z. B. auf -30 mV. Der Zeitraum, in dem Aktionspotenziale ungewöhnlich schwer auszulösen sind, wird als relative Refraktärzeit bezeichnet. ⓘ
Anstiegsphase
Die positive Rückkopplung der Anstiegsphase verlangsamt sich und kommt zum Stillstand, wenn die Natriumionenkanäle maximal geöffnet sind. Auf dem Höhepunkt des Aktionspotenzials ist die Natriumpermeabilität maximal, und die Membranspannung Vm entspricht nahezu der Natriumgleichgewichtsspannung ENa. Die gleiche erhöhte Spannung, die die Natriumkanäle zunächst geöffnet hat, schaltet sie jedoch auch langsam wieder ab, indem sie ihre Poren schließt; die Natriumkanäle werden inaktiviert. Dadurch sinkt die Durchlässigkeit der Membran für Natrium im Vergleich zu Kalium, was die Membranspannung wieder in Richtung des Ruhewertes treibt. Gleichzeitig öffnet die erhöhte Spannung spannungsempfindliche Kaliumkanäle; der Anstieg der Kaliumpermeabilität der Membran treibt Vm in Richtung EK. Zusammen bewirken diese Änderungen der Natrium- und Kaliumpermeabilität ein schnelles Absinken von Vm, wodurch die Membran repolarisiert wird und die "fallende Phase" des Aktionspotenzials entsteht. ⓘ
Nach der Hyperpolarisation
Die depolarisierte Spannung öffnet zusätzliche spannungsabhängige Kaliumkanäle, von denen sich einige nicht sofort wieder schließen, wenn die Membran zu ihrer normalen Ruhespannung zurückkehrt. Darüber hinaus öffnen sich weitere Kaliumkanäle als Reaktion auf den Einstrom von Kalziumionen während des Aktionspotentials. Die intrazelluläre Kaliumionenkonzentration ist vorübergehend ungewöhnlich niedrig, wodurch sich die Membranspannung Vm der Kaliumgleichgewichtsspannung EK weiter annähert. Das Membranpotenzial sinkt unter das Ruhemembranpotenzial. Daher kommt es zu einer Unterschreitung oder Hyperpolarisation, die als Nachhyperpolarisation bezeichnet wird und so lange anhält, bis die Kaliumpermeabilität der Membran wieder ihren üblichen Wert erreicht und das Membranpotenzial in den Ruhezustand zurückkehrt. ⓘ
In vielen Zellen, vor allem Nervenzellen, ist noch eine über das Ruhepotential hinausgehende Hyperpolarisation zu beobachten. Sie erklärt sich aus einer weiterhin erhöhten Kaliumleitfähigkeit, wodurch das Potential noch näher am Kalium-Gleichgewichtspotential liegt. Die K-Leitfähigkeit ist erhöht, weil während des Aktionspotentials eingeströmte Calciumionen hier besondere Kaliumkanäle öffnen; sie normalisiert sich erst, wenn der intrazelluläre Calciumspiegel wieder absinkt. Bezeichnete man die Repolarisation bereits als Hyperpolarisation, wird dieser Vorgang einer zusätzlichen Absenkung dann Nachhyperpolarisation genannt. ⓘ
Refraktärzeit
Auf jedes Aktionspotenzial folgt eine Refraktärzeit, die sich in eine absolute Refraktärzeit, in der kein weiteres Aktionspotenzial ausgelöst werden kann, und eine relative Refraktärzeit, in der ein stärkerer als der übliche Reiz erforderlich ist, unterteilen lässt. Diese beiden Refraktärperioden werden durch Veränderungen im Zustand der Natrium- und Kaliumkanalmoleküle verursacht. Wenn sich die Natriumkanäle nach einem Aktionspotenzial schließen, treten sie in einen "inaktivierten" Zustand ein, in dem sie unabhängig vom Membranpotenzial nicht mehr geöffnet werden können - dies führt zur absoluten Refraktärzeit. Selbst nachdem eine ausreichende Anzahl von Natriumkanälen wieder in den Ruhezustand übergegangen ist, bleibt häufig ein Teil der Kaliumkanäle offen, was eine Depolarisierung des Membranpotenzials erschwert und damit zur relativen Refraktärzeit führt. Da die Dichte und die Subtypen der Kaliumkanäle zwischen den verschiedenen Arten von Neuronen sehr unterschiedlich sein können, ist die Dauer der relativen Refraktärzeit sehr variabel. ⓘ
Die absolute Refraktärzeit ist weitgehend für die unidirektionale Ausbreitung von Aktionspotenzialen entlang von Axonen verantwortlich. Zu einem bestimmten Zeitpunkt ist das Axonstück hinter dem aktiv spuckenden Teil refraktär, während das davor liegende Stück, das in letzter Zeit nicht aktiviert wurde, durch die Depolarisation des Aktionspotentials stimuliert werden kann. ⓘ
Ausbreitung
Das am Axonhügel erzeugte Aktionspotenzial breitet sich als Welle entlang des Axons aus. Die Ströme, die während eines Aktionspotenzials an einem Punkt des Axons einwärts fließen, breiten sich entlang des Axons aus und depolarisieren die angrenzenden Abschnitte seiner Membran. Wenn diese Depolarisation stark genug ist, löst sie ein ähnliches Aktionspotenzial an den benachbarten Membranabschnitten aus. Dieser grundlegende Mechanismus wurde 1937 von Alan Lloyd Hodgkin nachgewiesen. Nachdem er Nervensegmente gequetscht oder gekühlt und damit die Aktionspotenziale blockiert hatte, zeigte er, dass ein Aktionspotenzial, das auf einer Seite der Blockade ankommt, ein weiteres Aktionspotenzial auf der anderen Seite auslösen kann, vorausgesetzt, das blockierte Segment ist ausreichend kurz. ⓘ
Sobald ein Aktionspotenzial an einer Membranstelle aufgetreten ist, braucht die Membranstelle Zeit, um sich zu erholen, bevor sie erneut feuern kann. Auf molekularer Ebene entspricht diese absolute Refraktärzeit der Zeit, die die spannungsaktivierten Natriumkanäle benötigen, um sich von der Inaktivierung zu erholen, d. h. in ihren geschlossenen Zustand zurückzukehren. Es gibt viele Arten von spannungsaktivierten Kaliumkanälen in Neuronen. Einige von ihnen werden schnell inaktiviert (Ströme vom A-Typ), andere langsam oder gar nicht; diese Variabilität garantiert, dass immer eine Stromquelle für die Repolarisation zur Verfügung steht, selbst wenn einige der Kaliumkanäle aufgrund einer vorangegangenen Depolarisation inaktiviert sind. Andererseits werden bei einer starken Depolarisation alle spannungsaktivierten Natriumkanäle innerhalb weniger Millisekunden inaktiviert, so dass eine nachfolgende Depolarisation erst dann möglich ist, wenn ein erheblicher Teil der Natriumkanäle wieder in den geschlossenen Zustand zurückgekehrt ist. Die absolute Refraktärzeit begrenzt zwar die Häufigkeit des Feuerns, sorgt aber dafür, dass sich das Aktionspotenzial nur in eine Richtung entlang eines Axons bewegt. Die Ströme, die aufgrund eines Aktionspotenzials fließen, breiten sich in beide Richtungen entlang des Axons aus. Allerdings kann nur der nicht gezündete Teil des Axons mit einem Aktionspotenzial reagieren; der Teil, der gerade gezündet hat, reagiert nicht, bis das Aktionspotenzial sicher außer Reichweite ist und kann diesen Teil nicht restimulieren. Bei der üblichen orthodromen Leitung breitet sich das Aktionspotenzial vom Axonhügel in Richtung der synaptischen Knöpfe (den axonalen Endpunkten) aus; eine Ausbreitung in die entgegengesetzte Richtung - bekannt als antidromische Leitung - ist sehr selten. Wenn jedoch ein Laboraxon in seiner Mitte stimuliert wird, sind beide Hälften des Axons "frisch", d. h. unbefeuert; dann werden zwei Aktionspotenziale erzeugt, von denen sich eines in Richtung des Axonhügels und das andere in Richtung der synaptischen Knötchen bewegt. ⓘ
Myelin und saltatorische Erregungsleitung

Um eine schnelle und effiziente Übertragung von elektrischen Signalen im Nervensystem zu ermöglichen, sind bestimmte neuronale Axone mit Myelinscheiden überzogen. Myelin ist eine multilamellare Membran, die das Axon in Segmenten umhüllt, die durch als Ranvier-Knoten bezeichnete Intervalle getrennt sind. Es wird von spezialisierten Zellen produziert: Schwann-Zellen ausschließlich im peripheren Nervensystem und Oligodendrozyten ausschließlich im zentralen Nervensystem. Die Myelinscheide verringert die Membrankapazität und erhöht den Membranwiderstand in den Interknotenintervallen, wodurch eine schnelle, saltatorische Bewegung von Aktionspotenzialen von Knoten zu Knoten ermöglicht wird. Die Myelinisierung ist hauptsächlich bei Wirbeltieren zu finden, aber ein analoges System wurde auch bei einigen wirbellosen Tieren, wie z. B. einigen Garnelenarten, entdeckt. Nicht alle Neuronen in Wirbeltieren sind myelinisiert; so sind beispielsweise die Axone der Neuronen des autonomen Nervensystems im Allgemeinen nicht myelinisiert. ⓘ
Myelin verhindert, dass Ionen entlang der myelinisierten Abschnitte in das Axon eindringen oder es verlassen. In der Regel erhöht die Myelinisierung die Leitungsgeschwindigkeit von Aktionspotenzialen und macht sie energieeffizienter. Ob saltatorisch oder nicht, die mittlere Leitungsgeschwindigkeit eines Aktionspotenzials reicht von 1 Meter pro Sekunde (m/s) bis über 100 m/s und nimmt im Allgemeinen mit dem Axonendurchmesser zu. ⓘ
Aktionspotenziale können sich in myelinisierten Axonabschnitten nicht durch die Membran ausbreiten. Der Strom wird jedoch durch das Zytoplasma geleitet, was ausreicht, um den ersten oder zweiten nachfolgenden Ranvier-Knoten zu depolarisieren. Stattdessen löst der Ionenstrom eines Aktionspotenzials an einem Ranvier-Knoten ein anderes Aktionspotenzial am nächsten Knoten aus; dieses scheinbare "Springen" des Aktionspotenzials von Knoten zu Knoten wird als saltatorische Leitung bezeichnet. Obwohl der Mechanismus der saltatorischen Reizleitung 1925 von Ralph Lillie vorgeschlagen wurde, stammt der erste experimentelle Beweis für die saltatorische Reizleitung von Ichiji Tasaki und Taiji Takeuchi sowie von Andrew Huxley und Robert Stämpfli. Im Gegensatz dazu löst das Aktionspotenzial in nicht-myelinisierten Axonen ein weiteres in der unmittelbar benachbarten Membran aus und bewegt sich kontinuierlich wie eine Welle das Axon hinunter. ⓘ

Myelin hat zwei wichtige Vorteile: schnelle Leitungsgeschwindigkeit und Energieeffizienz. Bei Axonen, die einen Mindestdurchmesser (etwa 1 Mikrometer) überschreiten, erhöht die Myelinisierung die Leitungsgeschwindigkeit eines Aktionspotenzials in der Regel um das Zehnfache. Umgekehrt sind myelinisierte Fasern bei einer bestimmten Leitungsgeschwindigkeit kleiner als ihre nicht myelinisierten Gegenstücke. So bewegen sich beispielsweise Aktionspotenziale in einem myelinisierten Froschaxon und einem nicht myelinisierten Tintenfisch-Riesenaxon mit etwa der gleichen Geschwindigkeit (25 m/s), aber das Froschaxon hat einen etwa 30-mal kleineren Durchmesser und eine 1000-mal kleinere Querschnittsfläche. Da sich die Ionenströme auf die Ranvier-Knoten beschränken, "entweichen" auch viel weniger Ionen durch die Membran, was Stoffwechselenergie spart. Diese Einsparung ist ein bedeutender selektiver Vorteil, da das menschliche Nervensystem etwa 20 % der Stoffwechselenergie des Körpers verbraucht. ⓘ
Die Länge der myelinisierten Segmente der Axone ist wichtig für den Erfolg der saltatorischen Reizleitung. Sie sollten so lang wie möglich sein, um die Leitungsgeschwindigkeit zu maximieren, aber nicht so lang, dass das ankommende Signal zu schwach ist, um ein Aktionspotenzial am nächsten Ranvier-Knoten auszulösen. In der Natur sind myelinisierte Segmente in der Regel lang genug, damit das passiv weitergeleitete Signal mindestens zwei Knoten durchläuft und dabei eine ausreichende Amplitude beibehält, um am zweiten oder dritten Knoten ein Aktionspotenzial auszulösen. Daher ist der Sicherheitsfaktor der saltatorischen Leitung hoch, so dass die Übertragung im Falle einer Verletzung die Knoten überbrücken kann. Aktionspotenziale können jedoch an bestimmten Stellen, an denen der Sicherheitsfaktor niedrig ist, vorzeitig enden, selbst bei nicht myelinisierten Neuronen; ein gängiges Beispiel ist die Verzweigungsstelle eines Axons, wo es sich in zwei Axone teilt. ⓘ
Einige Krankheiten führen zu einem Abbau des Myelins und zu einer Beeinträchtigung der saltatorischen Erregungsleitung, wodurch sich die Erregungsleitgeschwindigkeit der Aktionspotenziale verringert. Die bekannteste dieser Krankheiten ist die Multiple Sklerose, bei der der Abbau des Myelins die koordinierte Bewegung beeinträchtigt. ⓘ
Kabeltheorie
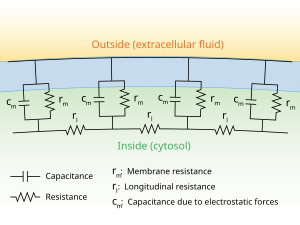
Der Stromfluss innerhalb eines Axons kann durch die Kabeltheorie und ihre Weiterentwicklungen, wie das Kompartimentmodell, quantitativ beschrieben werden. Die Kabeltheorie wurde 1855 von Lord Kelvin entwickelt, um das transatlantische Telegrafenkabel zu modellieren, und wurde 1946 von Hodgkin und Rushton als relevant für Neuronen nachgewiesen. In der einfachen Kabeltheorie wird das Neuron als ein elektrisch passives, perfekt zylindrisches Übertragungskabel behandelt, das durch eine partielle Differentialgleichung beschrieben werden kann ⓘ
wobei V(x, t) die Spannung über der Membran zu einem Zeitpunkt t und einer Position x entlang der Länge des Neurons ist, und wobei λ und τ die charakteristischen Längen- und Zeitskalen sind, auf denen diese Spannungen als Reaktion auf einen Reiz abfallen. Im Schaltplan auf der rechten Seite können diese Skalen aus den Widerständen und Kapazitäten pro Längeneinheit bestimmt werden. ⓘ
Diese Zeit- und Längenskalen können verwendet werden, um die Abhängigkeit der Leitungsgeschwindigkeit vom Durchmesser des Neurons in nicht-myelinisierten Fasern zu verstehen. So nimmt beispielsweise die Zeitskala τ sowohl mit dem Membranwiderstand rm als auch mit der Kapazität cm zu. Mit zunehmender Kapazität muss mehr Ladung übertragen werden, um eine bestimmte Transmembranspannung zu erzeugen (nach der Gleichung Q = CV); mit zunehmendem Widerstand wird weniger Ladung pro Zeiteinheit übertragen, so dass die Gleichgewichtseinstellung langsamer erfolgt. Wenn der Innenwiderstand pro Längeneinheit ri in einem Axon geringer ist als in einem anderen (z. B. weil der Radius des ersteren größer ist), wird die räumliche Abklinglänge λ größer und die Leitgeschwindigkeit eines Aktionspotenzials sollte zunehmen. Wenn der Transmembranwiderstand rm erhöht wird, sinkt der durchschnittliche "Leckstrom" durch die Membran, wodurch λ ebenfalls länger wird und sich die Leitungsgeschwindigkeit erhöht. ⓘ
Abbruch
Chemische Synapsen
Im Allgemeinen bewirken Aktionspotenziale, die die synaptischen Knöpfe erreichen, dass ein Neurotransmitter in den synaptischen Spalt freigesetzt wird. Neurotransmitter sind kleine Moleküle, die Ionenkanäle in der postsynaptischen Zelle öffnen können; die meisten Axone haben denselben Neurotransmitter an allen ihren Enden. Das Eintreffen des Aktionspotenzials öffnet spannungsempfindliche Kalziumkanäle in der präsynaptischen Membran; der Kalziumeinstrom bewirkt, dass mit Neurotransmitter gefüllte Bläschen an die Zelloberfläche wandern und ihren Inhalt in den synaptischen Spalt abgeben. Dieser komplexe Prozess wird durch die Neurotoxine Tetanospasmin und Botulinumtoxin gehemmt, die für Tetanus bzw. Botulismus verantwortlich sind. ⓘ

Elektrische Synapsen
Einige Synapsen verzichten auf den "Mittelsmann" des Neurotransmitters und verbinden die präsynaptische und die postsynaptische Zelle miteinander. Wenn ein Aktionspotenzial eine solche Synapse erreicht, können die in die präsynaptische Zelle fließenden Ionenströme die Barriere der beiden Zellmembranen überwinden und durch Poren, die so genannten Connexonen, in die postsynaptische Zelle eintreten. So können die Ionenströme des präsynaptischen Aktionspotenzials die postsynaptische Zelle direkt stimulieren. Elektrische Synapsen ermöglichen eine schnellere Übertragung, da sie nicht die langsame Diffusion von Neurotransmittern durch den synaptischen Spalt erfordern. Daher werden elektrische Synapsen immer dann eingesetzt, wenn eine schnelle Reaktion und zeitliche Koordinierung von entscheidender Bedeutung sind, wie bei Fluchtreflexen, der Netzhaut von Wirbeltieren und dem Herzen. ⓘ
Neuromuskuläre Verbindungen
Ein Sonderfall einer chemischen Synapse ist die neuromuskuläre Verbindung, bei der das Axon eines Motoneurons an einer Muskelfaser endet. In solchen Fällen ist der freigesetzte Neurotransmitter Acetylcholin, der sich an den Acetylcholinrezeptor bindet, ein integrales Membranprotein in der Membran (dem Sarkolemm) der Muskelfaser. Das Acetylcholin bleibt jedoch nicht gebunden, sondern dissoziiert und wird durch das Enzym Acetylcholinesterase in der Synapse hydrolysiert. Dieses Enzym reduziert schnell den Reiz auf den Muskel, wodurch das Ausmaß und der Zeitpunkt der Muskelkontraktion feinfühlig reguliert werden können. Einige Gifte inaktivieren die Acetylcholinesterase, um diese Kontrolle zu verhindern, so z. B. die Nervenkampfstoffe Sarin und Tabun sowie die Insektizide Diazinon und Malathion. ⓘ
Andere Zelltypen
Aktionspotenziale des Herzens

Das kardiale Aktionspotenzial unterscheidet sich vom neuronalen Aktionspotenzial durch ein verlängertes Plateau, bei dem die Membran einige hundert Millisekunden lang auf einer hohen Spannung gehalten wird, bevor sie wie üblich durch den Kaliumstrom repolarisiert wird. Dieses Plateau ist auf die Wirkung der langsameren Kalziumkanäle zurückzuführen, die sich öffnen und die Membranspannung in der Nähe ihres Gleichgewichtspotenzials halten, selbst nachdem die Natriumkanäle inaktiviert wurden. ⓘ
Das kardiale Aktionspotenzial spielt eine wichtige Rolle bei der Koordinierung der Herzkontraktion. Die Herzzellen des Sinusknotens liefern das Schrittmacherpotenzial, das das Herz synchronisiert. Die Aktionspotenziale dieser Zellen breiten sich zum und durch den atrioventrikulären Knoten (AV-Knoten) aus, der normalerweise die einzige Leitungsbahn zwischen den Vorhöfen und den Herzkammern darstellt. Aktionspotenziale aus dem AV-Knoten wandern durch das His-Bündel und von dort zu den Purkinje-Fasern. Umgekehrt können Anomalien im Aktionspotenzial des Herzens - sei es aufgrund einer angeborenen Mutation oder einer Verletzung - zu menschlichen Erkrankungen führen, insbesondere zu Arrhythmien. Mehrere Antiarrhythmika wie Chinidin, Lidocain, Betablocker und Verapamil wirken auf das Aktionspotenzial des Herzens. ⓘ
Muskuläre Aktionspotenziale
Das Aktionspotenzial in einer normalen Skelettmuskelzelle ist dem Aktionspotenzial in Neuronen ähnlich. Aktionspotenziale entstehen durch die Depolarisation der Zellmembran (des Sarkolemmas), die spannungsempfindliche Natriumkanäle öffnet; diese werden inaktiviert und die Membran wird durch den Ausstrom von Kaliumionen repolarisiert. Das Ruhepotential vor dem Aktionspotential beträgt typischerweise -90mV, etwas negativer als bei typischen Neuronen. Das Muskelaktionspotenzial dauert etwa 2-4 ms, die absolute Refraktärzeit beträgt etwa 1-3 ms, und die Leitungsgeschwindigkeit entlang des Muskels beträgt etwa 5 m/s. Das Aktionspotenzial setzt Kalziumionen frei, die das Tropomyosin freisetzen und die Kontraktion des Muskels ermöglichen. Muskelaktionspotenziale werden durch das Eintreffen eines präsynaptischen neuronalen Aktionspotenzials an der neuromuskulären Verbindungsstelle ausgelöst, die ein häufiges Ziel für Neurotoxine ist. ⓘ
Aktionspotenziale in Pflanzen
Auch Pflanzen- und Pilzzellen sind elektrisch erregbar. Der grundlegende Unterschied zu tierischen Aktionspotenzialen besteht darin, dass die Depolarisation in Pflanzenzellen nicht durch die Aufnahme von positiven Natriumionen, sondern durch die Abgabe von negativen Chloridionen erfolgt. Im Jahr 1906 veröffentlichte J. C. Bose die ersten Messungen von Aktionspotentialen in Pflanzen, die zuvor von Burdon-Sanderson und Darwin entdeckt worden waren. Ein Anstieg der zytoplasmatischen Kalziumionen kann die Ursache für die Freisetzung von Anionen in die Zelle sein. Dies macht Kalzium zu einem Vorläufer von Ionenbewegungen, wie dem Einstrom negativer Chloridionen und dem Ausstrom positiver Kaliumionen, wie sie in Gerstenblättern zu beobachten sind. ⓘ
Der anfängliche Einstrom von Kalziumionen führt auch zu einer geringen zellulären Depolarisation, wodurch sich die spannungsgesteuerten Ionenkanäle öffnen und die vollständige Depolarisation durch Chloridionen fortgesetzt werden kann. ⓘ
Einige Pflanzen (z. B. Dionaea muscipula) verwenden Natrium-gesteuerte Kanäle, um Bewegungen auszuführen und im Wesentlichen zu "zählen". Dionaea muscipula, auch als Venusfliegenfalle bekannt, kommt in subtropischen Feuchtgebieten in North und South Carolina vor. Wenn der Boden nährstoffarm ist, ernährt sich die Fliegenfalle von Insekten und Tieren. Trotz der Forschung an der Pflanze ist die molekulare Grundlage der Venusfliegenfalle und der fleischfressenden Pflanzen im Allgemeinen noch nicht verstanden. ⓘ
Es wurde jedoch viel über Aktionspotenziale und deren Auswirkungen auf die Bewegung und das Uhrwerk der Venusfliegenfalle geforscht. Zunächst einmal ist das Ruhemembranpotenzial der Venusfliegenfalle (-120mV) niedriger als bei tierischen Zellen (normalerweise -90mV bis -40mV). Das niedrigere Ruhepotenzial macht es einfacher, ein Aktionspotenzial zu aktivieren. Wenn also ein Insekt auf der Falle der Pflanze landet, löst es einen haarähnlichen Mechanorezeptor aus. Dieser Rezeptor aktiviert dann ein Aktionspotenzial, das etwa 1,5 ms dauert. Dies führt schließlich zu einem Anstieg der positiven Calciumionen in der Zelle, wodurch diese leicht depolarisiert wird. ⓘ
Die Fliegenfalle schließt sich jedoch nicht nach einem Auslöser. Stattdessen ist die Aktivierung von 2 oder mehr Haaren erforderlich. Wenn nur ein Haar ausgelöst wird, wird die Aktivierung als falsches Positiv gewertet. Außerdem muss das zweite Haar innerhalb eines bestimmten Zeitintervalls (0,75 s - 40 s) aktiviert werden, damit es mit der ersten Aktivierung registriert wird. Auf diese Weise beginnt ein Aufbau von Kalzium, der nach dem ersten Auslöser langsam abfällt. Wenn das zweite Aktionspotenzial innerhalb des Zeitintervalls ausgelöst wird, erreicht es die Kalziumschwelle, um die Zelle zu depolarisieren und die Falle für die Beute innerhalb eines Sekundenbruchteils zu schließen. ⓘ
Zusammen mit der anschließenden Freisetzung positiver Kaliumionen geht das Aktionspotenzial in Pflanzen mit einem osmotischen Salzverlust (KCl) einher. Im Gegensatz dazu ist das tierische Aktionspotential osmotisch neutral, da sich gleiche Mengen an eintretendem Natrium und austretendem Kalium osmotisch aufheben. Das Zusammenspiel von elektrischen und osmotischen Verhältnissen in Pflanzenzellen scheint aus einer osmotischen Funktion der elektrischen Erregbarkeit in einem gemeinsamen einzelligen Vorfahren von Pflanzen und Tieren unter wechselnden Salzbedingungen entstanden zu sein. Darüber hinaus wird die heutige Funktion der schnellen Signalübertragung als eine neuere Errungenschaft metazoischer Zellen in einer stabileren osmotischen Umgebung angesehen. Es ist wahrscheinlich, dass die bekannte Signalfunktion von Aktionspotenzialen in einigen Gefäßpflanzen (z. B. Mimosa pudica) unabhängig von der Funktion in erregbaren Zellen von Metazoen entstanden ist. ⓘ
Anders als die Anstiegsphase und der Peak scheinen die Abstiegsphase und die Nachhyperpolarisation in erster Linie von Kationen abzuhängen, bei denen es sich nicht um Kalzium handelt. Um die Repolarisierung einzuleiten, muss die Zelle Kalium durch passiven Transport an der Membran aus der Zelle herausbewegen. Der Unterschied zu Neuronen besteht darin, dass die Bewegung von Kalium die Abnahme des Membranpotenzials nicht dominiert. Um sich vollständig zu repolarisieren, benötigt eine Pflanzenzelle Energie in Form von ATP, um die Freisetzung von Wasserstoff aus der Zelle zu unterstützen - mit Hilfe eines Transporters, der allgemein als H+-ATPase bekannt ist. ⓘ
Taxonomische Verteilung und evolutionäre Vorteile
Aktionspotentiale sind in allen mehrzelligen Organismen zu finden, einschließlich Pflanzen, wirbellosen Tieren wie Insekten und Wirbeltieren wie Reptilien und Säugetieren. Schwämme scheinen der Hauptstamm der mehrzelligen Eukaryonten zu sein, der keine Aktionspotenziale überträgt, obwohl einige Studien darauf hindeuten, dass auch diese Organismen über eine Form der elektrischen Signalübertragung verfügen. Das Ruhepotenzial sowie die Größe und Dauer des Aktionspotenzials haben sich im Laufe der Evolution nicht wesentlich verändert, obwohl die Leitungsgeschwindigkeit mit dem Axonendurchmesser und der Myelinisierung stark variiert. ⓘ
| Tier | Zelltyp | Ruhepotential (mV) | AP-Anstieg (mV) | AP-Dauer (ms) | Konduktionsgeschwindigkeit (m/s) ⓘ |
|---|---|---|---|---|---|
| Tintenfisch (Loligo) | Riesenaxon | −60 | 120 | 0.75 | 35 |
| Regenwurm (Lumbricus) | Mediane Riesenfaser | −70 | 100 | 1.0 | 30 |
| Kakerlake (Periplaneta) | Riesige Faser | −70 | 80–104 | 0.4 | 10 |
| Frosch (Rana) | Axon des Ischiasnervs | -60 bis -80 | 110–130 | 1.0 | 7–30 |
| Katze (Felis) | Spinales Motoneuron | -55 bis -80 | 80–110 | 1–1.5 | 30–120 |
Da das Aktionspotenzial im Laufe der Evolution erhalten blieb, scheint es evolutionäre Vorteile zu bieten. Eine Funktion des Aktionspotentials ist die schnelle, weitreichende Signalübertragung innerhalb des Organismus; die Leitungsgeschwindigkeit kann 110 m/s überschreiten, was einem Drittel der Schallgeschwindigkeit entspricht. Zum Vergleich: Ein Hormonmolekül, das im Blutstrom transportiert wird, bewegt sich in großen Arterien mit etwa 8 m/s. Ein Teil dieser Funktion ist die straffe Koordination mechanischer Vorgänge, wie z. B. der Kontraktion des Herzens. Eine zweite Funktion ist die mit seiner Erzeugung verbundene Berechnung. Da das Aktionspotenzial ein Alles-oder-Nichts-Signal ist, das nicht mit der Übertragungsdistanz abnimmt, hat es ähnliche Vorteile wie die digitale Elektronik. Die Integration verschiedener dendritischer Signale am Axonhügel und deren Schwellenwertbildung zu einer komplexen Folge von Aktionspotenzialen ist eine weitere Form der Berechnung, die in der Biologie zur Bildung zentraler Mustergeneratoren genutzt und in künstlichen neuronalen Netzen nachgeahmt wurde. ⓘ
Man geht davon aus, dass der gemeinsame prokaryotische/eukaryotische Vorfahre, der vor etwa vier Milliarden Jahren lebte, über spannungsgesteuerte Kanäle verfügte. Diese Funktionalität wurde wahrscheinlich zu einem späteren Zeitpunkt für einen Kommunikationsmechanismus genutzt. Selbst moderne einzellige Bakterien können Aktionspotenziale nutzen, um mit anderen Bakterien im selben Biofilm zu kommunizieren. ⓘ
Experimentelle Methoden

Die Untersuchung von Aktionspotenzialen erforderte die Entwicklung neuer experimenteller Methoden. Die ersten Arbeiten vor 1955 wurden hauptsächlich von Alan Lloyd Hodgkin und Andrew Fielding Huxley durchgeführt, die zusammen mit John Carew Eccles 1963 den Nobelpreis für Physiologie oder Medizin für ihren Beitrag zur Beschreibung der ionischen Grundlage der Nervenleitung erhielten. Sie konzentrierte sich auf drei Ziele: die Isolierung von Signalen aus einzelnen Neuronen oder Axonen, die Entwicklung schneller, empfindlicher Elektronik und die Verkleinerung der Elektroden, so dass die Spannung innerhalb einer einzelnen Zelle aufgezeichnet werden konnte. ⓘ
Das erste Problem wurde durch die Untersuchung der riesigen Axone in den Neuronen des Tintenfisches (Loligo forbesii und Doryteuthis pealeii, damals noch als Loligo pealeii klassifiziert) gelöst. Diese Axone haben einen so großen Durchmesser (etwa 1 mm, also 100-mal größer als ein typisches Neuron), dass sie mit bloßem Auge zu sehen sind, was ihre Entnahme und Manipulation erleichtert. Sie sind jedoch nicht repräsentativ für alle erregbaren Zellen, und es wurden zahlreiche andere Systeme mit Aktionspotenzialen untersucht. ⓘ
Das zweite Problem wurde mit der entscheidenden Entwicklung der Spannungsklemme angegangen, die es den Experimentatoren ermöglichte, die einem Aktionspotenzial zugrunde liegenden Ionenströme isoliert zu untersuchen und eine wichtige Quelle elektronischen Rauschens zu eliminieren, nämlich den mit der Kapazität C der Membran verbundenen Strom IC. Da der Strom gleich C mal der Änderungsrate der Transmembranspannung Vm ist, bestand die Lösung darin, eine Schaltung zu entwickeln, die Vm unabhängig von den durch die Membran fließenden Strömen konstant hält (Änderungsrate Null). Der Strom, der erforderlich ist, um Vm auf einem konstanten Wert zu halten, ist somit ein direktes Spiegelbild des Stroms, der durch die Membran fließt. Zu den weiteren elektronischen Fortschritten gehörten die Verwendung von Faradayschen Käfigen und Elektronik mit hoher Eingangsimpedanz, so dass die Messung selbst die gemessene Spannung nicht beeinflusste. ⓘ
Das dritte Problem, nämlich die Beschaffung von Elektroden, die klein genug sind, um Spannungen innerhalb eines einzelnen Axons aufzuzeichnen, ohne es zu stören, wurde 1949 mit der Erfindung der Glasmikropipettenelektrode gelöst, die schnell von anderen Forschern übernommen wurde. Durch Verfeinerung dieser Methode können Elektrodenspitzen hergestellt werden, die bis zu 100 Å (10 nm) fein sind, was ebenfalls zu einer hohen Eingangsimpedanz führt. Aktionspotenziale können auch mit kleinen Metallelektroden aufgezeichnet werden, die direkt neben einem Neuron platziert werden, mit Neurochips, die EOSFETs enthalten, oder optisch mit Farbstoffen, die empfindlich auf Ca2+ oder auf Spannung reagieren. ⓘ

Während Glasmikropipettenelektroden die Summe der Ströme messen, die durch viele Ionenkanäle fließen, wurde die Untersuchung der elektrischen Eigenschaften eines einzelnen Ionenkanals in den 1970er Jahren mit der Entwicklung der Patch-Clamp-Elektrode durch Erwin Neher und Bert Sakmann möglich. Für diese Entdeckung wurden sie 1991 mit dem Nobelpreis für Physiologie oder Medizin ausgezeichnet. Mit der Patch-Clamp-Technik konnte nachgewiesen werden, dass Ionenkanäle diskrete Leitfähigkeitszustände haben, z. B. offen, geschlossen und inaktiviert. ⓘ
In den letzten Jahren wurden optische Bildgebungsverfahren entwickelt, um Aktionspotenziale zu messen, entweder durch gleichzeitige Ableitungen an mehreren Orten oder mit ultra-räumlicher Auflösung. Unter Verwendung spannungsempfindlicher Farbstoffe wurden Aktionspotenziale von einem winzigen Stück der Kardiomyozytenmembran optisch aufgezeichnet. ⓘ
Neurotoxine

Mehrere natürliche und synthetische Neurotoxine sind darauf ausgelegt, das Aktionspotenzial zu blockieren. Tetrodotoxin aus dem Kugelfisch und Saxitoxin aus Gonyaulax (der Dinoflagellaten-Gattung, die für "rote Gezeiten" verantwortlich ist) blockieren Aktionspotenziale durch Hemmung des spannungsempfindlichen Natriumkanals; ähnlich hemmt Dendrotoxin aus der Schwarzen Mamba-Schlange den spannungsempfindlichen Kaliumkanal. Solche Hemmstoffe von Ionenkanälen dienen einem wichtigen Forschungszweck, da sie es den Wissenschaftlern ermöglichen, bestimmte Kanäle nach Belieben "abzuschalten" und so die Beiträge der anderen Kanäle zu isolieren; sie können auch bei der Reinigung von Ionenkanälen durch Affinitätschromatographie oder bei der Bestimmung ihrer Konzentration nützlich sein. Solche Inhibitoren sind jedoch auch wirksame Neurotoxine und wurden für den Einsatz als chemische Waffen in Betracht gezogen. Neurotoxine, die auf die Ionenkanäle von Insekten abzielen, haben sich als wirksame Insektizide erwiesen; ein Beispiel ist das synthetische Permethrin, das die Aktivierung der an Aktionspotenzialen beteiligten Natriumkanäle verlängert. Die Ionenkanäle von Insekten unterscheiden sich ausreichend von denen des Menschen, so dass es beim Menschen kaum Nebenwirkungen gibt. ⓘ
Geschichte

Die Rolle der Elektrizität im Nervensystem von Tieren wurde erstmals von Luigi Galvani, der sie von 1791 bis 1797 untersuchte, an sezierten Fröschen beobachtet. Galvanis Ergebnisse regten Alessandro Volta dazu an, den Voltaischen Pfahl - die früheste bekannte elektrische Batterie - zu entwickeln, mit dem er die Elektrizität von Tieren (z. B. von Zitteraalen) und die physiologischen Reaktionen auf angelegte Gleichspannungen untersuchte. ⓘ
Wissenschaftler des 19. Jahrhunderts untersuchten die Ausbreitung elektrischer Signale in ganzen Nerven (d. h. in Neuronenbündeln) und wiesen nach, dass das Nervengewebe aus Zellen und nicht aus einem zusammenhängenden Netz von Röhren (einem Reticulum) besteht. Carlo Matteucci knüpfte an Galvanis Studien an und wies nach, dass Zellmembranen eine Spannung aufweisen und Gleichstrom erzeugen können. Matteuccis Arbeit inspirierte den deutschen Physiologen Emil du Bois-Reymond, der 1843 das Aktionspotenzial entdeckte. Die Leitungsgeschwindigkeit von Aktionspotenzialen wurde erstmals 1850 von Hermann von Helmholtz, einem Freund von du Bois-Reymond, gemessen. Um nachzuweisen, dass das Nervengewebe aus einzelnen Zellen besteht, verwendeten der spanische Arzt Santiago Ramón y Cajal und seine Studenten eine von Camillo Golgi entwickelte Färbemethode, mit der sie die unzähligen Formen der Neuronen sichtbar machen konnten, die sie in mühevoller Kleinarbeit darstellten. Für ihre Entdeckungen erhielten Golgi und Ramón y Cajal 1906 den Nobelpreis für Physiologie. Ihre Arbeit löste eine langjährige Kontroverse in der Neuroanatomie des 19. Jahrhunderts; Golgi selbst hatte sich für das Netzwerkmodell des Nervensystems eingesetzt. ⓘ

Das 20. Jahrhundert war eine bedeutende Ära für die Elektrophysiologie. In den Jahren 1902 und 1912 stellte Julius Bernstein die Hypothese auf, dass das Aktionspotenzial auf einer Veränderung der Durchlässigkeit der Axonmembran für Ionen beruht. Bernsteins Hypothese wurde von Ken Cole und Howard Curtis bestätigt, die zeigten, dass sich die Membranleitfähigkeit während eines Aktionspotentials erhöht. 1907 schlug Louis Lapicque vor, dass das Aktionspotenzial beim Überschreiten einer Schwelle entsteht, was sich später als Produkt der dynamischen Systeme der Ionenleitfähigkeiten herausstellte. 1949 verfeinerten Alan Hodgkin und Bernard Katz Bernsteins Hypothese, indem sie in Betracht zogen, dass die Axonmembran unterschiedliche Permeabilitäten für verschiedene Ionen aufweisen könnte; insbesondere wiesen sie die entscheidende Rolle der Natriumpermeabilität für das Aktionspotenzial nach. Sie führten die erste tatsächliche Aufzeichnung der elektrischen Veränderungen an der neuronalen Membran durch, die das Aktionspotenzial vermitteln. Diese Forschungslinie gipfelte in den fünf Arbeiten von Hodgkin, Katz und Andrew Huxley aus dem Jahr 1952, in denen sie die Spannungsklemmtechnik anwandten, um die Abhängigkeit der Permeabilitäten der Axonmembran für Natrium- und Kaliumionen von Spannung und Zeit zu bestimmen, woraus sie das Aktionspotenzial quantitativ rekonstruieren konnten. Hodgkin und Huxley setzten die Eigenschaften ihres mathematischen Modells in Beziehung zu diskreten Ionenkanälen, die in verschiedenen Zuständen existieren können, darunter "offen", "geschlossen" und "inaktiviert". Ihre Hypothesen wurden Mitte der 1970er und 1980er Jahre von Erwin Neher und Bert Sakmann bestätigt, die die Technik des Patch-Clampings entwickelten, um die Leitfähigkeitszustände einzelner Ionenkanäle zu untersuchen. Im 21. Jahrhundert beginnen die Forscher, die strukturelle Grundlage für diese Leitfähigkeitszustände und für die Selektivität der Kanäle für ihre Ionenspezies zu verstehen, und zwar mit Hilfe von Kristallstrukturen mit atomarer Auflösung, Fluoreszenzabstandsmessungen und Kryo-Elektronenmikroskopie-Studien. ⓘ
Julius Bernstein war auch der erste, der die Nernst-Gleichung für das Ruhepotential an der Membran aufstellte; diese wurde 1943 von David E. Goldman zur gleichnamigen Goldman-Gleichung verallgemeinert. Die Natrium-Kalium-Pumpe wurde 1957 identifiziert und ihre Eigenschaften schrittweise aufgeklärt, was in der Bestimmung ihrer atomar aufgelösten Struktur durch Röntgenkristallografie gipfelte. Die Kristallstrukturen verwandter Ionenpumpen wurden ebenfalls gelöst, was ein umfassenderes Bild von der Funktionsweise dieser molekularen Maschinen vermittelt. ⓘ
Quantitative Modelle

Mathematische und computergestützte Modelle sind für das Verständnis des Aktionspotenzials von grundlegender Bedeutung und bieten Vorhersagen, die anhand von experimentellen Daten überprüft werden können, was einen strengen Test einer Theorie ermöglicht. Das wichtigste und genaueste der frühen neuronalen Modelle ist das Hodgkin-Huxley-Modell, das das Aktionspotenzial durch einen gekoppelten Satz von vier gewöhnlichen Differentialgleichungen (ODEs) beschreibt. Obwohl das Hodgkin-Huxley-Modell im Vergleich zur realistischen Nervenmembran, wie sie in der Natur vorkommt, eine Vereinfachung mit wenigen Einschränkungen darstellt, hat seine Komplexität mehrere noch stärker vereinfachte Modelle inspiriert, wie das Morris-Lecar-Modell und das FitzHugh-Nagumo-Modell, die beide nur zwei gekoppelte ODEs haben. Die Eigenschaften der Hodgkin-Huxley- und FitzHugh-Nagumo-Modelle und ihrer Verwandten, wie des Bonhoeffer-Van der Pol-Modells, sind in Mathematik, Informatik und Elektronik gut untersucht worden. Die einfachen Modelle des Generatorpotentials und des Aktionspotentials sind jedoch nicht in der Lage, die neuronale Spike-Rate und Spike-Form nahe der Schwelle genau zu reproduzieren, insbesondere bei Mechanorezeptoren wie dem Pacinischen Korpuskel. Modernere Forschungen haben sich auf größere und stärker integrierte Systeme konzentriert; durch die Verbindung von Aktionspotentialmodellen mit Modellen anderer Teile des Nervensystems (wie Dendriten und Synapsen) können Forscher die neuronale Berechnung und einfache Reflexe wie Fluchtreflexe und andere, die von zentralen Mustergeneratoren gesteuert werden, untersuchen. ⓘ
Grundlagen
Ein Aktionspotential verläuft in einer für die Zellart typischen Form. Es dauert bei Nervenzellen oft nur etwa ein bis zwei Millisekunden, bei Skelettmuskelzellen kaum länger, bei Herzmuskelzellen meist über 200 ms. Reizabhängig stärkere oder schwächere Aktionspotentiale gibt es dabei nicht, vielmehr sind es Alles-oder-Nichts-Antworten. Die Signalstärke ergibt sich daher aus der Frequenz von Aktionspotentialen. Sie entstehen bei Nervenzellen typischerweise am Axonhügel und werden in Serien das Axon entlang fortgeleitet. Aktionspotentiale können sich auch rückwärts über den Zellkörper und die Dendriten ausbreiten; die Funktion dieser Weiterleitung wird noch untersucht. Die axonale Ausbreitung vom Zellkörper zum Endknöpfchen wird orthodrom genannt, die gegenläufige antidrom. ⓘ
Voraussetzung für die Ausbildung eines Aktionspotentials sind besondere Eigenschaften der Plasmamembran der Zelle. Die spezifische Ausstattung mit verschiedenen Gruppen von Ionenkanälen spiegelt sich in Kennzeichen der Verlaufsform wider. Zu einer Erregung kommt es, wenn sich das Membranpotential vom Ruhewert entfernt und in Richtung weniger negativer Werte verschiebt. Erreicht diese anfängliche Vordepolarisation eine bestimmte Schwelle, das sogenannte Schwellenpotential (etwa bei −55 mV), werden spannungsgesteuerte Ionenkanäle aktiviert, die sich in verketteter Abfolge öffnen, damit Ionenströme ermöglichen, und wieder inaktivieren. ⓘ
Während dieser Kette von Öffnungs- und Schließungsvorgängen der Kanäle ändern sich also vorübergehend die Membranleitfähigkeiten für verschiedene Ionen. Die damit verbundenen kurzzeitig auftretenden Ionenströme führen gemeinsam zu einem charakteristischen Potentialverlauf. Dessen Form ist zellbezogen die gleiche, unabhängig von der Stärke des auslösenden überschwelligen Reizes. Die kurzzeitigen Änderungen des Potentials breiten sich nun (elektrotonisch) auf den benachbarten Membranbereich aus und können dann erregend auch hier wieder zum Aktionspotential führen, was die Grundlage der Erregungsleitung ist. ⓘ
Ablauf

Initiationsphase
Während der Initiationsphase wird das Membranpotential so verändert, dass es vom Ruhepotential abweicht in Richtung Null, bis die Verringerung des Ladungsgefälles ein gewisses Schwellenpotential erreicht. Diese Vor-Depolarisierung kann im Experiment durch eine Reizelektrode, am Axonhügel durch die Öffnung von postsynaptischen Ionenkanälen (Na+, Ca2+) oder an der Axonmembran durch ein elektrotonisch weitergeleitetes (Aktions)potential aus einer benachbarten Membranregion geschehen. ⓘ
Bei derartigen vordepolarisierenden Veränderungen des Membranpotentials, beispielsweise von −70 auf −60 mV und darüber hinaus, können Kir-Kanäle durch Porenblocker wie Spermin versperrt werden. Damit wird ein in Richtung Ruhepotential gleichrichtend wirkender Kaliumstrom gedämpft. Dies erleichtert das Erreichen des Schwellenpotentials und beschleunigt die folgende Depolarisation bei Öffnung von Natriumkanälen. ⓘ
Refraktärzeit
Nach dem Abklingen des Aktionspotentials ist eine Zelle für eine kurze Zeit nicht erregbar. Bei den Arbeitsmyokardzellen des Herzens ist diese Phase – hier auch „Plateauphase“ genannt – besonders lang anhaltend, was auf einen „langsamen Calcium-Einstrom“ zurückgeführt wird. Dieser Umstand ist bedeutend, denn so wird ein rückläufiger Wiedereintritt der Erregung verhindert (Unidirektionalität). Die Dauer dieser Zeitspanne, die Refraktärzeit, ist abhängig vom Zeitverlauf der Wiederaktivierung von NaV-Kanälen. Während der absoluten Refraktärphase kurz nach dem Overshoot, wenn die Repolarisation noch im Gange ist, können diese Kanäle überhaupt nicht wieder öffnen. Man sagt auch, der Schwellenwert liegt bei unendlich. Während der relativen Refraktärphase benötigt man stärkere Reize und erhält schwächere Aktionspotentiale. Hier bewegt sich der Schwellenwert von unendlich wieder auf seinen normalen Wert zu. ⓘ
Schwellenpotential
Meist wird die Auslösung eines Aktionspotentials beschrieben als das Überschreiten eines bestimmten Schwellenpotentials, ab dem Natriumkanäle konzertiert geöffnet werden. Trotz aller Bemühungen eine solche exakte „Feuerschwelle“ zu finden, kann kein fixer Spannungswert angegeben werden als Bedingung für ein Aktionspotential. Stattdessen feuern Neurone auf einem relativen breiten Band auslösender Membranspannungen. Daher wird neurowissenschaftlich von der Vorstellung eines festen Wertes für das Schwellenpotential Abstand genommen. Systemtheoretisch lässt sich der Entstehungsprozess eines Aktionspotentials am ehesten durch eine Bifurkation wie beispielsweise beim Hodgkin-Huxley-Modell beschreiben. Dennoch ist es, auch in der Fachliteratur, durchaus üblich, weiterhin von einer Schwelle zu sprechen, um den „grauen Bereich zwischen Ruhe und Aktionspotential“ abgrenzend zu kennzeichnen. ⓘ
Tierische Aktionspotentiale
Bei Purkinjezellen können Aktionspotentiale in ihrer Häufigkeit außer durch spannungsaktivierte Natriumkanäle auch durch spannungsaktivierte Calciumkanäle moduliert werden. ⓘ




