Urämie
| Uremia ⓘ | |
|---|---|
| Andere Namen | Urämie |
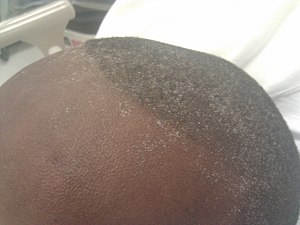 | |
| Urämischer Reif auf der Stirn und der Kopfhaut eines jungen Mannes, der über Anorexie und Müdigkeit klagte und dessen Blut-Harnstoff-Stickstoff- und Serum-Kreatininwerte etwa 100 bzw. 50 mg/dL betrugen. | |
| Fachgebiet | Nephrologie |
Urämie ist die Bezeichnung für hohe Harnstoffwerte im Blut. Harnstoff ist einer der Hauptbestandteile des Urins. Es handelt sich um einen Überschuss an Endprodukten des Aminosäuren- und Eiweißstoffwechsels, wie Harnstoff und Kreatinin, im Blut, der normalerweise mit dem Urin ausgeschieden wird. Das urämische Syndrom kann als die letzte klinische Manifestation des Nierenversagens (auch Nierenversagen genannt) definiert werden. Es handelt sich um die Anzeichen, Symptome und Ergebnisse von Labortests, die auf eine unzureichende Ausscheidungs-, Regulations- und endokrine Funktion der Nieren zurückzuführen sind. Die Begriffe Urämie und urämisches Syndrom werden austauschbar verwendet, um eine sehr hohe Plasmaharnstoffkonzentration zu bezeichnen, die das Ergebnis eines Nierenversagens ist. Im weiteren Verlauf des Artikels wird die erste Bezeichnung verwendet. ⓘ
Azotämie ist ein ähnlicher, weniger schwerwiegender Zustand mit hohen Harnstoffkonzentrationen, bei dem die Anomalie zwar chemisch gemessen werden kann, aber noch nicht so schwerwiegend ist, dass sie Symptome verursacht. Die Urämie beschreibt die pathologischen und symptomatischen Erscheinungsformen einer schweren Azotämie. ⓘ
Es gibt keinen bestimmten Zeitpunkt für das Auftreten einer Urämie bei Menschen mit fortschreitendem Verlust der Nierenfunktion. Menschen mit einer Nierenfunktion von weniger als 50 % (d. h. einer glomerulären Filtrationsrate [GFR] zwischen 50 und 60 ml/min) und einem Alter von über 30 Jahren können bis zu einem gewissen Grad an Urämie leiden. Das bedeutet, dass schätzungsweise 8 Millionen Menschen in den Vereinigten Staaten mit einer GFR von weniger als 60 mL/min urämische Symptome haben. Die Symptome, wie z. B. Müdigkeit, können sehr vage sein, was die Diagnose einer eingeschränkten Nierenfunktion erschwert. Die Behandlung kann durch eine Dialyse oder eine Nierentransplantation erfolgen, obwohl sich manche Patienten stattdessen für eine Symptomkontrolle und konservative Behandlung entscheiden. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| N19 | Nicht näher bezeichnete Niereninsuffizienz |
| R39.2 | Extrarenale Urämie |
| ICD-10 online (WHO-Version 2019) | |
Das Wort Urämie (von lateinisch urina, deutsch ‚Urin‘, und altgriechisch αἷμα haĩma, deutsch ‚Blut‘) bedeutet „Urin im Blut“, also das vermehrte Auftreten harnpflichtiger Substanzen im Blut aufgrund fehlender oder ungenügender Nierenfunktion (Niereninsuffizienz). Die Folge dieser unzureichenden Reinigung des Blutes ist eine Harnvergiftung durch schädliche Harnbestandteile (Urämietoxine, Nephrotoxine). Man spricht auch von der Retentionsurämie und beim Überwiegen von Endprodukten des Stickstoff-Stoffwechsels von der azotämischen Urämie. ⓘ
Das klinische Vollbild einer Urämie kann akut (5–10 Tage nach akutem Nierenversagen) oder chronisch (sich über Jahre hinweg sich entwickelnd beim chronischen Nierenversagen) auftreten. ⓘ
Als Pseudourämie bezeichnete man früher zerebrale Störungen bei chronischer arterieller Hypertonie mit Verwirrungszuständen (wie bei der Zerebralsklerose) auch ohne eine Niereninsuffizienz. ⓘ
Anzeichen und Symptome
Klassische Anzeichen einer Urämie sind: fortschreitende Schwäche und leichte Müdigkeit, Appetitlosigkeit aufgrund von Übelkeit und Erbrechen, Muskelschwund, Zittern, abnorme geistige Funktionen, häufige flache Atmung und metabolische Azidose. Ohne Intervention durch Dialyse oder Nierentransplantation schreitet die Urämie aufgrund von Nierenversagen fort und führt zu Stupor, Koma und Tod. Da die Urämie meist eine Folge des Nierenversagens ist, treten ihre Anzeichen und Symptome häufig gleichzeitig mit anderen Anzeichen und Symptomen des Nierenversagens auf. ⓘ
| Betroffener Bereich | Anzeichen und Symptome |
|---|---|
| Zentrales Nervensystem | Tagesschläfrigkeit, nächtliche Schlaflosigkeit, Gedächtnis- und Konzentrationsstörungen, Asthenie, Kopfschmerzen, Verwirrtheit, Müdigkeit, Krampfanfälle, Koma, Enzephalopathie, verminderter Geschmacks- und Geruchsinn, Schluckauf, Serositis |
| Peripheres Nervensystem | Polyneuritis, unruhige Beine, Krämpfe, periphere Neuropathie, oxidativer Stress, reduzierte Körpertemperatur |
| Gastrointestinales System | Anorexie, Übelkeit, Erbrechen, Gastroparese, Parotitis, Stomatitis, oberflächliche gastrointestinale Geschwüre |
| Hämatologisch | Anämie, Hämostasestörungen, granulozytäre, lymphozytäre und thrombozytäre Dysfunktion |
| Kardiovaskulär | Bluthochdruck, Arteriosklerose, koronare Herzkrankheit, Perikarditis, periphere und pulmonale Ödeme |
| Haut | Juckreiz, Hauttrockenheit, Calciphylaxie, urämischer Frost (Ausscheidung von Harnstoff über die Haut) |
| Endokrinologie | Wachstumsstörungen, Impotenz, Unfruchtbarkeit, Sterilität, Amenorrhöe |
| Skelett | Osteomalazie, β2-Mikroglobulin-Amyloidose, Knochenerkrankungen (durch Vitamin-D-Mangel, sekundären Hyperparathyreoidismus und Hyperphosphatämie) |
| Ernährung | Unterernährung, Gewichtsverlust, Muskelkatabolismus |
| Andere | urämischer Fötus |
| Immunität | niedrige Ansprechrate auf Impfungen, erhöhte Anfälligkeit für Infektionskrankheiten, systemische Entzündungen |
Die glomeruläre Filtrationsrate (GFR) misst die Plasmamenge in Millilitern, die pro Minute durch die Nieren gefiltert wird. Wenn die GFR abnimmt, verschlechtert sich die Prognose. Einige der Auswirkungen können, wenn auch nur vorübergehend, durch eine Dialysebehandlung rückgängig gemacht werden. ⓘ
| GFR (mL/min) | Auswirkungen |
|---|---|
| 100–120 | Normale GFR |
| <60 | Urämische Symptome können vorhanden sein, vermindertes Wohlbefinden |
| 30–60 | Kognitive Beeinträchtigung |
| 55 | Müdigkeit und verminderte Ausdauer |
| <50 | Insulinresistenz |
| <30 | Erhöhte Wahrscheinlichkeit von Symptomen |
| ≤15 | Nierenversagen |
Residuales Syndrom
Dialysepatienten erkranken am so genannten "Residualsyndrom". Das Residualsyndrom ist eine nicht lebensbedrohliche Erkrankung, die sich als toxische Wirkung zeigt und viele der gleichen Anzeichen und Symptome wie die Urämie verursacht. Es gibt mehrere Hypothesen, warum ein Residualsyndrom auftritt. Diese sind: die Anhäufung großmolekularer gelöster Stoffe, die schlecht dialysiert werden (z. B. β2-Mikroglobulin); die Anhäufung proteingebundener kleinmolekularer gelöster Stoffe, die schlecht dialysiert werden (z. B. p-Kresylsulfat und Indoxylsulfat); die Anhäufung dialysierbarer gelöster Stoffe, die unvollständig entfernt werden (z. B. die Anhäufung von dialysierbaren gelösten Stoffen, die unvollständig entfernt werden (z. B. sequestrierte gelöste Stoffe wie Phosphat in den Zellen oder unzureichende Eliminierung anderer toxischer gelöster Stoffe); indirekte Phänomene wie die Carbamylierung von Proteinen, Gewebeverkalkung oder die toxische Wirkung eines Hormonungleichgewichts (z. B. Parathormon) und die toxischen Auswirkungen der Dialyse selbst (z. B. Entfernung unbekannter wichtiger Vitamine oder Mineralien). Die Dialyse verlängert zwar die Lebensdauer, aber die Patienten können in ihrer Funktion stärker eingeschränkt sein. Sie haben körperliche Einschränkungen, darunter Beeinträchtigungen des Gleichgewichts, der Gehgeschwindigkeit und der sensorischen Funktionen. Sie haben auch kognitive Beeinträchtigungen wie Beeinträchtigungen der Aufmerksamkeit, des Gedächtnisses und der Ausführung von Aufgaben höherer Ordnung. Die Patienten werden länger als drei Jahrzehnte an der Dialyse gehalten, aber die durchschnittliche Sterblichkeitsrate und die Krankenhausaufenthalte sind hoch. Auch die Rehabilitation und Lebensqualität der Patienten ist schlecht. ⓘ
Ursachen
Zu einer renal bedingten Urämie kann es auf zwei Wegen kommen: Wenn die glomeruläre Filtration abnimmt, wird zu wenig Plasma von den harnpflichtigen Stoffen gereinigt. Ihr Serumspiegel steigt an. Wenn dagegen die tubuläre Rückresorption zunimmt, steigt der Plasmaspiegel der harnpflichtigen Stoffe ebenfalls an. Eine Abnahme der Glomerulären Filtrationsrate kann also ebenso wie ein Anstieg der tubulären Rückresorptionsrate zu einer Urämie führen. ⓘ
Nicht jede Nierenkrankheit führt zu einer Urämie. Nicht jede Urämie beruht auf einer Nierenkrankheit. Hier ist an die extrarenalen Nierensyndrome nach Wilhelm Nonnenbruch zu denken, also an die Niereninsuffizienz auch ohne Nierenkrankheit. Zu erwähnen sind hier zum Beispiel das Kardiorenalsyndrom und das Hepatorenalsyndrom. Nonnenbruch beschrieb 1949 die extrarenale Urämie sogar bei Patienten mit einer Anurie. 1953 wurde in der deutschen Ausgabe der ICD-6 (Internationale statistische Klassifikation der Krankheiten und verwandter Gesundheitsprobleme) die extrarenale Urämie mit N 899 verschlüsselt. Heute wird sie in der ICD-10 mit R 39.2 klassifiziert. ⓘ
Außerdem führt bei bestimmten Stoffwechselstörungen eine krankhaft vermehrte Bildung von Urämietoxinen unabhängig von der Nierenfunktion ebenfalls zu einer Urämie (Überproduktionsurämie). ⓘ

Die Ursachen für einen erhöhten Harnstoffgehalt im Blut lassen sich in drei verschiedene Kategorien einteilen: prärenale, renale und postrenale Azotämie. ⓘ
Eine prärenale Azotämie kann durch einen verminderten Blutfluss durch die Nieren (z. B. niedriger Blutdruck, kongestive Herzinsuffizienz, Schock, Blutungen, Dehydratation) oder durch eine erhöhte Produktion von Harnstoff in der Leber durch eine proteinreiche Ernährung oder einen erhöhten Proteinkatabolismus (z. B. Stress, Fieber, schwere Krankheit, Kortikosteroidtherapie oder gastrointestinale Blutungen) verursacht werden. ⓘ
Nierenbedingte Ursachen können auf eine verminderte Nierenfunktion zurückzuführen sein. Dazu gehören akutes und chronisches Nierenversagen, akute und chronische Glomerulonephritis, tubuläre Nekrosen und andere Nierenerkrankungen. ⓘ
Postrenale Ursachen können auf eine verminderte Ausscheidung von Harnstoff zurückzuführen sein. Diese können auf eine Behinderung des Harnabflusses, z. B. durch Steine, Blasen- oder Prostatatumore oder eine schwere Infektion, zurückzuführen sein. ⓘ
Diagnose
Durch eine ausführliche und genaue Anamnese und körperliche Untersuchung lässt sich feststellen, ob die Urämie akut oder chronisch ist. Bei einer akuten Urämie können die Ursachen ermittelt und beseitigt werden, so dass sich die Chancen auf eine Wiederherstellung der normalen Nierenfunktion erhöhen, wenn sie richtig behandelt wird. ⓘ
Blutuntersuchungen
Die wichtigsten Tests zur Diagnose einer Urämie sind ein Basis-Stoffwechselpanel mit Serumkalzium und -phosphor zur Bestimmung der GFR, des Blut-Harnstoff-Stickstoffs und des Kreatinins sowie des Serumkalium-, -phosphat-, -kalzium- und -natriumspiegels. Die Hauptanomalie ist eine sehr niedrige GFR (<30 mL/min). Bei einer Urämie sind sowohl der Harnstoff- als auch der Kreatininwert erhöht, der Kaliumwert ist wahrscheinlich erhöht, der Phosphatwert ist hoch, der Natriumwert ist normal oder leicht erhöht und der Kalziumwert ist wahrscheinlich erniedrigt. Im Rahmen einer Basisuntersuchung wird der Arzt auch die Anämie sowie die Schilddrüsen- und Nebenschilddrüsenfunktionen untersuchen. Eine chronische Anämie kann ein untrügliches Zeichen für eine bestehende Niereninsuffizienz sein. Die Schilddrüsen- und Nebenschilddrüsenwerte helfen bei der Abklärung von Müdigkeitssymptomen sowie bei der Bestimmung von Kalziumanomalien im Zusammenhang mit Urämie im Vergleich zu langjährigen oder nicht damit verbundenen Erkrankungen des Kalziumstoffwechsels. ⓘ
Urinuntersuchungen
Eine 24-Stunden-Urinsammlung zur Bestimmung der Kreatinin-Clearance kann eine Alternative sein, auch wenn der Test aufgrund des Sammelverfahrens nicht sehr genau ist. Eine weitere Laboruntersuchung, die in Betracht gezogen werden sollte, ist die Urinanalyse mit mikroskopischer Untersuchung auf Eiweiß, Gips, Blut und pH-Wert. ⓘ
Radioisotopen-Tests
Der zuverlässigste Test zur Bestimmung der GFR ist die Iothalamat-Clearance. Er kann jedoch kostenintensiv und zeitaufwändig sein. Klinische Labors berechnen die GFR im Allgemeinen mit der MDRD-Formel (Modification of Diet in Renal Disease) oder der Cockcroft-Gault-Formel. ⓘ
Andere
Darüber hinaus können Gerinnungsuntersuchungen eine verlängerte Blutungszeit bei ansonsten normalen Werten anzeigen. ⓘ
Mechanismus
Die Urämie führt dazu, dass viele verschiedene Verbindungen vom Körper zurückgehalten werden. Durch das Versagen der Nieren können sich diese Verbindungen in gefährlichen Mengen anreichern. Es sind mehr als 90 verschiedene Verbindungen identifiziert worden. Einige dieser Verbindungen können für den Körper giftig sein. ⓘ
| Gelöste Gruppe | Beispiel | Quelle | Eigenschaften |
|---|---|---|---|
| Peptide und kleine Proteine | β2-Mikroglobulin | aus dem Haupthistokompatibilitätskomplex ausgeschieden | wegen ihrer Größe schlecht dialysierbar |
| Guanidine | Guanidinobernsteinsäure | Arginin | erhöhte Produktion bei Urämie |
| Phenole | ρ-Kresylsulfat | Phenylalanin, Tyrosin | proteingebunden, von Darmbakterien produziert |
| Indole | Indikan | Tryptophan | proteingebunden, von Darmbakterien produziert |
| Aliphatische Amine | Dimethylamin | Cholin | großes Verteilungsvolumen, produziert von Darmbakterien |
| Polyole | CMPF | unbekannt | stark proteingebunden |
| Ukleoside | Pseudouridin | tRNA | prominenteste von mehreren veränderten RNA-Arten |
| Dicarboxylsäuren | Oxalat | Ascorbinsäure | Bildung von Kristallablagerungen |
| Carbonyle | Glyoxal | glykolytische Zwischenprodukte | Reaktion mit Proteinen zur Bildung von fortgeschrittenen Glykationsendprodukten |
Urämische Toxine
Urämische Toxine sind alle biologisch aktiven Verbindungen, die aufgrund von Nierenfunktionsstörungen zurückgehalten werden. Viele urämische Salze können auch urämische Toxine sein. ⓘ
Harnstoff war einer der ersten identifizierten Metaboliten. Seine Beseitigung steht in direktem Zusammenhang mit dem Überleben des Patienten, aber seine Wirkung auf den Körper ist noch nicht klar. Es ist jedoch nicht sicher, dass die derzeit mit Urämie assoziierten Symptome tatsächlich durch überschüssigen Harnstoff verursacht werden, da eine Studie gezeigt hat, dass urämische Symptome durch den Beginn der Dialyse gelindert wurden, selbst wenn dem Dialysat Harnstoff zugesetzt wurde, um den Harnstoff-Stickstoff-Spiegel im Blut auf etwa 90 mg pro Deziliter (d. h. etwa 32 mmol pro Liter) zu halten. Harnstoff könnte die Vorstufe weiterer toxischer Moleküle sein, doch ist es wahrscheinlicher, dass die Schädigung des Körpers auf eine Kombination verschiedener Verbindungen zurückzuführen ist, die als Enzyminhibitoren wirken oder den Membrantransport stören können. Indoxylsulfat ist eines der besser charakterisierten urämischen Toxine. Es hat sich gezeigt, dass Indoxylsulfat die Gefäßentzündung bei Atherosklerose verschlimmert, indem es das Verhalten von Makrophagen moduliert. ⓘ
| Toxin | Wirkung | Referenzen |
|---|---|---|
| Harnstoff | Bei hohen Konzentrationen [>300 mg/dL (>50 mmol/L)]: Kopfschmerzen, Erbrechen, Müdigkeit, Carbamylierung von Proteinen | |
| Kreatinin | Beeinträchtigt möglicherweise die Glukosetoleranz und die Überlebensfähigkeit der Erythrozyten | |
| Zyanat | Schläfrigkeit und Hyperglykämie, Carbamylierung von Proteinen und veränderte Proteinfunktion, da es ein Abbauprodukt von Harnstoff ist | |
| Polyole (z. B. Myoinositol) | Periphere Neuropathie | |
| Phenole | Können hochgradig toxisch sein, da sie fettlöslich sind und daher die Zellmembranen leicht passieren können | |
| "Mittlere Moleküle" | Peritonealdialysepatienten scheiden mittlere Moleküle effizienter aus als Hämodialysepatienten. Sie zeigen weniger Anzeichen von Neuropathie als Hämodialysepatienten | |
| β2-Mikroglobulin | Nieren-Amyloid | |
| Indoxylsulfat | Verursacht Nierenfunktionsstörungen und kardiovaskuläre Funktionsstörungen; steht in Verbindung mit chronischen Nierenerkrankungen und kardiovaskulären Erkrankungen | |
| ρ-Kresylsulfat | Häuft sich bei chronischer Nierenerkrankung an und sagt diese voraus |
Biochemische Merkmale
Viele Regulationsfunktionen des Körpers sind betroffen. Die Regulierung der Körperflüssigkeiten, die Salzretention sowie die Ausscheidung von Säuren und stickstoffhaltigen Metaboliten sind beeinträchtigt und können starken Schwankungen unterliegen. Die Regulierung der Körperflüssigkeit ist gestört, wenn die Ausscheidung von Flüssigkeit ausbleibt oder wenn der Flüssigkeitsverlust durch Erbrechen oder Durchfall verursacht wird. Die Salzregulation ist gestört, wenn die Salzzufuhr gering oder das Gefäßvolumen unzureichend ist. Die Ausscheidung von Säuren und stickstoffhaltigen Stoffwechselprodukten ist durch den Verlust der Nierenfunktion beeinträchtigt. ⓘ
| Zurückgehaltene stickstoffhaltige Stoffwechselprodukte | Flüssigkeits-, Säure-Basen- und Elektrolyt-Störungen | Unverträglichkeit von Kohlenhydraten | Anormaler Fettstoffwechsel | Veränderte endokrine Funktion |
|---|---|---|---|---|
| Harnstoff | Feste Urin-Osmolalität | Insulinresistenz (auch Hypoglykämie kann auftreten) | Hypertriglyceridämie | Sekundärer Hyperparathyreoidismus |
| Zyanat | Metabolische Azidose | Plasma-Insulin normal oder erhöht | Verringertes High-Density-Lipoprotein-Cholesterin | Veränderter Thyroxin-Stoffwechsel |
| Kreatinin | Hyponatriämie oder Hypernatriämie oder Hyperkalzämie | Verzögertes Ansprechen auf Kohlenhydratzufuhr | Hyperlipoproteinämie | Hyperreninämie und Hyperaldosteronismus |
| Guanidin-Verbindungen | Hyperchlorämie | Hyperglukagonämie | Hyporeninämie | |
| "Mittlere Moleküle" | Hypokalzämie | Hypoaldosteronismus | ||
| Harnsäure | Hyperphosphatämie | Verminderte Erythropoietin-Produktion | ||
| Hypermagnesiämie | Gonadale Dysfunktion (erhöhtes Prolaktin und luteinisierendes Hormon, vermindertes Testosteron) | |||
| Verminderte Aktivität der Natrium-Kalium-ATPase | Erhöhtes Serumgastrin und Melanozyten-stimulierendes Hormon |
Vorgeschichte
Harnstoff wurde zwischen 1797 und 1808 kristallisiert und identifiziert. In dieser Zeit wurde die Hypothese aufgestellt, dass Harnstoff die Quelle von Ammoniak im Urin ist, was 1817 bestätigt wurde. Es wurde die Hypothese aufgestellt, dass ein Überschuss an Harnstoff zu bestimmten Störungen führen kann. Später, im Jahr 1821, wurde bestätigt, dass der Körper tatsächlich Harnstoff produziert und dass dieser über die Nieren ausgeschieden wird. 1827 wurde Harnstoff zum ersten Mal im Labor synthetisiert, was die Zusammensetzung von Harnstoff bestätigte und ihn zum ersten biologischen Stoff machte, der synthetisiert wurde. Im Jahr 1856 wurde Harnstoff in vitro durch Oxidation von Proteinen hergestellt. 1827 brachte Henri Dutrochet die Idee der Dialyse auf den Weg, indem er entdeckte, wie sich kleinere Moleküle durch eine halbdurchlässige Membran von größeren trennen lassen. In den Jahren 1829 und 1831 wurden überzeugende Beweise dafür erbracht, dass bei bestimmten Patienten der Harnstoffgehalt im Blut erhöht war. Sie deuteten auch darauf hin, dass dadurch Schäden verursacht werden könnten. Spätere Untersuchungen ergaben, dass schwerwiegende neurologische Störungen wie Koma und Krämpfe nicht mit körperlichen Befunden wie generalisierten Hirnödemen korrelierten. Dies legte nahe, dass Urämie eine Form der Blutvergiftung war. 1851 beschrieb E.T. Frerich das klinische urämische Syndrom und schlug vor, dass der Mechanismus der Ursache eine Toxizität war. Im Jahr 1856 entwickelte J. Picard eine empfindliche Methode zur reproduzierbaren Messung des Blutharnstoffs. Er konnte eine 40 %ige Abnahme der Harnstoffkonzentration zwischen der Nierenarterie und der Nierenvene feststellen. Diese Arbeit bestätigte die Tatsache, dass Nierenversagen mit einem Anstieg des Blutharnstoffs einhergeht. Es waren die Arbeiten von J. Picard und E.T. Frerich, die den Begriff Urämie populär machten. ⓘ
Orale Manifestationen
Orale Symptome der Urämie finden sich bei bis zu 90 % der Nierenpatienten. Die Patienten können sich mit ammoniakartigem Geschmack und Geruch im Mund, Stomatitis, Gingivitis, vermindertem Speichelfluss, Xerostomie und Parotitis vorstellen. ⓘ
Eines der ersten Symptome von Nierenversagen ist urämischer Fetor. Dabei handelt es sich um einen Ammoniakgeruch im Mund, der durch die hohe Konzentration von Harnstoff im Speichel verursacht wird, der anschließend zu Ammoniak abgebaut wird. Wenn der Blut-Harnstoff-Stickstoff-Spiegel (BUN) ansteigt, kann der Patient eine urämische Stomatitis entwickeln. Die urämische Stomatitis äußert sich in Form von Pseudomembranen oder offenen Ulzerationen mit Rötung und eitrigem Belag im Mund. Diese Läsionen können mit einem hohen BUN-Spiegel (>150 mg/dl) zusammenhängen und verschwinden spontan, wenn der BUN-Spiegel durch medizinische Behandlung gesenkt wird. Es wird angenommen, dass sie durch den Verlust der Gewebsresistenz und die Unfähigkeit, traumatischen Einflüssen zu widerstehen, verursacht werden. Außerdem kann der Patient eine seltene Erscheinung entwickeln, den urämischen Reif. Dabei handelt es sich um einen weißen Belag auf der Haut oder im Mund, der durch restliche Harnstoffkristalle verursacht wird, die nach dem Schwitzen und der Speichelverdunstung oder infolge eines verminderten Speichelflusses auf der Epitheloberfläche zurückbleiben. Xerostomie ist ein häufiger oraler Befund, der durch eine Kombination aus direkter Beteiligung der Speicheldrüsen, chemischer Entzündung, Dehydratation und Mundatmung entsteht. Sie kann auf eine eingeschränkte Flüssigkeitsaufnahme, eine unerwünschte Wirkung einer Arzneimitteltherapie oder eine geringe Speichelmenge zurückzuführen sein. Gelegentlich kann eine Speichelschwellung beobachtet werden. ⓘ
Bei Patienten mit einer Nierenerkrankung kann manchmal eine Blässe der Mundschleimhaut festgestellt werden, die auf eine Anämie infolge einer Verringerung des Erythropoietinspiegels zurückzuführen ist. Eine Harnvergiftung kann zu einer Veränderung der Thrombozytenaggregation führen. In Verbindung mit der Verwendung von Heparin und anderen Antikoagulantien bei der Hämodialyse führt dies dazu, dass die Patienten anfällig für Ekchymosen, Petechien und Blutungen in der Mundhöhle sind. Sie kann auch zu Mukositis und Glossitis führen, die Schmerzen und Entzündungen der Zunge und der Mundschleimhaut verursachen können. Darüber hinaus können die Patienten ein verändertes Geschmacksempfinden und Dysgeusie haben und anfällig für bakterielle Infektionen und Candidosen sein. Bei Nierentransplantationspatienten tritt die Candidose aufgrund der allgemeinen Immunsuppression häufiger auf. ⓘ
Bei Kindern mit einer Nierenerkrankung wurde eine Schmelzhypoplasie im Milchgebiss und im bleibenden Gebiss beobachtet. Die Anomalien der Zahnentwicklung korrelieren mit dem Alter, in dem die Stoffwechselstörungen auftreten. Eine Schmelzhypoplasie in Form einer weißen oder braunen Verfärbung der Milchzähne wird zum Beispiel häufig bei Kleinkindern mit früh einsetzender Nierenerkrankung beobachtet. Schlechte Mundhygiene, kohlenhydratreiche Ernährung, krankheitsbedingte Schwächung, hypoplastischer Zahnschmelz, geringer Speichelfluss und Langzeitmedikation tragen zu einem erhöhten Risiko der Kariesbildung bei. Allerdings haben die Patienten in der Regel eine geringe Kariesaktivität, insbesondere bei Kindern. Dies ist auf das Vorhandensein von stark gepuffertem und alkalischem Speichel zurückzuführen, der durch die hohe Konzentration von Harnstoffstickstoff und Phosphat im Speichel verursacht wird. Der pH-Wert des Speichels liegt in der Regel über dem kritischen pH-Wert, bei dem eine Demineralisierung des Zahnschmelzes eintreten kann, und dies trägt dazu bei, die Bildung von Karies zu verhindern. Außerdem sind Pulpaverengungen und Verkalkungen ein häufiger Befund bei Patienten mit Nierenerkrankungen. Bei Dialysepatienten können Übelkeit und Erbrechen infolge der Dialysebehandlung zu schweren Zahnerosionen führen. ⓘ
Zahnärztliche Überlegungen
Bei der Behandlung von Patienten mit Niereninsuffizienz sollte der Zahnarzt eine vollständige Anamnese erheben, mit besonderem Augenmerk auf Krankheiten im Zusammenhang mit der Niereninsuffizienz, Medikamente mit den vorgeschriebenen Dosierungen, Blutparameter, Zeitpunkt und Art der durchgeführten Dialyse. Diese Aspekte können bei Bedarf direkt mit dem Nephrologen besprochen werden. Jede Änderung der Medikamente oder anderer Behandlungsaspekte muss vorher mit dem Nephrologen abgesprochen werden. ⓘ
Die zahnärztliche Untersuchung bei diesen Patienten besteht aus einer nicht-invasiven Komplettuntersuchung des Zahn-, Parodontal- und Schleimhautgewebes mit Röntgenaufnahmen zur Unterstützung des diagnostischen Prozesses. Alle potenziellen Infektionsherde sollten erfasst werden; dazu gehören parodontale und endodontische Läsionen, Wurzelreste, teilweise durchgebrochene und falsch positionierte dritte Molaren, Periimplantitis und Schleimhautläsionen. Wenn der Verdacht auf Parodontitis besteht, sollte ein Parodontalregister geführt werden. Kieferorthopädische Apparaturen können beibehalten werden, wenn sie die Mundhygiene nicht beeinträchtigen. ⓘ
Eine Urämie tritt häufig bei Patienten auf, die sich aufgrund einer Niereninsuffizienz einer Dialyse unterziehen. Für Hämodialysepatienten ist es wichtig, den Behandlungsplan festzulegen. Die zahnärztliche Behandlung sollte aus mehreren Gründen am Tag nach der Hämodialyse begonnen werden: Es gibt keine Anhäufung von urämischen Toxinen im Blut, und es gibt kein zirkulierendes Heparin. Die Behandlung sollte nicht am selben Tag wie die Hämodialyse begonnen werden, da sich die Patienten in der Regel unwohl fühlen und ihr Blut heparinisiert ist, was zu übermäßigen Blutungen führen kann. Bei Patienten, die sich einer Peritonealdialyse unterziehen, gibt es keine Kontraindikationen für eine zahnärztliche Behandlung, außer im Falle einer akuten Peritonealinfektion, bei der die Behandlung aufgeschoben werden sollte. ⓘ
Besondere Vorsicht ist bei der Lagerung des Patienten geboten, um eine Kompression des Arms mit dem Gefäßzugang für die Hämodialyse zu vermeiden. Injektionen oder Blutdruckmessungen sollten nicht an einem Arm mit einer arteriovenösen (AV) Fistel durchgeführt werden. Befindet sich die AV-Stelle an einem Bein, sollte der Patient längeres Sitzen vermeiden, da der venöse Abfluss behindert werden kann. Während langer zahnärztlicher Behandlungen sollte der Zahnarzt Patienten mit AV-Stellen an den Beinen jede Stunde die Möglichkeit geben, kurz zu gehen oder aufzustehen. ⓘ
Bei übermäßigen Blutungen, wie sie häufig bei Urämie und Niereninsuffizienz auftreten, sollten hämostatische Hilfsmittel eingesetzt werden. Zur Behandlung postoperativer Blutungen sollten routinemäßig primäre Verschlusstechniken und lokale hämostatische Mittel eingesetzt werden. Zur Verringerung von Blutungen während und nach einem Eingriff kann Tranexamsäure, sowohl als Spülung als auch oral verabreicht, eingesetzt werden. ⓘ
Patienten, die sich einer Dialyse unterziehen, sind zahlreichen Transfusionen und einer durch die Niereninsuffizienz bedingten Immunsuppression ausgesetzt; daher besteht für sie ein höheres Risiko einer Infektion mit dem Humanen Immundefizienz-Virus (HIV) und Hepatitis Typ B und C. Es ist wichtig, Maßnahmen zur Infektionskontrolle zu ergreifen, um eine Kreuzkontamination in der Zahnklinik zu vermeiden und das Risiko einer Exposition des zahnärztlichen Personals zu verhindern. ⓘ
Die meisten Medikamente werden zumindest teilweise über die Nieren aus dem Körper ausgeschieden. Bei Nierenversagen verlängert sich die Plasmahalbwertszeit von Arzneimitteln, die normalerweise über den Urin ausgeschieden werden, was zu einer erhöhten Toxizität führt. Viele Arzneimittel, die normalerweise sicher verabreicht werden können, können Patienten mit eingeschränkter Nierenfunktion nicht verabreicht werden. Darüber hinaus können einige Arzneimittel verabreicht werden, aber die Dosierung muss reduziert werden. Bei Patienten, die sich einer Dialyse unterziehen, wird jedoch eine verringerte Plasmahalbwertszeit der Arzneimittel beobachtet. Antibiotika der Aminoglykosid- und Tetrazyklin-Familie müssen aufgrund ihrer Nephrotoxizität vermieden werden. Die Antibiotika der Wahl sind Penicilline, Clindamycin und Cephalosporine, die in normaler Dosierung verabreicht werden können, auch wenn der therapeutische Bereich erweitert wird. Bei den Analgetika ist Paracetamol das Mittel der Wahl bei episodischen Schmerzen. Aspirin hat eine plättchenhemmende Wirkung und sollte daher bei urämischen Patienten nicht eingesetzt werden. Die Herausforderung bei der Pharmakotherapie von Patienten mit Nierenerkrankungen besteht darin, den therapeutischen Spiegel eines Medikaments in einem engen Bereich zu halten, um eine subtherapeutische Dosierung und Toxizität zu vermeiden. ⓘ
Geschichte
Schon Carl Anton Ewald konnte 1898 in der Real-Encyclopädie der gesammten Heilkunde die einzelnen Symptome der Urämie nicht in Übereinstimmung mit den einzelnen „retinierten Stoffwechselprodukten“ bringen. Bereits 1888 schrieb er: „Aus der Retention der Stoffwechselproducte resultirt die Urämie. Die urämischen Erscheinungen treten am schwersten auf, wo die Retention am grössten ist.“ ⓘ
Isidor Albu schrieb 1900 einen sechsseitigen Aufsatz über die „Harngiftigkeit“. Man spekulierte damals über eine Autointoxikation durch die Harnbestandteile. In zahlreichen Versuchen wurde Kaninchen Menschenurin infundiert, um einen „urotoxischen Coeffizienten des Harns“ zu errechnen. Eine Übertragbarkeit solcher Tierversuchsergebnisse auf den Menschen wurde nicht unterstellt. Über die Schädlichkeit der einzelnen Harngifte, Urotoxine, Urämiegifte oder Nierengifte gab es keine Informationen. ⓘ
Noch heute vermisst man in der aktuellen Fachliteratur detaillierte Tabellen über die konzentrationsabhängigen unerwünschten Wirkungen der einzelnen Nierengifte. ⓘ
Symptome
Klinisch im Vordergrund stehen ein therapieresistenter Juckreiz (urämischer Pruritus) sowie die Zeichen einer Enterokolitis. Diese geht oft mit Problemen des Magen-Darm-Traktes einher wie Übelkeit, Erbrechen sowie Blutungen durch Magenschleimhautentzündung (Gastritis) und Darmentzündung (Colitis). Am Herzen kann eine Urämie eine Herzbeutelentzündung hervorrufen, welche ein mit dem Stethoskop hörbares Herzbeutelreiben verursachen kann. Als Komplikation kann sich wiederum eine Herzinsuffizienz (Herzschwäche) ergeben. Im weiteren Krankheitsverlauf kann eine Hyperkaliämie (Kaliumüberschuss) mit nachfolgenden Herzrhythmusstörungen entstehen. Ein Lungenödem („Wasser in der Lunge“) mit Atemnot und zentraler Zyanose (violetter bis bläulicher Verfärbung der Haut, der Schleimhäute, der Lippen und/oder der Fingernägel) kommt in manchen Fällen vor. ⓘ
Da Harnstoff in höheren Konzentrationen Nerven schädigen kann, kann es zu neurologischen Störungen wie der urämischen Enzephalopathie (krankhafte Veränderungen des Gehirns) kommen, die von Persönlichkeitsveränderungen, Schlafstörungen, Erregtheitszuständen und einer Verlangsamung bis hin zum Koma reichen können. Auch periphere Nerven können gestört werden, was sich klinisch als Polyneuropathie (Erkrankung des gesamten äußeren Nervensystems) zeigt. Auch die Hämatopoese (Blutbildung) wird gestört, was zur Anämie (Blutarmut) führt. Auffallend ist weiterhin der Geruch der Atemluft nach Harn (Foetor uraemicus) – der aber nur auftritt, wenn ureasehaltige Bakterien im Mund angesiedelt sind. ⓘ
Therapie
Eine Urämie als klinisches Bild besteht normalerweise im Stadium IV der chronischen Niereninsuffizienz, deren Behandlung der Besserung der Urämie dient. Therapeutisch steht die Verbesserung der Nierenfunktion im Vordergrund. Bei chronischer Niereninsuffizienz kommen ACE-Hemmer, AT1-Antagonisten und andere Antihypertensiva wie Calciumantagonisten und Beta-Blocker zum Einsatz. ⓘ
Die im Volksmund auch als „Blutwäsche“ bekannte und erstmals 1924 in Gießen erfolgreich von Georg Haas am Menschen durchgeführte Dialyse (als Hämodialyse, Hämofiltration oder Peritonealdialyse) stellt eine Therapieoption bei fortgeschrittener Niereninsuffizienz dar und wird am Kreatinin-Wert, an der Harnstoffkonzentration im Serum, am Serum-Kalium, -Calcium und -Phosphat und an den klinischen Symptomen festgemacht. ⓘ
Zudem wurde bislang eine strenge Diät verschrieben, um z. B. eine zu hohe Protein-, Kalium- (durch Obstsäfte, Obst) und Phosphatzufuhr (durch Cola, Pizza) zu vermeiden. Aktuelle Studien stellen aber sowohl den Wert einer strengen Einschränkung der Proteinzufuhr als auch den Wert einer phosphatarmen Diät in Frage. ⓘ
Bei der extrarenalen Urämie kommt als Alternative zur Nierenersatztherapie neben der Behandlung der Grundkrankheiten auch der Einsatz harntreibender Mittel (Diuretika) in Frage. Alle Diuretika verkleinern iatrogen die tubuläre Rückresorption und vergrößern so die Bildungsrate des Sekundärharns mit entsprechender Ausscheidung auch von Urämietoxinen. ⓘ
Bei einer krankhaft vermehrten Bildung von Urämietoxinen muss versucht werden, diese Überproduktion durch eine entsprechende Diät, mit Medikamenten oder mit anderen Verfahren zu reduzieren. ⓘ