Somatropin
| Wachstumshormon 1 (Hypophyse) ⓘ | |||||||
|---|---|---|---|---|---|---|---|
 Wachstumshormon | |||||||
| Bezeichner | |||||||
| Symbol | GH1 | ||||||
| NCBI-Gen | 2688 | ||||||
| HGNC | 4261 | ||||||
| OMIM | 139250 | ||||||
| RefSeq | NM_022562 | ||||||
| UniProt | P01241 | ||||||
| Andere Daten | |||||||
| Ort | Chr. 17 q22-q24 | ||||||
| |||||||
| Wachstumshormon 2 (plazentagängig) ⓘ | |||||||
|---|---|---|---|---|---|---|---|
| Bezeichner | |||||||
| Symbol | GH2 | ||||||
| NCBI-Gen | 2689 | ||||||
| HGNC | 4262 | ||||||
| OMIM | 139240 | ||||||
| RefSeq | NM_002059 | ||||||
| UniProt | P01242 | ||||||
| Andere Daten | |||||||
| Ort | Chr. 17 q22-q24 | ||||||
| |||||||
Das Wachstumshormon (GH) oder Somatotropin, das in seiner menschlichen Form auch als menschliches Wachstumshormon (hGH oder HGH) bezeichnet wird, ist ein Peptidhormon, das das Wachstum, die Zellreproduktion und die Zellregeneration bei Menschen und anderen Tieren anregt. Es ist daher wichtig für die menschliche Entwicklung. GH stimuliert auch die Produktion von IGF-1 und erhöht die Konzentration von Glukose und freien Fettsäuren. Es ist eine Art Mitogen, das nur für Rezeptoren auf bestimmten Zelltypen spezifisch ist. GH ist ein einkettiges Polypeptid mit 191 Aminosäuren, das von somatotropen Zellen in den Seitenflügeln des Hypophysenvorderlappens synthetisiert, gespeichert und sezerniert wird. ⓘ
Eine rekombinante Form von hGH namens Somatropin (INN) wird als verschreibungspflichtiges Medikament zur Behandlung von Wachstumsstörungen bei Kindern und Wachstumshormonmangel bei Erwachsenen eingesetzt. In den Vereinigten Staaten ist es nur auf Verschreibung eines zugelassenen Gesundheitsdienstleisters legal in Apotheken erhältlich. In den letzten Jahren verschreiben einige Gesundheitsdienstleister in den Vereinigten Staaten älteren Menschen Wachstumshormone, um ihre Vitalität zu steigern. Obwohl dies legal ist, wurde die Wirksamkeit und Sicherheit dieser Verwendung von HGH nicht in einer klinischen Studie getestet. Viele der Funktionen von HGH sind noch unbekannt. ⓘ
In seiner Rolle als Anabolikum wird HGH seit mindestens 1982 von Sportlern verwendet und ist vom IOC und der NCAA verboten worden. Mit der herkömmlichen Urinanalyse lässt sich Doping mit HGH nicht nachweisen, so dass das Verbot erst in den frühen 2000er Jahren durchgesetzt wurde, als man begann, Bluttests zu entwickeln, die zwischen natürlichem und künstlichem HGH unterscheiden können. Die Bluttests, die von der WADA bei den Olympischen Spielen 2004 in Athen, Griechenland, durchgeführt wurden, betrafen vor allem HGH. Die Verwendung des Medikaments zur Leistungssteigerung ist derzeit nicht von der FDA zugelassen. ⓘ
GH wurde für die effizientere Aufzucht von Nutztieren in der industriellen Landwirtschaft untersucht, und es wurden mehrere Versuche unternommen, eine staatliche Genehmigung für die Verwendung von GH in der Viehzucht zu erhalten. Diese Anwendungen waren umstritten. In den Vereinigten Staaten ist die einzige von der FDA zugelassene Verwendung von GH in der Viehzucht die Verwendung einer kuhspezifischen Form von GH namens Rindersomatotropin zur Steigerung der Milchproduktion bei Milchkühen. Einzelhändler dürfen Milchbehälter als mit oder ohne Rindersomatotropin hergestellt kennzeichnen. ⓘ
| Somatropin ⓘ | ||
|---|---|---|

| ||
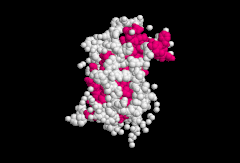
| Bändermodell des Somatropin nach Kristallstruktur. | ||
|
Vorhandene Strukturdaten: 1a22, 1axi, 1bp3, 1hgu, 1huw, 1hwg, 1hwh, 1kf9, 3hhr | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 191 Aminosäuren | |
| Sekundär- bis Quartärstruktur | 1-, 2-, 3-, 4- oder 5-mer in homo- und heteropolymeren Kombinationen | |
| Isoformen | 4 | |
| Bezeichner | ||
| Gen-Namen | GH1 ; GH-N, GHN, GH, hGH-N | |
| Externe IDs |
| |
| Arzneistoffangaben | ||
| ATC-Code | H01AC01 | |
| DrugBank | DB00052 | |
| Vorkommen | ||
| Homologie-Familie | Somatropin | |
| Übergeordnetes Taxon | Wirbeltiere | |
Somatropin oder Somatotropin (auch Somatotropes Hormon genannt) ist ein Proteohormon, das als Wachstumshormon im menschlichen und tierischen Organismus vorkommt und im Gehirn im Vorderlappen der Hypophyse gebildet wird. ⓘ
Rekombinant hergestelltes Somatropin (rhGH) wird als Arzneistoff verwendet bei Wachstumshormonmangel (GHD) infolge Insuffizienz der Hypophyse. ⓘ
Nomenklatur
Die Bezeichnungen Somatotropin (STH) oder somatotropes Hormon beziehen sich auf das Wachstumshormon, das in Tieren natürlich produziert und aus Tierkörpern extrahiert wird. Das aus menschlichen Leichen gewonnene Hormon wird mit hGH abgekürzt. Das wichtigste Wachstumshormon, das mit Hilfe der rekombinanten DNA-Technologie hergestellt wird, hat die zugelassene generische Bezeichnung (INN) Somatropin und den Markennamen Humatrope und wird in der wissenschaftlichen Literatur korrekt mit rhGH abgekürzt. Seit seiner Einführung im Jahr 1992 ist Humatrope ein verbotenes Sportdopingmittel und wird in diesem Zusammenhang als HGH bezeichnet. ⓘ
Biologie
Gen
Die Gene für das menschliche Wachstumshormon, die als Wachstumshormon 1 (Somatotropin; Hypophysenwachstumshormon) und Wachstumshormon 2 (Plazentawachstumshormon; Wachstumshormonvariante) bezeichnet werden, sind in der Region q22-24 des Chromosoms 17 lokalisiert und eng mit den Genen für menschliches Chorion-Somatomammotropin (auch als Plazenta-Laktogen bekannt) verwandt. GH, humanes Chorion-Somatomammotropin und Prolaktin gehören zu einer Gruppe homologer Hormone mit wachstumsfördernder und laktogener Wirkung. ⓘ
Struktur
Die Haupt-Isoform des menschlichen Wachstumshormons ist ein Protein mit 191 Aminosäuren und einem Molekulargewicht von 22.124 Dalton. Die Struktur umfasst vier Helices, die für eine funktionelle Interaktion mit dem GH-Rezeptor erforderlich sind. Es scheint, dass GH in seiner Struktur evolutionär homolog zu Prolaktin und chorionischem Somatomammotropin ist. Trotz ausgeprägter struktureller Ähnlichkeiten zwischen Wachstumshormonen verschiedener Spezies haben nur die Wachstumshormone des Menschen und der Altweltaffen signifikante Auswirkungen auf den menschlichen Wachstumshormonrezeptor. ⓘ
In der Hypophyse existieren mehrere molekulare Isoformen von GH, die in das Blut abgegeben werden. Insbesondere eine Variante von ca. 20 kDa, die durch alternatives Spleißen entstanden ist, ist in einem ziemlich konstanten Verhältnis von 1:9 vorhanden, während vor kurzem eine zusätzliche Variante von ca. 23-24 kDa auch in Zuständen nach dem Training in höheren Anteilen berichtet wurde. Diese Variante ist nicht identifiziert worden, aber es wurde vermutet, dass sie mit einer in der Hypophyse identifizierten glykosylierten Variante von 23 kDa übereinstimmt. Darüber hinaus zirkulieren diese Varianten teilweise gebunden an ein Protein (Wachstumshormon-bindendes Protein, GHBP), bei dem es sich um den verkürzten Teil des Wachstumshormonrezeptors handelt, und an eine säurelabilen Untereinheit (ALS). ⓘ
Regulierung
Die Sekretion von Wachstumshormon (GH) in der Hypophyse wird von den neurosekretorischen Kernen des Hypothalamus reguliert. Diese Zellen setzen die Peptide Wachstumshormon-freisetzendes Hormon (GHRH oder Somatocrinin) und Wachstumshormon-hemmendes Hormon (GHIH oder Somatostatin) in das die Hypophyse umgebende hypophysäre Portalvenenblut frei. Die GH-Freisetzung in der Hypophyse wird in erster Linie durch das Gleichgewicht dieser beiden Peptide bestimmt, das wiederum durch zahlreiche physiologische Stimulatoren (z. B. Bewegung, Ernährung, Schlaf) und Hemmstoffe (z. B. freie Fettsäuren) der GH-Sekretion beeinflusst wird. ⓘ
Somatotrope Zellen im Hypophysenvorderlappen synthetisieren und sezernieren GH pulsierend als Reaktion auf diese Stimuli durch den Hypothalamus. Der größte und am besten vorhersehbare GH-Spitzenwert tritt etwa eine Stunde nach Einsetzen des Schlafs mit Plasmaspiegeln von 13 bis 72 ng/ml auf. Ansonsten gibt es große Schwankungen zwischen den einzelnen Tagen und Personen. Nahezu fünfzig Prozent der GH-Sekretion erfolgt während des dritten und vierten NREM-Schlafstadiums. Sekretionsschübe während des Tages treten in Abständen von 3 bis 5 Stunden auf. Die Plasmakonzentration von GH während dieser Spitzenwerte kann zwischen 5 und 45 ng/ml liegen. Zwischen den Spitzenwerten sind die GH-Basalwerte niedrig, in der Regel weniger als 5 ng/ml für den größten Teil des Tages und der Nacht. Eine zusätzliche Analyse des pulsierenden GH-Profils ergab, dass die Basalwerte in allen Fällen weniger als 1 ng/ml betrugen, während die maximalen Spitzenwerte bei 10-20 ng/ml lagen. ⓘ
Es ist bekannt, dass eine Reihe von Faktoren die GH-Sekretion beeinflussen, z. B. Alter, Geschlecht, Ernährung, Bewegung, Stress und andere Hormone. Junge Heranwachsende sezernieren GH in einer Menge von etwa 700 μg/Tag, während gesunde Erwachsene GH in einer Menge von etwa 400 μg/Tag sezernieren. Schlafentzug unterdrückt im Allgemeinen die GH-Ausschüttung, insbesondere im frühen Erwachsenenalter. ⓘ
Zu den Stimulatoren der Sekretion von Wachstumshormon (GH) gehören:
- Peptidhormone
- GHRH (Somatocrinin) durch Bindung an den Wachstumshormon-Releasing-Hormon-Rezeptor (GHRHR)
- Ghrelin durch Bindung an Wachstumshormon-Sekretagogue-Rezeptoren (GHSR)
- Sexualhormone
- Erhöhte Androgensekretion während der Pubertät (bei Männern aus den Hoden und bei Frauen aus der Nebennierenrinde)
- Testosteron und DHEA
- Östrogen
- Clonidin und L-DOPA durch Stimulierung der GHRH-Freisetzung
- α4β2-Nikotin-Agonisten, einschließlich Nikotin, die auch synergistisch mit Clonidin wirken.
- Hypoglykämie, Arginin und Propranolol durch Hemmung der Somatostatinfreisetzung
- Tiefschlaf
- Insulin
- Glucagon
- Niacin als Nikotinsäure (Vitamin B3)
- Fasten
- Kräftige Bewegung ⓘ
Zu den Inhibitoren der GH-Sekretion gehören:
- GHIH (Somatostatin) aus dem periventrikulären Nukleus
- zirkulierende Konzentrationen von GH und IGF-1 (negative Rückkopplung auf Hypophyse und Hypothalamus)
- Hyperglykämie
- Glukokortikoide
- Dihydrotestosteron
- Phenothiazine ⓘ
Neben der Steuerung durch endogene und stimulierende Prozesse ist bekannt, dass eine Reihe von Fremdstoffen (Xenobiotika wie Medikamente und endokrine Disruptoren) die GH-Sekretion und -Funktion beeinflussen. ⓘ
Funktion

Die Auswirkungen des Wachstumshormons auf das Körpergewebe können im Allgemeinen als anabol (aufbauend) bezeichnet werden. Wie die meisten anderen Proteinhormone wirkt GH durch Interaktion mit einem spezifischen Rezeptor auf der Oberfläche der Zellen. ⓘ
Die bekannteste Wirkung von GH ist die Zunahme der Körpergröße in der Kindheit. Die Körpergröße wird offenbar durch mindestens zwei Mechanismen stimuliert:
- Da Polypeptidhormone nicht fettlöslich sind, können sie die Zellmembranen nicht durchdringen. Daher übt GH einen Teil seiner Wirkung durch Bindung an Rezeptoren auf den Zielzellen aus, wo es den MAPK/ERK-Signalweg aktiviert. Über diesen Mechanismus stimuliert GH direkt die Teilung und Vermehrung der Chondrozyten des Knorpels.
- Über den JAK-STAT-Signalweg stimuliert GH auch die Produktion des insulinähnlichen Wachstumsfaktors 1 (IGF-1, früher bekannt als Somatomedin C), eines Hormons, das dem Proinsulin ähnelt. Die Leber ist ein Hauptzielorgan von GH für diesen Prozess und ist der Hauptort der IGF-1-Produktion. IGF-1 hat wachstumsstimulierende Wirkungen auf eine Vielzahl von Geweben. Zusätzliches IGF-1 wird in den Zielgeweben gebildet, so dass es sowohl ein endokrines als auch ein autokrines/parakrines Hormon zu sein scheint. IGF-1 hat auch stimulierende Auswirkungen auf die Aktivität von Osteoblasten und Chondrozyten und fördert so das Knochenwachstum. ⓘ
Neben der Steigerung der Körpergröße bei Kindern und Jugendlichen hat das Wachstumshormon noch viele andere Auswirkungen auf den Körper:
- Erhöht die Kalziumeinlagerung, stärkt und erhöht die Mineralisierung der Knochen
- Vergrößerung der Muskelmasse durch Sarkomer-Hypertrophie
- Fördert die Lipolyse
- Erhöht die Proteinsynthese
- Stimuliert das Wachstum aller inneren Organe mit Ausnahme des Gehirns
- Spielt eine Rolle bei der Homöostase
- Verringert die Aufnahme von Glukose durch die Leber
- Fördert die Glukoneogenese in der Leber
- Trägt zur Erhaltung und Funktion der Pankreasinseln bei
- Stimuliert das Immunsystem
- Erhöht die Deiodierung von T4 zu T3 ⓘ
Somatropin ist essentiell für ein normales Wachstum. Bei einer verminderten Produktion oder einem verminderten Ansprechen der Zellen auf Somatropin kommt es zu einem Kleinwuchs. Bei einer Überproduktion resultiert ein Riesenwuchs oder eine Akromegalie (übermäßiges Wachstum an den noch nicht verknöcherten Zonen in den Akren wie Nase, Kinn, Finger und dem Schädelknochen sowie bei allen Weichteilen (z. B. Kardiomegalie)). ⓘ
Im Erwachsenenalter führt ein Mangel an Somatropin zu vielfältigen Symptomen:
- erhöhte Körperfettmasse (hauptsächlich Viszeralfett)
- reduzierte Muskelmasse
- reduzierte Knochenmineraldichte ⓘ
Außerdem führt ein Mangel an Somatropin zu
- einem erhöhten kardiovaskulären Risikoprofil,
- verringerter Lebensqualität und
- der vermehrten Inanspruchnahme medizinischer Leistungen. ⓘ
Diese Symptome gehen einher mit einer verminderten Lebenserwartung. ⓘ
Somatropin wirkt indirekt, indem es an den Somatropin-Rezeptor bindet, der ein Transkriptionsfaktor ist und die Expression des Proteins Insulinähnlicher Wachstumsfaktor 1 (IGF-1) erhöht. Dieses wiederum bindet an seinen Rezeptor (IGF1R), der ebenso ein Transkriptionsfaktor ist und die Produktion einer Vielzahl von anderen Proteinen steuert. Ist der Somatropin-Rezeptor durch Mutationen verändert, sprechen die Zellen nicht oder vermindert auf Somatropin an, was als Somatropin-Resistenz oder Laron-Syndrom bezeichnet wird. ⓘ
Genauer betrachtet wirkt Somatropin vor allem an folgenden Organen:
- Muskel, Leber (über IGF-1)
- Knochen, Niere (über EGF)
- Knorpel (über IbFGF) ⓘ
Anabol wirkt es vor allem an Muskel, Leber und Knochen, indem es dort zur vermehrten Aufnahme und Verwertung von Aminosäuren führt. Somatropin erhöht den Blutzuckerspiegel (durch Glykogenolyse) und wirkt auf die Fettzellen lipolytisch, also fettabbauend. ⓘ
Bei Wiederkäuern bewirkt Somatropin, dass die Laktation aufrechterhalten bleibt (siehe Rinder-Somatropin). Beim Haushund führt ein Somatotropinmangel zu Zwergwuchs. ⓘ
Biochemie
GH hat eine kurze biologische Halbwertszeit von etwa 10 bis 20 Minuten. ⓘ
Klinische Bedeutung
Überschüssiges
Die häufigste Erkrankung mit GH-Überschuss ist ein Hypophysentumor, der aus somatotrophen Zellen des Hypophysenvorderlappens besteht. Diese somatotrophen Adenome sind gutartig und wachsen langsam, wobei sie nach und nach immer mehr GH produzieren. Über Jahre hinweg sind die wichtigsten klinischen Probleme die eines GH-Überschusses. Schließlich kann das Adenom so groß werden, dass es Kopfschmerzen verursacht, das Sehvermögen durch Druck auf die Sehnerven beeinträchtigt oder durch Verdrängung einen Mangel an anderen Hypophysenhormonen verursacht. ⓘ
Ein anhaltender GH-Überschuss führt zu einer Verdickung der Kiefer-, Finger- und Zehenknochen und damit zu einer Schwere des Kiefers und einer Vergrößerung der Zehen, was als Akromegalie bezeichnet wird. Begleitende Probleme können Schwitzen, Druck auf die Nerven (z. B. Karpaltunnelsyndrom), Muskelschwäche, ein Überschuss an Sexualhormon-bindendem Globulin (SHBG), Insulinresistenz oder sogar eine seltene Form von Typ-2-Diabetes sowie eine eingeschränkte Sexualfunktion sein. ⓘ
GH-sezernierende Tumore werden in der Regel im fünften Lebensjahrzehnt erkannt. Es ist äußerst selten, dass ein solcher Tumor in der Kindheit auftritt, aber wenn dies der Fall ist, kann das übermäßige GH ein übermäßiges Wachstum verursachen, das traditionell als hypophysärer Gigantismus bezeichnet wird. ⓘ
Die übliche Behandlung für GH-produzierende Tumore ist die chirurgische Entfernung. Unter bestimmten Umständen kann eine gezielte Bestrahlung oder ein GH-Antagonist wie Pegvisomant eingesetzt werden, um den Tumor zu verkleinern oder seine Funktion zu blockieren. Andere Medikamente wie Octreotid (Somatostatin-Agonist) und Bromocriptin (Dopamin-Agonist) können zur Blockierung der GH-Sekretion eingesetzt werden, da sowohl Somatostatin als auch Dopamin die GHRH-vermittelte GH-Freisetzung aus dem Hypophysenvorderlappen negativ hemmen. ⓘ
Mangel
Die Auswirkungen eines Mangels an Wachstumshormon (GH) variieren je nach Alter, in dem sie auftreten. Veränderungen des Somatomedins können zu einem Wachstumshormonmangel führen, wobei zwei Mechanismen bekannt sind: das Versagen von Geweben, auf Somatomedin zu reagieren, oder das Versagen der Leber, Somatomedin zu produzieren. Die Hauptmanifestationen des GH-Mangels bei Kindern sind Wachstumsstörungen, die Entwicklung einer kurzen Statur und eine verzögerte Geschlechtsreife. Bei Erwachsenen trägt die Somatomedinveränderung zu einer erhöhten Osteoklastenaktivität bei, was zu schwächeren Knochen führt, die anfälliger für pathologische Frakturen und Osteoporose sind. Ein Mangel ist jedoch bei Erwachsenen selten, wobei die häufigste Ursache ein Hypophysenadenom ist. Andere Ursachen im Erwachsenenalter sind die Fortsetzung eines Problems aus der Kindheit, andere strukturelle Läsionen oder Traumata und sehr selten idiopathische GHD. ⓘ
Erwachsene mit GHD "neigen zu einer relativen Zunahme der Fettmasse und einer relativen Abnahme der Muskelmasse sowie in vielen Fällen zu einer verminderten Energie und Lebensqualität". ⓘ
Die Diagnose des GH-Mangels umfasst einen mehrstufigen diagnostischen Prozess, der in der Regel in GH-Stimulationstests gipfelt, um festzustellen, ob die Hypophyse des Patienten einen GH-Impuls freisetzt, wenn sie durch verschiedene Reize angeregt wird. ⓘ
Psychologische Auswirkungen
Qualität des Lebens
Mehrere Studien, vor allem mit Patienten mit GH-Mangel, haben gezeigt, dass GH eine entscheidende Rolle für das geistige und emotionale Wohlbefinden und die Aufrechterhaltung eines hohen Energieniveaus spielt. Erwachsene mit GH-Mangel weisen häufig höhere Raten an Depressionen auf als solche ohne Mangel. Zwar wurde eine GH-Ersatztherapie zur Behandlung von Depressionen infolge von GH-Mangel vorgeschlagen, doch sind die langfristigen Auswirkungen einer solchen Therapie unbekannt. ⓘ
Kognitive Funktion
GH wurde auch im Zusammenhang mit der kognitiven Funktion, einschließlich Lernen und Gedächtnis, untersucht. GH scheint beim Menschen die kognitiven Funktionen zu verbessern und könnte bei der Behandlung von Patienten mit kognitiven Beeinträchtigungen, die auf GH-Mangel zurückzuführen sind, nützlich sein. ⓘ
Medizinische Anwendungen
Substitutionstherapie
GH wird als Ersatztherapie bei Erwachsenen mit GH-Mangel eingesetzt, der entweder in der Kindheit oder im Erwachsenenalter (in der Regel infolge eines erworbenen Hypophysentumors) auftritt. Bei diesen Patienten wurden unterschiedliche Vorteile festgestellt, darunter eine Verringerung der Fettmasse, eine Zunahme der Magermasse, eine Erhöhung der Knochendichte, eine Verbesserung des Lipidprofils, eine Verringerung der kardiovaskulären Risikofaktoren und eine Verbesserung des psychosozialen Wohlbefindens. Langwirksame Wachstumshormonanaloga (LAGH) sind jetzt für die Behandlung des Wachstumshormonmangels sowohl bei Kindern als auch bei Erwachsenen verfügbar. Es handelt sich dabei um einmal wöchentlich zu verabreichende Injektionen im Gegensatz zu herkömmlichem Wachstumshormon, das täglich gespritzt werden muss. LAGH-Injektionen viermal im Monat haben sich als ebenso sicher und wirksam erwiesen wie tägliche Wachstumshormoninjektionen. ⓘ
Andere zugelassene Anwendungen
Somatropin wird seit 1963 zur Behandlung des Kleinwuchses eingesetzt, wenn er durch Wachstumshormonmangel verursacht ist. Es wurde aus Hypophysen von Toten gewonnen, bis dies Anfang 1985 weltweit verboten wurde, weil es bei Patienten zur Übertragung von AIDS und der Creutzfeldt-Jakob-Krankheit und in der Folge zu Todesfällen kam. Somatropin wird seit Dezember 1985 rekombinant hergestellt. Das Wachstumshormon wird heute auch dann zur Therapie einer geringen Körperhöhe angewandt, wenn eine andere Grunderkrankung diesen Kleinwuchs nach sich zieht, zum Beispiel beim Ullrich-Turner-Syndrom, beim Prader-Willi-Syndrom, bei chronischer Niereninsuffizienz oder bei Kleinwuchs infolge einer intrauterinen Wachstumsverzögerung (SGA, Small for Gestational Age). Außerdem wird es seit einigen Jahren zur Substitutionstherapie bei schwerem Wachstumshormonmangel im Erwachsenenalter eingesetzt. ⓘ
Die europäische Arzneimittelagentur (EMA) hat im Dezember 2011 das positive Nutzen-Risiko-Verhältnis für somatropinhaltige Arzneimittel bestätigt. ⓘ
Eine Version von rHGH wurde von der FDA auch zur Erhaltung der Muskelmasse bei AIDS-bedingtem Muskelschwund zugelassen. ⓘ
Off-Label-Verwendung
Die "Off-label"-Verschreibung von HGH ist umstritten und kann illegal sein. ⓘ
Die Behauptung, dass GH als Anti-Aging-Mittel eingesetzt werden kann, geht auf das Jahr 1990 zurück, als das New England Journal of Medicine eine Studie veröffentlichte, in der 12 Männer über 60 mit GH behandelt wurden. Am Ende der Studie wiesen alle Männer eine statistisch signifikante Zunahme der fettfreien Körpermasse und der Knochenmineraldichte auf, während dies bei der Kontrollgruppe nicht der Fall war. Die Autoren der Studie stellten fest, dass diese Verbesserungen im Gegensatz zu den Veränderungen standen, die normalerweise im Laufe eines 10- bis 20-jährigen Alterungsprozesses auftreten würden. Obwohl die Autoren zu keinem Zeitpunkt behaupteten, dass GH den Alterungsprozess selbst umkehrt, wurden ihre Ergebnisse fälschlicherweise als Hinweis darauf interpretiert, dass GH ein wirksames Anti-Aging-Mittel ist. Dies hat dazu geführt, dass Organisationen wie die umstrittene American Academy of Anti-Aging Medicine die Verwendung dieses Hormons als "Anti-Aging-Mittel" propagieren. ⓘ
Eine Meta-Analyse klinischer Studien zu diesem Thema, die Anfang 2007 an der Stanford University School of Medicine veröffentlicht wurde, ergab, dass die Anwendung von GH bei gesunden älteren Patienten zu einem Muskelzuwachs von etwa 2 kg und zu einer Verringerung des Körperfetts um den gleichen Betrag führte. Dies waren jedoch die einzigen positiven Auswirkungen der Einnahme von GH. Andere kritische Faktoren wie Knochendichte, Cholesterinspiegel, Lipidmessungen, maximaler Sauerstoffverbrauch oder andere Faktoren, die auf eine erhöhte Fitness hindeuten würden, wurden nicht beeinflusst. Die Forscher entdeckten auch keine Zunahme der Muskelkraft, was sie zu der Annahme veranlasste, dass GH den Körper lediglich mehr Wasser in den Muskeln speichern lässt, anstatt das Muskelwachstum zu steigern. Dies würde die Zunahme der mageren Körpermasse erklären. ⓘ
GH wurde auch experimentell zur Behandlung von Multipler Sklerose, zur Förderung der Gewichtsabnahme bei Fettleibigkeit sowie bei Fibromyalgie, Herzinsuffizienz, Morbus Crohn und Colitis ulcerosa sowie bei Verbrennungen eingesetzt. GH wurde auch experimentell bei Patienten mit Kurzdarmsyndrom eingesetzt, um den Bedarf an intravenöser totaler parenteraler Ernährung zu verringern. ⓘ
Im Jahr 1990 verabschiedete der US-Kongress ein Gesetz zur Verbrechensbekämpfung (Crime Control Act of 1990), das den Federal Food, Drug and Cosmetic Act änderte, Anabolika als kontrollierte Substanzen einstufte und einen neuen Abschnitt hinzufügte, in dem es heißt, dass eine Person, die "wissentlich menschliches Wachstumshormon für eine andere Verwendung beim Menschen als die Behandlung einer Krankheit oder eines anderen anerkannten medizinischen Zustands vertreibt oder mit der Absicht besitzt, es zu vertreiben, eine Straftat begeht, wenn eine solche Verwendung vom Secretary of Health and Human Services genehmigt worden ist". ⓘ
Die Drug Enforcement Administration des US-Justizministeriums betrachtet die Verschreibung von HGH außerhalb der zugelassenen Indikationen als illegal und als einen wichtigen Weg für den illegalen Vertrieb von HGH. Dieser Abschnitt wurde auch von einigen Ärzten, insbesondere von den Autoren eines 2005 im Journal of the American Medical Association veröffentlichten Kommentars, dahingehend interpretiert, dass die Verschreibung von HGH außerhalb der zugelassenen Indikationen als illegal angesehen werden kann. Und einige Artikel in der populären Presse, z. B. solche, in denen die pharmazeutische Industrie für die Vermarktung von Arzneimitteln für den Off-Label-Gebrauch kritisiert wird (mit der Befürchtung von Verstößen gegen die Berufsethik), haben deutliche Aussagen darüber gemacht, ob Ärzte HGH Off-Label verschreiben dürfen: "Im Gegensatz zu anderen verschreibungspflichtigen Medikamenten darf HGH nur für bestimmte Anwendungen verschrieben werden. Der Verkauf in den USA ist gesetzlich auf die Behandlung eines seltenen Wachstumsfehlers bei Kindern und eine Handvoll ungewöhnlicher Erkrankungen wie das Kurzdarmsyndrom oder das Prader-Willi-Syndrom beschränkt, eine angeborene Krankheit, die einen verminderten Muskeltonus und einen Mangel an Hormonen in den Geschlechtsdrüsen verursacht." Gleichzeitig sind Anti-Aging-Kliniken, in denen Ärzte HGH verschreiben, verabreichen und an Menschen verkaufen, ein großes Geschäft. In einem Artikel in der Vanity Fair aus dem Jahr 2012 sagte Dragos Roman, der bei der FDA ein Team leitet, das Medikamente im Bereich der Endokrinologie überprüft, auf die Frage, warum die Verschreibungen von HGH die Zahl der erwachsenen Patienten, die schätzungsweise an HGH-Mangel leiden, bei weitem übersteigt: "Die FDA reguliert nicht die Off-Label-Verwendung von HGH. Manchmal wird es angemessen eingesetzt. Manchmal aber auch nicht." ⓘ
Nebenwirkungen
Reaktionen an der Injektionsstelle sind häufig. Seltener können Patienten Gelenkschwellungen, Gelenkschmerzen, Karpaltunnelsyndrom und ein erhöhtes Diabetesrisiko haben. In einigen Fällen kann der Patient eine Immunreaktion gegen GH entwickeln. GH kann auch ein Risikofaktor für das Hodgkin-Lymphom sein. ⓘ
Eine Untersuchung von Erwachsenen, die während ihrer Kindheit mit GH-Ersatz aus Leichen behandelt worden waren (das seit 1985 weltweit nicht mehr verwendet wird), ergab ein leicht erhöhtes Auftreten von Darm- und Prostatakrebs, wobei jedoch kein Zusammenhang mit der GH-Behandlung hergestellt werden konnte. ⓘ
Leistungsverbesserung
Die erste Beschreibung der Verwendung von GH als Dopingmittel war Dan Duchaines "Underground Steroid handbook", das 1982 in Kalifornien erschien; es ist nicht bekannt, wo und wann GH erstmals auf diese Weise verwendet wurde. ⓘ
Athleten in vielen Sportarten haben menschliches Wachstumshormon verwendet, um ihre sportliche Leistung zu steigern. Einige neuere Studien konnten die Behauptung, dass menschliches Wachstumshormon die sportliche Leistung von männlichen Profisportlern verbessern kann, nicht bestätigen. Viele Sportverbände verbieten die Verwendung von GH und verhängen Sanktionen gegen Sportler, die damit erwischt werden. Da GH jedoch ein starkes körpereigenes Protein ist, ist es sehr schwierig, GH-Doping nachzuweisen. In den Vereinigten Staaten ist GH legal nur auf ärztliche Verschreibung erhältlich. ⓘ
Nahrungsergänzungsmittel
Um aus der Idee Kapital zu schlagen, dass GH bei der Bekämpfung des Alterns nützlich sein könnte, verkaufen Unternehmen, die Nahrungsergänzungsmittel vertreiben, auf ihren Websites Produkte, die im Werbetext mit GH in Verbindung gebracht werden, mit medizinisch klingenden Namen wie "HGH Releasers". Typische Inhaltsstoffe sind Aminosäuren, Mineralien, Vitamine und/oder Kräuterextrakte, deren Kombination den Körper dazu veranlassen soll, mehr GH zu bilden, was entsprechende positive Auswirkungen haben soll. Da diese Produkte in den Vereinigten Staaten als Nahrungsergänzungsmittel vermarktet werden, ist es illegal, dass sie GH enthalten, das ein Arzneimittel ist. Nach US-amerikanischem Recht dürfen Produkte, die als Nahrungsergänzungsmittel verkauft werden, auch keine Behauptungen enthalten, dass sie Krankheiten oder Leiden behandeln oder verhindern, und die Werbematerialien müssen einen Hinweis darauf enthalten, dass die gesundheitsbezogenen Angaben nicht von der FDA genehmigt sind. Die FTC und die FDA setzen das Gesetz durch, wenn sie auf Verstöße aufmerksam werden. ⓘ
Landwirtschaftliche Verwendung
In den Vereinigten Staaten ist es legal, Rinder-GH an Milchkühe zu verabreichen, um die Milchproduktion zu steigern, und es ist legal, GH bei der Aufzucht von Rindern zu verwenden; siehe Artikel über Rindersomatotropin, Rinderfütterung, Milchwirtschaft und die Kontroverse um Rinderhormone. ⓘ
Die Verwendung von GH in der Geflügelzucht ist in den Vereinigten Staaten illegal. Auch in Australien wird kein Hühnerfleisch zum Verkauf mit Hormonen behandelt. ⓘ
Mehrere Unternehmen haben versucht, eine Version von GH zur Verwendung bei Schweinen (Porcine Somatotropin) von der FDA genehmigen zu lassen, aber alle Anträge wurden zurückgezogen. ⓘ
Entwicklungsgeschichte des Medikaments
Das Wachstumshormon war das erste menschliche Genprodukt, das in einem Mikroorganismus künstlich exprimiert wurde. Genentech leistete Pionierarbeit bei der Verwendung von rekombinantem menschlichem Wachstumshormon für die Humantherapie, das 1985 von der FDA zugelassen wurde. ⓘ
Vor der Herstellung mittels rekombinanter DNA-Technologie wurde das Wachstumshormon zur Behandlung von Mangelzuständen aus der Hirnanhangdrüse von Leichen extrahiert. Versuche, ein vollständig synthetisches HGH herzustellen, scheiterten. Die begrenzte Verfügbarkeit von HGH führte dazu, dass die HGH-Therapie auf die Behandlung von idiopathischem Kleinwuchs beschränkt wurde. In den späten 1950er Jahren führten John C. Beck und Kollegen in Montreal sehr begrenzte klinische Studien mit Wachstumshormon durch, das von einem Affen aus der Alten Welt, dem Rhesusaffen, stammt. Die 1957 veröffentlichte Studie, die an einem 13-jährigen Mann mit gut dokumentiertem Hypopituitarismus als Folge eines Crainiophyaryngioms" durchgeführt wurde, ergab Folgendes: "Menschliches und Affen-Wachstumshormon führte zu einer signifikanten Erhöhung der Stickstoffspeicherung ... (und) es gab eine Retention von Kalium, Phosphor, Kalzium und Natrium. ... In beiden Zeiträumen kam es zu einer Zunahme des Körpergewichts. ... Während beider Verabreichungszeiträume des Wachstumshormons kam es zu einem signifikanten Anstieg der Aldosteronausscheidung im Urin. Dies war bei dem menschlichen Wachstumshormon am stärksten ausgeprägt. ... Eine Beeinträchtigung der Glukosetoleranzkurve war nach 10 Tagen der Verabreichung des menschlichen Wachstumshormons offensichtlich. Am fünften Tag der Verabreichung des Affenwachstumshormons war keine Veränderung der Glukosetoleranz nachweisbar." Die andere Studie, die 1958 veröffentlicht wurde, wurde an sechs Personen durchgeführt: dem gleichen Probanden wie in der Science-Studie, einem 18-jährigen Mann mit statischer und sexueller Retardierung und einem Skelettalter zwischen 13 und 14 Jahren, einer 15-jährigen Frau mit gut dokumentiertem Hypopituitarismus als Folge eines Kraniopharyngioms, einer 53-jährigen Frau mit Brustkrebs und weit verbreiteten Skelettmetastasen, einer 68-jährigen Frau mit fortgeschrittener postmenopausaler Osteoporose und einem gesunden 24-jährigen Medizinstudenten ohne klinische oder labortechnische Anzeichen einer systemischen Erkrankung. ⓘ
1985 wurden ungewöhnliche Fälle von Creutzfeldt-Jakob-Krankheit bei Personen festgestellt, die zehn bis fünfzehn Jahre zuvor aus Leichen gewonnenes HGH erhalten hatten. Aufgrund der Annahme, dass infektiöse Prionen, die die Krankheit verursachen, zusammen mit dem aus Leichen gewonnenen HGH übertragen wurden, wurde aus Leichen gewonnenes HGH vom Markt genommen. ⓘ
1985 ersetzte biosynthetisches menschliches Wachstumshormon das aus der Hypophyse gewonnene menschliche Wachstumshormon für den therapeutischen Einsatz in den USA und anderswo. ⓘ
Im Jahr 2005 waren in den Vereinigten Staaten rekombinante Wachstumshormone (und ihre Hersteller) erhältlich, darunter Nutropin (Genentech), Humatrope (Lilly), Genotropin (Pfizer), Norditropin (Novo) und Saizen (Merck Serono). Im Jahr 2006 hat die US-amerikanische Food and Drug Administration (FDA) eine Version von rHGH namens Omnitrope (Sandoz) zugelassen. Eine Form des Wachstumshormons mit verzögerter Freisetzung, Nutropin Depot (Genentech und Alkermes), wurde 1999 von der FDA zugelassen und ermöglichte weniger Injektionen (alle 2 oder 4 Wochen statt täglich); das Produkt wurde jedoch 2004 von Genentech/Alkermes aus finanziellen Gründen eingestellt (die Herstellung von Nutropin Depot erforderte erheblich mehr Ressourcen als der Rest der Nutropin-Reihe). ⓘ
Struktur
Die Primärstruktur des humanen Somatropins besteht aus 191 Aminosäuren mit einer Molekülmasse von 22.125 Da. Dabei existieren artspezifische Varianten des Hormons. Die Tertiärstruktur besteht aus vier α-Helices mit zwei intramolekularen Disulfidbindungen. ⓘ
Normalwerte
Die Angabe eines Normalwertes für die Konzentration des Somatropins wäre falsch, da es einen Tagesrhythmus und einen Lebensrhythmus der Sekretion gibt. Außerdem gibt es Faktoren, die die akute Sekretion stimulieren. Deswegen werden meist mehrere Werte in einem Tagesprofil abgenommen. ⓘ
Bei der Diagnostik der Akromegalie und des Riesenwuchses hat sich der Somatropin-Suppressionstest bewährt. Man spricht von einer autonomen Somatropin-Sekretion, wenn der Somatropin-Spiegel während der oralen Glukosebelastung (oGTT, 100 g Glukose) nicht unter 1,0 µg/l absinkt. ⓘ
Die Einzelbestimmung von Somatropin ist für die Diagnose eines Somatropin-Mangels wegen der episodischen (pulsatilen) Spontansekretion und der dadurch bedingten Phasen mit nicht nachweisbaren Hormonspiegeln ungeeignet. Die Bestimmung unter Stimulation gelingt mit folgenden Verfahren:
- GHRH-Test
- Arginin-Test
- Arginin-GHRH-Test
- Grenzwerte: 11,5 ng/ml für Normalgewichtige mit einem BMI ≤ 25 kg/m², 8 ng/ml für Übergewichtige mit einem BMI zwischen 25 und 30 kg/m² und 4,2 ng/ml für Adipöse mit einem BMI > 30 kg/m²
- Insulinhypoglykämie-Test (STF)
- Grenzwerte: Schwerer Mangel bei < 3 ng/ml; partieller Mangel bei 3–7 ng/ml; normal bei > 16 ng/ml
- STH-Suppressionstest ⓘ
Nichtmedizinische Verwendung
Synthetisches Somatropin wird als „Anti-Aging“-Mittel verwendet, wobei es keine Belege für einen Langzeitnutzen gibt. Häufig missbräuchlich angewendet wird es aufgrund seiner muskelbildenden Eigenschaften auch im Bodybuilding und anderen Sportarten. Zu diesem Zweck wird es teilweise auch mit Testosteron, Insulin, Trenbolon und dem Schilddrüsenhormon Triiodthyronin (T3) kombiniert. Mittlerweile sind aber auch schon gefährliche Totalfälschungen von angeblich Somatropin-haltigen Arzneimitteln aufgetaucht, die für die Verwendung in der Bodybuilder-Szene bestimmt waren. In der Doping-Szene gilt Somatropin allgemeinhin als teure „Wunderwaffe“. ⓘ
Die Anwendung von Somatropin bei Menschen ohne vorliegenden Mangel kann zu Akromegalie mit schwersten Nebenwirkungen führen, die oft irreversibel sind. ⓘ
Erste Ergebnisse der Studie Thymus Regeneration, Immunorestoration, and Insulin Mitigation warfen ethische Fragen auf wie „Wollen wir eine Welt, in der Millionen hungern und andere steinalt werden?“ ⓘ
Nachweis
Somatropin ist seit 1999 mit einem von dem deutschen Hormonforscher Christian Strasburger entwickelten Verfahren zuverlässig nachweisbar. Ein weiteres Verfahren wurde 2000 von Peter Sönksen entwickelt. ⓘ
Handelsnamen
Monopräparate ⓘ
Genotropin (D, A, CH), Humatrope (D, A, CH), Jintropin (RU, CN), Norditropin (D, A, CH), NutropinAq (D, A), Omnitrope (D, A, CH), Saizen (D, A, CH), Zomacton (D, A) ⓘ
Omnitrope (Sandoz) ist der Handelsname für das seit 2006 als Biosimilar zugelassene Somatropin. ⓘ