Salicylsäure
|
| |||

| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugter IUPAC-Name
2-Hydroxybenzoesäure | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
| EC-Nummer |
| ||
IUPHAR/BPS
|
|||
| KEGG | |||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C7H6O3 | ||
| Molekulare Masse | 138,122 g/mol | ||
| Erscheinungsbild | Farblose bis weiße Kristalle | ||
| Geruch | Geruchlos | ||
| Dichte | 1,443 g/cm3 (20 °C) | ||
| Schmelzpunkt | 158,6 °C (317,5 °F; 431,8 K) | ||
| Siedepunkt | 200 °C (392 °F; 473 K) zersetzt sich 211 °C (412 °F; 484 K) bei 20 mmHg | ||
Sublimation
Bedingungen |
Sublimiert bei 76 °C | ||
Löslichkeit in Wasser
|
| ||
| Löslichkeit | Löslich in Ether, CCl4, Benzol, Propanol, Aceton, Ethanol, Terpentinöl, Toluol | ||
| Löslichkeit in Benzol |
| ||
| Löslichkeit in Chloroform |
| ||
| Löslichkeit in Methanol |
| ||
| Löslichkeit in Olivenöl | 2,43 g/100 g (23 °C) | ||
| Löslichkeit in Aceton | 39,6 g/100 g (23 °C) | ||
| log P | 2.26 | ||
| Dampfdruck | 10,93 mPa | ||
| Azidität (pKa) |
| ||
| UV-vis (λmax) | 210 nm, 234 nm, 303 nm (4 mg/dL in Ethanol) | ||
Magnetische Suszeptibilität (χ)
|
-72,23-10-6 cm3/mol | ||
Brechungsindex (nD)
|
1.565 (20 °C) | ||
Dipolmoment
|
2.65 D | ||
| Thermochemie | |||
Std. Bildungsenthalpie
Bildung (ΔfH⦵298) |
-589,9 kJ/mol | ||
Std. Bildungsenthalpie
Verbrennung (ΔcH⦵298) |
3,025 MJ/mol | ||
| Pharmakologie | |||
ATC-Code
|
A01AD05 (WER) B01AC06 (WER) D01AE12 (WER) N02BA01 (WER) S01BC08 (WER) | ||
| Gefährdungen | |||
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |||
Gefahren für die Augen
|
Schwere Reizung | ||
Gefahren für die Haut
|
Leichte Reizung | ||
| GHS-Kennzeichnung: | |||
Piktogramme
|
 
| ||
Signalwort
|
Gefahr | ||
Gefahrenhinweise
|
H302, H318 | ||
Sicherheitshinweise
|
P280, P305+P351+P338 | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | 157 °C (315 °F; 430 K) geschlossener Tiegel | ||
Selbstentzündung
temperatur |
540 °C (1.004 °F; 813 K) | ||
| Letale Dosis oder Konzentration (LD, LC): | |||
LD50 (mediane Dosis)
|
480 mg/kg (Mäuse, oral) | ||
| Sicherheitsdatenblatt (SDS) | MSDS | ||
| Verwandte Verbindungen | |||
Verwandte Verbindungen
|
Methylsalicylat, Benzoesäure, Phenol, Aspirin, 4-Hydroxybenzoesäure, Magnesiumsalicylat, Cholin-Salicylat, Bismutsubsalicylat, Sulfosalicylsäure, Salicylat-Synthase | ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Stoffe in ihrem Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
Salicylsäure ist eine organische Verbindung mit der Formel HOC6H4CO2H. Sie ist ein farbloser, bitter schmeckender Feststoff und ein Vorläufer und Metabolit von Aspirin (Acetylsalicylsäure). Es handelt sich um ein Pflanzenhormon, das im Chemikalieninventar des Toxic Substances Control Act (TSCA) der EPA als experimentelles Teratogen aufgeführt ist. Der Name leitet sich vom lateinischen salix für Weidenbaum ab. Es ist ein Bestandteil einiger Anti-Akne-Produkte. Salze und Ester der Salicylsäure sind als Salicylate bekannt. ⓘ
Salicylsäure (o-Hydroxybenzoesäure) ist ein chemischer Stoff mit antipyretischer sowie analgetischer Wirkung. Salicylsäure kommt in Form ihres Methylesters in ätherischen Ölen und als Pflanzenhormon in den Blättern, Blüten und Wurzeln verschiedener Pflanzen vor und ist für die pflanzliche Abwehr von Pathogenen von Bedeutung. Ihren Namen bekam sie, da sie früher vor allem durch die oxidative Aufbereitung von Salicin, das in der Rinde verschiedener Weiden (wissenschaftlich Salix spec.) enthalten ist, gewonnen wurde. ⓘ
Verwendungen
Medizin

Salicylsäure als Medikament wird in der Regel zur Entfernung der äußeren Hautschicht verwendet. So wird sie zur Behandlung von Warzen, Schuppenflechte, Akne vulgaris, Ringelflechte, Schuppen und Ichthyose eingesetzt. ⓘ
Ähnlich wie andere Hydroxysäuren ist Salicylsäure ein Bestandteil vieler Hautpflegeprodukte zur Behandlung von seborrhoischer Dermatitis, Akne, Psoriasis, Schwielen, Hühneraugen, Keratosis pilaris, Acanthosis nigricans, Ichthyose und Warzen. ⓘ
Verwendung in der Herstellung
Salicylsäure wird als Konservierungsmittel für Lebensmittel, als Bakterizid und als Antiseptikum verwendet. ⓘ
Salicylsäure wird für die Herstellung anderer Arzneimittel verwendet, darunter 4-Aminosalicylsäure, Sandulpirid und Landetimid (über Salethamid). ⓘ
Salicylsäure ist seit langem ein wichtiger Ausgangsstoff für die Herstellung von Acetylsalicylsäure (Aspirin). Aspirin (Acetylsalicylsäure oder ASA) wird durch Veresterung der phenolischen Hydroxylgruppe der Salicylsäure mit der Acetylgruppe von Essigsäureanhydrid oder Acetylchlorid hergestellt. ASS ist der Standard, mit dem alle anderen nichtsteroidalen Antirheumatika (NSAIDs) verglichen werden. In der Veterinärmedizin wird diese Gruppe von Arzneimitteln hauptsächlich zur Behandlung von entzündlichen Erkrankungen des Bewegungsapparats eingesetzt. ⓘ
Bismutsubsalicylat, ein Salz von Bismut und Salicylsäure, ist der Wirkstoff in Magenmitteln wie Pepto-Bismol, ist der Hauptbestandteil von Kaopectate und "hat eine entzündungshemmende Wirkung (aufgrund der Salicylsäure) und wirkt auch als Antazidum und mildes Antibiotikum". ⓘ
Weitere Derivate sind Methylsalicylat, das als Einreibemittel zur Linderung von Gelenk- und Muskelschmerzen verwendet wird, und Cholinsalicylat, das äußerlich zur Linderung von Schmerzen bei Mundgeschwüren eingesetzt wird. Aminosalicylsäure wird verwendet, um bei Colitis ulcerosa eine Remission herbeizuführen, und wurde als Antituberkulöses Mittel eingesetzt, das häufig in Verbindung mit Isoniazid verabreicht wird. ⓘ
Natriumsalicylat ist ein nützlicher Leuchtstoff im vakuum-ultravioletten Spektralbereich mit einer nahezu flachen Quanteneffizienz für Wellenlängen zwischen 10 und 100 nm. Es fluoresziert blau bei 420 nm. Es lässt sich leicht auf einer sauberen Oberfläche durch Aufsprühen einer gesättigten Lösung des Salzes in Methanol und anschließendes Verdampfen herstellen. ⓘ

Weiterhin wird Salicylsäure als Flussmittel beim Weichlöten verwendet. ⓘ
Die Salicylsäure besitzt eine antimikrobielle Wirkung, jedoch ist ihr Einsatz als Konservierungsstoff in Lebensmitteln verboten. In Kosmetika ist die Salicylsäure gemäß der Verordnung (EG) Nr. 1223/2009 über kosmetische Mittel als Antischuppenmittel in Haarspülmitteln bis maximal 3 %, für sonstige Mittel bis zu einer Konzentration von 2 % und bei Verwendung als Konservierungsstoff bis maximal 0,5 % zugelassen. In Arzneimitteln zeigt Salicylsäure ab 5%iger Lösung einen für die Aknetherapie ausreichenden kerato- und somit auch komedolytischen Effekt. Die Wirkung beruht auf dem Abbau von Talgpfropfen in den Follikeln der Epidermis. Zudem wirkt Salicylsäure entzündungshemmend auf die Haut und beeinflusst die Arachidonsäurekaskade positiv. In 10%iger Lösung wird sie zur Behandlung von Hühneraugen, Warzen und Hautpilzen eingesetzt. ⓘ
Mechanismus der Wirkung
Salicylsäure moduliert die enzymatische Aktivität von COX-1, um die Bildung von entzündungsfördernden Prostaglandinen zu verringern. Salicylat kann die Prostaglandinbildung kompetitiv hemmen. Die antirheumatischen (nichtsteroidalen entzündungshemmenden) Wirkungen von Salicylat sind das Ergebnis seiner analgetischen und entzündungshemmenden Mechanismen. ⓘ
Salicylsäure bewirkt, dass die Zellen der Epidermis leichter abblättern, die Poren nicht verstopfen und Platz für neues Zellwachstum schaffen. Salicylsäure hemmt die Oxidation von Uridin-5-Diphosphoglukose (UDPG) konkurrierend mit Nicotinamid-Adenosin-Dinukleotid und nicht konkurrierend mit UDPG. Außerdem hemmt es kompetitiv die Übertragung der Glucuronylgruppe von Uridin-5-Phosphoglucuronsäure auf den phenolischen Akzeptor. ⓘ
Die wundheilungsverzögernde Wirkung der Salicylate ist wahrscheinlich hauptsächlich auf ihre hemmende Wirkung auf die Mucopolysaccharidsynthese zurückzuführen. ⓘ
Sicherheit
Wenn hohe Konzentrationen von Salicylsalbe auf einen großen Prozentsatz der Körperoberfläche aufgetragen werden, können hohe Mengen an Salicylsäure in das Blut gelangen, was eine Hämodialyse erforderlich macht, um weitere Komplikationen zu vermeiden. ⓘ
Herstellung und chemische Reaktionen
Biosynthese
Salicylsäure wird aus der Aminosäure Phenylalanin biosynthetisiert. In Arabidopsis thaliana kann sie über einen Phenylalanin-unabhängigen Weg synthetisiert werden. ⓘ
Industrielle Synthese
Natriumsalicylat wird kommerziell durch Behandlung von Natriumphenolat (dem Natriumsalz von Phenol) mit Kohlendioxid bei hohem Druck (100 atm) und hoher Temperatur (115 °C) hergestellt - eine Methode, die als Kolbe-Schmitt-Reaktion bekannt ist. Durch Ansäuern des Produkts mit Schwefelsäure erhält man Salicylsäure:
Sie kann auch durch Hydrolyse von Aspirin (Acetylsalicylsäure) oder Methylsalicylat (Wintergrünöl) mit einer starken Säure oder Base hergestellt werden. ⓘ
Reaktionen

Die Salicylsäure zählt aufgrund des enthaltenen Benzolrings zu den Aromaten. Da sie eine Carboxy- und Hydroxygruppe enthält, gehört sie zu den Hydroxycarbonsäuren. Wegen der β-Ständigkeit der Carboxy- zur Hydroxygruppe kann sie auch als β-Hydroxycarbonsäure bezeichnet werden. Da die Hydroxygruppe direkt an den aromatischen Benzolring gebunden ist, gehört sie ebenfalls zu den Phenolen und damit auch zu den Phenolsäuren. ⓘ
Bei schnellem, starkem Erhitzen decarboxyliert Salicylsäure unter Bildung von Phenol. Ab 76 °C sublimiert der Stoff teilweise, aus den abkühlenden Dämpfen entstehen nadelförmige Kristalle. ⓘ
Die – im Vergleich zu anderen Hydroxybenzoesäuren – hohe Azidität liegt an der Stabilisierung des Salicylat-Anions durch eine Wasserstoffbrücke mit der benachbarten Hydroxygruppe. ⓘ
Analytischer Nachweis: Da Salicylsäure formal das Enol (in diesem Fall ein Phenol) einer β-Ketocarbonsäure darstellt, bildet sie mit Eisen(III)-chlorid-Lösung einen violett gefärbten Komplex, den Tris-Salicylat-Eisen(III)-Komplex:
Dieser Nachweis ist nicht spezifisch, da ähnliche Verbindungen wie Acetessigester die gleiche Reaktion aufweisen. Der Flammpunkt liegt bei 157 °C und die Zündtemperatur bei 570 °C. ⓘ
Beim Erhitzen wandelt sich die Salicylsäure in Phenylsalicylat um:
- 2 HOC6H4CO2H → C6H5O2C6H4OH + CO2 + H2O
Bei weiterer Erhitzung entsteht Xanthon. ⓘ
Salicylsäure wird bei 200-230 °C langsam zu Phenol und Kohlendioxid abgebaut:
- C6H4OH(CO2H) → C6H5OH + CO2 ⓘ
Geschichte

Die Weide wird seit langem für medizinische Zwecke verwendet. Dioskurides, dessen Schriften mehr als 1 500 Jahre lang sehr einflussreich waren, verwendete "Itea" (bei dem es sich möglicherweise um eine Weidenart handelte) als Mittel gegen "schmerzhafte Darmverstopfungen", zur Geburtenkontrolle, für "diejenigen, die Blut spucken", zur Entfernung von Schwielen und Hühneraugen und äußerlich als "warme Packung bei Gicht". William Turner wiederholte dies 1597, indem er sagte, dass Weidenrinde, "zu Asche verbrannt und in Essig getränkt, Hühneraugen und andere ähnliche Erscheinungen an den Füßen und Zehen beseitigt". Einige dieser Heilmittel beschreiben möglicherweise die Wirkung von Salicylsäure, die aus dem in der Weide enthaltenen Salicin gewonnen werden kann. Es ist jedoch ein moderner Mythos, dass die Kräuterkundigen der Antike die Weide als Schmerzmittel verwendeten. ⓘ
Hippokrates, Galen, Plinius der Ältere und andere wussten, dass Weidenrinde Schmerzen lindern und Fieber senken kann. ⓘ
Sie wurde in Europa und China zur Behandlung dieser Beschwerden eingesetzt. Dieses Mittel wird in Texten aus dem alten Ägypten, Sumer und Assyrien erwähnt. ⓘ
Die Cherokee und andere amerikanische Ureinwohner verwenden einen Aufguss der Rinde gegen Fieber und für andere medizinische Zwecke. Im Jahr 2014 wiesen Archäologen Spuren von Salicylsäure auf Keramikfragmenten aus dem siebten Jahrhundert nach, die im Osten des Bundesstaates Colorado gefunden wurden. ⓘ
Reverend Edward Stone, ein Vikar aus Chipping Norton, Oxfordshire, England, berichtete 1763, dass die Rinde der Weide bei Fieber wirksam sei. ⓘ
Ein Extrakt aus Weidenrinde, Salicin genannt, nach dem lateinischen Namen für die weiße Weide (Salix alba), wurde 1828 von dem deutschen Chemiker Johann Andreas Buchner isoliert und benannt. Eine größere Menge der Substanz wurde 1829 von Henri Leroux, einem französischen Pharmazeuten, isoliert. Raffaele Piria, ein italienischer Chemiker, konnte die Substanz in einen Zucker und eine zweite Komponente umwandeln, die bei der Oxidation zu Salicylsäure wird. Salicylsäure wurde 1839 von deutschen Forschern auch aus dem Mädesüß (Filipendula ulmaria, früher als Spiraea ulmaria bezeichnet) isoliert. Ihr Extrakt verursachte Verdauungsprobleme wie Magenreizungen, Blutungen, Durchfall und sogar den Tod, wenn er in hohen Dosen eingenommen wurde. ⓘ
Im Jahr 1874 experimentierte der schottische Arzt Thomas MacLagan mit Salicin zur Behandlung von akutem Rheuma, mit beachtlichem Erfolg, wie er 1876 in The Lancet berichtete. In der Zwischenzeit versuchten deutsche Wissenschaftler Natriumsalicylat mit weniger Erfolg und schwereren Nebenwirkungen. ⓘ
1979 wurde festgestellt, dass Salicylate an der induzierten Abwehr von Tabak gegen das Tabakmosaikvirus beteiligt sind. 1987 wurde Salicylsäure als das lange gesuchte Signal identifiziert, das thermogene Pflanzen wie die Voodoo-Lilie (Sauromatum guttatum) zur Wärmeerzeugung veranlasst. ⓘ
Der italienische Chemiker Raffaele Piria isolierte die Salicylsäure erstmals 1838 aus dem Glucosid Salicin nach der Oxidation des primären Produkts Salicylalkohol. Der deutsche Chemiker Hermann Kolbe erkannte 1853 anhand des Zerfalls der Verbindung in Phenol und Kohlendioxid ihre Zusammensetzung und entwickelte hieraus im Jahre 1859 die nach ihm benannte Synthese. ⓘ
Nahrhafte Quellen
Salicylsäure kommt in Pflanzen als freie Salicylsäure und ihre carboxylierten Ester und Phenolglykoside vor. Mehrere Studien deuten darauf hin, dass der Mensch Salicylsäure in messbaren Mengen aus diesen Pflanzen aufnimmt. Zu den salicylsäurereichen Getränken und Lebensmitteln gehören Bier, Kaffee, Tee, zahlreiche Obst- und Gemüsesorten, Süßkartoffeln, Nüsse und Olivenöl. Fleisch, Geflügel, Fisch, Eier, Milchprodukte, Zucker, Brot und Getreideerzeugnisse haben einen geringen Salicylatgehalt. ⓘ
Manche Menschen, die empfindlich auf Salicylate in der Nahrung reagieren, können Symptome einer allergischen Reaktion wie Asthma bronchiale, Schnupfen, Magen-Darm-Beschwerden oder Durchfall haben und müssen daher eine salicylatarme Diät einhalten. ⓘ
Pflanzliches Hormon
Salicylsäure ist ein phenolisches Phytohormon, das in Pflanzen vorkommt und eine Rolle bei Pflanzenwachstum und -entwicklung, Photosynthese, Transpiration sowie Ionenaufnahme und -transport spielt. Salicylsäure ist an der endogenen Signalübertragung beteiligt und vermittelt die pflanzliche Abwehr gegen Krankheitserreger. Sie spielt eine Rolle bei der Resistenz gegen Krankheitserreger (d. h. bei der systemisch erworbenen Resistenz), indem sie die Produktion von Proteinen, die mit der Pathogenese zusammenhängen, und anderen Abwehrstoffen induziert. Die Rolle von SA als Verteidigungssignalgeber wird am deutlichsten durch Experimente demonstriert, bei denen es ausgeschaltet wird: Delaney et al. 1994, Gaffney et al. 1993, Lawton et al. 1995 und Vernooij et al. 1994 verwenden jeweils Nicotiana tabacum oder Arabidopsis, die nahG, für Salicylat-Hydroxylase, exprimieren. Die Inokulation mit dem Erreger führte nicht zu den üblichen hohen SA-Konzentrationen, SAR wurde nicht produziert, und in den systemischen Blättern wurden keine PR-Gene exprimiert. Tatsächlich waren die Probanden anfälliger für virulente - und sogar normalerweise avirulente - Krankheitserreger. ⓘ
Exogen zugeführt, kann Salicylsäure die Pflanzenentwicklung fördern, indem sie die Keimung der Samen, die Knospenblüte und die Fruchtreife unterstützt, obwohl eine zu hohe Salicylsäurekonzentration diese Entwicklungsprozesse negativ beeinflussen kann. ⓘ
Der flüchtige Methylester der Salicylsäure, Methylsalicylat, kann auch durch die Luft diffundieren und so die Kommunikation zwischen den Pflanzen erleichtern. Methylsalicylat wird von den Spaltöffnungen der benachbarten Pflanze aufgenommen, wo es nach der Rückumwandlung in Salicylsäure eine Immunreaktion auslösen kann. ⓘ
Als Phytohormon spielt die Salicylsäure eine wichtige Rolle als regulatorisches Signal bei abiotischem Stress wie Trockenheit und Hitze, Kälte oder osmotischem Druck. Zusätzlich ist sie für die Pflanze wichtig bei der Verteidigung gegen Pathogene, wird bei einem Befall sowohl lokal als auch systemisch exprimiert und ist in der Lage die Genexpression zu modulieren. Des Weiteren gibt es Hinweise, dass die Salicylsäure eine Rolle beim Wachstum und der Entwicklung der Pflanze spielt. ⓘ
Signaltransduktion
Es wurde eine Reihe von Proteinen identifiziert, die in Pflanzen mit SA interagieren, insbesondere Salicylsäure-bindende Proteine (SABPs) und die NPR-Gene (Nonexpressor of pathogenesis related genes), die mutmaßliche Rezeptoren sind. ⓘ
Vorkommen und Gewinnung
Biosynthese
Salicylsäure kommt in einer Vielzahl von Pflanzen vor und wirkt dort als Phytohormon. Es existieren zwei kompartimentierte Wege der Biosynthese: Der Phenylpropanoidweg im Cytoplasma ausgehend von Phenylalanin und der Isochorismatweg in den Chloroplasten. Meist liegt die Salicylsäure methyliert als flüssiges Methylsalicylat vor, um als flüchtiges Derivat für den Langstreckentransport wirksam zu sein. In Tabakpflanzen und Arabidopsis thaliana zeigte sich, dass diese Form wichtig bei der systemisch erworbenen Resistenz ist. Zudem kann die Salicylsäure glykosyliert als inaktive Form in den Vakuolen gespeichert werden. ⓘ
Technische Herstellung
Technisch wird sie durch die Kolbe-Schmitt-Reaktion (vereinfacht auch als Salicylsäure-Synthese bezeichnet) aus Kohlenstoffdioxid und Natriumphenolat hergestellt. Diese künstliche Herstellung hat die Gewinnung aus Weidenrinde weitestgehend verdrängt. ⓘ
Bereits 1874 wurde die Synthese der Salicylsäure nach einer Idee von Hermann Kolbe vom Labor in die fabrikmäßige Produktion übertragen, wobei der Schmitt-Schüler Friedrich von Heyden die Salicylsäurefabrik Dr. F. von Heyden in Dresden gründete, die ein Jahr später nach Radebeul übersiedelte. Von dort wurde die Salicylsäure als erstes industriell hergestelltes und „abgepacktes“ Medikament der Welt vertrieben. Friedrich von Heyden gilt als Gründer der industriellen Salicylsäureherstellung in der pharmazeutischen Industrie. ⓘ
Unerwünschte Wirkungen
Nebenwirkungen der Pharmakotherapie
Die Salicylsäure ist ein Metabolit der Acetylsalicylsäure, die im Organismus rasch hydrolysiert wird. Nebenwirkungen sind vor allem allergische Reaktionen, Blutungsneigung, Bronchokonstriktionen (Asthma bronchiale), Magenschleimhautschädigung mit Blutungen, in Einzelfällen Leberschädigung. Auch Harnsäureretention, Hyperurikämie und Nierenschädigung wurden beobachtet. Ein wichtiger Stoffwechselweg in der Leber führt über die Umwandlung in Salicylursäure. ⓘ
Toxizität
Auf der Haut, für Schleimhäute und Augen wirkt Salicylsäure akut reizend bis gewebsschädigend. Weiterhin verursacht die Säure bei oraler oder sonstiger Einnahme eine Dämpfung des Atemzentrums und eine Störung wichtiger Stoffwechselprozesse sowie des Zentralnervensystems. Bei chronischer Einwirkung zeigen sich Störungen des Magen-Darm-Trakts. Im Tierversuch zeigte Salicylsäure bei oraler und dermaler Gabe verschiedenste Wirkungen auf Tiere (Katze, Maus, Kaninchen und Ratte) wie Schläfrigkeit, Muskelschwäche und Organschäden bei Leber und Nieren. Die akute Toxizität LD50 lag oral zwischen 400 und 1300 mg/kg, dermal bei der Ratte bei 2 g/kg. Beim Menschen wurden bei dermaler Verabreichung TDLo-Werte von 57 bis 111 mg/kg ermittelt. Die Plasmahalbwertszeit von Salicylsäure beträgt etwa 2–3 Stunden. ⓘ
Sicherheitshinweise
Auf Vorschlag der Firma Novacyl wurde 2015 und 2016 die chemikalienrechtliche Einstufung von Salicylsäure überarbeitet. Der Ausschuss für Risikobewertung (RAC) der Europäischen Chemikalienagentur (ECHA) hat am 10. März 2016 die Einstufung für Salicylsäure wie folgt geändert: Salicylsäure wird als reproduktionstoxisch Repr 2 sowie Acut Tox 4 und Eye Dam 1 eingestuft. Die Warnhinweise wurde festgelegt auf H361d, H302 und H318. Diese Einstufung des RAC muss noch von der EU-Kommission in geltendes Recht umgesetzt werden, sie stellt aber mit der Veröffentlichung den Stand des Wissens dar, der von Unternehmen und Behörden berücksichtigt werden muss. ⓘ
Derivate der Salicylsäure
Salze
Salicylsäure reagiert mit Natronlauge zu Natriumsalicylat. ⓘ
Ester
Reagiert Salicylsäure mit einem Alkohol, so entsteht unter Wasserabspaltung ein Carbonsäureester bzw. ein Salicylsäureester. Sie kann auch mit organischen Säuren Ester bilden, wobei sie dann in der Reaktion als Alkohol fungiert. Salicylsäureester werden hauptsächlich in der Kosmetik- und Parfumindustrie als Antirheumatika in Badezusätzen, Salben oder Cremes, sowie als Riechstoffe und als UV-Filter in Sonnenschutzmitteln verwandt. Der wohl bekannteste Ester der Salicylsäure ist die Acetylsalicylsäure. Hier wurde die Hydroxygruppe der Salicylsäure mit der Carboxygruppe der Essigsäure verestert. Weitere relevante Salicylsäureester sind Salicylsäuremethylester, Salicylsäureethylester, Salicylsäurebenzylester, Salicylsäureisobutylester, Salicylsäureisopentylester, Salicylsäurephenylester und Salicylsäurehydroxyethylester. ⓘ
Halogenderivate
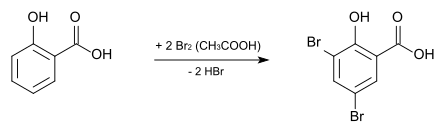
Durch Bromierung mit elementarem Brom in Eisessig entsteht die 3,5-Dibromsalicylsäure, deren Kupfersalz als Fungizid und Bakterizid eingesetzt wird. ⓘ
Durch Iodierung mit Iodchlorid erhält man die biochemisch relevante 3,5-Diiodsalicylsäure. An der 4-Position halogenierte Salicylsäurederivate, wie 4-Iodsalicylsäure lassen sich nicht auf direktem Weg erhalten. ⓘ