In-vitro-Fertilisation
| In-vitro-Fertilisation ⓘ | |
|---|---|
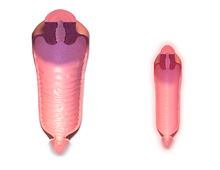
 Illustriertes Schema der IVF mit Einzelspermieninjektion (ICSI) | |
| Andere Bezeichnungen | IVF |
| ICD-10-PCS | 8E0ZXY1 |
| MeSH | D005307 |
Die In-vitro-Fertilisation (IVF) ist ein Befruchtungsverfahren, bei dem eine Eizelle mit Spermien in vitro ("im Glas") zusammengebracht wird. Bei diesem Verfahren wird der Eisprung der Frau überwacht und stimuliert, eine Eizelle oder Eizellen aus den Eierstöcken entnommen und in einem Nährmedium im Labor von Spermien befruchtet. Nachdem die befruchtete Eizelle (Zygote) 2-6 Tage lang einer Embryokultur unterzogen wurde, wird sie mit einem Katheter in die Gebärmutter übertragen, um eine erfolgreiche Schwangerschaft herbeizuführen. ⓘ
Die IVF ist eine Form der assistierten Reproduktionstechnologie, die zur Behandlung von Unfruchtbarkeit und zur Leihmutterschaft eingesetzt wird. Eine befruchtete Eizelle einer Spenderin kann in die Gebärmutter einer Leihmutter eingepflanzt werden, und das entstehende Kind ist genetisch nicht mit der Leihmutter verwandt. Einige Länder haben die Verfügbarkeit von IVF-Behandlungen verboten oder anderweitig reguliert, was zu Fruchtbarkeitstourismus geführt hat. Zu den Einschränkungen bei der IVF-Behandlung gehören die Kosten und das Alter, damit eine Frau eine gesunde Schwangerschaft austragen kann. ⓘ
Im Juli 1978 war Louise Brown das erste Kind, das erfolgreich geboren wurde, nachdem ihre Mutter eine IVF-Behandlung erhalten hatte. Brown wurde als Ergebnis einer IVF-Behandlung mit natürlichem Zyklus geboren, bei der keine Stimulation vorgenommen wurde. Der Eingriff fand im Dr. Kershaw's Cottage Hospital (heute Dr. Kershaw's Hospice) in Royton, Oldham, England, statt. Robert G. Edwards wurde 2010 mit dem Nobelpreis für Physiologie oder Medizin ausgezeichnet. Der Physiologe hatte die Behandlung gemeinsam mit Patrick Steptoe und der Embryologin Jean Purdy entwickelt. Die beiden letztgenannten kamen jedoch nicht mehr in Frage, da sie verstorben waren und der Nobelpreis nicht posthum verliehen wird. ⓘ
Mit einer Eizellenspende und einer IVF-Behandlung können auch Frauen schwanger werden, die das fortpflanzungsfähige Alter überschritten haben, unfruchtbare Partner haben, an idiopathischer weiblicher Unfruchtbarkeit leiden oder die Menopause erreicht haben. Nach der IVF-Behandlung werden manche Paare ohne weitere Fruchtbarkeitsbehandlungen schwanger. Im Jahr 2018 wurden weltweit schätzungsweise acht Millionen Kinder mithilfe von IVF und anderen assistierten Reproduktionstechniken geboren. Eine Studie aus dem Jahr 2019, in der 10 Zusatzstoffe zur IVF untersucht werden (Screening-Hysteroskopie, DHEA, Testosteron, GH, Aspirin, Heparin, Antioxidantien bei Männern und Frauen, Samenplasma und PRP), legt nahe, dass diese Zusatzstoffe vermieden werden sollten, solange nicht mehr Beweise dafür vorliegen, dass sie sicher und wirksam sind. ⓘ
Die In-vitro-Fertilisation (IVF) – lateinisch für „Befruchtung im Glas“ – ist eine Methode zur künstlichen Befruchtung. Sie wurde in den 1960er- und 1970er-Jahren von Robert Edwards, der 2010 dafür den Nobelpreis für Medizin erhielt, und Patrick Steptoe entwickelt. In Deutschland ist diese Behandlung zulässig, wenn bei einem (Ehe-)Paar ein Jahr lang trotz regelmäßigem, ungeschütztem Geschlechtsverkehr die Schwangerschaft ausbleibt oder eine Präimplantationsdiagnostik (PID) angezeigt ist. ⓘ
Terminologie
Der lateinische Begriff "in vitro" bedeutet "im Glas" und wird verwendet, weil frühe biologische Experimente, bei denen Gewebe außerhalb des lebenden Organismus kultiviert wurde, in Glasbehältern wie Bechergläsern, Reagenzgläsern oder Petrischalen durchgeführt wurden. Heute wird der wissenschaftliche Begriff "in vitro" für jedes biologische Verfahren verwendet, das außerhalb des Organismus durchgeführt wird, in dem es normalerweise stattgefunden hätte, um es von einem In-vivo-Verfahren (z. B. In-vivo-Befruchtung) zu unterscheiden, bei dem das Gewebe innerhalb des lebenden Organismus verbleibt, in dem es normalerweise vorkommt. ⓘ
Der umgangssprachliche Begriff "Reagenzglasbabys" für Babys, die durch IVF gezeugt wurden, bezieht sich auf die röhrenförmigen Behälter aus Glas oder Kunststoff, die so genannten Reagenzgläser, die üblicherweise in Chemie- und Biologielabors verwendet werden. Die IVF wird jedoch in der Regel in Petrischalen durchgeführt, die sowohl breiter als auch flacher sind und häufig zur Kultivierung von Kulturen verwendet werden. ⓘ
Im weiteren Sinne ist die IVF eine Form der assistierten Reproduktionstechnologie (ART). ⓘ
Medizinische Anwendungen
Indikationen
Die IVF kann zur Überwindung der weiblichen Unfruchtbarkeit eingesetzt werden, wenn diese auf Probleme mit den Eileitern zurückzuführen ist, die eine In-vivo-Befruchtung erschweren. Sie kann auch bei männlicher Unfruchtbarkeit helfen, wenn die Qualität der Spermien mangelhaft ist. In solchen Fällen kann die intrazytoplasmatische Spermieninjektion (ICSI) eingesetzt werden, bei der eine Samenzelle direkt in die Eizelle injiziert wird. Diese Methode wird eingesetzt, wenn die Spermien Schwierigkeiten haben, in die Eizelle einzudringen. In diesen Fällen können die Spermien des Partners oder eines Spenders verwendet werden. ICSI wird auch eingesetzt, wenn die Spermienzahl sehr niedrig ist. Es hat sich gezeigt, dass der Einsatz von ICSI bei entsprechender Indikation die Erfolgsquoten der IVF erhöht. ⓘ
Nach den NICE-Richtlinien des Vereinigten Königreichs ist eine IVF-Behandlung bei ungeklärter Unfruchtbarkeit für Frauen geeignet, die nach zwei Jahren regelmäßigen ungeschützten Geschlechtsverkehrs nicht schwanger geworden sind. ⓘ
Bei Frauen mit Anovulation kann eine IVF-Behandlung nach 7-12 versuchten Zyklen der Ovulationsinduktion eine Alternative sein, da letztere teuer und leichter zu kontrollieren ist. ⓘ
Erfolgsquoten
Die IVF-Erfolgsrate ist der Prozentsatz aller IVF-Verfahren, die zu einem positiven Ergebnis führen. Je nach Berechnungsmethode kann dieses Ergebnis die Zahl der bestätigten Schwangerschaften, die so genannte Schwangerschaftsrate, oder die Zahl der Lebendgeburten, die so genannte Lebendgeburtenrate, darstellen. Die Erfolgsrate hängt von verschiedenen Faktoren ab, wie z. B. dem Alter der Mutter, der Ursache der Unfruchtbarkeit, dem Status des Embryos, der Reproduktionsgeschichte und den Faktoren des Lebensstils. ⓘ
Mütterliches Alter: Jüngere IVF-Kandidatinnen haben eine höhere Wahrscheinlichkeit, schwanger zu werden. Bei Frauen, die älter als 41 Jahre sind, ist es wahrscheinlicher, dass sie mit einer Spendereizelle schwanger werden. ⓘ
Reproduktionsgeschichte: Frauen, die schon einmal schwanger waren, sind in vielen Fällen erfolgreicher mit IVF-Behandlungen als Frauen, die noch nie schwanger waren. ⓘ
Dank der Fortschritte in der Reproduktionstechnologie ist die Lebendgeburtenrate nach dem fünften IVF-Zyklus von 76 % im Jahr 2005 auf 80 % im Jahr 2010 gestiegen, obwohl die Anzahl der übertragenen Embryonen gesunken ist (die Mehrlingsrate sank von 25 % auf 8 %). ⓘ
Lebendgeburtenrate
Die Lebendgeburtenrate ist der Prozentsatz aller IVF-Zyklen, die zu einer Lebendgeburt führen. In dieser Rate sind Fehl- oder Totgeburten nicht enthalten; Geburten mit mehreren Kindern, wie Zwillinge und Drillinge, werden als eine Schwangerschaft gezählt. In einer von der Society for Assisted Reproductive Technology (SART) erstellten Zusammenfassung für das Jahr 2019, in der die durchschnittlichen IVF-Erfolgsraten in den Vereinigten Staaten pro Altersgruppe bei der Verwendung von Eizellen, die nicht gespendet wurden, aufgeführt sind, wurden die folgenden Daten zusammengestellt:
| < 35 | 35–37 | 38–40 | 41–42 | > 42 ⓘ | |
|---|---|---|---|---|---|
| Lebendgeburtenrate (%) | 55 | 41 | 26.8 | 13.4 | 4.3 |
Im Jahr 2006 meldeten die kanadischen Kliniken eine Lebendgeburtenrate von 27 %. Die Geburtenrate bei jüngeren Patientinnen war etwas höher, mit einer Erfolgsrate von 35,3 % bei den 21-Jährigen und jünger, der jüngsten untersuchten Gruppe. Die Erfolgsrate bei älteren Patientinnen war ebenfalls niedriger und nahm mit zunehmendem Alter ab: bei den 37-Jährigen lag sie bei 27,4 %, und bei den über 48-Jährigen, der ältesten untersuchten Gruppe, gab es keine Lebendgeburten. Einige Kliniken übertrafen diese Raten, aber es lässt sich nicht feststellen, ob dies auf eine bessere Technik oder auf die Auswahl der Patientinnen zurückzuführen ist, da es möglich ist, die Erfolgsraten künstlich zu erhöhen, indem man die schwierigsten Patientinnen nicht annimmt oder sie in Eizellspendezyklen lenkt (die gesondert erfasst werden). Darüber hinaus können die Schwangerschaftsraten durch das Einsetzen mehrerer Embryonen erhöht werden, auch auf die Gefahr hin, dass sich die Wahrscheinlichkeit von Mehrlingen erhöht. ⓘ
Da nicht jeder begonnene IVF-Zyklus zu einer Eizellentnahme oder einem Embryotransfer führt, muss in den Berichten über die Lebendgeburtenraten der Nenner angegeben werden, d. h. begonnene IVF-Zyklen, IVF-Entnahmen oder Embryotransfers. Die SART fasste die Erfolgsraten 2008-9 für US-Kliniken für Zyklen mit frischen Embryonen ohne Spendereizellen zusammen und gab die Lebendgeburtenraten nach dem Alter der zukünftigen Mutter an, mit einem Spitzenwert von 41,3 % pro begonnenem Zyklus und 47,3 % pro Embryotransfer bei Patientinnen unter 35 Jahren. ⓘ
IVF-Versuche in mehreren Zyklen führen zu einer höheren kumulativen Lebendgeburtenrate. Je nach demografischer Gruppe wurden in einer Studie 45 % bis 53 % bei drei Versuchen und 51 % bis 71 % bis 80 % bei sechs Versuchen ermittelt. ⓘ
Ab dem 15. Februar 2021 veröffentlichen die meisten australischen IVF-Kliniken ihre individuelle Erfolgsrate online unter YourIVFSuccess.com.au. Diese Website enthält auch ein Prognosetool. ⓘ
Schwangerschaftsrate
Die Schwangerschaftsrate kann auf verschiedene Weise definiert werden. In den Vereinigten Staaten enthalten die SART und die Centers for Disease Control (und in der Tabelle im Abschnitt Erfolgsraten oben) Statistiken über positive Schwangerschaftstests und klinische Schwangerschaftsraten. ⓘ
Die von der SART erstellte Zusammenfassung für 2019 enthält die folgenden Daten für nicht gespendete Eizellen (erster Embryotransfer) in den Vereinigten Staaten:
| <35 | 35-37 | 38-40 | 41-42 | >42 ⓘ | |
|---|---|---|---|---|---|
| Rate positiver Schwangerschaftstests (%) | 55.1 | 44.8 | 32.9 | 19.1 | 8.5 |
| Klinische Schwangerschaftsrate (%) | 47.5 | 38.3 | 27.5 | 15.5 | 6.3 |
Im Jahr 2006 meldeten kanadische Kliniken eine durchschnittliche Schwangerschaftsrate von 35 %. Eine französische Studie schätzt, dass 66 % der Patientinnen, die eine IVF-Behandlung beginnen, schließlich ein Kind bekommen (40 % während der IVF-Behandlung im Zentrum und 26 % nach Abbruch der IVF). Der Kinderwunsch nach Abbruch der IVF-Behandlung wurde hauptsächlich durch Adoption (46 %) oder spontane Schwangerschaft (42 %) erfüllt. ⓘ
Fehlgeburtenrate
Laut einer Studie der Mayo Clinic liegen die Fehlgeburtenraten bei IVF zwischen 15 und 25 %. ⓘ
Prädiktoren für den Erfolg
Die wichtigsten potenziellen Faktoren, die die Schwangerschafts- (und Lebendgeburts-)raten bei der IVF beeinflussen, sind das Alter der Mutter, die Dauer der Unfruchtbarkeit oder Subfertilität, der bFSH-Wert und die Anzahl der Eizellen, die alle die Eierstockfunktion widerspiegeln. Das optimale Alter der Frau liegt zwischen 23 und 39 Jahren zum Zeitpunkt der Behandlung. ⓘ

Zu den Biomarkern, die die Schwangerschaftschancen bei IVF beeinflussen, gehören:
- Anzahl der Antralfollikel, wobei eine höhere Anzahl zu höheren Erfolgsquoten führt.
- Anti-Müller-Hormonspiegel, wobei höhere Werte auf höhere Chancen für eine Schwangerschaft sowie für eine Lebendgeburt nach IVF hinweisen, selbst nach Bereinigung um das Alter.
- Grad der DNA-Fragmentierung, gemessen z. B. mit dem Comet-Assay, fortgeschrittenes mütterliches Alter und Spermaqualität.
- Frauen mit ovariellen FMR1-Genotypen, einschließlich het-norm/low, haben signifikant geringere Schwangerschaftschancen bei IVF.
- Ein erhöhter Progesteronspiegel am Tag der Induktion der endgültigen Reifung steht in Zusammenhang mit niedrigeren Schwangerschaftsraten in IVF-Zyklen bei Frauen, die sich einer ovariellen Stimulation mit GnRH-Analoga und Gonadotropinen unterziehen. Im Vergleich zu einem Progesteronspiegel von weniger als 0,8 ng/ml ergibt sich zu diesem Zeitpunkt bei einem Spiegel zwischen 0,8 und 1,1 ng/ml ein Odds Ratio für eine Schwangerschaft von etwa 0,8 und bei einem Spiegel zwischen 1,2 und 3,0 ng/ml ein Odds Ratio für eine Schwangerschaft von 0,6 bis 0,7. Andererseits scheint ein erhöhter Progesteronspiegel die Chance auf eine Schwangerschaft bei tiefgefrorenen Zyklen und Zyklen mit Eizellspende nicht zu verringern.
- Merkmale der Zellen aus dem Cumulus oophorus und der Membrana granulosa, die bei der Eizellgewinnung leicht zu entnehmen sind. Diese Zellen sind eng mit der Eizelle verbunden und teilen dieselbe Mikroumgebung, und die Expressionsrate bestimmter Gene in diesen Zellen wird mit einer höheren oder niedrigeren Schwangerschaftsrate in Verbindung gebracht.
- Eine Endometriumdicke (EMT) von weniger als 7 mm verringert die Schwangerschaftsrate um einen Odds Ratio von etwa 0,4 im Vergleich zu einer EMT von über 7 mm. Eine so geringe Dicke kommt jedoch nur selten vor, und eine routinemäßige Verwendung dieses Parameters wird als nicht gerechtfertigt angesehen. ⓘ
Weitere Determinanten für das Ergebnis der IVF sind:
- Mit zunehmendem Alter der Mutter nimmt die Wahrscheinlichkeit einer Empfängnis ab und die Wahrscheinlichkeit einer Fehlgeburt zu.
- Mit zunehmendem Alter des Vaters, insbesondere ab 50 Jahren, sinkt die Rate der Blastozystenbildung.
- Tabakrauchen verringert die Wahrscheinlichkeit, dass eine IVF-Behandlung zu einer Lebendgeburt führt, um 34 % und erhöht das Risiko einer Fehlgeburt bei einer IVF-Schwangerschaft um 30 %.
- Bei einem Body-Mass-Index (BMI) von über 27 sinkt die Wahrscheinlichkeit einer Lebendgeburt nach dem ersten IVF-Zyklus um 33 %, verglichen mit einem BMI zwischen 20 und 27. Außerdem haben fettleibige Schwangere ein höheres Risiko für Fehlgeburten, Schwangerschaftsdiabetes, Bluthochdruck, Thromboembolien und Probleme bei der Entbindung sowie ein erhöhtes Risiko für angeborene Anomalien des Fötus. Der ideale Body-Mass-Index liegt bei 19-30.
- Eine Salpingektomie oder ein laparoskopischer Eileiterverschluss vor der IVF-Behandlung erhöht die Chancen für Frauen mit Hydrosalpinges.
- Erfolgreiche vorangegangene Schwangerschaft und/oder Lebendgeburt erhöhen die Chancen
- Geringer Alkohol-/Koffeinkonsum erhöht die Erfolgsquote
- Die Anzahl der im Behandlungszyklus übertragenen Embryonen
- Qualität der Embryonen
- Einige Studien deuten auch darauf hin, dass Autoimmunkrankheiten eine Rolle bei der Verringerung der IVF-Erfolgsrate spielen können, da sie die ordnungsgemäße Einnistung des Embryos nach dem Transfer beeinträchtigen. ⓘ
Aspirin wird Frauen manchmal verschrieben, um die Chancen einer IVF-Befruchtung zu erhöhen. 2016 gab es jedoch keine Beweise dafür, dass es sicher und wirksam ist. ⓘ
Eine 2013 durchgeführte Überprüfung und Metaanalyse randomisierter kontrollierter Studien zur Akupunktur als unterstützende Therapie bei der IVF ergab keinen Gesamtnutzen und kam zu dem Schluss, dass ein offensichtlicher Nutzen, der in einer Untergruppe veröffentlichter Studien festgestellt wurde, in denen die Kontrollgruppe (die keine Akupunktur anwendete) eine unterdurchschnittliche Schwangerschaftsrate aufwies, wegen möglicher Publikationsverzerrungen und anderer Faktoren weiter untersucht werden muss. ⓘ
Ein Cochrane-Review kam zu dem Ergebnis, dass eine Endometriumverletzung, die im Monat vor der Ovarialinduktion durchgeführt wurde, sowohl die Lebendgeburtsrate als auch die klinische Schwangerschaftsrate bei IVF im Vergleich zu keiner Endometriumverletzung zu erhöhen scheint. Es gab keine Hinweise auf einen Unterschied zwischen den Gruppen in Bezug auf Fehlgeburten, Mehrlingsschwangerschaften oder Blutungsraten. Es gibt Hinweise darauf, dass eine Endometriumschädigung am Tag der Eizellentnahme mit einer niedrigeren Rate an Lebendgeburten oder anhaltenden Schwangerschaften verbunden ist. ⓘ
Die Einnahme von Antioxidantien (wie N-Acetyl-Cystein, Melatonin, Vitamin A, Vitamin C, Vitamin E, Folsäure, Myo-Inositol, Zink oder Selen) wurde laut Cochrane-Review nicht mit einer signifikant höheren Lebendgeburten- oder klinischen Schwangerschaftsrate bei IVF in Verbindung gebracht. Die Überprüfung ergab, dass orale Antioxidantien, die Männern bei Paaren mit männlichem Faktor oder ungeklärter Subfertilität verabreicht werden, die Lebendgeburtenrate verbessern können, aber es sind weitere Nachweise erforderlich. ⓘ
Ein Cochrane-Review aus dem Jahr 2015 kam zu dem Ergebnis, dass es keine Belege für die Auswirkung von Lebensstilberatung vor der Empfängnis auf die Wahrscheinlichkeit einer Lebendgeburt gibt. ⓘ
Komplikationen
Mehrlingsgeburten
Die wichtigste Komplikation der IVF ist das Risiko von Mehrlingsgeburten. Dies steht in direktem Zusammenhang mit der Praxis des Transfers mehrerer Embryonen beim Embryotransfer. Mehrlingsgeburten sind mit einem erhöhten Risiko von Schwangerschaftsverlusten, geburtshilflichen Komplikationen, Frühgeburten und neonataler Morbidität verbunden und können zu Langzeitschäden führen. In einigen Ländern (z. B. Großbritannien, Belgien) wurden strenge Grenzwerte für die Anzahl der zu transferierenden Embryonen festgelegt, um das Risiko von Mehrlingen hoher Ordnung (Drillinge oder mehr) zu verringern, doch werden sie nicht allgemein befolgt oder akzeptiert. Eine spontane Teilung der Embryonen im Mutterleib nach dem Transfer kann vorkommen, ist aber selten und würde zu eineiigen Zwillingen führen. Eine randomisierte Doppelblindstudie verfolgte IVF-Schwangerschaften, aus denen 73 Kinder (33 Jungen und 40 Mädchen) hervorgingen, und berichtete, dass 8,7 % der Einzelkinder und 54,2 % der Zwillinge ein Geburtsgewicht von weniger als 2.500 Gramm hatten. Es gibt Hinweise darauf, dass ein doppelter Embryotransfer in einem Zyklus eine höhere Lebendgeburtenrate erzielt als ein einfacher Embryotransfer; zwei einfache Embryotransfers in zwei Zyklen haben jedoch die gleiche Lebendgeburtenrate und würden Mehrlingsschwangerschaften vermeiden. ⓘ
Verzerrungen des Geschlechterverhältnisses
Bestimmte Arten der IVF, insbesondere die ICSI (erstmals 1991 angewandt) und der Blastozystentransfer (erstmals 1984 angewandt), führen nachweislich zu Verzerrungen des Geschlechterverhältnisses bei der Geburt. Die ICSI führt zu etwas mehr weiblichen Geburten (51,3 % weiblich), während der Blastozystentransfer dazu führt, dass deutlich mehr Jungen (56,1 % männlich) geboren werden. Die Standard-IVF, die am zweiten oder dritten Tag durchgeführt wird, führt zu einem normalen Geschlechterverhältnis. ⓘ
Es wird vermutet, dass epigenetische Veränderungen, die durch die verlängerte Kultur verursacht werden und zum Absterben von mehr weiblichen Embryonen führen, der Grund dafür sind, dass der Blastozystentransfer zu einem höheren männlichen Geschlechterverhältnis führt; die Zugabe von Retinsäure zur Kultur kann dieses Verhältnis jedoch wieder normalisieren. ⓘ
Verbreitung von Infektionskrankheiten
Durch das Waschen des Spermas kann das Risiko, dass eine chronische Krankheit des Samenspenders die Frau oder die Nachkommen infiziert, auf ein vernachlässigbares Maß reduziert werden. ⓘ
Bei Männern mit Hepatitis B rät der Praxisausschuss der Amerikanischen Gesellschaft für Reproduktionsmedizin, dass eine Spermawäsche bei der IVF nicht notwendig ist, um eine Übertragung zu verhindern, es sei denn, die Partnerin ist nicht wirksam geimpft worden. Bei Frauen mit Hepatitis B unterscheidet sich das Risiko einer vertikalen Übertragung während einer IVF nicht von dem einer spontanen Empfängnis. Es gibt jedoch nicht genügend Beweise, um sagen zu können, dass ICSI-Verfahren bei Frauen mit Hepatitis B im Hinblick auf die vertikale Übertragung auf die Nachkommenschaft sicher sind. ⓘ
Im Hinblick auf die mögliche Verbreitung von HIV/AIDS hat die japanische Regierung die Anwendung von IVF-Verfahren bei Paaren, bei denen beide Partner mit HIV infiziert sind, verboten. Obwohl die Ethikkommissionen des Ogikubo-Krankenhauses in Tokio zuvor die IVF-Behandlung von HIV-infizierten Paaren erlaubt hatten, beschloss das japanische Ministerium für Gesundheit, Arbeit und Soziales, diese Praxis zu unterbinden. Hideji Hanabusa, der Vizepräsident des Ogikubo-Krankenhauses, erklärt, dass es ihm zusammen mit seinen Kollegen gelungen sei, eine Methode zu entwickeln, mit der Wissenschaftler HIV aus Spermien entfernen können. ⓘ
Weitere Risiken für die Eizellspenderin/Rückholerin
Ein Risiko der ovariellen Stimulation ist die Entwicklung eines ovariellen Überstimulationssyndroms, insbesondere wenn hCG zur Auslösung der endgültigen Eizellreifung verwendet wird. Dies führt zu geschwollenen, schmerzhaften Eierstöcken. Es tritt bei 30 % der Patientinnen auf. Leichte Fälle können mit freiverkäuflichen Medikamenten behandelt werden, und die Fälle können sich auflösen, ohne dass eine Schwangerschaft eintritt. In mittelschweren Fällen schwellen die Eierstöcke an und es kommt zu Flüssigkeitsansammlungen in den Bauchhöhlen. In schweren Fällen leiden die Patientinnen unter plötzlichen starken Bauchschmerzen, Übelkeit und Erbrechen und müssen ins Krankenhaus eingeliefert werden. ⓘ
Bei der Eizellentnahme besteht ein geringes Risiko von Blutungen, Infektionen und Schäden an umliegenden Strukturen wie Darm und Blase (transvaginale Ultraschallaspiration) sowie von Atembeschwerden, Brustinfektionen, allergischen Reaktionen auf Medikamente oder Nervenschäden (Laparoskopie). ⓘ
Zu einer Eileiterschwangerschaft kann es auch kommen, wenn sich eine befruchtete Eizelle außerhalb der Gebärmutter, meist in den Eileitern, entwickelt und die sofortige Zerstörung des Fötus erforderlich macht. ⓘ
Die IVF scheint weder mit einem erhöhten Risiko für Gebärmutterhalskrebs noch für Eierstock- oder Gebärmutterschleimhautkrebs verbunden zu sein, wenn man den Störfaktor der Unfruchtbarkeit selbst neutralisiert. Auch scheint sie kein erhöhtes Risiko für Brustkrebs mit sich zu bringen. ⓘ
Unabhängig vom Ergebnis der Schwangerschaft ist die IVF-Behandlung für die Patientinnen in der Regel mit Stress verbunden. Neurotizismus und die Anwendung eskapistischer Bewältigungsstrategien werden mit einem höheren Grad an Stress in Verbindung gebracht, während das Vorhandensein von sozialer Unterstützung eine entlastende Wirkung hat. Ein negativer Schwangerschaftstest nach einer IVF ist mit einem erhöhten Risiko für Depressionen bei Frauen verbunden, jedoch nicht mit einem erhöhten Risiko für die Entwicklung von Angststörungen. Die Ergebnisse von Schwangerschaftstests scheinen kein Risikofaktor für Depressionen oder Angstzustände bei Männern zu sein. ⓘ
Studien zeigen, dass während des ersten Trimesters der IVF ein erhöhtes Risiko für Venenthrombosen oder Lungenembolien besteht. Bei der Betrachtung von Langzeitstudien, in denen Frauen mit und ohne IVF verglichen wurden, scheint es keinen Zusammenhang mit einem erhöhten Risiko für kardiale Ereignisse zu geben. Es gibt weitere laufende Studien, um dies zu bestätigen. ⓘ
Spontane Schwangerschaften sind sowohl nach erfolgreichen als auch nach erfolglosen IVF-Behandlungen aufgetreten. Innerhalb von 2 Jahren nach der Geburt eines durch IVF gezeugten Kindes hatten subfertilere Paare eine Empfängnisrate von 18 %. ⓘ
Geburtsfehler
Eine Untersuchung aus dem Jahr 2013 kam zu dem Ergebnis, dass durch IVF (mit oder ohne ICSI) gezeugte Kinder ein relatives Risiko für Geburtsfehler von 1,32 (95 % Konfidenzintervall 1,24-1,42) im Vergleich zu natürlich gezeugten Kindern haben. Im Jahr 2008 ergab eine Analyse der Daten der National Birth Defects Study in den USA, dass bestimmte Geburtsfehler bei durch IVF gezeugten Kindern signifikant häufiger auftraten, insbesondere Herzseptumdefekte, Lippenspalten mit oder ohne Gaumenspalte, Ösophagusatresien und Anorektalatresien; der Mechanismus der Kausalität ist unklar. In einer bevölkerungsweiten Kohortenstudie mit 308.974 Geburten (davon 6.163 mit Hilfe der assistierten Reproduktionstechnologie, wobei die Kinder von der Geburt bis zum fünften Lebensjahr begleitet wurden) fanden die Forscher jedoch heraus: "Das erhöhte Risiko von Geburtsfehlern im Zusammenhang mit IVF war nach Anpassung für elterliche Faktoren nicht mehr signifikant". Zu den elterlichen Faktoren gehörten bekannte unabhängige Risiken für Geburtsfehler wie das Alter der Mutter, ihr Raucherstatus usw. Die multivariate Korrektur konnte die Signifikanz der Assoziation von Geburtsfehlern und ICSI nicht aufheben (korrigiertes Odds Ratio 1,57), obwohl die Autoren spekulieren, dass zugrunde liegende männliche Unfruchtbarkeitsfaktoren (die mit der Verwendung von ICSI verbunden wären) zu dieser Beobachtung beitragen könnten, und sie waren nicht in der Lage, diese Störfaktoren zu korrigieren. Die Autoren stellten auch fest, dass eine Unfruchtbarkeitsanamnese das Risiko selbst bei fehlender Behandlung erhöhte (Odds Ratio 1,29), was mit einer dänischen nationalen Registerstudie übereinstimmt und "Patientenfaktoren in dieses erhöhte Risiko einbezieht". Die Autoren der dänischen nationalen Registerstudie spekulieren: "Unsere Ergebnisse deuten darauf hin, dass die gemeldete erhöhte Prävalenz angeborener Fehlbildungen bei Einlingsschwangerschaften, die nach assistierter Reproduktionstechnologie geboren wurden, zum Teil auf die zugrunde liegende Unfruchtbarkeit oder ihre Determinanten zurückzuführen ist." ⓘ
| Zustand | Relativ Risiko |
95% Konfidenz Intervall |
|---|---|---|
| Beckwith-Wiedemann-Syndrom | 3-4 | |
| angeborene Anomalien | 1.67 | 1.33–2.09 |
| vorgeburtliche Blutung | 2.49 | 2.30–2.69 |
| Bluthochdruck in der Schwangerschaft | 1.49 | 1.39–1.59 |
| vorzeitiger Blasensprung | 1.16 | 1.07–1.26 |
| Kaiserschnitt | 1.56 | 1.51–1.60 |
| Gestationsdiabetes | 1.48 | 1.33–1.66 |
| Einleitung der Wehen | 1.18 | 1.10–1.28 |
| geringes Gestationsalter | 1.39 | 1.27–1.53 |
| Frühgeburt | 1.54 | 1.47–1.62 |
| geringes Geburtsgewicht | 1.65 | 1.56–1.75 |
| Perinatale Sterblichkeit | 1.87 | 1.48–2.37 |
Andere Risiken für die Nachkommen
Wenn die zugrunde liegende Unfruchtbarkeit mit Anomalien in der Spermatogenese zusammenhängt, ist es plausibel, aber noch zu früh, um zu untersuchen, dass männliche Nachkommen ein höheres Risiko für Spermienanomalien haben. ⓘ
Die IVF scheint keine Risiken in Bezug auf die kognitive Entwicklung, die schulischen Leistungen, die sozialen Fähigkeiten und das Verhalten mit sich zu bringen. Es ist auch bekannt, dass IVF-Kinder eine ebenso sichere Bindung zu ihren Eltern haben wie Kinder, die auf natürlichem Wege gezeugt wurden, und dass IVF-Jugendliche genauso gut zurechtkommen wie Kinder, die auf natürlichem Wege gezeugt wurden. ⓘ
Begrenzte Langzeit-Follow-up-Daten deuten darauf hin, dass IVF mit einer erhöhten Inzidenz von Bluthochdruck, gestörtem Nüchternblutzucker, einer Zunahme der Gesamtkörperfettzusammensetzung, einem fortgeschrittenen Knochenalter, subklinischen Schilddrüsenstörungen, klinischen Depressionen im frühen Erwachsenenalter und Alkoholexzessen bei den Nachkommen verbunden sein könnte. Es ist jedoch nicht bekannt, ob diese potenziellen Zusammenhänge durch das IVF-Verfahren an sich, durch nachteilige geburtshilfliche Ergebnisse im Zusammenhang mit der IVF, durch die genetische Herkunft der Kinder oder durch noch unbekannte IVF-assoziierte Ursachen verursacht werden. Die zunehmende Manipulation der Embryonen während der IVF führt zu abweichenden fetalen Wachstumskurven, aber das Geburtsgewicht scheint kein zuverlässiger Marker für fetalen Stress zu sein. ⓘ
IVF, einschließlich ICSI, ist mit einem erhöhten Risiko für Imprinting-Störungen (einschließlich Prader-Willi-Syndrom und Angelman-Syndrom) verbunden, mit einem Odds Ratio von 3,7 (95% Konfidenzintervall 1,4 bis 9,7). ⓘ
Es wird angenommen, dass eine IVF-assoziierte Inzidenz von zerebralen Lähmungen und neurologischen Entwicklungsverzögerungen mit den Störfaktoren Frühgeburtlichkeit und niedriges Geburtsgewicht zusammenhängt. Ebenso wird angenommen, dass eine IVF-assoziierte Inzidenz von Autismus und Aufmerksamkeitsdefizitsyndrom mit Störfaktoren wie mütterlichen und geburtshilflichen Faktoren zusammenhängt. ⓘ
Insgesamt verursacht die IVF kein erhöhtes Risiko für Krebs bei Kindern. Studien haben eine Verringerung des Risikos für bestimmte Krebsarten und eine Erhöhung des Risikos für bestimmte andere Krebsarten wie Retinoblastom, Hepatoblastom und Rhabdomyosarkom gezeigt. ⓘ
Verfahren

Theoretisch könnte eine IVF durchgeführt werden, indem der Inhalt der Eileiter oder der Gebärmutter nach dem natürlichen Eisprung entnommen, mit Spermien vermischt und die befruchteten Eizellen wieder in die Gebärmutter eingesetzt werden. Ohne zusätzliche Techniken wären die Chancen auf eine Schwangerschaft jedoch äußerst gering. Zu den zusätzlichen Techniken, die bei der IVF routinemäßig eingesetzt werden, gehören die Hyperstimulation der Eierstöcke zur Erzeugung mehrerer Eizellen, die ultraschallgesteuerte transvaginale Entnahme von Eizellen direkt aus den Eierstöcken, die Co-Inkubation von Ei- und Samenzellen sowie die Kultur und Selektion der entstandenen Embryonen vor dem Embryotransfer in die Gebärmutter. ⓘ
Überstimulation der Eierstöcke
Unter ovarieller Hyperstimulation versteht man die Stimulation zur Entwicklung mehrerer Follikel in den Eierstöcken. Sie sollte mit einer Vorhersage des Ansprechens z. B. anhand des Alters, der Anzahl der Antralfollikel und des Spiegels des Anti-Müller-Hormons beginnen. Die daraus resultierende Vorhersage z. B. einer schlechten oder übermäßigen Reaktion auf die ovarielle Hyperstimulation bestimmt das Protokoll und die Dosierung der ovariellen Hyperstimulation. ⓘ
Zur ovariellen Hyperstimulation gehört auch die Unterdrückung des spontanen Eisprungs, wofür es zwei Hauptmethoden gibt: Verwendung eines (meist längeren) GnRH-Agonisten-Protokolls oder eines (meist kürzeren) GnRH-Antagonisten-Protokolls. Bei einem standardmäßigen langen GnRH-Agonisten-Protokoll können der Tag des Beginns der Hyperstimulationsbehandlung und der voraussichtliche Tag der späteren Eizellentnahme nach persönlicher Wahl gewählt werden, während bei einem GnRH-Antagonisten-Protokoll eine Anpassung an das spontane Einsetzen der vorherigen Menstruation erfolgen muss. Andererseits besteht beim GnRH-Antagonisten-Protokoll ein geringeres Risiko für das ovarielle Überstimulationssyndrom (OHSS), eine lebensbedrohliche Komplikation. ⓘ
Für die ovarielle Hyperstimulation an sich werden im Allgemeinen injizierbare Gonadotropine (in der Regel FSH-Analoga) unter strenger Überwachung eingesetzt. Dabei werden häufig der Östradiolspiegel und mittels gynäkologischer Ultraschalluntersuchung das Follikelwachstum überprüft. In der Regel sind Injektionen über einen Zeitraum von etwa 10 Tagen erforderlich. ⓘ
Natürliche IVF
Es gibt mehrere Methoden, die als IVF mit natürlichem Zyklus bezeichnet werden:
- IVF, bei der keine Medikamente zur Überstimulation der Eierstöcke eingesetzt werden, während Medikamente zur Unterdrückung des Eisprungs weiterhin verwendet werden können.
- IVF mit ovarieller Hyperstimulation, einschließlich Gonadotropinen, aber mit einem GnRH-Antagonisten-Protokoll, so dass der Zyklus durch natürliche Mechanismen eingeleitet wird.
- Gefrorener Embryotransfer; IVF mit Hyperstimulation der Eierstöcke, gefolgt von einer Kryokonservierung der Embryonen, gefolgt von einem Embryotransfer in einem späteren, natürlichen Zyklus. ⓘ
Die IVF-Methode, bei der keine Medikamente zur Überstimulation der Eierstöcke eingesetzt werden, war die Methode zur Empfängnis von Louise Brown. Diese Methode kann erfolgreich eingesetzt werden, wenn Frauen die Einnahme von Medikamenten zur Stimulation der Eierstöcke und die damit verbundenen Nebenwirkungen vermeiden wollen. Die HFEA schätzt die Lebendgeburtenrate auf etwa 1,3 % pro IVF-Zyklus ohne Medikamente zur Überstimulation der Eierstöcke bei Frauen im Alter zwischen 40 und 42 Jahren. ⓘ
Die milde IVF ist eine Methode, bei der während eines natürlichen Menstruationszyklus für kurze Zeit eine geringe Dosis ovarialstimulierender Medikamente eingesetzt wird, um 2-7 Eizellen zu produzieren und gesunde Embryonen zu erzeugen. Diese Methode scheint ein Fortschritt auf dem Gebiet der Verringerung von Komplikationen und Nebenwirkungen für Frauen zu sein und zielt auf die Qualität und nicht auf die Quantität von Eizellen und Embryonen ab. Eine Studie, in der eine milde Behandlung (milde Stimulation der Eierstöcke mit GnRH-Antagonist-Ko-Behandlung in Kombination mit einem einzigen Embryotransfer) mit einer Standardbehandlung (Stimulation mit einem GnRH-Agonisten im Langzeitprotokoll und Transfer von zwei Embryonen) verglichen wurde, kam zu dem Ergebnis, dass der Anteil der kumulativen Schwangerschaften, die nach einem Jahr zu einer Lebendgeburt führten, bei der milden Behandlung 43,4 % und bei der Standardbehandlung 44,7 % betrug. Die milde IVF kann kostengünstiger sein als die konventionelle IVF und birgt ein deutlich geringeres Risiko für Mehrlingsschwangerschaften und OHSS. ⓘ
Induktion der Endreifung
Wenn die Ovarialfollikel einen bestimmten Entwicklungsgrad erreicht haben, wird die endgültige Reifung der Eizellen eingeleitet, im Allgemeinen durch eine Injektion von humanem Choriongonadotropin (hCG). Das hCG wirkt als Analogon des luteinisierenden Hormons, und der Eisprung würde zwischen 38 und 40 Stunden nach einer einzigen HCG-Injektion stattfinden. Die Eizellentnahme erfolgt jedoch in der Regel zwischen 34 und 36 Stunden nach der hCG-Injektion, d. h. kurz bevor die Follikel platzen würden. Dies ermöglicht es, die Eizellentnahme zu einem Zeitpunkt zu planen, an dem die Eizellen voll ausgereift sind. Die HCG-Injektion birgt das Risiko eines ovariellen Hyperstimulationssyndroms. Durch die Verwendung eines GnRH-Agonisten anstelle von hCG wird das Risiko eines ovariellen Überstimulationssyndroms größtenteils ausgeschaltet, allerdings mit einer geringeren Entbindungsrate, wenn die Embryonen frisch übertragen werden. Aus diesem Grund frieren viele Zentren alle Eizellen oder Embryonen nach einem Agonisten-Trigger ein. ⓘ
Entnahme der Eizellen
Die Eizellen werden der Patientin mit einer transvaginalen Technik, der so genannten transvaginalen Eizellentnahme, entnommen. Dabei wird mit einer ultraschallgesteuerten Nadel die Vaginalwand durchstochen, um die Eierstöcke zu erreichen. Mit dieser Nadel können Follikel abgesaugt werden, und die Follikelflüssigkeit wird einem Embryologen zur Identifizierung der Eizellen übergeben. In der Regel werden zwischen zehn und dreißig Eizellen entnommen. Die Entnahme dauert je nach Anzahl der reifen Follikel in der Regel zwischen 20 und 40 Minuten und wird in der Regel unter bewusster Sedierung oder Vollnarkose durchgeführt. ⓘ
Vorbereitung der Eizellen und Spermien
Für ICSI-Behandlungen werden die identifizierten Eizellen im Labor von den sie umgebenden Zellen (auch Kumuluszellen genannt) befreit und für die Befruchtung vorbereitet. Vor der Befruchtung kann eine Eizellselektion durchgeführt werden, um befruchtungsfähige Eizellen auszuwählen, da sie sich in der Metaphase II befinden müssen. Es gibt Fälle, in denen Eizellen, die sich in der Metaphase I befinden, weiter kultiviert werden können, um eine nachträgliche Spermieninjektion vorzunehmen. In der Zwischenzeit wird das Sperma für die Befruchtung vorbereitet, indem inaktive Zellen und Samenflüssigkeit in einem als Spermawäsche bezeichneten Prozess entfernt werden. Wird der Samen von einem Samenspender zur Verfügung gestellt, wurde er in der Regel für die Behandlung vorbereitet, bevor er eingefroren und unter Quarantäne gestellt wurde, und er wird gebrauchsfertig aufgetaut. ⓘ
Ko-Inkubation

Die Spermien und die Eizelle werden zusammen in einem Verhältnis von etwa 75.000:1 in einem Nährmedium bebrütet, damit die eigentliche Befruchtung stattfinden kann. Eine Untersuchung aus dem Jahr 2013 kam zu dem Ergebnis, dass eine Dauer dieser Co-Inkubation von etwa 1 bis 4 Stunden zu deutlich höheren Schwangerschaftsraten führt als 16 bis 24 Stunden. In den meisten Fällen wird die Eizelle während der Co-Inkubation befruchtet und weist zwei Vorkerne auf. In bestimmten Situationen, z. B. bei geringer Spermienzahl oder -beweglichkeit, kann ein einzelnes Spermium mittels intrazytoplasmatischer Spermieninjektion (ICSI) direkt in die Eizelle injiziert werden. Die befruchtete Eizelle wird in ein spezielles Wachstumsmedium gegeben und etwa 48 Stunden lang belassen, bis die Eizelle aus sechs bis acht Zellen besteht. ⓘ
Beim intrafallopischen Gametentransfer werden der Frau Eizellen entnommen und zusammen mit den Spermien des Mannes in einen der Eileiter eingesetzt. So kann die Befruchtung im Körper der Frau stattfinden. Daher handelt es sich bei dieser Variante eigentlich um eine In-vivo-Befruchtung und nicht um eine In-vitro-Befruchtung. ⓘ
Die Embryokultur
Die Hauptdauer der Embryokultur ist das Spaltstadium (Tag zwei bis vier nach der Koinkubation) oder das Blastozystenstadium (Tag fünf oder sechs nach der Koinkubation). Die Embryokultur bis zum Blastozystenstadium führt zu einer signifikanten Erhöhung der Lebendgeburtenrate pro Embryotransfer, aber auch zu einer geringeren Anzahl von Embryonen, die für den Transfer und die Kryokonservierung von Embryonen zur Verfügung stehen, so dass die kumulativen klinischen Schwangerschaftsraten mit dem Transfer im Spaltstadium erhöht werden. Ein Transfer am zweiten statt am dritten Tag nach der Befruchtung hat keinen Einfluss auf die Lebendgeburtenrate. Bei Geburten von Embryonen, die bis zum Blastozystenstadium kultiviert wurden, ist die Wahrscheinlichkeit einer Frühgeburt (Odds Ratio 1,3) und angeborener Anomalien (Odds Ratio 1,3) signifikant höher als bei Geburten im Cleavage-Stadium. ⓘ
Auswahl der Embryonen
Die Labors haben Bewertungsmethoden entwickelt, um die Qualität von Eizellen und Embryonen zu beurteilen. Um die Schwangerschaftsraten zu optimieren, gibt es deutliche Hinweise darauf, dass ein morphologisches Bewertungssystem die beste Strategie für die Auswahl von Embryonen ist. Seit 2009, als das erste Zeitraffermikroskopiesystem für die IVF für den klinischen Einsatz zugelassen wurde, hat sich gezeigt, dass morphokinetische Scoring-Systeme die Schwangerschaftsraten weiter verbessern können. Vergleicht man jedoch alle verschiedenen Arten von Zeitraffer-Embryo-Bildgebungsgeräten mit oder ohne morphokinetisches Scoring-System mit der konventionellen Embryonenbeurteilung für die IVF, so gibt es keine ausreichenden Belege für einen Unterschied bei Lebendgeburten, Schwangerschaften, Totgeburten oder Fehlgeburten, um zwischen ihnen zu wählen. Derzeit wird aktiv an der Entwicklung einer genaueren Embryonenauswahlanalyse auf der Grundlage von künstlicher Intelligenz und Deep Learning gearbeitet. Der Embryo Ranking Intelligent Classification Assistant (ERICA) ist ein gutes Beispiel dafür. Diese Deep-Learning-Software ersetzt manuelle Klassifizierungen durch ein Ranking-System, das auf dem vorhergesagten genetischen Status eines einzelnen Embryos basiert und nicht invasiv ist. Studien in diesem Bereich sind noch nicht abgeschlossen, aber die derzeitigen Machbarkeitsstudien unterstützen das Potenzial dieser Software. ⓘ
Embryotransfer
Die Anzahl der zu transferierenden Embryonen hängt von der verfügbaren Anzahl, dem Alter der Patientin und anderen gesundheitlichen und diagnostischen Faktoren ab. In Ländern wie Kanada, dem Vereinigten Königreich, Australien und Neuseeland werden höchstens zwei Embryonen übertragen, es sei denn, es liegen außergewöhnliche Umstände vor. Im Vereinigten Königreich und gemäß den Vorschriften der HFEA können Frauen über 40 Jahren bis zu drei Embryonen transferiert werden, während es in den USA keine gesetzliche Begrenzung für die Anzahl der zu transferierenden Embryonen gibt, obwohl medizinische Verbände Praxisrichtlinien aufgestellt haben. Die meisten Kliniken und die Aufsichtsbehörden der Länder sind bestrebt, das Risiko einer Mehrlingsschwangerschaft zu minimieren, da es nicht ungewöhnlich ist, dass sich mehrere Embryonen einnisten, wenn mehrere Embryonen übertragen werden. Die Embryonen werden über einen dünnen Kunststoffkatheter, der durch die Vagina und den Gebärmutterhals eingeführt wird, in die Gebärmutter der Patientin übertragen. Es können mehrere Embryonen in die Gebärmutter eingebracht werden, um die Chancen auf Einnistung und Schwangerschaft zu erhöhen. ⓘ
Lutealunterstützung
Unter Lutealunterstützung versteht man die Verabreichung von Medikamenten, in der Regel Progesteron, Gestagene, hCG oder GnRH-Agonisten, oft in Verbindung mit Östradiol, um die Erfolgsrate der Einnistung und der frühen Embryogenese zu erhöhen und damit die Funktion des Gelbkörpers zu ergänzen und/oder zu unterstützen. Ein Cochrane-Review ergab, dass die Verabreichung von hCG oder Progesteron während der Lutealphase mit höheren Raten von Lebendgeburten oder anhaltenden Schwangerschaften in Verbindung gebracht werden kann, dass die Beweise jedoch nicht schlüssig sind. Die gleichzeitige Behandlung mit GnRH-Agonisten scheint die Ergebnisse zu verbessern, mit einer Lebendgeburtenrate RD von +16 % (95 % Konfidenzintervall +10 bis +22 %). Für Wachstumshormone oder Aspirin als Begleitmedikation bei der IVF gibt es dagegen keine Belege für einen allgemeinen Nutzen. ⓘ
Erweiterungen
Es gibt verschiedene Erweiterungen oder zusätzliche Techniken, die bei der IVF angewandt werden können, die in der Regel für das IVF-Verfahren selbst nicht notwendig sind, aber ohne die gleichzeitige Durchführung von IVF-Methoden praktisch unmöglich oder technisch schwierig wären. ⓘ
Genetisches Präimplantationsscreening bzw. Präimplantationsdiagnostik
Das genetische Präimplantationsscreening (PGS) oder die genetische Präimplantationsdiagnostik (PID) soll bei der IVF dazu dienen, einen Embryo auszuwählen, der die größten Chancen auf eine erfolgreiche Schwangerschaft zu haben scheint. Eine systematische Überprüfung und Meta-Analyse bestehender randomisierter kontrollierter Studien kam jedoch zu dem Ergebnis, dass es keine Belege für eine positive Wirkung von PGS mit Spaltpilzbiopsie gibt, gemessen an der Lebendgeburtenrate. Im Gegenteil, bei Frauen im fortgeschrittenen mütterlichen Alter senkt die PGS mit Spaltbiopsie die Lebendgeburtenrate signifikant. Technische Nachteile wie die Invasivität der Biopsie und nicht repräsentative Proben aufgrund von Mosaizismus sind die Hauptgründe für die Unwirksamkeit von PGS. ⓘ
Als Erweiterung der IVF kann die PGS/PGD jedoch für folgende Patienten in Frage kommen:
- Paare mit einer Familiengeschichte von Erbkrankheiten
- Paare, die eine pränatale Geschlechtsbestimmung wünschen. Dies kann zur Diagnose monogener Störungen mit Geschlechtsbindung verwendet werden. Sie kann möglicherweise zur Geschlechtsselektion eingesetzt werden, wobei ein Fötus abgetrieben wird, wenn er ein unerwünschtes Geschlecht hat.
- Paare, die bereits ein Kind mit einer unheilbaren Krankheit haben und kompatible Zellen von einem zweiten gesunden Kind benötigen, um das erste Kind zu heilen, erhalten ein "Rettergeschwisterchen", das vom HLA-Typ her mit dem kranken Kind übereinstimmt. ⓘ
Bei der PGS wird nach einer Reihe von Chromosomenanomalien gesucht, während bei der PID der spezifische molekulare Defekt der Erbkrankheit diagnostiziert wird. Sowohl bei der PGS als auch bei der PID werden während des IVF-Verfahrens einzelne Zellen aus einem Präembryo oder vorzugsweise Trophektodermzellen, die aus einer Blastozyste biopsiert wurden, analysiert. Vor dem Rücktransfer eines Präembryos in die Gebärmutter der Frau werden ein oder zwei Zellen aus dem Präembryo (8-Zell-Stadium) oder vorzugsweise aus einer Blastozyste entnommen. Diese Zellen werden dann auf ihre Normalität untersucht. In der Regel werden innerhalb von ein bis zwei Tagen nach Abschluss der Untersuchung nur die normalen Präembryonen in die Gebärmutter der Frau zurückverpflanzt. Alternativ kann eine Blastozyste durch Vitrifikation kryokonserviert und zu einem späteren Zeitpunkt in die Gebärmutter übertragen werden. Darüber hinaus kann PGS das Risiko von Mehrlingsschwangerschaften deutlich verringern, da weniger Embryonen, im Idealfall nur einer, für die Einnistung benötigt werden. ⓘ
Kryokonservierung
Die Kryokonservierung kann als Kryokonservierung von Eizellen vor der Befruchtung oder als Kryokonservierung von Embryonen nach der Befruchtung durchgeführt werden. ⓘ
Nach Schätzungen der Rand Consulting Group gab es 2006 in den Vereinigten Staaten 400.000 eingefrorene Embryonen. Der Vorteil besteht darin, dass Patienten, die nicht schwanger werden, mit solchen Embryonen schwanger werden können, ohne einen vollständigen IVF-Zyklus durchlaufen zu müssen. Oder sie können, wenn eine Schwangerschaft eingetreten ist, später für eine weitere Schwangerschaft zurückkehren. Überzählige Eizellen oder Embryonen aus Fruchtbarkeitsbehandlungen können für eine Eizell- oder Embryonenspende an eine andere Frau oder ein anderes Paar verwendet werden, und Embryonen können unter Verwendung von Spendereiern und -sperma speziell für den Transfer und die Spende erzeugt, eingefroren und gelagert werden. Die Kryokonservierung von Eizellen kann auch bei Frauen eingesetzt werden, die aufgrund einer Chemotherapie ihre Eierstockreserve verlieren könnten. ⓘ
Im Jahr 2017 haben viele Zentren die Kryokonservierung von Embryonen als primäre IVF-Therapie eingeführt und führen nur noch wenige oder gar keine Transfers von frischen Embryonen mehr durch. Die beiden Hauptgründe dafür sind die bessere Empfänglichkeit der Gebärmutterschleimhaut, wenn die Embryonen in Zyklen ohne Stimulation der Eierstöcke übertragen werden, und die Möglichkeit, die Embryonen zu lagern, bis die Ergebnisse der genetischen Präimplantationstests vorliegen. ⓘ
Die Ergebnisse der kryokonservierten Embryonen sind durchweg positiv, es gibt keine Zunahme von Geburtsfehlern oder Entwicklungsstörungen. ⓘ
Andere Expansionen
- Bei der Intrazytoplasmatischen Spermieninjektion (ICSI) wird ein einzelnes Spermium direkt in eine Eizelle injiziert. Sie wird hauptsächlich als Erweiterung der IVF zur Überwindung männlicher Unfruchtbarkeitsprobleme eingesetzt, kann aber auch verwendet werden, wenn die Eizellen nicht ohne weiteres von den Spermien durchdrungen werden können, und gelegentlich in Verbindung mit einer Samenspende. Sie kann bei Teratozoospermie eingesetzt werden, da eine abnorme Spermienmorphologie nach der Befruchtung der Eizelle keinen Einfluss auf die Blastozystenentwicklung oder die Blastozystenmorphologie zu haben scheint.
- Zusätzliche Methoden zur Erstellung von Embryonenprofilen. So entstehen beispielsweise Methoden zur umfassenden Analyse ganzer Genome, Transkriptome, Proteome und Metabolome, die zur Bewertung von Embryonen verwendet werden können, indem die Muster mit denen verglichen werden, die zuvor bei Embryonen in erfolgreichen und erfolglosen Schwangerschaften gefunden wurden.
- Assisted Zona Hatching (AZH) kann kurz vor dem Transfer des Embryos in die Gebärmutter durchgeführt werden. Dabei wird eine kleine Öffnung in die äußere Schicht der Eizelle eingebracht, um das Ausschlüpfen des Embryos zu erleichtern und den Einnistungsprozess des wachsenden Embryos zu unterstützen.
- Bei der Eizellspende und der Embryonenspende wird der nach der Befruchtung entstandene Embryo einer anderen Frau als derjenigen, die die Eizellen gespendet hat, eingesetzt. Diese Verfahren kommen für Frauen in Frage, die aufgrund von Operationen, Chemotherapie oder genetischen Ursachen keine Eizellen mehr haben, oder für Frauen mit schlechter Eizellenqualität, früheren erfolglosen IVF-Zyklen oder fortgeschrittenem mütterlichen Alter. Bei der Eizellspende werden Eizellen aus den Eierstöcken der Spenderin entnommen, im Labor mit den Spermien des Partners der Empfängerin befruchtet und die daraus entstehenden gesunden Embryonen in die Gebärmutter der Empfängerin eingesetzt.
- Bei der Eizellenselektion können die Eizellen mit den besten Chancen auf eine Lebendgeburt ausgewählt werden. Sie kann auch als Mittel zum genetischen Präimplantationsscreening eingesetzt werden.
- Das Embryo-Splitting kann zur Zwillingsbildung eingesetzt werden, um die Zahl der verfügbaren Embryonen zu erhöhen.
- Beim Zytoplasmatransfer wird das Zytoplasma einer Spendereizelle in eine Eizelle mit beschädigten Mitochondrien injiziert. Die so entstandene Eizelle wird dann mit Spermien befruchtet und in eine Gebärmutter eingeführt, in der Regel in die der Frau, die die Empfänger-Eizelle und die Kern-DNA zur Verfügung gestellt hat. Der Zytoplasma-Transfer wurde entwickelt, um Frauen zu helfen, die aufgrund fehlender oder beschädigter Mitochondrien, die im Zytoplasma einer Eizelle enthalten sind, unfruchtbar sind. ⓘ
Überbleibsel von Embryonen oder Eizellen
Es kann vorkommen, dass Embryonen oder Eizellen aus IVF-Verfahren übrig bleiben, wenn die Frau, für die sie ursprünglich erzeugt wurden, eine oder mehrere Schwangerschaften erfolgreich ausgetragen hat und sie nicht mehr verwenden möchte. Mit dem Einverständnis der Frau oder des Paares können diese gespendet werden, um anderen Frauen oder Paaren bei der Fortpflanzung durch Dritte zu helfen. ⓘ
Bei der Embryonenspende werden diese überzähligen Embryonen anderen Paaren oder Frauen für den Transfer zur Verfügung gestellt, um eine erfolgreiche Schwangerschaft herbeizuführen. Die Empfänger von Embryonen haben in der Regel genetische Probleme oder eigene Embryonen oder Eizellen von schlechter Qualität. Das daraus entstehende Kind wird als das Kind der Frau betrachtet, die es austrägt und zur Welt bringt, und nicht als das Kind des Spenders, wie es bei Ei- oder Samenspenden der Fall ist. ⓘ
In der Regel spenden die genetischen Eltern die Eizellen oder Embryonen an eine Fruchtbarkeitsklinik, wo sie durch Kryokonservierung von Eizellen oder Embryonen aufbewahrt werden, bis ein Träger für sie gefunden wird. In der Regel wird der Prozess des Abgleichs der Spende mit den zukünftigen Eltern von der Agentur selbst durchgeführt, woraufhin die Klinik das Eigentum an den Embryonen auf die zukünftigen Eltern überträgt. ⓘ
In den Vereinigten Staaten unterziehen sich Frauen, die als Empfängerinnen von Embryonen in Frage kommen, einem von der Food and Drug Administration (FDA) vorgeschriebenen Screening auf Infektionskrankheiten sowie Reproduktionstests, um den besten Ort für die Einpflanzung und den Zeitpunkt des Zyklus zu bestimmen, bevor der eigentliche Embryotransfer stattfindet. Der Umfang der Untersuchungen, die der Embryo bereits durchlaufen hat, hängt weitgehend von der IVF-Klinik und dem Verfahren der genetischen Eltern ab. Die Empfängerin des Embryos kann sich dafür entscheiden, weitere Tests von ihrem eigenen Embryologen durchführen zu lassen. ⓘ
Alternativen zur Spende nicht verwendeter Embryonen sind die Zerstörung (oder der Transfer zu einem Zeitpunkt, an dem eine Schwangerschaft sehr unwahrscheinlich ist), die Aufbewahrung im Gefrierschrank auf unbestimmte Zeit oder die Spende zur Verwendung in der Forschung (was dazu führt, dass sie nicht lebensfähig sind). Die individuellen moralischen Ansichten über die Beseitigung übrig gebliebener Embryonen können von den persönlichen Ansichten über den Beginn der menschlichen Persönlichkeit und die Definition und/oder den Wert potenzieller künftiger Personen sowie von der Bedeutung abhängen, die man grundlegenden Forschungsfragen beimisst. Manche Menschen sind der Meinung, dass die Spende übrig gebliebener Embryonen zu Forschungszwecken eine gute Alternative zum Verwerfen der Embryonen ist, wenn die Patienten angemessen, ehrlich und klar über das Forschungsprojekt, die Verfahren und die wissenschaftlichen Werte informiert werden. ⓘ
Geschichte
Die erste erfolgreiche Geburt eines Kindes nach einer IVF-Behandlung, Louise Brown, fand im Jahr 1978 statt. Louise Brown wurde als Ergebnis eines natürlichen IVF-Zyklus geboren, bei dem keine Stimulation vorgenommen wurde. Der Eingriff fand im Dr. Kershaw's Cottage Hospital (heute Dr. Kershaw's Hospice) in Royton, Oldham, England, statt. Robert G. Edwards wurde 2010 mit dem Nobelpreis für Physiologie oder Medizin ausgezeichnet. Er war der Physiologe, der die Behandlung zusammen mit Patrick Steptoe und der Embryologin Jean Purdy entwickelt hatte; Steptoe und Purdy kamen für die Auszeichnung nicht in Frage, da der Nobelpreis nicht posthum verliehen wird. ⓘ
Die zweite erfolgreiche Geburt eines Retortenbabys fand in Indien statt, nur 67 Tage nach der Geburt von Louise Brown. Das Mädchen mit dem Namen Durga wurde mit einer von Dr. Subhash Mukhopadhyay, einem Arzt und Forscher aus Kolkata, Indien, unabhängig entwickelten Methode in vitro gezeugt. ⓘ
Mit Hilfe von Eizellspenden und IVF können auch Menschen schwanger werden, die das fortpflanzungsfähige Alter überschritten haben, unfruchtbare männliche Partner haben, an idiopathischer weiblicher Unfruchtbarkeit leiden oder die Menopause erreicht haben. Adriana Iliescu hielt den Rekord als älteste Frau, die mit IVF und einer Spender-Eizelle ein Kind zur Welt brachte, als sie 2004 im Alter von 66 Jahren ein Kind zur Welt brachte; dieser Rekord wurde 2006 überboten. Nach einer IVF-Behandlung sind einige Paare in der Lage, auch ohne Fruchtbarkeitsbehandlungen schwanger zu werden. Im Jahr 2018 wurden weltweit schätzungsweise acht Millionen Kinder durch IVF und andere assistierte Reproduktionstechniken geboren. ⓘ
Ethik .
Verwechslungen
In einigen Fällen kam es zu Verwechslungen im Labor (falsch identifizierte Keimzellen, Übertragung falscher Embryonen), die zu rechtlichen Schritten gegen den IVF-Anbieter und komplexen Vaterschaftsklagen führten. Ein Beispiel dafür ist der Fall einer Frau in Kalifornien, die den Embryo eines anderen Paares erhielt und erst nach der Geburt ihres Sohnes von diesem Fehler erfuhr. Dies hat dazu geführt, dass viele Behörden und einzelne Kliniken Verfahren eingeführt haben, um das Risiko solcher Verwechslungen zu minimieren. Die HFEA beispielsweise verlangt von den Kliniken, dass sie ein System der doppelten Zeugenschaft verwenden, bei dem die Identität der Proben von zwei Personen an jedem Punkt des Transfers überprüft wird. Alternativ dazu werden technologische Lösungen immer beliebter, um die Personalkosten für die manuelle Doppelkontrolle zu senken und die Risiken durch eindeutig nummerierte RFID-Etiketten weiter zu verringern, die von an einen Computer angeschlossenen Lesegeräten identifiziert werden können. Der Computer verfolgt die Proben während des gesamten Prozesses und warnt den Embryologen, wenn nicht übereinstimmende Proben identifiziert werden. Obwohl die RFID-Verfolgung in den USA immer häufiger eingesetzt wird, ist sie noch nicht weit verbreitet. ⓘ
Genetische Präimplantationsdiagnostik oder Screening
Ursprünglich wurde die PID zum Screening von Embryonen entwickelt, die Träger von Erbkrankheiten sind. Inzwischen wird die Methode jedoch auch zur Auswahl von Merkmalen eingesetzt, die nichts mit Krankheiten zu tun haben, was ethische Fragen aufwirft. Beispiele für solche Fälle sind die Auswahl von Embryonen auf der Grundlage der Histokompatibilität (HLA) für Gewebespenden an kranke Familienmitglieder, die Diagnose einer genetischen Krankheitsanfälligkeit und die Geschlechtsauswahl. ⓘ
Diese Beispiele werfen wegen der Moral der Eugenik ethische Fragen auf. Sie ist verpönt, weil sie den Vorteil hat, unerwünschte Merkmale zu eliminieren und erwünschte Merkmale zu selektieren. Durch die PID erhalten Menschen die Möglichkeit, auf unethische Weise menschliches Leben zu schaffen und sich auf die Wissenschaft und nicht auf die natürliche Auslese zu verlassen. ⓘ
Ein taubes britisches Ehepaar, Tom und Paula Lichy, hat beispielsweise beantragt, ein taubes Baby mittels IVF zu erzeugen. Einige Medizinethiker haben sich sehr kritisch zu diesem Ansatz geäußert. Jacob M. Appel schrieb, dass "das absichtliche Aussortieren von blinden oder tauben Embryonen beträchtliches zukünftiges Leid verhindern könnte, während eine Politik, die es tauben oder blinden Eltern erlaubt, absichtlich nach solchen Merkmalen zu selektieren, weitaus problematischer wäre." ⓘ
Profitstreben der Industrie
Im Jahr 2008 übertrug ein kalifornischer Arzt 12 Embryonen auf eine Frau, die Achtlinge zur Welt brachte (Suleman-Oktupletts). Dies führte zu Vorwürfen, ein Arzt sei bereit, die Gesundheit und sogar das Leben von Menschen zu gefährden, um Geld zu verdienen. Robert Winston, Professor für Fruchtbarkeitsstudien am Imperial College London, hatte die Branche als "korrupt" und "gierig" bezeichnet und erklärt, dass "eines der größten Probleme, mit denen wir im Gesundheitswesen konfrontiert sind, darin besteht, dass die IVF zu einer massiven kommerziellen Industrie geworden ist", und dass "was passiert ist, ist natürlich, dass Geld diese ganze Technologie korrumpiert", und warf den Behörden vor, Paare nicht vor Ausbeutung zu schützen: "Die Regulierungsbehörde hat durchweg schlechte Arbeit geleistet. Sie hat die Ausbeutung von Menschen nicht verhindert, sie hat Paare nicht gut informiert, sie hat die Zahl der unwissenschaftlichen Behandlungen, zu denen Menschen Zugang haben, nicht begrenzt". Die IVF-Industrie wurde als eine marktgesteuerte Konstruktion von Gesundheit, Medizin und dem menschlichen Körper beschrieben. ⓘ
In den USA gewährt die Urheberrechtsklausel den Erfindern ein zeitlich begrenztes Monopol auf ihre jeweilige Arbeit. Dies hat zur Folge, dass IVF für die Patienten unerschwinglich ist, da die Anbieter auch die Kosten für die Patente tragen müssen. So hat beispielsweise 23andMe ein Verfahren zur Berechnung der Wahrscheinlichkeit der Vererbung von Genen patentiert. ⓘ
Der Industrie wird vorgeworfen, unwissenschaftliche Behauptungen aufzustellen und die Tatsachen in Bezug auf Unfruchtbarkeit zu verzerren, insbesondere durch weit übertriebene Behauptungen darüber, wie häufig Unfruchtbarkeit in der Gesellschaft vorkommt, um so viele Paare wie möglich und so schnell wie möglich dazu zu bringen, Behandlungen zu versuchen (anstatt längere Zeit zu versuchen, auf natürlichem Wege schwanger zu werden). Dies birgt die Gefahr, dass Unfruchtbarkeit aus ihrem sozialen Kontext herausgelöst und auf eine einfache biologische Fehlfunktion reduziert wird, die nicht nur durch biomedizinische Verfahren behandelt werden kann, sondern auch behandelt werden sollte. So hat beispielsweise Dr. Sami David, ein Fruchtbarkeitsspezialist, seine Enttäuschung über den derzeitigen Zustand der Branche zum Ausdruck gebracht und erklärt, dass viele Verfahren unnötig seien: "Es ist eher die erste als die letzte Wahl für eine Behandlung. Als die Branche Ende der 1970er, Anfang der 80er Jahre aufkam, war sie als letzter Ausweg gedacht. Jetzt ist es der erste Ausweg. Ich glaube, dass sie den Frauen auf lange Sicht schaden kann". IVF wirft somit ethische Fragen auf, die den Missbrauch bio-medizinischer Fakten betreffen, um Korrekturverfahren und Behandlungen für Zustände zu "verkaufen", die von einem konstruierten Ideal des "gesunden" oder "normalen" Körpers abweichen, d. h. fruchtbare Frauen und Männer mit Fortpflanzungssystemen, die in der Lage sind, gemeinsam Nachkommen zu zeugen. ⓘ
IVF über 40 Jahre
Alle Schwangerschaften können risikoreich sein, aber für Frauen, die älter als 40 Jahre sind, besteht ein größeres Risiko. Je älter die Frau ist, desto risikoreicher ist die Schwangerschaft. Mit zunehmendem Alter steigt die Wahrscheinlichkeit, dass Frauen an Krankheiten wie Schwangerschaftsdiabetes und Präeklampsie erkranken. Wenn ältere Frauen im Alter von über 40 Jahren schwanger werden, kann ihr Nachwuchs ein geringeres Geburtsgewicht haben und eher eine intensive Betreuung benötigen. Aus diesem Grund ist das erhöhte Risiko ein ausreichender Grund zur Besorgnis. Die hohe Zahl der Kaiserschnitte bei älteren Müttern wird allgemein als Risiko angesehen. ⓘ
Obwohl ältere Schwangerschaften mit einigen Risiken verbunden sind, gibt es auch einige Vorteile, die mit einem Kaiserschnitt verbunden sind. Eine Studie hat gezeigt, dass bei Geburten über 40 eine geringere Rate an Geburtstraumata zu verzeichnen ist, da häufiger per Kaiserschnitt entbunden wird. Auch wenn ein Kaiserschnitt für Mütter über 40 von Vorteil ist, gibt es immer noch viele Risikofaktoren zu beachten. Ein Kaiserschnitt kann ebenso ein Risiko darstellen wie ein Schwangerschaftsdiabetes. ⓘ
Frauen, die mit 40 schwanger werden, haben ein höheres Risiko für Schwangerschaftsbluthochdruck und Frühgeburten. Das Kind ist gefährdet, wenn es von älteren Müttern geboren wird, und die Risiken, die mit einer IVF-Befruchtung verbunden sind, sind ebenfalls zu beachten. ⓘ
Adriana Iliescu hielt eine Zeit lang den Rekord als älteste Frau, die mit IVF und einer Spender-Eizelle gezeugt wurde, als sie 2004 im Alter von 66 Jahren ein Kind zur Welt brachte. Im September 2019 wurde eine 74-jährige Frau die älteste Gebärende aller Zeiten, nachdem sie in einem Krankenhaus in Guntur, Andhra Pradesh, Zwillinge zur Welt gebracht hatte. ⓘ
Schwangerschaft nach der Menopause
Obwohl die Menopause ein natürliches Hindernis für eine weitere Empfängnis darstellt, können Frauen dank IVF auch in ihren Fünfzigern und Sechzigern schwanger werden. Frauen, deren Gebärmutter entsprechend vorbereitet wurde, erhalten Embryonen, die aus einer Eizelle einer Spenderin stammen. Obwohl diese Frauen also keine genetische Verbindung mit dem Kind haben, haben sie durch Schwangerschaft und Geburt eine physische Verbindung. In vielen Fällen ist der genetische Vater des Kindes der Partner der Frau. Auch nach der Menopause ist die Gebärmutter durchaus in der Lage, eine Schwangerschaft auszutragen. ⓘ
Gleichgeschlechtliche Paare, alleinstehende und unverheiratete Eltern
In einer Erklärung der ASRM aus dem Jahr 2009 wurden keine überzeugenden Beweise dafür gefunden, dass Kinder allein dadurch, dass sie von alleinerziehenden, unverheirateten oder homosexuellen Eltern aufgezogen werden, geschädigt oder benachteiligt werden. Sie befürwortet keine Beschränkung des Zugangs zu assistierten Reproduktionstechnologien auf der Grundlage des Familienstands oder der sexuellen Orientierung der zukünftigen Eltern. ⓘ
Zu den ethischen Bedenken gehören das Recht auf Fortpflanzung, das Wohlergehen des Nachwuchses, die Nichtdiskriminierung von unverheirateten Personen, Homosexuellen und die berufliche Autonomie. ⓘ
Bei einer kürzlich in Kalifornien geführten Kontroverse ging es um die Frage, ob Ärzte, die gleichgeschlechtliche Beziehungen ablehnen, verpflichtet werden sollten, eine künstliche Befruchtung für ein lesbisches Paar durchzuführen. Guadalupe T. Benitez, eine lesbische Arzthelferin aus San Diego, verklagte die Ärzte Christine Brody und Douglas Fenton von der North Coast Woman's Care Medical Group, nachdem Brody ihr mitgeteilt hatte, dass sie "religiös begründete Einwände gegen die Behandlung von ihr und Homosexuellen im Allgemeinen habe, um ihnen bei der Zeugung von Kindern durch künstliche Befruchtung zu helfen", und Fenton sich aus denselben Gründen weigerte, ihr ein Rezept für das Fruchtbarkeitsmedikament Clomid wieder auszustellen. Die California Medical Association hatte sich zunächst auf die Seite von Brody und Fenton gestellt, aber der Fall, North Coast Women's Care Medical Group v. Superior Court, wurde am 19. August 2008 vom California State Supreme Court einstimmig zu Gunsten von Benitez entschieden. ⓘ
Die IVF wird zunehmend eingesetzt, um lesbischen und anderen LGBT-Paaren die Möglichkeit zu geben, durch eine Technik namens reziproke IVF am Fortpflanzungsprozess teilzuhaben. Dabei werden die Eizellen eines Partners zur Erzeugung von Embryonen verwendet, die der andere Partner bis zur Schwangerschaft austrägt. ⓘ
Nadya Suleman erlangte internationale Aufmerksamkeit, nachdem ihr zwölf Embryonen eingepflanzt worden waren, von denen acht überlebten, so dass ihre bereits bestehende Familie mit sechs Kindern um acht Neugeborene erweitert werden konnte. Die kalifornische Ärztekammer versuchte, dem Fruchtbarkeitsarzt Michael Kamrava, der Suleman behandelte, die Zulassung zu entziehen. Die staatlichen Behörden behaupten, dass die Durchführung von Sulemans Eingriff ein Beweis für unvernünftiges Urteilsvermögen, minderwertige Pflege und mangelnde Rücksichtnahme auf die acht Kinder, die sie empfangen würde, und die sechs, die sie bereits mühsam aufzog, ist. Am 1. Juni 2011 entschied die Ärztekammer, dass Kamrava mit Wirkung vom 1. Juli 2011 die ärztliche Zulassung entzogen wird. ⓘ
Transgender-Eltern
Die Forschung und Literatur über die Fortpflanzung von Transgendern und die Familienplanung ist nach wie vor äußerst begrenzt. Es gibt jedoch keine Anhaltspunkte dafür, dass Kinder von Transgender-Eltern benachteiligt sind. ⓘ
Eine Literaturrecherche aus dem Jahr 2020 zeigt eindeutig, dass Transgender-Männer und -Frauen auf viele Hindernisse und Herausforderungen stoßen können, wenn sie schwanger werden und eine Familie gründen wollen. Diese Probleme ergeben sich aus der cis-normativen Struktur im medizinischen System der Vereinigten Staaten, die zu einer transphobischen Diskriminierung führt. Zu den ethischen Bedenken gehören reproduktive Rechte, reproduktive Gerechtigkeit, ärztliche Autonomie und Transphobie in der Gesundheitsversorgung. ⓘ
In der gleichen Literaturstudie aus dem Jahr 2020 werden die sozialen, emotionalen und körperlichen Erfahrungen schwangerer Transgender-Männer analysiert. Ein häufiges Hindernis für schwangere Transgender-Männer ist die Möglichkeit einer Geschlechtsdysphorie. Aus der Literatur geht hervor, dass Transgender-Männer über unangenehme Prozeduren und Interaktionen während ihrer Schwangerschaft berichten und sich aufgrund der geschlechtsspezifischen Terminologie, die von Gesundheitsdienstleistern verwendet wird, falsch verstanden fühlen. Außerhalb des Gesundheitssystems können schwangere Transgender-Männer aufgrund der kulturellen Annahme, dass alle schwangeren Menschen gleichgeschlechtliche Frauen sind, unter Geschlechtsdysphorie leiden. ⓘ
Viele Transgender-Personen behalten ihre ursprünglichen Geschlechtsorgane und entscheiden sich dafür, Kinder durch biologische Fortpflanzung zu bekommen. Jüngste Fortschritte in der assistierten Reproduktionstechnologie und der Erhaltung der Fruchtbarkeit haben die Möglichkeiten für Transgender erweitert, ein Kind mit ihren eigenen Keimzellen oder denen eines Spenders zu zeugen. Transgender-Männer und -Frauen können sich vor einer geschlechtsangleichenden Operation für eine Fertilitätserhaltung entscheiden, die jedoch für eine zukünftige biologische Fortpflanzung nicht erforderlich ist. Auch wenn Fruchtbarkeitsspezialisten häufig vorschlagen, dass Transgender-Männer ihre Testosteronhormone vor einer Schwangerschaft absetzen sollten, ist die Forschung zu diesem Thema noch nicht schlüssig. ⓘ
Zu den biologischen Fortpflanzungsmöglichkeiten für Transgender-Frauen gehören unter anderem IVF und IUI mit dem Sperma der Transfrau und den Eizellen und der Gebärmutter eines Spenders oder eines Partners. Zu den Möglichkeiten der Fruchtbarkeitsbehandlung für Transgender-Männer gehören u. a. IUI oder IVF mit den eigenen Eizellen und dem Sperma und/oder den Eizellen eines Spenders, der eigenen Gebärmutter oder einer anderen Gebärmutter, sei es die eines Partners oder einer Leihmutter. ⓘ
Anonyme Spender
Einige Kinder, die durch IVF mit anonymen Spendern gezeugt wurden, berichten, dass sie beunruhigt sind, weil sie nichts über ihre Spendereltern, ihre möglichen genetischen Verwandten und ihre Familiengeschichte wissen. ⓘ
Alana Stewart, die mit Spendersamen gezeugt wurde, gründete 2010 ein Online-Forum für Spenderkinder namens AnonymousUS. In diesem Forum sind die Ansichten aller am IVF-Prozess Beteiligten willkommen. Olivia Pratten, eine von einem Spender gezeugte Kanadierin, verklagte 2008 die Provinz British Columbia auf Zugang zu den Unterlagen über die Identität ihres Spendervaters. "Ich bin keine Behandlung, ich bin eine Person, und diese Unterlagen gehören mir", sagte Pratten. Im Mai 2012 entschied ein Gericht zu Prattens Gunsten und stimmte zu, dass die damaligen Gesetze Spenderkinder diskriminieren und anonyme Samen- und Eizellenspenden in British Columbia illegal sind. ⓘ
Im Vereinigten Königreich, in Schweden, Norwegen, Deutschland, Italien, Neuseeland und einigen australischen Staaten werden Spender nicht bezahlt und können nicht anonym sein. ⓘ
Im Jahr 2000 wurde eine Website namens Donor Sibling Registry eingerichtet, um biologischen Kindern mit einem gemeinsamen Spender zu helfen, miteinander in Kontakt zu treten. ⓘ
Im Jahr 2012 wurde ein Dokumentarfilm mit dem Titel Anonymer Vatertag veröffentlicht, in dem es um von Spendern gezeugte Kinder geht. ⓘ
Unerwünschte Embryonen
Während der Auswahl- und Transferphase können viele Embryonen zugunsten anderer Embryonen verworfen werden. Diese Auswahl kann auf Kriterien wie genetischen Störungen oder dem Geschlecht beruhen. Einer der ersten Fälle einer speziellen Genauswahl durch IVF war der Fall der Familie Collins in den 1990er Jahren, die das Geschlecht ihres Kindes auswählte. Die ethischen Fragen bleiben ungelöst, da in Wissenschaft, Religion und Philosophie kein Konsens darüber besteht, wann ein menschlicher Embryo als Person anerkannt werden sollte. Für diejenigen, die glauben, dass dies zum Zeitpunkt der Empfängnis der Fall ist, wird die IVF zu einer moralischen Frage, wenn mehrere Eizellen befruchtet werden, sich entwickeln und nur einige für den Transfer in die Gebärmutter ausgewählt werden. ⓘ
Wenn bei der IVF nur eine einzige Eizelle befruchtet wird, oder zumindest nur die Anzahl der Eizellen, die übertragen werden, dann wäre dies kein Problem. Dies birgt jedoch die Gefahr, dass die Kosten drastisch ansteigen, da jeweils nur wenige Eizellen befruchtet werden können. Infolgedessen muss das Paar entscheiden, was mit diesen zusätzlichen Embryonen geschehen soll. Je nachdem, wie es die Menschlichkeit des Embryos einschätzt oder wie hoch die Wahrscheinlichkeit ist, dass das Paar noch ein weiteres Kind haben möchte, hat es mehrere Möglichkeiten, mit diesen überzähligen Embryonen umzugehen. Sie können sie einfrieren lassen, sie anderen unfruchtbaren Paaren spenden, sie auftauen lassen oder sie für die medizinische Forschung spenden. Das Einfrieren der Embryonen kostet Geld, bei einer Spende ist das Überleben der Embryonen nicht gesichert, beim Auftauen werden sie sofort unfruchtbar und in der medizinischen Forschung werden sie abgebrochen. Im Bereich der medizinischen Forschung wird dem Paar nicht unbedingt mitgeteilt, wofür die Embryonen verwendet werden sollen, und so können einige von ihnen in der Stammzellenforschung eingesetzt werden, einem Bereich, der als ethisch problematisch gilt. ⓘ
Religiöse Reaktion
Die katholische Kirche lehnt alle Arten der assistierten Reproduktionstechnologie und der künstlichen Empfängnisverhütung mit der Begründung ab, dass sie das Zeugungsziel des ehelichen Geschlechtsverkehrs von dem Ziel der Vereinigung der Eheleute trennen. Die katholische Kirche erlaubt die Anwendung einiger weniger Reproduktionstechnologien und Verhütungsmethoden wie die natürliche Familienplanung, bei der die Eisprungzeiten erfasst werden, und erlaubt andere Formen von Reproduktionstechnologien, die eine Empfängnis durch normalen Geschlechtsverkehr ermöglichen, wie etwa ein Fruchtbarkeitsgleitmittel. Papst Benedikt XVI. hatte öffentlich die Ablehnung der katholischen Kirche gegenüber der In-vitro-Fertilisation bekräftigt und gesagt, dass diese die Liebe zwischen Mann und Frau ersetzt. ⓘ
Der Katechismus der katholischen Kirche lehrt in Übereinstimmung mit dem katholischen Verständnis des Naturrechts, dass die Fortpflanzung in einem "untrennbaren Zusammenhang" mit der sexuellen Vereinigung von Eheleuten steht. Darüber hinaus lehnt die Kirche die IVF ab, weil sie zur Beseitigung von Embryonen führen könnte; im Katholizismus wird ein Embryo als Individuum mit einer Seele betrachtet, das als Person behandelt werden muss. Die katholische Kirche vertritt die Auffassung, dass es nicht objektiv böse ist, unfruchtbar zu sein, und befürwortet die Adoption als eine Möglichkeit für solche Paare, die sich dennoch Kinder wünschen. ⓘ
Die Hindus begrüßen die IVF als Geschenk für diejenigen, die keine Kinder bekommen können, und haben Ärzte, die mit IVF zu tun haben, zur Durchführung von Punya erklärt, da es mehrere Persönlichkeiten gibt, von denen behauptet wird, dass sie ohne Geschlechtsverkehr geboren wurden, vor allem Kaurav und fünf Pandavas. ⓘ
Was die Reaktion des Islam auf die IVF betrifft, so sind sich die zeitgenössischen sunnitischen Gelehrten einig, dass IVF-Methoden unmoralisch und verboten sind. Die ART-Fatwa von Gad El-Hak Ali Gad El-Hak beinhaltet jedoch Folgendes:
- Die künstliche Befruchtung einer Eizelle der Frau mit dem Sperma ihres Mannes und die Rückübertragung der befruchteten Eizelle in die Gebärmutter der Frau ist erlaubt, sofern das Verfahren aus einem medizinischen Grund indiziert ist und von einem fachkundigen Arzt durchgeführt wird.
- Da die Ehe ein Vertrag zwischen Ehefrau und Ehemann für die Dauer ihrer Ehe ist, sollte sich kein Dritter in die ehelichen Funktionen Sex und Fortpflanzung einmischen. Das bedeutet, dass ein Dritter als Spender nicht akzeptabel ist, unabhängig davon, ob er oder sie Sperma, Eizellen, Embryonen oder eine Gebärmutter zur Verfügung stellt. Die Inanspruchnahme eines Dritten ist gleichbedeutend mit Zina, also Ehebruch. ⓘ
Innerhalb der orthodoxen jüdischen Gemeinschaft wird das Konzept diskutiert, da es in den traditionellen jüdischen Rechtsquellen kaum Präzedenzfälle gibt. Zu den religiösen Herausforderungen im Bereich der Sexualitätsgesetze gehören die Selbstbefriedigung (die als "Samenverschwendung" betrachtet werden kann), die Gesetze in Bezug auf sexuelle Aktivitäten und Menstruation (Niddah) sowie die spezifischen Gesetze zum Geschlechtsverkehr. Ein weiteres wichtiges Thema ist die Feststellung der Vaterschaft und der Abstammung. Bei einem auf natürlichem Wege gezeugten Kind wird die Identität des Vaters durch eine Rechtsvermutung (chazakah) der Legitimität bestimmt: rov bi'ot achar ha'baal - es wird angenommen, dass die sexuellen Beziehungen einer Frau zu ihrem Ehemann bestehen. Bei einem durch künstliche Befruchtung gezeugten Kind besteht diese Vermutung nicht, so dass Rabbiner Eliezer Waldenberg (neben anderen) eine externe Aufsichtsperson benötigt, um den Vater eindeutig zu identifizieren. Das Reformjudentum hat IVF im Allgemeinen gebilligt. ⓘ
Gesellschaft und Kultur
Viele Frauen in Afrika südlich der Sahara entscheiden sich dafür, ihre Kinder unfruchtbaren Frauen zu überlassen. Die IVF ermöglicht es diesen unfruchtbaren Frauen, ihre eigenen Kinder zu bekommen, was einer Kultur, in der das Aufziehen von Kindern als natürlich und kulturell wichtig angesehen wird, neue Ideale auferlegt. Viele unfruchtbare Frauen können sich in ihrer Gesellschaft mehr Respekt verschaffen, indem sie sich um die Kinder anderer Mütter kümmern, und dies kann verloren gehen, wenn sie sich stattdessen für eine IVF entscheiden. Da die IVF als unnatürlich angesehen wird, kann sie ihre gesellschaftliche Stellung sogar beeinträchtigen, anstatt sie mit fruchtbaren Frauen gleichzustellen. Außerdem ist es für unfruchtbare Frauen wirtschaftlich vorteilhaft, Pflegekinder großzuziehen, da diese Kinder dadurch besseren Zugang zu Ressourcen haben, die für ihre Entwicklung wichtig sind, und auch die Entwicklung der Gesellschaft im Allgemeinen fördern. Wenn die IVF immer beliebter wird, ohne dass die Geburtenrate sinkt, könnte es mehr Großfamilien geben, die weniger Möglichkeiten haben, ihre neugeborenen Kinder in ein Heim zu geben. Dies könnte zu einer Zunahme von Waisenkindern und/oder einer Verringerung der Ressourcen für die Kinder großer Familien führen. Dies würde letztlich das Wachstum der Kinder und der Gemeinschaft bremsen. ⓘ
In den USA hat sich die Ananas zu einem Symbol für IVF-Anwender entwickelt, möglicherweise weil einige Menschen ohne wissenschaftliche Beweise glaubten, dass der Verzehr von Ananas die Erfolgsquote des Verfahrens leicht erhöhen könnte. ⓘ
Emotionales Engagement für die Kinder
Studien haben gezeigt, dass IVF-Mütter eine stärkere emotionale Bindung zu ihrem Kind haben und die Mutterschaft mehr genießen als Mütter, die auf natürliche Weise gezeugt wurden. Ebenso haben Studien gezeigt, dass IVF-Väter mehr Wärme und emotionale Anteilnahme zeigen als Väter, die durch Adoption oder natürliche Empfängnis gezeugt wurden, und die Vaterschaft mehr genießen. Einige IVF-Eltern engagieren sich übermäßig für ihre Kinder. ⓘ
Männer und IVF
Die Forschung hat gezeigt, dass Männer sich weitgehend als "passive Mitwirkende" betrachten, da sie bei der IVF-Behandlung "weniger körperlich beteiligt" sind. Trotzdem sind viele Männer verzweifelt, wenn sie sehen, welchen Tribut die Hormoninjektionen und die ständigen körperlichen Eingriffe bei ihrer Partnerin fordern. ⓘ
Es wurde festgestellt, dass die Fruchtbarkeit ein wichtiger Faktor für die Wahrnehmung der Männlichkeit eines Mannes ist, was viele dazu veranlasst, die Behandlung geheim zu halten. In den Fällen, in denen die Männer mitteilten, dass sie und ihre Partnerin sich einer IVF-Behandlung unterzogen, berichteten sie, dass sie gehänselt wurden, vor allem von anderen Männern, obwohl einige dies als eine Bestätigung der Unterstützung und Freundschaft ansahen. Andere wiederum fühlten sich dadurch sozial isoliert. Im Vergleich zu Frauen verschlechterte sich die psychische Gesundheit von Männern in den Jahren nach einer fehlgeschlagenen Behandlung weniger. Viele Männer hatten jedoch Schuldgefühle, Enttäuschung und Unzulänglichkeiten und gaben an, dass sie lediglich versuchten, ihrer Partnerin einen "emotionalen Felsen" zu bieten. ⓘ
Kosten der IVF
Die Kosten einer IVF-Behandlung lassen sich in direkte und indirekte Kosten aufschlüsseln. Zu den direkten Kosten gehören die medizinischen Behandlungen selbst, einschließlich Arztbesuche, Medikamente, Ultraschalluntersuchungen, Labortests, das eigentliche IVF-Verfahren und alle damit verbundenen Krankenhaus- und Verwaltungskosten. Zu den indirekten Kosten gehören die Kosten für die Behandlung von Komplikationen bei den Behandlungen, die Reisekosten der Patienten und die verlorenen Arbeitsstunden. Diese Kosten können durch das zunehmende Alter der Frauen, die sich einer IVF-Behandlung unterziehen (insbesondere bei Frauen über 40), und durch die mit Mehrlingsgeburten verbundenen höheren Kosten noch weiter in die Höhe getrieben werden. So kann beispielsweise eine Schwangerschaft mit Zwillingen bis zu dreimal so teuer sein wie eine Einlingsschwangerschaft. ⓘ
In den USA gibt es in neunzehn Bundesstaaten Gesetze, die eine Versicherungsdeckung für Unfruchtbarkeitsbehandlungen vorschreiben, und in dreizehn davon ist die IVF ausdrücklich eingeschlossen. Diese Staaten, die eine IVF-Versicherung vorschreiben, sind: Arkansas, Kalifornien, Colorado, Connecticut, Delaware, Hawaii, Illinois, Louisiana, Maryland, Massachusetts, Montana, New Hampshire, New Jersey, New York, Ohio, Rhode Island, Texas, Utah und West Virginia. Diese Gesetze sind von Staat zu Staat unterschiedlich, aber viele verlangen, dass eine Eizelle mit dem Sperma eines Ehepartners befruchtet wird und dass man nachweisen muss, dass man durch heterosexuellen Sex nicht schwanger werden kann. Diese Voraussetzungen sind für ein queeres Paar nicht zu erfüllen. ⓘ
Verfügbarkeit und Inanspruchnahme
Aufgrund der hohen Kosten ist die IVF für viele Entwicklungsländer unerschwinglich, aber Forschungen des Genker Instituts für Fruchtbarkeitstechnologie in Belgien haben nach eigenen Angaben eine wesentlich kostengünstigere Methode (ca. 90 % weniger) mit ähnlicher Wirksamkeit gefunden, die für einige Fruchtbarkeitsbehandlungen geeignet sein könnte. Außerdem erlauben die Gesetze vieler Länder die IVF nur für alleinstehende Frauen, lesbische Paare und Personen, die an Leihmutterschaftsvereinbarungen teilnehmen. Die Anwendung der PID verschafft den Angehörigen dieser ausgewählten demografischen Gruppen einen unverhältnismäßigen Zugang zu einem Mittel, mit dem ein Kind mit Merkmalen gezeugt werden kann, die sie als "ideal" ansehen, was Fragen der Chancengleichheit sowohl für die Generation der Eltern/Elternteile als auch für die Generation des Kindes aufwirft. Viele unfruchtbare Paare fordern heute einen gleichberechtigten Zugang zum Embryoscreening, damit ihr Kind genauso gesund ist wie ein durch IVF erzeugtes. Der massenhafte Einsatz der PID, insbesondere als Mittel zur Bevölkerungskontrolle oder bei Vorliegen gesetzlicher Maßnahmen zur Bevölkerungs- oder Bevölkerungskontrolle, kann zu beabsichtigten oder unbeabsichtigten demografischen Effekten führen, wie z. B. das verzerrte Geschlechterverhältnis bei Lebendgeburten, das im kommunistischen China nach Einführung der Ein-Kind-Politik beobachtet wurde. ⓘ
Die hohen Kosten der IVF sind auch ein Hindernis für den Zugang von Menschen mit Behinderungen. Menschen mit Behinderungen haben in der Regel ein geringeres Einkommen, sind mit höheren Gesundheitskosten konfrontiert und nehmen häufiger Gesundheitsdienste in Anspruch als Menschen ohne Behinderungen. Wenn dann noch die hohen Kosten für mehrere IVF-Zyklen hinzukommen, hält dies viele Menschen mit Behinderungen davon ab, eine Fruchtbarkeitsbehandlung in Anspruch zu nehmen, und macht sie für die meisten völlig unerreichbar. ⓘ
Australien
In Australien liegt das Durchschnittsalter der Frauen, die sich einer ART-Behandlung unterziehen, bei 35,5 Jahren, wenn sie ihre eigenen Eizellen verwenden (jede vierte Frau ist 40 Jahre oder älter), und bei 40,5 Jahren, wenn sie gespendete Eizellen verwenden. IVF ist in Australien zwar möglich, doch können Australierinnen, die sich einer IVF-Behandlung unterziehen, das Geschlecht ihres Babys nicht wählen. ⓘ
Kamerun
Ernestine Gwet Bell betreute das erste kamerunische Kind, das 1998 durch IVF geboren wurde. ⓘ
Kanada
In Kanada kann ein Zyklus einer IVF-Behandlung zwischen 7.750 und 12.250 CAD kosten, und die Medikamente allein können zwischen 2.500 und über 7.000 CAD kosten. Die Finanzierungsmechanismen, die die Zugänglichkeit in Kanada beeinflussen, variieren je nach Provinz und Territorium, wobei einige Provinzen eine vollständige, teilweise oder gar keine Deckung bieten. ⓘ
New Brunswick bietet eine Teilfinanzierung durch seinen Infertility Special Assistance Fund - einen einmaligen Zuschuss von bis zu 5.000 $. Patienten können nur bis zu 50 % der Behandlungskosten oder 5.000 $ (je nachdem, welcher Betrag niedriger ist) beanspruchen, die nach April 2014 entstanden sind. Anspruchsberechtigt sind Patienten mit Vollzeitwohnsitz in New Brunswick, die über eine gültige Medicare-Karte verfügen und bei denen ein Arzt eine offizielle medizinische Diagnose der Unfruchtbarkeit gestellt hat. ⓘ
Im Dezember 2015 erließ die Provinzregierung von Ontario das Ontario Fertility Program für Patienten mit medizinischer und nichtmedizinischer Unfruchtbarkeit, unabhängig von sexueller Orientierung, Geschlecht oder Familienzusammensetzung. Für eine IVF-Behandlung in Frage kommen Patienten mit Wohnsitz in Ontario, die jünger als 43 Jahre sind, eine gültige Ontario Health Insurance Plan-Karte besitzen und sich noch keinem IVF-Zyklus unterzogen haben. Der Versicherungsschutz ist umfassend, aber nicht universell. Der Versicherungsschutz erstreckt sich auf bestimmte Blut- und Urintests, Beratung und Konsultationen durch Arzt und Krankenschwester, bestimmte Ultraschalluntersuchungen, bis zu zwei Zyklusüberwachungen, Auftauen, Einfrieren und Kultivieren von Embryonen, Befruchtung und embryologische Leistungen, einmalige Transfers aller Embryonen und eine chirurgische Spermienentnahme mit bestimmten Techniken, falls erforderlich. Arzneimittel und Medikamente sind im Rahmen dieses Programms nicht abgedeckt, ebenso wenig wie die Beratung durch einen Psychologen oder Sozialarbeiter, die Lagerung und der Versand von Eizellen, Spermien oder Embryonen sowie der Erwerb von Spendersamen oder -eizellen. ⓘ
Indien
Die Durchdringung des IVF-Marktes in Indien ist mit nur 2.800 Zyklen pro einer Million unfruchtbarer Menschen in der reproduktiven Altersgruppe (20-44 Jahre) recht gering, verglichen mit China, wo es 6.500 Zyklen gibt. Die größten Herausforderungen sind mangelndes Bewusstsein, Erschwinglichkeit und Zugänglichkeit. Seit 2018 hat sich Indien jedoch zu einem Ziel für Fruchtbarkeitstourismus entwickelt, da die Kosten niedriger sind als in der westlichen Welt. Im Dezember 2021 verabschiedete die Lok Sabha die Assisted Reproductive Technology (Regulation) Bill 2020, um ART-Dienstleistungen einschließlich IVF-Zentren, Samen- und Eizellenbanken zu regulieren. ⓘ
Israel
Israel hat mit 1657 Eingriffen pro Million Menschen und Jahr die höchste IVF-Rate der Welt. Kinderlose Paare können eine IVF-Finanzierung für bis zu zwei Kinder erhalten. Die gleiche Finanzierung gibt es auch für Menschen ohne Kinder, die bis zu zwei Kinder in einem Haus mit nur einem Elternteil aufziehen. IVF ist für Personen zwischen 18 und 45 Jahren möglich. Nach Angaben des israelischen Gesundheitsministeriums belaufen sich die Kosten auf etwa 3450 Dollar pro Eingriff. ⓘ
Schweden
Eine, zwei oder drei IVF-Behandlungen werden für Personen, die jünger als 40 Jahre sind und keine Kinder haben, staatlich bezuschusst. Die Regeln dafür, wie viele Behandlungen bezuschusst werden, und die obere Altersgrenze für die Betroffenen variieren zwischen den einzelnen Provinziallandtagen. Es werden auch alleinstehende Personen behandelt, und die Adoption von Embryonen ist erlaubt. Es gibt auch Privatkliniken, die die Behandlung gegen eine Gebühr anbieten. ⓘ
Vereinigtes Königreich
Die Verfügbarkeit von IVF in England wird von den Clinical Commissioning Groups (CCGs) bestimmt. Das National Institute for Health and Care Excellence (NICE) empfiehlt bis zu drei Behandlungszyklen für Personen unter 40 Jahren, die nach zwei Jahren ungeschütztem Geschlechtsverkehr nur wenig Erfolg bei der Empfängnis haben. Bei Personen, die älter als 40 Jahre sind, werden die Zyklen nicht fortgesetzt. Die CCGs in Essex, Bedfordshire und Somerset haben die Finanzierung auf einen oder gar keinen Zyklus reduziert, und es ist zu erwarten, dass sich diese Kürzungen weiter verbreiten werden. Unter außergewöhnlichen Umständen" kann eine Finanzierung möglich sein - zum Beispiel, wenn ein männlicher Partner eine übertragbare Infektion hat oder ein Partner von einer Krebsbehandlung betroffen ist. Nach Angaben der Kampagnengruppe Fertility Fairness finanzierte Ende 2014 jede CCG in England mindestens einen IVF-Zyklus". Die vom NHS in England gezahlten Preise schwankten 2014/5 zwischen weniger als 3.000 Pfund und mehr als 6.000 Pfund. Im Februar 2013 wurden die Kosten für die Umsetzung der NICE-Leitlinien für IVF zusammen mit anderen Unfruchtbarkeitsbehandlungen auf 236.000 Pfund pro Jahr und 100.000 Einwohner veranschlagt. ⓘ
IVF steht zunehmend auf der schwarzen Liste der NHS-Behandlungen. Im August 2017 hatten fünf der 208 CCGs die Finanzierung von IVF vollständig eingestellt, und andere zogen dies in Betracht. Im Oktober 2017 boten nur 25 CCGs die drei empfohlenen NHS-IVF-Zyklen für berechtigte Personen unter 40 Jahren an. Richtlinien könnten gegen Diskriminierungsgesetze verstoßen, wenn sie gleichgeschlechtliche Paare anders behandeln als heterosexuelle Paare. Im Juli 2019 erklärte Jackie Doyle-Price, dass sich Frauen in Praxen anmelden, die weiter von ihrem Wohnort entfernt sind, um die Rationierungspolitik der CCGs zu umgehen. ⓘ
Die Human Fertilisation and Embryology Authority (Behörde für menschliche Befruchtung und Embryologie) erklärte im September 2018, dass Eltern, die auf einen IVF-Zyklus beschränkt sind oder diesen selbst finanzieren müssen, sich eher für die Einpflanzung mehrerer Embryonen entscheiden, weil sie hoffen, dass sich dadurch die Chancen auf eine Schwangerschaft erhöhen. Dies erhöht die Wahrscheinlichkeit von Mehrlingsgeburten und die damit verbundenen schlechten Ergebnisse erheblich, was die Kosten für den NHS erhöhen würde. Der Präsident des Royal College of Obstetricians and Gynaecologists (Königliches Kollegium der Geburtshelfer und Gynäkologen) erklärte, dass die Finanzierung von drei Zyklen "der wichtigste Faktor für die Aufrechterhaltung niedriger Raten von Mehrlingsschwangerschaften und die Reduzierung der damit verbundenen Komplikationen" sei. ⓘ
Vereinigte Staaten
In den Vereinigten Staaten lag die Gesamtverfügbarkeit von IVF im Jahr 2005 bei 2,5 IVF-Ärzten pro 100.000 Einwohner und die Inanspruchnahme bei 236 IVF-Zyklen pro 100.000. Jährlich werden 126 Verfahren pro Million Menschen durchgeführt. Die Inanspruchnahme steigt stark mit der Verfügbarkeit und der IVF-Versicherungsdeckung und in erheblichem Maße auch mit dem Anteil der Alleinstehenden und dem mittleren Einkommen. In den USA kostet ein durchschnittlicher Zyklus von der Eizellentnahme bis zur Einnistung des Embryos 12 400 Dollar, und die Versicherungen, die die Behandlung - wenn auch nur teilweise - abdecken, begrenzen in der Regel die Anzahl der Zyklen, für die sie zahlen. Im Jahr 2015 wurden mehr als 1 Million Babys mit Hilfe der IVF-Technologie geboren. ⓘ
Die Kosten für eine IVF-Behandlung spiegeln eher die Kosteneffizienz des zugrunde liegenden Gesundheitssystems wider als das regulatorische oder finanzielle Umfeld. Sie liegen im Durchschnitt für einen Standard-IVF-Zyklus und in US-Dollar von 2006 zwischen 12 500 US-Dollar in den Vereinigten Staaten und 4 000 US-Dollar in Japan. In Irland kostet eine IVF-Behandlung etwa 4.000 €, wobei die Kosten für Fruchtbarkeitsmedikamente, falls erforderlich, bis zu 3.000 € betragen. Die Kosten pro Lebendgeburt sind in den Vereinigten Staaten (41.000 $) und im Vereinigten Königreich (40.000 $) am höchsten und in Skandinavien und Japan (jeweils rund 24.500 $) am niedrigsten. ⓘ
Viele Fruchtbarkeitskliniken in den Vereinigten Staaten begrenzen das Höchstalter für eine IVF-Behandlung auf 50 oder 55 Jahre. Diese Altersgrenzen erschweren es Menschen, die älter als fünfundfünfzig Jahre sind, das Verfahren in Anspruch zu nehmen. ⓘ
Alternativen
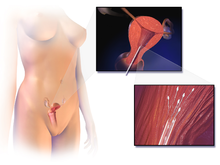
Alternativen zur IVF sind vor allem:
- Die künstliche Befruchtung, einschließlich der intrazervikalen Befruchtung und der intrauterinen Befruchtung von Sperma. Die künstliche Befruchtung setzt einen Eisprung der Frau voraus, ist aber ein relativ einfaches Verfahren und kann zu Hause ohne ärztliche Hilfe durchgeführt werden. Die künstliche Befruchtung kommt Frauen zugute, die ein eigenes Kind zur Welt bringen wollen, die alleinstehend sind, Frauen, die in einer lesbischen Beziehung leben, oder Frauen, die in einer heterosexuellen Beziehung leben, aber mit einem männlichen Partner, der unfruchtbar ist oder eine körperliche Beeinträchtigung hat, die einen vollständigen Geschlechtsverkehr verhindert.
- Die Ovulationsinduktion (im Sinne einer medizinischen Behandlung, die auf die Entwicklung von einem oder zwei Eisprungfollikeln abzielt) ist eine Alternative für Frauen mit Anovulation oder Oligoovulation, da sie weniger kostspielig und leichter zu kontrollieren ist. In der Regel werden Östrogene wie Clomifenzitrat oder Letrozol eingesetzt, gefolgt von einer natürlichen oder künstlichen Befruchtung.
- Leihmutterschaft, bei der sich die Leihmutter bereit erklärt, ein Kind für eine andere Person oder mehrere Personen auszutragen, die nach der Geburt die Eltern des Kindes werden. Eine Leihmutterschaft kann in Anspruch genommen werden, wenn eine Schwangerschaft aus medizinischen Gründen nicht möglich ist, wenn die Risiken einer Schwangerschaft für die Wunschmutter zu groß sind oder wenn ein alleinstehender Mann oder ein männliches Paar ein Kind haben möchte.
- Adoption, bei der eine Person die elterliche Sorge für eine andere Person, in der Regel ein Kind, von den biologischen oder rechtlichen Eltern dieser Person übernimmt. ⓘ
Rechtlicher Status
In China haben die Behörden 2003 die Anwendung von IVF durch Unverheiratete oder Paare mit bestimmten Infektionskrankheiten verboten. ⓘ
In Indien ist die IVF als Mittel zur Geschlechtsauswahl (Präimplantationsdiagnostik) gemäß dem Pre-Conception and Pre-Natal Diagnostic Techniques Act von 1994 verboten. ⓘ
In sunnitisch-muslimischen Ländern ist die IVF zwischen verheirateten Paaren im Allgemeinen erlaubt, wenn sie mit ihren eigenen Spermien und Eizellen durchgeführt wird, nicht aber mit Spendereizellen anderer Paare. Der Iran, ein schiitisches Land, hat jedoch eine komplexere Regelung. Der Iran verbietet die Samenspende, erlaubt aber die Spende sowohl befruchteter als auch unbefruchteter Eizellen. Befruchtete Eizellen werden von verheirateten Paaren an andere verheiratete Paare gespendet, während unbefruchtete Eizellen im Rahmen der mut'ah oder einer vorübergehenden Ehe mit dem Vater gespendet werden. ⓘ
2012 war Costa Rica das einzige Land der Welt mit einem vollständigen Verbot der IVF-Technologie, das vom Obersten Gerichtshof des Landes als verfassungswidrig eingestuft wurde, weil es "gegen das Leben verstößt". Costa Rica war das einzige Land in der westlichen Hemisphäre, das die IVF verbot. Ein von der Regierung von Präsidentin Laura Chinchilla widerwillig vorgelegtes Gesetzesprojekt wurde vom Parlament abgelehnt. Präsidentin Chinchilla hat sich in der Frage der IVF nicht öffentlich geäußert. Angesichts des massiven Einflusses der katholischen Kirche in ihrer Regierung scheint eine Änderung des Status quo jedoch sehr unwahrscheinlich. Trotz des starken Widerstands der costaricanischen Regierung und der Religion wurde das IVF-Verbot vom Interamerikanischen Gerichtshof für Menschenrechte in einer Entscheidung vom 20. Dezember 2012 aufgehoben. Das Gericht stellte fest, dass eine seit langem bestehende costaricanische Schutzgarantie für jeden menschlichen Embryo gegen die reproduktive Freiheit unfruchtbarer Paare verstößt, weil sie ihnen die Inanspruchnahme von IVF untersagt, bei der häufig Embryonen entsorgt werden, die nicht in die Gebärmutter der Frau eingepflanzt wurden. Am 10. September 2015 unterzeichnete Präsident Luis Guillermo Solís ein Dekret zur Legalisierung der In-vitro-Fertilisation. Das Dekret wurde am 11. September in das Amtsblatt des Landes aufgenommen. Die Gegner dieser Praxis haben seitdem vor dem Verfassungsgericht des Landes Klage eingereicht. ⓘ
In Australien wurden 2002 alle wesentlichen Beschränkungen für alleinstehende, aber unfruchtbare Menschen, die IVF anwenden, aufgehoben, nachdem eine letzte Berufung vor dem australischen High Court im Fall Leesa Meldrum aus verfahrenstechnischen Gründen abgelehnt worden war. Ein Bundesgericht in Victoria hatte im Jahr 2000 entschieden, dass das bestehende Verbot für alle alleinstehenden Frauen und Lesben, IVF zu nutzen, eine Diskriminierung aufgrund des Geschlechts darstellt. Die Regierung von Victoria kündigte 2007 Änderungen des IVF-Gesetzes an, mit denen die verbleibenden Beschränkungen für alleinstehende Frauen und Lesben aufgehoben wurden. ⓘ
Die bundesstaatlichen Vorschriften in den Vereinigten Staaten enthalten Screening-Anforderungen und Beschränkungen für Spenden, betreffen aber im Allgemeinen keine sexuell intimen Partner. Allerdings können Ärzte aufgrund von Nichtdiskriminierungsgesetzen verpflichtet sein, Behandlungen vorzunehmen, wie z. B. in Kalifornien. Im US-Bundesstaat Tennessee wurde 2009 ein Gesetzentwurf eingebracht, der IVF durch Spender als Adoption definiert hätte. In derselben Sitzungsperiode wurde in einem anderen Gesetzentwurf vorgeschlagen, unverheirateten und zusammenlebenden Paaren die Adoption zu verbieten, und Aktivistengruppen erklärten, dass die Verabschiedung des ersten Gesetzentwurfs unverheiratete Frauen von der IVF-Behandlung abhalten würde. Keiner dieser Gesetzesentwürfe wurde verabschiedet. ⓘ
Nur wenige amerikanische Gerichte haben sich mit der Frage des "Eigentums"-Status eines eingefrorenen Embryos befasst. Diese Frage könnte sich im Zusammenhang mit einem Scheidungsfall stellen, in dem ein Gericht entscheiden müsste, welcher Ehepartner über die Verfügung über die Embryonen entscheiden kann. Sie könnte auch im Zusammenhang mit einem Streit zwischen einem Samenspender und einer Eizellenspenderin auftreten, selbst wenn diese nicht verheiratet sind. Im Jahr 2015 entschied ein Gericht in Illinois, dass solche Streitigkeiten unter Bezugnahme auf einen Vertrag zwischen den werdenden Eltern entschieden werden können. In Ermangelung eines Vertrags würde das Gericht die relativen Interessen der Parteien abwägen. ⓘ
Behinderung und IVF
Menschen mit Behinderungen haben ebenso Anspruch auf einen gleichberechtigten Zugang zu Fruchtbarkeitsbehandlungen wie IVF wie Menschen ohne Behinderungen. In den meisten Fällen wird dieser Zugang jedoch nicht gewährt. Tatsächlich ist die Wahrscheinlichkeit, dass Menschen mit Behinderungen, die sich ein Kind wünschen, unfruchtbar werden, gleich hoch oder sogar höher als bei der nicht behinderten Bevölkerung, doch haben behinderte Menschen viel seltener Zugang zu Fruchtbarkeitsbehandlungen wie IVF. Es gibt viele äußere Faktoren, die behinderten Menschen den Zugang zu IVF erschweren, z. B. Annahmen über die Entscheidungsfähigkeit, sexuelle Interessen und Fähigkeiten, die Vererbbarkeit einer Behinderung und Überzeugungen über die Fähigkeit zur Kindererziehung. Annahmen wie diese können der Grund dafür sein, dass Menschen mit Behinderungen zu Unrecht weniger Zugang zu medizinisch indizierter reproduktiver Versorgung erhalten als andere Menschen ähnlichen Alters und Geschlechts. Dieselben falschen Vorstellungen über Menschen mit Behinderungen, die einst dazu führten, dass Gesundheitsdienstleister Tausende von Frauen mit Behinderungen sterilisierten, führen nun dazu, dass sie reproduktive Versorgung auf der Grundlage von Stereotypen über Menschen mit Behinderungen und ihre Sexualität anbieten oder verweigern. ⓘ
Nicht nur, dass falsche Vorstellungen über die elterlichen Fähigkeiten, die Sexualität und die Gesundheit von Menschen mit Behinderungen den Zugang zu Fruchtbarkeitsbehandlungen wie IVF einschränken und behindern, sondern auch strukturelle Barrieren wie Anbieter, die nicht über die Gesundheitsfürsorge für Menschen mit Behinderungen geschult sind, und unzugängliche Kliniken behindern den Zugang von Menschen mit Behinderungen zur IVF-Behandlung erheblich. Nicht behindertengerechte Gebäude, medizinische Geräte, Untersuchungstische usw. sind allesamt Barrieren, die den Zugang zu einer IVF-Behandlung für Menschen mit Behinderungen nahezu unmöglich machen. Eine Frau namens Nia erzählt, wie der Zugang zu einer IVF-Behandlung für eine behinderte blinde Person extrem schwierig, wenn nicht sogar fast unmöglich war. Sie erzählt uns, dass der Transport zur Klinik für Behinderte unzugänglich war, dass die für die IVF verabreichten Medikamente extrem schwer selbst zu verabreichen waren und dass ihre Betreuer nicht darüber informiert waren, wie man den IVF-Prozess behindertengerecht gestalten kann. Geschichten wie die von Nia zeigen uns, dass Fruchtbarkeitsbehandlungen wie IVF für Menschen mit Behinderungen in ungerechter Weise unzugänglich sind und warum sie behindertengerecht gestaltet werden müssen, um das Recht auf Elternschaft für Menschen mit Behinderungen zu schützen. ⓘ
Es gibt offensichtliche Anzeichen dafür, dass der Zugang zu IVF und ähnlichen Fruchtbarkeitsbehandlungen für Menschen mit Behinderungen weitaus weniger zugänglich ist. Obwohl die ASRM feststellt, dass "Kinder in einem breiten Spektrum von Erziehungsansätzen oder -häusern gedeihen" und dass es "unzutreffend ist anzunehmen, dass behindert zu sein bedeutet, keine sexuellen oder reproduktiven Interessen zu haben oder sexuell inaktiv, zölibatär oder asexuell zu sein, behindern Annahmen über die Sexualität und die Erziehungsfähigkeiten behinderter Menschen in Verbindung mit uniformierten Anbietern und dem Mangel an zugänglichen Kliniken und medizinischer Ausrüstung den Zugang zu Fruchtbarkeitsbehandlungen wie IVF für behinderte Menschen. Es müssen Schritte unternommen werden, um den Bereich der Fruchtbarkeit für alle zugänglich zu machen und das Recht zu schützen, eine Familie zu gründen, unabhängig vom Grad der Behinderung. ⓘ
Ablauf der In-vitro-Fertilisation
Spermien- und Eizellen-Gewinnung
Überprüfung auf Fehler im Erbgut: Bei Verdacht auf Erbkrankheiten erfolgt im Regelfall eine genetische Untersuchung zur Feststellung des Karyotyps – Chromosomenuntersuchung – normaler Karyotyp Frau 46 XX, Mann 46 XY, abweichender Karyotyp z. B. bei Klinefelter-Syndrom 47XXY, sowie eine Untersuchung auf schwere vererbbare Krankheiten (z. B. Mukoviszidose, die auf Fehlern in bestimmten Abschnitten von Chromosom 7 beruht; Azoospermiefaktor (AZF, beim Mann)). ⓘ
Downregulation: Durch die Gabe bestimmter Medikamente GnRH-Analoga/-Agonisten, GnRH-Antagonisten oder Antibabypille wird die Eigentätigkeit der Eierstöcke gedrosselt, damit anschließend durch die hormonelle Stimulation mehr als eine Eizelle gewonnen werden kann. ⓘ
Ovarielle Stimulation: Durch Hormongabe (FSH-Präparate) werden mehrere Eizellen zur Reifung stimuliert; optimal ist einer britischen Studie zufolge die Reifung von 15 Eizellen. Die Frau injiziert sich ca. 11 Tage lang (abhängig vom Follikelwachstum) mit einer Spritze oder einem sogenannten Pen Follikelstimulierendes Hormon (FSH) in einer festgelegten Dosis subkutan, d. h. unter die Haut (Bauch). ⓘ
Überprüfung der Spermien: Spermien werden auf Dichte/Konzentration (Anzahl), Morphologie (Form), Motilität (Beweglichkeit) und Infektionen (Bakterien, Chlamydien) überprüft. Kriterien für ein normales Spermiogramm nach WHO-Kriterien 2010: Spermien-Dichte 15 Mio/ml, progressive (lineare) Motilität 32 %, normale Morphologie 4 % ⓘ
Überwachung des Follikelwachstums: Ab dem 6. Zyklustag werden die Follikel mittels Ultraschall überwacht. Die Bauchdecke der Frau kann sich leicht anspannen. Am 9. Zyklustag (Ultraschall) wird entschieden, wann die Eizellen entnommen werden (abhängig von der Follikelgröße). ⓘ
Auslösung des Follikelsprungs: Der Follikelsprung (Ovulation) wird durch das Hormon HCG ausgelöst. ⓘ
Follikelpunktion: Die Follikelflüssigkeit wird transvaginal, ultraschallgesteuert mit einem stabförmigen Schallkopf, der mit einer Punktionsnadel versehen ist, aus den einzelnen Follikeln punktiert. ⓘ
Spermiengewinnung: Spermien zur Befruchtung der Eizelle werden zumeist parallel zur Eizellenpunktion durch Masturbation oder einen mikrochirurgischen Eingriff (TESE, s. u.) gewonnen. ⓘ
Befruchtung
Die gewonnenen Eizellen werden befruchtet. Dies gelingt mit einer Erfolgsrate von ca. 50 % bis 70 %. Dazu gibt es vier Methoden. ⓘ
In-vitro-Fertilisation (IVF)
Die Eizellen werden mit dem aufbereiteten Sperma in einem Reagenzglas zusammengebracht. Es findet eine spontane Befruchtung statt. So erfolgt eine natürliche Selektion der mobilen und schnellen Spermien. ⓘ
In-vitro-Maturation (IVM)
Bei der In-vitro-Maturation, einer experimentellen Technik, werden unreife Eizellen im Labor herangereift, wenn sie ein gewisses Reifestadium erreichen (Metaphase II). Im Gegensatz zur IVF ist bei einer IVM keine oder nur eine sehr niedrig dosierte Hormonbehandlung zur Stimulierung der Ovarien notwendig. Die Methode sei daher eine Alternative für Patientinnen, bei denen das Risiko eines ovariellen Überstimulationssyndroms besteht. ⓘ
Testikuläre Spermienextraktion mit ICSI (TESE-ICSI)
Dasselbe Vorgehen wie bei der ICSI, jedoch werden die Spermien nicht aus dem Ejakulat, sondern aus einer Hodenbiopsie gewonnen. Verwendung findet es bei einem Verschluss der ableitenden Samenwege und bei Azoospermie, die nicht auf einem Verschluss der ableitenden Samenwege beruht. ⓘ
Mikrochirurgische Epididymale Spermatozoenaspiration (MESA-ICSI)
Entspricht ebenfalls dem ICSI-Vorgehen, wobei die Spermien unter Verwendung eines Operationsmikroskops direkt aus dem Nebenhoden (Epididymis) gewonnen werden. Indikation ist wie auch bei der TESE die Verschlussazoospermie (=Fehlen reifer wie unreifer Spermien im Ejakulat durch Verschluss der Samenzellwege, normalem Hodenvolumen und normalem FSH-Spiegel). ⓘ
Rechtliche und ethische Probleme
Elternkombinationen
Bei der IVF ist es möglich, dass die genetische und die soziale Elternschaft auseinanderfallen. So ist es im Extremfall denkbar, dass die Eizelle einer Spenderin mit der Samenzelle eines Spenders befruchtet und die auf diese Weise entstandene Zygote einer Leihmutter eingesetzt wird. Zusammen mit den sozialen Eltern ist hier also die (Teil-)Elternschaft von bis zu fünf Personen denkbar. ⓘ
Derartige Kombinationen sind allerdings ethisch problematisch. In manchen Ländern sind Eizellspenden und/oder Leihmutterschaften deshalb verboten, in vielen anderen gesetzlich geregelt. In Polen scheiterte die katholische Kirche 2009 mit einer Initiative, IVF gesetzlich verbieten zu lassen. In Deutschland sind sowohl die Eizellspende als auch die Leihmutterschaft durch das Embryonenschutzgesetz verboten. Dagegen ist die Samenspende erlaubt, was angesichts des Gleichbehandlungsgrundsatzes kritisch diskutiert wird. Werden die Samen des Partners verwendet, spricht man von „homologer“, bei der Verwendung von Samen dritter (meist unbekannter) Spender von „heterologer“ Samenspende. ⓘ
Abtötung überzähliger Embryonen
Bei einer Mehrlingsschwangerschaft mit mehr als drei Föten besteht Gefahr sowohl für die körperliche (Eklampsie, Thrombo-Embolie) und seelische Gesundheit der Mutter, wie auch für die Kinder, da sie ein Geburtsgewicht von 1250 g (Minimumgewicht für eine gute Prognose für die körperliche und geistige Gesundheit) mit hoher Wahrscheinlichkeit so nicht erreichen. Hierfür soll nach Bundesärztekammer zunächst mit allen Mitteln versucht werden, die Schwangerschaft auf drei Föten zu begrenzen. Pro IVF-Zyklus dürfen demnach in Deutschland deshalb maximal drei Embryonen eingesetzt werden. Sollte es trotz aller Vorsicht, z. B. im Rahmen einer Hormontherapie, zu einer höhergradigen Mehrlingsschwangerschaft kommen, besteht die Möglichkeit der Mehrlingsreduktion durch Fetozid (intrauterine Tötung einzelner Föten) des am besten erreichbaren Fötus. Nur bei konkretem Anhalt für eine Gefährdung der Mutter oder der Kinder wäre im Einzelfall eine Reduktion auf unter drei Föten möglich. ⓘ
Sozialrechtliche Situation in Deutschland
Bis zum Jahre 2003 kamen die gesetzlichen Krankenkassen für vier volle Behandlungszyklen auf, inzwischen werden nur noch drei zur Hälfte übernommen. Die restlichen Kosten müssen selbst getragen werden. Die Kostenübernahme ist für Patienten in der gesetzlichen Krankenversicherung (GKV) in § 27a SGB V geregelt. Voraussetzung für eine Kostenübernahme ist: Das Paar muss verheiratet sein, es dürfen ausschließlich Ei- und Samenzellen der Ehegatten verwendet werden; Ehefrau und Ehemann müssen vor Behandlungsbeginn das 25. Lebensjahr vollendet haben; die Ehefrau darf bei Beginn der Behandlung das 40., der Ehemann das 50. Lebensjahr noch nicht vollendet haben; vor Beginn der Behandlung ist der Krankenkasse ein Behandlungsplan zur Genehmigung vorzulegen; zusätzliche Beratung der Ehegatten über die Maßnahmen von einem Arzt, welcher die Behandlung nicht selbst durchführt, über eine solche Behandlung und Überweisung des beratenden Arztes; bestehen einer hinreichenden Aussicht, dass durch die gewählte Behandlungsmethode eine Schwangerschaft herbeigeführt wird; es darf vorher keine Sterilisation des Mannes oder der Frau durchgeführt worden sein (Ausnahmen bedürfen der Genehmigung der Krankenkasse) und Durchführung eines HIV-Tests. Die Kostenübernahme ist darüber hinaus hinsichtlich der Anzahl der Behandlungsversuche begrenzt: bei der Insemination im Spontanzyklus bis zu achtmal, bei der Insemination nach hormoneller Stimulation bis zu dreimal, bei der In-vitro-Fertilisation bis zu dreimal, beim intratubaren Gameten-Transfer bis zu zweimal, bei der Intracytoplasmatischen Spermieninjektion bis zu dreimal. ⓘ
Sozialrechtliche Situation in Österreich
Bei bestimmten Indikationen übernimmt der österreichische IVF-Fonds seit dem Jahr 2000 bei bis zu vier IVF-Behandlungen 70 Prozent der Arzneimittel- und Behandlungskosten. Voraussetzung ist mindestens eine der folgenden medizinischen Indikationen: Beidseitig verschlossene oder sonst dauerhaft funktionsunfähige Eileiter, Endometriose, polyzystische Ovarien (PCO-Syndrom) oder seitens des Mannes Sterilität bzw. schwere männliche Infertilität. Das Paar muss in aufrechter Ehe oder in eheähnlicher Lebensgemeinschaft leben. Zum Zeitpunkt des Beginns des Versuches darf die Frau das 40. Lebensjahr (40. Geburtstag) und der Mann das 50. Lebensjahr (50. Geburtstag) noch nicht vollendet haben. Tritt bei einer Behandlung eine Schwangerschaft bis zur achten Woche ein (Herzschlag muss am Ultraschall ersichtlich sein), dann können wieder bis zu vier Behandlungszyklen beansprucht werden. Interessanterweise begründet in Österreich auch eine nachgewiesene Eileiterschwangerschaft 4 weitere Versuche, nicht jedoch der Abortus vor der 8. SSW. Des Weiteren ist im Gegensatz zu Deutschland, das die (Blastozyste)nkultur auch unter den restriktiven Bedingungen des Embryonenschutzgesetzes (ESchG) rechtlich zulässt, in Österreich die weitere Kultivierung aller imprägnierten Eizellen und damit auch aller entstehenden Embryonen sowie die anschließende Embryoselektion erlaubt. ⓘ
Sozialrechtliche Situation in der Schweiz
In der Schweiz werden die Kosten für eine In-vitro-Fertilisation nicht von der Krankenkasse übernommen. Einzig bei der Steuererklärung der Frau (des Ehepaars) besteht die Möglichkeit, die gesamten Auslagen als Krankheitskosten geltend zu machen und somit einen kleinen Teil der Ausgaben wieder einzusparen. ⓘ
Gesundheitliche und psychische Probleme
Bei den mit Hilfe von VF-Technologien gezeugten Kindern zeigte sich ein erhöhtes Risiko von organischen Fehlbildungen und funktionellen Veränderungen. Hierzu gehören „Fehlbildungen des Herzens, des muskuloskelettalen und des Zentralnervensystems sowie Frühgeburten und niedrige Geburtsgewichte“. ⓘ
Der Prozess einer IVF als sehr aufwendige Behandlung im Zuge einer künstlichen Befruchtung (z. B. im Vergleich zur Insemination) ist für beide beteiligten Partner eine starke Belastung. ⓘ
- Im psychischen Bereich stehen bei Mann und Frau gleichermaßen der – evtl. langjährige – erfolglose Kinderwunsch sowie der Leistungsdruck im Vordergrund. Der Kinderwunsch bzw. dessen Erfüllung liegt vermeintlich sehr nahe. Ohne Schwangerschaft verlaufene Behandlungszyklen können bis hin zu Depressionen führen. Im Extremfall kann die Beziehung auseinanderbrechen.
- Im gesundheitlichen Bereich ist vor allem die Frau betroffen. Die notwendigen, oftmals über Monate oder Jahre andauernden Hormonbehandlungen mit starken Dosen können zu Gemütsschwankungen, Gewichtszunahme, Ödemen, gesteigertem Infarktrisiko etc. führen. Die Entnahme der Eizellen stellt eine Operation mit allen zugeordneten Risiken (Infektion, Verletzung innerer Organe etc.) dar. Die Tatsache, dass auch bei einer vom Mann bedingten Kinderlosigkeit die Frau den körperlichen und medizinischen Hauptaufwand trägt, kann wiederum zu psychischem Druck und partnerschaftlichen Problemen führen.
- Nicht nur für die Kinderwunschpatienten stellt die IVF eine psychische Belastung dar. Psychologen warnen vor späteren psychischen Beeinträchtigungen von im Reagenzglas gezeugten Kindern. Diese haben unter Umständen Schwierigkeiten mit ihrer eigenen Abstammung, wenn bei der IVF auf anonyme Gametenspenden zurückgegriffen wurde. So müssen Eltern bei jedem vierten Kind mit psychischen Auffälligkeiten rechnen. ⓘ
Trotz dieses Problemkomplexes ist teilweise zu beobachten, dass Paare auch bei anhaltendem Misserfolg immer wieder eine erneute Behandlung auf sich nehmen – mitunter auch auf eigene Kosten. ⓘ
Wirtschaftliche Aspekte
In Deutschland gibt es rund 125 Kliniken und Fachzentren, die In-vitro-Fertilisationen anbieten. Sie führen jährlich etwa 70.000 Behandlungen durch, wobei eine Behandlung im Schnitt etwa 4.000 Euro kostet. So waren es 2016 bereits mehr als 90.000 Behandlungen, Tendenz weiterhin steigend. 2007 wurden 11.500 Kinder nach künstlicher Befruchtung geboren. Die weltweiten Aufwendungen für In-vitro-Fertilisation wurden im Jahr 2010 auf 6 Milliarden Euro pro Jahr geschätzt. Davon entfallen circa 2,4 Milliarden Euro auf die USA und 300 Millionen Euro auf Deutschland, was insgesamt etwa 0,1 % aller Gesundheitsausgaben in Deutschland ausmacht. Etwa ein Viertel des Umsatzes entfällt auf Fruchtbarkeitsmedikamente; bei diesen ist die Merck KGaA aus Darmstadt Weltmarktführer. Der Geschäftsbereich Fruchtbarkeit von Merck steuerte 2009 mit einem Umsatz von 600 Millionen Euro etwa ein Zehntel des gesamten Pharmageschäfts von Merck bei. Merck ist damit auch das einzige Pharmaunternehmen, für das die Reproduktionsmedizin eine nennenswerte Rolle spielt. ⓘ
Kosten und Finanzierung in Österreich
Ein Anbieter von IVF – und intracytoplasmatischen Spermieninjektion (ICSI) – in Wien verrechnet Kosten von rund 2700 € im Fall von Frauen unter 35 Jahren oder 2900 € bei 35–40-Jährigen. ICSI ist jeweils etwa 10 % teurer. Diese Beträge gelten ohne Steuern. Die Leistungen inkludieren Beratung, Medikamente, und die IVF bis hin zur Feststellung oder auch Nicht-Feststellung einer Schwangerschaft. (Stand November 2018) ⓘ
Liegen bestimmte medizinischen Indikationen vor, etwa entfernte oder funktionsunfähige Eileiter (ausgenommen als Folge einer beabsichtigten Eileiterunterbindung), so übernimmt seit dem Inkrafttreten des IVF-Fondsgesetzes mit 1. Jänner 2000 (zuletzt 2018 geändert) der beim Bundesministerium für Arbeit, Soziales, Gesundheit und Konsumentenschutz (BMASGK) eingerichtete IVF-Fonds unter bestimmten Bedingungen 70 % der anfallenden Kosten. Derart kofinanzierte IVF-Versuche werden anonymisiert im IVF-Register statistisch erfasst, für das Jahr 2017 10.216 Versuche. ⓘ
Es gibt 29 Vertragszentren laut IVF-Fonds-Gesetz, davon 22 private und 7 öffentliche, in 6 Bundesländern (nicht in: Bgld., Ktn., NÖ). ⓘ
Vertauschung von zwei Embryos in derselben Familie
Laut ORF, der Spiegel zitiert, ist es im Jahr 1990 in einer Kinderwunschpraxis in Österreich zu zwei Vertauschungen von zwei unterschiedlichen Embryos in derselben Familie gekommen. Diese wurden 2014 durch einen Abgleich von DNA-Analysen zwischen austragender Mutter und IVF-Kind entdeckt. Das Ehepaar, welches im Juli 1990 in Österreich in einer Kinderwunschklinik war und aus deren Behandlung die erste Tochter hervorgeht, stellte mittels DNA-Test fest, dass es sich nicht um ihre biologische Tochter handelt. Weiterhin ist die zweite Behandlung, welche im Januar 1992 ebenfalls in Österreich bei demselben Arzt stattgefunden hat und aus der eine zweite Tochter hervorgeht, die biologische Mutter des Kindes, der Vater ist jedoch auch nicht der Vater der zweiten Tochter. Beide Kinder sind noch immer auf der Suche nach ihren biologischen Eltern. Die Auswirkungen eines derartigen Vertauschungsvorfalls sind sowohl in tatsächlicher als auch rechtlicher Hinsicht immens. ⓘ