Dimethylsulfoxid
| |||
|
| |||
 Eine Probe von Dimethylsulfoxid
| |||
| Bezeichnungen | |||
|---|---|---|---|
| Bevorzugter IUPAC-Name
(Methansulfinyl)methan | |||
| Systematische IUPAC-Bezeichnung
(Methansulfinyl)methan (substitutiv) Dimethyl(oxido)schwefel (Zusatzstoff) | |||
| Andere Namen
Methylsulfinylmethan
Methylsulfoxid | |||
| Bezeichner | |||
3D-Modell (JSmol)
|
|||
| Abkürzungen | DMSO, Me2SO | ||
Beilstein-Referenz
|
506008 | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
| EC-Nummer |
| ||
Gmelin Referenz
|
1556 | ||
| KEGG | |||
| MeSH | Dimethyl+Sulfoxid | ||
PubChem CID
|
|||
| RTECS-Nummer |
| ||
| UNII | |||
InChI
| |||
SMILES
| |||
| Eigenschaften | |||
Chemische Formel
|
C2H6OS | ||
| Molare Masse | 78,13 g-mol-1 | ||
| Erscheinungsbild | Farblose Flüssigkeit | ||
| Dichte | 1.1004 g⋅cm-3 | ||
| Schmelzpunkt | 19 °C (66 °F; 292 K) | ||
| Siedepunkt | 189 °C (372 °F; 462 K) | ||
Löslichkeit in Wasser
|
mischbar | ||
| Löslichkeit in Diethylether | Nicht löslich | ||
| Dampfdruck | 0,556 Millibar oder 0,0556 kPa bei 20 °C | ||
| Azidität (pKa) | 35 | ||
Brechungsindex (nD)
|
1.479 εr = 48 | ||
| Viskosität | 1,996 cP bei 20 °C | ||
| Struktur | |||
Punktgruppe
|
Cs | ||
Molekulare Form
|
Trigonal pyramidal | ||
Dipolmoment
|
3.96 D | ||
| Pharmakologie | |||
ATC-Code
|
G04BX13 (WER) M02AX03 (WER) | ||
| Gefährdungen | |||
| Sicherheit und Gesundheitsschutz am Arbeitsplatz (OHS/OSH): | |||
Hauptgefahren
|
Reizend und entzündlich | ||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | 89 °C (192 °F; 362 K) | ||
| Sicherheitsdatenblatt (SDS) | Oxford MSDS | ||
| Verwandte Verbindungen | |||
Verwandte Sulfoxide
|
Diethylsulfoxid | ||
Verwandte Verbindungen
|
| ||
Wenn nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |||
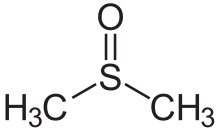
Dimethylsulfoxid (DMSO) ist eine schwefelorganische Verbindung mit der Formel (CH3)2SO. Diese farblose Flüssigkeit ist das am häufigsten kommerziell genutzte Sulfoxid. Es ist ein wichtiges polares aprotisches Lösungsmittel, das sowohl polare als auch unpolare Verbindungen löst und mit einer Vielzahl organischer Lösungsmittel sowie mit Wasser mischbar ist. Es hat einen relativ hohen Siedepunkt. DMSO hat die ungewöhnliche Eigenschaft, dass viele Menschen einen knoblauchartigen Geschmack im Mund wahrnehmen, nachdem DMSO mit ihrer Haut in Berührung gekommen ist. ⓘ
Von der chemischen Struktur her hat das Molekül eine idealisierte Cs-Symmetrie. Es hat eine trigonale pyramidale Molekülgeometrie, die mit anderen dreikoordinierten S(IV)-Verbindungen übereinstimmt, mit einem nicht gebundenen Elektronenpaar an dem annähernd tetraedrischen Schwefelatom. ⓘ
Darstellung und Gewinnung
Technisch wird Dimethylsulfoxid aus Dimethylsulfid z. B. durch katalytische Oxidation mit Distickstofftetroxid in Anwesenheit von Sauerstoff hergestellt. Im Labor kann der Thioether Dimethylsulfid mit stöchiometrischen Mengen Wasserstoffperoxid oder verdünnter Salpetersäure oxidiert werden. Das Dimethylsulfoxid kann allerdings weiter zu Dimethylsulfon oxidiert werden:

DMSO fällt daneben als Nebenprodukt bei der Zellstoffherstellung an. ⓘ
Reaktionen
Reaktionen mit Elektrophilen
Das Schwefelzentrum in DMSO ist nucleophil gegenüber weichen Elektrophilen und der Sauerstoff ist nucleophil gegenüber harten Elektrophilen. Mit Methyljodid bildet es Trimethylsulfoxoniumjodid, [(CH3)3SO]I:
- (CH3)2SO + CH3I → [(CH3)3SO]I ⓘ
Dieses Salz kann mit Natriumhydrid deprotoniert werden, um das Schwefeljodid zu bilden:
- [(CH3)3SO]I + NaH → (CH3)2S(CH2)O + NaI + H2 ⓘ
Säuregehalt
Die Methylgruppen von DMSO sind nur schwach sauer, mit einem pKa = 35. Aus diesem Grund wurden viele schwach basische organische Verbindungen in diesem Lösungsmittel auf ihre Basizität hin untersucht. ⓘ
Die Deprotonierung von DMSO erfordert starke Basen wie Lithiumdiisopropylamid und Natriumhydrid. Die Stabilisierung des entstehenden Carbanions wird durch die S(O)R-Gruppe gewährleistet. Das auf diese Weise gebildete Natriumderivat von DMSO wird als Dimsylnatrium bezeichnet. Es ist eine Base, z. B. für die Deprotonierung von Ketonen zur Bildung von Natriumenolaten, Phosphoniumsalzen zur Bildung von Wittig-Reagenzien und Formamidiniumsalzen zur Bildung von Diaminocarbenen. Es ist auch ein starkes Nukleophil. ⓘ
Oxidationsmittel
In der organischen Synthese wird DMSO als mildes Oxidationsmittel verwendet. Es bildet die Grundlage für mehrere selektive Sulfonium-basierte Oxidationsreaktionen wie die Pfitzner-Moffatt-Oxidation, die Corey-Kim-Oxidation und die Swern-Oxidation. Die Kornblum-Oxidation ist konzeptionell ähnlich. Bei all diesen Reaktionen wird eine intermediäre Sulfonium-Spezies gebildet (R2S+X, wobei X ein Heteroatom ist) ⓘ
Ligand und Lewis-Base
Aufgrund seiner Fähigkeit, viele Salze zu lösen, ist DMSO ein häufiger Ligand in der Koordinationschemie. Ein Beispiel hierfür ist der Komplex Dichlortetrakis(dimethylsulfoxid)ruthenium(II) (RuCl2(dmso)4). In diesem Komplex sind drei DMSO-Liganden über Schwefel an Ruthenium gebunden. Das vierte DMSO ist über Sauerstoff gebunden. Im Allgemeinen ist die sauerstoffgebundene Form häufiger anzutreffen. ⓘ
In Tetrachlorkohlenstofflösungen fungiert DMSO als Lewis-Base mit einer Reihe von Lewis-Säuren wie I2, Phenolen, Trimethylzinnchlorid, Metalloporphyrinen und dem Dimer Rh2Cl2(CO)4. Die Donoreigenschaften werden im ECW-Modell diskutiert. Die relative Donorstärke von DMSO gegenüber einer Reihe von Säuren im Vergleich zu anderen Lewis-Basen kann durch C-B-Plots veranschaulicht werden. ⓘ
Anwendungen
Lösungsmittel

DMSO ist ein polares aprotisches Lösungsmittel und weniger giftig als andere Vertreter dieser Klasse, wie Dimethylformamid, Dimethylacetamid, N-Methyl-2-pyrrolidon und Hexamethylphosphoramid (HMPA). DMSO wird häufig als Lösungsmittel für chemische Reaktionen mit Salzen verwendet, insbesondere für Finkelstein-Reaktionen und andere nukleophile Substitutionen. Es wird auch häufig als Extraktionsmittel in der Biochemie und Zellbiologie verwendet. Da DMSO nur schwach sauer ist, verträgt es relativ starke Basen und wird daher häufig für die Untersuchung von Carbanionen verwendet. Eine Reihe von nichtwässrigen pKa-Werten (C-H-, O-H-, S-H- und N-H-Aciditäten) für Tausende von organischen Verbindungen wurden in DMSO-Lösung bestimmt. ⓘ
Aufgrund seines hohen Siedepunkts von 189 °C (372 °F) verdampft DMSO bei normalem atmosphärischem Druck nur langsam. In DMSO gelöste Proben lassen sich im Vergleich zu anderen Lösungsmitteln nicht so leicht wiedergewinnen, da es sehr schwierig ist, alle Spuren von DMSO durch herkömmliche Rotationsverdampfung zu entfernen. Eine Technik zur vollständigen Rückgewinnung von Proben ist die Entfernung des organischen Lösungsmittels durch Verdampfen, gefolgt von der Zugabe von Wasser (um DMSO zu lösen) und Kryodesikkation, um sowohl DMSO als auch Wasser zu entfernen. In DMSO durchgeführte Reaktionen werden häufig mit Wasser verdünnt, um Produkte auszufällen oder phasenseparieren. Der relativ hohe Gefrierpunkt von DMSO von 18,5 °C (65,3 °F) bedeutet, dass es bei oder knapp unter Raumtemperatur ein Feststoff ist, was seine Verwendbarkeit in einigen chemischen Prozessen einschränken kann (z. B. Kristallisation bei Kühlung). ⓘ
In seiner deuterierten Form (DMSO-d6) ist es ein nützliches Lösungsmittel für die NMR-Spektroskopie, da es eine Vielzahl von Analyten auflösen kann, sein eigenes Spektrum einfach ist und es sich für NMR-Spektroskopiestudien bei hohen Temperaturen eignet. Nachteilig bei der Verwendung von DMSO-d6 ist seine hohe Viskosität, die die Signale verbreitert, und seine Hygroskopizität, die zu einer überwältigenden H2O-Resonanz im 1H-NMR-Spektrum führt. Es wird häufig mit CDCl3 oder CD2Cl2 gemischt, um die Viskosität und den Schmelzpunkt zu senken. ⓘ
DMSO wird auch verwendet, um Testverbindungen in In-vitro-Arzneimittelentdeckungs- und -entwicklungsprogrammen aufzulösen, einschließlich Hochdurchsatz-Screening-Programmen. Dies liegt daran, dass es sowohl polare als auch unpolare Verbindungen auflösen kann, dass es zur Aufbewahrung von Stammlösungen von Prüfsubstanzen verwendet werden kann (wichtig bei der Arbeit mit einer großen chemischen Bibliothek), dass es leicht mit Wasser und Zellkulturmedien mischbar ist und dass es einen hohen Siedepunkt hat (dies verbessert die Genauigkeit der Konzentrationen von Prüfsubstanzen, indem es die Verdunstung bei Raumtemperatur verringert). Eine Einschränkung bei DMSO besteht darin, dass es das Wachstum und die Lebensfähigkeit von Zelllinien beeinträchtigen kann, wobei niedrige DMSO-Konzentrationen manchmal das Zellwachstum stimulieren und hohe DMSO-Konzentrationen manchmal die Zellen hemmen oder abtöten. ⓘ
DMSO wird auch als Vehikel in In-vivo-Studien von Testverbindungen verwendet. So wurde es beispielsweise als Co-Lösungsmittel eingesetzt, um die Aufnahme des Flavonolglykosids Icariin im Fadenwurm Caenorhabditis elegans zu unterstützen. Wie bei der Verwendung von DMSO in In-vitro-Studien gibt es auch bei Tiermodellen einige Einschränkungen. Es kann zu pleiotropen Effekten kommen, und wenn die DMSO-Kontrollgruppen nicht sorgfältig geplant sind, können Lösemitteleffekte fälschlicherweise dem potenziellen Arzneimittel zugeschrieben werden. So hat beispielsweise selbst eine sehr niedrige DMSO-Dosis eine starke Schutzwirkung gegen Paracetamol (Paracetamol) -induzierte Leberschäden bei Mäusen. ⓘ
Darüber hinaus findet DMSO zunehmend Verwendung in Herstellungsverfahren für mikroelektronische Geräte. Es wird in großem Umfang zum Ablösen von Fotolack in TFT-LCD-Flachbildschirmen und bei fortgeschrittenen Verpackungsanwendungen (z. B. Wafer-Level-Packaging/Lötstoppmusterung) verwendet. DMSO ist auch ein wirksames Abbeizmittel, das sicherer ist als viele andere, wie Nitromethan und Dichlormethan. ⓘ

Biologie
DMSO wird in der Polymerase-Kettenreaktion (PCR) verwendet, um Sekundärstrukturen in der DNA-Vorlage oder den DNA-Primern zu hemmen. Es wird der PCR-Mischung vor der Reaktion zugesetzt, wo es die Selbstkomplementarität der DNA beeinträchtigt und so Störreaktionen minimiert. ⓘ
DMSO in einer PCR eignet sich für supergewickelte Plasmide (um sie vor der Amplifikation zu entspannen) oder DNA-Vorlagen mit hohem GC-Gehalt (um die Thermostabilität zu verringern). Beispielsweise senkt eine Endkonzentration von 10 % DMSO in der PCR-Mischung mit Phusion die Primer-Annealing-Temperatur (d. h. die Primer-Schmelztemperatur) um 5,5-6,0 °C (9,9-10,8 °F). ⓘ
Es ist als reversibler Zellzyklus-Arrester in der Phase G1 menschlicher lymphatischer Zellen bekannt. ⓘ
DMSO kann auch als Kälteschutzmittel verwendet werden, das dem Zellmedium zugesetzt wird, um die Eisbildung zu verringern und dadurch den Zelltod während des Gefrierprozesses zu verhindern. Etwa 10 % können mit einem langsamen Einfrierverfahren verwendet werden, und die Zellen können bei -80 °C eingefroren oder sicher in flüssigem Stickstoff gelagert werden. ⓘ
In der Zellkultur wird DMSO verwendet, um die Differenzierung von P19-Embryonalkarzinomzellen in Kardiomyozyten und Skelettmuskelzellen zu induzieren. ⓘ
Medizin
Die Verwendung von DMSO in der Medizin geht auf das Jahr 1963 zurück, als ein Team der Oregon Health & Science University Medical School unter der Leitung von Stanley Jacob entdeckte, dass DMSO die Haut und andere Membranen durchdringen kann, ohne sie zu beschädigen, und andere Verbindungen in ein biologisches System transportieren kann. In der Medizin wird DMSO vor allem als topisches Analgetikum, als Vehikel für die topische Anwendung von Arzneimitteln, als Entzündungshemmer und als Antioxidans verwendet. Da DMSO die Absorptionsrate einiger Verbindungen durch biologisches Gewebe, einschließlich der Haut, erhöht, wird es in einigen Systemen zur transdermalen Verabreichung von Arzneimitteln verwendet. Seine Wirkung kann durch den Zusatz von EDTA noch verstärkt werden. Es wird häufig mit Antimykotika gemischt, damit diese nicht nur die Haut, sondern auch Fuß- und Fingernägel durchdringen können. ⓘ
DMSO wurde für die Behandlung zahlreicher Krankheiten und Leiden untersucht, aber die US Food and Drug Administration (FDA) hat seine Verwendung nur für die symptomatische Linderung von Patienten mit interstitieller Blasenentzündung zugelassen. Eine Studie aus dem Jahr 1978 kam zu dem Schluss, dass DMSO bei der Mehrheit der 213 untersuchten Patienten mit entzündlichen Erkrankungen des Urogenitaltrakts eine deutliche Linderung brachte. Die Autoren empfahlen DMSO für entzündliche Erkrankungen des Urogenitaltrakts, die nicht durch eine Infektion oder einen Tumor verursacht wurden und bei denen die Symptome schwerwiegend waren oder die Patienten nicht auf eine konventionelle Therapie ansprachen. ⓘ
In der interventionellen Radiologie wird DMSO als Lösungsmittel für Ethylenvinylalkohol im flüssigen Emboliemittel Onyx verwendet, das bei der Embolisation, dem therapeutischen Verschluss von Blutgefäßen, eingesetzt wird. ⓘ
In der Kryobiologie wurde DMSO als Kryoprotektivum verwendet und ist auch heute noch ein wichtiger Bestandteil von Kryoprotektivum-Vitrifikationsmischungen, die zur Konservierung von Organen, Geweben und Zellsuspensionen verwendet werden. Ohne dieses Mittel werden bis zu 90 % der eingefrorenen Zellen inaktiv. Es ist besonders wichtig für das Einfrieren und die langfristige Lagerung von embryonalen Stammzellen und hämatopoetischen Stammzellen, die häufig in einer Mischung aus 10 % DMSO, einem Gefriermedium und 30 % fötalem Rinderserum eingefroren werden. Beim kryogenen Einfrieren von heteroploiden Zelllinien (MDCK, VERO usw.) wird eine Mischung aus 10 % DMSO mit 90 % EMEM (70 % EMEM + 30 % fötales Rinderserum + Antibiotikamischung) verwendet. Im Rahmen einer autologen Knochenmarktransplantation wird das DMSO zusammen mit den eigenen hämatopoetischen Stammzellen des Patienten re-infundiert. ⓘ
DMSO wird durch Disproportionierung zu Dimethylsulfid und Dimethylsulfon metabolisiert. Es unterliegt der renalen und pulmonalen Ausscheidung. Eine mögliche Nebenwirkung von DMSO ist daher ein erhöhter Dimethylsulfidspiegel im Blut, der ein blutbedingtes Mundgeruchssymptom verursachen kann. ⓘ
Alternative Medizin
DMSO wird als Alternativmedizin vermarktet. Seine Popularität als alternatives Heilmittel soll auf einen Dokumentarfilm von 60 Minutes im Jahr 1980 zurückzuführen sein, in dem ein früher Befürworter zu Wort kam. DMSO ist jedoch ein Bestandteil einiger Produkte, die von der amerikanischen Arzneimittelbehörde FDA als gefälschte Krebsheilmittel aufgelistet werden, und die FDA hat sich mit den Vertreibern angelegt. Eine dieser Vertreiberinnen ist Mildred Miller, die DMSO für eine Reihe von Krankheiten anpries und daraufhin wegen Medicare-Betrugs verurteilt wurde. ⓘ
Die Verwendung von DMSO als alternative Behandlung von Krebs ist besonders besorgniserregend, da es nachweislich mit einer Reihe von Chemotherapie-Medikamenten, darunter Cisplatin, Carboplatin und Oxaliplatin, interferiert. Es gibt keine ausreichenden Beweise für die Hypothese, dass DMSO irgendeine Wirkung hat, und die meisten Quellen stimmen darin überein, dass seine Geschichte von Nebenwirkungen bei Tests Vorsicht bei der Verwendung als Nahrungsergänzungsmittel rechtfertigt, wofür es mit dem üblichen Haftungsausschluss stark vermarktet wird. ⓘ
Veterinärmedizin
DMSO wird in der Tiermedizin häufig als Einreibemittel für Pferde verwendet, allein oder in Kombination mit anderen Inhaltsstoffen. Im letzteren Fall dient DMSO häufig als Lösungsmittel, um die anderen Inhaltsstoffe über die Haut zu transportieren. Auch bei Pferden wird DMSO intravenös verwendet, wiederum allein oder in Kombination mit anderen Arzneimitteln. Es wird allein zur Behandlung von erhöhtem Hirndruck und/oder Hirnödemen bei Pferden eingesetzt. ⓘ
Geschmack
Der wahrgenommene Knoblauchgeschmack bei Hautkontakt mit DMSO ist möglicherweise auf eine nichtolfaktorische Aktivierung der TRPA1-Rezeptoren in den Trigeminalganglien zurückzuführen. Im Gegensatz zu Dimethyl- und Diallyldisulfiden (die einen knoblauchähnlichen Geruch haben), Mono- und Trisulfiden (die typischerweise einen üblen Geruch haben) und ähnlichen geruchsintensiven Schwefelverbindungen ist das reine chemische DMSO geruchlos. ⓘ
Sicherheit
Toxizität
DMSO ist ein ungiftiges Lösungsmittel mit einer mittleren tödlichen Dosis, die höher ist als die von Ethanol (DMSO: LD50, oral, Ratte, 14.500 mg/kg; Ethanol: LD50, oral, Ratte, 7.060 mg/kg). ⓘ
Frühe klinische Versuche mit DMSO wurden aufgrund von Sicherheitsbedenken, insbesondere wegen seiner Fähigkeit, das Auge zu schädigen, eingestellt. Zu den am häufigsten berichteten Nebenwirkungen gehören Kopfschmerzen sowie Brennen und Juckreiz bei Hautkontakt. Es wurde von starken allergischen Reaktionen berichtet. DMSO kann dazu führen, dass Schadstoffe, Toxine und Arzneimittel über die Haut aufgenommen werden, was unerwartete Auswirkungen haben kann. Es wird angenommen, dass DMSO die Wirkung von Blutverdünnern, Steroiden, Herzmedikamenten, Beruhigungsmitteln und anderen Medikamenten verstärkt. In einigen Fällen könnte dies schädlich oder gefährlich sein. ⓘ
In Australien ist DMSO als Medikament der Liste 4 (S4) aufgeführt, und ein Unternehmen wurde strafrechtlich verfolgt, weil es Produkten als Konservierungsmittel zugesetzt wurde. ⓘ
Da DMSO leicht in die Haut eindringt, können in DMSO gelöste Stoffe schnell absorbiert werden. Die Wahl der Handschuhe ist bei der Arbeit mit DMSO wichtig. Empfohlen werden Butylkautschuk-, Fluorelastomer-, Neopren- oder dicke (15 mil / 0,4 mm) Latexhandschuhe. Nitrilhandschuhe, die in chemischen Laboratorien sehr häufig verwendet werden, können zwar bei kurzem Kontakt schützen, bauen sich aber bei Kontakt mit DMSO schnell ab. ⓘ
Am 9. September 1965 berichtete das Wall Street Journal, dass ein Hersteller der Chemikalie davor gewarnt hatte, dass der Tod einer irischen Frau nach einer DMSO-Behandlung wegen eines verstauchten Handgelenks möglicherweise auf die Behandlung zurückzuführen war, obwohl weder eine Autopsie durchgeführt noch ein kausaler Zusammenhang festgestellt wurde. Die klinische Forschung mit DMSO wurde eingestellt und erst wieder aufgenommen, als die National Academy of Sciences (NAS) 1972 Erkenntnisse zugunsten von DMSO veröffentlichte. 1978 wurde DMSO von der US-amerikanischen Gesundheitsbehörde FDA für die Behandlung der interstitiellen Zystitis zugelassen. 1980 veranstaltete der US-Kongress eine Anhörung zu Behauptungen, dass die FDA DMSO nur langsam für andere medizinische Zwecke zulässt. Im Jahr 2007 erteilte die US-amerikanische FDA eine Schnellzulassung für klinische Studien über die Verwendung von DMSO zur Verringerung von Hirngewebeschwellungen nach traumatischen Hirnverletzungen. Die Exposition von sich entwickelnden Mäusegehirnen gegenüber DMSO kann zu einer Degeneration des Gehirns führen. Diese Neurotoxizität konnte bereits bei einer Dosis von 0,3 ml/kg festgestellt werden, ein Wert, der bei Kindern, die während einer Knochenmarktransplantation DMSO ausgesetzt waren, überschritten wurde. ⓘ
In die Kanalisation eingeleitetes DMSO kann auch zu Geruchsproblemen in kommunalen Abwässern führen: Abwasserbakterien wandeln DMSO unter hypoxischen (anoxischen) Bedingungen in Dimethylsulfid (DMS) um, das einen stark unangenehmen Geruch hat, der an verfaulten Kohl erinnert. Chemisch reines DMSO ist jedoch geruchlos, da es keine C-S-C- (Sulfid) und C-S-H- (Mercaptan) Bindungen aufweist. Die Desodorierung von DMSO wird durch die Entfernung der enthaltenen geruchsintensiven Verunreinigungen erreicht. ⓘ
Explosionsgefahr
Die Verbindung beginnt sich am Normaldrucksiedepunkt bei 189 °C thermisch zu zersetzen, was heftig bis explosionsartig erfolgen kann. Die Zersetzung wird durch Säuren oder Basen katalysiert, so dass diese schon bei wesentlich niedrigeren Temperaturen relevant werden kann. Eine heftige bis explosionsartige Zersetzung erfolgt auch in Gegenwart von Halogenverbindungen, Metallnitraten, Metallperchloraten, Natriumhydrid, Periodsäure und von Fluorierungsmitteln. ⓘ
Dimethylsulfoxid kann mit Natriumhydrid oder Natriumamid unter Bildung eines Methylsulfinylcarbanions (Dimsylanion) deprotoniert werden, welches als sehr starkes nucleophiles Reagenz in der organischen Synthese verwendet wird. Die Reaktionsgemische können sich oberhalb von 70 °C explosionsartig zersetzen. Es besteht auch beim Isolieren des festen Natriumsalzes Explosionsgefahr. ⓘ
Dimethylsulfoxid kann eine explosive Reaktion auslösen, wenn es Acylchloriden ausgesetzt wird; bei einer niedrigen Temperatur erzeugt diese Reaktion das Oxidationsmittel für die Swern-Oxidation. ⓘ
Eigenschaften
Physikalische Eigenschaften
Dimethylsulfoxid ist eine farb- und geruchlose, hygroskopische Flüssigkeit. Nach längerer Lagerung weist es häufig einen fauligen Geruch (nach Dimethylsulfid) auf. Mit einem Schmelzpunkt bei 18 °C kann die Substanz nur wenig unterhalb der Raumtemperatur erstarren. Die Schmelzenthalpie beträgt 14,37 kJ·mol−1. Bei Normaldruck siedet die Verbindung bei 189 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,49107, B = 1807,002 und C = −60,995 im Temperaturbereich von 325,5 bis 442,1 K. bzw. mit A = 5,23039, B = 2239,161 und C = −29,215 im Temperaturbereich von 293 bis 323 K. Es ist in jedem Verhältnis mit Wasser mischbar, weiterhin mit vielen organischen Lösemitteln wie Alkoholen, Carbonsäureestern, Ketonen, und chlorierten Kohlenwasserstoffen. Es gehört der Gruppe nukleophiler, aprotischer, dipolarer Lösemittel an (wie zum Beispiel Dimethylformamid). ⓘ
DMSO-Molekül mit Bindungslängen und -winkeln ⓘ
Sicherheitstechnische Kenngrößen
Dimethylsulfoxid bildet oberhalb des Flammpunktes bei 88 °C entzündbare Dampf-Luft-Gemische. Die untere Explosionsgrenze liegt bei 1,8 Vol.‑% (58 g/m³). Eine obere Explosionsgrenze (OEG) kann wegen der thermischen Zersetzung der Substanz nicht bestimmt werden. Die Sauerstoffgrenzkonzentration wurde bei 200 °C mit 3,9 Vol% bestimmt. Die Zündtemperatur beträgt 270 °C. Der Stoff fällt somit in die Temperaturklasse T3. Die elektrische Leitfähigkeit ist mit 2·10−7 S·m−1 eher gering. ⓘ
Pharmakologie
Dimethylsulfoxid hat entzündungshemmende (antiphlogistische) und schmerzlindernde (analgetische) Eigenschaften. Es findet daher therapeutische Verwendung als perkutanes (lat. durch die Haut) Arzneimittel zur Behandlung lokaler Schmerzzustände (beispielsweise bei Sportverletzungen oder rheumatischen Beschwerden). Da DMSO bei Blutergüssen zum schnellen Abschwellen beiträgt, wird es bei Bedarf besonders in Kampfsportarten angewandt. Eine Studie aus Brasilien konnte zeigen, dass DMSO-Gel in Kombination mit therapeutischem Ultraschall gegenüber anderen Behandlungsformen (bzw. keiner Behandlung) signifikant bessere Ergebnisse im Hinblick auf das Abschwellen stumpfer Verletzungen aufweisen. ⓘ
Seine besondere Fähigkeit ist das leichte Eindringen in Haut und andere Zellmembranen. Es dient daher als Trägersubstanz bei auf der Haut angewendeten Arzneimitteln (Salben, Gele, Pflaster, Tinkturen) zur Einschleusung der Wirkstoffe wie Schmerzmittel als sogenannter Transportvermittler (auch Penetrationsverstärker, Schleppersubstanzen genannt), d. h., in DMSO gelöste Substanzen werden leicht vom Organismus durch die Haut aufgenommen. Das gilt auch für Gifte, die sonst keine oder schwach wirksame Kontaktgifte darstellen, wie Cyanide. Daher müssen Lösungen von als toxisch geltenden Verbindungen sofort, wenn diese auf die Haut gelangen, mit geeigneten Mitteln (z. B. Wasser) abgespült werden. ⓘ
Dimethylsulfoxid ist in keiner Kombination mehr im deutschen Arzneimittelhandel verfügbar. Es besitzt bei intravenöser Anwendung verschiedene toxische Eigenschaften, die sich auf Herz, Nerven, Magen-Darm-Trakt auswirken und darüber hinaus wurden allergische Reaktionen beschrieben. ⓘ







