Fragiles-X-Syndrom
| Fragiles X-Syndrom ⓘ | |
|---|---|
| Andere Namen | Martin-Bell-Syndrom, Escalante-Syndrom |
 | |
| Junge mit abstehenden Ohren, die für das fragile X-Syndrom charakteristisch sind | |
| Fachgebiet | Medizinische Genetik, Pädiatrie, Psychiatrie |
| Symptome | Geistige Behinderung, langes und schmales Gesicht, große Ohren, flexible Finger, große Hoden |
| Komplikationen | Autismus-Merkmale, Krampfanfälle |
| Übliches Auftreten | Bemerkbar im Alter von 2 Jahren |
| Dauer | Lebenslang |
| Ursachen | Genetisch bedingt (X-chromosomal rezessiv) |
| Diagnostische Methode | Genetischer Test |
| Behandlung | Unterstützende Behandlung, Frühintervention |
| Häufigkeit | 1 von 4.000 (Männer), 1 von 8.000 (Frauen) |
Das Fragile-X-Syndrom (FXS) ist eine genetische Störung, die durch eine leichte bis mittelschwere geistige Behinderung gekennzeichnet ist. Der durchschnittliche IQ von Männern mit FXS liegt unter 55, während etwa zwei Drittel der betroffenen Frauen intellektuell behindert sind. Zu den körperlichen Merkmalen können ein langes und schmales Gesicht, große Ohren, flexible Finger und große Hoden gehören. Etwa ein Drittel der Betroffenen weist autistische Merkmale auf, wie z. B. Probleme mit sozialen Interaktionen und verzögerte Sprache. Hyperaktivität ist häufig, und bei etwa 10 % treten Krampfanfälle auf. Männer sind in der Regel häufiger betroffen als Frauen. ⓘ
Diese Störung und der Befund des Fragilen X-Syndroms wird X-chromosomal rezessiv vererbt. Es wird in der Regel durch eine Expansion des CGG-Triplettrepeats innerhalb des FMR1-Gens (Fragile X Messenger Ribonucleoprotein 1) auf dem X-Chromosom verursacht. Dadurch wird dieser Teil des Gens zum Schweigen gebracht (Methylierung), was zu einem Mangel an dem daraus resultierenden Protein (FMRP) führt, das für die normale Entwicklung von Verbindungen zwischen Neuronen erforderlich ist. Die Diagnose erfordert einen Gentest zur Bestimmung der Anzahl der CGG-Wiederholungen im FMR1-Gen. Normalerweise gibt es zwischen 5 und 40 Wiederholungen; das fragile X-Syndrom tritt mit mehr als 200 auf. Von einer Prämutation spricht man, wenn das Gen zwischen 40 und 200 Wiederholungen aufweist; Frauen mit einer Prämutation haben ein erhöhtes Risiko, ein betroffenes Kind zu bekommen. Ein Test auf Prämutationsträger kann eine genetische Beratung ermöglichen. ⓘ
Es gibt keine Heilung. Eine frühzeitige Intervention wird empfohlen, da sie die besten Voraussetzungen für die Entwicklung aller Fähigkeiten bietet. Diese Interventionen können Sonderschulunterricht, Sprachtherapie, Physiotherapie oder Verhaltenstherapie umfassen. Medikamente können zur Behandlung von Krampfanfällen, Stimmungsproblemen, aggressivem Verhalten oder ADHS eingesetzt werden. Das Fragile-X-Syndrom tritt schätzungsweise bei 1,4 von 10.000 Männern und 0,9 von 10.000 Frauen auf. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| Q99.2 | Fragiles X-Chromosom
Syndrom des fragilen X-Chromosoms |
| ICD-10 online (WHO-Version 2019) | |
Das Fragiles-X-Syndrom (FXS) ist eine der häufigsten Ursachen erblicher kognitiver Behinderung des Menschen. Ursache hierfür ist eine genetische Veränderung auf dem X-Chromosom, die Mutation eines expandierenden Trinukleotidrepeats im Gen FMR1 (fragile X mental retardation 1). Die Behinderung, die zu den X-chromosomalen mentalen Retardierungen gezählt wird, kann in ihrer Schwere stark variieren und von leichten Lernschwierigkeiten bis zu extremer kognitiver Beeinträchtigung reichen. ⓘ
Das Syndrom wird nach seinen Erstbeschreibern auch als Martin-Bell-Syndrom (MBS) oder Marker-X-Syndrom sowie in der abgekürzten Form als fra(X)-Syndrom bezeichnet. Dieser Name leitet sich aus der Beobachtung von Zellkulturen betroffener Menschen ab: Unter entsprechenden Kulturbedingungen wird in einem Teil der Zellen durch Abnahme des Kondensationsgrades des X-chromosomalen Chromatins in der betroffenen Region eine scheinbare Bruchstelle, der sogenannte fragile Bereich, beobachtet. ⓘ
Anzeichen und Symptome

Die meisten Kleinkinder zeigen keine körperlichen Anzeichen von FXS. Erst in der Pubertät beginnen sich die körperlichen Merkmale von FXS zu entwickeln. Abgesehen von der geistigen Behinderung können zu den auffälligen Merkmalen des Syndroms ein längliches Gesicht, große oder abstehende Ohren, Plattfüße, größere Hoden (Makroorchismus) und ein geringer Muskeltonus gehören. Wiederkehrende Mittelohrentzündungen und Nasennebenhöhlenentzündungen sind in der frühen Kindheit häufig. Das Sprechen kann verworren oder nervös sein. Zu den Verhaltensmerkmalen gehören stereotype Bewegungen (z. B. Händeklatschen) und eine atypische soziale Entwicklung, insbesondere Schüchternheit, eingeschränkter Augenkontakt, Gedächtnisprobleme und Schwierigkeiten beim Erkennen von Gesichtern. Einige Personen mit fragilem X-Syndrom erfüllen auch die Diagnosekriterien für Autismus. ⓘ
Männer mit einer Vollmutation weisen eine praktisch vollständige Penetranz auf und zeigen daher fast immer Symptome von FXS, während Frauen mit einer Vollmutation aufgrund eines zweiten, normalen X-Chromosoms im Allgemeinen eine Penetranz von etwa 50 % aufweisen. Bei Frauen mit FXS können die Symptome von leicht bis schwer reichen, obwohl sie im Allgemeinen weniger betroffen sind als Männer. ⓘ
Vom FXS können sowohl Männer als auch Frauen betroffen sein. Das Leitsymptom ist eine unterschiedlich stark ausgeprägte Intelligenzminderung, deren Schwere von Lernproblemen bis hin zu schwergradiger kognitiver Beeinträchtigung reichen kann und mit Sprachstörungen und Aufmerksamkeitsdefiziten einhergeht. ⓘ
Bei Kindern sind bei etwa 12 % der Betroffenen autistische Verhaltensweisen, wie z. B. wenig Augenkontakt, soziale Phobie, Übererregbarkeit und Überempfindlichkeit auf bestimmte Stimuli und repetitives Verhalten, ausgeprägt, beinahe 20 % der Kinder bekommen Krampfanfälle (Epilepsie). ⓘ
Bei Frauen sind die Symptome häufig milder ausgeprägt, was auf die zufällige Inaktivierung eines der beiden X-Chromosomen in weiblichen Zellen zurückzuführen ist (Lyon-Hypothese). ⓘ
Bei etwa 50 % finden sich eine abnorme Bänderlockerheit, bei 20 % flexible Plattfüße und gelegentlich eine Skoliose. ⓘ
Physischer Phänotyp
- Große, abstehende Ohren (beide)
- Langes Gesicht (vertikaler Oberkieferüberschuss)
- Hochgewölbter Gaumen (im Zusammenhang mit dem oben Genannten)
- Überstreckbare Fingergelenke
- Überstreckbare Daumen ("doppelgelenkig")
- Plattfüße
- Weiche Haut
- Postpubertärer Makroorchismus (große Hoden bei Männern nach der Pubertät)
- Hypotonie (niedriger Muskeltonus) ⓘ
Intellektuelle Entwicklung
Menschen mit FXS können sich auf einem Kontinuum von Lernbehinderungen im Rahmen eines normalen Intelligenzquotienten (IQ) bis hin zu schweren geistigen Behinderungen bewegen, mit einem durchschnittlichen IQ von 40 bei Männern, bei denen das FMR1-Gen vollständig ausgeschaltet ist. Frauen, die tendenziell weniger betroffen sind, haben im Allgemeinen einen normalen oder grenzwertigen IQ mit Lernschwierigkeiten. Die Hauptschwierigkeiten bei Personen mit FXS betreffen das Arbeits- und Kurzzeitgedächtnis, die Exekutivfunktion, das visuelle Gedächtnis, die visuell-räumlichen Beziehungen und die Mathematik, wobei die verbalen Fähigkeiten relativ unbeeinträchtigt sind. ⓘ
Die Daten zur intellektuellen Entwicklung bei FXS sind begrenzt. Es gibt jedoch einige Hinweise darauf, dass der standardisierte IQ in den meisten Fällen im Laufe der Zeit abnimmt, offenbar als Folge einer verlangsamten intellektuellen Entwicklung. Eine Längsschnittstudie, in der Geschwisterpaare untersucht wurden, bei denen ein Kind betroffen war und das andere nicht, ergab, dass betroffene Kinder eine um 55 % langsamere intellektuelle Lernrate aufwiesen als nicht betroffene Kinder. ⓘ
Menschen mit FXS zeigen häufig Sprach- und Kommunikationsprobleme. Dies kann mit der Muskelfunktion des Mundes und den Defiziten des Frontallappens zusammenhängen. ⓘ
Autismus
Das Fragile-X-Syndrom tritt in vielen Fällen zusammen mit Autismus auf und ist in diesen Fällen eine vermutete genetische Ursache für den Autismus. Dieser Befund hat dazu geführt, dass ein Screening auf FMR1-Mutationen bei Kindern, bei denen Autismus diagnostiziert wurde, als obligatorisch angesehen wird. Die Prävalenz von gleichzeitigen Autismus-Spektrum-Störungen (ASD) bei Menschen mit fragilem X-Syndrom wird auf 15 bis 60 % geschätzt, wobei die Schwankungen auf unterschiedliche Diagnosemethoden und die hohe Häufigkeit autistischer Merkmale bei Menschen mit fragilem X-Syndrom zurückzuführen sind, die nicht die DSM-Kriterien für eine ASD erfüllen. ⓘ
Obwohl Menschen mit FXS Schwierigkeiten haben, Freundschaften zu schließen, haben Menschen mit FXS und ASD typischerweise auch Schwierigkeiten bei der gegenseitigen Unterhaltung mit Gleichaltrigen. Soziales Rückzugsverhalten, einschließlich Vermeidung und Gleichgültigkeit, scheinen die besten Prädiktoren für ASD bei FXS zu sein, wobei Vermeidung eher mit sozialer Angst korreliert zu sein scheint, während Gleichgültigkeit stärker mit ASD korreliert war. Wenn sowohl Autismus als auch FXS vorhanden sind, wird ein größeres Sprachdefizit und ein niedrigerer IQ beobachtet als bei Kindern mit nur FXS. ⓘ
Auch bei genetischen Mausmodellen von FXS wurden autismusähnliche Verhaltensweisen festgestellt. ⓘ
Soziale Interaktion
FXS ist durch soziale Ängstlichkeit gekennzeichnet, die sich unter anderem in schlechtem Augenkontakt, Abneigung gegen Blicke, einer verlängerten Zeitspanne bis zum Beginn einer sozialen Interaktion und Schwierigkeiten beim Aufbau von Beziehungen zu Gleichaltrigen äußert. Soziale Ängste gehören zu den häufigsten Merkmalen von FXS, wobei in einer Serie bis zu 75 % der männlichen Betroffenen als übermäßig schüchtern und 50 % als panisch beschrieben wurden. Soziale Ängste bei Menschen mit FXS hängen mit Problemen bei der Gesichtserkennung zusammen, also der Fähigkeit, ein Gesicht zu erkennen, das man schon einmal gesehen hat. ⓘ
Es hat den Anschein, dass Menschen mit FXS an sozialer Interaktion interessiert sind und ein größeres Einfühlungsvermögen zeigen als Menschen mit anderen Ursachen geistiger Behinderung, aber Angst und Rückzug zeigen, wenn sie in ungewohnte Situationen mit unbekannten Menschen kommen. Dies kann von leichtem sozialem Rückzug, der überwiegend mit Schüchternheit einhergeht, bis hin zu schwerem sozialem Rückzug reichen, der mit einer koexistierenden Autismus-Spektrum-Störung einhergehen kann. ⓘ
Bei Frauen mit FXS treten häufig Schüchternheit, soziale Ängste und soziales Vermeiden oder Zurückziehen auf. Darüber hinaus wurde festgestellt, dass die Prämutation bei Frauen mit sozialer Ängstlichkeit in Zusammenhang steht. ⓘ
Weibliche Personen mit FXS zeigen eine verminderte Aktivierung in den präfrontalen Regionen des Gehirns. ⓘ
Psychische Gesundheit
Eine Aufmerksamkeitsdefizit-Hyperaktivitätsstörung (ADHS) findet sich bei der Mehrheit der Männer mit FXS und bei 30 % der Frauen, womit dies die häufigste psychiatrische Diagnose bei Menschen mit FXS ist. Kinder mit Fragilem X haben eine sehr kurze Aufmerksamkeitsspanne, sind hyperaktiv und reagieren überempfindlich auf visuelle, auditive, taktile und olfaktorische Reize. Diese Kinder haben aufgrund der lauten Geräusche Schwierigkeiten in großen Menschenmengen, was zu Wutausbrüchen aufgrund von Hyperaktivität führen kann. Hyperaktivität und störendes Verhalten erreichen ihren Höhepunkt in den Vorschuljahren und nehmen dann mit zunehmendem Alter allmählich ab, obwohl die unaufmerksamen Symptome im Allgemeinen lebenslang bestehen bleiben. ⓘ
Neben den charakteristischen Merkmalen der Sozialphobie treten bei FXS sehr häufig eine Reihe anderer Angstsymptome auf, wobei die Symptome typischerweise eine Reihe psychiatrischer Diagnosen umfassen, aber keines der Kriterien vollständig erfüllen. Kinder mit FXS ziehen sich von leichten Berührungen zurück und können die Beschaffenheit von Materialien als irritierend empfinden. Übergänge von einem Ort zum anderen können für Kinder mit FXS schwierig sein. In einigen Fällen kann eine Verhaltenstherapie eingesetzt werden, um die Empfindlichkeit des Kindes zu verringern. Verhaltensweisen wie Händeklatschen und Beißen sowie Aggression können Ausdruck von Angst sein. ⓘ
Perseveration ist ein häufiges Kommunikations- und Verhaltensmerkmal bei FXS. Kinder mit FXS wiederholen eine bestimmte alltägliche Tätigkeit immer und immer wieder. Beim Sprechen besteht die Tendenz nicht nur darin, dieselbe Phrase zu wiederholen, sondern auch über dasselbe Thema zu sprechen. Verworrenes Sprechen und Selbstgespräche sind häufig zu beobachten. Selbstgespräche sind Selbstgespräche, bei denen verschiedene Töne und Tonhöhen verwendet werden. Obwohl nur eine Minderheit der FXS-Betroffenen die Kriterien für eine Zwangsstörung erfüllt, weist die überwiegende Mehrheit Symptome von Besessenheit auf. Da Personen mit FXS diese Verhaltensweisen jedoch im Allgemeinen als angenehm empfinden, werden sie im Gegensatz zu Personen mit Zwangsstörungen häufiger als stereotype Verhaltensweisen bezeichnet. ⓘ
Gemütssymptome bei Menschen mit FXS erfüllen selten die diagnostischen Kriterien für eine schwere Gemütsstörung, da sie in der Regel nicht von Dauer sind. Stattdessen sind sie in der Regel vorübergehend und stehen im Zusammenhang mit Stressfaktoren und können eine labile (schwankende) Stimmung, Reizbarkeit, Selbstverletzung und Aggression beinhalten. ⓘ
Bei Personen mit Fragilem X-assoziiertem Tremor/Ataxie-Syndrom (FXTAS) treten wahrscheinlich Kombinationen von Demenz-, Stimmungs- und Angststörungen auf. Bei Männern mit der FMR1-Prämutation und klinischen Hinweisen auf FXTAS wurde ein erhöhtes Auftreten von Somatisierung, Zwangsstörungen, zwischenmenschlicher Sensibilität, Depression, phobischer Angst und Psychotizismus festgestellt. ⓘ
Sehvermögen
Zu den ophthalmologischen Problemen gehört Strabismus. Dies muss frühzeitig erkannt werden, um eine Amblyopie zu vermeiden. Bei frühzeitiger Diagnose ist zur Behandlung des Schielens in der Regel eine Operation oder ein Pflaster erforderlich. Refraktionsfehler sind bei Patienten mit FXS ebenfalls häufig. ⓘ
Neurologie
Menschen mit FXS haben ein höheres Risiko, Krampfanfälle zu entwickeln, wobei in der Literatur Raten zwischen 10 % und 40 % angegeben werden. In größeren Studienpopulationen schwankt die Häufigkeit zwischen 13 % und 18 %, was mit einer kürzlich durchgeführten Umfrage unter Pflegekräften übereinstimmt, die ergab, dass 14 % der Männer und 6 % der Frauen von Krampfanfällen betroffen waren. Es handelt sich in der Regel um partielle Anfälle, die im Allgemeinen nicht häufig auftreten und mit Medikamenten behandelt werden können. ⓘ
Bei Personen, die Träger von Prämutationsallelen sind, besteht ein Risiko für die Entwicklung des Fragiles-X-assoziierten Tremor/Ataxie-Syndroms (FXTAS), einer progressiven neurodegenerativen Erkrankung. Sie tritt bei etwa der Hälfte der männlichen Träger im Alter von über 70 Jahren auf, während die Penetranz bei Frauen geringer ist. Typischerweise tritt der Tremor im sechsten Lebensjahrzehnt auf, mit anschließendem Fortschreiten der Ataxie (Koordinationsverlust) und allmählichem kognitiven Verfall. ⓘ
Arbeitsgedächtnis
Ab dem 40. Lebensjahr entwickeln Männer mit FXS zunehmend schwerwiegendere Probleme bei der Ausführung von Aufgaben, die die zentrale Exekutive des Arbeitsgedächtnisses erfordern. Das Arbeitsgedächtnis umfasst die vorübergehende Speicherung von Informationen "im Kopf", während dieselben oder andere Informationen verarbeitet werden. Das phonologische Gedächtnis (oder verbale Arbeitsgedächtnis) verschlechtert sich bei Männern mit dem Alter, während das visuell-räumliche Gedächtnis nicht direkt mit dem Alter zusammenhängt. Bei Männern ist die Funktion der phonologischen Schleife häufig beeinträchtigt. Die CGG-Länge korreliert signifikant mit der zentralen Exekutive und dem visuell-räumlichen Gedächtnis. Bei einem prämutierten Individuum ist die CGG-Länge jedoch nur mit der zentralen Exekutive signifikant korreliert, nicht aber mit dem phonologischen Gedächtnis oder dem visuell-räumlichen Gedächtnis. ⓘ
Fruchtbarkeit
Etwa 20 % der Frauen, die Trägerinnen der fragilen X-Prämutation sind, leiden an einer fragilen X-bedingten primären Ovarialinsuffizienz (FXPOI), die als frühe Menopause definiert ist, d. h. eine Menopause, die zwischen 40 und 45 Jahren eintritt (normalerweise tritt die Menopause zwischen 45 und 55 Jahren ein). Die Anzahl der CGG-Wiederholungen korreliert mit der Penetranz und dem Alter des Auftretens. Allerdings ist die vorzeitige Menopause bei Trägern von Vormutationen häufiger als bei Frauen mit der vollständigen Mutation, und bei Vormutationen mit mehr als 100 Wiederholungen beginnt das Risiko für FXPOI zu sinken. Die Fragile X-assoziierte primäre Ovarialinsuffizienz (FXPOI) ist eine der drei Fragile X-assoziierten Störungen (FXD), die durch Veränderungen im FMR1-Gen verursacht werden. FXPOI betrifft Trägerinnen der Prämutation des Fragilen-X-Syndroms, das durch das FMR1-Gen verursacht wird, wenn ihre Eierstöcke nicht richtig funktionieren. Frauen mit FXPOI können menopausenähnliche Symptome entwickeln, sind aber nicht wirklich menopausal. Frauen mit FXPOI können in einigen Fällen trotzdem schwanger werden, da ihre Eierstöcke gelegentlich lebensfähige Eizellen freisetzen. ⓘ
FMRP ist ein Chromatin-bindendes Protein, das bei der Reaktion auf DNA-Schäden eine Rolle spielt. FMRP besetzt auch Stellen auf meiotischen Chromosomen und reguliert die Dynamik der DNA-Schadensreaktionsmaschinerie während der Spermatogenese. ⓘ
Ursachen
Das Fragile-X-Syndrom ist eine genetische Störung, die durch eine Mutation des Gens für das Fragile-X-Messenger-Ribonukleoprotein 1 (FMR1) auf dem X-Chromosom hervorgerufen wird, wobei es sich in den meisten Fällen um eine Erhöhung der Anzahl der CGG-Trinukleotid-Wiederholungen in der 5'-untranslatierten Region von FMR1 handelt. Eine Mutation an dieser Stelle wird bei etwa 1 von 2000 Männern und 1 von 259 Frauen gefunden. Die Inzidenz der Erkrankung selbst liegt bei etwa 1 von 3600 Männern und 1 von 4000-6000 Frauen. Obwohl dies über 98 % der Fälle ausmacht, kann FXS auch als Folge von Punktmutationen auftreten, die FMR1 betreffen. ⓘ
Bei nicht betroffenen Personen enthält das FMR1-Gen 5-44 Wiederholungen der Sequenz CGG, am häufigsten 29 oder 30 Wiederholungen. Der Bereich zwischen 45 und 54 Wiederholungen gilt als "Grauzone", wobei ein Prämutationsallel im Allgemeinen eine Länge zwischen 55 und 200 Wiederholungen aufweist. Personen mit Fragilem X-Syndrom haben eine vollständige Mutation des FMR1-Allels mit über 200 CGG-Repeats. Bei diesen Personen mit einer Repeat-Expansion von mehr als 200 liegt eine Methylierung der CGG-Repeat-Expansion und des FMR1-Promotors vor, was zum Silencing des FMR1-Gens und zu einem Mangel an dessen Produkt führt. ⓘ
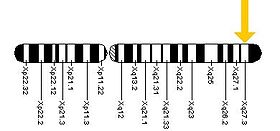
Es wird angenommen, dass diese Methylierung von FMR1 in der Chromosomengruppe Xq27.3 zu einer Verengung des X-Chromosoms führt, das an dieser Stelle unter dem Mikroskop "zerbrechlich" erscheint, ein Phänomen, das dem Syndrom seinen Namen gab. In einer Studie wurde festgestellt, dass das FMR1-Silencing durch die FMR1-mRNA vermittelt wird. Die FMR1-mRNA enthält den transkribierten CGG-Repeat-Trakt als Teil der 5'-untranslatierten Region, der mit dem komplementären CGG-Repeat-Teil des FMR1-Gens hybridisiert, um einen RNA-DNA-Duplex zu bilden. ⓘ
Bei einer Untergruppe von Menschen mit geistiger Behinderung und Symptomen, die dem fragilen X-Syndrom ähneln, wurden Punktmutationen in FMR1 festgestellt. Dieser Untergruppe fehlte die CGG-Repeat-Expansion in FMR1, die traditionell mit dem Fragilen-X-Syndrom in Verbindung gebracht wird. ⓘ
Vererbung
Das fragile X-Syndrom wurde traditionell als X-chromosomal dominante Erkrankung mit variabler Expressivität und möglicherweise reduzierter Penetranz betrachtet. Aufgrund der genetischen Antizipation und der X-Inaktivierung bei Frauen folgt die Vererbung des fragilen X-Syndroms jedoch nicht dem üblichen Muster der X-chromosomal-dominanten Vererbung, und einige Wissenschaftler haben vorgeschlagen, X-chromosomale Störungen nicht mehr als dominant oder rezessiv zu bezeichnen. Frauen mit vollständigen FMR1-Mutationen haben aufgrund der Variabilität der X-Inaktivierung möglicherweise einen milderen Phänotyp als Männer. ⓘ
Vor der Entdeckung des FMR1-Gens zeigte die Analyse von Stammbäumen, dass männliche Träger asymptomatisch waren und ihre Enkelkinder häufiger von der Krankheit betroffen waren als ihre Geschwister, was darauf hindeutet, dass eine genetische Vorwegnahme stattfand. Diese Tendenz, dass künftige Generationen häufiger betroffen sind, wurde nach ihrer Beschreibung im Jahr 1985 als Sherman-Paradoxon bekannt. Aus diesem Grund haben männliche Kinder oft ein höheres Maß an Symptomen als ihre Mütter. ⓘ
Die Erklärung für dieses Phänomen ist, dass männliche Träger ihre Prämutation an alle ihre Töchter weitergeben, wobei sich die Länge des FMR1 CGG-Repeats während der Meiose, der für die Spermienproduktion erforderlichen Zellteilung, in der Regel nicht erhöht. Übrigens geben Männer mit einer Vollmutation nur Prämutationen an ihre Töchter weiter. Frauen mit einer Vollmutation sind jedoch in der Lage, diese Vollmutation weiterzugeben, so dass theoretisch eine 50%ige Chance besteht, dass ein Kind betroffen ist. Außerdem vergrößert sich die Länge der CGG-Repeats bei Trägerinnen von Prämutationen während der Meiose häufig aufgrund von Instabilität, so dass sie je nach Länge ihrer Prämutation eine Vollmutation an ihre Kinder weitergeben können, die dann betroffen sind. Es wird davon ausgegangen, dass die Repeat-Expansion eine Folge des Strangabfalls entweder während der DNA-Replikation oder der DNA-Reparatursynthese ist. ⓘ
Der typische X-chromosomale Erbgang, der auch als X-chromosomal rezessiver Erbgang bezeichnet wird, beruht darauf, dass Frauen jeweils zwei X-Chromosomen, Männer jedoch immer nur eines besitzen. Entsprechend geben Frauen immer ein X-Chromosom an ihre Nachkommen weiter, Männer können entweder ein X-Chromosom oder ein Y-Chromosom vererben und entsprechend festlegen, ob die Nachkommen männlich oder weiblich sind. Im Falle von X-chromosomalen Mutationen ergibt sich dabei ein typischer Erbgang, der sich durch folgende Eigenschaften auszeichnet:
- Die Mutter zeigt in der Regel keine Symptome durch die Mutation, wenn die Veränderung des Gens nur auf einem ihrer beiden X-Chromosomen existiert und der Effekt durch das andere kompensiert wird, d. h. der Erbgang ist rezessiv.
- Die Mutter kann das fehlerhafte Gen mit einer Wahrscheinlichkeit von 50 % an ihre Nachkommen weitergeben. Dadurch können 50 % ihrer weiblichen Nachkommen wieder Trägerinnen werden, 50 % nicht. Wird das fehlerhafte Gen an einen männlichen Nachkommen weitergegeben, so prägt es sich bei diesem aufgrund der fehlenden Kompensation aus.
- Der Vater kann das fehlerhafte Gen niemals an seine männlichen Nachkommen vererben, da diese von ihm das Y-Chromosom erhalten. Töchter werden von ihren betroffenen Vätern jedoch in 100 % der Fälle das mutante X-Chromosom erben und somit in jedem Fall Trägerinnen werden. ⓘ
Aus diesen Gründen treten die Symptome einer X-chromosomal rezessiven Mutation wie etwa der Bluterkrankheit vor allem bei Männern auf (Hemizygotie), während Frauen häufiger nur Überträgerinnen des fehlerhaften Gens sind. Nur im ungünstigen Fall, dass die Töchter sowohl von der Mutter als auch vom Vater ein mutiertes Gen erhalten, prägt sich die Mutation auch bei den Frauen aus. ⓘ
Pathophysiologie
FMRP kommt im gesamten Körper vor, jedoch in den höchsten Konzentrationen im Gehirn und in den Hoden. Es scheint in erster Linie für die selektive Bindung an etwa 4 % der mRNA im Gehirn von Säugetieren verantwortlich zu sein und transportiert diese aus dem Zellkern heraus und zu den Synapsen der Neuronen. Die meisten dieser mRNA-Ziele befinden sich in den Dendriten von Neuronen, und Hirngewebe von Menschen mit FXS und von Mausmodellen zeigt abnorme dendritische Stacheln, die für einen verstärkten Kontakt mit anderen Neuronen erforderlich sind. Die daraus resultierenden Anomalien bei der Bildung und Funktion von Synapsen und der Entwicklung neuronaler Schaltkreise führen zu einer Beeinträchtigung der Neuroplastizität, die ein wesentlicher Bestandteil von Gedächtnis und Lernen ist. Seit langem wird vermutet, dass Veränderungen des Konnektoms an der Pathophysiologie der Sinnesorgane beteiligt sind, und in jüngster Zeit wurde eine Reihe von Schaltkreisveränderungen nachgewiesen, die eine strukturell erhöhte lokale Konnektivität und eine funktionell verringerte weitreichende Konnektivität umfassen. ⓘ
Darüber hinaus ist FMRP an mehreren Signalwegen beteiligt, auf die eine Reihe von Arzneimitteln abzielen, die sich in der klinischen Prüfung befinden. Der Stoffwechselweg der metabotropen Glutamatrezeptoren der Gruppe 1 (mGluR), zu denen mGluR1 und mGluR5 gehören, ist an der mGluR-abhängigen Langzeitdepression (LTD) und der Langzeitpotenzierung (LTP) beteiligt, die beide wichtige Mechanismen beim Lernen darstellen. Das Fehlen von FMRP, das die mRNA-Produktion und damit die Proteinsynthese unterdrückt, führt zu übertriebener LTD. FMRP scheint auch die Dopaminbahnen im präfrontalen Kortex zu beeinträchtigen, was vermutlich zu den mit FXS verbundenen Aufmerksamkeitsdefiziten, Hyperaktivität und Impulskontrollproblemen führt. Die Herunterregulierung der GABA-Signalwege, die eine hemmende Funktion haben und an Lernen und Gedächtnis beteiligt sind, könnte ein Faktor für die Angstsymptome sein, die bei FXS häufig auftreten. ⓘ
Diagnose
Eine zytogenetische Analyse des fragilen X-Syndroms war erstmals Ende der 1970er Jahre verfügbar, als die Diagnose des Syndroms und der Trägerstatus durch die Kultivierung von Zellen in einem folatarmen Medium und die anschließende Untersuchung auf fragile Stellen" (Diskontinuität der Färbung in der Region der Trinukleotidwiederholung) auf dem langen Arm des X-Chromosoms bestimmt werden konnten. Diese Technik erwies sich jedoch als unzuverlässig, da die fragile Stelle oft in weniger als 40 % der Zellen einer Person zu finden war. Bei Männern war dies kein so großes Problem, aber bei weiblichen Trägern, bei denen die fragile Stelle im Allgemeinen nur in 10 % der Zellen zu sehen war, konnte die Mutation oft nicht sichtbar gemacht werden. ⓘ
Seit den 1990er Jahren werden empfindlichere molekulare Techniken zur Bestimmung des Trägerstatus eingesetzt. Die fragile X-Anomalie wird nun direkt durch die Analyse der Anzahl der CGG-Wiederholungen mittels Polymerase-Kettenreaktion (PCR) und des Methylierungsstatus mittels Southern-Blot-Analyse bestimmt. Durch die Bestimmung der Anzahl der CGG-Wiederholungen auf dem X-Chromosom ermöglicht diese Methode eine genauere Risikobewertung für Prämutationsträger in Bezug auf ihr eigenes Risiko für fragile X-assoziierte Syndrome sowie ihr Risiko, betroffene Kinder zu haben. Da diese Methode nur auf die Expansion des CGG-Repeats testet, können Personen mit FXS aufgrund von Missense-Mutationen oder Deletionen, die FMR1 betreffen, mit diesem Test nicht diagnostiziert werden und sollten sich daher einer Sequenzierung des FMR1-Gens unterziehen, wenn ein klinischer Verdacht auf FXS besteht. ⓘ
Pränatale Tests mit Chorionzottenbiopsie oder Fruchtwasseruntersuchung ermöglichen eine Diagnose der FMR1-Mutation, während sich der Fötus im Mutterleib befindet, und scheinen zuverlässig zu sein. ⓘ
Eine frühzeitige Diagnose des Fragilen X-Syndroms oder des Trägerstatus ist wichtig, um bei Kindern oder Föten mit dem Syndrom frühzeitig eingreifen zu können und eine genetische Beratung im Hinblick auf die mögliche Betroffenheit der zukünftigen Kinder eines Paares zu ermöglichen. Die meisten Eltern bemerken bei ihren Kindern Verzögerungen in der Sprech- und Sprachfähigkeit, Schwierigkeiten in sozialen und emotionalen Bereichen sowie eine erhöhte Sensibilität in bestimmten Situationen. ⓘ
Bis zur Entdeckung des zugrundeliegenden Gens im Jahre 1991 war der Nachweis einer Lücke im X-Chromosom in Zellkulturen das einzige, allerdings recht unzuverlässige Verfahren, da in benachbarten Genbereichen ebenfalls fragile Stellen auftreten. Die Diagnostik erfolgt heute über molekulargenetische Analysemethoden aus einer Blutprobe mittels Polymerase-Kettenreaktion (PCR) und Southern Blot. Bleibt trotz negativer Befunde ein Verdacht, kann mittels immunohistochemischer Diagnostik mit monoklonalen Antikörpern direkt die FMR-Proteinkonzentration bestimmt werden. Für Feten mit erhöhtem Risiko kann pränatal entweder eine Chorionzottenbiopsie in der 10.–12. Schwangerschaftswoche (SSW) oder eine Amniozentese in der 16.–18. SSW durchgeführt werden. ⓘ
Behandlung
Aufgrund der genetischen Ursache ist eine Heilung nach dem derzeitigen Stand der Forschung nicht möglich. Symptomatisch kann nach eingehender kinderpsychiatrischer, pädiatrischer und neurologischer Untersuchung ein individuelles Förderprogramm erstellt werden, welches Verhaltenstherapie, Ergotherapie, Musiktherapie, Kunsttherapie und logopädische Betreuung einschließt. Diese Programme können sehr erfolgreich sein, wenn ein günstiges Umfeld hergestellt wird. Weiterhin können in Deutschland über die zuständigen Gesundheitsämter sowie die Kreissozialämter als Kostenträger „Maßnahmen der Eingliederungshilfe“ nach SGB IX beantragt werden. ⓘ
Es gibt keine Heilung für die dem FXS zugrunde liegenden Defekte. Die Behandlung von FXS kann Sprachtherapie, Verhaltenstherapie, Beschäftigungstherapie, Sonderschulunterricht oder individualisierte Bildungspläne und, falls erforderlich, die Behandlung körperlicher Anomalien umfassen. Personen, in deren Familiengeschichte das Fragile-X-Syndrom vorkommt, sollten eine genetische Beratung in Anspruch nehmen, um festzustellen, wie hoch die Wahrscheinlichkeit ist, dass ihre Kinder betroffen sind, und wie schwer die Beeinträchtigungen bei den betroffenen Nachkommen sein können. ⓘ
Medikation
Zu den aktuellen Trends bei der Behandlung der Störung gehören Medikamente zur symptomorientierten Behandlung, die darauf abzielen, die mit der Störung verbundenen sekundären Merkmale zu minimieren. Wenn bei einer Person FXS diagnostiziert wird, ist eine genetische Beratung zum Testen von Familienmitgliedern, bei denen ein Risiko besteht, dass sie die vollständige Mutation oder eine Prämutation tragen, ein wichtiger erster Schritt. Aufgrund der höheren Prävalenz von FXS bei Jungen sind die am häufigsten verwendeten Medikamente Stimulanzien, die auf Hyperaktivität, Impulsivität und Aufmerksamkeitsstörungen abzielen. Bei komorbiden Störungen mit FXS werden Antidepressiva wie selektive Serotonin-Wiederaufnahmehemmer (SSRI) eingesetzt, um die zugrundeliegenden Angstzustände, zwanghaften Verhaltensweisen und Stimmungsstörungen zu behandeln. Nach Antidepressiva werden Antipsychotika wie Risperidon und Quetiapin eingesetzt, um die hohe Rate an selbstverletzendem, aggressivem und abweichendem Verhalten in dieser Population zu behandeln (Bailey Jr. et al., 2012). Antikonvulsiva sind eine weitere Gruppe pharmakologischer Behandlungen, die zur Kontrolle von Krampfanfällen und Stimmungsschwankungen bei 13 % bis 18 % der Personen mit FXS eingesetzt werden. Medikamente, die auf die mGluR5-Rezeptoren (metabotrope Glutamatrezeptoren) abzielen, die mit der synaptischen Plastizität in Verbindung stehen, sind besonders hilfreich bei der gezielten Behandlung der Symptome von FXS. Auch Lithium wird derzeit in klinischen Studien am Menschen eingesetzt, wobei sich signifikante Verbesserungen im Verhalten, im adaptiven Verhalten und im verbalen Gedächtnis zeigten. In einigen wenigen Studien wurde der Einsatz von Folsäure vorgeschlagen, doch sind aufgrund der geringen Qualität dieser Nachweise weitere Untersuchungen erforderlich. Neben pharmakologischen Behandlungen tragen auch Umwelteinflüsse wie das häusliche Umfeld und die elterlichen Fähigkeiten sowie verhaltenstherapeutische Maßnahmen wie Sprachtherapie, sensorische Integration usw. dazu bei, die Anpassungsfähigkeit von Menschen mit FXS zu fördern. Metformin kann zwar das Körpergewicht von Menschen mit Fragilem X-Syndrom reduzieren, es ist jedoch ungewiss, ob es neurologische oder psychiatrische Symptome verbessert. ⓘ
Die derzeitige pharmakologische Behandlung konzentriert sich auf die Bewältigung problematischer Verhaltensweisen und psychiatrischer Symptome im Zusammenhang mit FXS. Da jedoch nur sehr wenig Forschung in dieser speziellen Population durchgeführt wurde, ist die Evidenz für den Einsatz dieser Medikamente bei Personen mit FXS gering. ⓘ
ADHS, von dem die Mehrheit der Jungen und 30 % der Mädchen mit FXS betroffen sind, wird häufig mit Stimulanzien behandelt. Der Einsatz von Stimulanzien bei Menschen mit Fragilem X-Syndrom ist jedoch mit einer größeren Häufigkeit von unerwünschten Ereignissen verbunden, darunter erhöhte Angstzustände, Reizbarkeit und Stimmungsschwankungen. Angstzustände sowie Stimmungsschwankungen und Zwangssymptome können mit SSRI behandelt werden, die jedoch auch die Hyperaktivität verschlimmern und enthemmtes Verhalten verursachen können. Atypische Antipsychotika können zur Stabilisierung der Stimmung und zur Kontrolle der Aggression eingesetzt werden, insbesondere bei Patienten mit komorbidem ASD. Allerdings ist eine Überwachung auf metabolische Nebenwirkungen wie Gewichtszunahme und Diabetes sowie auf Bewegungsstörungen im Zusammenhang mit extrapyramidalen Nebenwirkungen wie Spätdyskinesien erforderlich. Bei Personen mit gleichzeitig bestehenden Anfallsleiden kann eine Behandlung mit Antikonvulsiva erforderlich sein. ⓘ
Prognose
In einer Übersichtsarbeit aus dem Jahr 2013 wurde festgestellt, dass die Lebenserwartung bei FXS 12 Jahre niedriger ist als in der Allgemeinbevölkerung und dass die Todesursachen ähnlich sind wie in der Allgemeinbevölkerung. ⓘ
Forschung
Das Fragile X-Syndrom ist die am meisten "übersetzte" menschliche Neuroentwicklungsstörung, die untersucht wird. Daher hat die Erforschung der Ätiologie des FXS zu zahlreichen Versuchen der Arzneimittelentwicklung geführt. Das zunehmende Verständnis der molekularen Krankheitsmechanismen bei FXS hat zur Entwicklung von Therapien geführt, die auf die betroffenen Signalwege abzielen. Mausmodelle zeigen, dass mGluR5-Antagonisten (Blocker) dendritische Spine-Anomalien und Krampfanfälle sowie kognitive und Verhaltensprobleme lindern können, was für die Behandlung von FXS vielversprechend sein könnte. Zwei neue Medikamente, AFQ-056 (Mavoglurant) und Dipraglurant, sowie das neu entwickelte Medikament Fenobam werden derzeit in Humanstudien für die Behandlung von FXS geprüft. Es gibt auch erste Hinweise auf die Wirksamkeit von Arbaclofen, einem GABAB-Agonisten, zur Verbesserung des sozialen Rückzugs bei Menschen mit FXS und ASD. Darüber hinaus gibt es Hinweise aus Mausmodellen, dass Minocyclin, ein Antibiotikum, das zur Behandlung von Akne eingesetzt wird, Anomalien der Dendriten behebt. Eine offene Studie am Menschen hat vielversprechende Ergebnisse gezeigt, obwohl es derzeit keine Belege aus kontrollierten Studien gibt, die seine Anwendung unterstützen. ⓘ
Die erste vollständige DNA-Sequenz der Wiederholungsexpansion bei einer Person mit der vollständigen Mutation wurde 2012 von Wissenschaftlern mithilfe der SMRT-Sequenzierung erstellt. ⓘ
Geschichte
Das FXS wurde 1943 erstmals durch James Purdon Martin (1893–1984) und Julia Bell anhand einer Familie mit elf kognitiv zurückgebliebenen Männern unter wissenschaftlichen Gesichtspunkten beschrieben. Schon hier wurde ein X-chromosomaler Erbgang angenommen. ⓘ
Erst 1969 konnte dies durch Herbert Lubs an einer vierköpfigen Familie mit zwei betroffenen Männern und zwei nicht betroffenen Frauen nachgewiesen werden. In seinen Zellkulturen beobachtete Lubs ein Zusammenziehen des längeren Armes (q-Arm) in X-Chromosomen. Eine derartige Mutation konnte später auch in der ersten Familie nachgewiesen werden. ⓘ
Die Entdeckung geriet zunächst in Vergessenheit, bis Grant Sutherland durch Zufall herausfand, dass der entsprechende Nachweis nur in einem Folsäure-freien Kulturmedium nachvollziehbar ist: Bei seinem Umzug von Melbourne nach Adelaide, wo ein anderes Kulturmedium eingesetzt wurde, welches bessere Chromosomenfärbungen ermöglichte, konnten seine Ergebnisse zunächst nicht wiederholt werden, bis er wieder das vorherige Kulturmedium einsetzte. ⓘ
Bei der Vererbung des FXS war lange Zeit ungeklärt, warum es nicht immer mit anderen X-chromosomal gebundenen Erbgängen übereinstimmte. Insbesondere wurden auch heterozygote Überträgerinnen festgestellt, die eigentlich symptomfrei bleiben sollten. Dieses Phänomen veranlasste 1985 Stephanie Sherman und ihre Mitarbeiter zu einer genaueren Untersuchung der Stammbäume. Dabei stellten sie fest, dass Töchter eines nicht betroffenen Überträgers eine höhere Wahrscheinlichkeit besaßen, betroffene Nachkommen zu erhalten. Daraus schlussfolgerten sie, dass die Mutation in zwei Schritten erfolgen müsste, die im ersten Schritt noch symptomfrei bleibt und im zweiten nur bei der Übertragung von Frauen auf ihre Nachkommen erfolgt. Diese Beobachtungen sind in der Medizin seitdem als Sherman-Paradoxon bekannt. ⓘ
Das die Erkrankung verursachende mutierte Gen wurde 1991 von mehreren Forschern gemeinsam entdeckt und das Syndrom in die Gruppe der Trinukleotiderkrankungen eingeordnet (Verkerk et al., 1991). ⓘ
Verbreitung
Die Häufigkeit des FXS wird in der Literatur sehr breit angegeben, da in vielen Studien auch unterschiedliche Bemessungsgrundlagen für eine Vollmutation angelegt wurden. ⓘ
Im Schnitt beträgt die Häufigkeit 1:1.200 bei Männern und 1:2.500 bei Frauen. Damit stellt diese Besonderheit nach dem Down-Syndrom (Trisomie 21) die häufigste Form von genetisch bedingter kognitiver Behinderung dar. ⓘ
Differenzialdiagnose
Da die Symptome in früher Kindheit oft unspezifisch sind und Entwicklungsverzögerungen für viele Menschen in Betracht kommen, ist die Differenzialdiagnose vergleichsweise schwierig. ⓘ
Insbesondere in Betracht kommen das Sotos-Syndrom, das Prader-Willi-Syndrom, Autismus und die Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS), mit der das FXS anscheinend mehrere auslösende Gene teilt, ferner der Cherubismus. ⓘ
Bei Kindern mit Sprech-/ Sprachverzögerung und motorischen Defiziten sollte deshalb ein Test auf das FXS in Betracht gezogen werden, insbesondere bei entsprechender Familienanamnese. ⓘ
Vererbung
Das Fragiles-X-Syndrom ist ein erblich bedingtes Syndrom, welches entsprechend in einigen Familien gehäuft auftreten kann. Da die Genmutation, die dieser Besonderheit zugrunde liegt, nur am X-Chromosom auftritt, müsste die Vererbung eigentlich auch der anderer X-chromosomaler Erbgänge folgen, im Fall des FXS gibt es allerdings einige bislang nicht geklärte Abweichungen hiervon. ⓘ
Neurobiologie des Fragiles-X-Syndroms
Zur Erforschung der neurobiologischen Grundlagen, die die Symptomatik des Fragiles-X-Syndroms hervorrufen, wurde ein Tiermodell entwickelt. Dabei handelt es sich um eine sogenannte FMR1-Knockout-Maus, einen Mausstamm, bei dem durch geeignete molekularbiologische Methoden gezielt das FMR1-Gen entfernt wurde. Die Deletion von FMR1 in Mäusen ist von einigen Symptomen begleitet, wie sie auch für FXS-Patienten charakteristisch sind. Dazu gehören die Hyperaktivität, die epileptischen Anfälle und die Vergrößerung der Hoden. Im Gegensatz dazu waren Beobachtungen eines geringeren Lernvermögens der FMR1-Knockout-Mäuse nicht direkt auf den Menschen übertragbar, auch wegen der geringen Vergleichbarkeit der kognitiven Fähigkeiten zwischen Mäusen und Menschen. ⓘ
Neuere Befunde zeigen jedoch, dass eine einfache Form des assoziativen Lernens, und zwar der klassischen Konditionierung, die beim Menschen und bei Mäusen gleichermaßen anzutreffen ist und den gleichen Mechanismen gehorcht, sowohl in FMR1-Knockout-Mäusen als auch FXS-Patienten schwer beeinträchtigt ist. Dabei handelt es sich um die Konditionierung des Lidschlussreflexes.
Beim Lidschlussreflex handelt es sich um einen Schutzreflex des Augenlides. Er wird aktiviert, wenn ein unangenehmer oder schmerzhafter Reiz auf die Oberfläche des Augapfels trifft. Das Augenlid schließt sich. Die Konditionierung des Lidschlussreflexes im Experiment geschieht folgendermaßen: Als sogenannter unkonditionierter Reiz dient ein kurzer Luftstoß auf den Augapfel. Der konditionierte Reiz ist ein Ton, der vor dem Luftstoß beginnt und gemeinsam mit ihm endet (beim sogenannten delay conditioning). Nach einigen Versuchen mit gleichem Intervall zwischen Beginn des Tones und dem Luftstoß schließt sich das Auge exakt zu einem Zeitpunkt, der gewährleistet, dass es beim Auftreffen des Luftstoßes bereits geschlossen ist. Konditioniert wird dabei das Timing des Reflexes. ⓘ
Die Konditionierung des Lidschlussreflexes kann sowohl im Tierversuch als auch am Menschen durchgeführt werden. Die neuronalen Schaltkreise, die für eine korrekte Anpassung des Reflexes verantwortlich sind, sind sehr gut bekannt und eingehend untersucht. Die beteiligten Neurone befinden sich im Kleinhirn. Von zentraler Bedeutung für die Konditionierung des Lidschlussreflexes ist eine Form der synaptischen Plastizität an der Parallelfasersynapse der Purkinjezellen. Der Befund, dass die Konditionierung des Lidschlussreflexes in FXS-Patienten verschlechtert ist, kann durchaus therapeutische Bedeutung gewinnen. Man könnte den Lidschlussreflex als Parameter verwenden, um die Wirksamkeit möglicher Therapien ganz objektiv zu messen. ⓘ
Corticale Nervenzellen der FMR1-Knockout-Mäuse sowie der FXS-Patienten weisen eine erhöhte Anzahl und größere durchschnittliche Länge der Dornfortsätze (sog. spines) auf. Das lässt auf eine synaptische Funktion des FMR1-Proteins schließen. Das FMR1-Protein ist ein RNA-bindendes Protein. Man nimmt heute an, dass eine seiner Funktionen darin besteht, die Translation der gebundenen RNA solange zu hemmen, wie diese unterwegs vom Zellkern im Perikaryon zum Dendriten ist. Dort funktioniert das FMR1-Protein dann als eine Art Schalter, der die RNA freigibt und deren Translation als Antwort auf synaptische Signale ermöglicht. Demnach gehört das FMR1-Protein zu den Faktoren, die für eine aktivitätsabhängige Proteinsynthese an Synapsen erforderlich sind. ⓘ
Die mGluR-Theorie des FXS
Das FMR1-Protein wird an Synapsen nach Aktivierung metabotroper Glutamatrezeptoren (mGluR) synthetisiert. Die Gruppe-1-mGluR stimulieren einerseits die Proteinsynthese, andererseits aber auch den Transport FMR1-Protein-assoziierter RNA in den Dendriten. Das legt die Vermutung nahe, dass das FMR1-Protein hemmend auf die Synthese anderer synaptischer Proteine wirkt. Damit übereinstimmend wurde gefunden, dass im Hippocampus bestimmte Formen der synaptischen Plastizität, die abhängig von Proteinsynthese sind, in den FMR1-Knockout-Mäusen verstärkt sind, während andere Formen, die unabhängig von der Synthese von Proteinen sind, unverändert bleiben. Daraus wurde geschlussfolgert, dass auch andere Formen der mGluR- und proteinsyntheseabhängigen synaptischen Plastizität durch Deletion des FMR1-Gens hochreguliert sein müssten. In der Tat war das auch in Purkinjezellen der Fall. Dort ist die Langzeitdepression an der Parallelfasersynapse ebenfalls mGluR-abhängig und erwies sich als verstärkt in den FMR1-Knockout-Mäusen. Die spines der Purkinjezellen sind in FMR1-Knockout-Mäusen verlängert. Alle diese Veränderungen legen nahe, dass das FMR1-Protein als Regulator der synaptischen Struktur sowie der mGluR-abhängigen Plastizität wirkt. ⓘ