Y-Chromosom
| Menschliches Y-Chromosom ⓘ | |
|---|---|
Menschliches Y-Chromosom (nach G-Banding) | |
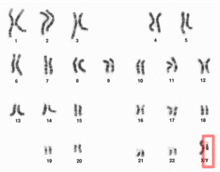 Y-Chromosom im Karyogramm des menschlichen Mannes | |
| Merkmale | |
| Länge (bp) | 57.227.415 bp (GRCh38) |
| Anzahl von Genen | 63 (CCDS) |
| Typ | Allosom |
| Position des Zentromers | Akrozentrisch (10,4 Mbp) |
| Vollständige Genlisten | |
| CCDS | Gen-Liste |
| HGNC | Gen-Liste |
| UniProt | Gen-Liste |
| NCBI | Gen-Liste |
| Externe Kartenbetrachter | |
| Ensembl | Chromosom Y |
| Entrez | Chromosom Y |
| NCBI | Chromosom Y |
| UCSC | Chromosom Y |
| Vollständige DNA-Sequenzen | |
| RefSeq | NC_000024 (FASTA) |
| GenBank | CM000686 (FASTA) |
Das Y-Chromosom ist eines von zwei Geschlechtschromosomen (Allosomen) bei therischen Säugetieren, einschließlich des Menschen, und vielen anderen Tieren. Das andere ist das X-Chromosom. Bei vielen Arten ist das Y-Chromosom das geschlechtsbestimmende Chromosom, da das Vorhandensein oder Fehlen des Y-Chromosoms das männliche oder weibliche Geschlecht der Nachkommen bestimmt, die bei der sexuellen Fortpflanzung entstehen. Bei Säugetieren enthält das Y-Chromosom das Gen SRY, das die männliche Entwicklung auslöst. Die DNA im menschlichen Y-Chromosom besteht aus etwa 59 Millionen Basenpaaren. Das Y-Chromosom wird nur vom Vater an den Sohn weitergegeben. Mit einem Unterschied von 30 % zwischen Mensch und Schimpanse ist das Y-Chromosom einer der sich am schnellsten entwickelnden Teile des menschlichen Genoms. Das menschliche Y-Chromosom trägt schätzungsweise 100-200 Gene, von denen zwischen 45 und 73 für Proteine kodieren. Alle Y-gebundenen Single-Copy-Gene sind hemizygot (auf nur einem Chromosom vorhanden), außer in Fällen von Aneuploidie wie dem XYY-Syndrom oder dem XXYY-Syndrom. ⓘ
Das Y-Chromosom ist ein Geschlechtschromosom (Gonosom). Es bewirkt die Ausbildung des männlichen Phänotyps. ⓘ
Überblick
Entdeckung
Das Y-Chromosom wurde 1905 von Nettie Stevens am Bryn Mawr College im Rahmen einer Studie über den Mehlwurm Tenebrio molitor als geschlechtsbestimmendes Chromosom identifiziert. Edmund Beecher Wilson entdeckte denselben Mechanismus im selben Jahr unabhängig davon bei Hemiptera. Stevens schlug vor, dass Chromosomen immer paarweise existieren und dass das kleinere Chromosom (heute als "Y" bezeichnet) das Paar des 1890 von Hermann Henking entdeckten X-Chromosoms ist. Sie erkannte, dass die frühere Vorstellung von Clarence Erwin McClung, wonach das X-Chromosom das Geschlecht bestimmt, falsch war und dass die Geschlechtsbestimmung in Wirklichkeit auf das Vorhandensein oder Fehlen des Y-Chromosoms zurückzuführen ist. Anfang der 1920er Jahre stellte Theophilus Painter fest, dass die X- und Y-Chromosomen das Geschlecht des Menschen (und anderer Säugetiere) bestimmen. ⓘ
Das Chromosom erhielt den Namen "Y", um alphabetisch an das "X" von Henking anzuknüpfen. Die Vorstellung, das Y-Chromosom sei nach seiner Ähnlichkeit mit dem Buchstaben "Y" benannt worden, ist falsch. Alle Chromosomen erscheinen unter dem Mikroskop normalerweise als amorpher Klecks und nehmen erst während der Mitose eine klar definierte Form an. Diese Form ist bei allen Chromosomen vage X-förmig. Es ist reiner Zufall, dass das Y-Chromosom während der Mitose zwei sehr kurze Verzweigungen hat, die unter dem Mikroskop zusammengeführt werden können und wie das Unterteil eines Y aussehen. ⓘ
Variationen
Die meisten therischen Säugetiere haben nur ein Paar Geschlechtschromosomen in jeder Zelle. Männchen haben ein Y-Chromosom und ein X-Chromosom, während die Weibchen zwei X-Chromosomen haben. Bei Säugetieren enthält das Y-Chromosom ein Gen, SRY, das die embryonale Entwicklung zum Mann auslöst. Die Y-Chromosomen von Menschen und anderen Säugetieren enthalten auch andere Gene, die für die normale Spermienproduktion benötigt werden. ⓘ
Es gibt jedoch auch Ausnahmen. Beim Menschen haben einige Männer zwei X und ein Y ("XXY", siehe Klinefelter-Syndrom) oder ein X und zwei Y (siehe XYY-Syndrom), und einige Frauen haben drei X oder ein einzelnes X anstelle eines Doppel-X ("X0", siehe Turner-Syndrom). Es gibt weitere Ausnahmen, bei denen SRY beschädigt ist (was zu einer XY-Frau führt) oder auf das X kopiert wird (was zu einem XX-Mann führt). ⓘ
Ursprünge und Entwicklung
Vor dem Y-Chromosom
Viele ektotherme Wirbeltiere haben keine Geschlechtschromosomen. Wenn sie unterschiedliche Geschlechter haben, wird das Geschlecht eher durch die Umwelt als durch die Gene bestimmt. Bei einigen von ihnen, insbesondere bei Reptilien, hängt das Geschlecht von der Inkubationstemperatur ab. Einige Wirbeltiere sind Zwitter, aber mit Ausnahme einiger weniger Fische mit Rochenflossen sind sie eher sequenziell (ein und derselbe Organismus produziert zu verschiedenen Zeitpunkten seines Lebens männliche oder weibliche Geschlechtszellen, aber nie beide) als simultan (ein und derselbe Organismus produziert gleichzeitig männliche und weibliche Geschlechtszellen). ⓘ
Herkunft
Es wird angenommen, dass sich die X- und Y-Chromosomen aus einem Paar identischer Chromosomen, den so genannten Autosomen, entwickelt haben, als ein Urtier eine allelische Variation, einen so genannten "Geschlechtslocus", entwickelte - allein der Besitz dieses Allels machte den Organismus männlich. Das Chromosom mit diesem Allel wurde zum Y-Chromosom, während das andere Mitglied des Paares zum X-Chromosom wurde. Im Laufe der Zeit entwickelten sich auf dem Y-Chromosom Gene, die für Männer vorteilhaft und für Frauen schädlich waren (oder keine Auswirkungen auf sie hatten), oder sie wurden durch den Prozess der Translokation erworben. ⓘ
Bis vor kurzem ging man davon aus, dass sich die X- und Y-Chromosomen vor etwa 300 Millionen Jahren getrennt haben. Im Jahr 2010 veröffentlichte Forschungsarbeiten, insbesondere die 2008 veröffentlichte Sequenzierung des Schnabeltiergenoms, legen jedoch nahe, dass das XY-Geschlechtsbestimmungssystem erst vor 166 Millionen Jahren, zur Zeit der Abspaltung der Monotremen von anderen Säugetieren, entstanden sein könnte. Diese neue Schätzung des Alters des therischen XY-Systems beruht auf der Feststellung, dass Sequenzen, die sich auf den X-Chromosomen von Beuteltieren und eutherischen Säugetieren befinden, auch auf den Autosomen von Schnabeltieren und Vögeln vorhanden sind. Die ältere Schätzung beruhte auf falschen Berichten, dass die X-Chromosomen der Schnabeltiere diese Sequenzen enthalten. ⓘ
Rekombinationshemmung
Die Rekombination zwischen dem X- und dem Y-Chromosom erwies sich als schädlich - sie führte dazu, dass Männchen ohne notwendige Gene, die zuvor auf dem Y-Chromosom zu finden waren, und Weibchen mit unnötigen oder sogar schädlichen Genen, die zuvor nur auf dem Y-Chromosom zu finden waren, ausgestattet wurden. Infolgedessen häuften sich Gene, die für Männer vorteilhaft waren, in der Nähe der geschlechtsbestimmenden Gene an, und die Rekombination in dieser Region wurde unterdrückt, um diese männerspezifische Region zu erhalten. Im Laufe der Zeit veränderte sich das Y-Chromosom so, dass sich die Bereiche um die geschlechtsbestimmenden Gene überhaupt nicht mehr mit dem X-Chromosom rekombinieren konnten. Das Ergebnis dieses Prozesses ist, dass 95 % des menschlichen Y-Chromosoms nicht mehr rekombinieren können. Nur die Spitzen der Y- und X-Chromosomen rekombinieren. Die Spitzen des Y-Chromosoms, die mit dem X-Chromosom rekombinieren können, werden als pseudoautosomaler Bereich bezeichnet. Der Rest des Y-Chromosoms wird unversehrt an die nächste Generation weitergegeben, so dass es für die Verfolgung der menschlichen Evolution genutzt werden kann. ⓘ
Degeneration
Einer Schätzung zufolge hat das menschliche Y-Chromosom im Laufe seiner Existenz 1.393 seiner ursprünglich 1.438 Gene verloren, und eine lineare Extrapolation dieses Verlusts von 1.393 Genen über 300 Millionen Jahre ergibt eine Rate des genetischen Verlusts von 4,6 Genen pro Million Jahre. Ein fortgesetzter Genverlust mit einer Rate von 4,6 Genen pro Million Jahre würde innerhalb der nächsten 10 Millionen Jahre zu einem Y-Chromosom ohne funktionale Gene führen - d. h. das Y-Chromosom würde seine Funktion vollständig verlieren -, was bei der derzeitigen Altersschätzung von 160 Millionen Jahren der Hälfte der Zeit entspricht. Vergleichende Genomanalysen zeigen, dass bei vielen Säugetierarten ein ähnlicher Funktionsverlust ihres heterozygoten Geschlechtschromosoms zu beobachten ist. Die Degeneration könnte einfach das Schicksal aller nicht rekombinanten Geschlechtschromosomen sein, und zwar aufgrund von drei gemeinsamen evolutionären Kräften: hohe Mutationsrate, ineffiziente Selektion und genetische Drift. ⓘ
Vergleiche des Y-Chromosoms von Mensch und Schimpanse (erstmals 2005 veröffentlicht) zeigen jedoch, dass das menschliche Y-Chromosom seit der Divergenz von Mensch und Schimpanse vor 6 bis 7 Millionen Jahren keine Gene verloren hat, und in einem wissenschaftlichen Bericht aus dem Jahr 2012 heißt es, dass seit der Divergenz des Menschen vom Rhesusaffen vor 25 Millionen Jahren nur ein Gen verloren gegangen ist. Diese Fakten sind ein direkter Beweis dafür, dass das Modell der linearen Extrapolation fehlerhaft ist, und deuten darauf hin, dass das heutige menschliche Y-Chromosom entweder nicht mehr oder viel langsamer schrumpft als die 4,6 Gene pro Million Jahre, die nach dem Modell der linearen Extrapolation geschätzt werden. ⓘ
Hohe Mutationsrate
Das menschliche Y-Chromosom ist aufgrund der Umgebung, in der es sich befindet, besonders hohen Mutationsraten ausgesetzt. Das Y-Chromosom wird ausschließlich durch Spermien weitergegeben, die während der Gametogenese mehrere Zellteilungen durchlaufen. Jede Zellteilung bietet eine weitere Gelegenheit, Basenpaar-Mutationen anzuhäufen. Außerdem werden die Spermien in der stark oxidativen Umgebung des Hodens gelagert, was weitere Mutationen begünstigt. Diese beiden Bedingungen zusammengenommen führen dazu, dass das Y-Chromosom einem größeren Mutationsrisiko ausgesetzt ist als der Rest des Genoms. Die erhöhte Mutationsmöglichkeit für das Y-Chromosom wird von Graves mit einem Faktor von 4,8 angegeben. In ihrer Originalreferenz wird diese Zahl jedoch für die relativen Mutationsraten in männlichen und weiblichen Keimlinien für die Abstammungslinie, die zum Menschen führt, ermittelt. ⓘ
Die Beobachtung, dass das Y-Chromosom nur wenig meiotische Rekombination erfährt und im Vergleich zum Rest des Genoms eine beschleunigte Mutations- und Degradationsrate aufweist, legt eine evolutionäre Erklärung für die adaptive Funktion der Meiose in Bezug auf den Hauptteil der genetischen Information nahe. Brandeis schlug vor, dass die grundlegende Funktion der Meiose (insbesondere der meiotischen Rekombination) die Erhaltung der Integrität des Genoms ist, ein Vorschlag, der mit der Idee übereinstimmt, dass die Meiose eine Anpassung zur Reparatur von DNA-Schäden ist. ⓘ
Ineffiziente Selektion
Ohne die Fähigkeit zur Rekombination während der Meiose ist das Y-Chromosom nicht in der Lage, einzelne Allele der natürlichen Selektion auszusetzen. Deleteriöse Allele können mit vorteilhaften Nachbarn "trampen" und so schlecht angepasste Allele in die nächste Generation übertragen. Umgekehrt kann gegen vorteilhafte Allele selektiert werden, wenn sie von schädlichen Allelen umgeben sind (Hintergrundselektion). Da das Y-Chromosom nicht in der Lage ist, seinen Geninhalt zu sortieren, ist es besonders anfällig für die Anhäufung von "Junk"-DNA. Massive Anhäufungen retrotransponierbarer Elemente sind über das gesamte Y-Chromosom verstreut. Die zufällige Einfügung von DNA-Segmenten unterbricht oft die kodierten Gensequenzen und macht sie funktionsunfähig. Das Y-Chromosom hat jedoch keine Möglichkeit, diese "springenden Gene" auszusortieren. Ohne die Fähigkeit, Allele zu isolieren, kann die Selektion nicht wirksam auf sie einwirken. ⓘ
Ein klarer, quantitativer Hinweis auf diese Ineffizienz ist die Entropierate des Y-Chromosoms. Während alle anderen Chromosomen im menschlichen Genom Entropieraten von 1,5-1,9 Bits pro Nukleotid aufweisen (verglichen mit dem theoretischen Maximum von genau 2 für keine Redundanz), beträgt die Entropierate des Y-Chromosoms nur 0,84. Das bedeutet, dass das Y-Chromosom im Verhältnis zu seiner Gesamtlänge einen viel geringeren Informationsgehalt hat; es ist redundanter. ⓘ
Genetische Drift
Selbst wenn es einem gut angepassten Y-Chromosom gelingt, die genetische Aktivität aufrechtzuerhalten, indem es eine Mutationsakkumulation vermeidet, gibt es keine Garantie, dass es an die nächste Generation weitergegeben wird. Die Populationsgröße des Y-Chromosoms ist von Natur aus auf 1/4 der Größe der Autosomen begrenzt: Diploide Organismen enthalten zwei Kopien der autosomalen Chromosomen, während nur die Hälfte der Population ein Y-Chromosom enthält. Daher ist die genetische Drift eine außergewöhnlich starke Kraft, die auf das Y-Chromosom wirkt. Durch reine Zufallsauswahl kann ein erwachsener Mann sein Y-Chromosom nie weitergeben, wenn er nur weibliche Nachkommen hat. Auch wenn ein Mann ein gut angepasstes Y-Chromosom ohne übermäßige Mutation hat, kann es sein, dass es nie in den nächsten Genpool gelangt. Der wiederholte zufällige Verlust gut angepasster Y-Chromosomen in Verbindung mit der Tendenz des Y-Chromosoms, aus den oben beschriebenen Gründen eher mehr als weniger schädliche Mutationen aufzuweisen, trägt zur artübergreifenden Degeneration der Y-Chromosomen durch die Mullersche Ratsche bei. ⓘ
Genkonversion
Wie bereits erwähnt, ist das Y-Chromosom nicht in der Lage, sich während der Meiose wie die anderen menschlichen Chromosomen zu rekombinieren. 2003 entdeckten Forscher des MIT jedoch einen Prozess, der den Degenerationsprozess verlangsamen könnte. Sie fanden heraus, dass das menschliche Y-Chromosom in der Lage ist, mit sich selbst zu "rekombinieren", indem es palindrome Basenpaar-Sequenzen verwendet. Eine solche "Rekombination" wird als Genkonversion bezeichnet. ⓘ
Im Fall der Y-Chromosomen handelt es sich bei den Palindromen nicht um nichtcodierende DNA; diese Basenpaare enthalten funktionierende Gene, die für die männliche Fruchtbarkeit wichtig sind. Die meisten der Sequenzpaare sind zu mehr als 99,97 % identisch. Die umfangreiche Nutzung der Genkonversion könnte eine Rolle bei der Fähigkeit des Y-Chromosoms spielen, genetische Fehler zu korrigieren und die Integrität der relativ wenigen Gene, die es trägt, zu erhalten. Mit anderen Worten: Da das Y-Chromosom ein einziges Chromosom ist, hat es Duplikate seiner Gene auf sich selbst, anstatt ein zweites, homologes Chromosom zu haben. Wenn Fehler auftreten, kann es andere Teile von sich selbst als Vorlage verwenden, um sie zu korrigieren. ⓘ
Die Ergebnisse wurden durch den Vergleich ähnlicher Regionen des Y-Chromosoms beim Menschen mit den Y-Chromosomen von Schimpansen, Bonobos und Gorillas bestätigt. Der Vergleich zeigte, dass dasselbe Phänomen der Genumwandlung offenbar schon vor mehr als 5 Millionen Jahren stattfand, als sich Menschen und nicht-menschliche Primaten voneinander unterschieden. ⓘ
Künftige Evolution
Einigen Theorien zufolge übernehmen im Endstadium der Degeneration des Y-Chromosoms andere Chromosomen zunehmend Gene und Funktionen, die früher mit dem Y-Chromosom verbunden waren, und im Rahmen dieser Theorie verschwindet das Y-Chromosom schließlich ganz, und es entsteht ein neues geschlechtsbestimmendes System. Mehrere Nagetierarten aus den Schwesterfamilien Muridae und Cricetidae haben diese Stadien auf folgende Weise erreicht:
- Die Transkaukasische Maulwurfsmaus, Ellobius lutescens, die Zaisaner Maulwurfsmaus, Ellobius tancrei, und die Japanischen Landratten Tokudaia osimensis und Tokudaia tokunoshimensis haben das Y-Chromosom und SRY vollständig verloren. Tokudaia spp. haben einige andere Gene, die ursprünglich auf dem Y-Chromosom vorhanden waren, auf das X-Chromosom verlagert. Beide Geschlechter von Tokudaia spp. und Ellobius lutescens haben einen XO-Genotyp (Turner-Syndrom), während alle Ellobius tancrei einen XX-Genotyp besitzen. Das/die neue(n) geschlechtsbestimmende(n) System(e) für diese Nagetiere bleibt/bleiben unklar.
- Der Waldlemming Myopus schisticolor, der Arktische Lemming Dicrostonyx torquatus und mehrere Arten der Grasmausgattung Akodon haben durch eine Vielzahl von Veränderungen an den X- und Y-Chromosomen fruchtbare Weibchen entwickelt, die zusätzlich zu dem ursprünglichen XX-Weibchen den Genotyp besitzen, der normalerweise für Männchen kodiert, also XY.
- Bei der Wühlmaus, Microtus oregoni, produzieren die Weibchen, die jeweils nur ein X-Chromosom besitzen, nur X-Gameten, und die Männchen, XY, produzieren Y-Gameten oder Gameten ohne Geschlechtschromosomen durch Nicht-Disjunktion.
Außerhalb der Nagetiere hat der schwarze Muntjac, Muntiacus crinifrons, neue X- und Y-Chromosomen durch Verschmelzung der ursprünglichen Geschlechtschromosomen und Autosomen entwickelt. ⓘ
Moderne Daten lassen Zweifel an dieser Hypothese aufkommen. Zu diesem Schluss kamen Wissenschaftler, die die Y-Chromosomen von Rhesusaffen untersuchten. Beim genomischen Vergleich des Y-Chromosoms von Rhesusaffen und Menschen fanden die Wissenschaftler nur sehr wenige Unterschiede, wenn man bedenkt, dass sich Menschen und Rhesusaffen vor 30 Millionen Jahren auseinander entwickelten. ⓘ
Einige Organismen haben das Y-Chromosom verloren. Zum Beispiel die meisten Arten von Nematoden. Um das Y-Chromosom vollständig zu eliminieren, musste jedoch eine alternative Methode zur Bestimmung des Geschlechts entwickelt werden (z. B. durch Bestimmung des Geschlechts anhand des Verhältnisses zwischen X-Chromosom und Autosomen), und alle für die männliche Funktion erforderlichen Gene mussten auf andere Chromosomen verlagert werden. In der Zwischenzeit zeigen moderne Daten die komplexen Mechanismen der Evolution des Y-Chromosoms und die Tatsache, dass das Verschwinden des Y-Chromosoms nicht garantiert ist. ⓘ
Geschlechterverhältnis 1:1
Das Fisher-Prinzip erklärt, warum fast alle Arten, die sich sexuell fortpflanzen, ein Geschlechterverhältnis von 1:1 haben. W. D. Hamilton gab in seinem Aufsatz von 1967 über "Außergewöhnliche Geschlechterverhältnisse" die folgende grundlegende Erklärung unter der Voraussetzung, dass die Kosten für die Erzeugung von Männchen und Weibchen gleich hoch sind:
- Angenommen, männliche Geburten sind weniger häufig als weibliche.
- Ein neugeborenes Männchen hat dann bessere Paarungschancen als ein neugeborenes Weibchen und kann daher mit mehr Nachkommen rechnen.
- Eltern, die genetisch dazu veranlagt sind, männliche Kinder zu zeugen, neigen daher dazu, überdurchschnittlich viele Enkelkinder zu bekommen.
- Daher verbreiten sich die Gene für die männliche Veranlagung, und männliche Geburten werden immer häufiger.
- Nähert man sich dem Geschlechterverhältnis von 1:1, so schwindet der Vorteil, der mit der Produktion von Männern verbunden ist.
- Die gleiche Argumentation gilt, wenn durchgängig Männchen durch Weibchen ersetzt werden. Daher ist 1:1 das Gleichgewichtsverhältnis. ⓘ
Nicht-therisches Y-Chromosom
Neben den therianischen Säugetieren haben viele andere Organismengruppen Y-Chromosomen, die jedoch keine gemeinsame Abstammung mit den therianischen Y-Chromosomen haben. Zu diesen Gruppen gehören Monotremes, Drosophila, einige andere Insekten, einige Fische, einige Reptilien und einige Pflanzen. Bei Drosophila melanogaster löst das Y-Chromosom keine männliche Entwicklung aus. Stattdessen wird das Geschlecht durch die Anzahl der X-Chromosomen bestimmt. Das Y-Chromosom von D. melanogaster enthält jedoch Gene, die für die männliche Fruchtbarkeit notwendig sind. D. melanogaster mit XXY sind also weiblich, und D. melanogaster mit einem einzigen X (X0) sind männlich, aber steril. Es gibt einige Drosophila-Arten, bei denen X0-Männchen sowohl lebensfähig als auch fruchtbar sind. ⓘ
ZW-Chromosomen
Andere Organismen haben spiegelbildliche Geschlechtschromosomen: Das homogene Geschlecht ist das Männchen, das zwei Z-Chromosomen hat, und das Weibchen ist das heterogene Geschlecht und hat ein Z-Chromosom und ein W-Chromosom. Zum Beispiel haben weibliche Vögel, Schlangen und Schmetterlinge ZW-Geschlechtschromosomen und männliche Tiere ZZ-Geschlechtschromosomen. ⓘ
Nicht-invertiertes Y-Chromosom
Bei einigen Arten wie dem Japanischen Reisfisch ist das XY-System noch in der Entwicklung begriffen und eine Kreuzung zwischen X und Y ist noch möglich. Da die männlich-spezifische Region sehr klein ist und keine essenziellen Gene enthält, ist es sogar möglich, künstlich XX-Männchen und YY-Weibchen zu erzeugen, ohne dass dies negative Auswirkungen hat. ⓘ
Mehrere XY-Paare
Monotremen besitzen vier oder fünf (Schnabeltiere) Paare von XY-Geschlechtschromosomen, wobei jedes Paar aus Geschlechtschromosomen mit homologen Regionen besteht. Die Chromosomen benachbarter Paare sind teilweise homolog, so dass während der Mitose eine Kette gebildet wird. Das erste X-Chromosom in der Kette ist ebenfalls teilweise homolog mit dem letzten Y-Chromosom, was darauf hindeutet, dass in der Geschichte tiefgreifende Umlagerungen stattgefunden haben, bei denen teilweise neue Teile aus Autosomen hinzugefügt wurden. ⓘ
Die Geschlechtschromosomen der Schnabeltiere weisen eine starke Sequenzähnlichkeit mit dem Z-Chromosom der Vögel auf (was auf eine enge Homologie hindeutet), und das SRY-Gen, das bei den meisten anderen Säugetieren für die Geschlechtsbestimmung von zentraler Bedeutung ist, ist offenbar nicht an der Geschlechtsbestimmung der Schnabeltiere beteiligt. ⓘ
Menschliches Y-Chromosom
Beim Menschen umfasst das Y-Chromosom etwa 58 Millionen Basenpaare (die Bausteine der DNA) und macht fast 2 % der gesamten DNA in einer männlichen Zelle aus. Das menschliche Y-Chromosom enthält über 200 Gene, von denen mindestens 72 für Proteine kodieren. Merkmale, die über das Y-Chromosom vererbt werden, nennt man Y-gebundene Merkmale oder holandrische Merkmale (von altgriechisch ὅλος hólos, "ganz" + ἀνδρός andrós, "männlich"). ⓘ
Männer können das Y-Chromosom in einer Untergruppe von Zellen verlieren, was als Mosaikverlust des Y-Chromosoms (mLOY) bezeichnet wird. Diese postzygotische Mutation ist stark altersabhängig und betrifft etwa 15 % der Männer im Alter von 70 Jahren. Rauchen ist ein weiterer wichtiger Risikofaktor für LOY. Es hat sich gezeigt, dass Männer mit einem höheren Prozentsatz an hämatopoetischen Stammzellen im Blut, denen das Y-Chromosom fehlt (und vielleicht auch ein höherer Prozentsatz an anderen Zellen, denen es fehlt), ein höheres Risiko für bestimmte Krebsarten haben und eine kürzere Lebenserwartung aufweisen. Es wurde festgestellt, dass Männer mit LOY (definiert als fehlendes Y in mindestens 18 % ihrer blutbildenden Zellen) im Durchschnitt 5,5 Jahre früher sterben als andere. Dies wurde als Zeichen dafür gewertet, dass das Y-Chromosom eine Rolle spielt, die über die Geschlechtsbestimmung und die Fortpflanzung hinausgeht (obwohl der Verlust des Y-Chromosoms eher eine Auswirkung als eine Ursache sein kann). Männliche Raucher haben ein 1,5- bis 2-mal höheres Risiko für Krebserkrankungen außerhalb der Atemwege als weibliche Raucher. ⓘ
Struktur
Zytogenetische Bande
| Chr. | Arm | Bande | ISCN Anfang |
ISCN Stopp |
Basispaar Anfang |
Basispaar Stopp |
Färbung | Dichte ⓘ |
|---|---|---|---|---|---|---|---|---|
| Y | p | 11.32 | 0 | 149 | 1 | 300,000 | gneg | |
| Y | p | 11.31 | 149 | 298 | 300,001 | 600,000 | gpos | 50 |
| Y | p | 11.2 | 298 | 1043 | 600,001 | 10,300,000 | gneg | |
| Y | p | 11.1 | 1043 | 1117 | 10,300,001 | 10,400,000 | acen | |
| Y | q | 11.1 | 1117 | 1266 | 10,400,001 | 10,600,000 | acen | |
| Y | q | 11.21 | 1266 | 1397 | 10,600,001 | 12,400,000 | gneg | |
| Y | q | 11.221 | 1397 | 1713 | 12,400,001 | 17,100,000 | gpos | 50 |
| Y | q | 11.222 | 1713 | 1881 | 17,100,001 | 19,600,000 | gneg | |
| Y | q | 11.223 | 1881 | 2160 | 19,600,001 | 23,800,000 | gpos | 50 |
| Y | q | 11.23 | 2160 | 2346 | 23,800,001 | 26,600,000 | gneg | |
| Y | q | 12 | 2346 | 3650 | 26,600,001 | 57,227,415 | gvar |
Nicht-kombinierende Region des Y (NRY)
Das menschliche Y-Chromosom ist normalerweise nicht in der Lage, sich mit dem X-Chromosom zu rekombinieren, mit Ausnahme von kleinen Stücken pseudoautosomaler Regionen (PARs) an den Telomeren (die etwa 5 % der Chromosomenlänge ausmachen). Diese Regionen sind Relikte der alten Homologie zwischen dem X- und dem Y-Chromosom. Der größte Teil des Y-Chromosoms, der nicht rekombiniert, wird als "NRY" (non-recombining region of the Y chromosome) bezeichnet. Einzel-Nukleotid-Polymorphismen (SNPs) in dieser Region werden verwendet, um direkte väterliche Abstammungslinien zu verfolgen. ⓘ
Genauer gesagt liegt PAR1 bei 0,1-2,7 Mb. PAR2 liegt bei 56,9-57,2 Mb. Dazwischen befindet sich die nicht-vererbende Region (NRY) oder männerspezifische Region (MSY). ⓘ
Gene
Anzahl von Genen
Im Folgenden werden einige Schätzungen der Genanzahl des menschlichen Y-Chromosoms aufgeführt. Da die Forscher unterschiedliche Ansätze zur Genomannotation verwenden, variieren ihre Vorhersagen über die Anzahl der Gene auf jedem Chromosom (technische Einzelheiten siehe Genvorhersage). Unter den verschiedenen Projekten verfolgt das Collaborative Consensus Coding Sequence Project (CCDS) eine extrem konservative Strategie. Daher stellt die von CCDS vorhergesagte Genanzahl eine untere Grenze für die Gesamtzahl der menschlichen proteinkodierenden Gene dar. ⓘ
| Geschätzt durch | Protein-codierende Gene | Nicht-kodierende RNA-Gene | Pseudogene | Quelle | Datum der Freisetzung ⓘ |
|---|---|---|---|---|---|
| CCDS | 63 | — | — | 2016-09-08 | |
| HGNC | 45 | 55 | 381 | 2017-05-12 | |
| Ensembl | 63 | 109 | 392 | 2017-03-29 | |
| UniProt | 47 | — | — | 2018-02-28 | |
| NCBI | 73 | 122 | 400 | 2017-05-19 |
Gen-Liste
Im Allgemeinen ist das menschliche Y-Chromosom extrem genarm - es ist eine der größten Genwüsten im menschlichen Genom. Sieht man von den pseudoautosomalen Genen ab, sind auf dem menschlichen Y-Chromosom folgende Gene kodiert:
| Name | X-Paralog | Anmerkung ⓘ |
|---|---|---|
| SRY | SOX3 | Geschlechtsbestimmende Region. Dies ist der kurze p-Arm [Yp]. |
| ZFY | ZFX | Zinkfinger. |
| RPS4Y1 | RPS4X | Ribosomales Protein S4. |
| AMELY | AMELX | Amelogenin. |
| TBL1Y | TBL1X | |
| PCDH11Y | PDCH11X | X-transponierte Region (XTR) von Xq21, eines von zwei Genen. Einst als "PAR3" bezeichnet, später jedoch widerlegt. |
| TGIF2LY | TGIF2LX | Das andere X-transponierte Gen. |
| TSPY1, TSPY2 | TSPX | Hodenspezifisches Protein. |
| AZFa | (kein) | Kein Gen. Erster Teil der AZF-Region auf Arm q. Enthält die vier folgenden Gene. X-Gegenstücke entgehen der Inaktivierung. |
| USP9Y | USP9X | Ubiquitin-Protease. |
| DDX3Y | DDX3X | Helicase. |
| UTY | UTX | Histon-Demethylase. |
| TB4Y | TB4X | |
| AZFb | (kein) | Zweite AZF-Region auf Arm q. Anfällig für NAHR [nicht-allelische homologe Rekombination] mit AZFc. Überschneidet sich mit AZFc. Enthält drei Single-Copy-Genregionen und Wiederholungen. |
| CYorf15 | CXorf15 | |
| RPS4Y2 | RPS4X | Eine weitere Kopie des ribosomalen Proteins S4. |
| EIF1AY | EIF4AX | |
| KDM5D | KDM5C | |
| XKRY | XK (Protein) | Gefunden in dem "gelben" Amplikon. |
| HSFY1, HSFY2 | HSFX1, HSFX2 | Gefunden in dem "blauen" Amplikon. |
| PRY, PRY2 | Im "blauen" Amplikon gefunden. Identifiziert durch Ähnlichkeit mit PTPN13 (Chr. 4). | |
| RBMY1A1 | RBMY | Große Anzahl von Kopien. Teil einer RBM-Genfamilie von RNA-Erkennungsmotiv-Proteinen (RRM). |
| AZFc | (kein) | Letzter (distaler) Teil des AZF. Mehrere Palindrome. |
| DAZ1, DAZ2, DAZ3, DAZ4 | RRM-Gene in zwei palindromischen Clustern. BOLL und DAZLA sind autosomale Homologe. | |
| CDY1, CDY2 | CDY1 ist eigentlich zwei identische Kopien. CDY2 sind zwei eng verwandte Kopien im Palindrom P5. Wahrscheinlich von autosomalem CDYL abgeleitet. | |
| VCY1, VCY2 | VCX1 bis 3 | Drei Kopien von VCX2 (BPY2). Teil der VCX/VCY-Familie. Die beiden Kopien von BPY1 liegen stattdessen in Yq11.221/AZFa. |
Y-Chromosom-gebundene Krankheiten
Krankheiten, die mit dem Y-Chromosom in Verbindung stehen, gehen in der Regel mit einer Aneuploidie, einer atypischen Anzahl von Chromosomen, einher. ⓘ
Y-Chromosom-Mikrodeletion
Die Y-Chromosomen-Mikrodeletion (YCM) ist eine Familie von genetischen Störungen, die durch fehlende Gene im Y-Chromosom verursacht werden. Viele betroffene Männer weisen keine Symptome auf und führen ein normales Leben. Es ist jedoch auch bekannt, dass YCM bei einer beträchtlichen Anzahl von Männern mit verminderter Fruchtbarkeit oder reduzierter Spermienzahl auftritt. ⓘ
Defektes Y-Chromosom
Dies führt dazu, dass die Person einen weiblichen Phänotyp aufweist (d. h. mit frauenähnlichen Genitalien geboren wird), obwohl sie einen XY-Karyotyp besitzt. Das Fehlen des zweiten X führt zu Unfruchtbarkeit. Anders ausgedrückt, aus der entgegengesetzten Richtung betrachtet, durchläuft die Person eine Defeminisierung, die jedoch nicht zu einer vollständigen Maskulinisierung führt. ⓘ
Die Ursache kann in einem unvollständigen Y-Chromosom gesehen werden: Der übliche Karyotyp in diesen Fällen ist 45X, plus ein Fragment von Y. Dies führt in der Regel zu einer gestörten Hodenentwicklung, so dass das Kind intern oder extern vollständig ausgebildete männliche Genitalien haben kann oder auch nicht. Es kann die gesamte Bandbreite der Uneindeutigkeit der Struktur auftreten, insbesondere wenn Mosaizismus vorhanden ist. Wenn das Y-Fragment minimal und nicht funktionsfähig ist, ist das Kind in der Regel ein Mädchen mit den Merkmalen des Turner-Syndroms oder einer gemischten Gonadendysgenesie. ⓘ
XXY
Beim Klinefelter-Syndrom (47, XXY) handelt es sich nicht um eine Aneuploidie des Y-Chromosoms, sondern um ein zusätzliches X-Chromosom, das in der Regel zu einer gestörten postnatalen Hodenfunktion führt. Der Mechanismus ist nicht vollständig geklärt; er scheint nicht auf eine direkte Störung der Expression von Y-Genen durch das zusätzliche X-Chromosom zurückzuführen zu sein. ⓘ
XYY
Das 47, XYY-Syndrom (einfach als XYY-Syndrom bezeichnet) wird durch das Vorhandensein einer einzigen zusätzlichen Kopie des Y-Chromosoms in jeder Zelle eines Mannes verursacht. 47, XYY-Männer haben ein X-Chromosom und zwei Y-Chromosomen, also insgesamt 47 Chromosomen pro Zelle. Forscher haben herausgefunden, dass eine zusätzliche Kopie des Y-Chromosoms bei einigen Jungen und Männern mit einer größeren Statur und häufigeren Lernproblemen verbunden ist, aber die Auswirkungen sind unterschiedlich, oft minimal, und die große Mehrheit kennt ihren Karyotyp nicht. ⓘ
In den Jahren 1965 und 1966 veröffentlichten Patricia Jacobs und Kollegen eine Chromosomenuntersuchung von 315 männlichen Patienten der Schottlands einzigem Spezialkrankenhaus für Entwicklungsbehinderte, Dabei stellten sie fest, dass mehr Patienten als erwartet ein zusätzliches Y-Chromosom hatten. Die Autoren dieser Studie fragten sich, "ob ein zusätzliches Y-Chromosom seine Träger zu ungewöhnlich aggressivem Verhalten prädisponiert", und diese Vermutung "prägte die nächsten fünfzehn Jahre der Forschung über das menschliche Y-Chromosom". ⓘ
In den folgenden zehn Jahren wurde diese Vermutung durch Studien widerlegt: Die erhöhte Kriminalitätsrate von XYY-Männern ist auf eine niedrigere mittlere Intelligenz und nicht auf eine erhöhte Aggressivität zurückzuführen, und die erhöhte Körpergröße war das einzige Merkmal, das zuverlässig mit XYY-Männern in Verbindung gebracht werden konnte. Das Konzept des "kriminellen Karyotyps" ist also unzutreffend. ⓘ
Seltene
Die folgenden Krankheiten, die mit dem Y-Chromosom in Verbindung stehen, sind selten, aber bemerkenswert, weil sie Aufschluss über die Natur des Y-Chromosoms geben. ⓘ
Mehr als zwei Y-Chromosomen
Größere Ausprägungen der Y-Chromosomen-Polysomie (mit mehr als einer zusätzlichen Kopie des Y-Chromosoms in jeder Zelle, z. B. XYYY) sind wesentlich seltener. Das zusätzliche genetische Material kann in diesen Fällen zu Skelettanomalien, Zahnanomalien, vermindertem IQ, verzögerter Entwicklung und Atemproblemen führen, aber die Schweregrade dieser Erkrankungen sind unterschiedlich. ⓘ
XX-Männchen-Syndrom
Das XX-Männchen-Syndrom tritt auf, wenn bei der Bildung der männlichen Geschlechtszellen eine Rekombination stattgefunden hat, bei der der SRY-Anteil des Y-Chromosoms auf das X-Chromosom verschoben wurde. Wenn ein solches X-Chromosom zum Kind beiträgt, wird die Entwicklung aufgrund des SRY-Gens zu einem Mann führen. ⓘ
Genetische Genealogie
In der humangenetischen Genealogie (der Anwendung der Genetik auf die traditionelle Genealogie) ist die Nutzung der im Y-Chromosom enthaltenen Informationen von besonderem Interesse, da das Y-Chromosom im Gegensatz zu anderen Chromosomen ausschließlich vom Vater an den Sohn in der patrilinearen Linie weitergegeben wird. Die mitochondriale DNA, die mütterlicherseits sowohl an die Söhne als auch an die Töchter vererbt wird, wird auf analoge Weise verwendet, um die matrilineare Linie zu verfolgen. ⓘ
Funktion des Gehirns
In der Forschung wird derzeit untersucht, ob die männlich geprägte neuronale Entwicklung eine direkte Folge der mit dem Y-Chromosom verbundenen Genexpression oder eine indirekte Folge der mit dem Y-Chromosom verbundenen Produktion androgener Hormone ist. ⓘ
Mikrochimärismus
Das Vorhandensein von männlichen Chromosomen in fötalen Zellen im Blutkreislauf von Frauen wurde 1974 entdeckt. ⓘ
Im Jahr 1996 wurde festgestellt, dass männliche fötale Vorläuferzellen nach der Geburt bis zu 27 Jahre lang im mütterlichen Blutkreislauf verbleiben können. ⓘ
In einer Studie des Fred Hutchinson Cancer Research Center, Seattle, aus dem Jahr 2004 wurde die Herkunft der männlichen Chromosomen im peripheren Blut von Frauen untersucht, die keine männlichen Nachkommen hatten. Insgesamt wurden 120 Probanden (Frauen, die nie Söhne gehabt hatten) untersucht, und es wurde festgestellt, dass 21 % von ihnen männliche DNA hatten. Die Probanden wurden anhand ihrer Krankengeschichte in vier Gruppen eingeteilt:
- Gruppe A (8 %) hatte nur weibliche Nachkommenschaft gehabt.
- Die Patientinnen der Gruppe B (22 %) hatten eine oder mehrere Fehlgeburten hinter sich.
- Bei den Patientinnen der Gruppe C (57 %) wurden die Schwangerschaften medizinisch beendet.
- Gruppe D (10 %) war noch nie schwanger gewesen. ⓘ
In der Studie wurde festgestellt, dass 10 % der Frauen noch nie schwanger gewesen waren, was die Frage aufwirft, woher die Y-Chromosomen in ihrem Blut stammen könnten. Die Studie legt nahe, dass mögliche Gründe für das Auftreten eines männlichen Chromosomen-Mikrochimärismus einer der folgenden sein könnte:
- Fehlgeburten,
- Schwangerschaften,
- verschwundener männlicher Zwilling,
- möglicherweise durch Geschlechtsverkehr. ⓘ
In einer Studie des gleichen Instituts aus dem Jahr 2012 wurden Zellen mit dem Y-Chromosom in mehreren Bereichen des Gehirns verstorbener Frauen nachgewiesen. ⓘ
Theorie der Entstehung des Y-Chromosoms bei Säugetieren
Ansammlung von Fertilitätsgenen
Neben dem Verlust von Genen kann aber auch ein Erwerb vor allem der Fertilitäts-Gene beim Y-Chromosom festgestellt werden:
- Zum einen entstanden durch Mutationen auf dem Y-Chromosom neue Gene.
- Zum anderen sammelten sich Gene von anderen Chromosomen durch Translokation auf dem Y-Chromosom. ⓘ
Es ist noch nicht geklärt, welcher Evolutionsmechanismus zu dieser Ansammlung führte. Möglicherweise müssen sich die Fertilitätsgene auf dem Y-Chromosom sammeln, da die Weibchen ohne Schaden zu erleiden auf diese nur für die Reifung der Spermien wichtigen Gene verzichten können. ⓘ
Stabilität der Fertilitätsgene
Eigentlich müssten die Fertilitätsgene, die nur auf dem Y-Chromosom vorkommen, aufgrund der fehlenden Rekombinationsmöglichkeit auch zugrunde gehen. Sie liegen jedoch auf einem Chromosom in mehreren Kopien vor, die einzelne Verluste kompensieren können. ⓘ
Bekannte Gene auf dem Y-Chromosom
Das Y-Chromosom enthält unter anderem folgende Gene:
- AMELY Amelogenin, Y Isoform
- RPS4Y1 40S ribosomales Protein S4, Y Isoform1
- RPS4Y2 40S ribosomales Protein S4, Y Isoform2
- AZF1 Azoospermia Factor 1
- BPY2 Testis-specific basic protein Y 2
- DAZ1 Deleted in azoospermia protein 1
- DAZ2 Deleted in azoospermia protein 2
- DDX3Y DEAD-box helicase 3, Y-linked
- PRKY Serin/Threonin-Proteinkinase PRKY
- RBMY1A1 RNA binding motif protein, Y-linked, family 1, member A1
- SRY sex-determining region of Y
- TSPY Testis-specific Y-encoded protein 1
- USP9Y Ubiquitin specific peptidase 9, Y-linked
- UTY
- ZFY Zinc finger Y-chromosomal protein ⓘ
Von den Genen des Y-Chromosoms sind in Mäusen zwei Gene essentiell, SRY und Eif2s3y. Werden diese beiden Gene auf anderen Chromosomen untergebracht, können (männliche) Mäuse ohne Y-Chromosom erzeugt werden. ⓘ
Synonyme
Das Y-Chromosom wird in der Bioinformatik auch als 24. Chromosom bezeichnet, wenn bestimmte Datenbanken nur die Eingabe von Zahlen zulassen. ⓘ

