Elektronenmikroskop

Ein Elektronenmikroskop (früher auch Übermikroskop) ist ein Mikroskop, welches das Innere oder die Oberfläche eines Objekts mit Elektronen abbilden kann. Wie bei klassischen Lichtmikroskopen ist auch hier das Auflösungsvermögen von der verwendeten Wellenlänge abhängig. Da die Materiewelle, die schnellen Elektronen zugeordnet werden kann, eine sehr viel kürzere Wellenlänge besitzt als sichtbares Licht, kann mit einem Elektronenmikroskop eine deutlich höhere Auflösung (derzeit etwa 0,1 nm) erreicht werden als mit einem Lichtmikroskop (etwa 200 nm). Während die Auflösung von Lichtmikroskopen tatsächlich die durch Beugung bedingte physikalische Grenze erreicht, verschlechtern bei Elektronenmikroskopen die Aberrationen der elektronenoptischen Bauteile die nutzbare Auflösung um etwa eineinhalb Größenordnungen gegenüber der theoretisch möglichen Auflösung, die für 100 keV Elektronenenergie etwa 0,0037 nm beträgt. ⓘ
Es gibt verschiedene Typen von Elektronenmikroskopen, die auf unterschiedliche Weise ein Bild des Objekts erzeugen:
- Bei Transmissionselektronenmikroskopen werden elektronenoptische Linsen eingesetzt, die mittels magnetischer oder elektrischer Felder die Elektronenbahnen ähnlich wie Licht beim Durchgang durch lichtoptische Sammellinsen ablenken. Dadurch ergibt sich eine Analogie zwischen traditionellen Durchlichtmikroskopen und den Transmissionselektronenmikroskopen bis hin zum Strahlengang.
- Sekundärelektronenmikroskope beschreiten einen anderen Weg der Bilderzeugung ähnlich den konfokalen Lichtmikroskopen. ⓘ

Elektronenmikroskope nutzen geformte Magnetfelder, um elektronenoptische Linsensysteme zu bilden, die den Glaslinsen eines optischen Lichtmikroskops entsprechen. ⓘ
Elektronenmikroskope werden zur Untersuchung der Ultrastruktur eines breiten Spektrums biologischer und anorganischer Proben eingesetzt, darunter Mikroorganismen, Zellen, große Moleküle, Biopsieproben, Metalle und Kristalle. In der Industrie werden Elektronenmikroskope häufig zur Qualitätskontrolle und Fehleranalyse eingesetzt. Moderne Elektronenmikroskope erstellen elektronenmikroskopische Bilder mit Hilfe spezieller Digitalkameras und Framegrabbern, die die Bilder aufnehmen. ⓘ
Geschichte


Die erste auf magnetischen Kräften beruhende Linse wurde 1926 von Hans Busch entwickelt. Als erstes Elektronenmikroskop – seinerzeit auch als Übermikroskop bezeichnet – wurde 1931 ein TEM von Ernst Ruska und Max Knoll gebaut, wenngleich zunächst keine elektronentransparenten Objekte, sondern testweise kleine Metallgitter abgebildet wurden. Für diese Arbeit erhielt Ruska 1986 den Physik-Nobelpreis. Er entwickelte auch bei Siemens 1938 das erste kommerzielle Elektronenmikroskop. ⓘ
Etwa zeitgleich mit Ruska und Knoll baute Reinhold Rüdenberg ein elektrostatisches Elektronenmikroskop, für das er 1931 ein Patent bekam. ⓘ
Die Kontrastierung biologischer Objekte mit Osmiumsäure schlug Ladislaus Marton 1934 vor. Das erste STEM wurde 1937 von Manfred von Ardenne gebaut. ⓘ
Das erste sowjetische Elektronenmikroskop wurde 1940 von Wiktor Werzner gebaut. ⓘ
Während in den frühen Jahren die Aufklärung lichtmikroskopisch unsichtbarer Krankheitserreger (Viren) eine bedeutende Triebfeder für die Entwicklung des Elektronenmikroskops war, erweiterte sich das Interesse später besonders auf die Materialwissenschaft, nachdem Robert D. Heidenreich 1949 die Präparation dünner durchstrahlbarer Metallfolien gelang. ⓘ
In den 1960er Jahren entwickelte man TEM mit immer höherer Beschleunigungsspannung (bis zu 3 MV, um 1965 in Toulouse, 1970 in Osaka), vor allem um dickere Objekte durchstrahlen zu können. In diesem Jahrzehnt wurde auch erstmals atomare Auflösung erreicht. ⓘ
Ende der 1960er Jahre führte Albert Crewe den Feldemitter für STEM ein und verhalf dieser Technik damit erst zu ihrer Bedeutung. ⓘ
Ende der 1980er Jahre wurde das ESEM entwickelt. Seit Ende der 1980er Jahre werden Schottky-Feldemitter in TEM eingesetzt. Seit Anfang der 1990er Jahre kommen FESEM mit Schottky-Feldemitter zum Einsatz. ⓘ
Erwähnenswert ist auch der zunehmende Einsatz von Computern seit den 1990er Jahren. So lassen sich beispielsweise komplizierte Linsensysteme automatisch durch Analyse der Aufnahmen einer CCD-Kamera justieren, was den Benutzer des Mikroskops deutlich entlastet. Unabdingbar ist der Einsatz von Computern zur Kompensation von Aberrationen der elektronenoptischen Linsen mit magnetischen Multipollinsen, eine Technik, die in den letzten Jahren sowohl im REM, TEM, wie auch im STEM-Bereich immer mehr Bedeutung erlangt. ⓘ
Anfang 2008 wurde ein neues Transmissionselektronenmikroskop mit Aberrationskorrektur, „TEAM“ genannt, angekündigt. Es weist eine Auflösung von 0,05 nm auf. ⓘ
Im Dezember 2008 wurde vom Forschungszentrum Jülich der Bau eines 15 Millionen Euro kostenden Labors mit Elektronenmikroskop am Ernst-Ruska-Centrum für Mikroskopie und Spektroskopie angekündigt. Mit einer Auflösung von ebenfalls 0,05 nm wird es zu den auflösungsstärksten Mikroskopen der Welt gehören. ⓘ
Anlässlich der Verleihung des Kavli-Preises für Nanotechnologie 2020 an Maximilian Haider et al. wurde eine Rekordauflösung von 43 Pikometer genannt – weniger als der Atomdurchmesser von Wasserstoff. Haider leitet die 1996 gegründete Firma CEOS (Corrected Electron Optical Systems) die Abbildungselemente für Elektronenmikroskope herstellt. Haider erhielt mit Harald Rose (Physiker) und Knut Urban 2011 den Wolf-Preis in Physik für Verbesserung der Auflösung von Elektronenmikroskopen und alle drei erhielten mit Ondrej Krivanek 2020 den Kavli-Preis für Leistungen auf dem Gebiet der Elektronenmikroskopie. Krivanek entwickelte Aberrationskorrektoren (bis 3. Ordnung), Methoden der Elektronenenergieverlustspektroskopie (EELS), demonstrierte Sub-Angström Elektronenmikroskopie und die Kopplung mit Vibrationsspektroskopie zum Beispiel in der Biologie und analytischen Chemie. ⓘ
Der Nobelpreis wurde für das Gebiet der Elektronenmikroskopie außer an Ruska auch an Jacques Dubochet, Richard Henderson und Joachim Frank verliehen (Kryo-Elektronenmikroskopie, Nobelpreis für Chemie 2017). ⓘ

Typen
Transmissionselektronenmikroskop (TEM)
Die ursprüngliche Form des Elektronenmikroskops, das Transmissionselektronenmikroskop (TEM), verwendet einen Hochspannungselektronenstrahl, um die Probe zu beleuchten und ein Bild zu erzeugen. Der Elektronenstrahl wird von einer Elektronenkanone erzeugt, die in der Regel mit einer Wolframglühkathode als Elektronenquelle ausgestattet ist. Der Elektronenstrahl wird durch eine Anode beschleunigt, die in der Regel bei +100 keV (40 bis 400 keV) gegenüber der Kathode liegt, durch elektrostatische und elektromagnetische Linsen fokussiert und durch die Probe geleitet, die für die Elektronen teilweise durchlässig ist und sie teilweise aus dem Strahl streut. Beim Austritt aus der Probe trägt der Elektronenstrahl Informationen über die Struktur der Probe, die durch das Objektivsystem des Mikroskops vergrößert wird. Die räumliche Veränderung dieser Information (das "Bild") kann durch Projektion des vergrößerten Elektronenbildes auf einen fluoreszierenden Bildschirm betrachtet werden, der mit einem Leuchtstoff oder Szintillatormaterial wie Zinksulfid beschichtet ist. Alternativ kann das Bild fotografisch aufgezeichnet werden, indem ein fotografischer Film oder eine fotografische Platte direkt dem Elektronenstrahl ausgesetzt wird, oder ein hochauflösender Leuchtstoff kann über ein optisches Linsensystem oder einen faseroptischen Lichtleiter an den Sensor einer Digitalkamera gekoppelt werden. Das von der Digitalkamera erfasste Bild kann auf einem Monitor oder Computer angezeigt werden. ⓘ
Die Auflösung von TEMs wird in erster Linie durch sphärische Aberration begrenzt, aber eine neue Generation von Hardware-Korrektoren kann die sphärische Aberration reduzieren, um die Auflösung in der hochauflösenden Transmissions-Elektronenmikroskopie (HRTEM) auf unter 0,5 Angström (50 Pikometer) zu erhöhen, was Vergrößerungen von über 50 Millionen Mal ermöglicht. Die Fähigkeit der HRTEM, die Positionen von Atomen in Materialien zu bestimmen, ist für die Forschung und Entwicklung im Bereich der Nanotechnologie von Nutzen. ⓘ
Transmissionselektronenmikroskope werden häufig im Elektronenbeugungsmodus eingesetzt. Die Vorteile der Elektronenbeugung gegenüber der Röntgenkristallographie liegen darin, dass die Probe kein Einkristall oder sogar ein polykristallines Pulver sein muss und dass die Fourier-Transformationsrekonstruktion der vergrößerten Struktur des Objekts physikalisch erfolgt, so dass das Phasenproblem, mit dem die Röntgenkristallographen nach der Gewinnung ihrer Röntgenbeugungsmuster konfrontiert sind, nicht gelöst werden muss. ⓘ
Ein großer Nachteil des Transmissionselektronenmikroskops besteht darin, dass extrem dünne Schnitte der Proben benötigt werden, in der Regel etwa 100 Nanometer. Die Herstellung dieser Dünnschliffe für biologische und materielle Proben ist technisch sehr anspruchsvoll. Halbleiterdünnschnitte können mit einem fokussierten Ionenstrahl hergestellt werden. Biologische Gewebeproben werden chemisch fixiert, dehydriert und in ein Polymerharz eingebettet, um sie so weit zu stabilisieren, dass ultradünne Schnitte möglich sind. Schnitte biologischer Proben, organischer Polymere und ähnlicher Materialien müssen unter Umständen mit Schweratom-Markern eingefärbt werden, um den erforderlichen Bildkontrast zu erzielen. ⓘ
Serienschnitt-Elektronenmikroskop (ssEM)
Eine Anwendung der TEM ist die Serienschnitt-Elektronenmikroskopie (ssEM), z. B. bei der Analyse der Konnektivität in volumetrischen Proben von Hirngewebe, indem viele Dünnschnitte nacheinander aufgenommen werden. Dies kann durch die Einführung einer Fräsmethode in die Bildgebungspipeline erreicht werden, bei der aufeinanderfolgende Schichten eines 3D-Volumens dem Strahl ausgesetzt und abgebildet werden. Zu diesen Methoden gehören Serial Block Face SEM (SB-SEM) und Focused Ion Beam-SEM (FIB-SEM). Durch die Vorverarbeitung von Volumina zur Erstellung vieler Schichten, die automatisiert abgebildet werden, wurde kürzlich eine Hochdurchsatz-Bildgebung von Volumina bis zu 1 mm3 erreicht. Mit dieser Methode können ganze lokale neuronale Mikroschaltkreise aufgelöst werden, obwohl der apparative und zeitliche Aufwand hierfür noch immer beträchtlich ist: Die Abbildung eines 1 mm3-Blocks Hirngewebe erforderte sechs Monate nahezu kontinuierlicher Abbildung durch sechs parallel laufende TEM. ⓘ
Rastertransmissionselektronenmikroskop (STEM)
Das STEM rastert eine fokussierte einfallende Sonde über eine Probe, die (wie beim TEM) ausgedünnt wurde, um den Nachweis von durch die Probe gestreuten Elektronen zu erleichtern. Die hohe Auflösung des TEM ist somit auch im STEM möglich. Die Fokussierung (und die Aberrationen) finden beim STEM vor dem Auftreffen der Elektronen auf die Probe statt, beim TEM erst danach. Die Verwendung eines REM-ähnlichen Strahlrasters im STEM vereinfacht die ringförmige Dunkelfeldabbildung und andere Analysetechniken, bedeutet aber auch, dass die Bilddaten seriell und nicht parallel erfasst werden. Häufig kann ein TEM mit der Option des Scannens ausgestattet werden, so dass es sowohl als TEM als auch als STEM fungieren kann. ⓘ
Rasterelektronenmikroskop (SEM)

Beim Rasterelektronenmikroskop (REM; oder englisch scanning electron microscope, SEM) wird ein dünner Elektronenstrahl über das üblicherweise massive Objekt gerastert. Dabei werden aus dem Objekt wieder austretende oder rückgestreute Elektronen, oder auch andere Signale, synchron detektiert, der detektierte Strom bestimmt den Intensitätswert des zugeordneten (momentan vom Elektronenstrahl bestrahlten) Bildpunktes. Meist werden die Daten auch sofort auf Monitoren dargestellt, sodass man den Bildaufbau in Echtzeit verfolgen kann. Bei alten REM ohne Rechneranbindung wurde mit der Signalintensität eine Kathodenstrahlröhre direkt angesteuert, zur Bildspeicherung wurde dann das auf dem Leuchtschirm dieser Röhre geschriebene Bild mit einer Fotokamera bei entsprechend langer Verschlussöffnungszeit fotografiert. ⓘ
Die wichtigsten im REM zur Abbildung der Objektoberfläche genutzten Signale sind Sekundärelektronen (SE) und Rückstreuelektronen (BE oder BSE vom engl. back scattered electrons). Das Kathodolumineszenz (KL)-Signal (oder englisch cathodoluminescence, CL) ist von untergeordneter Bedeutung und wird nur in speziellen Untersuchungen angewandt. ⓘ
Bei den SE handelt es sich um niederenergetische Elektronen, die durch den Primärelektronenbeschuss freigesetzt werden. Damit ist eine sehr hohe Auflösung möglich. Die SE werden durch eine Saugspannung in Richtung des Detektors beschleunigt und erzeugen dort eine ihrer Menge entsprechende Anzahl von elektrischen Impulsen. Je nach Positionierung des Detektors in der Objektkammer wird ein unterschiedliches Bild erzeugt. Der Standard-SE-Detektor ist seitlich über dem Objekt angebracht und liefert ein sehr natürliches, räumlich wirkendes Bild, weil die dem Detektor zugewandte Seite heller ist als die abgewandte. Früher nannte man ein REM, das nur in dieser Betriebsart arbeitete, Sekundärelektronenmikroskop. Ein weiterer bei modernen REM vorhandener SE-Detektor ist der sogenannte „Inlens“-Detektor, der ringförmig oberhalb des Objekts im Inneren der Säule angebracht ist. Er ermöglicht aufgrund des sehr geringen Arbeitsabstands sehr hoch aufgelöste Bilder (wenige Nanometer) bei geringen Beschleunigungsspannungen des Primärstrahls (einige hundert Volt). ⓘ
Die BE oder BSE sind Elektronen aus dem Primärstrahl, die an den getroffenen Atomkernen an oder bis zu einige zehn Nanometer unterhalb der Objektoberfläche elastisch gestreut werden. Die Energie der Elektronen liegt dabei im Bereich der eingestrahlten Primärelektronen, die Bildauflösung liegt je nach Primärenergie im Mikrometerbereich. Der BSE-Detektor ist in der Regel als 4-Quadranten-Halbleiter-Detektor direkt oberhalb des Objekts platziert. Abhängig von der Beschaltung der Halbleiterkristalle erhält man unterschiedliche Topographiekontraste, wobei tiefliegende Bereiche des Objekts dunkel erscheinen. Die Eigenschaft, dass schwere Elemente die Elektronen stärker reflektieren als leichte, macht man sich mit dem sogenannten Z-Kontrast (Z = Ordnungszahl der Elemente) zunutze. So lässt die Helligkeit des Bildbereichs Rückschlüsse auf die chemische Natur der Objektoberfläche zu. ⓘ
Als Kathodolumineszenz (KL) bezeichnet man die durch Elektronenbeschuss ausgelöste Lumineszenz der Objektoberfläche. Das KL-Signal, das heißt das vom Objekt emittierte Licht, wird über spezielle Spiegel und Lichtleiter aus der Objektkammer herausgeführt, mittels Monochromator spektral zerlegt und über einen Photomultiplier oder einen CCD-Detektor detektiert. ⓘ
Eine weitere, derzeit stark an Bedeutung gewinnende Untersuchungsmethode am REM (aber auch am Transmissionselektronenmikroskop), die jedoch nicht die Objektoberfläche abbildet, benutzt die Elektronenrückstreubeugung. Mit ihrer Hilfe kann man die kristallographische Orientierung von Kristallen an der Objektoberfläche bestimmen. Dies ist zum Beispiel zur Charakterisierung von Materialeigenschaften in der Werkstoffwissenschaft und Geologie von großer Bedeutung. Hierzu werden die von den Kristallflächen des Objekts reflektierten Elektronen auf einen Detektorschirm projiziert und die so entstehenden Kikuchi-Linien mit Hilfe eines Computers analysiert und kristallographischen Richtungen zugeordnet. ⓘ
Die Elektronenmikrosonde ist ein spezielles Rasterelektronenmikroskop, das darauf optimiert ist, chemische Analysen an Oberflächen im Mikrometer-Bereich durchzuführen. Hier kommen die wellenlängendispersive (WDX) oder die energiedispersive (EDX) Röntgenanalyse zur Anwendung. ⓘ
Ein ESEM (englisch environmental scanning electron microscope) erlaubt es, mit einem relativ hohen Gasdruck (einige Dutzend Millibar) in Objektnähe zu arbeiten. Dadurch ist es möglich, auch feuchte Objekte (beispielsweise lebende Zellen oder wachsende Kristalle) zu untersuchen. ⓘ
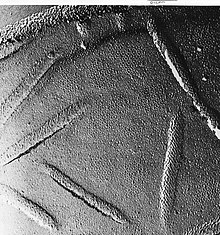
Das REM erzeugt Bilder, indem es die Probe mit einem fokussierten Elektronenstrahl untersucht, der über einen rechteckigen Bereich der Probe gescannt wird (Rasterabtastung). Wenn der Elektronenstrahl mit der Probe in Wechselwirkung tritt, verliert er durch eine Reihe von Mechanismen Energie. Die verlorene Energie wird in andere Formen umgewandelt, z. B. in Wärme, die Emission von Sekundärelektronen mit niedriger Energie und von Rückstreuelektronen mit hoher Energie, Lichtemission (Kathodolumineszenz) oder Röntgenemission, die alle Signale liefern, die Informationen über die Eigenschaften der Probenoberfläche, z. B. ihre Topografie und Zusammensetzung, enthalten. Das von einem REM angezeigte Bild bildet die variierende Intensität eines dieser Signale an einer Stelle im Bild ab, die der Position des Strahls auf der Probe entspricht, als das Signal erzeugt wurde. In dem unten und rechts gezeigten REM-Bild einer Ameise wurde das Bild aus den von einem Sekundärelektronendetektor erzeugten Signalen konstruiert, dem normalen oder konventionellen Abbildungsmodus der meisten REMs. ⓘ
Im Allgemeinen ist die Bildauflösung eines SEM geringer als die eines TEM. Da das REM jedoch die Oberfläche einer Probe und nicht ihr Inneres abbildet, müssen die Elektronen nicht durch die Probe wandern. Dadurch entfällt die Notwendigkeit einer umfangreichen Probenvorbereitung, um die Probe auf Elektronentransparenz zu verdünnen. Das REM ist in der Lage, Massenproben abzubilden, die auf den Probentisch passen und noch manövriert werden können, einschließlich einer Höhe, die geringer ist als der verwendete Arbeitsabstand, häufig 4 Millimeter für hochauflösende Bilder. Das REM hat auch eine große Tiefenschärfe und kann daher Bilder erzeugen, die die dreidimensionale Oberflächenform der Probe gut wiedergeben. Ein weiterer Vorteil des REM sind die Umwelt-Rasterelektronenmikroskope (Environmental Scanning Electron Microscopes, ESEM), die Bilder von guter Qualität und Auflösung mit hydratisierten Proben oder im Niedrig- statt im Hochvakuum oder unter Kammergasen erzeugen können. Dies erleichtert die Abbildung unfixierter biologischer Proben, die im Hochvakuum herkömmlicher Elektronenmikroskope instabil sind.

Reflexionselektronenmikroskop (REM)
Beim Reflexionselektronenmikroskop (REM) wird wie beim TEM ein Elektronenstrahl auf eine Oberfläche auftreffen, aber anstelle von Transmissions- (TEM) oder Sekundärelektronen (SEM) wird der reflektierte Strahl elastisch gestreuter Elektronen nachgewiesen. Diese Technik wird in der Regel mit der Reflexions-Hochenergie-Elektronenbeugung (RHEED) und der Reflexions-Hochenergieverlust-Spektroskopie (RHELS) gekoppelt. Eine weitere Variante ist die spinpolarisierte Niedrigenergie-Elektronenmikroskopie (SPLEEM), die zur Untersuchung der Mikrostruktur magnetischer Domänen eingesetzt wird. ⓘ
Rastertunnelmikroskopie (STM)
Bei der STM wird eine leitende Spitze, die an eine Spannung gehalten wird, in die Nähe einer Oberfläche gebracht, und es kann ein Profil auf der Grundlage der Tunnelwahrscheinlichkeit eines Elektrons von der Spitze zur Probe erstellt werden, da diese eine Funktion der Entfernung ist. ⓘ
Farbe
In den gängigsten Konfigurationen erzeugen Elektronenmikroskope Bilder mit einem einzigen Helligkeitswert pro Pixel, wobei die Ergebnisse gewöhnlich in Graustufen wiedergegeben werden. Häufig werden diese Bilder jedoch mit Hilfe einer Software zur Erkennung von Merkmalen oder einfach durch manuelle Bearbeitung in einem Grafikeditor eingefärbt. Dies kann zur Verdeutlichung der Struktur oder aus ästhetischen Gründen geschehen und fügt im Allgemeinen keine neuen Informationen über das Exemplar hinzu. ⓘ
In einigen Konfigurationen werden Informationen über mehrere Eigenschaften der Probe pro Pixel erfasst, in der Regel durch den Einsatz mehrerer Detektoren. Im REM können die Attribute Topographie und Materialkontrast durch ein Paar von Rückstreuelektronendetektoren erfasst werden, und diese Attribute können in einem einzigen Farbbild überlagert werden, indem jedem Attribut eine andere Primärfarbe zugewiesen wird. In ähnlicher Weise kann eine Kombination von Rückstreu- und Sekundärelektronensignalen verschiedenen Farben zugeordnet und in einem einzigen Farbmikroskopbild überlagert werden, das gleichzeitig die Eigenschaften der Probe anzeigt. ⓘ
Einige Arten von Detektoren, die im REM verwendet werden, haben analytische Fähigkeiten und können mehrere Daten pro Pixel liefern. Beispiele hierfür sind die Detektoren der energiedispersiven Röntgenspektroskopie (EDS), die in der Elementaranalyse verwendet werden, und Kathodolumineszenzmikroskopsysteme (CL), die die Intensität und das Spektrum der elektroneninduzierten Lumineszenz in (z. B.) geologischen Proben analysieren. In REM-Systemen, die diese Detektoren verwenden, ist es üblich, die Signale farblich zu kodieren und sie in einem einzigen Farbbild zu überlagern, so dass Unterschiede in der Verteilung der verschiedenen Komponenten der Probe deutlich zu sehen und zu vergleichen sind. Optional kann das Standard-Sekundärelektronenbild mit einem oder mehreren Zusammensetzungskanälen zusammengeführt werden, so dass die Struktur und Zusammensetzung der Probe verglichen werden kann. Solche Bilder können unter Beibehaltung der vollständigen Integrität des ursprünglichen Signals erstellt werden, das in keiner Weise verändert wird. ⓘ
Vorbereitung der Probe

Materialien, die unter dem Elektronenmikroskop betrachtet werden sollen, müssen unter Umständen bearbeitet werden, um eine geeignete Probe herzustellen. Die erforderliche Technik hängt von der Art der Probe und der gewünschten Analyse ab:
- Chemische Fixierung - bei biologischen Proben soll die bewegliche makromolekulare Struktur der Probe durch chemische Vernetzung von Proteinen mit Aldehyden wie Formaldehyd und Glutaraldehyd und von Lipiden mit Osmiumtetroxid stabilisiert werden.
- Negativfärbung - Suspensionen, die Nanopartikel oder feines biologisches Material (wie Viren und Bakterien) enthalten, werden kurz mit einer verdünnten Lösung einer elektronenopaken Lösung wie Ammoniummolybdat, Uranylacetat (oder Formiat) oder Phosphowolframsäure vermischt. Diese Mischung wird auf ein entsprechend beschichtetes EM-Gitter aufgetragen, abgetupft und anschließend getrocknet. Die Betrachtung dieses Präparats im TEM sollte ohne Verzögerung erfolgen, um optimale Ergebnisse zu erzielen. Die Methode ist in der Mikrobiologie für eine schnelle, aber grobe morphologische Identifizierung wichtig, kann aber auch als Grundlage für eine hochauflösende 3D-Rekonstruktion mit Hilfe der EM-Tomographie-Methode verwendet werden, wenn Kohlenstofffolien als Träger verwendet werden. Die Negativfärbung wird auch zur Beobachtung von Nanopartikeln verwendet.
- Kryofixierung - Einfrieren einer Probe in flüssigem Ethan, und zwar so schnell, dass das Wasser glasartiges (nicht kristallines) Eis bildet. Dadurch wird die Probe in einer Momentaufnahme ihres Lösungszustands konserviert. Aus dieser Technik hat sich ein ganzer Bereich namens Kryo-Elektronenmikroskopie entwickelt. Mit der Entwicklung der Kryo-Elektronenmikroskopie gläserner Schnitte (CEMOVIS) ist es nun möglich, Proben von praktisch jedem biologischen Präparat nahe an seinem ursprünglichen Zustand zu betrachten.
- Dehydratisierung - oder Ersatz von Wasser durch organische Lösungsmittel wie Ethanol oder Aceton, gefolgt von einer Trocknung am kritischen Punkt oder Infiltration mit Einbettungsharzen. Auch Gefriertrocknung.
- Einbettung biologischer Proben - nach der Dehydrierung wird das Gewebe für die Betrachtung im Transmissionselektronenmikroskop eingebettet, damit es für die Betrachtung geschnitten werden kann. Dazu wird das Gewebe durch ein "Übergangslösungsmittel" wie Propylenoxid (Epoxypropan) oder Aceton geleitet und dann mit einem Epoxidharz wie Araldite, Epon oder Durcupan infiltriert; Gewebe kann auch direkt in wassermischbares Acrylharz eingebettet werden. Nach der Polymerisation (Aushärtung) des Harzes wird die Probe in Dünnschnitte (Ultradünnschnitte) geschnitten und gefärbt - dann ist sie zur Betrachtung bereit.
- Einbetten, Materialien - nach dem Einbetten in Harz wird die Probe in der Regel mit ultrafeinen Schleifmitteln geschliffen und poliert, bis sie spiegelglatt ist. Der Poliervorgang muss sorgfältig durchgeführt werden, um Kratzer und andere Polierartefakte, die die Bildqualität beeinträchtigen, zu vermeiden.
- Metallschattierung - Metall (z. B. Platin) wird von einer Überkopf-Elektrode aufgedampft und in einem Winkel auf die Oberfläche einer biologischen Probe aufgebracht. Die Oberflächentopografie führt zu Schwankungen in der Dicke des Metalls, die sich im elektronenmikroskopischen Bild als Helligkeits- und Kontrastschwankungen bemerkbar machen.
- Replikation - Eine mit Metall (z. B. Platin oder einem Gemisch aus Kohlenstoff und Platin) schräg beschichtete Oberfläche wird mit reinem Kohlenstoff beschichtet, der von Kohlenstoffelektroden im rechten Winkel zur Oberfläche verdampft wird. Anschließend wird das Probenmaterial abgetragen (z. B. in einem Säurebad, mit Hilfe von Enzymen oder durch mechanische Abtrennung), um ein Oberflächenabbild zu erhalten, das die Ultrastruktur der Oberfläche aufzeichnet und mit Hilfe der Transmissionselektronenmikroskopie untersucht werden kann.
- Schneiden - erzeugt dünne Scheiben der Probe, die für Elektronen halbtransparent sind. Diese können auf einem Ultramikrotom mit einem Glas- oder Diamantmesser geschnitten werden, um ultradünne Schnitte von etwa 60-90 nm Dicke zu erzeugen. Es werden auch Einweg-Glasmesser verwendet, da sie im Labor hergestellt werden können und viel billiger sind.
- Färbung - verwendet Schwermetalle wie Blei, Uran oder Wolfram, um bildgebende Elektronen zu streuen und so einen Kontrast zwischen verschiedenen Strukturen zu erzeugen, da viele (insbesondere biologische) Materialien für Elektronen nahezu "transparent" sind (Schwachphasenobjekte). In der Biologie können die Proben vor dem Einbetten und auch später nach dem Schneiden "en bloc" gefärbt werden. In der Regel werden Dünnschnitte mehrere Minuten lang mit einer wässrigen oder alkoholischen Uranylacetatlösung und anschließend mit wässrigem Bleizitrat gefärbt.
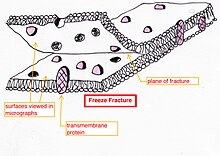
- Gefrierfrakturierung oder Gefrierätzung - eine Präparationsmethode, die sich besonders für die Untersuchung von Lipidmembranen und den darin enthaltenen Proteinen in der "Frontalansicht" eignet. Das frische Gewebe oder die Zellsuspension wird schnell eingefroren (Kryofixierung) und dann durch Brechen (oder mit einem Mikrotom) gebrochen, während es auf der Temperatur von flüssigem Stickstoff gehalten wird. Die kalt gebrochene Oberfläche (manchmal "geätzt", indem die Temperatur für einige Minuten auf etwa -100 °C erhöht wird, um etwas Eis sublimieren zu lassen) wird dann in einem Hochvakuumverdampfer mit verdampftem Platin oder Gold in einem durchschnittlichen Winkel von 45° beschattet. Die zweite Schicht aus Kohlenstoff, die senkrecht zur durchschnittlichen Oberflächenebene aufgedampft wird, dient häufig dazu, die Stabilität der Replikatschicht zu verbessern. Die Probe wird wieder auf Raumtemperatur und -druck gebracht, dann wird das äußerst zerbrechliche "vorbeschattete" Metallabbild der Bruchfläche durch vorsichtigen chemischen Aufschluss mit Säuren, Hypochloritlösung oder SDS-Reinigungsmittel vom darunter liegenden biologischen Material gelöst. Das noch schwimmende Replikat wird gründlich von Chemikalienresten befreit, vorsichtig auf feine Gitter aufgefischt, getrocknet und dann im TEM betrachtet.
- Immunogoldmarkierung von Gefrierbruchreplikaten (FRIL) - Die Gefrierbruchmethode wurde modifiziert, um die Identifizierung der Komponenten der Bruchfläche durch Immunogoldmarkierung zu ermöglichen. Anstatt das gesamte darunter liegende Gewebe des aufgetauten Replikats als letzten Schritt vor der Betrachtung unter dem Mikroskop zu entfernen, wird die Gewebedicke während oder nach dem Bruchvorgang minimiert. Die dünne Gewebeschicht bleibt an das Metallreplikat gebunden, so dass sie mit Antikörpern gegen die gewünschten Strukturen immunogoldmarkiert werden kann. Die dünne Schicht der Originalprobe auf dem mit Gold versehenen Replikat ermöglicht die Identifizierung von Strukturen in der Bruchebene. Es gibt auch verwandte Verfahren zur Markierung der Oberfläche von geätzten Zellen und andere Varianten der Markierung von Replikaten.
- Ionenstrahlfräsen - verdünnt Proben, bis sie für Elektronen durchlässig sind, indem Ionen (in der Regel Argon) aus einem Winkel auf die Oberfläche geschossen und Material von der Oberfläche gesputtert wird. Eine Unterklasse davon ist das fokussierte Ionenstrahlfräsen, bei dem Galliumionen verwendet werden, um in einem bestimmten Bereich der Probe eine elektronentransparente Membran zu erzeugen, beispielsweise durch ein Gerät in einem Mikroprozessor. Das Ionenstrahlfräsen kann auch für das Polieren von Querschnitten vor der REM-Analyse von Materialien verwendet werden, die durch mechanisches Polieren nur schwer zu bearbeiten sind.
- Leitende Beschichtung - eine ultradünne Schicht aus elektrisch leitendem Material, die entweder durch Hochvakuumverdampfung oder durch Sputterbeschichtung der Probe im Niedrigvakuum aufgebracht wird. Dies geschieht, um die Ansammlung statischer elektrischer Felder an der Probe zu verhindern, die durch die bei der Bildgebung erforderliche Elektronenbestrahlung entstehen. Zu den Beschichtungsmaterialien gehören Gold, Gold/Palladium, Platin, Wolfram, Graphit usw.
- Erdung - um die Ansammlung elektrischer Ladungen auf einer leitfähig beschichteten Probe zu vermeiden, wird diese in der Regel elektrisch mit dem Metallprobenhalter verbunden. Häufig wird zu diesem Zweck ein elektrisch leitender Klebstoff verwendet. ⓘ
Nachteile

Elektronenmikroskope sind teuer im Bau und in der Wartung, aber die Investitions- und Betriebskosten konfokaler Lichtmikroskopsysteme überschneiden sich inzwischen mit denen von Basiselektronenmikroskopen. Mikroskope, die eine hohe Auflösung erreichen sollen, müssen in stabilen Gebäuden (manchmal unterirdisch) untergebracht werden und über besondere Einrichtungen wie Magnetfeldkompensationsanlagen verfügen. ⓘ
Die Proben müssen weitgehend im Vakuum betrachtet werden, da die Luftmoleküle die Elektronen streuen würden. Eine Ausnahme bildet die Flüssigphasen-Elektronenmikroskopie, bei der entweder eine geschlossene Flüssigkeitszelle oder eine Umgebungskammer verwendet wird, z. B. im Umwelt-Rasterelektronenmikroskop, mit dem hydratisierte Proben in einer feuchten Umgebung mit niedrigem Druck (bis zu 20 Torr oder 2,7 kPa) betrachtet werden können. Es wurden auch verschiedene Techniken für die In-situ-Elektronenmikroskopie von gasförmigen Proben entwickelt. ⓘ
Rasterelektronenmikroskope, die im konventionellen Hochvakuummodus arbeiten, bilden in der Regel leitende Proben ab; nicht leitende Materialien erfordern daher eine leitende Beschichtung (Gold/Palladium-Legierung, Kohlenstoff, Osmium usw.). Der Niederspannungsmodus moderner Mikroskope ermöglicht die Betrachtung nicht leitender Proben ohne Beschichtung. Nichtleitende Materialien können auch mit einem Rasterelektronenmikroskop mit variablem Druck (oder unter Umgebungsbedingungen) abgebildet werden. ⓘ
Kleine, stabile Proben wie Kohlenstoff-Nanoröhrchen, Kieselalgenfruchtkörper und kleine Mineralkristalle (z. B. Asbestfasern) müssen vor der Untersuchung im Elektronenmikroskop nicht besonders behandelt werden. Proben aus hydratisierten Materialien, darunter fast alle biologischen Proben, müssen auf verschiedene Weise vorbereitet werden, um sie zu stabilisieren, ihre Dicke zu verringern (Ultradünnschnitt) und ihren elektronenoptischen Kontrast zu erhöhen (Färbung). Diese Verfahren können zu Artefakten führen, die sich jedoch in der Regel durch den Vergleich der mit völlig unterschiedlichen Präparationsmethoden erzielten Ergebnisse identifizieren lassen. Seit den 1980er Jahren wird auch die Analyse kryofixierter, verglaster Proben zunehmend von Wissenschaftlern genutzt, was die Aussagekraft dieser Technik weiter bestätigt. ⓘ
Die aufwendige Vorbereitung der Objekte kann zu Artefakten führen – Strukturen, die nur durch die Vorbereitung entstanden sind, und nichts mit dem eigentlichen Objekt zu tun haben –, was die Auswertung der Bilder erschwert. Darüber hinaus können im REM die Materialeigenschaften von denen kompakter Objekte abweichen, durch den überproportionalen Anteil oberflächennaher Bereiche am Analytvolumen. Ein weiteres Problem ist die Schädigung der Objekte durch den Elektronenstrahl, beispielsweise durch Erwärmung oder Wegstoßen ganzer Atome nach Kollision mit den schnellen Elektronen, aber auch Einschuss von Fremdatomen aus dem Vakuum in die Probe. Das im Inneren des Mikroskops herrschende Vakuum, die zum Herstellen eines Präparates nötige Trocknung und Fixierung sowie das unverzichtbare äußerst feine Schneiden des Präparates machen es (außer mit dem ESEM) unmöglich, ein lebendes Objekt zu mikroskopieren. ⓘ
Als weiterer Nachteil können die sehr hohen Anschaffungs- und Unterhaltskosten für Elektronenmikroskope angesehen werden, die es Privatunternehmen oft nicht erlauben, eigene Geräte zu betreiben. Daher sind Elektronenmikroskope überwiegend in Forschungsinstituten und in Dienstleistungsunternehmen anzutreffen. ⓘ
Anwendungen
Biologie und Lebenswissenschaften
|
|
Aufbau

Die Hauptbestandteile eines Elektronenmikroskops sind:
- Die Elektronenkanone, die die freien Elektronen in einer Elektronenquelle erzeugt und in Richtung einer ringförmig um die Strahlachse liegenden Anode beschleunigt. Elektrisch liegt die Anode auf Erdpotential, die Kathode auf einer negativen Hochspannung, die je nach Mikroskop zwischen wenigen Kilovolt bis zu 3 Megavolt liegt. Diese Spannung zwischen Kathode und Anode bestimmt die Energie der Elektronen.
- Elektronenlinsen, die die Flugbahnen der Elektronen ablenken können. Meist werden magnetische Linsen verwendet, in der Elektronenkanone zum Teil auch elektrostatische. Elektronenlinsen haben die gleiche Funktion wie Glaslinsen im Lichtmikroskop. Während die Brennweite der Glaslinsen fest liegt, ist sie bei Elektronenlinsen regelbar. Deshalb enthält ein Elektronenmikroskop im Gegensatz zu einem Lichtmikroskop keine austauschbaren oder verschiebbaren Linsen(systeme) wie die Objektive beziehungsweise das Okular eines Lichtmikroskops. Neben Linsen kommen wie beim Lichtmikroskop auch Blenden zum Einsatz.
- Das Vakuumsystem, das dafür sorgt, dass die Elektronenquelle effizienter arbeiten kann und die Elektronen auf ihrem Weg nicht durch Kollision mit Gasmolekülen behindert werden.
- Die Objekthalterung, die eine stabile Lage des Objekts garantieren muss. Daneben sind oft Manipulationsmöglichkeiten erwünscht, von denen je nach Art des Objekthalters unterschiedliche Kombinationen realisiert werden: Verschiebung, Drehung, Kippung, Heizung, Kühlung und anderes.
- Detektoren, die die Elektronen selbst oder sekundäre Signale registrieren.
- Die Mikroskopsäule (engl. column) bildet den Rahmen für alle elektronenoptischen Bauteile, schirmt in der Regel magnetisch ab, um die Einflüsse äußerer Magnetfelder auf die Messungen abzuschwächen, und dichtet das im Inneren aufrechterhaltene Vakuum ab. ⓘ
Arten
Einige weitere spezielle Arten von Elektronenmikroskopen
Abgesehen von der prinzipiellen Unterscheidung gibt es noch eine Vielzahl von Bezeichnungen, die mehr oder weniger systematisch sind und sich meist nach dem Einsatzgebiet, installierten Zusatztechniken oder bestimmten Besonderheiten der jeweiligen Geräte richtet. Im Folgenden sind einige davon gegeben:
- Analytisches Transmissions-Elektronenmikroskop (ANTEM, Ausrüstung mit EELS- und EDS-Spektrometern, oftmals auch im STEM-Modus betreibbar)
- energiegefiltertes Transmissionselektronenmikroskop (EFTEM, mit abbildendem In-column- oder Post-column-EELS-Spektrometer)
- Environmental Scanning Electron Microscope (ESEM, speziell zur Untersuchung bei atmosphärenähnlichen Umgebungen.)
- aberrationskorrigierte TEM, STEM und REM
- Reflexionselektronenmikroskop (ein TEM, in dem das Objekt so gekippt werden kann, dass seine Oberfläche unter streifendem Elektroneneinfall abgebildet wird) ⓘ
Optische Aberrationen in Elektronenmikroskopen
Reale optische Linsenelemente, sowohl in der Licht- als auch in der Elektronenoptik, zeigen Abweichungen vom idealen Verhalten. In der Strahlenoptik werden zum Beispiel parallele Strahlen, die durch eine ideale Sammellinse laufen, so abgelenkt, dass sie sich nach der Linse allesamt im Brennpunkt schneiden. Bei einer realen Linse ist dies nicht der Fall. Im Bild der Wellenoptik wird eine Schar paralleler Lichtstrahlen durch eine ebene Welle repräsentiert. Die Wirkung der Sammellinse transformiert diese ebene Welle in eine einlaufende Kugelwelle. Die Aberrationen realer Sammellinsen äußern sich in diesem Modell durch eine relative Phasenverschiebung verschiedener Anteile, so dass die Wellenform nicht mehr der einer exakten Kugelwelle entspricht. ⓘ
Während man Linsensysteme in der Lichtoptik durch geeignete Materialwahl und Formgebung zumindest für bestimmte Bereiche der Lichtwellenlängen nahezu aberrationsfrei gestalten kann, ist dies in den Linsenelementen der Elektronenoptik nicht möglich. Die Linsen haben ein rotationssymmetrisches magnetisches Dipolfeld (die Symmetrieachse ist die optische Achse der Linse). Die Feldform ist damit prinzipiell vorgegeben, und O. Scherzer zeigte bereits 1936, dass solche Linsen zwangsläufig starke sphärische Aberrationen aufweisen. Mit Hilfe von Kombinationen magnetischer Multipolelemente, die zusätzlich in den Strahlengang gebracht werden, lassen sich solche Aberrationen bis zu einem gewissen Grade korrigieren (Cs-Korrektor, Stigmator), dies hat eine gewisse Ähnlichkeit mit der Korrektur optischer Fehler in hochwertigen Photoobjektiven (sphärische Aberration, CS) bzw. menschlicher Stabsichtigkeit (Astigmatismus) durch Zylinderglas-Brillen, siehe hierzu auch Abbildungsfehler. Da die Aberrationen allerdings vom augenblicklichen Zustand der Linse abhängen (hier spielen Temperaturverteilung, elektronenoptische Justage und andere Parameter eine große Rolle), müssen die Aberrationen jeweils zeitnah gemessen und die Korrekturelemente entsprechend angesteuert werden. ⓘ
Ein Messverfahren für die optischen Fehler (Aberrationen) eines Transmissions-Elektronenmikroskops (TEM) ist das Zemlin-Tableau. Dabei werden im TEM Bilder von Folien aus amorphem Material (meist amorpher Kohlenstoff) unter verschiedenen Strahlkippungen aufgenommen. Die Power-Spektren dieser Bilder werden entsprechend dem Azimut der Strahlkippung in einem Tableau angeordnet. Mit Hilfe dieses Tableaus können alle paraxialen Aberrationen gemessen werden. Das Zemlin-Tableau dient somit der exakten Justierung des Elektronenmikroskops und der Korrektur der optischen Fehler. ⓘ
Zunächst wurde die Aberrationskorrektur nur benutzt, um die räumliche Signalauflösung (das Informationslimit) von TEMs und STEMs zu verbessern (vor der Einführung der Korrektur Mitte der 1990er Jahre bei etwa 0,11–0,15 nm). Das Auflösungsvermögen von REMs ist aufgrund ihrer Wirkungsweise meist nicht durch den geringstmöglichen Elektronenstrahldurchmesser gegeben, da der Elektronenstrahl durch das Objekt selbst stark gestreut wird. Allerdings erlaubt der Einsatz von Aberrationskorrektoren in REMs zum einen höhere Strahlströme (also schnellere Bildaufnahme) und zum andern die Kompensation von verringerten Elektronenenergien, was ja zunächst aufgrund der Wellenlängenvergrößerung zu einem größeren Strahldurchmesser führt. ⓘ
Objektaufbereitung
Für die Untersuchung im normalen REM sollte die Probe leitfähig oder mit einer leitfähigen Schicht überzogen sein, solange nicht spezielle Techniken benutzt werden, siehe Rasterelektronenmikroskop. ⓘ
Für die Transmissionselektronenmikroskopie (sowohl CTEM als auch STEM) müssen die Objekte mit geeigneten Verfahren auf eine maximale Dicke von meist 10–100 nm (in besonderen Fällen genügt etwa 1 µm) gebracht werden, siehe Transmissionselektronenmikroskop. ⓘ
Die Oberflächenmorphologie massiver Objekte kann mit dem Transmissionselektronenmikroskop untersucht werden, indem von diesem Objekt ein durchstrahlbarer Kohlenstoffabdruck hergestellt und mit Hilfe eines Trägernetzes in das Elektronenmikroskop eingebracht wird. Am besten eignen sich dafür dünne Schichten aus Kohlenstoff, der aus einem Lichtbogen im Hochvakuum unter einem bestimmten Neigungswinkel (z. B. 45 Grad) aufgedampft wird und anschließend von der zu untersuchenden Oberfläche abgelöst wird. ⓘ
Trivia
Noch 1970 wurde geschätzt, dass insgesamt weniger als ein Kubikmillimeter Material elektronenmikroskopisch erforscht worden sei, bedingt durch die dünnen Schichten und die starke Vergrößerung. ⓘ