Xylole
Die Xylole (von altgriechisch ξύλον xýlon „Holz“), auch Xylene oder nach der IUPAC-Nomenklatur Dimethylbenzene, sind flüssige organisch-chemische Verbindungen mit einem charakteristischen aromatischem Geruch und der allgemeinen Summenformel C8H10. Sie zählen zu den aromatischen Kohlenwasserstoffen und bestehen jeweils aus einem Benzolring mit zwei Methylsubstituenten (–CH3). Durch unterschiedliche Anordnung der Methylgruppen ergeben sich drei Konstitutionsisomere des Xylols: 1,2-Xylol (ortho-Xylol), 1,3-Xylol (meta-Xylol) und 1,4-Xylol (para-Xylol). In der Technik (z. B. als Lösungsmittel) werden sie meist als (ungetrenntes) Isomerengemisch verwendet und setzen sich in der Regel aus 60 % m-Xylol, 10–25 % o-Xylol und 10–25 % p-Xylol zusammen. Als Lösungsmittel verwendete Xylolmischungen enthalten häufig auch Ethylbenzol, das im gleichen Temperaturbereich siedet und ähnliche Lösungseigenschaften besitzt. ⓘ
Vertreter
| Xylole ⓘ | ||||||||||||
| Name | o-Xylol | m-Xylol | p-Xylol | |||||||||
| Andere Namen | 1,2-Dimethylbenzol 1,2-Dimethylbenzen |
1,3-Dimethylbenzol 1,3-Dimethylbenzen |
1,4-Dimethylbenzol 1,4-Dimethylbenzen | |||||||||
| Strukturformel | 
|
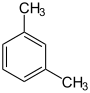
|
||||||||||
| CAS-Nummer | 95-47-6 | 108-38-3 | 106-42-3 | |||||||||
| 1330-20-7 (Isomerengemisch) | ||||||||||||
| PubChem | 7237 | 7929 | 7809 | |||||||||
| ECHA-InfoCard | 100.002.203 | 100.003.252 | 100.003.088 | |||||||||
| 100.014.124 (Isomerengemisch) | ||||||||||||
| Summenformel | C8H10 | |||||||||||
| Molare Masse | 106,17 g·mol−1 | |||||||||||
| Aggregatzustand | flüssig | |||||||||||
| Kurzbeschreibung | farblose Flüssigkeit | |||||||||||
| Schmelzpunkt | −25 °C | −48 °C | 13 °C | |||||||||
| Siedepunkt | 144 °C | 139 °C | 138 °C | |||||||||
| Löslichkeit in Wasser | 180 mg·l−1 | 174 mg·l−1 | 200 mg·l−1 | |||||||||
| GHS- Kennzeichnung |
aus Verordnung (EG) Nr. 1272/2008 (CLP), ggf. erweitert
|
aus Verordnung (EG) Nr. 1272/2008 (CLP), ggf. erweitert
|
aus Verordnung (EG) Nr. 1272/2008 (CLP), ggf. erweitert
| |||||||||
| H- und P-Sätze | 226‐304‐312‐315‐319‐335‐412 | 226‐304‐312‐332‐315‐319‐335‐412 | 226‐304‐312‐315‐332‐319‐335‐412 | |||||||||
| 210‐261‐273‐301+310‐302+352‐312‐331 | 261‐273‐280‐301+310‐305+351+338‐331 | 210‐280‐305+351+338‐301+330+331 | ||||||||||
| MAK | Schweiz: 100 ml·m−3 bzw. 435 mg·m−3 | |||||||||||
Eigenschaften
Die physikalischen Eigenschaften der Isomere von Xylol unterscheiden sich geringfügig. Der Schmelzpunkt reicht von -47,87 °C (-54,17 °F) (m-Xylol) bis 13,26 °C (55,87 °F) (p-Xylol) - wie üblich ist der Schmelzpunkt des para-Isomers viel höher, weil es sich leichter in die Kristallstruktur einfügt. Der Siedepunkt jedes Isomers liegt bei etwa 140 °C (284 °F). Die Dichte jedes Isomers beträgt etwa 0,87 g/ml (7,26 lb/U.S. gallon oder 8,72 lb/imp gallon) und ist damit geringer als die Dichte von Wasser. Der Geruch von Xylol ist bereits bei Konzentrationen von 0,08 bis 3,7 ppm (Teile Xylol pro Million Teile Luft) nachweisbar und kann in Wasser bei 0,53 bis 1,8 ppm geschmeckt werden. ⓘ
| Isomere des Xylols ⓘ | ||||
|---|---|---|---|---|
| Allgemein | ||||
| Allgemeiner Name | Xylol | o-Xylol | m-Xylol | p-Xylol |
| Systematische Bezeichnung | Dimethylbenzol | 1,2-Dimethylbenzol | 1,3-Dimethylbenzol | 1,4-Dimethylbenzol |
| Andere Bezeichnungen | Xylol | o-Xylol; Orthoxylen |
m-Xylol; Metaxylen |
p-Xylol; Paraxylol |
| Molekulare Formel | C8H10 | |||
| SMILES | Cc1c(C)cccc1 | Cc1cc(C)ccc1 | Cc1ccc(C)cc1 | |
| Molare Masse | 106,16 g/mol | |||
| Erscheinungsbild | Klare, farblose Flüssigkeit | |||
| CAS-Nummer | [1330-20-7] | [95-47-6] | [108-38-3] | [106-42-3] |
| Eigenschaften | ||||
| Dichte und Phase | 0,864 g/ml, flüssig | 0,88 g/ml, flüssig | 0,86 g/ml, flüssig | 0,86 g/ml, flüssig |
| Löslichkeit in Wasser | Praktisch unlöslich | |||
| Löslich in unpolaren Lösungsmitteln wie aromatischen Kohlenwasserstoffen | ||||
| Schmelzpunkt | -47.4 °C (-53.3 °F; 226 K) | -25 °C (-13 °F; 248 K) | -48 °C (-54 °F; 225 K) | 13 °C (55 °F; 286 K) |
| Siedepunkt | 138,5 °C (281,3 °F; 412 K) | 144 °C (291 °F; 417 K) | 139 °C (282 °F; 412 K) | 138 °C (280 °F; 411 K) |
| Viskosität | 0,812 cP bei 20 °C (68 °F) | 0,62 cP bei 20 °C (68 °F) | 0,34 cP bei 30 °C (86 °F) | |
| Gefahren | ||||
| SDS | Xylole | o-Xylol | m-Xylol | p-Xylol |
| EU-Piktogramme |   
| |||
| NFPA 704 | ||||
| Flammpunkt | 30 °C (86 °F) | 17 °C (63 °F) | 25 °C (77 °F) | 25 °C (77 °F) |
| H & P-Sätze | H225, H226, H304, H312, H315, H319, H332, H335, H412 P210, P233, P240, P241, P242, P243, P261, P264, P271, P273, P280, P301+P310, P302+P352, P303+P361+P353, P304+P312, P304+P340, P305+P351+P338, P312, P321, P322, P331, P332+P313, P337+P313, P362, P363, P370+P378, P403+P233, P403+P235, P405, P501 | |||
| RTECS-Nummer | ZE2450000 | ZE2275000 | ZE2625000 | |
| Verwandte Verbindungen | ||||
| Verwandte aromatische Kohlenwasserstoffe |
Toluol, Mesitylen, Benzol, Ethylbenzol | |||
| Verwandte Verbindungen | Xylenole - Arten von Phenolen | |||
| Sofern nicht anders angegeben, beziehen sich die Daten auf Stoffe im Standardzustand (bei 25 °C, 100 kPa). Infobox Haftungsausschluss und Verweise | ||||
Xylole bilden Azeotrope mit Wasser und einer Vielzahl von Alkoholen. Das Azeotrop mit Wasser besteht zu 60 % aus Xylolen und siedet bei 94,5 °C. Wie viele Alkylbenzolverbindungen bilden auch die Xylole Komplexe mit verschiedenen Halogenkohlenwasserstoffen. Die Komplexe der verschiedenen Isomere haben oft völlig unterschiedliche Eigenschaften. ⓘ
Gewinnung und Darstellung
Rohstoffquellen für die Gewinnung der Xylole sind Kohle (aus Steinkohlenteer) und Erdöl (durch Cracken), wobei Isomerengemische anfallen. Da die Isomere ähnliche Siedepunkte haben, ist eine Auftrennung durch Destillation schwierig. Die Abtrennung des o-Isomers wird technisch durch Rektifikation durchgeführt, anschließend kann p-Xylol aufgrund seines relativ hohen Schmelzpunktes durch Ausfrieren getrennt werden. Großtechnisch spielt die Abtrennung des p-Xylols mit Hilfe der Adsorption mit einem Molekularsieb eine wichtige Rolle. ⓘ
Anwendungen
Xylole finden als Lösungsmittel Verwendung und dienen zur Herstellung von Kunst- und Klebstoffen. Da der Flammpunkt von Xylol oberhalb von 21 °C liegt, ist es in der Praxis neben Butylacetat eines der wichtigsten Lösungsmittel für Lacke. Weiterhin werden sie Kraftstoffen zur Erhöhung der Oktanzahl beigemengt. ⓘ
p-Xylol ist Ausgangsstoff für Terephthalsäure, die zur Herstellung von gesättigten Polyestern verwendet wird. o-Xylol dient zur Gewinnung von Phthalsäureanhydrid, meist für die Herstellung von Kunstharzen oder Kunstfasern. Durch Nitrierung erhält man die Nitroxylole, die durch anschließende Reduktion zur Darstellung der Xylidine dienen. ⓘ
Neben Toluol gehören die Xylole zu den technisch wichtigsten aromatischen Kohlenwasserstoffen, den sogenannten BTEX-Aromaten. ⓘ
Terephthalsäure und verwandte Derivate
p-Xylol ist der wichtigste Vorläufer von Terephthalsäure und Dimethylterephthalat, beides Monomere, die bei der Herstellung von Kunststoffflaschen aus Polyethylenterephthalat (PET) und Polyesterkleidung verwendet werden. 98 % der p-Xylol-Produktion und die Hälfte aller produzierten Xylole werden auf diese Weise verbraucht. o-Xylol ist ein wichtiges Vorprodukt für Phthalsäureanhydrid. Der Bedarf an Isophthalsäure ist relativ bescheiden, so dass m-Xylol nur selten nachgefragt wird (und damit der Nutzen seiner Umwandlung in die o- und p-Isomere). ⓘ
Anwendungen als Lösungsmittel und industrielle Zwecke
Xylole werden als Lösungsmittel in der Druck-, Gummi- und Lederindustrie verwendet. Es ist ein häufiger Bestandteil von Druckfarben, Gummi und Klebstoffen. Beim Verdünnen von Farben und Lacken kann es Toluol ersetzen, wenn eine langsamere Trocknung erwünscht ist, und wird daher von Restauratoren von Kunstgegenständen bei Löslichkeitstests verwendet. Ebenso ist es ein Reinigungsmittel, z. B. für Stahl, Siliziumwafer und integrierte Schaltkreise. In der Zahnmedizin kann Xylol zum Auflösen von Guttapercha verwendet werden, einem Material für die Endodontie (Wurzelkanalbehandlung). In der Erdölindustrie ist Xylol auch ein häufiger Bestandteil von Paraffinlösungsmitteln, die verwendet werden, wenn die Rohre mit Paraffinwachs verstopft sind. ⓘ
Verwendung im Labor
Im Labor wird Xylol zur Herstellung von Bädern mit Trockeneis zur Kühlung von Reaktionsgefäßen und als Lösungsmittel zur Entfernung von synthetischem Immersionsöl aus dem Mikroskopobjektiv bei der Lichtmikroskopie verwendet. In der Histologie ist Xylol das am häufigsten verwendete Klärungsmittel. Xylol wird verwendet, um Paraffin von getrockneten Objektträgern zu entfernen, bevor diese gefärbt werden. Nach dem Färben werden die Objektträger in Xylol gelegt, bevor sie mit einem Deckglas befestigt werden. ⓘ
Vorläufer für andere Verbindungen
In einer großtechnischen Anwendung wird para-Xylol in Terephthalsäure umgewandelt. Die Hauptanwendung von ortho-Xylol ist die Herstellung von Phthalsäureestern, die als Weichmacher verwendet werden. Meta-Xylol wird in Isophthalsäurederivate umgewandelt, die Bestandteil von Alkydharzen sind. ⓘ
Reaktionen
Die Methylgruppen (–CH3) können zu Carboxygruppen oxidiert werden. Geeignete Oxidationsmittel zur Umsetzung beider Methylgruppen sind beispielsweise Kaliumpermanganat oder Chromschwefelsäure. o-Xylol wird so in Phthalsäure, m-Xylol in Isophthalsäure und p-Xylol in Terephthalsäure überführt. o-Xylol kann katalytisch – z. B. an Vanadium(V)oxid – in der Gasphase zu Phthalsäureanhydrid oxidiert werden. Durch Sauerstoff (z. B. in Gegenwart von Cobalt(II)-stearat als Katalysator) erhält man die entsprechenden Monocarbonsäuren, die Toluylsäuren (Methylbenzoesäuren). Ebenfalls durch selektive Oxidation lassen sich die Benzoldicarbaldehyde erhalten. Xylole gehen die für Aromaten typischen Substitutionsreaktionen ein. ⓘ
Gefahren
Xylole sind entzündlich und wirken gesundheitsschädigend bei Aufnahme über die Haut und die Atemwege. Sie können zum Beispiel Kopfschmerzen, Gedächtnis- und Orientierungsstörungen, Schwindel und Atemnot hervorrufen. Xylole sind wassergefährdend (WGK 2). Zwischen einem Luftvolumenanteil von 1 bis 8 % bilden sie explosive Gemische. Emissionen von Xylolen sind hauptsächlich auf den Kfz-Verkehr zurückzuführen. In den letzten Jahren ist ein Rückgang der Xylolemissionen zu verzeichnen. ⓘ
Die Xylole wurden 2013 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme der Xylole waren die Besorgnisse bezüglich Verbraucherverwendung, kumulative Exposition, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Substanzen und der möglichen Gefahr durch sensibilisierende Eigenschaften. Die Neubewertung soll ab 2020 von Deutschland durchgeführt werden. ⓘ
Vorkommen und Herstellung
Xylole sind ein wichtiger petrochemischer Stoff, der durch katalytisches Reforming und auch durch Verkohlung von Kohle bei der Herstellung von Koksbrennstoff gewonnen wird. Sie kommen auch in Rohöl vor, je nach Quelle in Konzentrationen von etwa 0,5-1 %. Geringe Mengen kommen in Benzin und Flugzeugtreibstoffen vor. ⓘ
Xylole werden hauptsächlich als Teil der BTX-Aromaten (Benzol, Toluol und Xylole) hergestellt, die aus dem als Reformat bezeichneten Produkt der katalytischen Reformierung gewonnen werden. ⓘ
Jährlich werden mehrere Millionen Tonnen produziert. Im Jahr 2011 begann ein globales Konsortium mit dem Bau einer der größten Xylol-Anlagen der Welt in Singapur. ⓘ
Geschichte
Xylol wurde erstmals 1850 von dem französischen Chemiker Auguste Cahours (1813-1891) isoliert und benannt, nachdem er es als einen Bestandteil von Holzteer entdeckt hatte. ⓘ
Industrielle Herstellung
Xylole werden durch die Methylierung von Toluol und Benzol hergestellt. Das im Handel oder im Labor hergestellte Xylol enthält in der Regel etwa 40-65 % m-Xylol und jeweils bis zu 20 % o-Xylol, p-Xylol und Ethylbenzol. Das Verhältnis der Isomere kann durch das patentierte UOP-Isomar-Verfahren oder durch Transalkylierung von Xylol mit sich selbst oder Trimethylbenzol zugunsten des hochgeschätzten p-Xylols verschoben werden. Diese Umwandlungen werden von Zeolithen katalysiert. ⓘ
ZSM-5 wird verwendet, um einige Isomerisierungsreaktionen zu erleichtern, die zur Massenproduktion moderner Kunststoffe führen. ⓘ
Chemische Eigenschaften
Im Allgemeinen gibt es zwei Arten von Reaktionen mit Xylolen: solche mit den Methylgruppen und solche mit den C-H-Bindungen des Rings. Da die C-H-Bindungen der Methylgruppen benzylisch und damit geschwächt sind, sind sie anfällig für radikalische Reaktionen, einschließlich der Halogenierung zu den entsprechenden Xyloldichloriden (Bis(chlormethyl)benzolen), während die Monobromierung Xylylbromid ergibt, ein Tränengasmittel. Oxidation und Ammoxidation zielen auch auf die Methylgruppen ab und führen zu Dicarbonsäuren und Dinitrilen. Elektrophile greifen den aromatischen Ring an und führen zu Chlor- und Nitroxylenen. ⓘ
Gesundheit und Sicherheit
Xylol ist brennbar, aber von mäßiger akuter Toxizität mit LD50-Werten von 200 bis 5000 mg/kg für Tiere. Die orale LD50 für Ratten beträgt 4300 mg/kg. Der wichtigste Entgiftungsmechanismus ist die Oxidation zu Methylbenzoesäure und die Hydroxylierung zu Hydroxylen. ⓘ
Die Hauptwirkung des Einatmens von Xyloldampf ist eine Depression des zentralen Nervensystems (ZNS) mit Symptomen wie Kopfschmerzen, Schwindel, Übelkeit und Erbrechen. Bei einer Exposition von 100 ppm kann es zu Übelkeit oder Kopfschmerzen kommen. Bei einer Exposition zwischen 200 und 500 ppm können Symptome wie Rauschzustände, Schwindel, Schwäche, Reizbarkeit, Erbrechen und eine verlangsamte Reaktionszeit auftreten. ⓘ
Die Nebenwirkungen einer Exposition gegenüber niedrigen Xylol-Konzentrationen (< 200 ppm) sind reversibel und verursachen keine dauerhaften Schäden. Langfristige Exposition kann zu Kopfschmerzen, Reizbarkeit, Depressionen, Schlaflosigkeit, Unruhe, extremer Müdigkeit, Zittern, Hörverlust, Konzentrationsschwäche und Verlust des Kurzzeitgedächtnisses führen. Ein Zustand, der als chronische lösungsmittelinduzierte Enzephalopathie bezeichnet wird und gemeinhin als "organisches Lösungsmittel-Syndrom" bekannt ist, wurde mit Xylol-Exposition in Verbindung gebracht. Es gibt nur sehr wenige Informationen, die Xylol bei der Untersuchung dieser Wirkungen von anderen Lösungsmittelexpositionen abgrenzen. ⓘ
Hörstörungen wurden ebenfalls mit Xylol-Exposition in Verbindung gebracht, sowohl in Studien mit Versuchstieren als auch in klinischen Studien. ⓘ
Xylol ist auch ein Hautreizstoff und entzieht der Haut ihre Fette, wodurch sie durchlässiger für andere Chemikalien wird. Die Verwendung von undurchlässigen Handschuhen und Masken sowie gegebenenfalls von Atemschutzmasken wird empfohlen, um arbeitsbedingte Gesundheitsschäden durch Xylol zu vermeiden. ⓘ
Xylole werden in Methylhippursäuren umgewandelt. Das Vorhandensein von Methylhippursäure kann als Biomarker verwendet werden, um die Exposition gegenüber Xylol zu bestimmen. ⓘ




