Muskeldystrophie
| Muskeldystrophie ⓘ | |
|---|---|
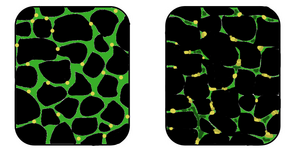 | |
| In den betroffenen Muskeln (rechts) ist das Gewebe desorganisiert und die Konzentration von Dystrophin (grün) ist im Vergleich zu normalen Muskeln (links) stark reduziert. | |
| Spezialgebiet | Neuromuskuläre Medizin |
| Symptome | Zunehmende Schwächung, Abbau der Skelettmuskulatur, Schwierigkeiten beim Gehen |
| Dauer | Chronisch |
| Arten | > 30, einschließlich Duchenne-Muskeldystrophie, Becker-Muskeldystrophie, fazioskapulohumerale Muskeldystrophie, Gliedergürtel-Muskeldystrophie, myotone Dystrophie |
| Ursachen | Genetisch bedingt (X-chromosomal rezessiv, autosomal rezessiv oder autosomal dominant) |
| Diagnostische Methode | Genetischer Test |
| Behandlung | Pharmakotherapie, Physiotherapie, Zahnspangen, Korrekturoperation, assistierte Beatmung |
| Vorhersage | Hängt von der jeweiligen Störung ab |
Muskeldystrophien (MD) sind eine genetisch und klinisch heterogene Gruppe seltener neuromuskulärer Erkrankungen, die im Laufe der Zeit eine fortschreitende Schwäche und einen Abbau der Skelettmuskulatur verursachen. Die Erkrankungen unterscheiden sich darin, welche Muskeln hauptsächlich betroffen sind, wie stark die Schwäche ist, wie schnell sie sich verschlimmert und wann die Symptome beginnen. Einige Arten sind auch mit Problemen in anderen Organen verbunden. ⓘ
Mehr als 30 verschiedene Erkrankungen werden als Muskeldystrophien klassifiziert. Davon macht die Duchenne-Muskeldystrophie (DMD) etwa 50 % der Fälle aus und betrifft Männer ab einem Alter von etwa vier Jahren. Zu den anderen relativ häufigen Muskeldystrophien gehören die Becker-Muskeldystrophie, die fazioskapulohumerale Muskeldystrophie und die myotone Dystrophie, während die Gliedergürtel-Muskeldystrophie und die kongenitale Muskeldystrophie ihrerseits Gruppen von mehreren - in der Regel sehr seltenen - genetischen Störungen sind. ⓘ
Muskeldystrophien werden durch Mutationen in Genen verursacht, in der Regel in solchen, die an der Herstellung von Muskelproteinen beteiligt sind. Diese Mutationen werden entweder von den Eltern vererbt oder können spontan während der frühen Entwicklung auftreten. Muskeldystrophien können X-chromosomal rezessiv, autosomal rezessiv oder autosomal dominant sein. Zur Diagnose werden häufig Bluttests und Gentests durchgeführt. ⓘ
Es gibt keine Heilung für eine Erkrankung aus der Gruppe der Muskeldystrophien. Mehrere Medikamente, die die Ursache bekämpfen sollen, sind in der Entwicklung, darunter Gentherapie (Microdystrophin) und Antisense-Medikamente (Ataluren, Eteplirsen usw.). Weitere Medikamente sind Kortikosteroide (Deflazacort), Kalziumkanalblocker (Diltiazem) zur Verlangsamung der Degeneration der Skelett- und Herzmuskulatur, Antikonvulsiva zur Kontrolle von Krampfanfällen und bestimmter Muskelaktivitäten sowie Immunsuppressiva (Vamorolon) zur Verzögerung der Schädigung absterbender Muskelzellen. Physikalische Therapie, Zahnspangen und Korrekturoperationen können bei einigen Symptomen helfen, während bei einer Schwäche der Atemmuskulatur eine unterstützte Beatmung erforderlich sein kann. ⓘ
Die Ergebnisse hängen von der spezifischen Art der Erkrankung ab. Viele Betroffene können irgendwann nicht mehr gehen, und insbesondere die Duchenne-Muskeldystrophie ist mit einer verkürzten Lebenserwartung verbunden. ⓘ
Die Muskeldystrophie wurde erstmals in den 1830er Jahren von Charles Bell beschrieben. Das Wort "Dystrophie" kommt aus dem Griechischen dys, was "nein, un-" bedeutet, und troph-, was "ernähren" bedeutet. ⓘ
Muskeldystrophie, auch progressive Muskeldystrophie (Dystrophia musculorum progressiva) genannt, bezeichnet eine Gruppe von Muskelerkrankungen. Es handelt sich um Erbkrankheiten, die durch genetische Mutationen verursacht werden, welche meist zu Defekten oder zu einem Mangel von in der Muskulatur vorkommenden Proteinen führen. Dies führt in der Konsequenz zu Muskelschwäche und Muskelschwund. Alle Muskeldystrophien sind durch fortschreitende (progressive) Degeneration der Muskulatur, einhergehend mit Umbauprozessen, gekennzeichnet. Diese Veränderungen werden zusammengefasst als dystrophische Veränderungen, die sich licht- oder elektronenmikroskopisch nachweisen lassen. Die einzelnen Muskeldystrophien unterscheiden sich hinsichtlich der Art des Erbgangs, der hauptsächlich betroffenen Körperregionen, des Erkrankungsalters und des Verlaufs. Eine kausale Behandlungsmöglichkeit, die das Fortschreiten der Muskeldegeneration aufhalten kann, ist nicht bekannt. ⓘ
Die Dystrophia musculorum progressiva wurde zuerst 1891 von Wilhelm Erb beschrieben. Sie wurde auch als progressive idiopathische Muskeldystrophie (Erb) bezeichnet. ⓘ
Anzeichen und Symptome
Die Anzeichen und Symptome, die auf eine Muskeldystrophie hinweisen, sind:
- Fortschreitender Muskelschwund
- Schlechtes Gleichgewicht
- Skoliose (Verkrümmung der Wirbelsäule und des Rückens)
- Fortschreitende Unfähigkeit zu gehen
- Watschelgang
- Verformung der Waden
- Eingeschränkter Bewegungsumfang
- Schwierigkeiten bei der Atmung
- Kardiomyopathie
- Muskelkrämpfe
- Gowers-Zeichen ⓘ
Einteilung
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| G71.0 | Muskeldystrophie |
| ICD-10 online (WHO-Version 2019) | |
Die Einteilung der Muskeldystrophien kann entweder traditionell nach klinischem Verteilungsmuster, das heißt anhand der bevorzugt betroffenen Muskulatur, oder nach genetischen Kriterien erfolgen. Eine einheitliche Klassifikation, die sich in der Fachliteratur durchgesetzt hat, gibt es noch nicht. ⓘ
| Gruppe | Erbkrankheit | Vererbung | OMIM | Genort | Genprodukt ⓘ |
|---|---|---|---|---|---|
| X-Chromosomal vererbte Dystrophien | Muskeldystrophie Duchenne | X-chromosomal-rezessiv | 310200 | Xp21 | Dystrophin |
| Muskeldystrophie Becker-Kiener | X-chromosomal-rezessiv | 300376 | Xp21 | Dystrophin | |
| Emery-Dreifuss-Muskeldystrophie Typ 1 | X-chromosomal-rezessiv | 310300 | Xq28 | Emerin | |
| Skapuloperoneale Muskeldystrophie | X-chromosomal-rezessiv | 300696 | Xq26.3 | Four and a half LIM domain protein 1 (FHL1) | |
| Reducing body myopathy (RBM) | X-chromosomal-rezessiv | 300717 und 300718 | Xq26.3 | Four and a half LIM domain protein 1 (FHL1) | |
| Gliedergürteldystrophien | LGMD1A | autosomal-dominant | 159000 | 5q31 | Myotilin |
| LGMD1B | autosomal-dominant | 159001 | 1q11-21 | Laminin A/C | |
| LGMD1C | autosomal-dominant | 60781 | 3p25 | Caveolin-3 | |
| LGMD1D | autosomal-dominant | 602067 | 6q23 | nicht bekannt | |
| LGMD1E | autosomal-dominant | 603511 | 7q | nicht bekannt | |
| LGMD2A | autosomal-rezessiv | 253600 | 15q15.1-21.1 | Calpain-3 | |
| LGMD2B | autosomal-rezessiv | 253601 | 2p13 | Dysferlin | |
| LGMD2C | autosomal-rezessiv | 253700 | 13q12 | γ-Sarkoglykan | |
| LGMD2D | autosomal-rezessiv | 608009 | 17q12-21.3 | α-Sarkoglykan (Adhalin) | |
| LGMD2E | autosomal-rezessiv | 604286 | 4q12 | β-Sarkoglykan | |
| LGMD2F | autosomal-rezessiv | 601287 | 5q33-34 | δ-Sarkoglykan | |
| LGMD2G | autosomal-rezessiv | 601954 | 17q11-12 | Telethonin | |
| LGMD2H | autosomal-rezessiv | 254110 | 9q31-33 | E3 Ubiquitin-Ligase (TRIM32) | |
| LGMD2I | autosomal-rezessiv | 607155 | 19q13 | Fukutin-related protein (FKRP) | |
| LGMD2J | autosomal-rezessiv | 608807 | 2q31 | Titin | |
| LGMD2K | autosomal-rezessiv | 609308 | 9q34.13 | POMT1 | |
| LGMD2L | autosomal-rezessiv | 611307 | 11p14.3 | Anoctamin-5 | |
| LGMD2M | autosomal-rezessiv | 611588 | 9q31-33 | Fukutin | |
| LGMD2N | autosomal-rezessiv | 613158 | 1p34 | POMT2 | |
| LGMD2O | autosomal-rezessiv | 613157 | 1p34.1 | POMGNT1 | |
| LGMD2Q | autosomal-rezessiv | 613723 | 8q24.3 | Plectin | |
| Kongenitale Muskeldystrophien | Kongenitaler Merosinmangel (Merosinopathie, MDC1A) | autosomal-rezessiv | 607855 | 6q22-23 | Laminin-α2 (Merosin) |
| Kongenitale Myopathie mit Integrin-alpha-7-Mangel | autosomal-rezessiv | 613204 | 12q13 | Integrin alpha-7 | |
| Kongenitale Muskeldystrophie 1C (MDC1C) | autosomal-rezessiv | 606612 | 19q13 | Fukutin-related protein (FKRP) | |
| Kongenitale Muskeldystrophie Typ Fukuyama (FCMD) | autosomal-rezessiv | 253800 | 9q31-33 | Fukutin | |
| Walker-Warburg-Syndrom | autosomal-rezessiv | 236670 | 9q34.13 | POMT1 | |
| Muskel-Auge-Gehirn-Krankheit (Typ Santavuori) | autosomal-rezessiv | 253280 | 1p34.1 | POMGNT1 | |
| Rigid-Spine-Syndrom | autosomal-rezessiv | 602771 | 1p36.11 | Selenoprotein N1 | |
| Ullrich-Myopathie | autosomal-rezessiv und autosomal-dominant | 254090 | 21q22.3 21q22.3 2q37.3 |
Kollagen alpha-1 Kollagen alpha-2 Kollagen alpha-3 | |
| Bethlem-Myopathie | autosomal-dominant | 158810 | 21q22.3 21q22.3 2q37.3 |
Kollagen alpha-1 Kollagen alpha-2 Kollagen alpha-3 | |
| Distale Muskeldystrophien | Distale Muskeldystrophie Typ Welander | autosomal-dominant | 604454 | 2p13 | nicht bekannt |
| Distale Muskeldystrophie Typ Udd | autosomal-dominant | 600334 | 2q31.2 | Titin | |
| Distale Muskeldystrophie Typ Markesbery-Griggs | autosomal-dominant | 609452 | 10q23.2 | ZASP | |
| Distale Muskeldystrophie Typ Nonaka | autosomal-rezessiv | 605820 | 9p13.3 | UDP-N-acetylglucosamine-2-epimerase/N-acetylmannosamine-Kinase (GNE) | |
| Muskeldystrophie Miyoshi 1 | autosomal-rezessiv | 254130 | 2p13.2 | Dysferlin | |
| Muskeldystrophie Miyoshi 2 | autosomal-rezessiv | 613318 | 8q22.3 | unbekannt | |
| Muskeldystrophie Miyoshi 3 | autosomal-rezessiv | 613319 | 11p14.3 | Anoctamin-5 | |
| Distale Muskeldystrophie Typ Laing | autosomal-dominant | 160500 | 14q11.2 | Myosin-7 | |
| Vocal cord and pharyngeal weakness with distal myopathy (VCPDM) | autosomal-dominant | 606070 | 5q31 | Matrin-3 | |
| Myofibrilläre Myopathien | Myofibrilläre Myopathie Typ 1 (MFM1) | autosomal-dominant und autosomal-rezessiv | 601419 | 2q35 | Desmin |
| Myofibrilläre Myopathie Typ 2 (MFM2) | autosomal-dominant | 608810 | 11q23.1 | Alpha-crystallin B | |
| Myofibrilläre Myopathie Typ 3 (MFM3) | autosomal-dominant | 609200 | 5q31.2 | Myotilin | |
| Myofibrilläre Myopathie Typ 4 (MFM4) | autosomal-dominant | 609452 | 10q23.2 | ZASP | |
| Myofibrilläre Myopathie Typ 5 (MFM5) | autosomal-dominant | 609524 | 7q32.1 | Filamin-C | |
| Myofibrilläre Myopathie Typ 6 (MFM6) | autosomal-dominant | 612954 | 10q26.11 | BAG family molecular chaperone regulator 3 (BAG3) | |
| Myotone Dystrophien | Myotone Dystrophie Typ 1 (Morbus Curschmann-Steinert) | autosomal-dominant | 160900 | 19q13.32 | Myotonin-Protein-Kinase (DMPK, Myotonic dystrophy protein kinase) |
| Myotone Dystrophie Typ 2 (Proximale myotone Myopathie, PROMM) | autosomal-dominant | 602668 | 3q21.3 | Zink finger protein 9 (ZNF9) | |
| Sonstige Muskeldystrophien | Fazioskapulohumerale Muskeldystrophie (FSHD) | autosomal-dominant | 606070 | 4q35 | Double homeobox protein 4 (DUX4) |
| Skapuloperoneale Muskeldystrophie (Stark-Kaeser-Syndrom) | autosomal-dominant | 181400 | 2q35 | Desmin | |
| Emery-Dreifuss-Muskeldystrophie Typ 4 | autosomal-dominant | 612998 | 6q25.1-q25.2 | Nesprin-1 | |
| Emery-Dreifuss-Muskeldystrophie Typ 5 | autosomal-dominant | 612999 | 14q23.2 | Nesprin-2 |
Diagnose
Die Diagnose einer Muskeldystrophie basiert auf den Ergebnissen einer Muskelbiopsie, einer erhöhten Kreatinphosphokinase (CpK3), einer Elektromyographie und einer genetischen Untersuchung. Eine körperliche Untersuchung und die Anamnese des Patienten helfen dem Arzt, die Art der Muskeldystrophie zu bestimmen. Bei den verschiedenen Arten von Muskeldystrophie sind bestimmte Muskelgruppen betroffen. ⓘ
Klassifizierung
| Name der Störung | OMIM | Gen | Vererbungsmuster | Alter des Auftretens | Betroffene Muskeln | Beschreibung ⓘ |
|---|---|---|---|---|---|---|
| Becker-Muskeldystrophie | 300376 | DMD | XR | Kindheit | Distale Gliedmaßen mit fortschreitender allgemeiner Schwäche | Eine weniger schwere Variante der Duchenne-Muskeldystrophie, von der vor allem Jungen betroffen sind. |
| Kongenitale Muskeldystrophie | Mehrere | Mehrere | AD, AR | Bei der Geburt | Generalisierte Schwäche | Zu den Symptomen gehören allgemeine Muskelschwäche und mögliche Gelenkdeformitäten. Die Krankheit schreitet langsam voran, und die Lebenserwartung ist verkürzt.
Die angeborene Muskeldystrophie umfasst mehrere Erkrankungen mit einer Reihe von Symptomen. Die Degeneration der Muskeln kann leicht oder schwerwiegend sein. Die Probleme können sich auf die Skelettmuskulatur beschränken, oder die Muskeldegeneration kann mit Auswirkungen auf das Gehirn und andere Organsysteme verbunden sein. Mehrere Formen der angeborenen Muskeldystrophien werden durch Defekte in Proteinen verursacht, von denen man annimmt, dass sie in irgendeiner Weise mit dem Dystrophin-Glykoprotein-Komplex und den Verbindungen zwischen den Muskelzellen und der sie umgebenden Zellstruktur zusammenhängen. Einige Formen der kongenitalen Muskeldystrophie weisen schwere Hirnfehlbildungen auf, wie z. B. Lissenzephalie und Hydrocephalus. |
| Duchenne-Muskeldystrophie | 310200 | DMD | XR | Kindheit | Distale Gliedmaßen mit fortschreitender allgemeiner Schwäche, die auch die Atemmuskulatur betrifft | Die häufigste Form der Muskeldystrophie im Kindesalter, von der vor allem Jungen betroffen sind (bei weiblichen Trägern können leichte Symptome auftreten). Sie ist durch fortschreitenden Muskelschwund gekennzeichnet. Die klinischen Symptome werden deutlich, wenn das Kind zu laufen beginnt. Im Alter von 10 Jahren benötigt das Kind möglicherweise eine Schiene, und im Alter von 12 Jahren sind die meisten Patienten nicht mehr in der Lage zu gehen. Die typische Lebenserwartung liegt zwischen 15 und 45 Jahren. Sporadische Mutationen in diesem Gen treten häufig auf. |
| Distale Muskeldystrophie | 254130 | DYSF | AD, AR | 20-60 Jahre | Distale Muskeln in Händen, Unterarmen und Unterschenkeln | Der Verlauf ist langsam und nicht lebensbedrohlich.
Die Miyoshi-Myopathie, eine der distalen Muskeldystrophien, verursacht eine anfängliche Schwäche der Wadenmuskeln und wird durch Defekte in demselben Gen verursacht, das für eine Form der Gliedergürtel-Muskeldystrophie verantwortlich ist. |
| Emery-Dreifuss-Muskeldystrophie | Mehrere | Mehrere | XR, AD, AR | Kindheit, frühes Teenageralter | Distale Muskeln der Gliedmaßen, Gliedergürtel, Herz | Zu den Symptomen gehören Muskelschwäche und Muskelschwund, der in den distalen Gliedmaßenmuskeln beginnt und sich auf die Gliedergürtelmuskeln ausweitet. Die meisten Patienten haben auch Herzleitungsstörungen und Herzrhythmusstörungen. |
| Fazioskapulohumeralen Muskeldystrophie | 158900 | DUX4 | AD | Adoleszenz | Gesicht, Schultern, Oberarme, im weiteren Verlauf auch andere Muskeln | Verursacht eine fortschreitende Schwäche, zunächst der Muskeln des Gesichts, der Schultern und der Oberarme. Häufig sind weitere Muskeln betroffen. Betroffene Personen können schwer behindert werden, 20 % sind im Alter von 50 Jahren auf einen Rollstuhl angewiesen. In 30 % der Fälle handelt es sich um spontane Mutationen. Penetranz und Schweregrad scheinen bei Frauen geringer zu sein als bei Männern. |
| Gliedergürtel-Muskeldystrophie | Mehrere | Mehrere | AD, AR | Jede | Oberarme und Beine | Die Person führt normalerweise ein normales Leben mit etwas Hilfe. Seltene kardiopulmonale Komplikationen können lebensbedrohlich sein. |
| Myotone Muskeldystrophie | 160900 602668 |
DMPK CNBP |
AD | Erwachsenwerden | Skelettmuskeln, Herz, andere Muskelgruppen | Myotonie (verzögerte Muskelentspannung), Muskelschwund und -schwäche. Der Schweregrad und die Erscheinungsformen variieren und betreffen neben den Skelettmuskeln auch viele andere Körpersysteme, darunter das Herz, die endokrinen Organe und die Augen. |
| Okulopharyngeale Muskeldystrophie | 164300 | PABPN1 | AD, selten AR | 40-50 Jahre | Augenmuskeln, Gesicht, Rachen, Becken, Schultern |
Behandlung
Derzeit gibt es keine Heilung für Muskeldystrophie. Bei der Behandlung können Physiotherapie, Beschäftigungstherapie, orthopädische Maßnahmen (z. B. Knöchel-Fuß-Orthese), Sprachtherapie und Atemtherapie hilfreich sein. Niedrig dosierte Kortikosteroide wie Prednison und Deflazacort können helfen, den Muskeltonus zu erhalten. In einigen Fällen können Orthesen (orthopädische Hilfsmittel zur Unterstützung) und korrigierende orthopädische Eingriffe erforderlich sein, um die Lebensqualität zu verbessern. Die Herzprobleme, die bei der Emery-Dreifuss-Muskeldystrophie (EDMD) und der myotonen Muskeldystrophie auftreten, können einen Herzschrittmacher erforderlich machen. Die bei der myotonen Muskeldystrophie auftretende Myotonie (verzögerte Entspannung eines Muskels nach einer starken Kontraktion) kann mit Medikamenten wie Chinin behandelt werden. ⓘ
Die Beschäftigungstherapie hilft den Betroffenen, die Aktivitäten des täglichen Lebens (wie z. B. Selbsternährung und Selbstpflege) und Freizeitaktivitäten so unabhängig wie möglich durchzuführen. Dies kann durch den Einsatz von Hilfsmitteln oder durch energiesparende Techniken erreicht werden. Die Ergotherapie kann Veränderungen in der häuslichen und beruflichen Umgebung einer Person vornehmen, um deren Funktion und Zugänglichkeit zu verbessern. Darüber hinaus befasst sie sich mit psychosozialen Veränderungen und kognitiven Beeinträchtigungen, die mit MD einhergehen können, und bietet der Familie und dem Betroffenen Unterstützung und Aufklärung über die Krankheit. ⓘ
Vorhersage
Die Prognose hängt von der jeweiligen Form der Muskeldystrophie ab. Einige Dystrophien verursachen eine fortschreitende Schwäche und einen Verlust der Muskelfunktion, was zu schweren körperlichen Behinderungen und einer lebensbedrohlichen Verschlechterung der Atemmuskulatur oder des Herzens führen kann. Andere Dystrophien haben keine Auswirkungen auf die Lebenserwartung und verursachen nur relativ leichte Beeinträchtigungen. ⓘ
Geschichte
In den 1860er Jahren wurden in medizinischen Fachzeitschriften vermehrt Beschreibungen von Jungen veröffentlicht, die zunehmend schwächer wurden, ihre Gehfähigkeit verloren und in jungen Jahren starben. Im folgenden Jahrzehnt beschrieb der französische Neurologe Guillaume Duchenne die häufigste und schwerste Form der Krankheit, die heute seinen Namen trägt - MD Duchenne. ⓘ
Gesellschaft und Kultur
1966 begannen Jerry Lewis und die Muscular Dystrophy Association (MDA) in den USA und Kanada mit der jährlichen Fernsehsendung The Jerry Lewis Telethon am Tag der Arbeit, die wesentlich dazu beitrug, das Bewusstsein für Muskeldystrophie in Nordamerika zu schärfen. Befürworter der Rechte von Menschen mit Behinderungen kritisierten jedoch, dass der Spendenmarathon die Menschen, die mit der Krankheit leben, eher mitleidig als respektvoll darstelle. ⓘ
Am 18. Dezember 2001 wurde in den USA das MD CARE-Gesetz unterzeichnet, das den Public Health Service Act ändert, um die Forschung für die verschiedenen Muskeldystrophien zu ermöglichen. Mit diesem Gesetz wurde auch das Muskeldystrophie-Koordinationskomitee eingerichtet, das die Forschungsanstrengungen durch eine kohärente Forschungsstrategie bündeln soll. ⓘ
Diagnostik
Die Bestimmung der Kreatinkinase (CK) im Blutserum kann einen allgemeinen Anhalt für das Vorliegen einer Muskeldystrophie bieten, da die Serumkonzentration bei Degeneration der Skelettmuskelfasern ansteigt. Dementsprechend ist die Kreatinkinase bei den meisten Muskeldystrophien leicht bis deutlich erhöht (HyperCKämie). Die Bestimmung der Serumkreatinkinase gilt als sensitiver und spezifischer als die Bestimmung anderer Enzyme wie der Aspartat-Aminotransferase (ASAT), der Alanin-Aminotransferase (ALAT) und der Lactatdehydrogenase (LDH), die häufig ebenfalls erhöht sind. Da sich die Höhe der Serumkreatininkinase zwischen den einzelnen Muskeldystrophien teils deutlich unterscheidet, kann diese auch für differentialdiagnostische Überlegungen herangezogen werden. Darüber hinaus kann eine CK-Erhöhung auch einziges Symptom einer Muskeldystrophie sein. Dies spielt u. a. eine Rolle bei der Untersuchung von Verwandten, da eine Erhöhung der CK dann gegebenenfalls Hinweise auf den Vererbungsmodus liefern kann. ⓘ