QT-Syndrom
| Langes QT-Syndrom ⓘ | |
|---|---|
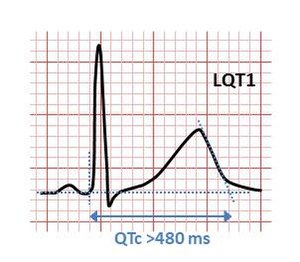 | |
| EKG mit typischem Muster des vererbten Long-QT-Syndroms (LQT1). Ein QT-Intervall von >480 ms wird als abnorm lang angesehen. | |
| Fachgebiet | Kardiologie |
| Symptome | Ohnmacht, Hörverlust, Krampfanfälle |
| Komplikationen | Plötzlicher Tod |
| Ursachen | Genetisch bedingt, bestimmte Medikamente, Kaliummangel im Blut, Kalziummangel im Blut, Herzversagen |
| Risikofaktoren | Plötzlicher Tod in der Familiengeschichte |
| Diagnostische Methode | Elektrokardiogramm (EKG), klinischer Befund, Gentest |
| Differentialdiagnose | Brugada-Syndrom, arrhythmogene rechtsventrikuläre Dysplasie |
| Behandlung | Vermeiden von anstrengender Bewegung, ausreichende Kaliumzufuhr, Betablocker, implantierbarer Herzdefibrillator |
| Häufigkeit | ≈ 1 von 7.000 |
| Todesfälle | ≈ 3.500 pro Jahr (USA) |
Das lange QT-Syndrom (LQTS) ist eine Erkrankung, bei der die Repolarisation des Herzens nach einem Herzschlag gestört ist. Dies führt zu einem erhöhten Risiko für einen unregelmäßigen Herzschlag, der zu Ohnmacht, Ertrinken, Krampfanfällen oder plötzlichem Tod führen kann. Diese Episoden können durch Bewegung oder Stress ausgelöst werden. Einige seltene Formen des LQTS gehen mit anderen Symptomen und Anzeichen einher, darunter Taubheit und Phasen der Muskelschwäche. ⓘ
Das lange QT-Syndrom kann bei der Geburt vorhanden sein oder sich später im Leben entwickeln. Die vererbte Form kann allein oder als Teil einer größeren genetischen Störung auftreten. Ein späterer Ausbruch kann durch bestimmte Medikamente, einen niedrigen Kaliumspiegel im Blut, einen niedrigen Kalziumspiegel im Blut oder eine Herzinsuffizienz verursacht werden. Zu den Medikamenten, die in Frage kommen, gehören bestimmte Antiarrhythmika, Antibiotika und Antipsychotika. LQTS kann mit Hilfe eines Elektrokardiogramms (EKG) diagnostiziert werden, wenn ein korrigiertes QT-Intervall von mehr als 480-500 Millisekunden festgestellt wird, aber klinische Befunde, andere EKG-Merkmale und Gentests können die Diagnose auch bei kürzeren QT-Intervallen bestätigen. ⓘ
Die Behandlung kann darin bestehen, anstrengende körperliche Betätigung zu vermeiden, ausreichend Kalium zu sich zu nehmen, Betablocker einzusetzen oder einen implantierbaren Herzdefibrillator zu verwenden. Bei Menschen mit LQTS, die einen Herzstillstand überleben und unbehandelt bleiben, beträgt das Risiko, innerhalb von 15 Jahren zu sterben, mehr als 50 %. Bei angemessener Behandlung sinkt dieses Risiko auf weniger als 1 % innerhalb von 20 Jahren. ⓘ
Das lange QT-Syndrom betrifft schätzungsweise 1 von 7.000 Menschen. Frauen sind häufiger betroffen als Männer. Bei den meisten Betroffenen treten die Symptome auf, bevor sie 40 Jahre alt sind. Es ist neben dem Brugada-Syndrom und der arrhythmogenen rechtsventrikulären Dysplasie eine relativ häufige Ursache für plötzliche Todesfälle. In den Vereinigten Staaten führt sie zu etwa 3 500 Todesfällen pro Jahr. Die Erkrankung wurde erstmals 1957 eindeutig beschrieben. ⓘ
| Klassifikation nach ICD-10 ⓘ | |
|---|---|
| I49.8 | LQTS (Long QT-Syndrom) |
| ICD-10 online (WHO-Version 2019) | |

Das Long-QT-Syndrom (LQTS, „Langes-QT-Syndrom“, früher QT-Syndrom) ist eine seltene Krankheit, die bei sonst herzgesunden Menschen zum plötzlichen Herztod führen kann. Es ist entweder vererbt (kongenital) oder erworben, dann meist als Folge einer unerwünschten Arzneimittelwirkung. Die bekanntesten kongenitalen Long-QT-Syndrome sind das Romano-Ward-Syndrom (autosomal-dominant; synonym: Pseudohypokaliämie-Syndrom) und das Jervell- und Lange-Nielsen-Syndrom (autosomal-rezessiv; JLNS). ⓘ
Das wegweisende und namensgebende Krankheitszeichen des Long-QT-Syndroms ist eine Verlängerung der QT-Zeit im Elektrokardiogramm (EKG) mit einer frequenzkorrigierten QT-Zeit (QTc, englisch Corrected QT interval) von über 440 Millisekunden (ms). Für das Long-QT-Syndrom typisch ist anfallsweise auftretendes Herzrasen (Tachykardie), oft in Form der lebensbedrohlichen Torsade-de-pointes-Tachykardien. Diese Herzrhythmusstörungen können zu Schwindelattacken, plötzlicher Bewusstlosigkeit (Synkope) und zum Herzstillstand durch Kammerflimmern führen. Viele Patienten leiden aber unter keinerlei Beschwerden, bleiben also asymptomatisch. ⓘ
Sowohl die Tachykardien als auch die Synkopen treten bevorzugt bei körperlicher Belastung oder in Stresssituationen auf. Bei symptomatischen Patienten ist die Prognose ohne Behandlung schlecht, fast allen Patienten kann aber heutzutage eine adäquate Therapie angeboten werden. ⓘ
Anzeichen und Symptome
Viele Menschen mit langem QT-Syndrom haben keine Anzeichen oder Symptome. Wenn Symptome auftreten, werden sie in der Regel durch abnorme Herzrhythmen (Arrhythmien) verursacht, am häufigsten durch eine Form der ventrikulären Tachykardie namens Torsades de pointes (TdP). Kehrt die Arrhythmie spontan in einen normalen Rhythmus zurück, kann der Betroffene Schwindel (so genannte Präsynkopen) oder Ohnmacht erleben, denen ein flatterndes Gefühl in der Brust vorausgehen kann. Wenn die Arrhythmie anhält, kann der Betroffene einen Herzstillstand erleiden, der unbehandelt zum plötzlichen Tod führen kann. Bei Menschen mit LQTS kann es auch zu krampfartigen Anfällen (nicht-epileptischen Anfällen) kommen, die auf eine verminderte Durchblutung des Gehirns während einer Arrhythmie zurückzuführen sind. Auch Epilepsie wird mit bestimmten Formen des Long-QT-Syndroms in Verbindung gebracht. ⓘ
Die Herzrhythmusstörungen, die zu Ohnmachtsanfällen und plötzlichem Tod führen, treten eher unter bestimmten Umständen auf, die zum Teil davon abhängen, welche genetische Variante vorhanden ist. Während Herzrhythmusstörungen jederzeit auftreten können, sind sie bei einigen Formen des LQTS häufiger als Reaktion auf körperliche Anstrengung oder psychischen Stress (LQT1), bei anderen Formen nach einem plötzlichen lauten Geräusch (LQT2) und bei einigen Formen im Schlaf oder unmittelbar nach dem Aufwachen (LQT3) zu beobachten. ⓘ
Einige seltene Formen des Long-QT-Syndroms wirken sich auf andere Körperteile aus und führen bei der Jervell- und Lange-Nielsen-Form der Erkrankung zu Taubheit und bei der Andersen-Tawil-Form (LQT7) zu periodischen Lähmungen. ⓘ
Risiko für Herzrhythmusstörungen
Menschen mit dem Long-QT-Syndrom haben zwar ein erhöhtes Risiko, Herzrhythmusstörungen zu entwickeln, aber das absolute Risiko für Herzrhythmusstörungen ist sehr unterschiedlich. Der stärkste Prädiktor für die Entwicklung einer TdP ist die Frage, ob diese Arrhythmie oder eine andere Form des Herzstillstands in der Vergangenheit aufgetreten ist. Personen mit LQTS, die eine Synkope erlitten haben, ohne dass damals ein EKG aufgezeichnet wurde, haben ebenfalls ein höheres Risiko, da die Synkope in diesen Fällen häufig auf eine nicht dokumentierte selbstterminierende Arrhythmie zurückzuführen ist. ⓘ
Neben einer Vorgeschichte von Herzrhythmusstörungen ist auch das Ausmaß der QT-Verlängerung ein Risikofaktor. Einige haben stark verlängerte QT-Intervalle, andere haben nur eine leichte QT-Verlängerung oder sogar ein normales QT-Intervall in Ruhe (verdecktes LQTS). Diejenigen mit den längsten QT-Intervallen haben ein höheres Risiko, eine TdP zu erleiden, und es wird angenommen, dass ein korrigiertes QT-Intervall von mehr als 500 ms ein höheres Risiko darstellt. Dennoch besteht auch bei Personen mit nur leichter QT-Verlängerung oder verdecktem LQTS ein gewisses Risiko für Herzrhythmusstörungen. Insgesamt ist jede Verlängerung des korrigierten QT-Intervalls um 10 ms mit einem um 15 % erhöhten Arrhythmierisiko verbunden. ⓘ
Da sich die QT-verlängernden Wirkungen sowohl der genetischen Varianten als auch der erworbenen Ursachen des LQTS addieren, ist bei Personen mit vererbtem LQTS die Wahrscheinlichkeit einer TdP größer, wenn sie QT-verlängernde Medikamente erhalten oder wenn sie Elektrolytprobleme wie niedrige Kaliumwerte im Blut (Hypokaliämie) haben. Auch bei Personen, die QT-verlängernde Medikamente einnehmen, ist die Wahrscheinlichkeit einer TdP größer, wenn sie eine genetische Veranlagung zu einem verlängerten QT-Intervall haben, selbst wenn diese Veranlagung verdeckt ist. Herzrhythmusstörungen treten bei medikamenteninduziertem LQTS häufiger auf, wenn das betreffende Medikament schnell intravenös verabreicht wurde oder wenn hohe Konzentrationen des Medikaments im Blut der Person vorhanden sind. Das Risiko für Herzrhythmusstörungen ist auch höher, wenn die Person, die das Medikament erhält, eine Herzinsuffizienz hat, Digitalis einnimmt oder kürzlich eine Kardioversion bei Vorhofflimmern durchgeführt wurde. Weitere Risikofaktoren für die Entwicklung von Torsades de pointes bei LQTS-Patienten sind das weibliche Geschlecht, ein höheres Alter, eine bereits bestehende Herz-Kreislauf-Erkrankung sowie eine abnorme Leber- oder Nierenfunktion. ⓘ
Ursachen
Es gibt mehrere Subtypen des Long-QT-Syndroms. Diese lassen sich grob unterteilen in solche, die durch genetische Mutationen verursacht werden, mit denen die Betroffenen geboren werden, die sie ihr Leben lang in sich tragen und die sie an ihre Kinder weitergeben können (vererbtes oder angeborenes langes QT-Syndrom), und solche, die durch andere Faktoren verursacht werden, die nicht vererbt werden können und oft reversibel sind (erworbenes langes QT-Syndrom). ⓘ
Vererbtes

Das angeborene oder kongenitale lange QT-Syndrom wird durch genetische Anomalien verursacht. LQTS kann durch Varianten in mehreren Genen entstehen, die in einigen Fällen zu ganz unterschiedlichen Merkmalen führen. Die Gemeinsamkeit dieser Varianten besteht darin, dass sie einen oder mehrere Ionenströme beeinflussen, was zu einer Verlängerung des ventrikulären Aktionspotenzials und damit zu einer Verlängerung des QT-Intervalls führt. Es wurden Klassifizierungssysteme vorgeschlagen, um zwischen Subtypen der Erkrankung zu unterscheiden, die auf den klinischen Merkmalen basieren (und nach denjenigen benannt sind, die die Erkrankung zuerst beschrieben haben) und nach der zugrunde liegenden genetischen Variante unterteilt sind. Die häufigste Form, die 99 % der Fälle ausmacht, ist das Romano-Ward-Syndrom (genetisch LQT1-6 und LQT9-16), eine autosomal dominante Form, bei der die elektrische Aktivität des Herzens betroffen ist, ohne dass andere Organe betroffen sind. Eine seltenere Form ist das Jervell-Lange-Nielsen-Syndrom, eine autosomal rezessive Form des LQTS, bei der ein verlängertes QT-Intervall mit angeborener Taubheit kombiniert ist. Weitere seltene Formen sind das Anderson-Tawil-Syndrom (LQT7) mit Merkmalen wie einem verlängerten QT-Intervall, periodischen Lähmungen und Anomalien des Gesichts und des Skeletts sowie das Timothy-Syndrom (LQT8), bei dem ein verlängertes QT-Intervall mit Anomalien in der Struktur des Herzens und einer Autismus-Spektrum-Störung verbunden ist. ⓘ
Romano-Ward-Syndrom
LQT1 ist der häufigste Subtyp des Romano-Ward-Syndroms, der für 30 bis 35 % aller Fälle verantwortlich ist. Das verantwortliche Gen, KCNQ1, wurde auf Chromosom 11p15.5 isoliert und kodiert für die Alpha-Untereinheit des Kaliumkanals KvLQT1. Diese Untereinheit interagiert mit anderen Proteinen (insbesondere mit der minK-Beta-Untereinheit), um den Kanal zu bilden, der den verzögerten Kaliumgleichrichterstrom IKs überträgt, der für die Repolarisationsphase des kardialen Aktionspotenzials verantwortlich ist. Varianten in KCNQ1, die den IKs-Strom verringern (Varianten mit Funktionsverlust), verlangsamen die Repolarisation des Aktionspotenzials. Dies verursacht den LQT1-Subtyp des Romano-Ward-Syndroms, wenn eine einzige Kopie der Variante vererbt wird (heterozygoter, autosomal dominanter Erbgang). Die Vererbung von zwei Kopien der Variante (homozygot, autosomal rezessiver Erbgang) führt zu dem schwereren Jervell- und Lange-Nielsen-Syndrom. Umgekehrt führen Varianten in KCNQ1, die die IKs erhöhen, zu einer schnelleren Repolarisation und dem Kurz-QT-Syndrom. ⓘ
Der LQT2-Subtyp ist die zweithäufigste Form des Romano-Ward-Syndroms und für 25 bis 30 % aller Fälle verantwortlich. Sie wird durch Varianten im KCNH2-Gen (auch als hERG bekannt) auf Chromosom 7 verursacht, das für den Kaliumkanal kodiert, der den schnellen Einwärtsgleichrichterstrom IKr leitet. Dieser Strom ist für die terminale Repolarisationsphase des kardialen Aktionspotenzials und damit für die Länge des QT-Intervalls verantwortlich. ⓘ
Der LQT3-Subtyp des Romano-Ward-Syndroms wird durch Varianten im SCN5A-Gen auf dem Chromosom 3p21-24 verursacht. SCN5A kodiert für die Alpha-Untereinheit des kardialen Natriumkanals NaV1.5, der für den Natriumstrom INa verantwortlich ist, der die Herzzellen zu Beginn des Aktionspotenzials depolarisiert. Normalerweise werden kardiale Natriumkanäle schnell inaktiviert, aber die Mutationen, die bei LQT3 eine Rolle spielen, verlangsamen ihre Inaktivierung, was zu einem kleinen, anhaltenden "späten" Natriumstrom führt. Dieser anhaltende Einwärtsstrom verlängert das Aktionspotenzial und damit das QT-Intervall. Während einige Varianten in SCN5A LQT3 verursachen, können andere Varianten ganz andere Zustände hervorrufen. Varianten, die zu einer Verringerung des frühen Spitzenstroms führen, können das Brugada-Syndrom und kardiale Überleitungsstörungen verursachen, während andere Varianten mit dilatativer Kardiomyopathie in Verbindung gebracht wurden. Einige Varianten, die sich sowohl auf den frühen als auch auf den späten Natriumstrom auswirken, können Überlappungssyndrome verursachen, die Aspekte sowohl des LQT3- als auch des Brugada-Syndroms kombinieren. ⓘ
Seltene Romano-Ward-Subtypen (LQT4-6 und LQT9-16)
LQT5 wird durch Varianten im KCNE1-Gen verursacht, das für die Beta-Untereinheit des Kaliumkanals MinK verantwortlich ist. Diese Untereinheit ist in Verbindung mit der von KCNQ1 kodierten Alpha-Untereinheit für den Kaliumstrom IKs verantwortlich, der bei LQTS vermindert ist. LQT6 wird durch Varianten im KCNE2-Gen verursacht, das für die Kaliumkanal-Beta-Untereinheit MiRP1 verantwortlich ist, die den Kaliumstrom IKr erzeugt. Varianten, die diesen Strom verringern, wurden mit einer Verlängerung des QT-Intervalls in Verbindung gebracht. Spätere Beweise, wie das relativ häufige Auftreten von Varianten in diesem Gen bei Personen ohne langes QT-Syndrom und die allgemeine Notwendigkeit, dass ein zweiter Stressor wie Hypokaliämie vorhanden sein muss, um die QT-Verlängerung aufzudecken, haben jedoch nahegelegt, dass dieses Gen stattdessen einen Modifikator für die Anfälligkeit für QT-Verlängerungen darstellt. Daher ist umstritten, ob Varianten in KCNE2 ausreichen, um das Romano-Ward-Syndrom allein zu verursachen. ⓘ
LQT9 wird durch Varianten in dem Membranstrukturprotein Caveolin-3 verursacht. Caveoline bilden spezifische Membrandomänen, so genannte Caveolae, in denen spannungsgesteuerte Natriumkanäle sitzen. Ähnlich wie bei LQT3 erhöhen diese Caveolin-Varianten den späten, anhaltenden Natriumstrom, der die zelluläre Repolarisierung beeinträchtigt. ⓘ
LQT10 ist ein extrem seltener Subtyp, der durch Varianten im SCN4B-Gen verursacht wird. Das Produkt dieses Gens ist eine Beta-Hilfsuntereinheit (NaVβ4), die kardiale Natriumkanäle bildet, deren Varianten den späten anhaltenden Natriumstrom erhöhen. LQT13 wird durch Varianten in GIRK4 verursacht, einem Protein, das an der parasympathischen Modulation des Herzens beteiligt ist. Klinisch sind die Patienten durch eine nur mäßige QT-Verlängerung, aber eine erhöhte Neigung zu Vorhofarrhythmien gekennzeichnet. LQT14, LQT15 und LQT16 werden durch Varianten in den für Calmodulin zuständigen Genen (CALM1, CALM2 bzw. CALM3) verursacht. Calmodulin interagiert mit mehreren Ionenkanälen und spielt unter anderem eine Rolle bei der Modulation des L-Typ-Kalziumstroms als Reaktion auf Kalziumkonzentrationen und beim Trafficking der von KCNQ1 produzierten Proteine, wodurch Kaliumströme beeinflusst werden. Die genauen Mechanismen, durch die diese genetischen Varianten das QT-Intervall verlängern, sind noch unklar. ⓘ
Jervell- und Lange-Nielsen-Syndrom
Das Jervell- und Lange-Nielsen-Syndrom (JLNS) ist eine seltene Form von LQTS, die autosomal rezessiv vererbt wird. Zusätzlich zu einer schweren Verlängerung des QT-Intervalls werden die Betroffenen mit einer schweren sensorineuralen Taubheit auf beiden Ohren geboren. Das Syndrom wird durch die Vererbung von zwei Kopien einer bestimmten Variante in den Genen KCNE1 oder KCNQ1 verursacht. Die gleichen genetischen Varianten führen zu den Formen LQT1 und LQT5 des Romano-Ward-Syndroms, wenn nur eine Kopie der Variante vererbt wird. JLNS ist im Allgemeinen mit einem höheren Risiko für Herzrhythmusstörungen verbunden als die meisten anderen Formen von LQTS. ⓘ
Andersen-Tawil-Syndrom (LQT7)
LQT7, auch bekannt als Andersen-Tawil-Syndrom, zeichnet sich durch eine Trias von Merkmalen aus - neben einem verlängerten QT-Intervall können die Betroffenen an intermittierender Schwäche leiden, die häufig zu Zeiten niedriger Kaliumkonzentrationen im Blut auftritt (hypokaliämische periodische Paralyse), sowie an charakteristischen Gesichts- und Skelettanomalien wie einem kleinen Unterkiefer (Mikrognathie), tief angesetzten Ohren und verwachsenen oder abnormal abgewinkelten Fingern und Zehen (Syndaktylie und Klinodaktylie). Die Erkrankung wird autosomal-dominant vererbt und wird durch Mutationen im KCNJ2-Gen verursacht, das für das Kaliumkanalprotein Kir2.1 kodiert. ⓘ
Timothy-Syndrom (LQT8)
LQT8, auch bekannt als Timothy-Syndrom, kombiniert ein verlängertes QT-Intervall mit verwachsenen Fingern oder Zehen (Syndaktylie). Häufig werden Anomalien der Herzstruktur beobachtet, darunter Ventrikelseptumdefekt, Fallot-Tetralogie und hypertrophe Kardiomyopathie. Die Erkrankung tritt früh im Leben auf, und die durchschnittliche Lebenserwartung beträgt 2,5 Jahre, wobei der Tod am häufigsten durch ventrikuläre Arrhythmien verursacht wird. Viele Kinder mit Timothy-Syndrom, die länger überleben, weisen Merkmale einer Autismus-Spektrum-Störung auf. Das Timothy-Syndrom wird durch Varianten im Kalziumkanal Cav1.2 verursacht, der durch das Gen CACNA1c kodiert wird. ⓘ
Tabelle der assoziierten Gene
Im Folgenden finden Sie eine Liste der Gene, die mit dem Long-QT-Syndrom in Verbindung stehen:
| Typ | OMIM | Gen | Anmerkungen ⓘ |
| LQT1 | 192500 | KCNQ1 | Kodiert die α-Untereinheit des langsamen verzögert gleichrichtenden Kaliumkanals KV7.1, der den Kaliumstrom IKs überträgt. |
| LQT2 | 152427 | KCNH2 | Auch bekannt als hERG. Kodiert die α-Untereinheit des schnellen verzögert gleichrichtenden Kaliumkanals KV11.1, der den Kaliumstrom IKr führt. |
| LQT3 | 603830 | SCN5A | Kodiert die α-Untereinheit des kardialen Natriumkanals NaV1.5, der den Natriumstrom INa führt. |
| LQT4 | 600919 | ANK2 | Enkodiert Ankyrin B, das die Ionenkanäle in der Zelle verankert. Es ist umstritten, ob es sich um ein krankheitsverursachendes oder ein geringfügiges QT-Suszeptibilitätsgen handelt. |
| LQT5 | 176261 | KCNE1 | Kodiert MinK, eine β-Untereinheit des Kaliumkanals. Heterozygoter Erbgang führt zu Romano-Ward, homozygoter Erbgang zum Jervell- und Lange-Nielsen-Syndrom. |
| LQT6 | 603796 | KCNE2 | Kodiert MiRP1, eine β-Untereinheit des Kaliumkanals. Umstritten, ob es sich um ein krankheitsverursachendes oder ein geringfügiges QT-Suszeptibilitätsgen handelt. |
| LQT7 | 170390 | KCNJ2 | Kodiert den einwärts gleichrichtenden Kaliumstrom Kir2.1, der den Kaliumstrom IK1 trägt. Verursacht das Andersen-Tawil-Syndrom. |
| LQT8 | 601005 | CACNA1c | Kodiert die α-Untereinheit CaV1.2 des Kalziumkanals Cav1.2, der den Kalziumstrom ICa(L) leitet. Verursacht das Timothy-Syndrom. |
| LQT9 | 611818 | CAV3 | Kodiert Caveolin-3, das für die Bildung von Membransäckchen, den so genannten Caveolae, verantwortlich ist. Mutationen in diesem Gen können den späten Natriumstrom INa erhöhen. |
| LQT10 | 611819 | SCN4B | Enkodiert die β4-Untereinheit des kardialen Natriumkanals. |
| LQT11 | 611820 | AKAP9 | Enkodiert das A-Kinase-assoziierte Protein, das mit KV7.1 interagiert. |
| LQT12 | 601017 | SNTA1 | Enkodiert Syntrophin-α1. Mutationen in diesem Gen können den späten Natriumstrom INa erhöhen. |
| LQT13 | 600734 | KCNJ5 | Auch bekannt als GIRK4, kodiert für G-Protein-sensitive einwärts gleichrichtende Kaliumkanäle (Kir3.4), die den Kaliumstrom IK(ACh) leiten. |
| LQT14 | 616247 | CALM1 | Kodiert Calmodulin-1, ein kalziumbindendes Botenprotein, das mit dem Kalziumstrom ICa(L) interagiert. |
| LQT15 | 616249 | CALM2 | Kodiert Calmodulin-2, ein Calcium-bindendes Botenprotein, das mit dem Calciumstrom ICa(L) interagiert. |
| LQT16 | 114183 | CALM3 | Kodiert Calmodulin-3, ein Calcium-bindendes Botenprotein, das mit dem Calciumstrom ICa(L) interagiert. |
Erworben
Obwohl das lange QT-Syndrom häufig genetisch bedingt ist, kann ein verlängertes QT-Intervall, das mit einem erhöhten Risiko für Herzrhythmusstörungen einhergeht, auch bei Menschen ohne genetische Anomalie auftreten, meist als Nebenwirkung von Medikamenten. Eine arzneimittelbedingte QT-Verlängerung ist häufig eine Folge der Behandlung mit Antiarrhythmika wie Amiodaron und Sotalol, Antibiotika wie Erythromycin oder Antihistaminika wie Terfenadin. Weitere Medikamente, die das QT-Intervall verlängern, sind einige Antipsychotika wie Haloperidol und Ziprasidon sowie das Antidepressivum Citalopram. Listen von Medikamenten, die mit einer Verlängerung des QT-Intervalls in Verbindung gebracht werden, finden Sie z. B. in der CredibleMeds-Datenbank im Internet. ⓘ
Andere Ursachen für erworbenes LQTS sind abnorm niedrige Kalium- (Hypokaliämie) oder Magnesiumwerte (Hypomagnesiämie) im Blut. Dies kann sich nach einer plötzlichen Verringerung der Blutzufuhr zum Herzen (Myokardinfarkt), einem niedrigen Schilddrüsenhormonspiegel (Hypothyreose) und einer langsamen Herzfrequenz (Bradykardie) verschlimmern. ⓘ
Anorexia nervosa wurde mit plötzlichen Todesfällen in Verbindung gebracht, die möglicherweise auf eine QT-Verlängerung zurückzuführen sind. Die bei dieser Erkrankung auftretende Unterernährung kann manchmal die Konzentration von Salzen wie Kalium im Blut beeinträchtigen, was zu einem erworbenen langen QT-Syndrom führen kann, das wiederum einen plötzlichen Herztod verursacht. Die Unterernährung und die damit verbundenen Veränderungen im Salzhaushalt entwickeln sich über einen längeren Zeitraum, und eine rasche Wiederaufnahme der Ernährung kann das Salzgleichgewicht weiter stören und das Risiko von Herzrhythmusstörungen erhöhen. Daher müssen die Elektrolytwerte sorgfältig überwacht werden, um die Komplikationen des Refeeding-Syndroms zu vermeiden. ⓘ
Faktoren, die das QT-Intervall verlängern, sind additiv, d. h. eine Kombination von Faktoren (z. B. die Einnahme eines QT-verlängernden Medikaments und ein niedriger Kaliumspiegel) kann eine stärkere QT-Verlängerung verursachen als jeder Faktor für sich. Dies gilt auch für einige genetische Varianten, die für sich genommen das QT-Intervall nur geringfügig verlängern, aber Menschen anfälliger für eine signifikante medikamenteninduzierte QT-Verlängerung machen können. ⓘ
Mechanismen
Die verschiedenen Formen des langen QT-Syndroms, sowohl angeborene als auch erworbene, führen zu abnormalen Herzrhythmen (Arrhythmien), indem sie die elektrischen Signale beeinflussen, die zur Koordinierung der einzelnen Herzzellen dienen. Das gemeinsame Thema ist eine Verlängerung des kardialen Aktionspotenzials - des charakteristischen Musters von Spannungsänderungen an der Zellmembran, die bei jedem Herzschlag auftreten. Wenn Herzzellen entspannt sind, befinden sich normalerweise weniger positiv geladene Ionen auf der Innenseite der Zellmembran als auf der Außenseite, was als Polarisierung der Membran bezeichnet wird. Wenn sich die Herzzellen zusammenziehen, dringen positiv geladene Ionen wie Natrium und Kalzium in die Zelle ein und gleichen diese Polarität aus oder kehren sie um bzw. depolarisieren die Zelle. Nach einer Kontraktion stellt die Zelle ihre Polarität wieder her (oder repolarisiert), indem sie positiv geladene Ionen wie Kalium aus der Zelle austreten lässt und die Membran wieder in ihren entspannten, polarisierten Zustand zurückversetzt. Beim Long-QT-Syndrom dauert diese Repolarisation länger, was sich in den einzelnen Zellen als längeres Aktionspotenzial und auf dem Oberflächen-EKG als langes QT-Intervall zeigt. ⓘ
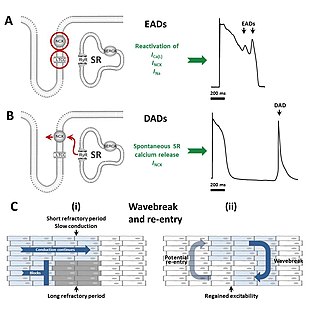
Die verlängerten Aktionspotenziale können durch verschiedene Mechanismen zu Herzrhythmusstörungen führen. Die für das lange QT-Syndrom charakteristische Arrhythmie, die Torsades de Pointes, beginnt, wenn ein erstes Aktionspotenzial weitere abnorme Aktionspotenziale in Form von Nachdepolarisationen auslöst. Frühe Nachdepolarisationen, die auftreten, bevor die Zelle vollständig repolarisiert ist, treten besonders häufig bei verlängerten Aktionspotenzialen auf und entstehen durch die Reaktivierung von Kalzium- und Natriumkanälen, die normalerweise bis zum nächsten Herzschlag abgeschaltet sind. Unter den richtigen Bedingungen kann die Reaktivierung dieser Ströme, die durch den Natrium-Calcium-Austauscher begünstigt wird, eine weitere Depolarisation der Zelle verursachen. Die frühen Nachdepolarisationen, die beim Long-QT-Syndrom Herzrhythmusstörungen auslösen, gehen in der Regel von den Purkinje-Fasern des kardialen Reizleitungssystems aus. Frühe Nachdepolarisationen können als Einzelereignisse auftreten, sie können aber auch wiederholt auftreten und zu mehreren schnellen Aktivierungen der Zelle führen. ⓘ
Einige Forschungsergebnisse deuten darauf hin, dass verzögerte Nachdepolarisationen, die nach Abschluss der Repolarisation auftreten, ebenfalls eine Rolle beim Long-QT-Syndrom spielen können. Diese Form der Nachdepolarisation entsteht durch die spontane Freisetzung von Kalzium aus dem intrazellulären Kalziumspeicher, dem so genannten sarkoplasmatischen Retikulum, wodurch Kalzium durch den Natrium-Kalzium-Austauscher im Austausch gegen Natrium aus der Zelle herausgedrängt wird und ein Netto-Einwärtsstrom entsteht. ⓘ
Während es starke Hinweise darauf gibt, dass der Auslöser für Torsades de Pointes von Nachdepolarisationen herrührt, ist weniger sicher, was diese Arrhythmie aufrechterhält. Einiges deutet darauf hin, dass wiederholte Nachdepolarisationen aus vielen Quellen zur Aufrechterhaltung der Arrhythmie beitragen. Es gibt jedoch auch Hinweise darauf, dass die Arrhythmie durch einen Mechanismus aufrechterhalten wird, der als Re-Entry bekannt ist. Nach diesem Modell tritt die Aktionspotenzialverlängerung in unterschiedlichem Ausmaß in verschiedenen Schichten des Herzmuskels auf, wobei die Aktionspotenziale in einigen Schichten länger sind als in anderen. Als Reaktion auf einen auslösenden Impuls breiten sich die Depolarisationswellen in Regionen mit kürzeren Aktionspotenzialen aus, blockieren aber in Regionen mit längeren Aktionspotenzialen. Dadurch kann sich die depolarisierende Wellenfront um die blockierten Bereiche herum biegen und möglicherweise eine vollständige Schleife bilden, die sich selbst wiederholt. Das verdrehte Muster auf dem EKG lässt sich durch die Bewegung des Kerns des Reentrantkreislaufs in Form einer mäandernden Spiralwelle erklären. ⓘ
Ursache des Long-QT-Syndroms sind geringfügige Abweichungen im Ablauf der elektrischen Signalübermittlung in den Zellen des Herzmuskels (Myokard). Dabei handelt es sich um eine verzögerte Repolarisation, hauptsächlich eine Verlängerung der als Phase 2 bezeichneten Plateauphase des Aktionspotentials. Während dieser früher oft als vulnerable Phase bezeichneten Zeit von etwa 300-400 Millisekunden können irreguläre Nachdepolarisationen bereits wieder ein Aktionspotenzial auslösen, welches dann länger anhaltende Arrhythmien triggern kann („getriggerte Aktivität“). Bei den kongenitalen Long-QT-Syndromen wird die Verlängerung der Plateauphase durch abnorme Eigenschaften der Ionenkanäle verursacht, entweder in Form eines verminderten Ionentransports („loss of function“ des Kalium-Ionenkanals beim LQTS1 und LQTS2) oder einer erhöhten Transportleistung („gain of function“ des Natrium-Ionenkanals beim LQTS3). Beim erworbenen Long-QT-Syndrom wird sie in erster Linie auf eine Hemmung des schnellen Anteils des Kalium-Ionenstromes IKr zurückgeführt. ⓘ
Diagnose


Die Diagnose des langen QT-Syndroms ist schwierig. Zwar ist das Kennzeichen des LQTS eine Verlängerung des QT-Intervalls, doch ist das QT-Intervall sowohl bei Gesunden als auch bei Menschen mit LQTS sehr unterschiedlich. Dies führt zu Überschneidungen zwischen den QT-Intervallen von Menschen mit und ohne LQTS. 2,5 % der Menschen mit genetisch nachgewiesenem LQTS haben ein QT-Intervall, das im normalen Bereich liegt. Umgekehrt hat angesichts der Normalverteilung der QT-Intervalle ein Teil der gesunden Menschen ein längeres QT-Intervall als jeder beliebige Grenzwert. Daher sollten bei der Diagnosestellung neben dem QT-Intervall auch andere Faktoren berücksichtigt werden, von denen einige in Scoring-Systeme eingeflossen sind. ⓘ
Elektrokardiogramm

Das lange QT-Syndrom wird in erster Linie durch Messung des herzfrequenzkorrigierten QT-Intervalls (QTc) auf einem 12-Kanal-Elektrokardiogramm (EKG) diagnostiziert. Das Long-QT-Syndrom geht mit einem verlängerten QTc einher, obwohl in einigen genetisch nachgewiesenen Fällen von LQTS diese Verlängerung verborgen sein kann, was als verborgenes LQTS bezeichnet wird. Der QTc-Wert beträgt bei 95 % der normalen Männer weniger als 450 ms und bei 95 % der normalen Frauen weniger als 460 ms. Ist der QTc-Wert länger als diese Grenzwerte, wird ein LQTS vermutet. Da jedoch auch 5 % der Normalen in diese Kategorie fallen, wird ein Grenzwert von 470 ms für Männer und 480 ms für Frauen vorgeschlagen, der der 99-sten Perzentile der Normalwerte entspricht. ⓘ
Die wichtigsten Subtypen des vererbten LQTS sind mit spezifischen EKG-Merkmalen verbunden. LQT1 ist typischerweise mit breit angelegten T-Wellen assoziiert, während die T-Wellen bei LQT2 gekerbt und von geringerer Amplitude sind, während die T-Wellen bei LQT3 oft erst spät einsetzen und ihnen ein langes isoelektrisches Segment vorausgeht. ⓘ
Schwartz-Score

Der Schwartz-Score wurde als Methode zur Kombination klinischer und EKG-Faktoren vorgeschlagen, um zu beurteilen, wie wahrscheinlich es ist, dass eine Person eine vererbte Form von LQTS hat. In der nachstehenden Tabelle sind die Kriterien aufgeführt, die zur Berechnung des Scores verwendet werden. ⓘ
| Korrigiertes QT-Intervall (QTc) | ≥ 480 ms | 3 Punkte | QTc definiert nach der Bazett'schen Korrektur |
| 460-470 ms | 2 Punkte | ||
| 450 ms und männliches Geschlecht | 1 Punkt | ||
| Torsades de pointes | 2 Punkte | ||
| T-Wellen-Alternans | 1 Punkt | ||
| Gekerbte T-Wellen in mindestens 3 Ableitungen | 1 Punkt | ||
| Niedrige Herzfrequenz für das Alter (Kinder) | 0,5 Punkte | ||
| Synkope | bei Belastung | 2 Punkte | Es können nicht gleichzeitig Punkte für Synkope und Torsades vergeben werden. |
| ohne Belastung | 1 Punkt | ||
| Angeborene Taubheit | 0,5 Punkte | ||
| Familiengeschichte | Anderes Familienmitglied mit bestätigtem LQTS | 1 Punkt | Ein und dasselbe Familienmitglied kann nicht für LQTS und plötzlichen Herztod gezählt werden |
| Plötzlicher Herztod eines unmittelbaren Familienmitglieds im Alter von <30 Jahren | 0,5 Punkte | ||
| Punktzahl: 0-1 : geringe Wahrscheinlichkeit für LQTS; 2-3 : mittlere Wahrscheinlichkeit für LQTS; ≥ 4 : hohe Wahrscheinlichkeit für LQTS | |||
Andere Untersuchungen
Bei diagnostischer Unsicherheit können andere Untersuchungen hilfreich sein, um eine QT-Verlängerung zu entlarven. Zusätzlich zur Verlängerung des Ruhe-QT-Intervalls kann LQTS die Art und Weise beeinflussen, wie sich das QT-Intervall als Reaktion auf Bewegung und Stimulation durch Katecholamine wie Adrenalin verändert. Mit Hilfe von Provokationstests in Form von Belastungstoleranztests oder direkter Adrenalininfusion können diese abnormalen Reaktionen nachgewiesen werden. Diese Untersuchungen sind besonders nützlich, um Personen mit verdecktem kongenitalem LQTS 1 (LQT1) zu identifizieren, die ein normales QT-Intervall in Ruhe haben. Während sich bei gesunden Personen das QT-Intervall bei körperlicher Betätigung verkürzt, kann es bei Personen mit verborgenem LQT1 bei körperlicher Betätigung oder Adrenalininfusion zu einer paradoxen Verlängerung des QT-Intervalls kommen, wodurch die zugrunde liegende Erkrankung sichtbar wird. ⓘ
Leitlinien-Cutoffs
Die internationalen Konsensus-Leitlinien unterscheiden sich hinsichtlich des Grades der QT-Verlängerung, der für die Diagnose von LQTS erforderlich ist. Die Europäische Gesellschaft für Kardiologie empfiehlt, dass ein LQTS mit oder ohne Symptome oder andere Untersuchungen diagnostiziert werden kann, wenn das korrigierte QT-Intervall länger als 480 ms ist. Sie empfiehlt, dass eine Diagnose in Betracht gezogen werden kann, wenn ein QTc-Wert von mehr als 460 ms vorliegt und eine ungeklärte Synkope aufgetreten ist. Die Leitlinien der Heart Rhythm Society sind strenger und empfehlen einen QTc-Grenzwert von mehr als 500 ms, wenn keine anderen Faktoren vorliegen, die das QT-Intervall verlängern, oder von mehr als 480 ms bei Synkopen. Beide Richtlinien stimmen darin überein, dass LQTS auch diagnostiziert werden kann, wenn eine Person einen Schwartz-Score von mehr als 3 hat oder wenn eine pathogene genetische Variante, die mit LQTS assoziiert ist, unabhängig vom QT-Intervall identifiziert wird. ⓘ
Behandlung
Personen, bei denen LQTS diagnostiziert wurde, wird in der Regel geraten, Medikamente zu meiden, die das QT-Intervall weiter verlängern oder den Schwellenwert für TDP senken können; Listen dieser Medikamente sind in öffentlich zugänglichen Online-Datenbanken zu finden. Darüber hinaus sind zwei Interventionsmöglichkeiten für Personen mit LQTS bekannt: die Prävention von Arrhythmien und die Beendigung von Arrhythmien. ⓘ
Arrhythmie-Prävention
Die Arrhythmieunterdrückung umfasst den Einsatz von Medikamenten oder chirurgischen Eingriffen, die die zugrunde liegende Ursache der mit LQTS verbundenen Arrhythmien bekämpfen. Da die Ursache der Arrhythmien bei LQTS frühe Nachdepolarisationen (EADs) sind und diese bei adrenerger Stimulation verstärkt auftreten, können Maßnahmen ergriffen werden, um die adrenerge Stimulation bei diesen Personen abzuschwächen. Dazu gehört die Verabreichung von Betarezeptorenblockern, die das Risiko von stressbedingten Arrhythmien verringern. Nadolol, ein starker nicht-selektiver Betablocker, verringert nachweislich das Arrhythmierisiko bei allen drei Hauptgenotypen (LQT1, LQT2 und LQT3). ⓘ
Genotyp und QT-Intervalldauer sind unabhängige Prädiktoren für das Wiederauftreten lebensbedrohlicher Ereignisse während einer Betablockertherapie. Genauer gesagt sind das Vorhandensein eines QTc >500 ms und die Genotypen LQT2 und LQT3 mit der höchsten Inzidenz von Rezidiven verbunden. Bei diesen Patienten kann eine Primärprävention durch den Einsatz implantierbarer Kardioverter-Defibrillatoren in Betracht gezogen werden.
- Kalium-Supplementierung: Wenn der Kaliumgehalt im Blut ansteigt, verkürzt sich das Aktionspotenzial, so dass eine Erhöhung der Kaliumkonzentration das Auftreten von Herzrhythmusstörungen minimieren könnte. Dies sollte bei LQT2 am besten funktionieren, da der hERG-Kanal besonders empfindlich auf die Kaliumkonzentration reagiert, aber die Anwendung ist experimentell und nicht evidenzbasiert.
- Natriumkanalblocker wie Mexiletin wurden zur Vorbeugung von Herzrhythmusstörungen beim Long-QT-Syndrom eingesetzt. Die zwingendste Indikation ist die Behandlung von Patienten, deren langes QT-Syndrom durch defekte Natriumkanäle verursacht wird, die einen anhaltenden späten Strom erzeugen (LQT3). Mexiletin verkürzt jedoch auch das QT-Intervall bei anderen Formen des langen QT-Syndroms, einschließlich LQT1, LQT2 und LQT8. Da die vorherrschende Wirkung von Mexiletin auf den frühen Spitzen-Natriumstrom gerichtet ist, gibt es theoretische Gründe, warum Medikamente, die vorzugsweise den späten Natriumstrom unterdrücken, wie z. B. Ranolazin, wirksamer sein könnten, auch wenn die Beweise, dass dies in der Praxis der Fall ist, begrenzt sind.
- Amputation der zervikalen Sympathikuskette (linke Stilektomie). Diese Therapie ist in der Regel dem durch JLNS verursachten LQTS vorbehalten, kann aber in bestimmten Fällen als Zusatztherapie zu Betablockern eingesetzt werden. In den meisten Fällen spricht die moderne Therapie für eine ICD-Implantation, wenn die Betablockertherapie versagt.
- Bei Patienten, bei denen ein hohes Risiko für lebensbedrohliche Arrhythmien besteht, kann die ICD-Implantation als Präventivmaßnahme in Betracht gezogen werden. ⓘ
Beendigung von Herzrhythmusstörungen
Bei der Arrhythmie-Terminierung geht es darum, eine lebensbedrohliche Arrhythmie zu stoppen, wenn sie bereits aufgetreten ist. Eine wirksame Form der Arrhythmieunterbrechung bei Personen mit LQTS ist die Implantation eines implantierbaren Kardioverter-Defibrillators (ICD). Auch eine externe Defibrillation kann zur Wiederherstellung des Sinusrhythmus eingesetzt werden. ICDs werden häufig bei Patienten eingesetzt, die trotz Betablocker-Therapie Ohnmachtsanfälle erleiden, sowie bei Patienten, die einen Herzstillstand erlitten haben. Wie bereits erwähnt, können ICDs auch bei Patienten eingesetzt werden, bei denen ein hohes Risiko für lebensbedrohliche Herzrhythmusstörungen besteht. ⓘ
Mit besseren Kenntnissen über die genetischen Grundlagen des LQTS werden hoffentlich präzisere Behandlungsmethoden zur Verfügung stehen. ⓘ
Ergebnisse
Der Genotyp und die QT-Intervalldauer sind die stärksten Prädiktoren für das Ergebnis bei Patienten mit LQTS. Sie wurden kombiniert, um einen extern validierten Risiko-Score-Rechner zu erstellen, der das 5-Jahres-Risiko für jeden einzelnen Patienten schätzt und Ärzten helfen kann, Patienten mit dem höchsten Risiko für lebensbedrohliche Arrhythmien zu identifizieren. ⓘ
Bei Menschen, die aufgrund von LQTS einen Herzstillstand oder eine Ohnmacht erleiden und die nicht behandelt werden, liegt das Risiko, innerhalb von 15 Jahren zu sterben, bei etwa 50 %. Bei sorgfältiger Behandlung sinkt dieses Risiko auf weniger als 1 % innerhalb von 20 Jahren. Bei Personen, die vor ihrem 18. Lebensjahr Symptome zeigen, ist die Wahrscheinlichkeit eines Herzstillstands größer. ⓘ
Epidemiologie
Schätzungen zufolge ist einer von 2.500 bis 7.000 Menschen von einem vererbten LQTS betroffen. ⓘ
Vorgeschichte
Der erste dokumentierte Fall von LQTS wurde 1856 von Meissner in Leipzig beschrieben, als ein taubes Mädchen starb, nachdem ihr Lehrer es angeschrien hatte. Kurz nachdem sie benachrichtigt wurden, berichteten die Eltern des Mädchens, dass ihr älterer Bruder, der ebenfalls taub war, zuvor nach einem schrecklichen Schreck gestorben war. Dies war mehrere Jahrzehnte vor der Erfindung des EKG, ist aber wahrscheinlich der erste beschriebene Fall des Jervell- und Lange-Nielsen-Syndroms. 1957 wurde der erste Fall, der durch ein EKG dokumentiert wurde, von Anton Jervell und Fred Lange-Nielsen in Tønsberg, Norwegen, beschrieben. Der italienische Kinderarzt Cesarino Romano (1963) und der irische Kinderarzt Owen Conor Ward (1964) beschrieben getrennt voneinander die häufigere Variante von LQTS mit normalem Gehör, die später Romano-Ward-Syndrom genannt wurde. Durch die Einrichtung des Internationalen Registers für das Long-QT-Syndrom im Jahr 1979 konnten zahlreiche Stammbäume umfassend ausgewertet werden. Dies half bei der Entdeckung vieler der zahlreichen beteiligten Gene. Transgene Tiermodelle des LQTS trugen dazu bei, die Rolle verschiedener beteiligter Gene und Hormone zu definieren, und vor kurzem wurden experimentelle pharmakologische Therapien zur Normalisierung der abnormalen Repolarisierung bei Tieren veröffentlicht. ⓘ
Ursache und Formen
Krankheitszeichen
Die Verlängerung der QT-Zeit selbst ist normalerweise nicht spürbar, mehr als die Hälfte der Patienten mit einem Long-QT-Syndrom leiden an keinerlei Beschwerden. Wenn Symptome auftreten, so sind sie bereits durch potentiell lebensbedrohliche (sog. maligne) Herzrhythmusstörungen verursacht, die schon als ein schwerwiegendes Krankheitszeichen gewertet werden müssen. Dabei handelt es sich um anhaltende (>30 Sekunden) oder nicht-anhaltende (≤ 30 Sekunden) ventrikuläre Tachykardien meist vom Typ der Torsade-de-pointes-Tachykardie. Je nach Dauer und Pulsfrequenz der Tachykardie, Körperposition und allgemeiner Verfassung können diese Tachykardien gar nicht bemerkt werden, zu Schwindel oder plötzlicher Bewusstlosigkeit (Synkope) oder gar zum Herzstillstand und damit zum plötzlichen Herztod führen. ⓘ
Da die Tachykardien urplötzlich und bevorzugt bei körperlicher Belastung oder in Stresssituationen auftreten, werden auch die Symptome häufig unerwartet und aus völligem Wohlbefinden in den beschriebenen Situationen bemerkt. ⓘ
Diagnostik
Der wegweisende und namensgebende Befund des Long-QT-Syndroms ist die Verlängerung des QT-Intervalls im Ruhe-EKG. ⓘ
Die in Millisekunden (ms) gemessene QT-Zeit ist für sich genommen wenig aussagekräftig, da sie beim Menschen u. a. von der Herzfrequenz, dem Alter und dem Geschlecht abhängig ist. Um eine abnormal lange QT-Zeit zuverlässig erkennen und verschiedene QT-Zeiten im Verlauf miteinander sinnvoll vergleichen zu können, ist eine rechnerische Korrektur der gemessenen QT-Zeit erforderlich. Am häufigsten wird die Bazett-Formel genutzt:
,
wobei die QT-Dauer in ms und der RR-Abstand in Sekunden anzugeben ist. Bei Herzfrequenzen über 100 pro Minute führt die Korrekturformel nach Bazett zu einer Überkorrektur, bei Herzfrequenzen unter 60 pro Minute zu einer Unterkorrektur. Bei Frequenzen über 80 pro Minute führt die in den letzten Jahren zunehmend häufiger angewandte Formel nach Fridericia zu exakteren Ergebnissen:
,
wobei ebenfalls die QT-Dauer in ms und der RR-Abstand in Sekunden anzugeben ist. ⓘ
Für wissenschaftliche Zwecke ist eine genauere Korrektur der QT-Zeit erforderlich, die auch das Geschlecht und das Alter des Patienten berücksichtigt. Dies geschieht nach folgenden Formeln (nach Pfeufer u. a. 2005):
- Für Männer:
- Für Frauen:
ⓘ
Nachteil der genannten Korrekturformeln ist der erforderliche Rechenschritt, der einen Rechner oder entsprechende Nomogramme erforderlich macht. Aus diesem Grund verwenden viele Ärzte spezielle „EKG-Lineale“, die zur ermittelten Herzfrequenz jeweils die normale QT-Zeit angeben. ⓘ
Als oberer Grenzwert gilt eine QTc von 440 ms, ab 500 ms ist von einem hohen Risiko auszugehen. Für die Bewertung der „gemessenen“ QT-Zeit und damit auch der berechneten QTc ist das Wissen um die Fehlerquellen der Methode wichtig. Besonders bei niedrigen Amplituden der T-Wellen und gelegentlich nachfolgenden U-Wellen ist das Ende der T-Welle und damit der Endpunkt der Messung nicht exakt definiert und unterliegt der subjektiven Wahrnehmung des Untersuchers. Darüber hinaus unterscheiden sich die aus einer, drei oder zwölf gleichzeitig abgeleiteten EKG-Linien ermittelten QT-Intervalle signifikant, so dass die Messmethode bei Vergleichen berücksichtigt werden sollte. ⓘ
Abschätzung der QT-Zeit aus dem Ruhe-EKG
Eine verlängerte QT-Zeit kann relativ einfach im Ruhe-EKG erkannt werden, wenn man den RR-Abstand zweier benachbarter QRS-Zacken betrachtet. Ist die QT-Zeit länger als der halbe RR-Abstand, dann ist die QT-Zeit auf jeden Fall verlängert. ⓘ
Score zur Abschätzung der Wahrscheinlichkeit eines LQT-Syndroms
| EKG-Zeichen ohne auslösendes Medikament oder andere bekannte Ursache in der Anamnese ⓘ | |
| QTc ≥ 480 ms (berechnet nach Bazzet-Formel) | 3 Pkt. |
| QTc 460–479 ms | 2 Pkt. |
| QTc 450–459 (Männer) | 1 Pkt. |
| QTc > 480 ms (4 min n. Belastung) | 1 Pkt. |
| Torsade de pointes ohne nachfolgende Synkope | 2 Pkt. |
| T-Wellen-Alternanz | 1 Pkt. |
| T-Wellen-Kerbungen in 3 Ableitungen | 1 Pkt. |
| Niedrige Herzfrequenz (unterhalb der 2. alterskorrigierten Percentile) | 0,5 Pkt. |
| Eigenanamnese | |
| Synkope, stressinduziert | 2 Pkt. |
| Synkope, andere Ursache | 1 Pkt. |
| Innenohrschwerhörigkeit, kongenital | 0,5 Pkt. |
| Familienanamnese | |
| LQTS bei Familienmitglied | 1 Pkt. |
| Unerklärter plötzlicher Herztod <30 LJ | 0,5 Pkt. |
Bei einem Score von 1 besteht eine geringe, bei einem Score bis 3 eine mittlere, ab 4 eine hohe Wahrscheinlichkeit für das Vorliegen eines Long-QT-Syndroms. ⓘ
Therapie
Da die Häufigkeit schwerwiegender Herzrhythmusstörungen unter einer Behandlung mit Betarezeptorenblockern eindeutig abnimmt, gehören sie zur Standardtherapie bei kongenitalem Long-QT-Syndrom. Patienten, bei denen trotzdem noch Synkopen auftreten und solche nach einem überlebten Herzstillstand sollten vorsorglich einen implantierbaren Defibrillator (ICD) erhalten. Möglicherweise profitieren Patienten mit einem besonders hohen Risiko bereits vor dem Auftreten von Symptomen von der Implantation eines ICD. ⓘ
Bei einem durch Medikamente verursachten Long-QT-Syndrom steht das unverzügliche Absetzen der Substanz im Vordergrund. Betablocker gelten – im Gegensatz zur kongenitalen Form – hier als kontraindiziert, da sie eine Bradykardie hervorrufen oder verstärken und so das Risiko bedrohlicher Rhythmusstörungen eher erhöhen. Bewährt hat sich neben dem Ausgleich einer evtl. Hypokaliämie die Zufuhr von Magnesium, bei Bradykardie wird eine Steigerung der Herzfrequenz durch Medikamente (z. B. Orciprenalin) oder eine vorübergehende Schrittmacherstimulation empfohlen. ⓘ
Körperliche Belastung ist für Patienten mit einem Long-QT-Syndrom problematisch. Besonders bei abruptem Belastungsbeginn oder -ende, Kälte, Druckschwankungen und lauten Geräuschen besteht ein erhöhtes Risiko für bedrohliche Rhythmusstörungen. Aus diesem Grund wird von Sportarten wie Basketball, Eishockey, Bodybuilding, Wellenreiten/Surfen, Schwimmen, Tauchen und Schnorcheln grundsätzlich abgeraten, ebenso vom wettkampfmäßigen Laufen, Gewichtheben, Motorradfahren, Squash- und Tennisspielen. Regelmäßige, moderate, körperliche Aktivität wie Joggen, Walking und Skaten hingegen wird befürwortet, und auch gegen Bowlen und Gewichtheben ist wenig einzuwenden, wenn es nicht leistungsorientiert erfolgt. Kinder werden oft vom Schulsport befreit, da dieser unter dem Aspekt der Benotung (Gefahr einer Überforderungssituation) steht, individuell kann aber über die Ausübung von anderen Freizeitsportarten entschieden werden. ⓘ


![{\displaystyle QTc={QT{\textrm {-Zeit}} \over {\sqrt[{3}]{RR{\textrm {-Abstand}}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d740b275343a06d395acc7488ceb523657fccc7c)
![{\displaystyle QTc{\textrm {[ms]}}=QT{\textrm {[ms]}}-(0{,}152\times {(RR{\textrm {[ms]}}-1000)})-(0{,}318\times {(Alter{\textrm {[a]}}-60)})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d809d6aad08f2912b021afc26e5a0753a2338797)
![{\displaystyle QTc{\textrm {[ms]}}=QT{\textrm {[ms]}}-(0{,}154\times {(RR{\textrm {[ms]}}-1000)})-(0{,}207\times {(Alter{\textrm {[a]}}-60)})-4{,}58}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b3629ad8b9991082bbe0513c12b52b0b8dd9ff19)