Bernsteinsäure

| |

| |

| |
| Bezeichnungen | |
|---|---|
| Bevorzugte IUPAC-Bezeichnung
Butandisäure | |
| Andere Bezeichnungen
Bernsteinsäure
1,4-Butandisäure | |
| Bezeichner | |
3D-Modell (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Arzneimittelbank | |
IUPHAR/BPS
|
|
PubChem CID
|
|
| UNII | |
InChI
| |
SMILES
| |
| Eigenschaften | |
Chemische Formel
|
C4H6O4 |
| Molekulare Masse | 118,088 g-mol-1 |
| Dichte | 1,56 g/cm3 |
| Schmelzpunkt | 184-190 °C (363-374 °F; 457-463 K) |
| Siedepunkt | 235 °C (455 °F; 508 K) |
Löslichkeit in Wasser
|
58 g/L (20 °C) oder 100 mg/mL |
| Löslichkeit in Methanol | 158 mg/ml |
| Löslichkeit in Ethanol | 54 mg/ml |
| Löslichkeit in Aceton | 27 mg/ml |
| Löslichkeit in Glycerin | 50 mg/ml |
| Löslichkeit in Ether | 8,8 mg/ml |
| Acidität (pKa) | pKa1 = 4,2 pKa2 = 5,6 |
Magnetische Suszeptibilität (χ)
|
-57,9-10-6 cm3/mol |
| Gefahren | |
| Flammpunkt | 206 °C (403 °F; 479 K) |
| Verwandte Verbindungen | |
Andere Anionen
|
Natriumsuccinat |
Verwandte Carbonsäuren
|
Propionsäure Malonsäure Buttersäure Äpfelsäure Weinsäure Fumarsäure Valeriansäure Glutarsäure |
Sofern nicht anders angegeben, beziehen sich die Daten auf Stoffe im Standardzustand (bei 25 °C [77 °F], 100 kPa).
Infobox Referenzen
| |
Bernsteinsäure (/səkˈsɪnɪk/) ist eine Dicarbonsäure mit der chemischen Formel (CH2)2(CO2H)2. Der Name leitet sich vom lateinischen succinum ab, was Bernstein bedeutet. In lebenden Organismen nimmt Bernsteinsäure die Form eines Anions, des Succinats, an, das mehrere biologische Funktionen hat: als Stoffwechselzwischenprodukt, das durch das Enzym Succinat-Dehydrogenase im Komplex 2 der Elektronentransportkette in Fumarat umgewandelt wird, das an der Herstellung von ATP beteiligt ist, und als Signalmolekül, das den zellulären Stoffwechselzustand wiedergibt. Es wird als Lebensmittelzusatzstoff E363 vermarktet. Succinat wird in den Mitochondrien über den Tricarbonsäurezyklus (TCA) gebildet. Succinat kann die mitochondriale Matrix verlassen und sowohl im Zytoplasma als auch im extrazellulären Raum wirken, indem es die Genexpressionsmuster verändert, die epigenetische Landschaft moduliert oder eine hormonähnliche Signalwirkung entfaltet. Somit ist Succinat ein Bindeglied zwischen dem zellulären Stoffwechsel, insbesondere der ATP-Bildung, und der Regulierung der zellulären Funktionen. Eine Dysregulation der Succinatsynthese und damit der ATP-Synthese tritt bei einigen genetisch bedingten mitochondrialen Erkrankungen wie dem Leigh-Syndrom und dem Melas-Syndrom auf, und ein Abbau kann zu pathologischen Zuständen wie maligner Transformation, Entzündungen und Gewebeschäden führen. ⓘ
| Strukturformel ⓘ | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bernsteinsäure | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H6O4 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser kristalliner Feststoff | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 118,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,56 g·cm−3 | ||||||||||||||||||
| Schmelzpunkt |
185–190 °C | ||||||||||||||||||
| Siedepunkt |
235 °C | ||||||||||||||||||
| pKS-Wert |
| ||||||||||||||||||
| Löslichkeit |
löslich in Wasser (58 g·l−1 bei 20 °C) | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−940,5 kJ/mol | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Bernsteinsäure, auch Succinylsäure oder Butandisäure, E 363, ist eine farblose, kristalline aliphatische Dicarbonsäure. Die Kristalle sind in siedendem Wasser gut löslich. ⓘ
Physikalische Eigenschaften
Bernsteinsäure ist ein weißer, geruchloser Feststoff mit stark saurem Geschmack. In wässriger Lösung ionisiert die Bernsteinsäure leicht und bildet ihre konjugierte Base, das Succinat (/ˈsʌksɪneɪt/). Als diprotische Säure durchläuft die Bernsteinsäure zwei aufeinander folgende Deprotonierungsreaktionen:
- (CH2)2(CO2H)2 → (CH2)2(CO2H)(CO2)- + H+
- (CH2)2(CO2H)(CO2)- → (CH2)2(CO2)22- + H+
Der pKa dieser Prozesse beträgt 4,3 bzw. 5,6. Beide Anionen sind farblos und können als Salze isoliert werden, z. B. Na(CH2)2(CO2H)(CO2) und Na2(CH2)2(CO2)2. In lebenden Organismen kommt vor allem Succinat, nicht Bernsteinsäure, vor. ⓘ
Als Radikalgruppe wird sie als Succinylgruppe (/ˈsʌksɪnəl/) bezeichnet. ⓘ
Wie die meisten einfachen Mono- und Dicarbonsäuren ist sie nicht schädlich, kann aber Haut und Augen reizen. ⓘ
Technisch
Technisch sind verschiedene Synthesewege zur Produktion von Bernsteinsäure bekannt. Die Herstellung erfolgt in der Regel über eine katalytische Hydrierung der Maleinsäure, Maleinsäureanhydrid oder Fumarsäure, wobei verschiedene Katalysatoren eingesetzt werden können (Ni, Cu, NiO, CuZnCr, Pd-Al2O3, Pd-CaCO3). Über diesen Syntheseweg werden pro Jahr 20.000 bis 30.000 Tonnen Bernsteinsäure hergestellt. ⓘ
Außerdem ist die Oxidation von 1,4-Butandiol (BDO) möglich, wobei verschiedene technische Wege existieren. Auch die Hydrocarboxylierung von Acetylenglycol, katalysiert über RhCl3-Pentachlorthiophenol, Acetylen, Acrylsäure, 1,4-Dioxan und Propiolacton ist möglich. ⓘ
Gentechnisch veränderte Escherichia coli und Saccharomyces cerevisiae werden für die kommerzielle Produktion durch Fermentation von Glukose vorgeschlagen. ⓘ
Chemische Reaktionen
Bernsteinsäure kann zu Fumarsäure dehydriert oder in Diester, wie Diethylsuccinat (CH2CO2CH2CH3)2, umgewandelt werden. Dieser Diethylester ist ein Substrat für die Stobbe-Kondensation. Die Dehydratisierung von Bernsteinsäure ergibt Bernsteinsäureanhydrid. Succinat kann zur Herstellung von 1,4-Butandiol, Maleinsäureanhydrid, Succinimid, 2-Pyrrolidinon und Tetrahydrofuran verwendet werden. ⓘ
Anwendungen
Bernsteinsäure ist in der EU als Lebensmittelzusatzstoff der Nummer E 363 zugelassen und dient aufgrund des mild sauren und zugleich leicht salzigen Geschmacks als Geschmacksverstärker für Desserts, Trockensuppen und Getränkepulver. Als Kochsalzersatz in Diätkost werden verschiedene Salze der Bernsteinsäure genutzt (Fe, Mg, Ca, K). Aufgrund der körpereigenen Produktion und Verstoffwechslung von Bernsteinsäure wird die Verwendung von Bernsteinsäure als Lebensmittelzusatzstoff als unbedenklich angesehen. ⓘ
Während der alkoholischen Gärung sowie beim späteren Ausbau des Weins in Gebinden wie dem Holzfass oder dem Edelstahlbehälter entstehen neben den zentralen Säuren des Weins (Weinsäure, Äpfelsäure und Citronensäure) auch Bernsteinsäure sowie Essigsäure, Buttersäure und Milchsäure. Bernsteinsäure entsteht dabei vor allem bei der Kohlensäuremaischung und schmeckt leicht bitter und salzig, die Veresterung zu Bernsteinsäuremonomethylester bringt eine mild-fruchtige Komponente in den Wein. ⓘ
Im Jahr 2004 wurde Succinat vom US-Energieministerium in die Liste der 12 wichtigsten Plattformchemikalien aus Biomasse aufgenommen. ⓘ
Vorprodukt für Polymere, Harze und Lösungsmittel
Bernsteinsäure ist ein Vorprodukt für einige Polyester und ein Bestandteil einiger Alkydharze. 1,4-Butandiol (BDO) kann mit Bernsteinsäure als Vorprodukt synthetisiert werden. Die Automobil- und Elektronikindustrie ist bei der Herstellung von Steckern, Isolatoren, Radkappen, Schaltknäufen und Verstärkungsträgern stark auf BDO angewiesen. Bernsteinsäure dient auch als Basis für bestimmte biologisch abbaubare Polymere, die für Anwendungen im Bereich des Tissue Engineering von Interesse sind. ⓘ
Die Acylierung mit Bernsteinsäure wird als Succinierung bezeichnet. Eine Übersuccinierung liegt vor, wenn mehr als ein Succinat an ein Substrat gebunden wird. ⓘ
Lebensmittel und Nahrungsergänzungsmittel
Als Lebensmittelzusatzstoff und Nahrungsergänzungsmittel wird Bernsteinsäure von der U.S. Food and Drug Administration allgemein als sicher anerkannt. Bernsteinsäure wird hauptsächlich als Säureregulator in der Lebensmittel- und Getränkeindustrie verwendet. Sie ist auch als Aromastoff erhältlich, der eine leicht saure und adstringierende Komponente zum Umami-Geschmack beiträgt. Als Hilfsstoff in pharmazeutischen Produkten wird es auch zur Kontrolle des Säuregehalts oder als Gegenion verwendet. Zu den Arzneimitteln, die Succinat enthalten, gehören Metoprololsuccinat, Sumatriptansuccinat, Doxylaminsuccinat oder Solifenacinsuccinat. ⓘ
Biosynthese
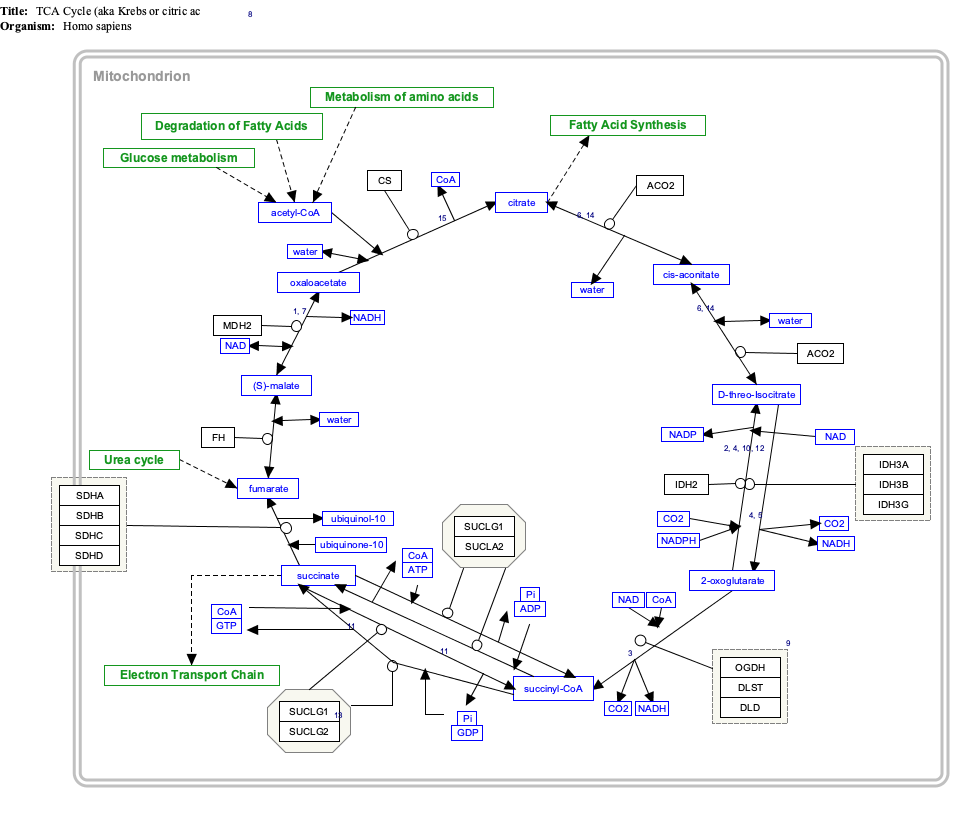
Tricarbonsäure-Zyklus (TCA)
Succinat ist ein wichtiges Zwischenprodukt im Tricarbonsäurezyklus, einem primären Stoffwechselweg zur Erzeugung chemischer Energie in Gegenwart von O2. Succinat wird durch das Enzym Succinyl-CoA-Synthetase in einem GTP/ATP-erzeugenden Schritt aus Succinyl-CoA erzeugt: Succinyl-CoA + NDP + Pi → Succinat + CoA + NTP ⓘ
Katalysiert durch das Enzym Succinat-Dehydrogenase (SDH), wird Succinat anschließend zu Fumarat oxidiert: Succinat + FAD → Fumarat + FADH2 ⓘ
SDH ist auch an der mitochondrialen Elektronentransportkette beteiligt, wo es als Atmungskomplex II bekannt ist. Bei diesem Enzymkomplex handelt es sich um ein membrangebundenes Lipoprotein mit vier Untereinheiten, das die Oxidation von Succinat über die Elektronen-Zwischenträger FAD und drei 2Fe-2S-Cluster mit der Reduktion von Ubichinon verbindet. Succinat dient somit als direkter Elektronendonor für die Elektronentransportkette und wird selbst in Fumarat umgewandelt. ⓘ
Klicken Sie unten auf die Gene, Proteine und Metaboliten, um zu den entsprechenden Artikeln zu gelangen. ⓘ
Reduktiver Zweig des TCA-Zyklus
Succinat kann alternativ durch die umgekehrte Aktivität von SDH gebildet werden. Unter anaeroben Bedingungen betreiben bestimmte Bakterien wie A. succinogenes, A. succiniciproducens und M. succiniciproducens den TCA-Zyklus in umgekehrter Richtung und wandeln Glukose über die Zwischenprodukte Oxalacetat, Malat und Fumarat in Succinat um. Dieser Weg wird im Metabolic Engineering genutzt, um Succinat für den menschlichen Gebrauch zu erzeugen. Außerdem verleiht die bei der Fermentation von Zucker entstehende Bernsteinsäure fermentierten Alkoholen eine Kombination aus Salzigkeit, Bitterkeit und Säure. ⓘ
Die Anhäufung von Fumarat kann die SDH-Aktivität umkehren und so die Succinatbildung verstärken. Unter pathologischen und physiologischen Bedingungen kann das Malat-Aspartat-Shuttle oder das Purinnukleotid-Shuttle das mitochondriale Fumarat erhöhen, das dann leicht in Succinat umgewandelt wird. ⓘ
Glyoxylat-Zyklus
Succinat ist auch ein Produkt des Glyoxylatzyklus, der zwei Acetyleinheiten mit zwei Kohlenstoffatomen in das Succinat mit vier Kohlenstoffatomen umwandelt. Der Glyoxylatzyklus wird von vielen Bakterien, Pflanzen und Pilzen genutzt und ermöglicht es diesen Organismen, von Acetat oder Acetyl-CoA-haltigen Verbindungen zu leben. Der Stoffwechselweg umgeht die Decarboxylierungsschritte des TCA-Zyklus durch das Enzym Isocitratlyase, das Isocitrat in Succinat und Glyoxylat spaltet. Das erzeugte Succinat steht dann entweder für die Energieerzeugung oder die Biosynthese zur Verfügung. ⓘ
GABA-Shunt
Succinat ist der Wiedereintritt für den GABA-Shunt in den TCA-Zyklus, einen geschlossenen Kreislauf, der GABA synthetisiert und recycelt. Der GABA-Shunt dient als alternativer Weg zur Umwandlung von Alpha-Ketoglutarat in Succinat, wobei das TCA-Zyklus-Zwischenprodukt Succinyl-CoA umgangen wird und stattdessen das Zwischenprodukt GABA entsteht. Die Transaminierung und anschließende Decarboxylierung von Alpha-Ketoglutarat führt zur Bildung von GABA. GABA wird dann von der GABA-Transaminase zu Bernsteinsemialdehyd metabolisiert. Schließlich wird Succinsäuresemialdehyd durch Succinsäuresemialdehyd-Dehydrogenase (SSADH) zu Succinat oxidiert, das wieder in den TCA-Zyklus gelangt und den Kreislauf schließt. Die für den GABA-Shunt erforderlichen Enzyme werden in Neuronen, Gliazellen, Makrophagen und Pankreaszellen exprimiert. ⓘ

Zellulärer Stoffwechsel
Metabolisches Zwischenprodukt
Succinat wird in den Mitochondrien produziert und konzentriert, und seine wichtigste biologische Funktion ist die eines Stoffwechselzwischenprodukts. Alle Stoffwechselwege, die mit dem TCA-Zyklus verknüpft sind, einschließlich des Stoffwechsels von Kohlenhydraten, Aminosäuren, Fettsäuren, Cholesterin und Häm, sind auf die vorübergehende Bildung von Succinat angewiesen. Das Zwischenprodukt wird über mehrere Wege für biosynthetische Prozesse verfügbar gemacht, darunter der reduktive Zweig des TCA-Zyklus oder der Glyoxylatzyklus, die die Nettoproduktion von Succinat vorantreiben können. Bei Nagetieren liegen die mitochondrialen Konzentrationen bei etwa 0,5 mM, während die Plasmakonzentration nur 2-20 μM beträgt. ⓘ
ROS-Produktion
Die Aktivität der Succinat-Dehydrogenase (SDH), die Succinat in Fumarat umwandelt, ist an der mitochondrialen Produktion reaktiver Sauerstoffspezies (ROS) beteiligt, indem sie den Elektronenfluss in der Elektronentransportkette steuert. Unter den Bedingungen einer Succinat-Akkumulation kann die schnelle Oxidation von Succinat durch SDH den umgekehrten Elektronentransport (RET) antreiben. Wenn der mitochondriale Atmungskomplex III nicht in der Lage ist, die von der Succinat-Oxidation gelieferten überschüssigen Elektronen aufzunehmen, zwingt er die Elektronen, entlang der Elektronentransportkette rückwärts zu fließen. RET am mitochondrialen Atmungskomplex 1, dem Komplex, der normalerweise vor SDH in der Elektronentransportkette steht, führt zur ROS-Produktion und schafft eine pro-oxidative Mikroumgebung. ⓘ
Zusätzliche biologische Funktionen
Zusätzlich zu seinen metabolischen Funktionen dient Succinat als intrazelluläres und extrazelluläres Signalmolekül. Extra-mitochondriales Succinat verändert die epigenetische Landschaft durch Hemmung der Familie der 2-Oxogluterat-abhängigen Dioxygenasen. Alternativ kann Succinat in das extrazelluläre Milieu und in den Blutstrom freigesetzt werden, wo es von Zielrezeptoren erkannt wird. Im Allgemeinen ist für die Freisetzung aus den Mitochondrien eine Überproduktion oder ein Unterverbrauch von Succinat erforderlich, die durch eine verringerte, umgekehrte oder völlig fehlende Aktivität von SDH oder durch andere Veränderungen des Stoffwechsels verursacht werden. Mutationen in SDH, Hypoxie oder ein energetisches Ungleichgewicht sind alle mit einer Veränderung des Flusses durch den TCA-Zyklus und einer Succinat-Akkumulation verbunden. Beim Verlassen der Mitochondrien dient Succinat als Signal für den Stoffwechselzustand und teilt den benachbarten Zellen mit, wie stoffwechselaktiv die ursprüngliche Zellpopulation ist. Somit stellt Succinat eine Verbindung zwischen einer Störung des TCA-Zyklus oder metabolischen Veränderungen, der Zell-Zell-Kommunikation und den Reaktionen auf oxidativen Stress her. ⓘ
Transporter
Succinat benötigt spezifische Transporter, um sowohl die Mitochondrien- als auch die Plasmamembran zu durchqueren. Succinat verlässt die mitochondriale Matrix und passiert die innere mitochondriale Membran über Dicarboxylat-Transporter, in erster Linie SLC25A10, einen Succinat-Fumarat/Malat-Transporter. Im zweiten Schritt des mitochondrialen Exports durchquert Succinat die äußere Mitochondrienmembran durch Porine, unspezifische Proteinkanäle, die die Diffusion von Molekülen mit weniger als 1,5 kDa erleichtern. Der Transport durch die Plasmamembran ist wahrscheinlich gewebespezifisch. Ein wichtiger Transporterkandidat ist INDY (I'm not dead yet), ein natriumunabhängiger Anionenaustauscher, der sowohl Dicarboxylat als auch Citrat in den Blutkreislauf transportiert. ⓘ

Extrazelluläre Signalübertragung
Extrazelluläres Succinat kann als Signalmolekül mit hormonähnlicher Funktion wirken und auf eine Vielzahl von Geweben wie Blutzellen, Fettgewebe, Immunzellen, die Leber, das Herz, die Netzhaut und vor allem die Niere abzielen. Der G-Protein-gekoppelte Rezeptor GPR91, auch bekannt als SUCNR1, dient als Detektor für extrazelluläres Succinat. Arg99, His103, Arg252 und Arg281 in der Nähe der Mitte des Rezeptors bilden eine positiv geladene Bindungsstelle für Succinat. Die Ligandenspezifität von GPR91 wurde anhand von 800 pharmakologisch aktiven Verbindungen und 200 Carbonsäure- und Succinat-ähnlichen Verbindungen, die alle eine deutlich geringere Bindungsaffinität aufwiesen, eingehend getestet. Insgesamt liegt die EC50 für Succinat-GPR91 im Bereich von 20-50 uM. Je nach Zelltyp kann GPR91 mit mehreren G-Proteinen interagieren, darunter Gs, Gi und Gq, und eine Vielzahl von Signalwirkungen ermöglichen. ⓘ
Wirkung auf Adipozyten
In Adipozyten hemmt die Succinat-aktivierte GPR91-Signalkaskade die Lipolyse. ⓘ
Wirkung auf die Leber und die Netzhaut
Die Succinat-Signalisierung erfolgt häufig als Reaktion auf hypoxische Bedingungen. In der Leber dient Succinat als parakrines Signal, das von anoxischen Hepatozyten freigesetzt wird und über GPR91 Stellat-Zellen ansteuert. Dies führt zu einer Aktivierung der Stellatzellen und zur Fibrogenese. Daher wird angenommen, dass Succinat eine Rolle bei der Leberhomöostase spielt. In der Netzhaut reichert sich Succinat als Reaktion auf ischämische Bedingungen in den retinalen Ganglienzellen an. Die autokrine Succinat-Signalisierung fördert die retinale Neovaskularisierung, indem sie die Aktivierung angiogener Faktoren wie den endothelialen Wachstumsfaktor (VEGF) auslöst. ⓘ
Wirkung auf das Herz
Extrazelluläres Succinat reguliert die Lebensfähigkeit von Kardiomyozyten durch GPR91-Aktivierung; eine langfristige Succinat-Exposition führt zu einer pathologischen Hypertrophie der Kardiomyozyten. Die Stimulation von GPR91 löst mindestens zwei Signalwege im Herzen aus: einen MEK1/2- und ERK1/2-Weg, der die hypertrophe Genexpression aktiviert, und einen Phospholipase-C-Weg, der das Muster der Ca2+-Aufnahme und -Verteilung verändert und die CaM-abhängige hypertrophe Genaktivierung auslöst. ⓘ
Wirkung auf Immunzellen
SUCNR1 wird in hohem Maße auf unreifen dendritischen Zellen exprimiert, wo die Succinatbindung die Chemotaxis stimuliert. Darüber hinaus steigert SUCNR1 in Synergie mit Toll-like-Rezeptoren die Produktion von proinflammatorischen Zytokinen wie TNF alpha und Interleukin-1beta. Succinat kann die adaptive Immunität verstärken, indem es die Aktivität von Antigen-präsentierenden Zellen auslöst, die ihrerseits T-Zellen aktivieren. ⓘ
Wirkung auf Blutplättchen
SUCNR1 ist einer der am stärksten exprimierten G-Protein-gekoppelten Rezeptoren auf menschlichen Thrombozyten, der in ähnlichem Maße wie P2Y12 vorhanden ist, obwohl die Rolle der Succinat-Signalisierung bei der Thrombozytenaggregation umstritten ist. In mehreren Studien wurde eine Succinat-induzierte Aggregation nachgewiesen, aber die Wirkung ist interindividuell sehr unterschiedlich. ⓘ
Wirkung auf die Nieren
Succinat wirkt als Modulator des Blutdrucks, indem es die Reninfreisetzung in den Zellen der Macula densa und des juxtaglomerulären Apparats über GPR91 stimuliert. Therapien, die auf Succinat abzielen, um das kardiovaskuläre Risiko und den Bluthochdruck zu senken, werden derzeit untersucht. ⓘ
Intrazelluläre Signalübertragung

Die Anhäufung von Fumarat oder Succinat verringert die Aktivität von 2-Oxoglutarat-abhängigen Dioxygenasen, einschließlich Histon- und DNA-Demethylasen, Prolylhydroxylasen und Kollagen-Prolyl-4-Hydroxylasen, durch kompetitive Hemmung. 2-Oxoglutarat-abhängige Dioxygenasen benötigen einen Eisen-Cofaktor zur Katalyse von Hydroxylierungen, Entsättigungen und Ringschlüssen. Gleichzeitig mit der Oxidation des Substrats wandeln sie 2-Oxoglutarat, auch bekannt als alpha-Ketoglutarat, in Succinat und CO2 um. 2-Oxoglutarat-abhängige Dioxygenasen binden Substrate in einer sequentiellen, geordneten Weise. Zunächst koordiniert 2-Oxoglutarat mit einem Fe(II)-Ion, das an eine konservierte 2-Histidinyl-1-Aspartyl/Glutamyl-Triade von Resten im Enzymzentrum gebunden ist. Anschließend gelangt das primäre Substrat in die Bindungstasche und schließlich bindet sich der Sauerstoff an den Enzym-Substrat-Komplex. Bei der oxidativen Decarboxylierung entsteht dann ein Ferryl-Zwischenprodukt, das mit Succinat koordiniert ist und zur Oxidation des gebundenen primären Substrats dient. Succinat kann den enzymatischen Prozess stören, indem es sich zuerst an das Fe(II)-Zentrum anlagert und so die Bindung von 2-Oxoglutarat verhindert. So kann eine erhöhte Succinat-Belastung über eine enzymatische Hemmung zu Veränderungen der Aktivität der Transkriptionsfaktoren und genomweiten Veränderungen der Histon- und DNA-Methylierung führen. ⓘ
Epigenetische Auswirkungen
Succinat und Fumarat hemmen die TET-Familie (Ten-Eleven-Translokation) von 5-Methylcytosin-DNA-modifizierenden Enzymen und die JmjC-Domäne enthaltende Histon-Lysin-Demethylase (KDM). Pathologisch erhöhte Succinatspiegel führen zu Hypermethylierung, epigenetischem Silencing und Veränderungen in der neuroendokrinen Differenzierung, die möglicherweise die Krebsbildung fördern. ⓘ
Genregulierung
Die Succinathemmung von Prolylhydroxylasen (PHDs) stabilisiert den Transkriptionsfaktor Hypoxie-induzierbarer Faktor (HIF)1α. PHDs hydroxylieren Prolin parallel zur oxidativen Decarboxylierung von 2-Oxyglutarat zu Succinat und CO2. Beim Menschen regulieren drei HIF-Prolyl-4-Hydroxylasen die Stabilität der HIFs. Die Hydroxylierung von zwei Prolylresten in HIF1α erleichtert die Ubiquitinbindung und markiert es damit für die proteolytische Zerstörung durch den Ubiquitin/Proteasom-Weg. Da PHDs einen absoluten Bedarf an molekularem Sauerstoff haben, wird dieser Prozess bei Hypoxie unterdrückt, wodurch HIF1α der Zerstörung entgehen kann. Hohe Succinatkonzentrationen ahmen den Hypoxiezustand nach, indem sie die PHDs unterdrücken, wodurch HIF1α stabilisiert und die Transkription von HIF1-abhängigen Genen auch unter normalen Sauerstoffbedingungen induziert wird. Es ist bekannt, dass HIF1 die Transkription von mehr als 60 Genen induziert, darunter Gene, die an der Vaskularisierung und Angiogenese, dem Energiestoffwechsel, dem Zellüberleben und der Tumorinvasion beteiligt sind. ⓘ
Rolle für die menschliche Gesundheit
Entzündungen
Stoffwechselsignale, an denen Succinat beteiligt ist, können über die Stabilisierung von HIF1-alpha oder die GPR91-Signalgebung in angeborenen Immunzellen an Entzündungen beteiligt sein. Es hat sich gezeigt, dass die Succinatakkumulation über diese Mechanismen die Produktion von Entzündungszytokinen reguliert. Bei dendritischen Zellen wirkt Succinat als Chemoattraktor und steigert ihre Antigenpräsentationsfunktion durch rezeptorstimulierte Zytokinproduktion. In entzündlichen Makrophagen führt die Succinat-induzierte Stabilität von HIF1 zu einer verstärkten Transkription von HIF1-abhängigen Genen, einschließlich des pro-inflammatorischen Zytokins Interleukin-1β. Andere entzündliche Zytokine, die von aktivierten Makrophagen produziert werden, wie der Tumornekrosefaktor oder Interleukin 6, werden von Succinat und HIF1 nicht direkt beeinflusst. Der Mechanismus, durch den sich Succinat in Immunzellen anreichert, ist nicht vollständig geklärt. Die Aktivierung von entzündlichen Makrophagen durch Toll-like-Rezeptoren führt zu einer Verlagerung des Stoffwechsels hin zur Glykolyse. Trotz einer allgemeinen Herunterregulierung des TCA-Zyklus unter diesen Bedingungen ist die Succinatkonzentration erhöht. Lipopolysaccharide, die an der Aktivierung von Makrophagen beteiligt sind, erhöhen jedoch die Glutamin- und GABA-Transporter. Succinat kann also durch einen verstärkten Glutamin-Stoffwechsel über Alpha-Ketoglutarat oder den GABA-Shunt gebildet werden. ⓘ
Tumorentstehung
Succinat ist eines von drei Oncometaboliten, Stoffwechselzwischenprodukten, deren Anhäufung zu metabolischen und nicht-metabolischen Dysregulationen führt, die mit der Tumorentstehung in Verbindung gebracht werden. Funktionsverlust-Mutationen in den Genen, die für Succinat-Dehydrogenase kodieren und häufig bei hereditären Paragangliomen und Phäochromozytomen gefunden werden, führen zu einem pathologischen Anstieg von Succinat. SDH-Mutationen wurden auch bei gastrointestinalen Stromatumoren, Nierentumoren, Schilddrüsentumoren, Hodenseminomen und Neuroblastomen festgestellt. Der onkogene Mechanismus, der durch mutierte SHD verursacht wird, hängt vermutlich mit der Fähigkeit von Succinat zusammen, 2-Oxogluterat-abhängige Dioxygenasen zu hemmen. Die Hemmung von KDMs und TET-Hydroxylasen führt zu einer epigenetischen Dysregulierung und Hypermethylierung, die Gene betrifft, die an der Zelldifferenzierung beteiligt sind. Darüber hinaus führt die durch Succinat geförderte Aktivierung von HIF-1α zu einem pseudohypoxischen Zustand, der die Tumorentstehung durch transkriptionelle Aktivierung von Genen fördern kann, die an Proliferation, Stoffwechsel und Angiogenese beteiligt sind. Die beiden anderen Onkometaboliten, Fumarat und 2-Hydroxyglutarat, haben eine ähnliche Struktur wie Succinat und wirken durch parallele HIF-induzierende onkogene Mechanismen. ⓘ
Ischämie-Reperfusionsschäden
Die Anhäufung von Succinat unter hypoxischen Bedingungen wurde mit der Reperfusionsschädigung durch erhöhte ROS-Produktion in Verbindung gebracht. Während der Ischämie sammelt sich Succinat an. Nach der Reperfusion wird Succinat schnell oxidiert, was zu einer abrupten und umfangreichen Produktion von ROS führt. ROS lösen dann den zellulären apoptotischen Mechanismus aus oder führen zu oxidativen Schäden an Proteinen, Membranen, Organellen usw. In Tiermodellen führte die pharmakologische Hemmung der ischämischen Succinat-Akkumulation zu einer Verbesserung der Ischämie-Reperfusionsschäden. Seit 2016 wird die Hemmung der Succinat-vermittelten ROS-Produktion als therapeutisches Wirkstoffziel untersucht. ⓘ
Geschichte

Die Bernsteinsäure wurde 1546 von Georgius Agricola bei der trockenen Destillation durch Erhitzen von Bernstein entdeckt. Nicolas Lémery erkannte als Erster im Jahre 1675 die Säurenatur des Stoffes und Jöns Jakob Berzelius fand die Zusammensetzung (C4H6O4) der Säure heraus. Bis weit in das 20. Jahrhundert waren Arzneimittel auf der Basis von Bernsteinsäure und ihrer Salze zur Anwendung bei Katarrhen und Syphilis in Gebrauch. ⓘ

Ende des 19. Jahrhunderts versuchte der in Danzig lebende Apotheker Otto Helm die Herkunft von Bernstein anhand seines Gehaltes an Bernsteinsäure zu erkennen. Die auf dem Wege der Trockendestillation gewonnene und in Retorten sublimierte Säure wog Helm und kam zu dem Ergebnis, dass ein Anteil zwischen 3,2 % und 8,2 % auf baltischen Bernstein schließen lasse. Er untersuchte mit dieser Methode auch sizilianischen Bernstein und archäologische Funde unter anderem aus Mykene. Während er in Proben sizilianischen Bernsteins keine Säurespuren fand, wiesen die antiken Stücke einen Säuregehalt von 4,1 % bis 6,3 % auf. Helm hielt damit die seit Alters her Archäologen beschäftigende Frage nach der Herkunft der im Mittelmeerraum gemachten Bernsteinfunde für beantwortet. Es musste sich nach diesen Befunden um baltischen Bernstein handeln. Später stellte sich heraus, dass der Gehalt an Bernsteinsäure kein verlässliches Merkmal zur Identifizierung baltischen Bernsteins ist, da auch in Bernstein anderer europäischer Lagerstätten entsprechende Konzentrationen an Bernsteinsäure gefunden wurden. Helms Herkunftsnachweis behielt indes Gültigkeit, da diese Lagerstätten in der Antike noch nicht bekannt waren. ⓘ
Rolf C. A. Rottländer kam 1970 zu dem Schluss, Bernsteinsäure sei eigentlich gar nicht von Natur aus in Bernstein enthalten, sondern bilde sich erst im Zuge der alkalischen Hydrolyse des Bernsteins (als ein alkalisches Salz) oder während der Trockendestillation (als sein Anhydrid). Er schlug vor, Bernsteinsäure (als Salz oder Anhydrid) als ein natürliches Oxidationsprodukt von Bernstein und damit als einen Indikator für dessen Alterungsprozess zu betrachten. ⓘ
Die Frage der Herkunft antiken Bernsteins aus archäologischen Grabungen ist damit weiterhin Gegenstand wissenschaftlicher Diskussionen und wird in jüngerer Zeit mit Hilfe anderer Untersuchungsmethoden (Infrarot-Spektroskopie, Massenspektrometrie, Gaschromatographie, Kernspinresonanzspektroskopie [NMR] und andere mehr) zu beantworten versucht. ⓘ
Gewinnung und Darstellung
Biotechnologisch
Bernsteinsäure kann durch Fermentation aus Kohlenhydraten hergestellt werden, insbesondere aus Stärke und verschiedenen Oligosacchariden (C6- und C5-Zucker). Hierbei kann das natürliche Vorkommen der Bernsteinsäure im Stoffwechsel genutzt werden, um sie gezielt durch Mikroorganismen herstellen zu lassen. Biotechnologisch hergestellte Bernsteinsäure wird vor allem für die Nutzung in Lebensmitteln genutzt, allerdings existieren mittlerweile auch Pilotanlagen zu biotechnologischen Bernsteinsäureproduktion für technische Anwendungen. ⓘ
Aufgrund der Möglichkeit, biotechnologisch Bernsteinsäure mit Hilfe von Bakterien großtechnisch zu produzieren, wird verstärkt mit Basfia succiniciproducens, Mannheimia succiniciproducens und Anaerobiospirillum succiniciproducens geforscht. Auch der Modellorganismus Escherichia coli, der über Metabolic Engineering für die Produktion hoher Mengen an Bernsteinsäure optimiert werden soll, steht im Fokus der Forschung. ⓘ
Chemische Eigenschaften
Als Succinate bezeichnet man die Salze und Ester der Bernsteinsäure. Der Begriff 'Succinat' leitet sich vom lateinischen Wort suc(c)inum für Bernstein ab. Succinate enthalten in ihren Kristallgittern das Succinat-Ion als negativ geladenes Anion. Die allgemeine Formel eines Alkalisuccinats lautet MOOC–CH2–CH2–COOM, M steht besonders für Natrium- und Kaliumionen. Alkalisuccinate lösen sich leicht in Wasser. Die Erdalkalisuccinate sind nur schwer, die übrigen Succinate gar nicht wasserlöslich. So findet man Calciumsuccinat in unreifen Früchten oder Algen. Die esterartigen Succinate können durch die Halbstrukturformel R–O–CO–CH2–CH2–CO–O–R beschrieben werden. ⓘ
Im Jahr 1949 entdeckte Daniel Bovet die muskelerschlaffende Wirkung des Bischolinesters der Bernsteinsäure, des Succinylbischolins, das 1951 als kurzwirksames Muskelrelaxans in die Klinik eingeführt wurde. ⓘ
Wird Bernsteinsäure erhitzt, spaltet sie Wasser ab und bildet unter Ringschluss das Bernsteinsäureanhydrid. ⓘ