Chagas-Krankheit
| Chagas-Krankheit ⓘ | |
|---|---|
| Andere Namen | Amerikanische Trypanosomiasis |
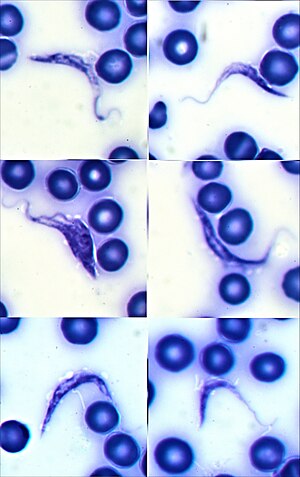 | |
| Mikroskopische Aufnahme von Giemsa-gefärbten Trypanosoma cruzi Trypomastigoten in menschlichem Blut | |
| Aussprache |
|
| Fachgebiet | Ansteckende Krankheit |
| Symptome | Fieber, große Lymphknoten, Kopfschmerzen |
| Komplikationen | Herzinsuffizienz, vergrößerte Speiseröhre, vergrößerter Dickdarm |
| Auslöser | Trypanosoma cruzi, verbreitet durch Kusswanzen |
| Diagnostische Methode | Nachweis des Parasiten, seiner DNA oder von Antikörpern im Blut |
| Vorbeugung | Beseitigung von Kusswanzen und Vermeidung ihrer Bisse |
| Medikation | Benznidazol, Nifurtimox |
| Häufigkeit | 6,5 Millionen (2019) |
| Todesfälle | 9,490 (2019) |
Die Chagas-Krankheit, auch bekannt als Amerikanische Trypanosomiasis, ist eine tropische Parasitenerkrankung, die durch Trypanosoma cruzi verursacht wird. Sie wird hauptsächlich durch Insekten der Unterfamilie Triatominae verbreitet, die als "Kusswanzen" bekannt sind. Die Symptome verändern sich im Verlauf der Infektion. Im Frühstadium sind die Symptome in der Regel nicht oder nur leicht ausgeprägt und können Fieber, geschwollene Lymphknoten, Kopfschmerzen oder Schwellungen an der Bissstelle umfassen. Nach vier bis acht Wochen treten unbehandelte Personen in die chronische Phase der Krankheit ein, die in den meisten Fällen keine weiteren Symptome verursacht. Bis zu 45 % der Menschen mit chronischen Infektionen entwickeln 10-30 Jahre nach der Ersterkrankung eine Herzerkrankung, die zu Herzversagen führen kann. Verdauungskomplikationen wie eine vergrößerte Speiseröhre oder ein vergrößerter Dickdarm können ebenfalls bei bis zu 21 % der Menschen auftreten, und bei bis zu 10 % der Menschen können Nervenschäden auftreten. ⓘ
T. cruzi wird in der Regel durch den Biss einer Raubwanze auf Menschen und andere Säugetiere übertragen. Die Krankheit kann auch durch Bluttransfusionen, Organtransplantationen, den Verzehr von mit den Parasiten verunreinigten Lebensmitteln oder Getränken sowie durch vertikale Übertragung (von der Mutter auf ihr Kind) übertragen werden. Die Diagnose einer frühen Erkrankung erfolgt durch den Nachweis des Parasiten im Blut unter dem Mikroskop oder durch den Nachweis seiner DNA mittels Polymerase-Kettenreaktion. Die chronische Erkrankung wird durch den Nachweis von Antikörpern gegen T. cruzi im Blut diagnostiziert. ⓘ
Die Vorbeugung konzentriert sich auf die Beseitigung von Kusswanzen und die Vermeidung ihrer Bisse. Dazu kann die Verwendung von Insektiziden oder Moskitonetzen gehören. Weitere Präventionsmaßnahmen sind die Untersuchung von Blut, das für Transfusionen verwendet wird. Bis zum Jahr 2022 wurde noch kein Impfstoff entwickelt. Frühe Infektionen können mit den Medikamenten Benznidazol oder Nifurtimox behandelt werden, die in der Regel die Krankheit heilen, wenn sie kurz nach der Infektion verabreicht werden, aber weniger wirksam sind, je länger eine Person an der Chagas-Krankheit leidet. Bei einer chronischen Erkrankung können die Medikamente die Entwicklung von Endstadiumsymptomen verzögern oder verhindern. Benznidazol und Nifurtimox verursachen häufig Nebenwirkungen, darunter Hauterkrankungen, Reizungen des Verdauungssystems und neurologische Symptome, die dazu führen können, dass die Behandlung abgesetzt wird. Ab 2019 werden neue Medikamente gegen die Chagas-Krankheit entwickelt, und experimentelle Impfstoffe wurden in Tiermodellen untersucht. ⓘ
Schätzungsweise 6,5 Millionen Menschen, vor allem in Mexiko, Mittelamerika und Südamerika, sind 2019 an der Chagas-Krankheit erkrankt, was zu etwa 9.490 jährlichen Todesfällen führt. Die meisten Erkrankten sind arm, und die meisten wissen nicht, dass sie infiziert sind. Große Bevölkerungswanderungen haben die Chagas-Krankheit in neue Regionen getragen, darunter auch in die Vereinigten Staaten und viele europäische Länder. Die Krankheit befällt mehr als 150 Tierarten. ⓘ
Die Krankheit wurde erstmals 1909 von dem brasilianischen Arzt Carlos Chagas beschrieben, nach dem sie auch benannt ist. Die Chagas-Krankheit wird als vernachlässigte Tropenkrankheit eingestuft. ⓘ
| Klassifikation nach ICD-10 | |
|---|---|
| B57 | Chagas-Krankheit |
| ICD-10 online (WHO-Version 2019) | |
Die Chagas-Krankheit [ˈʃaːgas-] (auch als Amerikanische Trypanosomiasis, Südamerikanische Trypanosomiasis oder Morbus Chagas bezeichnet) ist eine infektiöse Erkrankung und Parasitose, die durch den Einzeller Trypanosoma cruzi hervorgerufen wird. Sie wird durch den Kot von Raubwanzen übertragen. Ihr klinisches Bild ist gekennzeichnet von Gesichtsödem und Lymphknotenschwellungen. ⓘ

Anzeichen und Symptome

Die Chagas-Krankheit tritt in zwei Stadien auf: einem akuten Stadium, das sich ein bis zwei Wochen nach dem Insektenstich entwickelt, und einem chronischen Stadium, das sich über viele Jahre entwickelt. Das akute Stadium verläuft häufig symptomlos. Wenn sie auftreten, sind die Symptome in der Regel geringfügig und nicht spezifisch für eine bestimmte Krankheit. Zu den Anzeichen und Symptomen gehören Fieber, Unwohlsein, Kopfschmerzen und eine Vergrößerung von Leber, Milz und Lymphknoten. Manchmal entwickelt sich an der Infektionsstelle ein geschwollener Knoten, der "Romaña-Zeichen" genannt wird, wenn er sich auf dem Augenlid befindet, oder ein "Chagom", wenn er sich an einer anderen Stelle der Haut befindet. In seltenen Fällen (weniger als 1-5 %) entwickeln Infizierte eine schwere akute Erkrankung, die eine Entzündung des Herzmuskels, eine Flüssigkeitsansammlung um das Herz sowie eine Entzündung des Gehirns und des umliegenden Gewebes nach sich ziehen und lebensbedrohlich sein kann. Die akute Phase dauert in der Regel vier bis acht Wochen und klingt ohne Behandlung ab. ⓘ
Sofern sie nicht mit Antiparasitika behandelt werden, bleiben die Menschen nach der Genesung von der akuten Phase mit T. cruzi infiziert. Die meisten chronischen Infektionen verlaufen asymptomatisch, was als indeterminierte chronische Chagas-Krankheit bezeichnet wird. Im Laufe einer jahrzehntelangen Erkrankung entwickeln jedoch etwa 30-40 % der Menschen eine Organfunktionsstörung (determinierte chronische Chagas-Krankheit), die meist das Herz oder das Verdauungssystem betrifft. ⓘ
Die häufigste Langzeitmanifestation ist die Herzerkrankung, die bei 14-45 % der Menschen mit chronischer Chagas-Krankheit auftritt. Menschen mit einer Chagas-Herzerkrankung leiden häufig unter Herzklopfen und manchmal auch unter Ohnmachtsanfällen, die auf eine unregelmäßige Herzfunktion zurückzuführen sind. Im Elektrokardiogramm zeigen sich bei Menschen mit Chagas-Herzkrankheit am häufigsten Herzrhythmusstörungen. Mit dem Fortschreiten der Krankheit werden die Herzkammern vergrößert (dilatative Kardiomyopathie), wodurch sich die Fähigkeit des Herzens, Blut zu pumpen, verringert. In vielen Fällen ist das erste Anzeichen einer Chagas-Herzerkrankung eine Herzinsuffizienz, eine Thromboembolie oder Schmerzen in der Brust, die auf Anomalien im Mikrogefäßsystem zurückzuführen sind. ⓘ
Ebenfalls häufig bei der chronischen Chagas-Krankheit ist eine Schädigung des Verdauungssystems, von der 10-21 % der Menschen betroffen sind. Vergrößerungen der Speiseröhre oder des Dickdarms sind die häufigsten Verdauungsprobleme. Menschen mit vergrößerter Speiseröhre leiden häufig unter Schmerzen (Odynophagie) oder Schluckbeschwerden (Dysphagie), saurem Reflux, Husten und Gewichtsverlust. Menschen mit einem vergrößerten Dickdarm leiden häufig unter Verstopfung und können eine schwere Verstopfung des Darms oder seiner Blutversorgung entwickeln. Bis zu 10 % der chronisch infizierten Personen entwickeln Nervenschäden, die zu Taubheit und veränderten Reflexen oder Bewegungen führen können. Während sich die chronische Erkrankung in der Regel über Jahrzehnte entwickelt, kommt es bei einigen Menschen mit Chagas-Krankheit (weniger als 10 %) direkt nach der akuten Erkrankung zu Herzschäden. ⓘ
Die Anzeichen und Symptome unterscheiden sich bei Menschen, die sich über weniger häufige Wege mit T. cruzi infizieren. Menschen, die sich durch die Einnahme von Parasiten infizieren, entwickeln in der Regel innerhalb von drei Wochen nach dem Verzehr eine schwere Krankheit mit Symptomen wie Fieber, Erbrechen, Kurzatmigkeit, Husten und Schmerzen in Brust, Bauch und Muskeln. Diejenigen, die angeboren infiziert sind, haben in der Regel nur wenige oder gar keine Symptome, können aber leichte unspezifische Symptome oder schwere Symptome wie Gelbsucht, Atemnot und Herzprobleme haben. Menschen, die sich durch Organtransplantationen oder Bluttransfusionen infiziert haben, neigen zu ähnlichen Symptomen wie bei der durch Vektoren übertragenen Krankheit, aber die Symptome treten möglicherweise erst nach einer Woche bis zu fünf Monaten auf. Bei chronisch infizierten Personen, die aufgrund einer HIV-Infektion immunsupprimiert sind, kann es zu besonders schweren und ausgeprägten Erkrankungen kommen, die meist durch Entzündungen des Gehirns und des umliegenden Gewebes oder Hirnabszesse gekennzeichnet sind. Die Symptome sind je nach Größe und Lokalisierung der Hirnabszesse sehr unterschiedlich, umfassen aber typischerweise Fieber, Kopfschmerzen, Krampfanfälle, Gefühlsstörungen oder andere neurologische Probleme, die auf bestimmte Schädigungen des Nervensystems hinweisen. Gelegentlich treten bei diesen Personen auch akute Herzentzündungen, Hautläsionen und Erkrankungen des Magens, des Darms oder des Bauchfells auf. ⓘ
Eine akute Phase tritt bei ca. einem Drittel der Neuinfizierten auf. Es handelt sich meist um Kinder oder Personen mit Abwehrschwäche. Diese Phase klingt gewöhnlich nach ca. vier Wochen wieder ab. Fieber, Atemnot, Ödeme, Durchfall, Bauchschmerzen, Lymphknotenschwellungen, Krampfanfälle bei Einschluss des Gehirns und Herzvergrößerung sind die Folge. ⓘ
Nach einer Latenzphase, die u. U. Jahre dauern kann, kommt es zur chronischen Erkrankung. Symptome der akuten Phase können aber auch während der Latenzphase wieder ausbrechen, wenn eine neu auftretende Abwehrschwäche hinzukommt, z. B. eine HIV-Infektion. ⓘ
Die Symptome der chronischen Phase entstehen vorwiegend aus der chronischen Herzvergrößerung (Herzrasen, Leistungsschwäche, Luftnot bei Belastung) und der Zerstörung von Nervenzellen im Verdauungstrakt. Dies führt zu einer massiven Auftreibung insbesondere von Speiseröhre (Megaösophagus) und Dickdarm (Megacolon). Hierdurch ist eine normale Darmpassage nicht mehr möglich. Dies kann zum Tod durch Darmdurchbruch, Darmverschluss (Ileus) oder Bauchfellentzündung (Peritonitis) führen. ⓘ
Unbehandelt kann die Chagaskrankheit in bis zu 10 % der Fälle tödlich enden. Besonders gefährdet sind Säuglinge und Kleinkinder. ⓘ
Ursache
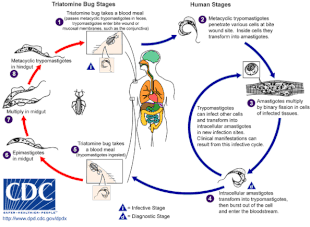
Die Chagas-Krankheit wird durch eine Infektion mit dem Protozoen-Parasiten T. cruzi verursacht, der in der Regel durch den Biss von Triatomäusen, auch "küssende Wanzen" genannt, auf den Menschen übertragen wird. Wenn das Insekt an der Bissstelle seinen Kot absetzt, gelangen bewegliche Formen von T. cruzi, so genannte Trypomastigoten, in die Blutbahn und dringen in verschiedene Wirtszellen ein. In einer Wirtszelle verwandelt sich der Parasit in eine replikative Form, die Amastigote, die mehrere Replikationsrunden durchläuft. Die replizierten Amastigoten wandeln sich wieder in Trypomastigoten um, die die Wirtszelle sprengen und in den Blutkreislauf freigesetzt werden. Trypomastigoten verbreiten sich dann im ganzen Körper in verschiedenen Geweben, wo sie in Zellen eindringen und sich vermehren. Über viele Jahre hinweg können die Zyklen von Parasitenvermehrung und Immunreaktion diese Gewebe schwer schädigen, insbesondere das Herz und den Verdauungstrakt. ⓘ
Übertragung

T. cruzi kann von verschiedenen Wanzenarten aus den Gattungen Triatoma, Panstrongylus und Rhodnius übertragen werden. Die Hauptüberträger für die Infektion des Menschen sind die in menschlichen Behausungen lebenden Arten von Triatomäusen, nämlich Triatoma infestans, Rhodnius prolixus, Triatoma dimidiata und Panstrongylus megistus. Diese Insekten sind unter verschiedenen lokalen Namen bekannt, darunter vinchuca in Argentinien, Bolivien, Chile und Paraguay, barbeiro (der Barbier) in Brasilien, pito in Kolumbien, chinche in Mittelamerika und chipo in Venezuela. Die Wanzen ernähren sich in der Regel nachts und bevorzugen feuchte Oberflächen in der Nähe der Augen oder des Mundes. Eine Triatomwanze kann sich mit T. cruzi infizieren, wenn sie sich von einem infizierten Wirt ernährt. T. cruzi vermehrt sich im Verdauungstrakt des Insekts und wird mit dem Kot der Wanze ausgeschieden. Wenn sich eine infizierte Triatomine ernährt, sticht sie in die Haut und nimmt eine Blutmahlzeit zu sich, wobei sie gleichzeitig ihren Kot abgibt, um Platz für die neue Mahlzeit zu schaffen. Der Biss ist normalerweise schmerzlos, verursacht aber Juckreiz. Durch Kratzen an der Bissstelle gelangt der mit T. cruzi versetzte Kot in die Bisswunde und löst eine Infektion aus. ⓘ
Neben der klassischen Übertragung durch Vektoren kann die Chagas-Krankheit auch durch den Verzehr von Lebensmitteln oder Getränken übertragen werden, die mit Triatominsekten oder deren Exkrementen kontaminiert sind. Da die Parasiten durch Erhitzen oder Trocknen abgetötet werden, sind Getränke und insbesondere Fruchtsäfte die häufigste Infektionsquelle. Dieser orale Übertragungsweg wurde bei mehreren Ausbrüchen in Betracht gezogen, wo er zu ungewöhnlich schweren Symptomen führte, die wahrscheinlich auf eine Infektion mit einer höheren Parasitenlast als durch den Biss einer Triatombe zurückzuführen sind. ⓘ
T. cruzi kann unabhängig von der Triatomeenwanze bei Bluttransfusionen, nach Organtransplantationen oder über die Plazenta während der Schwangerschaft übertragen werden. Bei einer Transfusion mit dem Blut eines infizierten Spenders wird der Empfänger in 10-25 % der Fälle infiziert. Um dies zu verhindern, werden Blutspenden in vielen Ländern, in denen die Chagas-Krankheit endemisch ist, sowie in den Vereinigten Staaten auf T. cruzi untersucht. Auch bei der Transplantation von festen Organen eines infizierten Spenders kann T. cruzi auf den Empfänger übertragen werden. Dies gilt insbesondere für die Herztransplantation, bei der in 75-100 % der Fälle T. cruzi übertragen wird, und in geringerem Maße für die Transplantation der Leber (0-29 %) oder einer Niere (0-19 %). Eine infizierte Mutter kann T. cruzi über die Plazenta auf ihr Kind übertragen; dies geschieht bei bis zu 15 % der Geburten von infizierten Müttern. Im Jahr 2019 erfolgten 22,5 % der Neuinfektionen durch kongenitale Übertragung. ⓘ
Der Erreger Trypanosoma cruzi ist ein Einzeller, der durch Raubwanzen (Reduviidae) übertragen wird. Die Überträger (Vektor) sind drei bis vier Zentimeter große Raubwanzen der Gattungen Triatoma, Rhodnius und Panstrongylus (alle aus der Unterfamilie Triatominae), wobei Triatoma infestans den wichtigsten Insektenwirt darstellt. Alle Stadien, auch die Larven, sind empfänglich für Trypanosoma cruzi. ⓘ
In Laborexperimenten konnte auch eine Übertragung von T. cruzi von Bettwanzen auf Mäuse und von Mäusen auf Bettwanzen demonstriert werden. Inwieweit Bettwanzen bei der Übertragung der Chagas-Krankheit auf den Menschen eine Rolle spielen können, ist allerdings unklar; eine systematische Analyse von Bettwanzenpopulationen in Regionen mit T. cruzi steht noch aus. ⓘ
Pathophysiologie

In der akuten Phase der Krankheit werden die Anzeichen und Symptome direkt durch die Replikation von T. cruzi und die Reaktion des Immunsystems auf diese verursacht. In dieser Phase kann T. cruzi in verschiedenen Geweben des Körpers und im Blut zirkulieren. In den ersten Wochen der Infektion wird die Parasitenvermehrung durch die Produktion von Antikörpern und die Aktivierung der Entzündungsreaktion des Wirts unter Kontrolle gebracht, insbesondere durch Zellen, die sich gegen intrazelluläre Erreger richten, wie NK-Zellen und Makrophagen, angetrieben durch Entzündungssignalmoleküle wie TNF-α und IFN-γ. ⓘ
Bei der chronischen Chagas-Krankheit entwickeln sich über Jahre hinweg langfristige Organschäden aufgrund der fortgesetzten Vermehrung des Parasiten und der Schädigung durch das Immunsystem. Im Frühstadium der Krankheit ist T. cruzi häufig in den quergestreiften Muskelfasern des Herzens zu finden. Mit fortschreitender Erkrankung vergrößert sich das Herz im Allgemeinen, wobei erhebliche Bereiche der Herzmuskelfasern durch Narbengewebe und Fett ersetzt werden. Bereiche mit aktiver Entzündung sind über das gesamte Herz verstreut und beherbergen jeweils entzündliche Immunzellen, typischerweise Makrophagen und T-Zellen. Im fortgeschrittenen Stadium der Erkrankung werden Parasiten im Herzen nur noch selten nachgewiesen und sind möglicherweise nur in sehr geringen Mengen vorhanden. ⓘ
Im Herzen, im Dickdarm und in der Speiseröhre führt die chronische Erkrankung zu einem massiven Verlust von Nervenendigungen. Im Herzen kann dies zu Herzrhythmusstörungen und anderen Funktionsstörungen des Herzens beitragen. Im Dickdarm und in der Speiseröhre ist der Verlust der Kontrolle über das Nervensystem die Hauptursache für Organfunktionsstörungen. Der Verlust der Nerven beeinträchtigt die Bewegung der Nahrung durch den Verdauungstrakt, was zu einer Verstopfung der Speiseröhre oder des Dickdarms und einer Einschränkung ihrer Blutversorgung führen kann. ⓘ
Diagnose

Das Vorhandensein von T. cruzi im Blut ist diagnostisch für die Chagas-Krankheit. In der akuten Phase der Infektion kann der Nachweis durch die mikroskopische Untersuchung von frischem, antikoaguliertem Blut oder dessen Buffy Coat auf bewegliche Parasiten oder durch die Anfertigung von dünnen und dicken, mit Giemsa gefärbten Blutausstrichen zur direkten Visualisierung der Parasiten erfolgen. Bei der Untersuchung des Blutausstrichs werden in 34-85 % der Fälle Parasiten nachgewiesen. Die Empfindlichkeit erhöht sich, wenn Techniken wie die Mikrohämatokrit-Zentrifugation zur Konzentration des Blutes eingesetzt werden. Bei der mikroskopischen Untersuchung gefärbter Blutausstriche erscheinen T. cruzi-Trypomastigoten als S- oder U-förmige Organismen mit einem Flagellum, das durch eine wellenförmige Membran mit dem Körper verbunden ist. Im Inneren des Parasitenkörpers sind ein Zellkern und eine kleinere Struktur, der Kinetoplast, sichtbar. Der Kinetoplast von T. cruzi ist relativ groß, was ihn von anderen Trypanosomenarten, die den Menschen infizieren, unterscheidet. ⓘ
Alternativ kann die T. cruzi-DNA auch mittels Polymerase-Kettenreaktion (PCR) nachgewiesen werden. Bei der akuten und kongenitalen Chagas-Krankheit ist die PCR empfindlicher als die Mikroskopie und zuverlässiger als Antikörpertests für die Diagnose der kongenitalen Krankheit, da sie nicht durch die Übertragung von Antikörpern gegen T. cruzi von der Mutter auf das Kind beeinflusst wird (passive Immunität). Die PCR wird auch zur Überwachung des T. cruzi-Spiegels bei Empfängern von Organtransplantaten und immunsupprimierten Personen eingesetzt, wodurch eine Infektion oder Reaktivierung in einem frühen Stadium festgestellt werden kann. ⓘ
Bei der chronischen Chagas-Krankheit ist die Parasitenkonzentration im Blut zu gering, um durch Mikroskopie oder PCR zuverlässig nachgewiesen werden zu können, so dass die Diagnose in der Regel durch serologische Tests gestellt wird, bei denen Immunglobulin-G-Antikörper gegen T. cruzi im Blut nachgewiesen werden. Zur Bestätigung der Diagnose sind zwei positive serologische Ergebnisse mit unterschiedlichen Testmethoden erforderlich. Sind die Testergebnisse nicht schlüssig, können zusätzliche Testmethoden wie der Western-Blot eingesetzt werden. ⓘ
Es gibt verschiedene Schnelltests für die Chagas-Krankheit. Diese Tests sind leicht zu transportieren und können von Personen ohne spezielle Ausbildung durchgeführt werden. Sie eignen sich für das Screening einer großen Anzahl von Personen und für die Untersuchung von Personen, die keinen Zugang zu Gesundheitseinrichtungen haben, aber ihre Empfindlichkeit ist relativ gering, und es wird empfohlen, zur Bestätigung eines positiven Ergebnisses eine zweite Methode anzuwenden. ⓘ
T.-cruzi-Parasiten können aus Blutproben mittels Blutkultur, Xenodiagnose oder durch Beimpfung von Tieren mit dem Blut der Person gezüchtet werden. Bei der Blutkulturmethode werden die roten Blutkörperchen der Person vom Plasma getrennt und in ein spezielles Wachstumsmedium gegeben, um die Vermehrung des Parasiten zu fördern. Es kann bis zu sechs Monate dauern, bis ein Ergebnis vorliegt. Bei der Xenodiagnose wird das Blut an Triatominsekten verfüttert, deren Kot dann 30 bis 60 Tage später auf den Parasiten untersucht wird. Diese Methoden werden nicht routinemäßig angewendet, da sie langsam sind und eine geringe Empfindlichkeit aufweisen. ⓘ
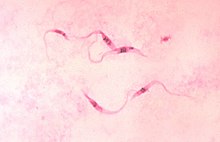
Der Erreger lässt sich besonders in der akuten Phase in den ersten Wochen mikroskopisch im Blut (Blutausstrich oder dicker Tropfen) nachweisen. In der chronischen Krankheitsphase wird der Erreger mit Antikörpertests (z. B. Immunfluoreszenz) nachgewiesen. In Südamerika gibt es den Trypanosomentest in Form der sogenannten Xenodiagnose. Dazu lässt man laborgezüchtete Raubwanzen, die erregerfrei sind, auf der Haut des Patienten eine Blutmahlzeit nehmen. Nach zwei bis vier Wochen (nach unterschiedlichen Quellen) wird der Darm der Raubwanzen auf Erregerbefall untersucht. Im Gehirn lässt sich die Auswirkung der Erkrankung mittels CT oder MRT nachweisen. Zur Untersuchung des Herzens kann man die Echokardiografie nutzen. ⓘ
In den USA gibt es seit 2007 einen ELISA-basierten, von der FDA zugelassenen Bluttest. ⓘ
Vorbeugung

Die Bemühungen zur Vorbeugung der Chagas-Krankheit haben sich weitgehend auf die Vektorkontrolle konzentriert, um die Exposition gegenüber Triatomäusen zu begrenzen. Insektizid-Sprühprogramme waren die Hauptstütze der Vektorkontrolle, bei der Häuser und die umliegenden Gebiete mit Restinsektiziden besprüht wurden. Ursprünglich wurden dafür chlororganische, phosphororganische und carbamathaltige Insektizide verwendet, die in den 1980er Jahren durch Pyrethroide ersetzt wurden. Diese Programme haben die Übertragung in Brasilien und Chile drastisch reduziert und wichtige Vektoren aus bestimmten Regionen eliminiert: Triatoma infestans in Brasilien, Chile, Uruguay und Teilen von Peru und Paraguay sowie Rhodnius prolixus in Mittelamerika. Die Vektorkontrolle wurde in einigen Regionen durch die Entwicklung von Insektizidresistenzen bei Triatomwanzen behindert. Als Reaktion darauf wurden im Rahmen von Vektorkontrollprogrammen alternative Insektizide (z. B. Fenitrothion und Bendiocarb in Argentinien und Bolivien), die Behandlung von Haustieren (die sich ebenfalls von Triatomäusen ernähren) mit Pestiziden, mit Pestiziden imprägnierte Anstriche und andere experimentelle Ansätze eingesetzt. In Gebieten mit Triatomäusen kann die Übertragung von T. cruzi verhindert werden, indem man unter Moskitonetzen schläft und die Wohnverhältnisse so verbessert, dass Triatomäusen die Besiedlung von Häusern verwehrt wird. ⓘ
Bluttransfusionen waren früher der zweithäufigste Übertragungsweg für die Chagas-Krankheit. T. cruzi kann in gekühlt gelagertem Blut überleben und auch das Einfrieren und Auftauen überstehen, so dass es in Vollblut, gepackten roten Blutkörperchen, Granulozyten, Kryopräzipitat und Blutplättchen überleben kann. Die Entwicklung und Einführung von Screening-Tests in Blutbanken hat das Infektionsrisiko bei Bluttransfusionen drastisch verringert. In den lateinamerikanischen Ländern werden fast alle Blutspenden einem Chagas-Screening unterzogen. Auch in Ländern, die nicht zu den Endemiegebieten gehören und in denen es viele Einwanderer aus endemischen Gebieten gibt, ist das Screening weit verbreitet. Dazu gehören das Vereinigte Königreich (seit 1999), Spanien (2005), die Vereinigten Staaten (2007), Frankreich und Schweden (2009), die Schweiz (2012) und Belgien (2013). Serologische Tests, in der Regel ELISA-Tests, werden zum Nachweis von Antikörpern gegen T. cruzi-Proteine im Spenderblut eingesetzt. ⓘ
Die Programme zur Prävention der Chagas-Krankheit zielen auch auf andere Übertragungswege ab. Die Behandlung von T. cruzi-infizierten Müttern während der Schwangerschaft verringert das Risiko einer kongenitalen Übertragung der Infektion. Zu diesem Zweck haben viele Länder in Lateinamerika routinemäßige Untersuchungen von Schwangeren und Säuglingen auf eine T. cruzi-Infektion eingeführt, und die Weltgesundheitsorganisation empfiehlt, alle Kinder infizierter Mütter zu untersuchen, um zu verhindern, dass sich aus einer angeborenen Infektion eine chronische Krankheit entwickelt. Ähnlich wie bei Bluttransfusionen werden in vielen Ländern, in denen die Chagas-Krankheit endemisch ist, Organe für Transplantationen mit serologischen Tests untersucht. ⓘ
Es gibt keinen Impfstoff gegen die Chagas-Krankheit. Mehrere experimentelle Impfstoffe wurden an mit T. cruzi infizierten Tieren getestet und waren in der Lage, die Parasitenzahl im Blut und im Herzen zu verringern, aber bis 2016 wurden noch keine Impfstoffkandidaten in klinischen Studien am Menschen getestet. ⓘ

Es gibt bisher keinen zugelassenen Trypanosomiasisimpfstoff. Zur Vorbeugung gegen die Krankheit werden die Raubwanzen bekämpft. Diese leben gerne nahe der Schlafplätze der Haustiere, somit sind jene Orte abzusondern. Ausreichend geschlossene Wohnungen sowie zeltartige, auch bodenseitig durchgehend geschlossene Moskitonetze mit dichtschließendem Reißverschluss bieten einen sehr guten Schutz, sofern man das Netz beim Schlafen nicht berührt. Notfalls muss das herkömmliche Moskitonetz bis unter die Matratze gesteckt werden. Die gefährdetsten Schlafplätze liegen in offenen einfachen Häusern, z. B. mit Wänden und Dächern aus Stroh und ähnlichem Flechtwerk. Viele unspezifisch wirkende Insektizide oder Repellents sind gegen Raubwanzen meist unwirksam. ⓘ
Ein Forscherteam um den Parasitologen und Infektionsbiologen Sven Klimpel hat 2020 herausgefunden, dass (teils infolge der globalen Erwärmung) die Wanzen auch in Portugal, Frankreich, Spanien, Italien, Zentralafrika und Südostasien heimisch werden könnten. Die Autoren der Studie empfehlen, die Infektion meldepflichtig zu machen. ⓘ
Verwaltung
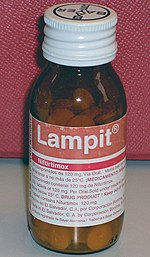
Die Chagas-Krankheit wird mit antiparasitären Medikamenten behandelt, um T. cruzi aus dem Körper zu eliminieren, sowie mit symptomatischer Behandlung, um die Auswirkungen der Infektion zu lindern. Im Jahr 2018 waren Benznidazol und Nifurtimox die Antiparasitika der Wahl zur Behandlung der Chagas-Krankheit, wobei Benznidazol in den meisten Ländern Lateinamerikas das einzige verfügbare Medikament ist. Bei beiden Medikamenten besteht die Behandlung in der Regel aus zwei bis drei oralen Gaben pro Tag über 60 bis 90 Tage. Die antiparasitäre Behandlung ist in der Frühphase der Infektion am wirksamsten: Sie beseitigt T. cruzi bei 50 bis 80 % der Menschen in der akuten Phase, aber nur bei 20-60 % der Menschen in der chronischen Phase. Die Behandlung der chronischen Erkrankung ist bei Kindern wirksamer als bei Erwachsenen, und die Heilungsrate bei angeborenen Erkrankungen liegt bei nahezu 100 %, wenn sie im ersten Lebensjahr behandelt werden. Eine antiparasitäre Behandlung kann auch das Fortschreiten der Krankheit verlangsamen und die Möglichkeit einer kongenitalen Übertragung verringern. Die Beseitigung von T. cruzi heilt nicht die durch die chronische Chagas-Krankheit verursachten Herz- und Magen-Darm-Schäden, so dass diese Erkrankungen separat behandelt werden müssen. Eine antiparasitäre Behandlung wird nicht für Personen empfohlen, die bereits eine dilatative Kardiomyopathie entwickelt haben. ⓘ
Benznidazol gilt in der Regel als Mittel der ersten Wahl, da es mildere unerwünschte Wirkungen als Nifurtimox hat und seine Wirksamkeit besser bekannt ist. Sowohl Benznidazol als auch Nifurtimox haben häufige Nebenwirkungen, die dazu führen können, dass die Behandlung abgebrochen wird. Die häufigsten Nebenwirkungen von Benznidazol sind Hautausschlag, Verdauungsprobleme, Appetitlosigkeit, Schwäche, Kopfschmerzen und Schlafprobleme. Diese Nebenwirkungen können manchmal mit Antihistaminika oder Kortikosteroiden behandelt werden und bilden sich im Allgemeinen zurück, wenn die Behandlung abgesetzt wird. Allerdings wird Benzidazol in bis zu 29 % der Fälle abgesetzt. Bei Nifurtimox treten häufiger Nebenwirkungen auf, die bis zu 97,5 % der Personen betreffen, die das Medikament einnehmen. Die häufigsten Nebenwirkungen sind Appetitlosigkeit, Gewichtsverlust, Übelkeit und Erbrechen sowie verschiedene neurologische Störungen wie Stimmungsschwankungen, Schlaflosigkeit, Parästhesien und periphere Neuropathie. Die Behandlung wird in bis zu 75 % der Fälle abgebrochen. Beide Medikamente sind bei Schwangeren und Menschen mit Leber- oder Nierenversagen kontraindiziert. Ab 2019 wurde über Resistenzen gegen diese Medikamente berichtet. ⓘ
Die medikamentöse Therapie ist schwierig. Die einzigen verfügbaren Arzneimittel, Nifurtimox und Benznidazol, wirken vor allem in der akuten Phase der Erkrankung, haben teils schwere Nebenwirkungen und gelten als mutagen. Außerdem sind manche Erreger gegen die Mittel resistent. Durch bessere Kontrolle der Erkrankungen bei Kindern sollen die schwerer zu behandelnden chronischen Formen vermieden werden. Die Zahl der Neuinfektionen ist nach den Statistiken der WHO allerdings durch die Bekämpfung des Insekts sehr zurückgegangen. Wegen unterschiedlichster Verbreitungskarten, die im Internet angeboten werden, sollte vorsichtshalber im gesamten Verbreitungsgebiet der Krankheitsüberträger eine angemessene Prophylaxe getroffen werden, dazu könnten auch noch Gebiete in den USA gehören. ⓘ
Komplikationen
Im chronischen Stadium besteht die Behandlung darin, die klinischen Manifestationen der Krankheit zu kontrollieren. Die Behandlung der Chagas-Kardiomyopathie ähnelt der Behandlung anderer Herzkrankheiten. Es können Betablocker und ACE-Hemmer verschrieben werden, aber manche Menschen mit Chagas-Krankheit können die Standarddosis dieser Medikamente nicht einnehmen, weil sie einen niedrigen Blutdruck oder eine niedrige Herzfrequenz haben. Zur Behandlung von Herzrhythmusstörungen können Antiarrhythmika wie Amiodaron verschrieben werden, oder es wird ein Herzschrittmacher implantiert. Zur Vorbeugung von Thromboembolien und Schlaganfällen können Blutverdünner eingesetzt werden. Eine durch Chagas verursachte chronische Herzerkrankung ist ein häufiger Grund für eine Herztransplantation. Da Transplantatempfänger immunsuppressive Medikamente einnehmen, um eine Abstoßung des Organs zu verhindern, werden sie mittels PCR überwacht, um eine Reaktivierung der Krankheit festzustellen. Menschen mit Chagas-Krankheit, die sich einer Herztransplantation unterziehen, haben eine höhere Überlebensrate als der durchschnittliche Empfänger einer Herztransplantation. ⓘ
Leichte Magen-Darm-Erkrankungen können symptomatisch behandelt werden, z. B. durch die Einnahme von Abführmitteln bei Verstopfung oder die Einnahme eines Prokinetikums wie Metoclopramid vor den Mahlzeiten zur Linderung der Speiseröhrensymptome. In schwereren Fällen einer Speiseröhrenerkrankung kann ein chirurgischer Eingriff zur Durchtrennung der Muskeln des unteren Ösophagussphinkters (Kardiomyotomie) durchgeführt werden, und bei fortgeschrittenem Megakolon und Megaösophagus kann eine chirurgische Entfernung des betroffenen Teils des Organs erforderlich sein. ⓘ
Epidemiologie


Im Jahr 2019 waren schätzungsweise 6,5 Millionen Menschen weltweit an der Chagas-Krankheit erkrankt, mit etwa 173.000 Neuinfektionen und 9.490 Todesfällen pro Jahr. Die Krankheit führte 2013 zu einer jährlichen wirtschaftlichen Belastung von schätzungsweise 7,2 Milliarden US-Dollar, von denen 86 % von den endemischen Ländern getragen werden. Die Chagas-Krankheit führt jedes Jahr zum Verlust von mehr als 800.000 behinderungsbereinigten Lebensjahren. ⓘ
Das endemische Gebiet der Chagas-Krankheit erstreckt sich vom Süden der Vereinigten Staaten bis in den Norden Chiles und Argentiniens, wobei Bolivien (6,1 %), Argentinien (3,6 %) und Paraguay (2,1 %) die höchste Prävalenz der Krankheit aufweisen. Innerhalb des lateinamerikanischen Kontinents ist die Chagas-Krankheit in 21 Ländern endemisch: Argentinien, Belize, Bolivien, Brasilien, Chile, Kolumbien, Costa Rica, Ecuador, El Salvador, Französisch-Guayana, Guatemala, Guyana, Honduras, Mexiko, Nicaragua, Panama, Paraguay, Peru, Surinam, Uruguay und Venezuela. In den endemischen Gebieten sind die jährlichen Infektionen und Todesfälle von ihren Höchstständen in den 1980er Jahren bis 2010 um 67 % bzw. mehr als 73 % zurückgegangen, was vor allem auf die Bemühungen zur Vektorkontrolle und das Screening von Blutspenden zurückzuführen ist. Die Übertragung durch Insektenvektoren und Bluttransfusionen wurde in Uruguay (1997), Chile (1999) und Brasilien (2006) vollständig unterbrochen, und in Argentinien war die vektorielle Übertragung seit 2001 in 13 der 19 endemischen Provinzen unterbrochen. Während der humanitären Krise in Venezuela hat die vektorielle Übertragung in Gebieten begonnen, in denen sie zuvor unterbrochen war, und die Seroprävalenzraten der Chagas-Krankheit sind gestiegen. Die Übertragungsraten sind auch in der Region Gran Chaco aufgrund der Resistenz gegen Insektizide und im Amazonasbecken aufgrund der oralen Übertragung gestiegen. ⓘ
Während die durch Vektoren übertragene Chagas-Krankheit im größten Teil Lateinamerikas zurückgegangen ist, ist die Rate der oral übertragenen Krankheit gestiegen, was möglicherweise auf die zunehmende Verstädterung und Abholzung zurückzuführen ist, die die Menschen in engeren Kontakt mit Triatominen bringt und die Verteilung der Triatominenarten verändert. Die oral übertragene Chagas-Krankheit ist vor allem in Venezuela besorgniserregend, wo zwischen 2007 und 2018 16 Ausbrüche verzeichnet wurden. ⓘ
Chagas kommt in zwei verschiedenen ökologischen Zonen vor: In der Region des Südkegels lebt der Hauptüberträger in und um menschliche Häuser. In Mittelamerika und Mexiko lebt die Hauptüberträgerart sowohl in Wohnungen als auch in unbewohnten Gebieten. In beiden Gebieten tritt Chagas fast ausschließlich in ländlichen Gebieten auf, wo T. cruzi auch in Wild- und Haustieren vorkommt. T. cruzi infiziert mehr als 100 Säugetierarten in ganz Lateinamerika, darunter Opossums (Didelphis spp.), Gürteltiere, Seidenaffen, Fledermäuse, verschiedene Nagetiere und Hunde, die sich alle durch die Vektoren oder oral durch den Verzehr von Triatom-Wanzen und anderen infizierten Tieren infizieren können. Bei entomophagen Tieren ist dies ein üblicher Übertragungsweg. Didelphis spp. sind insofern einzigartig, als sie für die Übertragung keine Triatomine benötigen und den Lebenszyklus durch ihren eigenen Urin und Kot vollenden. Die Übertragung durch Tiere erfolgt auch durch vertikale Übertragung über die Plazenta, Bluttransfusionen und Organtransplantationen. ⓘ
Nicht endemische Länder
Obwohl die Chagas-Krankheit traditionell als eine Krankheit des ländlichen Lateinamerikas gilt, hat die internationale Migration die Erkrankten in zahlreiche nicht endemische Länder, vor allem in Nordamerika und Europa, verstreut. Im Jahr 2020 leben etwa 300.000 Infizierte in den Vereinigten Staaten, und 2018 wurde geschätzt, dass 30.000 bis 40.000 Amerikaner an Chagas-Kardiomyopathie erkrankt sind. Die überwiegende Mehrheit der Fälle in den Vereinigten Staaten tritt bei Einwanderern aus Lateinamerika auf, aber eine lokale Übertragung ist möglich. Elf Triatominenarten sind in den Vereinigten Staaten heimisch, und in einigen südlichen Bundesstaaten gibt es anhaltende Zyklen der Krankheitsübertragung zwischen Insektenvektoren und Tierreservoiren, zu denen Waldratten, Opossums, Waschbären, Gürteltiere und Stinktiere gehören. Eine lokal erworbene Infektion ist jedoch sehr selten: Von 1955 bis 2015 wurden nur 28 Fälle dokumentiert. Im Jahr 2013 wurden die Behandlungskosten in den Vereinigten Staaten auf 900 Millionen US-Dollar pro Jahr geschätzt (weltweite Kosten 7 Milliarden US-Dollar), einschließlich Krankenhausaufenthalt und medizinischer Geräte wie Herzschrittmacher. ⓘ
In Europa sind 2019 etwa 68.000 bis 123.000 Menschen von der Chagas-Krankheit betroffen. Spanien, das eine hohe Einwanderungsrate aus Lateinamerika aufweist, hat die höchste Prävalenz der Krankheit. Man schätzt, dass 50 000 bis 70 000 Spanier mit der Chagas-Krankheit leben, was die Mehrheit der europäischen Fälle ausmacht. Die Prävalenz variiert innerhalb der europäischen Länder aufgrund der unterschiedlichen Einwanderungsmuster stark. Italien hat die zweithöchste Prävalenz, gefolgt von den Niederlanden, dem Vereinigten Königreich und Deutschland. ⓘ
Geschichte

T. cruzi zirkulierte wahrscheinlich in südamerikanischen Säugetieren lange vor der Ankunft des Menschen auf dem Kontinent. T. cruzi wurde in alten menschlichen Überresten in ganz Südamerika nachgewiesen, von einer 9000 Jahre alten Chinchorro-Mumie in der Atacama-Wüste über Überreste verschiedenen Alters in Minas Gerais bis hin zu einer 1100 Jahre alten Mumie in der Chihuahuan-Wüste nahe dem Rio Grande. Viele frühe schriftliche Berichte beschreiben Symptome, die mit der Chagas-Krankheit übereinstimmen. Frühe Beschreibungen der Krankheit werden manchmal Miguel Diaz Pimenta (1707), Luís Gomes Ferreira [pt] (1735) und Theodoro J. H. Langgaard (1842) zugeschrieben. ⓘ
Die offizielle Beschreibung der Chagas-Krankheit erfolgte 1909 durch Carlos Chagas, nachdem er ein zweijähriges Mädchen mit Fieber, geschwollenen Lymphknoten und einer vergrößerten Milz und Leber untersucht hatte. Bei der Untersuchung ihres Blutes entdeckte Chagas Trypanosomen, die mit denen identisch waren, die er kurz zuvor im Hinterdarm von Triatominen identifiziert hatte, und nannte sie zu Ehren seines Mentors, des brasilianischen Arztes Oswaldo Cruz, Trypanosoma cruzi. Er schickte infizierte Triatominen an Cruz in Rio de Janeiro, der zeigte, dass der Biss der infizierten Triatomine T. cruzi auch auf Marmosettenaffen übertragen konnte. In nur zwei Jahren, 1908 und 1909, veröffentlichte Chagas Beschreibungen der Krankheit, des sie verursachenden Organismus und des für die Infektion erforderlichen Insektenvektors. Fast unmittelbar danach wurde die Krankheit auf Anregung von Miguel Couto, damals Professor an der Faculdade de Medicina do Rio de Janeiro [pt], allgemein als "Chagas-Krankheit" bezeichnet. Chagas' Entdeckung brachte ihm nationalen und internationalen Ruhm ein, aber indem er die Unzulänglichkeiten der brasilianischen Regierung bei der Bekämpfung der Krankheit aufzeigte, zog er Kritik an sich selbst und an der Krankheit, die seinen Namen trug, auf sich, was die Forschung zu seiner Entdeckung unterdrückte und wahrscheinlich seine Nominierung für den Nobelpreis 1921 vereitelte. ⓘ
In den 1930er Jahren nahm Salvador Mazza die Erforschung der Chagas-Krankheit wieder auf und beschrieb über tausend Fälle in der argentinischen Provinz Chaco. In Argentinien ist die Krankheit ihm zu Ehren als Mal de Chagas-Mazza bekannt. In den 1940er Jahren wurden serologische Tests für die Chagas-Krankheit eingeführt, die zeigten, dass die Infektion mit T. cruzi in ganz Lateinamerika verbreitet war. Zusammen mit den Erfolgen bei der Eliminierung des Malariaüberträgers durch den Einsatz von Insektiziden gab dies den Anstoß für öffentliche Gesundheitskampagnen, die sich auf die Behandlung von Häusern mit Insektiziden konzentrierten, um Triatominen auszurotten. In den 1950er Jahren wurde die Entdeckung gemacht, dass die Behandlung von Blut mit Kristallviolett den Parasiten ausrotten kann, was dazu führte, dass es in Lateinamerika in Transfusionsscreeningprogrammen weit verbreitet war. In den 1960er Jahren begannen groß angelegte Bekämpfungsprogramme, zunächst in São Paulo, dann an verschiedenen Orten in Argentinien und schließlich auf nationaler Ebene in ganz Lateinamerika. Einen großen Schub erhielten diese Programme in den 1980er Jahren durch die Einführung von Pyrethroid-Insektiziden, die nach der Anwendung keine Flecken oder Gerüche hinterließen und länger und kostengünstiger wirkten. Mit Unterstützung der Panamerikanischen Gesundheitsorganisation entstanden regionale Gremien, die sich der Bekämpfung der Chagas-Krankheit widmeten. 1991 wurde die Initiative des Südkegels zur Ausrottung der Chagas-Krankheit ins Leben gerufen, gefolgt von der Initiative der Andenländer (1997), der Initiative der mittelamerikanischen Länder (1997) und der Initiative der Amazonasländer (2004). ⓘ
Als herausragend bei der Arbeit von Chagas gilt, dass er allein den kompletten Mechanismus der Krankheit beschrieben hat: das auslösende Pathogen, den Vektor, den Wirt, die klinische Manifestation und die Epidemiologie. ⓘ
Lange hielt Chagas den Stich fälschlich für die Hauptinfektionsquelle:
„Durch unwiderlegbare Versuche […] ist es bewiesen, dass der Triatomstich den natürlichen Mechanismus der Übertragung des Trypanosoms darstellt. Brumpt behauptet zwar, dass die Übertragung sich vorzugsweise durch Stuhlablagerung in Haut und Schleimhaut des Menschen vollzieht, doch glaube ich, dass dieser sicherlich mögliche Prozess eine Ausnahme bildet: der Insektenstich ist der biologische Infektionsprozess dieses Trypanosoms.“ ⓘ
1969 beschrieb der britische Parasitologe Ralph Lainson die Krankheit als erster vollständig korrekt. Er entdeckte, dass durch blutsaugende Triatominae verunreinigte Lebensmittel die Krankheit übertragen. ⓘ
Forschung
Behandlungen
Fexinidazol, ein für die Behandlung der afrikanischen Trypanosomiasis zugelassenes Antiparasitikum, hat in Tiermodellen eine Wirkung gegen die Chagas-Krankheit gezeigt. Ab 2019 wird es in Spanien in klinischen Studien der Phase II für die chronische Chagas-Krankheit getestet. Weitere Arzneimittelkandidaten sind GNF6702, ein Proteasom-Inhibitor, der bei Mäusen gegen die Chagas-Krankheit wirksam ist und sich in vorläufigen Toxizitätsstudien befindet, sowie AN4169, das in Tiermodellen vielversprechende Ergebnisse erzielt hat. ⓘ
Eine Reihe von experimentellen Impfstoffen wurde an Tieren getestet. Neben Subunit-Impfstoffen wurden auch Impfungen mit abgeschwächten T. cruzi-Parasiten oder Organismen, die einige der gleichen Antigene wie T. cruzi exprimieren, aber keine menschlichen Krankheiten verursachen, wie Trypanosoma rangeli oder Phytomonas serpens, erprobt. Auch die DNA-Impfung wurde bereits erforscht. Ab 2019 ist die Impfstoffforschung hauptsächlich auf Kleintiermodelle beschränkt. ⓘ
Diagnostische Tests
Im Jahr 2018 waren die Standarddiagnosetests für die Chagas-Krankheit nur begrenzt in der Lage, die Wirksamkeit einer antiparasitären Behandlung zu messen, da serologische Tests noch Jahre nach der Eliminierung von T. cruzi aus dem Körper positiv bleiben können und die PCR falsch-negative Ergebnisse liefern kann, wenn die Parasitenkonzentration im Blut niedrig ist. Mehrere potenzielle Biomarker für das Ansprechen auf die Behandlung werden derzeit untersucht, z. B. Immunoassays gegen spezifische T. cruzi-Antigene, Durchflusszytometrie-Tests zum Nachweis von Antikörpern gegen verschiedene Lebensstadien von T. cruzi und Marker für physiologische Veränderungen, die durch den Parasiten verursacht werden, wie z. B. Veränderungen der Blutgerinnung und des Lipidstoffwechsels. ⓘ
Ein weiterer Forschungsbereich ist die Verwendung von Biomarkern zur Vorhersage des Fortschreitens einer chronischen Krankheit. Der Serumspiegel des Tumornekrosefaktors alpha, des natriuretischen Peptids im Gehirn und in den Vorhöfen sowie des Angiotensin-konvertierenden Enzyms 2 wurden als Indikatoren für die Prognose der Chagas-Kardiomyopathie untersucht. ⓘ
Das von T. cruzi ausgeschiedene Akute-Phase-Antigen (SAPA), das im Blut mittels ELISA oder Western Blot nachgewiesen werden kann, wurde als Indikator für eine frühe akute und kongenitale Infektion verwendet. Ein Test für T. cruzi-Antigene im Urin wurde entwickelt, um eine kongenitale Erkrankung zu diagnostizieren. ⓘ
Verbreitung
Sie ist hauptsächlich in Mittel- und Südamerika verbreitet und wird durch den Kot blutsaugender Raubwanzen übertragen. Die Raubwanzen infizieren sich auch gegenseitig durch Koprophagie und „Kannibalismus“. Ein Erregerreservoir (s. a. Zoonose) besteht u. a. bei freilebenden Tieren (z. B. Gürteltieren, Opossums, Zweifinger-Faultieren), aber auch bei Hunden, Katzen und Ratten. Auch der infizierte Mensch ist ein wichtiges Parasitenreservoir. Insgesamt soll es mehr als 18 Millionen Infizierte geben. In Bolivien könnte etwa ein Viertel der Bevölkerung betroffen sein. Jährlich gibt es 50.000 Neuinfektionen und 15.000 Todesfälle. ⓘ
Durch Migration, Tourismus und Bioinvasion der Raubwanzen durch Warentransport kann die Krankheit auf anderen Kontinenten eingeschleppt und in seltenen Fällen dort durch Blutspenden verbreitet werden. In Spanien, wo über 200.000 Einwanderer aus Lateinamerika leben, gibt es geschätzt zirka 6000 Infizierte. In den USA könnten mehrere 100.000 Einwanderer infiziert sein. Dort gibt es drei gesicherte Fälle von Chagas-Erkrankungen durch Blutkonserven, 2006 war bei Routinetests eine von 4655 überprüften Blutkonserven positiv. ⓘ
Im Mai 2012 meldete Uruguay die Ausrottung der übertragenden, in Südamerika als Vinchuca bezeichneten Raubwanze. ⓘ
Die Krankheit wird von der Weltgesundheitsorganisation (WHO) als vernachlässigte Krankheit bezeichnet, also als eine hauptsächlich arme Menschen betreffende Krankheit, zu deren Erforschung und Bekämpfung nur wenig Geld bereitgestellt wird, obwohl sie weit verbreitet ist und gravierende Folgen für die Erkrankten und die gesamte Gesellschaft hat. ⓘ
Infektionswege

Die überwiegend nachtaktiven Raubwanzen stechen und saugen meist unbemerkt Blut bei schlafenden Menschen, Säugetieren, Reptilien und Vögeln, mit Vorliebe in Regionen mit dünnerer Haut wie z. B. an Lippen oder in der Augenumgebung. Währenddessen defäkiert das Insekt. Die Infektion erfolgt nicht durch den Stich, sondern durch Einreiben des erregerhaltigen Kotes in die frische Stichwunde durch den Menschen selbst oder durch Eindringen des Erregers in unverletzte Schleimhaut, besonders des Auges. Der Kot kann vermutlich jahrelang infektiös bleiben. Die diaplazentare Infektion des Fötus durch die Mutter ist möglich. Auch Muttermilch ist infektiös. In seltenen Fällen kann es zu einer Übertragung durch Nahrungsmittel kommen. 2005 und 2006 wurden aus Brasilien Infektionen durch verschmutzten Bacaba-Wein (aus Palmfrüchten, Oenacarpus distichus, Oenocarpus babaca) gemeldet, auch der Saft der Kohlpalme (Euterpe oleracea) steht im gleichen Verdacht. ⓘ