Adhäsion
| Teil einer Serie über ⓘ |
| Kontinuumsmechanik |
|---|

Prozess der Anhaftung eines Stoffes an der Oberfläche eines anderen Stoffes.
Anmerkung 1: Adhäsion erfordert Energie, die aus chemischen und/oder physikalischen
Bindungen stammen kann, wobei letztere reversibel sind, wenn genügend Energie zugeführt wird.Anmerkung 2: In der Biologie spiegelt die Adhäsion das Verhalten von Zellen kurz nach dem Kontakt
mit der Oberfläche.Anmerkung 3: In der Chirurgie spricht man von Adhäsion, wenn zwei Gewebe unerwartet miteinander verschmelzen. ⓘ
Adhäsion ist die Tendenz ungleicher Teilchen oder Oberflächen, aneinander zu haften (Kohäsion bezieht sich auf die Tendenz ähnlicher oder gleicher Teilchen/Oberflächen, aneinander zu haften). ⓘ
Die Kräfte, die Adhäsion und Kohäsion bewirken, lassen sich in mehrere Arten unterteilen. Die intermolekularen Kräfte, die für die Funktion der verschiedenen Arten von Aufklebern und Klebebändern verantwortlich sind, fallen in die Kategorien chemische Adhäsion, dispersive Adhäsion und diffusive Adhäsion. Zusätzlich zu den kumulativen Größen dieser intermolekularen Kräfte gibt es auch bestimmte mechanische Effekte, die sich ergeben. ⓘ

Adhäsion (lateinisch adhaerere „anhaften“), auch Adhäsions- oder Anhangskraft genannt, ist der physikalische Zustand einer Grenzflächenschicht, die sich zwischen zwei in Kontakt tretenden kondensierten Phasen, d. h. Feststoffen und Flüssigkeiten mit vernachlässigbarem Dampfdruck, ausbildet. Der Zustand ist durch molekulare Wechselwirkungen in der Grenzflächenschicht charakterisiert, die einen mechanischen Zusammenhalt der beteiligten Phasen bewirken. ⓘ
Der Zusammenhalt zwischen den beteiligten Materialien beruht in den meisten Fällen auf physikalischen Wechselwirkungen. Bei ausreichend rauer Oberfläche kann es zudem zu einer mechanischen Verklammerung der Materialien (Formschluss) kommen. Falls die Materialien miteinander auch eine chemische Bindung eingehen, bildet sich in der Regel eine besonders feste und dauerhafte Verbindung aus. Beispiele für die Bildung chemischer Bindungen zwischen Bindemitteln und bestimmten Materialien sind Silikon und Glas, Polyurethan und Holz oder Epoxidharz und Aluminium. ⓘ
Oberflächenenergie

A: γ = (1/2)W11
B: W12 = γ1 + γ2 - γ12
C: γ12 = (1/2)W121 = (1/2)W212
D: W12 + W33 - W13 - W23 = W132. ⓘ
Die Oberflächenenergie wird üblicherweise als die Arbeit definiert, die erforderlich ist, um einen Bereich einer bestimmten Oberfläche aufzubauen. Eine andere Möglichkeit, die Oberflächenenergie zu betrachten, besteht darin, sie mit der Arbeit in Beziehung zu setzen, die erforderlich ist, um eine Schüttgutprobe zu spalten, wodurch zwei Oberflächen entstehen. Wenn die neuen Oberflächen identisch sind, ist die Oberflächenenergie γ jeder Oberfläche gleich der Hälfte der Spaltarbeit W: γ = (1/2)W11. ⓘ
Wenn die Oberflächen ungleich sind, gilt die Young-Dupré-Gleichung: W12 = γ1 + γ2 - γ12, wobei γ1 und γ2 die Oberflächenenergien der beiden neuen Oberflächen sind und γ12 die Grenzflächenenergie ist. ⓘ
Diese Methodik kann auch für die Spaltung in einem anderen Medium verwendet werden: γ12 = (1/2)W121 = (1/2)W212. Diese beiden Energiemengen beziehen sich auf die Energie, die erforderlich ist, um eine Spezies in zwei Teile zu spalten, während sie sich in einem Medium der anderen Spezies befindet. Gleiches gilt für ein System mit drei Arten: γ13 + γ23 - γ12 = W12 + W33 - W13 - W23 = W132, wobei W132 die Energie ist, die für die Spaltung der Art 1 von der Art 2 in einem Medium der Art 3 erforderlich ist. ⓘ
Ein grundlegendes Verständnis der Begriffe Spaltungsenergie, Oberflächenenergie und Oberflächenspannung ist sehr hilfreich für das Verständnis des physikalischen Zustands und der Vorgänge an einer bestimmten Oberfläche, aber wie weiter unten erörtert wird, ergeben sich aus der Theorie dieser Variablen auch einige interessante Effekte, die die praktische Anwendbarkeit von Klebeflächen in Bezug auf ihre Umgebung betreffen. ⓘ
Mechanismen
Es gibt keine einheitliche Theorie für die Adhäsion, und bestimmte Mechanismen sind spezifisch für bestimmte Materialszenarien. Es wurden fünf Mechanismen der Adhäsion vorgeschlagen, um zu erklären, warum ein Material an einem anderen haftet: ⓘ
Mechanisch
Klebematerialien füllen die Hohlräume oder Poren der Oberflächen und halten die Oberflächen durch Verzahnung zusammen. Andere Verzahnungsphänomene werden auf unterschiedlichen Längenskalen beobachtet. Nähen ist ein Beispiel für zwei Materialien, die eine großflächige mechanische Verbindung eingehen, Klettverschlüsse bilden eine solche auf mittlerer Skala und einige Textilklebstoffe (Leim) bilden eine solche auf kleiner Skala. ⓘ
Chemische
Zwei Materialien können an der Verbindungsstelle eine Verbindung eingehen. Die stärksten Verbindungen entstehen, wenn die Atome der beiden Materialien Elektronen teilen oder austauschen (bekannt als kovalente Bindung bzw. ionische Bindung). Eine schwächere Bindung entsteht, wenn ein Wasserstoffatom in einem Molekül von einem Stickstoff-, Sauerstoff- oder Fluoratom in einem anderen Molekül angezogen wird, ein Phänomen, das als Wasserstoffbrückenbindung bezeichnet wird. ⓘ
Chemische Adhäsion tritt auf, wenn die Oberflächenatome zweier getrennter Oberflächen Ionen-, Kovalenz- oder Wasserstoffbindungen bilden. Das technische Prinzip, das der chemischen Adhäsion in diesem Sinne zugrunde liegt, ist recht einfach: Wenn Oberflächenmoleküle sich verbinden können, dann werden die Oberflächen durch ein Netzwerk dieser Bindungen miteinander verbunden. Es ist erwähnenswert, dass diese anziehenden ionischen und kovalenten Kräfte nur über sehr kleine Entfernungen wirksam sind - weniger als ein Nanometer. Das bedeutet im Allgemeinen nicht nur, dass Oberflächen, die das Potenzial für chemische Bindungen haben, sehr nahe beieinander liegen müssen, sondern auch, dass diese Bindungen ziemlich spröde sind, da die Oberflächen dicht beieinander gehalten werden müssen. ⓘ
Dispersive Haftung
Bei der dispersiven Adhäsion, auch Physisorption genannt, werden zwei Materialien durch van-der-Waals-Kräfte zusammengehalten: die Anziehung zwischen zwei Molekülen, die jeweils einen Bereich mit leichter positiver und negativer Ladung aufweisen. Im einfachen Fall sind solche Moleküle daher in Bezug auf die durchschnittliche Ladungsdichte polar, obwohl es bei größeren oder komplexeren Molekülen mehrere "Pole" oder Bereiche mit größerer positiver oder negativer Ladung geben kann. Diese positiven und negativen Pole können eine dauerhafte Eigenschaft eines Moleküls sein (Keesom-Kräfte) oder ein vorübergehender Effekt, der in jedem Molekül auftreten kann, da die zufällige Bewegung von Elektronen innerhalb der Moleküle zu einer vorübergehenden Konzentration von Elektronen in einer Region führen kann (London-Kräfte). ⓘ


In der Oberflächenwissenschaft bezieht sich der Begriff Adhäsion fast immer auf die dispersive Adhäsion. In einem typischen Fest-Flüssig-Gas-System (z. B. ein Flüssigkeitstropfen auf einem von Luft umgebenen Festkörper) wird der Kontaktwinkel zur indirekten Bewertung der Adhäsion verwendet, während eine Zentrifugalhaftungswaage direkte quantitative Adhäsionsmessungen ermöglicht. Im Allgemeinen wird davon ausgegangen, dass Fälle, in denen der Kontaktwinkel niedrig ist, eine höhere Adhäsion pro Flächeneinheit aufweisen. Bei diesem Ansatz wird davon ausgegangen, dass ein geringerer Kontaktwinkel mit einer höheren Oberflächenenergie einhergeht. Theoretisch ist die genauere Beziehung zwischen Kontaktwinkel und Adhäsionsarbeit etwas komplizierter und wird durch die Young-Dupre-Gleichung gegeben. Der Kontaktwinkel des Dreiphasensystems hängt nicht nur von der dispersiven Adhäsion (Wechselwirkung zwischen den Molekülen der Flüssigkeit und den Molekülen des Festkörpers), sondern auch von der Kohäsion (Wechselwirkung zwischen den Flüssigkeitsmolekülen selbst) ab. Starke Adhäsion und schwache Kohäsion führen zu einem hohen Grad an Benetzung, einem lyophilen Zustand mit niedrigen gemessenen Kontaktwinkeln. Umgekehrt führen schwache Adhäsion und starke Kohäsion zu lyophoben Bedingungen mit hohen gemessenen Kontaktwinkeln und schlechter Benetzung. ⓘ
Die Londoner Dispersionskräfte sind besonders nützlich für die Funktion von Klebevorrichtungen, da sie keine permanente Polarität der beiden Oberflächen erfordern. Sie wurden in den 1930er Jahren von Fritz London beschrieben und sind von vielen Forschern beobachtet worden. Dispersionskräfte sind eine Folge der statistischen Quantenmechanik. London stellte die Theorie auf, dass Anziehungskräfte zwischen Molekülen, die sich nicht durch ionische oder kovalente Wechselwirkungen erklären lassen, durch polare Momente innerhalb der Moleküle verursacht werden können. Multipole könnten für die Anziehung zwischen Molekülen mit permanenten Multipolmomenten verantwortlich sein, die an der elektrostatischen Wechselwirkung beteiligt sind. Experimentelle Daten zeigten jedoch, dass viele der Verbindungen, bei denen Van-der-Waals-Kräfte beobachtet wurden, überhaupt keine Multipole aufwiesen. London schlug vor, dass momentane Dipole allein durch die Nähe der Moleküle zueinander hervorgerufen werden. Durch die Lösung des quantenmechanischen Systems zweier Elektronen als harmonische Oszillatoren, die sich in einem endlichen Abstand voneinander befinden, um ihre jeweiligen Ruhepositionen verschoben werden und mit den Feldern des anderen wechselwirken, zeigte London, dass die Energie dieses Systems durch gegeben ist:
Während der erste Term einfach die Nullpunktenergie ist, beschreibt der negative zweite Term eine anziehende Kraft zwischen benachbarten Oszillatoren. Dasselbe Argument kann auch auf eine große Anzahl gekoppelter Oszillatoren ausgedehnt werden und umgeht somit Probleme, die die großräumigen Anziehungseffekte permanenter Dipole, die sich insbesondere durch Symmetrie aufheben, negieren würden. ⓘ
Der additive Charakter des Dispersionseffekts hat eine weitere nützliche Folge. Betrachten wir einen einzigen solchen dispersiven Dipol, der als Ursprungsdipol bezeichnet wird. Da jeder Ursprungsdipol von Natur aus so ausgerichtet ist, dass er von den benachbarten Dipolen, die er induziert, angezogen wird, während die anderen, weiter entfernten Dipole durch keine Phasenbeziehung mit dem Ursprungsdipol korreliert sind (und somit im Durchschnitt nichts dazu beitragen), gibt es in einer Masse solcher Teilchen eine Netto-Anziehungskraft. Wenn man identische Teilchen betrachtet, wird dies als Kohäsionskraft bezeichnet. ⓘ
Wenn es um Adhäsion geht, muss diese Theorie in Begriffe umgewandelt werden, die sich auf Oberflächen beziehen. Wenn in einer Masse ähnlicher Moleküle eine Nettoanziehungskraft vorhanden ist, führt die Spaltung dieser Masse in zwei Oberflächen zu Oberflächen mit einer dispersiven Oberflächenenergie, da die Form der Energie die gleiche bleibt. Diese Theorie liefert eine Grundlage für die Existenz von van der Waals-Kräften an der Oberfläche, die zwischen allen Molekülen mit Elektronen bestehen. Diese Kräfte lassen sich leicht beobachten, wenn glatte Oberflächen spontan in Kontakt springen. Glatte Oberflächen von Glimmer, Gold, verschiedenen Polymeren und festen Gelatinelösungen bleiben nicht auseinander, wenn ihr Abstand klein genug wird - in der Größenordnung von 1-10 nm. Die Gleichung, die diese Anziehung beschreibt, wurde in den 1930er Jahren von De Boer und Hamaker vorhergesagt:
Dabei ist P die Kraft (negativ für Anziehung), z ist der Trennungsabstand und A ist eine materialspezifische Konstante, die Hamaker-Konstante. ⓘ

Der Effekt wird auch in Experimenten deutlich, bei denen ein Polydimethylsiloxan (PDMS)-Stempel mit kleinen periodischen Pfostenstrukturen hergestellt wird. Die Oberfläche mit den Pfosten wird mit der Vorderseite nach unten auf eine glatte Oberfläche gelegt, so dass die Fläche zwischen den einzelnen Pfosten über die glatte Oberfläche hinausragt, wie ein von Säulen getragenes Dach. Aufgrund dieser anziehenden Dispersionskräfte zwischen dem PDMS und dem glatten Substrat fällt die erhöhte Oberfläche - oder das "Dach" - ohne jegliche äußere Kraft außer der Van-der-Waals-Anziehung auf das Substrat. Einfache glatte Polymeroberflächen - ohne Mikrostrukturen - werden üblicherweise für diese dispersiven Klebeeigenschaften verwendet. Abziehbilder und Aufkleber, die ohne chemische Klebstoffe auf Glas haften, sind als Spielzeug und Dekoration weit verbreitet und als ablösbare Etiketten nützlich, da sie ihre Klebeeigenschaften nicht so schnell verlieren wie Klebebänder, die chemische Klebstoffe verwenden. ⓘ
Es ist wichtig zu beachten, dass diese Kräfte auch über sehr kleine Entfernungen wirken - 99 % der Arbeit, die notwendig ist, um van-der-Waals-Bindungen zu brechen, wird erledigt, sobald Oberflächen mehr als einen Nanometer auseinander gezogen werden. Aufgrund dieser begrenzten Bewegung sowohl bei van-der-Waals- als auch bei ionischen/kovalenten Bindungen lässt die praktische Wirksamkeit der Adhäsion aufgrund einer oder beider Wechselwirkungen sehr zu wünschen übrig. Sobald ein Riss entsteht, breitet er sich aufgrund der Sprödigkeit der Grenzflächenbindungen leicht entlang der Grenzfläche aus. ⓘ
Eine weitere Folge ist, dass eine Vergrößerung der Oberfläche in dieser Situation oft wenig zur Verbesserung der Haftfestigkeit beiträgt. Dies ergibt sich aus dem bereits erwähnten Rissversagen - die Spannung an der Grenzfläche ist nicht gleichmäßig verteilt, sondern konzentriert sich auf den Bereich des Versagens. ⓘ
Elektrostatik
Einige leitende Materialien können Elektronen abgeben, so dass an der Verbindungsstelle ein elektrischer Ladungsunterschied entsteht. Dies führt zu einer kondensatorähnlichen Struktur und erzeugt eine elektrostatische Anziehungskraft zwischen den Materialien. ⓘ
Diffus
Einige Materialien können an der Verbindungsstelle durch Diffusion miteinander verschmelzen. Dies kann der Fall sein, wenn die Moleküle der beiden Materialien beweglich und ineinander löslich sind. Dies ist besonders bei Polymerketten der Fall, bei denen ein Ende des Moleküls in das andere Material diffundiert. Dies ist auch der Mechanismus, der beim Sintern zum Tragen kommt. Wenn Metall- oder Keramikpulver zusammengepresst und erhitzt werden, diffundieren Atome von einem Teilchen zum nächsten. Dadurch verbinden sich die Teilchen zu einer Einheit. ⓘ
Diffusionskräfte sind so etwas wie mechanische Bindungen auf molekularer Ebene. Diffusionsbindung tritt auf, wenn Spezies von einer Oberfläche in eine benachbarte Oberfläche eindringen, während sie noch an die Phase ihrer Ursprungsoberfläche gebunden sind. Ein lehrreiches Beispiel sind Polymer-auf-Polymer-Oberflächen. Die diffusive Bindung in Polymer-auf-Polymer-Oberflächen ist das Ergebnis von Abschnitten von Polymerketten von einer Oberfläche, die mit denen einer benachbarten Oberfläche ineinandergreifen. Die Bewegungsfreiheit der Polymere wirkt sich stark auf ihre Fähigkeit zur Interdigitalisierung und damit auf die diffusive Bindung aus. Vernetzte Polymere sind beispielsweise weniger diffusions- und interdigitalisierungsfähig, da sie an vielen Kontaktpunkten miteinander verbunden sind und sich nicht frei in die angrenzende Oberfläche hineindrehen können. Unvernetzte Polymere (Thermoplaste) hingegen können freier in die benachbarte Phase wandern, indem sie Schwänze und Schleifen über die Grenzfläche ziehen. ⓘ
Ein weiterer Umstand, unter dem diffusive Bindung auftritt, ist die "Spaltung". Unter Kettenspaltung versteht man das Zerschneiden von Polymerketten, was zu einer höheren Konzentration von distalen Enden führt. Die erhöhte Konzentration dieser Kettenenden führt zu einer erhöhten Konzentration von Polymerschwänzen, die sich über die Grenzfläche erstrecken. Die Spaltung kann leicht durch ultraviolette Bestrahlung in Gegenwart von Sauerstoffgas erreicht werden, was darauf hindeutet, dass Klebevorrichtungen, die eine diffusive Bindung verwenden, tatsächlich von einer längeren Exposition gegenüber Wärme/Licht und Luft profitieren. Je länger eine solche Vorrichtung diesen Bedingungen ausgesetzt ist, desto mehr Schwänze werden abgeschnitten und verzweigen sich über die Grenzfläche. ⓘ
Sobald sie die Grenzfläche überquert haben, bilden die Schwänze und Schleifen die für sie günstigen Bindungen. Im Fall von Polymer-auf-Polymer-Oberflächen bedeutet dies mehr van-der-Waals-Kräfte. Diese können zwar spröde sein, sind aber ziemlich stark, wenn ein großes Netzwerk dieser Bindungen gebildet wird. Die äußerste Schicht jeder Oberfläche spielt eine entscheidende Rolle für die Hafteigenschaften solcher Grenzflächen, da selbst eine winzige Interdigitation - nur ein oder zwei Schwänze von 1,25 Angström Länge - die van-der-Waals-Bindungen um eine Größenordnung erhöhen kann. ⓘ
Stärke
Die Stärke der Adhäsion zwischen zwei Materialien hängt davon ab, welche der oben genannten Mechanismen zwischen den beiden Materialien ablaufen und wie groß die Oberfläche ist, auf der sich die beiden Materialien berühren. Materialien, die sich gegenseitig benetzen, haben in der Regel eine größere Kontaktfläche als solche, die dies nicht tun. Die Benetzung hängt von der Oberflächenenergie der Materialien ab. ⓘ
Materialien mit geringer Oberflächenenergie wie Polyethylen, Polypropylen, Polytetrafluorethylen und Polyoxymethylen lassen sich ohne spezielle Oberflächenvorbereitung nur schwer verkleben. ⓘ
Ein weiterer Faktor, der die Festigkeit eines Klebstoffkontakts bestimmt, ist seine Form. Klebstoffkontakte mit komplexer Form beginnen sich an den "Rändern" der Kontaktfläche abzulösen. Der Prozess der Zerstörung von Klebstoffkontakten ist auf dem Film zu sehen. ⓘ
Andere Effekte
Im Zusammenspiel mit den oben beschriebenen primären Oberflächenkräften gibt es noch eine Reihe von Nebeneffekten, die eine Rolle spielen. Während die Kräfte selbst zum Ausmaß der Adhäsion zwischen den Oberflächen beitragen, spielen die folgenden eine entscheidende Rolle für die Gesamtfestigkeit und Zuverlässigkeit einer Klebevorrichtung. ⓘ
Bespannung
Die Fadenbildung ist vielleicht der wichtigste dieser Effekte und wird häufig bei Klebebändern beobachtet. Fadenbildung tritt auf, wenn eine Trennung zwischen zwei Oberflächen beginnt und die Moleküle an der Grenzfläche eine Brücke über den Spalt schlagen, anstatt wie die Grenzfläche selbst zu reißen. Die wichtigste Folge dieses Effekts ist das Zurückhalten des Risses. Indem sie den ansonsten spröden Grenzflächenbindungen eine gewisse Flexibilität verleihen, können die Moleküle, die sich über den Spalt ziehen, die Ausbreitung des Risses verhindern. Eine weitere Möglichkeit, dieses Phänomen zu verstehen, ist der Vergleich mit der bereits erwähnten Spannungskonzentration an der Bruchstelle. Da die Spannung nun über einen gewissen Bereich verteilt ist, hat die Spannung an einem bestimmten Punkt eine geringere Chance, die gesamte Haftkraft zwischen den Oberflächen zu überwältigen. Wenn es an einer Grenzfläche, die einen viskoelastischen Klebstoff enthält, zum Versagen kommt und sich ein Riss ausbreitet, geschieht dies durch einen allmählichen Prozess, der als "Fingering" bezeichnet wird, und nicht durch einen schnellen, spröden Bruch. Die Fadenbildung kann sowohl bei der diffusiven als auch bei der chemischen Bindung auftreten. Bei den Molekülsträngen, die den Spalt überbrücken, handelt es sich entweder um die Moleküle, die zuvor über die Grenzfläche diffundiert sind, oder um den viskoelastischen Klebstoff, vorausgesetzt, es befindet sich ein erhebliches Volumen davon an der Grenzfläche. ⓘ
Mikrostrukturen
Es ist bekannt, dass das Zusammenspiel von Mechanismen auf molekularer Ebene und hierarchischen Oberflächenstrukturen zu einem hohen Maß an Haftreibung und Bindung zwischen Oberflächenpaaren führt. Technologisch fortschrittliche Klebevorrichtungen nutzen manchmal Mikrostrukturen auf Oberflächen, wie z. B. dicht gepackte periodische Stifte. Dabei handelt es sich um biomimetische Technologien, die von den Haftfähigkeiten der Füße verschiedener Gliederfüßer und Wirbeltiere (vor allem Geckos) inspiriert sind. Indem periodische Unterbrechungen in glatte, haftende Oberflächen eingemischt werden, erhält die Schnittstelle wertvolle risshemmende Eigenschaften. Da die Rissentstehung eine viel größere Spannung erfordert als die Rissausbreitung, sind solche Oberflächen viel schwieriger zu trennen, da jedes Mal, wenn die nächste individuelle Mikrostruktur erreicht wird, ein neuer Riss begonnen werden muss. ⓘ
Hysterese
Die Hysterese bezieht sich in diesem Fall auf die Umstrukturierung der Klebegrenzungsfläche über einen bestimmten Zeitraum hinweg, so dass die zum Trennen zweier Oberflächen erforderliche Arbeit größer ist als die Arbeit, die durch das Zusammenfügen der beiden Oberflächen geleistet wurde (W > γ1 + γ2). In den meisten Fällen handelt es sich dabei um ein Phänomen, das mit der diffusiven Bindung zusammenhängt. Je mehr Zeit ein Oberflächenpaar mit diffusiver Bindung hat, um sich umzustrukturieren, desto mehr Diffusion findet statt und desto stärker wird die Adhäsion. Die bereits erwähnte Reaktion bestimmter Polymer-auf-Polymer-Oberflächen auf ultraviolette Strahlung und Sauerstoffgas ist ein Beispiel für Hysterese, die aber auch ohne diese Faktoren mit der Zeit eintritt. ⓘ
Die Hysterese lässt sich nicht nur beobachten, indem man feststellt, ob W > γ1 + γ2 gilt, sondern auch durch "Stop-Start"-Messungen. Bei diesen Experimenten gleiten zwei Oberflächen kontinuierlich gegeneinander und werden gelegentlich für eine bestimmte Zeit angehalten. Die Ergebnisse von Experimenten mit Polymer-auf-Polymer-Oberflächen zeigen, dass die Wiederaufnahme des reibungslosen Gleitens einfach ist, wenn die Stoppzeit kurz genug ist. Überschreitet die Anhaltezeit jedoch einen gewissen Grenzwert, so erhöht sich zunächst der Bewegungswiderstand, was darauf hindeutet, dass die Anhaltezeit für eine Umstrukturierung der Oberflächen ausreichte. ⓘ
Benetzbarkeit und Absorption
Einige atmosphärische Einflüsse auf die Funktionalität von Klebevorrichtungen lassen sich mit Hilfe der Theorie der Oberflächenenergie und der Grenzflächenspannung charakterisieren. Es ist bekannt, dass γ12 = (1/2)W121 = (1/2)W212. Wenn γ12 hoch ist, ist es für jede Spezies günstiger, im Kontakt mit einer fremden Spezies zusammenzuhalten, als zu dissoziieren und sich mit der anderen zu vermischen. Daraus folgt, dass bei einer hohen Grenzflächenspannung die Adhäsionskraft schwach ist, da es für die einzelnen Spezies nicht vorteilhaft ist, sich mit der anderen zu verbinden. Die Grenzflächenspannung einer Flüssigkeit und eines Festkörpers steht in direktem Zusammenhang mit der Benetzbarkeit der Flüssigkeit (im Verhältnis zum Festkörper), und so kann man extrapolieren, dass die Kohäsion in nicht benetzenden Flüssigkeiten zunimmt und in benetzenden Flüssigkeiten abnimmt. Ein Beispiel, das dies belegt, ist Polydimethylsiloxan-Kautschuk, der eine Selbstklebekraft von 43,6 mJ/m2 in Luft, 74 mJ/m2 in Wasser (einer nicht benetzenden Flüssigkeit) und 6 mJ/m2 in Methanol (einer benetzenden Flüssigkeit) aufweist. ⓘ
Dieses Argument lässt sich dahingehend erweitern, dass eine Oberfläche, die sich in einem Medium befindet, mit dem die Bindung günstig ist, mit geringerer Wahrscheinlichkeit an einer anderen Oberfläche haften wird, da das Medium die potenziellen Stellen auf der Oberfläche einnimmt, die sonst für die Haftung an einer anderen Oberfläche zur Verfügung stehen würden. Dies gilt natürlich in besonderem Maße für benetzende Flüssigkeiten, aber auch für Gasmoleküle, die an der betreffenden Oberfläche adsorbieren und damit potenzielle Adhäsionsstellen besetzen könnten. Dieser letzte Punkt ist eigentlich ziemlich intuitiv: Wenn man einen Klebstoff zu lange der Luft aussetzt, wird er schmutzig, und seine Klebkraft nimmt ab. Dies wird im Experiment beobachtet: Wenn Glimmer an der Luft gespalten wird, ist seine Spaltungsenergie, W121 oder Wmica/air/mica, um den Faktor 13 kleiner als die Spaltungsenergie im Vakuum, Wmica/vac/mica. ⓘ
Seitliche Adhäsion
Seitliche Adhäsion ist die Adhäsion, die mit dem Gleiten eines Objekts auf einem Substrat verbunden ist, z. B. das Gleiten eines Tropfens auf einer Oberfläche. Handelt es sich bei den beiden Objekten um Festkörper, entweder mit oder ohne Flüssigkeit dazwischen, wird die seitliche Adhäsion als Reibung beschrieben. Das Verhalten der lateralen Adhäsion zwischen einem Tropfen und einer Oberfläche unterscheidet sich jedoch tribologisch stark von der Reibung zwischen Festkörpern, und der natürlich adhäsive Kontakt zwischen einer ebenen Oberfläche und einem Flüssigkeitstropfen macht die laterale Adhäsion in diesem Fall zu einem individuellen Feld. Die seitliche Adhäsion kann mit der Zentrifugaladhäsionswaage (CAB) gemessen werden, die eine Kombination aus Zentrifugal- und Gravitationskräften verwendet, um die normalen und seitlichen Kräfte zu entkoppeln. ⓘ
Adhäsionstheorien
Mechanische Adhäsion
Die Theorie der mechanischen Adhäsion bezieht sich auf formschlüssige Verklammerungen einer Phase in den mikroskopisch kleinen Poren und Vertiefungen an der Oberfläche eines Feststoffs. Früher war dies der einzige Erklärungsansatz für Adhäsion; die Frage nach dem Zusammenhalt zweier Phasen mit glatten und porenfreien Kontaktflächen lässt sich damit nicht beantworten. ⓘ
Spezifische Adhäsion
Theorien der spezifischen Adhäsion wurden entwickelt, weil die Theorie der mechanischen Adhäsion nicht ausreichte, den Zusammenhalt von Feststoffen mit glatten Oberflächen zu erklären. Die verschiedenen Theorien der spezifischen Adhäsion und die Theorie der mechanischen Adhäsion schließen einander nicht aus, sondern ergänzen sich. ⓘ
Der Polarisationstheorie (De Bruyne 1935) zufolge beruht Adhäsion auf dem Dipolcharakter der Moleküle. Dieser Erklärungsansatz ist jedoch auf polare Stoffe beschränkt. ⓘ
Die elektrostatische Theorie (Derjagin 1950) setzt eine elektrische Doppelschicht (eine mehrere Molekül- oder Atomschichten dicke Raumladungszone, hervorgerufen durch Ladungsverschiebungen) als Ursache für die Adhäsionskraft an. Dafür müssen allerdings geeignete Ladungsträger, wie Elektronen oder Ionen, vorhanden sein. ⓘ
Die Diffusionstheorie (Voyutzkij 1960) legt die Brownsche Molekularbewegung – also die durch die Temperatur verursachte Eigenbewegung der Moleküle – zu Grunde, die dazu führt, dass Teilchen der beiden beteiligten Stoffe ineinander diffundieren. Die Stoffe müssen jedoch eine chemische Affinität zueinander besitzen, was meist nur bei Kunststoffen der Fall ist. Bei Metallen etwa verhindert die Metallbindung eine Diffusion. ⓘ
Grundlage der Adsorptions- und Benetzungstheorie (Zismann, Fowkes, Good und Wu, 1963) ist die Ober- und Grenzflächentheorie. Dieser thermodynamischen Betrachtung der Adhäsion zufolge benetzen solche Flüssigkeiten feste Oberflächen besonders gut, die sich an der Grenzfläche zur festen Phase in einem nur geringfügig ungünstigeren energetischen Zustand als im Inneren befinden. Ist der energetische Zustand an der Phasengrenze günstiger als im Inneren, kommt es zur vollständigen Benetzung (Spreitung), bei der sämtliche Teilchen der Flüssigkeit an der festen Oberfläche haften. Keine Benetzung – der andere Extremfall – tritt ein, wenn der energetische Zustand für die Teilchen im Inneren der Flüssigkeit so günstig ist, dass diese eine Kugel bildet, wodurch sich die Kontaktfläche mit dem Feststoff auf ein Minimum reduziert. Unter Berücksichtigung der Struktur der Grenzflächenschicht (Rauheit und Fremdstoffpartikel), der Temperatur und anderer Faktoren über die thermodynamische Betrachtung hinaus lassen sich so Rückschlüsse auf die Adhäsion ziehen. ⓘ
Vorkommen
Adhäsion bei Verkehrsmitteln
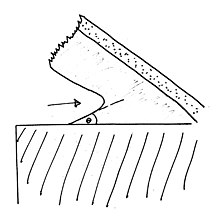
Unter Adhäsion versteht man im Straßenverkehr die Straßenhaftung (eng. Grip) – Gummi (Reifen) auf Untergrund (Straße) – bzw. im Schienenverkehr die Schienenhaftung – Eisen (Bahnräder) auf Eisen (Schiene). Von einer Adhäsionsbahn spricht man, wenn eine Bahn ohne Hilfsmittel (z. B. Zahnrad oder Seil) starke Steigungen bewältigen kann und ausschließlich die Haftung der Räder für die Fortbewegung genügt. Die Adhäsion wirkt auch bei startenden Flugbooten und hält deren Rumpf im Wasser. Die Konstrukteure lösten dieses Problem mittels einer Abreißkante auf halber Länge des Kiels (auch als Stufe bezeichnet), so dass sich der Bootsrumpf der Maschine von der Wasseroberfläche lösen kann. ⓘ
Adhäsion bei Klebstoffen
Adhäsion umfasst die Haftkräfte an den Kontaktflächen zweier unterschiedlicher oder gleicher Stoffe durch Molekularkräfte. Die Stoffe können sich in festem oder in flüssigem Zustand befinden. Im Bereich der Klebstoffe versteht man unter Adhäsion die Haftung von Klebschichten an den Fügeteiloberflächen. Die Vorgänge bei der Adhäsion sind noch nicht vollständig aufgeklärt. Sie gestalten sich besonders schwierig, weil die Abhängigkeiten zwischen den Klebstoffsystemen und den verschiedenen Fügeteiloberflächen sehr komplex sind. ⓘ
Adhäsion bei Folien
Adhäsionsfolien haften ohne Klebstoff auf glatten/glänzenden Oberflächen mittels der Anziehungskraft der Moleküle zwischen beiden Materialien. Voraussetzung ist, dass sich die Moleküle so nahe wie möglich kommen, um eine Adhäsion zu erreichen. Deshalb funktioniert dies nur auf glatten Oberflächen, beispielsweise als Schutzfolien auf Displays oder Tönungsfolien auf Glas von Kraftfahrzeugen. ⓘ
Adhäsion bei Tieren
Manche Tiere (u. a. Lamellengeckos als die größten Vertreter) können sich an senkrechten glatten Wänden oder sogar an der Unterseite von Blättern und unter Zimmerdecken halten und fortbewegen. Grund hierfür sind Haftsysteme an den Sohlen der Füße, die bei Geckos aus etwa einer Milliarde feiner Keratin-Härchen (Spatulae) mit Ausmaßen im Nanometerbereich bestehen. Durch die spezielle lamellenartige Anordnung kommt eine große Zahl dieser Härchen mit dem Untergrund in Kontakt, so dass Adhäsionskräfte wirksam werden können. Natürlich vorkommende Oberflächenfeuchtigkeit erhöht die Wirkung. Ursache sind elektrodynamische Wechselwirkungen zwischen den beteiligten Materialien (z. B. Van-der-Waals-Kräfte sowie Kapillarkräfte). Auch viele Insekten nutzen zur Fortbewegung solche spatelförmigen Hafthaare neben ihren Greifsystemen oder Saugnäpfen. ⓘ
Adhäsion bei organischen Geweben
- chirurgisch: Verwachsungen oder Verklebungen von Organen (siehe Verwachsungsbauch)
- hämatologisch: Anhaftung von Blutzellen (z. B. Thrombozyten, Leukozyten) sowohl an Gefäßinnenwänden (z. B. im Rahmen einer Entzündungsreaktion), als auch gefäßinnenwandfremden (endothelfremden) Oberflächen bzw. Geweben
- bakteriologisch: Anhaftung von Bakterien an Schleimhautoberflächen am Beginn einer Infektion
- Zelladhäsion: Anhaftung von Gewebezellen an Proteine der extrazellulären Matrix über fokale Adhäsionsstellen und Hemidesmosomen
- zahnmedizinisch:
- Chemische Anhaftung von Füllungsmaterialien am Dentin (dentinadhesiv)
- Anhaftung einer Totalprothese an der Schleimhaut. ⓘ




